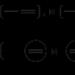بالإضافة إلى التحليل الكهربائي ، من الممكن وجود نوع آخر من تفاعل الأكسدة والاختزال. في هذه الحالة ، تمر الإلكترونات من عامل الاختزال إلى العامل المؤكسد عبر موصل معدني عبر دائرة كهربائية خارجية. نتيجة لذلك ، يظهر تيار كهربائي في الدائرة الخارجية ، ويسمى هذا الجهاز عنصر كلفاني.الخلايا الجلفانية مصادر التيار الكيميائي- أجهزة التحويل المباشر للطاقة الكيميائية إلى طاقة كهربائية متجاوزة أشكالها الأخرى.
وجدت الخلايا الجلفانية القائمة على معادن مختلفة ومركباتها تطبيقات عملية واسعة كمصادر للتيار الكيميائي.
في الخلية الجلفانية ، يتم تحويل الطاقة الكيميائية إلى طاقة كهربائية. تتكون أبسط خلية كلفانية من سفينتين مع محاليل CuSO 4 و ZnSO 4 ، حيث يتم غمر صفائح النحاس والزنك ، على التوالي. ترتبط الأوعية ببعضها البعض بواسطة أنبوب يسمى جسر ملح مملوء بمحلول إلكتروليت (على سبيل المثال ، KCl). يسمى هذا النظام عنصر جلفاني من النحاس والزنك.
من الناحية التخطيطية ، تظهر العمليات التي تحدث في خلية جلفانية من النحاس والزنك ، أو بعبارة أخرى ، دائرة للخلية الجلفانية ، في الشكل أدناه.
 رسم تخطيطي لخلية كلفانية
رسم تخطيطي لخلية كلفانية
تحدث أكسدة الزنك عند الأنود:
Zn - 2e - \ u003d Zn 2+.
نتيجة لذلك ، تتحول ذرات الزنك إلى أيونات تدخل في محلول ، ويذوب أنود الزنك ، وتتناقص كتلته. لاحظ أن القطب الموجب في الخلية الجلفانية هو القطب السالب (بسبب الإلكترونات التي تم الحصول عليها من ذرات الزنك) على عكس عملية التحليل الكهربائي حيث يتم توصيله بالقطب الموجب للبطارية الخارجية.
تتحرك الإلكترونات من ذرات الزنك على طول دائرة كهربائية خارجية (موصل معدني) إلى القطب السالب ، حيث تتم عملية تقليل أيونات النحاس من محلول ملحها:
النحاس 2+ + 2 هـ - \ u003d النحاس.
نتيجة لذلك ، تتشكل ذرات النحاس ، والتي تترسب على سطح الكاثود ، وتزداد كتلتها. الكاثود في الخلية الجلفانية هو قطب موجب الشحنة.
يمكن تمثيل المعادلة الكلية للتفاعل الذي يحدث في خلية جلفانية من النحاس والزنك على النحو التالي:
Zn + Cu 2+ = Zn 2+ + Cu.
في الواقع ، يحدث تفاعل استبدال النحاس بالزنك في ملحه. يمكن إجراء نفس التفاعل بطريقة أخرى - عن طريق غمر لوح من الزنك في محلول CuSO 4. في هذه الحالة ، يتم تشكيل نفس المنتجات - أيونات النحاس والزنك. لكن الاختلاف بين التفاعل في خلية جلفانية من النحاس والزنك هو أن عمليات الارتداد والتعلق بالإلكترونات مفصولة مكانيًا. لا تحدث عمليات الارتداد (الأكسدة) والتعلق (الاختزال) للإلكترونات أثناء الاتصال المباشر لذرة الزنك مع أيون Cu 2+ ، ولكن في أماكن مختلفة من النظام - على التوالي على الأنود والكاثود ، متصلة بواسطة موصل معدني. بهذه الطريقة لإجراء هذا التفاعل ، تنتقل الإلكترونات من القطب الموجب إلى القطب السالب على طول دائرة خارجية ، وهي موصل معدني. التدفق الموجه والمنظم للجسيمات المشحونة (في هذه الحالة ، الإلكترونات) هو كهرباء. يحدث تيار كهربائي في الدائرة الخارجية للخلية الجلفانية. تحتاج إلى تشغيل JavaScript للتصويت
المصادر الكيميائية للتيار الكهربائي أو الخلايا الجلفانيةتحويل الطاقة المنبعثة أثناء تفاعلات الأكسدة والاختزال إلى طاقة كهربائية. تعمل الخلايا الجلفانية كمصادر تيار مباشر. هم مقسمون إلى المواد الكيميائيةو تركيز.
يمكن أن تتكون أبسط خلية كلفانية كيميائية من قطبين معدنيين لهما إمكانات أقطاب مختلفة ومتصلة في دائرة مغلقة.
ستحدث عملية الأكسدة على القطب ، الذي يحتوي على قيمة أقل لإمكانات القطب. هذا القطب يسمى الأنود.
على القطب ، الذي يحتوي على قيمة أعلى لإمكانات القطب ، ستحدث عملية الاسترداد. هذا القطب يسمى الكاثود.
دعونا نفكر بمزيد من التفصيل في مبدأ تشغيل الخلايا الجلفانية باستخدام مثال عنصر مكون من أقطاب الزنك والنحاس. يسمى هذا العنصر عنصر جاكوبي دانيال (الشكل 94).
أرز. 94. مخطط خلية جلفانية النحاس والزنك
يتكون كل قطب من صفيحة معدنية مغمورة في محلول ملحي: ZnSO 4 و CuSO 4 ، على التوالي.
يتم فصل المحاليل الملحية عن بعضها البعض بواسطة قسم مسامي يمكن من خلاله تمرير أيونات المعادن و SO4 2- بسهولة. في كثير من الأحيان ، بدلاً من قسم مسامي ، " جسر الملح "- أنبوب زجاجي منحني مملوء بمحلول KCl مشبع (الشكل 95). في هذه الحالة ، لا تتلامس الأقطاب الكهربائية مع بعضها البعض ، كل واحد منهم في وعاء منفصل متصل باستخدام جسر الملح.
أرز. 95. مخطط عنصر النحاس والزنك مع جسر الملح: 1 - صفيحة الزنك. 2 - صفيحة نحاسية 3 - جسر الملح
في هذه الحالة ، تحدث عملية الأكسدة على قطب الزنك:
Zn 0 - 2ē \ u003d Zn 2+ ،
نتيجة لذلك تدخل أيونات الزنك من اللوحة إلى المحلول. تمر الإلكترونات الزائدة عبر موصل معدني من لوحة الزنك إلى النحاس وتستعيد أيونات النحاس 2+ الموجودة في المحلول
النحاس 2 + + 2ē \ u003d النحاس 0 ،
التي تترسب على الصفيحة في شكل ذرات متعادلة. تتحرك أيونات الكبريتات الحرة المتبقية في القطب النحاسي وأيونات الزنك 2+ في القطب الكهربائي للزنك والتي ظهرت بشكل زائد تجاه بعضها البعض من خلال قسم مسامي أو جسر ملح. وهكذا ، يتم نقل الشحنات الكهربائية في الدائرة وينشأ تيار كهربائي.
في هذا العنصر ، يتم الحصول على الطاقة الكهربائية نتيجة تفاعل كيميائي.
Zn + CuSO 4 \ u003d Cu + ZnSO 4
السمة الرئيسية للخلية الجلفانية هي القوة الدافعة الكهربائية (emf) التي يعتمد عليها التيار في الدائرة. إنه يساوي فرق جهود القطب
emf \ u003d E 2 - E 1
حيث E 1 و E 2 - على التوالي ، إمكانات الأنود والكاثود.
بالنسبة لخلية جاكوبي دانيال الجلفانية ، فإن القوة الدافعة الكهربائية هي
emf = E Cu - E Zn
كلما زادت قيمة emf. عنصر ، كلما زاد التيار في دائرته.
وفقًا لمعادلة Nernst ، يتم حساب إمكانات أقطاب النحاس والزنك بالصيغ:
E Cu = E Cu 0 +
E Zn = E Zn 0 +
بطرح المعادلة الثانية من الأولى ، نحصل على تعبير لحساب emf. خلية جلفانية من النحاس والزنك
emf = E Cu 0 - E Zn 0 + =
E Cu 0 - E Zn 0 +
بالنسبة لأي عنصر آخر ، يتكون من قطبين معدنيين ، ويستند إلى تفاعل كيميائي ، يمكن حساب القوة الدافعة الكهربائية بالصيغة:
emf = E 2 0 - E 1 0 +
حيث E 2 0 و E 1 0 هما جهد القطب القياسي ، على التوالي ، للكاثود والأنود ؛ n 2 و n 1 هي قيم شحنات الأيونات المشاركة في نصف التفاعلات التي تحدث عند الكاثود والأنود ؛ أ 2 و 1 هي أنشطة أيونات المعادن في المحاليل عند الكاثود والأنود ، على التوالي).
لدرجة حرارة تبلغ 298 كلفن ، عند استبدال قيم الثوابت R و F والانتقال من اللوغاريتم الطبيعي إلى اللوغاريتم العشري ، ستُكتب المعادلة بطريقة مختلفة:
emf \ u003d E 2 0 - E 1 0 + 0.059
يمكن تحديد الخلايا الجلفانية كرسم تخطيطي. على اليسار ، يظهر قطب كهربائي أو نصف خلية مع جهد قطب كهربائي منخفض (أنود) ، وعلى اليمين مع جهد قطب كهربائي أعلى (كاثود).
عند تسجيل الأقطاب الكهربائية ، يشار إلى المرحلة الصلبة أولاً (على سبيل المثال ، المعدن في حالة القطب المعدني أو الأكسدة) ، ثم المواد المذابة في الطور السائل. يتم فصل المراحل عن بعضها بخط رأسي واحد. إذا احتوت إحدى المراحل على عدة مكونات ، فسيتم فصلها بفاصلات.
يتم تمثيل الواجهة بين حلول قطبين بواسطة خط عمودي منقط أو خطين صلبين ½½ (إذا تم فصل الحلول عن بعضها البعض بواسطة جسر ملح).
وفقًا للقواعد أعلاه ، تبدو دائرة عنصر Jacobi-Daniel كما يلي:
الزنك ½ ZnSO 4 ½½ CuSO 4 ½ النحاس
يمكن أيضًا أن تتكون الخلية الجلفانية من قطبين من أقطاب الأكسدة والاختزال بقيم مختلفة لإمكانات الأكسدة والاختزال. تسمى هذه الخلايا بخلاف ذلك بالخلايا الجلفانية الأكسدة والاختزال. كما أنها تشير إلى الخلايا الكيميائية الجلفانية ، لأن. يعتمد عملها على حدوث تفاعل كيميائي.
تسمى الخلية الجلفانية ، حيث لا يكون مصدر الطاقة تفاعلًا كيميائيًا ، ولكن عمل معادلة تركيزات (أنشطة) الأيونات ، يسمى التركيز . يمكن أن يتكون من قطبين متطابقين من المعدن مغمور في محاليل من نفس الملح ، ولكن بتركيز (نشاط) مختلف من أيونات المعادن (الشكل 96) ، على سبيل المثال:
Zn ½ ZnSO 4 ½½ ZnSO 4 ½ Zn أو Ag ½ AgNO 3 ½½ AgNO 3 ½ Ag
أرز. 96. سلسلة تركيز الزنك: م - جسر ملح يحتوي على كلوريد البوتاسيوم
يذوب القطب ، الموجود في محلول أكثر تمييعًا ، وتتحول أيوناته إلى المحلول:
نحاس - 2ē ® نحاس 2+
Ag - ē ® Ag +
يصبح القطب نفسه مشحونًا سالبًا.
على القطب ، مغمورة في محلول أكثر تركيزًا ، على العكس من ذلك ، تترسب أيونات المعادن ، وتكون مشحونة بشكل إيجابي. وبالتالي ، تحدث العمليات على كلا القطبين الكهربائيين مما يؤدي إلى معادلة تركيز أيونات المعادن في المحاليل.
في هذه الحالة ، تكون إمكانات الأقطاب متساوية:
ه 1 = ه 0 + ؛ E 2 \ u003d E 0 +
بطرح المعادلة الأولى من الثانية ، نحصل على صيغة لحساب emf. من عنصر التركيز:
emf \ u003d E 2 - E 1 \ u003d
سيعمل عنصر التركيز حتى تتساوى أنشطة أيونات المعادن في كلا المحلين ؛ عندما 1 \ u003d a 2 لها emf. سوف تساوي 0.
في الظروف الحديثة ، فإن أكثر مصادر التيار الكيميائي شيوعًا هي الخلايا الجلفانية. على الرغم من عيوبها الفردية ، إلا أنها تستخدم على نطاق واسع في الإلكترونيات ، ويتم العمل المستمر لتحسينها. مبدأ تشغيل الخلية الجلفانية بسيط للغاية. يتم غمر صفائح النحاس والزنك في محلول مائي من حامض الكبريتيك ، والذي يلعب دور القطب الموجب والسالب.
مبدأ عمل الخلية الجلفانية
عندما يتم توصيل القطبين بموصل ، تظهر أبسط دائرة كهربائية. سيحدث التدفق الحالي داخل العنصر من شحنة سالبة إلى شحنة موجبة ، أي من صفيحة زنك إلى صفيحة نحاسية. سيتم تنفيذ حركة الجسيمات المشحونة على طول الدائرة الخارجية في الاتجاه المعاكس.
عند التعرض للتيار الكهربائي ، ستحدث حركة بقايا حامض الكبريتيك وأيونات الهيدروجين في اتجاهات مختلفة. في هذه الحالة ، ينقل الهيدروجين الشحنة إلى الصفيحة النحاسية ، وينقل باقي الحمض إلى صفيحة الزنك. وبالتالي ، سيتم الحفاظ على الجهد في المحطات. في الوقت نفسه ، تستقر فقاعات الهيدروجين على الصفيحة النحاسية ، مما يضعف التأثير الكلي للعنصر ويخلق جهدًا إضافيًا. يُعرف هذا الجهد باسم القوة الدافعة الكهربائية للاستقطاب. لتجنب هذه الظاهرة ، يتم إدخال مادة في التركيبة قادرة على امتصاص ذرات الهيدروجين وأداء وظيفة إزالة الاستقطاب.
الخلايا الجلفانية: مزايا وعيوب
لتصنيع الخلايا الجلفانية الحديثة تستخدم مجموعة متنوعة من المواد. الأكثر شيوعًا هي المواد التي تعتمد على عناصر الكربون والزنك المستخدمة في أظافر الأصابع.
تعتبر جودتها الإيجابية الرئيسية منخفضة التكلفة نسبيًا. ومع ذلك ، فإن هذه العناصر لها طاقة منخفضة وعمر تخزين قصير. الخيار الأفضل هو استخدام العناصر القلوية. هنا ، ليس الفحم ، ولكن المحلول القلوي يعمل كإلكتروليت. عند التفريغ ، لا يتم إطلاق أي غاز ، مما يضمن إحكام تام. العناصر القلوية لها مدة صلاحية أعلى.

المبدأ العام لتشغيل الخلية الجلفانية لجميع أنواعها هو نفسه تمامًا. على سبيل المثال ، العناصر القائمة على أكسيد الزئبق تشبه بنيوياً العناصر القلوية. تتميز بمقاومة متزايدة لدرجات الحرارة المرتفعة ، وقوة ميكانيكية عالية وقيمة جهد ثابتة. العيب هو سمية الزئبق ، الأمر الذي يتطلب معالجة دقيقة للعناصر المستهلكة.
مثال على خلية كيميائية كلفانية هي خلية جاكوبي دانيال (الشكل 6). يتكون من قطب نحاسي (لوح نحاسي مغمور في محلول CuSO 4) وقطب كهربي من الزنك (صفيحة زنك مغمورة في محلول ZnSO 4). يظهر A DES على سطح صفيحة الزنك ويتم إنشاء توازن
Zn ⇄ Zn 2+ + 2ē
في هذه الحالة ، ينشأ جهد القطب الكهربائي للزنك ، وستبدو دائرة القطب الكهربائي مثل Zn | ZnSO 4 أو Zn | Zn 2+.
وبالمثل ، يظهر DES أيضًا على صفيحة نحاسية ويتم إنشاء توازن
نحاس ⇄ نحاس 2+ + 2ē
لذلك ، ينشأ جهد قطب كهربائي للنحاس ، وستبدو دائرة القطب الكهربائي مثل Cu | CuSO 4 أو Cu | Cu 2+.
على القطب Zn (أكثر نشاطًا كهروكيميائيًا) ، تستمر عملية الأكسدة: Zn - 2ē → Zn 2+. على القطب النحاس (أقل نشاطًا كهربيًا) ، تتم عملية الاختزال: Cu 2+ + 2ē → Cu.
أرز. 6 مخطط خلية جلفانية النحاس والزنك
المعادلة الكلية للتفاعل الكهروكيميائي:
Zn + Cu 2+ → Zn 2+ + Cu
أو Zn + CuSO 4 → ZnSO 4 + Cu
نظرًا لأن دائرة الخلية الكيميائية الجلفانية مكتوبة وفقًا لقاعدة "right plus" ، فإن دائرة خلية Jacobi-Daniel ستبدو بالشكل
يشير الشريط المزدوج في الرسم التخطيطي إلى التلامس الإلكتروليتي بين الأقطاب الكهربائية ، وعادة ما يتم ذلك عن طريق جسر الملح.
في الخلية الجلفانية المنغنيز والزنك (الشكل 7) ، كما هو الحال في خلية النحاس والزنك ، يعمل قطب الزنك كقطب موجب. يتم ضغط القطب الموجب من خليط من ثاني أكسيد المنغنيز مع الجرافيت وسخام الأسيتيلين على شكل عمود "تكتل" ، في منتصفه يتم وضع قضيب كربون - جامع تيار.
أرز. 7 مخطط خلية جافة من المنغنيز والزنك
1 - الأنود (كأس الزنك) ، 2 - الكاثود (خليط من ثاني أكسيد المنجنيز مع الجرافيت) ، 3 - جامع تيار الجرافيت بغطاء معدني ،
4 - المنحل بالكهرباء
يحتوي الإلكتروليت المستخدم في خلايا المنغنيز والزنك المحتوية على كلوريد الأمونيوم ، بسبب التحلل المائي لـ NH 4 CI ، على تفاعل حمضي قليلاً. في الإلكتروليت الحمضي ، تحدث عملية توليد التيار على القطب الموجب:
МnO 2 + 4Н + + 2ē → n 2+ + 2Н 2 O
في المنحل بالكهرباء برقم هيدروجيني 7-8 ، يوجد عدد قليل جدًا من أيونات الهيدروجين ويبدأ التفاعل مع مشاركة الماء:
MnO 2 + H 2 O + ē → MnOOH + OH -
MnOOH عبارة عن هيدروكسيد منجنيز (III) غير مكتمل - منجانيت.
عندما يتم استهلاك أيونات الهيدروجين في عملية التشكيل الحالية ، يصبح المنحل بالكهرباء حامضيًا أو متعادلًا أو حتى قلويًا. لا يمكن الاحتفاظ بالتفاعل الحمضي في المحلول الملحي أثناء تفريغ العناصر. من المستحيل إضافة حمض إلى إلكتروليت الملح ، لأن هذا سيؤدي إلى تفريغ ذاتي قوي وتآكل لإلكترود الزنك. عندما يتراكم المنجانيت على القطب ، يمكن أن يتفاعل جزئيًا مع أيونات الزنك المتكونة أثناء تفريغ القطب الكهربائي للزنك. في هذه الحالة ، يتم الحصول على مركب قليل الذوبان - هيتايروليت ، ويتم تحمض المحلول:
2MnOOH + Zn 2+ → ZnO ∙ Mn 2 O 3 + 2H +
يمنع تكوين الهيتيروليت المنحل بالكهرباء من أن يصبح شديد القلوية عند تفريغ الخلية.