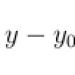1 слайд
Тема урока: Аммиак «Можно не любить химию, но прожить без неё сегодня и завтра нельзя» О.М. Нефёдов

2 слайд
Встречаемся с аммиаком производство HNO3 Медицина Продукт белкового обмена в живых организмах Производство удобрений Моющие средства Краска для волос Хладогент в холодильниках Сегодня аммиак - исключительной важности сырье для производства азотсодержащих веществ, применяемых в сельском хозяйстве, химии, медицине, военном деле. И что не менее важно, он является одним из продуктов белкового обмена в организме.

3 слайд
История открытия аммиака Посредине ливийской пустыни стоял храм, посвященный богу Амон Ра. В древности арабские алхимики получали из оазиса Амон, находившегося около храма, бесцветные кристаллы. растирали в ступках, нагревали – и получали едкий газ. Сначала его именовали аммониак, а потом сократили название до «аммиак». В 18 веке аммиак был получен английским химиком Джозефом Пристли. Сегодня аммиак - исключительной важности сырье для производства азотсодержащих веществ, применяемых в сельском хозяйстве, химии, медицине, военном деле. И что не менее важно, он является одним из продуктов белкового обмена в организме.

4 слайд

5 слайд
Физические свойства аммиака NH3 NH3 аммиак - газ: без цвета, с характерным запахом, легче воздуха (собирают в перевёрнутый вверх дном сосуд) NH3 - ЯДОВИТ! Жидкий аммиак вызывает сильные ожоги кожи; обычно его перевозят в стальных баллонах (окрашены в желтый цвет, имеют надпись "Аммиак" черного цвета) Нашатырный спирт – 3-10 % раствор аммиака Аммиачная вода - 18 -25 % раствор аммиака Смесь аммиака с воздухом взрывоопасна!

6 слайд
Строение молекулы аммиака ▪ ▪ ▪ Н * * *Н Н │ N ▪▪ Атом азота за счет своих трех неспаренных электронов образует с атомами водорода 3 ковалентные полярные связи => валентность N равна ІІІ Неподеленная электронная пара атома азота способна участвовать в образовании четвертой ковалентной связи с атомами, имеющими вакантную (свободную) орбиталь по донорно-акцепторному механизму. Валентность N равна ІV Механизм донорно-акцепторной связи: H3N: + H+ = + ион аммония

7 слайд
Химические свойства аммиака Реакции, идущие с изменением степени окисления азота NH3 – сильный восстановитель без изменения степени окисления азота NH3 – слабое основание 1. аммиак – непрочное соединение, при нагревании разлагается: 2NH3 N2 + 3H2 2. аммиак горит в кислороде: NH3 + O2 → N2 + H2O 3. окисление аммиака кислородом воздуха в присутствии катализатора: NH3 + O2 NО + H2O Pt, Rh аммиак реагирует с водой: NH3 + H2O NH4OH NH4+ + OH− гидроксид аммония аммиак реагирует с кислотами: NH3 + HCl → NH4Cl хлорид аммония

8 слайд
Добрый старый аммиак, Он богач, и он бедняк, Богат неподеленными своими электронами, Но только, вот беда, ему В растворе скучно одному. Он погулять готов всегда: Там кислота, а тут вода… Потом, обобранный до нитки, Он плачет: «Где мои пожитки? Какое это беззаконие: Стал катионом я аммония!»
ИСТОРИЧЕСКАЯ СПРАВКА Впервые аммиак был получен в чистом виде в 1774 г. английским химиком Джозефом Пристли. В 1784 г. французский химик Клод Луи Бертолле с помощью электрического разряда разложил аммиак на элементы и установил таким образом состав этого газа, который в 1787 г. получил официальное название «аммониак» – от латинского названия нашатыря – sal ammoniac; эту соль получали близ храма бога Амона в Египте. Джозеф Пристли Клод Луи Бертолле

ИСТОРИЧЕСКАЯ СПРАВКА Это название сохраняется и ныне в большинстве западноевропейских языков (нем. Ammoniak, англ. ammonia, фр. ammoniaque); сокращенное название «аммиак» которым мы пользуемся, ввел в обиход в 1801 г. русский химик Яков Дмитриевич Захаров, который впервые разработал систему русской химической номенклатуры. Оазис Аммона в Северной Африке Остатки Храма Аммона

Резкий запах аммиака известен человеку с доисторических времен, так как этот газ образуется в значительных количествах при гниении, разложении и сухой перегонке содержащих азот органических соединений, например мочевины или белков. Не исключено, что на ранних стадиях эволюции Земли в ее атмосфере было довольно много аммиака. Однако и сейчас ничтожные количества этого газа всегда можно обнаружить в воздухе и в дождевой воде, поскольку он непрерывно образуется при разложении животных и растительных белков. На некоторых планетах Солнечной системы ситуация иная: астрономы считают, что значительная часть масс Юпитера и Сатурна приходится на твердый аммиак. ИСТОРИЧЕСКАЯ СПРАВКА

СТРОЕНИЕ МОЛЕКУЛЫ АММИАКА Азот более электроотрицательный элемент, чем водород, поэтому при образовании связи N-H общие электронные пары «сдвигаются» к атому азота. Каждая связь N-H становится полярной, поэтому и молекула аммиака в целом полярная. Из электронной формулы видно и другое: у атома азота остаётся свободная (неподелённая) пара электронов. Это дополнительно повышает полярность молекулы аммиака и обусловливает многие свойства аммиака.

ФИЗИЧЕСКИЕ СВОЙСТВА АММИАКА газ без цвета имеет резкий запах едкий вкус в 1,7 раза легче воздуха при Т = -33,4 0 С сжижается при Т = - 77,7 0 С затвердевает растворяется в спиртах, бензоле, ацетоне хорошо растворим в воде (в 1 V воды – 700 V аммиака) Растворимость аммиака в воде Н2ОН2О NHз

ФИЗИОЛОГИЧЕСКОЕ ДЕЙСТВИЕ НА ОРГАНИЗМ ЧЕЛОВЕКА По физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это мы и воспринимаем как резкий запах. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюнктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи. При соприкосновении сжиженного аммиака и его растворов с кожей возникает жжение, возможен химический ожог с пузырями, изъязвлениями. Кроме того, сжиженный аммиак при испарении поглощает тепло, и при соприкосновении с кожей возникает обморожение различной степени.

ХИМИЧЕСКИЕ СВОЙСТВА АММИАКА (связанные с изменениями степени окисления азота) 1. Разложение аммиака: ? N -3 H 3 + = N ? H Горение аммиака: ? N -3 H ? О 2 0 = ? N ? H 2 O -2 + Q 3. Каталитическое окисление аммиака: ? N -3 H ? О 2 0 = ? N +2 O + ? H 2 O -2 + Q Горение аммиака в кислороде Задание: составьте электронный баланс, укажите окислитель/восстановитель, процесс окисление /восстановитель NH 4 Cl, Ca(OH) 2 KMnO 4 O2O2 NHз

ПРОВЕРЬ СЕБЯ! 1) 2 N -3 H 3 + = N H N е = N окисление/восстановитель 3 2H + +2e = H 2 0 –восстановление/окислитель 2) 4 N -3 H О 2 0 = 2 N H 2 O -2 + Q 2 2N е = N окисление/восстановитель 3 О e = 2О -2 –восстановление/окислитель 3) 4 N -3 H О 2 0 = 4 N +2 O + 6 H 2 O -2 + Q 4 N е = N +2 - окисление/восстановитель 5 О e = 2О -2 –восстановление/окислитель

ХИМИЧЕСКИЕ СВОЙСТВА АММИАКА (связанные с особенностями ковалентной полярной связи в молекуле аммиака) 1)Взаимодействие с водой:.. NHз + HOH NH 4 OH 2)Взаимодействие с кислотами:.. NHз + HCl NH 4 Cl Гидроксид аммония или «нашатырный спирт» Хлорид аммония или «нашатырь», «нюхательная соль» Вывод: аммиак обладает основными (щелочными) свойствами

ПОЛУЧЕНИЕ АММИАКА Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония: NH 4 Cl + NaOH = NH 3 + NaCl + H 2 O. Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота: N 2 (г) + 3H 2 (г) 2NH 3 (г) + 45,9 к Дж Это так называемый процесс Габера (немецкий физик, разработал физико-химические основы метода). NH 4 Cl, Ca(OH) 2 NHз

ПРИМЕНЕНИЕ АММИАКА Используется для производства азотных удобрений (нитрат и сульфат аммония, мочевина), взрывчатых веществ и полимеров, азотной кислоты, соды (по аммиачному методу) и других продуктов химической промышленности. Жидкий аммиак используют в качестве растворителя. В холодильной технике используется в качестве холодильного агента.

ПРИМЕНЕНИЕ АММИАКА В медицине 10% раствор аммиака, чаще называемый нашатырным спиртом, применяется при обморочных состояниях (для возбуждения дыхания), для стимуляции рвоты, а также наружно невралгии, миозиты, укусы насекомых, обработка рук хирурга. Для возбуждения дыхания и выведения больного из обморочного состояния осторожно подносят небольшой кусок марли или ваты, смоченный нашатырным спиртом, к носу больного (на 0,5–1 с). Физиологическое действие нашатырного спирта обусловлено резким запахом аммиака, который раздражает специфические рецепторы слизистой оболочки носа и способствует возбуждению дыхательного и сосудодвигательного центров мозга, вызывая учащение дыхания и повышение артериального давления.

ИСТОЧНИКИ ИНФОРМАЦИИ 0%D0%9A&imgurl= 1.jpg&imgrefurl= =__u8g4E- 8evya8zce7LvnS2LQ09lo=&h=245&w=300&sz=10&hl=ru&zoom=1&um=1&itbs=1 &tbnid=xErS9lz4l8rcjM:&tbnh=95&tbnw=116&prev=/images%3Fq%3D%25D0%25 90%25D0%259C%25D0%259C%25D0%2598%25D0%2590%25D0%259A%26start%3 D108%26um%3D1%26hl%3Dru%26newwindow%3D1%26sa%3DN%26ndsp%3D18 %26tbs%3Disch:1&start=117&um=1&newwindow=1&sa=N&ndsp=18&tbs=isch:1 #tbnid=xErS9lz4l8rcjM&start=121

Аммиак: состав, строение, свойства, применение
Лукуша Елена Фёдоровна, учитель химии МБОУ «Морская средняя школа» городского округа Судак, Республики Крым

Аммиак может быть обязан своим названием оазису бога Аммона в Северной Африке, находящемуся на перекрестке караванных путей.
В очень жарком климате мочевина (NH 2) 2 CO, разлагается особенно быстро.
Одним из основных продуктов разложения и является аммиак.
Оазис «Аммон»
в Северной Африке

По некоторым другим сведениям, аммиак мог получить современное название от древнеегипетского слова «амониан».
Так называли всех
верующих людей, поклоняющихся богу Амону.
Люди во время своих ритуальных обрядов нюхали NH 4 Cl, который при нагревании издаёт запах аммиака.
Бог Аммон в образе барана

Сокращенное название «аммиак» которым мы всегда пользуемся, ввел в обиход в 1801 году русский ученый - химик, академик
Яков Дмитриевич Захаров, который впервые разработал также и систему русской химической номенклатуры.


ковалентная полярная
Химическая связь
Кристаллическая решетка
молекулярная

Физические свойства (при н.у.)
- бесцветный газ
с резким характерным запахом (запах нашатырного спирта)
- легче воздуха (М=17 г/моль)
- хорошо растворяется в воде (1200 объёмов при 0 °C) и 700 объёмов (при 20 °C) в объёме воды
- температура плавления -77.73 °C
- температура кипения -33.34 °C
- ЯДОВИТ!


Получение аммиака
Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония:
2NH 4 Cl + Ca(OH) 2 = 2NH 3 + СaCl 2 + 2H 2 O
(NH 4 ) 2 SO 4 + 2NaOH = 2NH 3 + Na 2 SO 4 + 2H 2 O
Гидроксид аммония неустойчивое основание, разлагается:
NH 4 OH ↔ NH 3 + H 2 O
При получении аммиака необходимо держать пробирку - приёмник дном кверху, так как аммиак …..

Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота:
N2(г) + 3H2(г) ↔ 2NH3(г) + 45,9 кДж
катализатор – пористое железо
температура – 450 – 500 ˚С
давление – 25 – 30 МПа
Это так называемый процесс Габера (немецкий физик, разработал физико-химические основы метода).

Химические свойства аммиака
Для аммиака характерны реакции:
1) с изменением степени окисления атома азота (реакции окисления);
2) без изменения степени окисления атома азота (присоединение).

Реакции с изменением степени окисления атома азота (реакции окисления)
N -3 → N 0 → N +2
NH3-сильный восстановитель

с кислородом
Горение аммиака (при нагревании)
4NH 3 + 3O 2 → 2N 2 + 6H 2 0
Каталитическое окисление амииака (катализатор Pt – Rh, температура)
4NH 3 + 5O 2 → 4NO + 6H 2 O

с оксидами металлов
2NH 3 +3CuO =3Cu + N 2 +3H 2 O

с сильными окислителями
2NH 3 + 3Cl 2 = N 2 + 6HCl
(при нагревании)

Реакции без изменения степени окисления атома азота (присоединение - образование иона аммония NH 4 +
по донорно-акцепторному механизму

Взаимодействие с кислотами
NH 3 + HCl → NH 4 Cl
2NH 3 +H 2 SO 4 → (NH 4 ) 2 SO 4

Взаимодействие с водой
NH 3 + H 2 O = NH 4 OH
При добавлении фенолфталеина‑ раствор становится малиновым, так как при растворении аммиака частично образуется гидроксид аммония NH 4 OH.

Применение аммиака
- Производство пластмасс и
волокон
2. В составе моющих средств

3. Производство азотных удобрений
4. В сельском хозяйстве

5. Производство азотной кислоты
6. Получение взрывчатых веществ



Это интересно
- Пары нашатырного спирта способны изменять окраску цветов. Например, голубые и синие лепестки становятся зелеными , ярко красные - черными.
- Облака Юпитера состоят из аммиака.
Чтобы пользоваться предварительным просмотром презентаций создайте себе аккаунт (учетную запись) Google и войдите в него: https://accounts.google.com
Подписи к слайдам:
Аммиак NH 3 Кириллова Маргарита Алексеевна учитель химии лицея № 369 Красносельского района
Строение атома азота N Азот 14,0067 2 5 7 2 s 2 2p 3 N 7 N II период V группа 2 s 2p На внешнем уровне атома азота – валентные 1 s -орбиталь, на которой находятся два спаренных электрона, и три p- орбитали, на каждой из которых по одному неспаренному электрону.
Образование молекулы аммиака При образовании связей в молекуле аммиака атом азота находится в состоянии sp 3 - гибридизации. 109 0 28 ’ : N + H: N:Н Н Н Н: : Н Н Н Н 107,3 0 На 4-й гибридизованной орбитали атома N находится неподеленная пара электронов. Форма молекулы – пирамидальная. Н: : Н
Строение молекул аммиака Между молекулами аммиака образуются водородные связи: Связи N-H полярные, молекула имеет пирамидальную форму, общие электронные пары смещены в сторону атома азота. Одна из вершин занята неподеленной парой электронов. Молекула сильно полярна.
Физические свойства аммиака Бесцветный газ с резким запахом. Почти в два раза легче воздуха: При охлаждении до -33 0 С – c жижается. Очень хорошо растворяется в воде, т.к. образуются водородные связи между молекулами аммиака и молекулами воды (в 1 V воды растворяется 700 V аммиака. 10%-ный р-р – “ нашатырный спирт ” . Концентрированный раствор содержит 25% аммиака.
Способы получения аммиака В промышленности: N 2 + 3H 2 2NH 3 Реакция проводится при нагревании, под давлением, в присутствии катализатора. В лаборатории: Действием щелочей на соли аммония: 2NH 4 Cl + Ca(OH) 2 = CaCl 2 + 2NH 3 + 2H 2 O Гидролиз нитридов: Mg 3 N 2 + 6H 2 O = 3Mg(OH) 2 + 2NH 3
Химические свойства аммиака NH 3 – низшая степень окисления азота. -3 1. Аммиак - восстановитель Реакция горения аммиака: 4NH 3 + 3O 2 = 2N 2 + 6H 2 O Каталитическое окисление аммиака: 4NH 3 + 5O 2 = 4NO + 6H 2 O Аммиаком можно восстановить некоторые неактивные металлы: 3CuO + 2 NH 3 = 3Cu + N 2 + 3H 2 O
II. Основные свойства аммиака: При растворении аммиака в воде образуется гидрат аммиака, который диссоциирует: NH 3 + H 2 O NH 3 H 2 O NH 4 + + OH - ион аммония Изменяет окраску индикаторов: Фенолфталеин – б / цв малиновый Метилоранж – оранжевый желтый Лакмус – фиолетовый синий С кислотами образует соли аммония: NH 3 + HCl = NH 4 Cl хлорид аммония 2NH 3 + = (NH 4) 2 SO 4 сульфат аммония NH 3 + H 2 SO 4 = NH 4 HSO 4 гидросульфат аммония
Образование иона аммония NH 3 + H + = NH 4 + Н: : Н Н: : Н N N: Н: + H + Н: : Н Н: : N N: Н: + Атом азота находится в состоянии sp 3 - гибридизации. Три связи образованы по обменному механизму,четвертая – по донорно-акцепторному. Донор – атом азота – предоставляет пару электронов. Акцептор – ион Н + - предоставляет орбиталь.
Соли аммония Ион аммония по размерам и заряду близок к ионам щелочных металлов, поэтому соли аммония похожи на соли щелочных металлов. Кристаллические вещества. Белого цвета. Хорошо растворяются в воде. Их растворение в воде сопровождается поглощением тепла. Качественная реакция на ион аммония – взаимодействие солей с растворами щелочей: NH 4 NO 3 + NaOH = NaNO 3 + NH 3 + H 2 O характерный резкий запах аммиака
Разложение солей аммония при нагревании Соли летучих кислот: NH 4 Cl = NH 3 + HCl (NH 4) 2 CO 3 = 2NH 3 + CO 2 + H 2 O C оли нелетучих кислот: (NH 4) 2 SO 4 = NH 4 HSO 4 + NH 3 (NH 4) 3 PO 4 = (NH 4) 2 HPO 4 + NH 3 без нагревания (NH 4) 2 HPO 4 = NH 4 H 2 PO 4 + NH 3 при нагревании Соли с анионом-окислителем: (NH 4) 2 Cr 2 O 7 = N 2 + Cr 2 O 3 + 4H 2 O NH 4 NO 3 = N 2 O + 2H 2 O NH 4 NO 2 = N 2 + 2H 2 O
Азотная кислота Аммиачнаяселитра Ca(NO 3) 2 Сульфат аммония (NH 4) 2 SO 4 Хлорид аммония NH 4 Cl Карбамид (мочевина) CO(NH 2) 2 Аммиачная вода NH 3 H 2 O Жидкий аммиак NH 3 Аммиак Азотные удобрения Производство лекарств Окислитель ракетного топлива Соли аммония для паяния Производство взрывчатых веществ Получение соды Хладоагент в промышленных холодильных установках Производство фотопленки и красителей Обработка драгоценных металлов Применение аммиака и солей аммония
Благодарю за внимание
Презентация "Аммиак" может быть использована учителем химии в учебном процессе в качестве учебного электронного тематического пособия:
- на уроках химии при объяснении нового и закреплении пройденного материала по теме "Неметаллы. Аммиак" в 9-11 классе;
- во внеклассной работе - на факультативных занятиях и кружках;
- при индивидуальных занятиях с учащимися;
- при подготовке учащихся к практическим работам по получению, собиранию и обнаружению газообразных веществ.
Так, например, объяснение нового материала на уроке "Аммиак" можно провести на основе беседы с учащимися. Учитель может построить ее на повторяющемся вопросе - что вам известно о:? И далее следуют наводящие вопросы учителя (подготовленные заранее, в зависимости от специфики класса следует подбирать вопросы с различной дифференциацией). Учитель, по своему усмотрению, может перефразировать вопросы, изменить их последовательность, сократить их общий объем. Ответы учащихся учитель дополняет своим рассказом и показом соответствующих слайдов. Объяснение нового материала можно провести и по другой схеме: показ слайда (слайдов), затем рассказ учителя с элементами беседы; либо - сначала рассказ учителя, затем показ слайда (слайдов) и беседа с учащимися (если она уместна).
Учитель может приостановить презентацию для показа демонстрационных опытов, либо видеоопытов, работы с электронной доской, а затем возобновить работу с ней.
Для большей заинтересованности учащихся в получении знаний по теме и активизации их на уроке учитель предлагает им выполнить заранее домашнее задание творческого характера. Задание в виде вопросов, цепочек превращений предлагается всему классу, либо оно распределяется по группам класса. Учащиеся должны подготовить ответы на вопросы.
Вопросы, например, такие:
1. Как был получен аммиак, объясните этимологию этого слова? В какое историческое время это было?
2. Как правильно собрать аммиак и доказать его наличие?
3. Что интересного вам известно об аммиаке? Где применяется это вещество?
Повторение пройденного материала по теме "Химия неметаллов" учитель может провести также на основе презентации. Если возникают затруднения при ответах учащихся, то есть возможность вернуться к рассмотрению данного вопроса на основе соответствующего слайда. Наличие гиперссылок облегчат поиск нужного слайда.
Использовать презентацию "Аммиак" могут и учащиеся при дистанционном обучении, при выполнении домашних заданий, подготовке к контрольным и практическим работам, самопроверке своих знаний по теме, т.е. с помощью данной презентации можно повысить самостоятельный поиск знаний учащимися, что особенно актуально при переходе школ на ФГОС второго поколения.
На слайдах представлен материал, который позволит подготовиться к итоговой аттестации в формате ГИА и ЕГЭ. олимпиаде. В случае затруднений всегда можно вернуться к презентации.
Наличие такого электронного пособия, как презентация "Аммиак" в кабинете химии, дает возможность учителю сократить время на подготовку к уроку, повысить заинтересованность учащихся в изучении темы, повысить уровень обученности и качества знаний учащихся по химии.