शिक्षा के लिए संघीय एजेंसी
यूएसटीयू - यूपीआई
धातुकर्म प्रक्रियाओं के सिद्धांत विभाग
एल.ए. ज़ुकोवा, ए.ए. Zhukov
भौतिक रसायन
विभाग द्वारा तैयार शैक्षिक इलेक्ट्रॉनिक पाठ संस्करण "धातुकर्म प्रक्रियाओं का सिद्धांत"
150100 - धातु विज्ञान, 150600 - सामग्री विज्ञान और सामग्री की प्रौद्योगिकी के छात्रों के लिए अनुशासन "भौतिक रसायन विज्ञान" पर व्याख्यान का सार
येकातेरिनबर्ग
खंड 1. परिचय और बुनियादी शर्तें …………… |
…………….………………………… |
|||||
व्याख्यान 1 ………………… |
…………………………… |
…………………………… |
||||
धारा 2. ऊष्मप्रवैगिकी के पहले नियम का थर्मल प्रभावों की गणना के लिए आवेदन |
||||||
प्रक्रियाएं …………………………… |
……………………………………………………… |
|||||
व्याख्यान 2………………………… |
…………………………………………………… |
|||||
धारा 3. प्रक्रियाओं की दिशा निर्धारित करने के लिए ऊष्मप्रवैगिकी के दूसरे नियम का अनुप्रयोग |
||||||
और संतुलन की स्थिति ……………………………………………………………………… |
||||||
व्याख्यान 3…………………… |
…………………………………………………………… |
|||||
व्याख्यान 4............ |
………………………………………………………………………… |
|||||
व्याख्यान 5…… |
……………………………………………………………………………… |
|||||
धारा 4. समाधान के उष्मागतिकी ……… |
……………………………………………….44 |
|||||
व्याख्यान 6…………………………………………………………………… |
||||||
व्याख्यान 7 ……… |
…………………………………………………………………………… |
|||||
लेक्चर 8…… |
…………………………………………………………………………… |
|||||
खंड 5. चरण संतुलन और राज्य आरेख ……… |
…………………………..……59 |
|||||
व्याख्यान 9 ………………………………………………… |
…………………………… |
|||||
व्याख्यान 10………………………………………………………………………………… |
||||||
व्याख्यान 11…………………………………………………………………… |
||||||
व्याख्यान 12 ………………………………………………………………………………… |
||||||
धारा 6. भूतल घटना …………………………………………………………… |
||||||
व्याख्यान 13………………………………………………………………………………… |
||||||
व्याख्यान 14……………………………………………………………………………… |
||||||
धारा 7. सजातीय रासायनिक प्रतिक्रियाओं की गतिज ………………… |
...………………… |
|||||
व्याख्यान 15…………………………………………………………………… |
||||||
धारा 8. विषम रासायनिक प्रतिक्रियाओं की गतिज …………………………… |
||||||
व्याख्यान 16…………………………………… |
………………………………… |
|||||
व्याख्यान 17……………………………………………………………………………… |
||||||
धारा 9. तरल और अनाकार धातुओं की संरचना और गुण ………………………….147 |
||||||
व्याख्यान 18………………………………………………………………………………… |
||||||
धारा 1. परिचय और बुनियादी शर्तें
अनुशासन के नाम से ही यह पता चलता है कि यह रसायन विज्ञान और भौतिकी के बीच एक सीमांत विज्ञान है। भौतिक रसायन विज्ञान का मुख्य कार्य विभिन्न भौतिक और रासायनिक घटनाओं के संबंध का अध्ययन है। चूंकि कोई भी वास्तविक घटना जटिल होती है, इसमें व्यक्तिगत पहलुओं का चयन - भौतिक या रासायनिक - बल्कि मनमाना होता है। इसलिए, कभी-कभी भौतिक रसायन विज्ञान और भौतिकी और रसायन विज्ञान के अलग-अलग वर्गों द्वारा अध्ययन किए गए मुद्दों के बीच एक रेखा खींचना मुश्किल होता है। एक विज्ञान के रूप में, भौतिक रसायन विज्ञान ने 19वीं शताब्दी के उत्तरार्ध में आकार लेना शुरू किया, हालांकि भौतिक रसायन विज्ञान की सामग्री का नाम और सामान्य परिभाषा सबसे पहले एम.वी. लोमोनोसोव (1752): "भौतिक रसायन विज्ञान एक ऐसा विज्ञान है जिसे भौतिक वैज्ञानिकों के प्रावधानों और प्रयोगों के आधार पर जटिल निकायों में रासायनिक क्रियाओं के माध्यम से होने वाले कारणों की व्याख्या करनी चाहिए।"
भौतिक रसायन विज्ञान रासायनिक प्रक्रियाओं के बहुपक्षीय अध्ययन से संबंधित है
और भौतिक घटनाओं के साथ, दोनों विज्ञानों के सैद्धांतिक और प्रायोगिक तरीकों का उपयोग करते हुए, साथ ही साथ अपने स्वयं के। यह एक रासायनिक प्रक्रिया के पाठ्यक्रम और उसके परिणाम की भविष्यवाणी करना संभव बनाता है, और इसके परिणामस्वरूप, एक इष्टतम परिणाम प्राप्त करने के लिए इसे नियंत्रित करना संभव बनाता है। भौतिक रसायन विज्ञान के आवेदन के क्षेत्र में रासायनिक और चरण परिवर्तन, रासायनिक प्रक्रियाओं पर भौतिक मापदंडों के प्रभाव और भौतिक गुणों पर रासायनिक संरचना के प्रभाव के सभी मुद्दों को शामिल किया गया है। पदार्थों के विभिन्न गुणों और उनकी भागीदारी के साथ विभिन्न प्रक्रियाओं की विशेषताओं के बहुपक्षीय अध्ययन के आधार पर, भौतिक रसायन विज्ञान दो सबसे महत्वपूर्ण कार्यों को हल करता है - यह प्रक्रिया की संभावना और इसकी गति को स्थापित करता है, उन कारकों को निर्धारित करता है जो इसे होने की अनुमति देते हैं। को नियंत्रित।
धातु विज्ञान लंबे समय से भौतिक रसायन विज्ञान की उपलब्धियों पर आधारित है, जिसने धातुकर्म इकाइयों में होने वाली प्रक्रियाओं के सिद्धांत को विकसित करना संभव बना दिया है। दी गई शर्तों के तहत विभिन्न प्रक्रियाओं की संभावना को सही ठहराते हुए, वैज्ञानिक दृष्टिकोण उनकी सबसे पूर्ण घटना के लिए स्थितियों की पहचान करना, इन प्रक्रियाओं की दरों की गणना करना, उनके पाठ्यक्रम के दौरान अवशोषित या जारी गर्मी की मात्रा को ध्यान में रखना संभव बनाता है, और एक के रूप में परिणाम, उच्च गुणवत्ता वाली धातु प्राप्त करने के लिए तकनीकी व्यवस्थाओं का अनुकूलन।
धातुओं और मिश्र धातुओं का उत्पादन एक जटिल और बहु-चरण प्रक्रिया है, जिसके प्रत्येक चरण में, तरल अवस्था सहित, भविष्य की संरचनात्मक सामग्री की आवश्यक संरचना और आवश्यक गुण बनते हैं। भौतिक रसायन शास्त्र के तरीकों का उपयोग मिश्र धातु की रासायनिक संरचना को दिए गए गुणों के साथ प्रमाणित करने और इसे प्राप्त करने के तरीकों को निर्धारित करने के लिए किया जाता है, इसके क्रिस्टलीकरण के दौरान होने वाली प्रक्रियाओं का अनुकूलन, एक पिंड की शीतलन दर निर्धारित करता है, जो किसी दिए गए चरण संरचना के गठन में योगदान देता है और संरचना, और धातु विज्ञान में कई अन्य प्रक्रियाओं के विश्लेषण में। इस प्रकार, भौतिक रसायन विज्ञान वांछित गुणों के साथ धातु, मिश्र धातु और अन्य सामग्री प्राप्त करने का सैद्धांतिक आधार है।
पर वर्तमान में, भौतिक रसायन विज्ञान अपने स्वयं के अनुसंधान विधियों के साथ एक स्वतंत्र अनुशासन है और कई अनुप्रयुक्त विषयों के लिए सैद्धांतिक आधार है।
भौतिक रसायन विज्ञान एक विशेषज्ञ धातुकर्मी के वैज्ञानिक दृष्टिकोण को आकार देने में एक प्रमुख भूमिका निभाता है, जो सबसे सामान्य पदों से धातुओं और मिश्र धातुओं को प्राप्त करने और प्रसंस्करण की प्रक्रियाओं के विश्लेषण और भविष्यवाणी करने की अनुमति देता है।
भौतिक रसायन विज्ञान का अध्ययन करने का उद्देश्य छात्रों को इस वैज्ञानिक अनुशासन के बुनियादी नियमों और उनके परिणामों से परिचित कराना है, कुछ सैद्धांतिक
और सिस्टम की संतुलन स्थिति और चल रही प्रक्रियाओं के कैनेटीक्स, विकासशील कौशल और क्षमताओं के मापदंडों का अध्ययन करने के लिए प्रयोगात्मक तरीकेविशेष पाठ्यक्रमों में धातुकर्म प्रक्रियाओं और प्रौद्योगिकियों के गहन अध्ययन के लिए आवश्यक भौतिक और रासायनिक विश्लेषण।
भौतिक रसायन विज्ञान द्वारा अध्ययन की गई विभिन्न प्रकार की घटनाओं ने भीतर अलगाव को जन्म दिया
इसके कई खंड हैं, जिनमें से मुख्य में निम्नलिखित शामिल हैं।
रासायनिक ऊष्मप्रवैगिकीऊर्जा संतुलन, रासायनिक और चरण संतुलन के मुद्दों पर विचार करने के साथ-साथ उन प्रणालियों में प्रक्रियाओं की दिशा को स्पष्ट करने से संबंधित है जहां कोई संतुलन नहीं है।
पदार्थ की संरचनाइसमें परमाणुओं, अणुओं की संरचना और पदार्थ की विभिन्न समग्र अवस्थाओं में उनकी परस्पर क्रिया का अध्ययन शामिल है।
समाधान सिद्धांतसमाधान बनाने वाले शुद्ध पदार्थों के गुणों के अनुसार समाधान और उनके घटकों के गुणों की व्याख्या और भविष्यवाणी करना है।
रासायनिक गतिकीरासायनिक प्रतिक्रियाओं की गति और तंत्र, प्रवाह की स्थिति पर उनकी निर्भरता का अध्ययन करता है।
सतह की घटनातरल पदार्थ और ठोस की सतह परतों के विशिष्ट गुणों और समग्र रूप से सिस्टम की विशेषताओं पर उनके प्रभाव पर विचार करें।
इलेक्ट्रोकैमिस्ट्री चार्ज कणों - आयनों से जुड़े रासायनिक प्रक्रियाओं का अध्ययन है।
इन वर्गों के बीच कोई स्पष्ट सीमाएँ नहीं हैं। किसी भी घटना का अध्ययन करते समय, विभिन्न वर्गों के अभ्यावेदन का उपयोग करना पड़ता है।
भौतिक रसायन विज्ञान के क्षेत्र में अनुसंधान तीन मुख्य विधियों पर आधारित है, जिनमें से प्रत्येक की अपनी अवधारणाएं, कानून और अनुसंधान के प्रयोगात्मक तरीके हैं।
भौतिक रसायन शास्त्र के तरीके
थर्मोडायनामिक विधि. इसकी मदद से प्राप्त सभी अवधारणाओं और कानूनों को प्रक्रियाओं के आणविक तंत्र में प्रवेश किए बिना, अनुभव के विवरण के परिणामस्वरूप तैयार किया जाता है। इस वजह से, यह विधि औपचारिक है, जो इसके आवेदन के दायरे को कुछ हद तक सीमित करती है। हालाँकि, यह व्यावहारिक गणनाओं को भी सुविधाजनक बनाता है।
सांख्यिकीय विधि।यह कणों के बड़े समूह के रूप में निकायों के विचार पर आधारित है, जो थर्मोडायनामिक्स की अवधारणाओं और नियमों को प्रमाणित करना और वर्णित घटनाओं की सीमा का विस्तार करना संभव बनाता है। यह विधि पदार्थों के स्थूल गुणों को अणुओं के सूक्ष्म गुणों से संबंधित करती है।
आणविक गतिजतरीका। आपको पदार्थों के गुणों और उनकी भागीदारी के साथ प्रक्रियाओं की विशेषताओं का वर्णन करने की अनुमति देता है, जिसमें गति के नियमों और इन पदार्थों को बनाने वाले कणों की बातचीत के आधार पर गति शामिल है।
भौतिक रसायन विज्ञान द्वारा अध्ययन की गई घटना की प्रकृति जटिल है; इसलिए, सैद्धांतिक और प्रयोगात्मक अनुसंधान विधियों के निरंतर सुधार के बावजूद, उनके सैद्धांतिक विवरण को संपूर्ण नहीं माना जा सकता है। घटना के सार की व्यापक समझ सृजन के मार्ग पर चलती है मॉडल प्रतिनिधित्वउनकी क्रमिक जटिलता और विवरण के साथ नए प्रयोगात्मक तथ्य जमा हो रहे हैं। कोई भी मॉडल वास्तविकता की कमोबेश सरलीकृत, जानबूझकर आदर्शित छवि है। भौतिक रसायन विज्ञान में व्यापक रूप से उपयोग किए जाने वाले सबसे प्रसिद्ध सरल अमूर्त एक आदर्श गैस, एक आदर्श क्रिस्टल, एक आदर्श समाधान, आदि के मॉडल हैं। गणितीय अभिव्यक्तियाँ जो सरलतम मॉडल के आधार पर घटनाओं और प्रक्रियाओं का वर्णन करती हैं, उनमें कठिन-से-निर्धारित मात्राएँ नहीं होती हैं, जो गणना को सरल करता है। एक नियम के रूप में, उनके आधार पर गणना वास्तविक प्रणालियों के गुणों के प्रयोगात्मक रूप से मापा मूल्यों के साथ संतोषजनक समझौता नहीं करती है। हालांकि, ऐसी तुलना भी उपयोगी है। प्रायोगिक डेटा से सैद्धांतिक भविष्यवाणियों के विचलन की प्रकृति और परिमाण के आधार पर, यह एक वास्तविक वस्तु की विशेषताओं को प्रकट करना संभव बनाता है जिसे आदर्श मॉडल में ध्यान में नहीं रखा जाता है और मॉडल सिद्धांत के अधिक उन्नत संस्करणों में अतिरिक्त मापदंडों को पेश करना संभव बनाता है।
बुनियादी अवधारणाएं और परिभाषाएं
भौतिक रसायन विज्ञान का मूल खंड है रासायनिक ऊष्मप्रवैगिकी।इसके ढांचे के भीतर पेश किए गए वैचारिक तंत्र का उपयोग भौतिक रसायन विज्ञान के अन्य वर्गों में भी किया जाता है।
थर्मोडायनामिक प्रणाली- यह एक काल्पनिक या वास्तविक इंटरफ़ेस के माध्यम से आसपास के स्थान से अलग किया गया एक पिंड या पिंडों का एक समूह है। एक थर्मोडायनामिक प्रणाली का द्रव्यमान अपरिवर्तित होता है, और पर्यावरण के साथ इसकी बातचीत केवल गर्मी और काम के रूप में ऊर्जा के आदान-प्रदान के माध्यम से होती है। एक माध्यम के साथ एक प्रणाली के आदान-प्रदान के मामले में, इसे खुला कहा जाता है। हम केवल ऐसे थर्मोडायनामिक सिस्टम पर विचार करेंगे जो पर्यावरण के साथ ऊर्जा का आदान-प्रदान करते हैं, लेकिन पदार्थ (बंद) का आदान-प्रदान नहीं करते हैं, उन्हें केवल "सिस्टम" कहते हैं।
ऊर्जा पदार्थ की गति की एक विशेषता है, दोनों मात्रात्मक और गुणात्मक रूप से, अर्थात। इस आंदोलन का पैमाना। किसी भी प्रणाली में ऊर्जा होती है, और इसके रूप विविध होते हैं, जैसे कि पदार्थ की गति के रूप होते हैं।
एक प्रणाली को बंद या पृथक कहा जाता है, अगर यह पर्यावरण के साथ या तो गर्मी के रूप में या काम के रूप में ऊर्जा का आदान-प्रदान नहीं करता है। यदि ऊर्जा का आदान-प्रदान केवल कार्य के रूप में होता है, तो निकाय कहलाता है रुद्धोष्म रूप से बंद. एक प्रणाली को सजातीय कहा जाता है यदि उसके प्रत्येक गुण का सिस्टम के विभिन्न भागों में समान मूल्य होता है या एक बिंदु से दूसरे बिंदु पर लगातार बदलता रहता है। एक प्रणाली विषम है यदि इसमें भौतिक इंटरफेस द्वारा एक दूसरे से अलग किए गए कई भाग होते हैं, जिससे गुजरते समय गुण और संरचना अचानक बदल सकती है। भौतिक इंटरफ़ेस द्वारा शेष भागों से अलग किए गए सिस्टम के सजातीय भाग को चरण कहा जाता है। एक बंद बर्तन में, इसके ऊपर वाष्प के साथ एक विषम प्रणाली का एक उदाहरण तरल है। इस प्रणाली में दो भाग (चरण) होते हैं, जिसके बीच की सीमा से गुजरते समय, उदाहरण के लिए, घनत्व अचानक बदल जाता है।
एक प्रणाली के सभी भौतिक और रासायनिक गुणों की समग्रता इसकी स्थिति की विशेषता है। किसी भी गुण को बदलने से उसकी स्थिति में परिवर्तन होता है। हालांकि, सिस्टम के सभी गुण स्वतंत्र नहीं हैं। उनमें से कुछ को दूसरों के माध्यम से व्यक्त किया जा सकता है। उदाहरण के लिए, एक आदर्श गैस की अवस्था को उसके तीन गुणों द्वारा निर्दिष्ट किया जा सकता है: तापमान T, आयतन V और दबाव P। राज्य के प्रसिद्ध आदर्श गैस समीकरण के तीसरे को निर्धारित करने के लिए उनमें से दो को चुनना पर्याप्त है - मेंडेलीव-क्लैपेरॉन समीकरण:
जहाँ R सार्वत्रिक गैस स्थिरांक है (R = 8.314 J/(mol × K)), n गैस के मोलों की संख्या है।
हालांकि, अधिकांश वास्तविक प्रणालियों के लिए, राज्य f(P,V,T) = 0 के सामान्य समीकरण अज्ञात या बहुत जटिल हैं और पर्याप्त सटीक नहीं हैं, जो हमें व्यक्तिगत गुणों के विशेष संबंधों का उपयोग करने के लिए मजबूर करता है जबकि अन्य स्थिर रहते हैं।
आमतौर पर, स्वतंत्र चर वे माने जाते हैं जिनके मान, दी गई शर्तों के तहत, निर्धारित करना और बदलना आसान होता है। बहुत बार ये तापमान और दबाव होते हैं। मल्टीकंपोनेंट सिस्टम में, घटकों की सांद्रता उनमें जोड़ दी जाती है।
व्यापक गुण हैं, अर्थात्। पदार्थ की मात्रा, या प्रणाली के द्रव्यमान (उदाहरण के लिए, मात्रा), और गहन, द्रव्यमान पर निर्भर नहीं (उदाहरण के लिए, तापमान) के आधार पर। व्यापक गुणों से कई गहन गुण आसानी से प्राप्त हो जाते हैं। इस प्रकार, मोलर (या मोलर) आयतन V m, जो कि एक गहन गुण है, सिस्टम के कुल आयतन (व्यापक गुण) को उसके घटक पदार्थों के मोल्स की संख्या से विभाजित करके प्राप्त किया जा सकता है। घनत्व - किसी पदार्थ के इकाई आयतन का द्रव्यमान - भी एक गहन गुण है। ऊष्मप्रवैगिकी में, वे मुख्य रूप से दाढ़ गुणों के साथ काम करते हैं, क्योंकि संतुलन की स्थिति में उनके मूल्य पूरे सिस्टम और उसके किसी भी हिस्से के लिए समान होते हैं।
एक प्रणाली के स्वतंत्र गहन गुणों को कहा जाता है राज्य पैरामीटर. अन्य गुणों को इन मापदंडों के कार्यों के रूप में माना जाता है।
सिस्टम की किसी भी संपत्ति का मूल्य उन राज्यों पर निर्भर नहीं करता है जिनमें यह पहले था, यानी। थर्मोडायनामिक पथ पर निर्भर नहीं करता है जिसके द्वारा सिस्टम किसी दिए गए राज्य में आया था। कोई भी परिवर्तन जो प्रणाली में होता है, और उसके गुणों में परिवर्तन के साथ जुड़ा होता है, एक प्रक्रिया कहलाती है। इस प्रकार, संपत्ति परिवर्तन प्रक्रिया के पथ पर निर्भर नहीं करता है, लेकिन केवल सिस्टम के प्रारंभिक और अंतिम राज्यों द्वारा निर्धारित किया जाता है।पर
भविष्य में, हम ग्रीक अक्षर (उदाहरण के लिए, V ) का उपयोग किसी संपत्ति में एक परिमित परिवर्तन प्रदर्शित करने के लिए करेंगे, और लैटिन अक्षर d या (आंशिक डेरिवेटिव में) इस संपत्ति में एक असीम परिवर्तन प्रदर्शित करने के लिए।
वह प्रक्रिया जिसमें प्रणाली, प्रारंभिक अवस्था को छोड़कर, परिवर्तनों की एक श्रृंखला से गुजरकर, वापस आती है, वृत्ताकार कहलाती है। स्पष्ट है कि वृत्ताकार प्रक्रिया में निकाय के गुणों में परिवर्तन शून्य के बराबर होता है। स्थिर तापमान (T \u003d const) पर होने वाली प्रक्रियाओं को कहा जाता है इज़ोटेर्माल, स्थिर दबाव पर (P = const ) - समदाब रेखीय या समदाब रेखीयसिस्टम के स्थिर आयतन पर (V = const ) -
आइसोकोरिक या आइसोकोरिक. वे प्रक्रियाएँ जिनमें तंत्र और पर्यावरण के बीच ऊर्जा का आदान-प्रदान केवल कार्य के रूप में होता है, कहलाते हैं
रुद्धोष्म
एक प्रणाली की स्थिति जिसमें किसी भी बिंदु पर उसके सभी मापदंडों ने निरंतर मान लिया है और समय के साथ नहीं बदलता है, संतुलन कहलाता है। वह प्रक्रिया जिसके द्वारा एक प्रणाली संतुलन अवस्थाओं की एक श्रृंखला से गुजरती है, कहलाती है संतुलन प्रक्रिया. यह केवल एक असीम रूप से धीमी प्रक्रिया हो सकती है। इस मामले में "संतुलन" की अवधारणा "प्रतिवर्ती" की अवधारणा के साथ मेल खाती है। रिवर्सिबल एक ऐसी थर्मोडायनामिक प्रक्रिया है जो सिस्टम को पर्यावरण में कोई बदलाव छोड़े बिना अपनी मूल स्थिति में लौटने की अनुमति देती है। कोई भी संतुलन प्रक्रिया प्रतिवर्ती होती है और, इसके विपरीत, एक प्रतिवर्ती प्रक्रिया के दौरान, प्रणाली संतुलन अवस्थाओं की एक श्रृंखला से गुजरती है। लीक होने के बाद अपरिवर्तनीय प्रक्रियासिस्टम स्वतंत्र रूप से नहीं कर सकता, अर्थात। बाहरी प्रभाव के बिना, मूल स्थिति में लौट आएं। सभी वास्तविक, स्वचालित रूप से बहने वाली प्रक्रियाएं अपरिवर्तनीय हैं और केवल कुछ हद तक प्रतिवर्ती प्रक्रिया की अवधारणा तक पहुंच सकती हैं।
जैसा कि ऊपर उल्लेख किया गया है, एक थर्मोडायनामिक प्रणाली पर्यावरण के साथ दो रूपों में ऊर्जा का आदान-प्रदान कर सकती है: कार्य (मैक्रोफिजिकल फॉर्म) और हीट (माइक्रोफिजिकल फॉर्म)।
कार्य इस प्रकार की गति (ऊर्जा) के स्थानांतरण का एक मात्रात्मक माप है, जो परिमित द्रव्यमान को स्थानांतरित करके किया जाता है, अर्थात। किसी भी ताकत के प्रभाव में संपूर्ण या उसके भागों के रूप में प्रणाली।
ऊर्जा और कार्य के लिए सबसे अधिक उपयोग की जाने वाली इकाइयाँ, विशेष रूप से उष्मागतिकी में, SI जूल (J) और ऑफ-सिस्टम इकाई, कैलोरी (1) हैं।
कैल = 4.18 जे)।
काम के प्रदर्शन के साथ एक प्रक्रिया के एक उदाहरण के रूप में, पिस्टन के नीचे सिलेंडर में गैस के विस्तार पर विचार करें, जो दबाव पी (चित्रा 1) के अधीन है।
यदि पिस्टन के नीचे की गैस (बिना घर्षण के गतिमान) आयतन V 1 की अवस्था से आयतन V 2 की अवस्था तक फैलती है, तो यह बाहरी दबाव के विरुद्ध A कार्य करती है। बल F जिसके साथ गैस पिस्टन पर कार्य करती है
एफ = पीएस
जहाँ S बेलन का अनुप्रस्थ काट का क्षेत्रफल है। अतिसूक्ष्म कार्य ए उठाते समय किया गया
चित्र 1 - विस्तार के दौरान दाबित गैस द्वारा कार्य करना
पिस्टन ऊंचाई डीएच है
ए = एफ डीएच = पीएस डीएच,
δ ए = पी डीवी।
गैस के आयतन में परिमित परिवर्तन के लिए, परिणामी समीकरण को एकीकृत करते हुए, हम प्राप्त करते हैं:
ए = पीडीवी।
माना गया उदाहरण राज्य 1 से राज्य 2 (चित्र 2) में सिस्टम संक्रमण के दो अलग-अलग पथों (ए और बी) के लिए ग्राफिक रूप से चित्रित किया जा सकता है।
चित्र 2 - पथ a और पथ b के अनुदिश होने वाली प्रक्रियाओं में आयतन V 1 से आयतन V 2 तक फैली हुई गैस द्वारा किए गए कार्य की मात्रा में अंतर

चूंकि काम संख्यात्मक रूप से वक्र के नीचे के क्षेत्र के बराबर है, जो कि इंटीग्रैंड (पी) का ग्राफ है, यह स्पष्ट है कि ए ए ए बी, हालांकि दोनों मामलों में सिस्टम की प्रारंभिक और अंतिम स्थिति, साथ ही साथ परिवर्तन गुणों में (पी और वी), समान हैं।
इसलिए, कार्य प्रक्रिया के पथ पर निर्भर करता है, और इसलिए यह सिस्टम का गुण नहीं है। कार्य एक प्रक्रिया की विशेषता है। इसलिए, संपत्ति परिवर्तन के विपरीत (,घ और) काम और उसके असीम के लिएमात्रा पदनाम अपनाया गयाक्रमशः ए और δए।
यदि गैस एक स्थिर बाहरी दबाव (P = const ) पर फैलती है, तो, जैसा कि चित्र 3 में दिखाया गया है, कार्य की गणना प्रारंभिक अवस्था से सिस्टम के संक्रमण के परिणामस्वरूप आयतन में परिवर्तन से दबाव को गुणा करके की जाती है। अंतिम राज्य।
3 - में गैस विस्तार का कार्य |
||
समदाब रेखीय प्रक्रिया |
ए = पी (वी 2 - वी 1)
ऊष्मा इस प्रकार की गति (ऊर्जा) के स्थानांतरण का एक मात्रात्मक माप है, जो दो आसन्न पिंडों के अणुओं की अराजक टक्कर द्वारा किया जाता है।
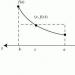
गर्मी, काम की तरह, सिस्टम की संपत्ति नहीं है, बल्कि प्रक्रिया की एक विशेषता है, और इसके पथ पर निर्भर करती है। इसलिए, सिस्टम में हीट रिजर्व के बारे में बात करना असंभव है। गर्मी पदनाम -क्यू या इसकी असीम रूप से छोटी राशि के लिए -क्यू . सिस्टम इसमें होने वाली प्रक्रियाओं के संबंध में गर्मी को अवशोषित और मुक्त दोनों कर सकता है। गर्मी का अवशोषण, इस मामले में सशर्त रूप से सकारात्मक माना जाता है ( Q > 0) में होता है एन्दोठेर्मिकप्रक्रियाएं। सिस्टम द्वारा गर्मी की रिहाई, माइनस साइन के साथ ध्यान में रखी जाती है (क्यू< 0), प्रवाह के साथ जुड़ेएक्ज़ोथिर्मिकप्रक्रियाएं (चित्र 4)। सिस्टम द्वारा किए गए कार्य को सकारात्मक माना जाता है (ए> 0)। बाहरी ताकतों की कार्रवाई के तहत सिस्टम पर किया गया कार्य नकारात्मक माना जाता है (ए< 0).
ए< 0 |
thermodynamic
क्यू > 0 |
|
एंडो थर्मल |
एक्सो थर्मल |
प्रक्रियाओं |
प्रक्रियाओं |
चित्र 4 - ऊष्मा और कार्य के लिए ऊष्मप्रवैगिकी में अपनाए गए संकेतों का नियम
ऊष्मप्रवैगिकी में सबसे महत्वपूर्ण मात्राओं में से एक है आंतरिक ऊर्जा(यू) प्रणाली का, जो इसकी संपत्ति है। यह सिस्टम के ऊर्जा भंडार की विशेषता है, जिसमें अणुओं के अनुवाद और घूर्णी गति की ऊर्जा, परमाणुओं की इंट्रामोल्युलर कंपन गति की ऊर्जा, इलेक्ट्रॉन गति की ऊर्जा और इंट्रान्यूक्लियर ऊर्जा शामिल है। आंतरिक ऊर्जा में पूरे सिस्टम की गतिज ऊर्जा और उसकी स्थिति की स्थितिज ऊर्जा शामिल नहीं होती है।
आंतरिक ऊर्जासिस्टम के तापमान और आयतन का एक कार्य है। लत
तापमान पर U आणविक गति की गतिज ऊर्जा की उस पर निर्भरता के कारण होता है। आंतरिक ऊर्जा के परिमाण पर सिस्टम द्वारा कब्जा किए गए आयतन का प्रभाव इस तथ्य के कारण है कि अणुओं की बातचीत की संभावित ऊर्जा उनके बीच की दूरी पर निर्भर करती है।
सिस्टम की आंतरिक ऊर्जा का निरपेक्ष मूल्य वर्तमान में गणना या मापा नहीं जा सकता है, क्योंकि इंट्रान्यूक्लियर ऊर्जा के मूल्य के बारे में कोई जानकारी नहीं है। हालांकि, विभिन्न प्रक्रियाओं में आंतरिक ऊर्जा में परिवर्तन की गणना करना संभव है:
यू = यू2 - यू1।
धारा 2. प्रक्रियाओं के ऊष्मीय प्रभावों की गणना के लिए ऊष्मागतिकी के पहले नियम का अनुप्रयोग
ऊष्मप्रवैगिकी का पहला नियम
यह नियम ऊष्मीय परिघटनाओं पर लागू होने वाले ऊर्जा संरक्षण के सामान्य नियम का एक विशेष मामला है। यह सैद्धांतिक रूप से सिद्ध नहीं है, बल्कि प्रायोगिक तथ्यों के सामान्यीकरण का परिणाम है। इसकी वैधता की पुष्टि इस तथ्य से होती है कि कानून का कोई भी परिणाम अनुभव का खंडन नहीं करता है। इसे निम्नानुसार तैयार किया गया है।
पहला नियम: किसी भी प्रक्रिया में, सिस्टम की आंतरिक ऊर्जा में वृद्धि सिस्टम को संचारित गर्मी की मात्रा के बराबर होती है जो सिस्टम द्वारा किए गए कार्य की मात्रा को घटा देती है।
ऊष्मागतिकी के प्रथम नियम का गणितीय अभिलेख व्यंजक है
यदि निकाय द्वारा किया गया कार्य केवल उसके विस्तार से जुड़ा है। सामान्य स्थिति में, जब कार्य न केवल बाहरी दबाव के विरुद्ध, बल्कि विद्युत, चुंबकीय और अन्य बलों के विरुद्ध भी किया जा सकता है, तो किसी को लिखना चाहिए
डु = δQ - पीडीवी - δA′ ,
जहां मूल्य A को "उपयोगी" कार्य कहा जाता है। हम आगे केवल A को ही ध्यान में रखेंगे जहाँ आवश्यक होगा।
विभिन्न प्रक्रियाओं के लिए पहला कानून लागू करने के उदाहरण
1 परिपत्र प्रक्रिया (यू = कास्ट)। जाहिर है, इस तरह की एक प्रक्रिया के परिणामस्वरूप, dU = 0, जिसका अर्थ है कि δQ = A, या Q = A। एक परिपत्र प्रक्रिया में, सिस्टम द्वारा सभी कार्य इसे गर्मी की आपूर्ति करके किया जाता है।
2 समतापी प्रक्रिया (टी = स्थिरांक)। व्युत्पत्ति को सरल बनाने के लिए, आइए हम एक आदर्श गैस में होने वाली प्रक्रिया के लिए समीकरण dU = Q T - PdV के अनुप्रयोग पर विचार करें। इस मामले में, सिस्टम की आंतरिक ऊर्जा मात्रा पर निर्भर नहीं करती है, इसलिए यू = एफ (टी)। एक स्थिर तापमान पर, dU = 0। इसलिए, सिस्टम को आपूर्ति की जाने वाली सारी गर्मी इसके द्वारा काम करने में खर्च होती है:
Q = A = पीडीवी।
राज्य PV = nRT के आदर्श गैस समीकरण को ध्यान में रखते हुए सभी कार्य बराबर हैं
ए = वी2 |
पीडीवी = वी 2 |
डीवी = एनआरटी लॉग |
|||||
आइसोकोरिक प्रक्रिया (वी = स्थिरांक)। चूँकि dV = 0, तब |
|||||||
डीयू = δक्यूवी - |
A = δQV - PdV = QV , |
||||||
या डीयू = δ क्यूवी। |
|||||||
सिस्टम को आपूर्ति की जाने वाली सभी गर्मी आंतरिक ऊर्जा को बढ़ाने के लिए जाती है: क्यू वी \u003d यू। |
|||||||
रुद्धोष्म प्रक्रिया (क्यू = 0)। समीकरण dU = Q - δA को dU = . के रूप में रूपांतरित किया जाता है |
|||||||
A, या δA = - dU। सिस्टम अपनी आंतरिक ऊर्जा के नुकसान के कारण काम करता है। |
|||||||
समदाब रेखीय प्रक्रिया (पी = स्थिरांक)। आइए हम पहले नियम dU = Q P - PdV . के समीकरण को निरूपित करें |
|||||||
क्यूपी = डीयू + पीडीवी, |
|||||||
जहां, अंतर के गुणों का उपयोग करके, हम निम्नलिखित परिवर्तन करते हैं:
δQP = dU + d (PV) = d (U + PV)।
कोष्ठक U + PV में मान को H अक्षर से प्रदर्शित किया जाता है और इसे निकाय की एन्थैल्पी कहते हैं। फिर
क्यूपी = डीएच; क्यू \u003d एच \u003d एच 2 - एच 1।
इस प्रकार, आइसोबैरिक प्रक्रिया में सिस्टम द्वारा प्राप्त गर्मी को एन्थैल्पी की वृद्धि पर खर्च किया जाता है। एन्थैल्पी सिस्टम की स्थिति का एक गुण या कार्य है, और इसका परिवर्तन प्रक्रिया के पथ पर निर्भर नहीं करता है, क्योंकि यू, पी और वी तीनों मात्राओं में परिवर्तन केवल सिस्टम की प्रारंभिक और अंतिम अवस्थाओं द्वारा निर्धारित किया जाता है। आंतरिक ऊर्जा की तरह, एन्थैल्पी का निरपेक्ष मान निर्धारित नहीं किया जा सकता है। प्रायोगिक आंकड़ों के आधार पर, विचाराधीन पदार्थ की एन्थैल्पी एच में केवल परिवर्तन तब निर्धारित किया जाता है जब बाहरी स्थितियां बदलती हैं या प्रक्रिया के आगे बढ़ने पर विचाराधीन प्रणाली का एच।
हम देखते हैं कि दो विशेष मामलों में, अर्थात्, जब वी = कॉन्स और पी = कॉन्स्ट, सिस्टम द्वारा प्राप्त गर्मी क्रमशः राज्य कार्यों के मूल्यों को बढ़ाने के लिए जाती है, यू



भौतिक रसायन विज्ञान के इतिहास में मील के पत्थर "भौतिक रसायन विज्ञान" शब्द एम.वी. लोमोनोसोव, जिन्होंने 1752 में पहली बार सेंट पीटर्सबर्ग विश्वविद्यालय के छात्रों को "भौतिक रसायन विज्ञान" पाठ्यक्रम दिया था। वह ट्रैक का मालिक है। परिभाषा: "भौतिक रसायन विज्ञान एक विज्ञान है जो भौतिकी के प्रावधानों और प्रयोगों के आधार पर बताता है कि रासायनिक संचालन के दौरान मिश्रित निकायों में क्या होता है।"

भौतिक रसायन विज्ञान के इतिहास में मील के पत्थर 1887 में, ओस्टवाल्ड को लीपज़िग विश्वविद्यालय में भौतिक रसायन विज्ञान का पहला प्रोफेसर नियुक्त किया गया था, जहां जैकब वैन'ट हॉफ, स्वंते अरहेनियस और वाल्टर नर्नस्ट ने उनके सहायकों और सहयोगियों के बीच काम किया था। उसी वर्ष, ओस्टवाल्ड ने "जर्नल ऑफ़ फिजिकल केमिस्ट्री" ("ज़ीट्सक्रिफ्ट फर फिजिकलिस्के केमी") की स्थापना की।

एक फार्मासिस्ट की गतिविधियाँ भौतिक रसायन विज्ञान या विश्लेषण के भौतिक-रासायनिक तरीकों के प्रासंगिक खंड औषधीय पदार्थों का औद्योगिक उत्पादन रासायनिक संतुलन, रासायनिक गतिकी और कटैलिसीस का सिद्धांत पौधे और पशु कच्चे माल से औषधीय पदार्थों का निष्कर्षण चरण संतुलन का सिद्धांत, (निष्कर्षण) , समाधान का सिद्धांत, प्रसार का सिद्धांत औषधीय उत्पादों और खुराक रूपों की तैयारी छितरी हुई प्रणालियों के गुण, चरण संतुलन, सतह की घटना, समाधान के गुण, आदि। औषधीय पदार्थों की भौतिक अनुकूलता का निर्धारण चरण और रासायनिक संतुलन, समाधान, थर्मल विश्लेषण पदार्थों में औषधीय पदार्थों का विश्लेषण, खुराक के रूप में, प्राकृतिक वस्तुओं में, अर्क में विश्लेषण के भौतिक और रासायनिक तरीके: ऑप्टिकल - स्पेक्ट्रोफोटोमेट्री, फोटोकलरिमेट्री, नेफेलोमेट्री, टर्बिडीमेट्री, आदि; इलेक्ट्रोकेमिकल - पोटेंशियोमेट्रिक, कंडक्टोमेट्रिक, एम्परोमेट्रिक अनुमापन, पोलरोग्राफी, आदि। क्रोमैटोग्राफिक - सोखना, विभाजन क्रोमैटोग्राफी, कॉलम, पतली-परत, कागज, इलेक्ट्रोफोरेटिक क्रोमैटोग्राफी, आदि। दवाओं के शेल्फ जीवन का निर्धारण और विस्तार कैनेटीक्स, कटैलिसीस, फोटोकैमिस्ट्री मानव शरीर में दवाओं को पेश करने के लिए एक विधि का चयन करना समाधान (ऑस्मोसिस, पारस्परिक) के बारे में शिक्षण पदार्थों की घुलनशीलता), चरण संतुलन (निष्कर्षण, वितरण, प्रसार) पर शिक्षण, एसिड-बेस कटैलिसीस, कैनेटीक्स, छितरी हुई प्रणालियों के गुण शरीर में औषधीय पदार्थों के व्यवहार का अध्ययन प्रसार, जैल के गुण, सर्फेक्टेंट और मैक्रोमोलेक्यूलर पदार्थों के गुण , कैनेटीक्स, समाधानों का अध्ययन, रासायनिक संतुलन का अध्ययन आदि।


थर्मोडायनामिक्स की बुनियादी अवधारणाएँ एक प्रणाली एक निर्दिष्ट चरण अवस्था में पदार्थों (घटकों) का एक समूह है जो एक सीमा सतह द्वारा पर्यावरण से बातचीत और अलग होती है। एक सजातीय प्रणाली को एक सजातीय प्रणाली कहा जाता है, जिसके अंदर भागों के बीच कोई इंटरफ़ेस नहीं होता है विभिन्न गुणों के साथ प्रणाली के शुष्क गैस मिश्रण) विषम एस। विभिन्न गुणों वाले भागों के बीच इंटरफेस है और दो या दो से अधिक चरणों से मिलकर बनता है।

थर्मोडायनामिक्स चरण की बुनियादी अवधारणाएं - एक प्रणाली के सभी सजातीय भागों का एक सेट, रासायनिक संरचना, संरचना और सभी गहन गुणों में समान और एक इंटरफ़ेस घटक द्वारा अन्य भागों से अलग - एक स्वतंत्र रूप से मौजूदा रासायनिक यौगिक जो चरण का हिस्सा है ओपन सिस्टम बंद प्रणाली पृथक प्रणाली

ऊष्मप्रवैगिकी की मूल अवधारणाएँ व्यापक गुण पदार्थ की मात्रा (आयतन, ऊष्मा क्षमता, एन्ट्रापी) पर निर्भर करते हैं गहन गुण पदार्थ की मात्रा (घनत्व, तापमान) पर निर्भर नहीं करते हैं राज्य के कार्य ऐसे गुण होते हैं जो प्रारंभिक और अंतिम अवस्था पर निर्भर करते हैं और नहीं संक्रमण पथ पर निर्भर करता है।

थर्मोडायनामिक्स की बुनियादी अवधारणाएं आंतरिक ऊर्जा (यू) राज्य का एक कार्य है जो सिस्टम के कुल ऊर्जा आरक्षित की विशेषता है कार्य (डब्ल्यू) ऊर्जा हस्तांतरण का एक मैक्रोस्कोपिक रूप है (कणों की निर्देशित गति की गतिज ऊर्जा के रूप में) गर्मी (क्यू) ) आणविक टक्कर (हीट एक्सचेंज) द्वारा ऊर्जा हस्तांतरण है। ऊर्जा हस्तांतरण का सूक्ष्म (अव्यवस्थित) रूप। गर्मी और काम प्रक्रिया के कार्य हैं!


थर्मोडायनामिक्स का शून्य नियम 1931 फाउलर यदि सिस्टम "ए" और "बी" सिस्टम "सी" के साथ थर्मल संतुलन में हैं, तो यह कहना संभव है कि "ए" और "बी" थर्मल संतुलन में हैं, अन्य यह एक दूसरे के साथ झूठ है तापमान माप के आधार पर



थर्मोडायनामिक्स की पहली उत्पत्ति (ऊर्जा के संरक्षण का कानून) यदि सिस्टम काम नहीं करता है, तो आंतरिक ऊर्जा में कोई भी परिवर्तन गर्मी के अवशोषण या रिलीज के कारण ही होता है, यानी। डब्ल्यू = 0 यू = क्यू . पर क्यू = 0 यू = डब्ल्यू या डब्ल्यू = यू पर - यह इस प्रकार है कि एक सतत गति मशीन (तंत्र) बनाना असंभव है जो बाहर से ऊर्जा के प्रवाह के बिना अनिश्चित काल तक काम करता है




थर्मोकैमिस्ट्री (मूल अवधारणाएं) गठन की गर्मी एच एफ (गठन से - गठन) दहन की गर्मी एच सी (दहन से - दहन) मानक स्थितियां (1 एटीएम = पा), 298 के (25 डिग्री सेल्सियस) यदि थर्मोकेमिकल या थर्मोडायनामिक मान है मानक स्थिति के लिए दिया गया है, तो इसे "ओ" चिह्न के साथ चिह्नित किया गया है: एच के बारे में एफ; एच ओ एस; यू के बारे में




हेस के नियम का दूसरा परिणाम यदि दो प्रतिक्रियाएँ होती हैं, जो विभिन्न प्रारंभिक अवस्थाओं से एक ही अंतिम अवस्था तक जाती हैं, तो उनके तापीय प्रभावों के बीच का अंतर एक प्रारंभिक अवस्था से दूसरी प्रारंभिक अवस्था में संक्रमण की प्रतिक्रिया के ऊष्मीय प्रभाव के बराबर होता है С (जीआर) ) + 2 \u003d CO 2 393.51 k J / mol C (alm) + O 2 \u003d CO 2 395.39 k J / mol

हेस के नियम का तीसरा परिणाम यदि दो प्रतिक्रियाएं होती हैं, जो एक ही प्रारंभिक अवस्था से अलग-अलग अंतिम अवस्था तक जाती हैं, तो उनके तापीय प्रभावों के बीच का अंतर एक अंतिम अवस्था से दूसरी अंतिम अवस्था में संक्रमण की प्रतिक्रिया के ऊष्मीय प्रभाव के बराबर होता है। (जी) + ओ 2 सीओ 2 393.505 के जे / मोल सीओ + 1/2 ओ 2 सीओ 2 282.964 के जे / मोल सी (जी) + 1/2 ओ 2 सीओ + एच आर एच आर \u003d 393.505 (282.964) \ u003d 110.541 के जे / मोल।









थर्मोडायनामिक्स की दूसरी उत्पत्ति गर्मी को एक ठंडे शरीर से एक गर्म शरीर में स्वचालित रूप से स्थानांतरित नहीं किया जा सकता है एक विभिन्न प्रकार की ऊर्जा गर्मी में परिवर्तित हो जाती है, और गर्मी समाप्त हो जाती है हालांकि, एक प्रणाली के घटकों के बीच ऊर्जा के अपव्यय की गणना की जा सकती है सांख्यिकीय ऊष्मप्रवैगिकी के तरीके




निरपेक्ष शून्य तापमान पर एक पूरी तरह से व्यवस्थित क्रिस्टल के लिए थर्मोडायनामिक्स की तीसरी उत्पत्ति, जब कणों की कोई थर्मल गति नहीं होती है, तो थर्मोडायनामिक संभावना डब्ल्यू 1 के बराबर होती है। इसलिए, बोल्ट्जमैन समीकरण के अनुसार, इसकी एन्ट्रॉपी शून्य के बराबर है: एस 0 = के एलएन 1 = 0











- -

रासायनिक संतुलन 1. संतुलन का थर्मोडायनामिक संकेत (गिब्स और हेल्महोल्ट्ज ऊर्जा नहीं बदलते हैं) 2. संतुलन का गतिज संकेत (प्रत्यक्ष और रिवर्स प्रतिक्रियाओं की दरें समान हैं) कार्य: पदार्थों के संतुलन मिश्रण की संरचना का अनुकूलन; रासायनिक प्रतिक्रिया उत्पादों की संतुलन उपज की गणना






ले चेटेलियर का सिद्धांत यदि कोई प्रणाली संतुलन की स्थिति में है, तो उस पर संतुलन पैदा करने वाली ताकतों की कार्रवाई के तहत, सिस्टम एक ऐसी स्थिति में जाता है जिसमें बाहरी बल का प्रभाव प्रणाली की संरचना को कमजोर करता है।

रासायनिक प्रतिक्रिया इज़ोटेर्म समीकरण जैकब वैन'ट हॉफ () (फ्रेडरिक केकुले के छात्र) "शानदार गैर-बकवास!" एडॉल्फ कोल्बे "रुको और देखो ..."



बुनियादी अवधारणा चरण - प्रणाली के सभी सजातीय भागों का एक सेट, रासायनिक संरचना, संरचना और सभी गहन गुणों में समान और एक इंटरफ़ेस घटक द्वारा अन्य भागों से अलग - एक स्वतंत्र रूप से मौजूदा रासायनिक यौगिक जो चरण इंटरफ़ेस (इंटरफ़ेस) का हिस्सा है।


GIBBS का चरण नियम C = 0 - प्रणाली को अपरिवर्तनीय कहा जाता है; किसी भी राज्य पैरामीटर में बदलाव से चरणों की संख्या में बदलाव होता है। सी = 1 - प्रणाली को मोनोवेरिएंट कहा जाता है; चरणों की संख्या को बदले बिना केवल एक पैरामीटर को बदला जा सकता है। = 2 - प्रणाली को द्विचर कहा जाता है।



चरण क्षेत्रों के लिए = + 2 = = 2 संतुलन रेखाओं के लिए С = + 2 = = 1 त्रिगुण बिंदु के लिए = + 2 = = 0

समाधान 1. थर्मोडायनामिक रूप से स्थिर सजातीय आणविक-फैलाव प्रणाली 2. चर या विषम संरचना की एकल-चरण प्रणाली, जिसमें दो या दो से अधिक घटक होते हैं। एक नियम के रूप में, एक विलायक और एक विलेय पृथक होते हैं। मुख्य प्रकार गैर-इलेक्ट्रोलाइट समाधान और इलेक्ट्रोलाइट समाधान हैं।





 कोनोवलोव का पहला नियम तरल तब उबलता है जब उनके ऊपर वाष्प का दबाव वायुमंडलीय दबाव के बराबर हो जाता है। शुद्ध तरल पदार्थ एक स्थिर तापमान पर उबालते हैं (टी किप) समाधान में, यह अलग है: एक संतुलन समाधान की तुलना में संतृप्त वाष्प, उस घटक में अपेक्षाकृत अधिक समृद्ध होता है, जिसके अतिरिक्त सिस्टम में कुल वाष्प दबाव बढ़ जाता है। एक संतुलन बाइनरी सिस्टम में वाष्प एक तरल की तुलना में कम उबलते घटक के साथ समृद्ध होता है।
कोनोवलोव का पहला नियम तरल तब उबलता है जब उनके ऊपर वाष्प का दबाव वायुमंडलीय दबाव के बराबर हो जाता है। शुद्ध तरल पदार्थ एक स्थिर तापमान पर उबालते हैं (टी किप) समाधान में, यह अलग है: एक संतुलन समाधान की तुलना में संतृप्त वाष्प, उस घटक में अपेक्षाकृत अधिक समृद्ध होता है, जिसके अतिरिक्त सिस्टम में कुल वाष्प दबाव बढ़ जाता है। एक संतुलन बाइनरी सिस्टम में वाष्प एक तरल की तुलना में कम उबलते घटक के साथ समृद्ध होता है।
 उबलते आरेख पर कोनोवलोव का दूसरा नियम एक्स्ट्रेमा समाधान और संतृप्त वाष्प के ऐसे संतुलन के अनुरूप है, जिसमें दोनों चरणों की रचनाएं समान हैं। एज़ोट्रोपिक समाधान ऐसे समाधान हैं जो घटकों के एक निश्चित अनुपात में समान वाष्प संरचना रखते हैं द्रव का संघटन (अर्थात मिश्रण एक शुद्ध पदार्थ की तरह व्यवहार करता है)।
उबलते आरेख पर कोनोवलोव का दूसरा नियम एक्स्ट्रेमा समाधान और संतृप्त वाष्प के ऐसे संतुलन के अनुरूप है, जिसमें दोनों चरणों की रचनाएं समान हैं। एज़ोट्रोपिक समाधान ऐसे समाधान हैं जो घटकों के एक निश्चित अनुपात में समान वाष्प संरचना रखते हैं द्रव का संघटन (अर्थात मिश्रण एक शुद्ध पदार्थ की तरह व्यवहार करता है)।



अलग-अलग स्लाइड्स पर प्रस्तुतीकरण का विवरण:
1 स्लाइड
स्लाइड का विवरण:
2 स्लाइड
स्लाइड का विवरण:
3 स्लाइड
स्लाइड का विवरण:
गैस एक पदार्थ के एकत्रीकरण की स्थिति है जिसमें अणु एक दूसरे से काफी दूरी पर स्थित, बेतरतीब ढंग से चलते हैं। ठोस पदार्थों में, कणों के बीच की दूरी कम होती है, आकर्षण बल प्रतिकर्षण बल के अनुरूप होता है। तरल ठोस और गैसीय के बीच एकत्रीकरण की एक अवस्था है। एक तरल में, कण एक दूसरे के करीब होते हैं और एक दूसरे के सापेक्ष गति कर सकते हैं; गैस की तरह द्रव का कोई निश्चित आकार नहीं होता है। प्लाज्मा एक अत्यंत दुर्लभ गैस है जिसमें अनियमित रूप से गतिमान विद्युत आवेशित कण इलेक्ट्रॉन और परमाणुओं या आयनों के धनात्मक आवेशित नाभिक होते हैं।)
4 स्लाइड
स्लाइड का विवरण:
एक ही पदार्थ की कुल अवस्थाएं रासायनिक गुणों और संरचना में भिन्न नहीं होती हैं, और उनके भौतिक गुण समान नहीं होते हैं। एक उदाहरण H2O (पानी) है। भौतिक गुणों में अंतर इस तथ्य के कारण है कि गैसीय, तरल और ठोस पदार्थों में कण एक दूसरे से असमान दूरी पर स्थित होते हैं, जिसके कारण उनके बीच अभिनय करने वाली आकर्षण शक्तियाँ असमान रूप से प्रकट होती हैं।
5 स्लाइड
स्लाइड का विवरण:
एमकेटी के मूल प्रावधान सभी पदार्थ - तरल, ठोस और गैसीय - सबसे छोटे कणों - अणुओं से बनते हैं, जो स्वयं परमाणुओं ("प्राथमिक अणु") से मिलकर बने होते हैं। किसी रासायनिक पदार्थ के अणु सरल या जटिल हो सकते हैं और इनमें एक या अधिक परमाणु होते हैं। अणु और परमाणु विद्युत रूप से तटस्थ कण हैं। कुछ शर्तों के तहत, अणु और परमाणु एक अतिरिक्त विद्युत आवेश प्राप्त कर सकते हैं और सकारात्मक या नकारात्मक आयनों में बदल सकते हैं। परमाणु और अणु निरंतर अराजक गति में हैं। कण एक दूसरे के साथ उन बलों द्वारा परस्पर क्रिया करते हैं जो प्रकृति में विद्युत हैं। कणों के बीच गुरुत्वाकर्षण संपर्क नगण्य है।
6 स्लाइड
स्लाइड का विवरण:
1. समग्र अवस्थाओं का सिद्धांत 1.1 प्रस्तावना चरण संक्रमण - किसी पदार्थ का एक समग्र राज्य से दूसरे राज्य में संक्रमण - संघनित टी-एल पिघलने एल-टी जमना (ठंड) चरण संक्रमण गर्मी के अवशोषण या रिलीज के साथ होते हैं
7 स्लाइड
स्लाइड का विवरण:
1. कुल राज्यों का सिद्धांत 1.2। गैसीय पदार्थ की अवस्था गैस पदार्थ के एकत्रीकरण की अवस्था है जिसमें इसके घटक कण (परमाणु, अणु, आयन) परस्पर क्रिया बलों द्वारा बंधे या बहुत कमजोर रूप से बंधे नहीं होते हैं, स्वतंत्र रूप से चलते हैं, उन्हें प्रदान की गई पूरी मात्रा को भरते हैं। गैसों की मुख्य विशेषताएं: उनका घनत्व कम होता है, क्योंकि कण बहुत दूर हैं और उनका न तो अपना आकार है और न ही अपना आयतन; वे उस बर्तन को पूरी तरह से भर देते हैं जिसमें वे स्थित होते हैं, और उसका रूप ले लेते हैं और आसानी से संकुचित हो जाते हैं।
8 स्लाइड
स्लाइड का विवरण:
राज्य का आदर्श गैस समीकरण एक आदर्श गैस एक सैद्धांतिक गैस मॉडल है जिसमें गैस कणों के आकार और परस्पर क्रिया की उपेक्षा की जाती है और केवल उनके लोचदार टकराव को ध्यान में रखा जाता है। आदर्श गैस एक गैस है जिसमें अणुओं के बीच आकर्षण बल नहीं होते हैं .
9 स्लाइड
स्लाइड का विवरण:
गैस के कणों (परमाणुओं, अणुओं, आयनों) को भौतिक बिंदुओं के रूप में लिया जाता है (अर्थात, उनका कोई आयतन नहीं होता है) कणों के बीच पारस्परिक आकर्षण बल नहीं होते हैं (अंतर-आणविक बल) अणुओं के बीच परस्पर क्रिया बिल्कुल लोचदार प्रभावों (यानी प्रभावों में कम हो जाती है) गतिज ऊर्जा पूरी तरह से एक वस्तु से दूसरी वस्तु में स्थानांतरित हो जाती है) गैस कणों (परमाणुओं, अणुओं, आयनों) में एक आयतन होता है गैस के कण परस्पर क्रिया बलों द्वारा परस्पर जुड़े होते हैं जो कणों के बीच बढ़ती दूरी के साथ घटते हैं अणुओं के बीच टकराव बिल्कुल लोचदार नहीं होते हैं आदर्श गैस वास्तविक गैस 1. कुल राज्यों का सिद्धांत 1.2। पदार्थ की गैसीय अवस्था एक वास्तविक गैस प्रबल विरलन और सामान्य तापमान पर एक आदर्श गैस के समान होती है
10 स्लाइड
स्लाइड का विवरण:
एक आदर्श गैस की स्थिति का समीकरण (मेंडेलीव-क्लैपेरॉन समीकरण) एक ऐसा संबंध है जो दबाव, आयतन और तापमान के मूल्यों से संबंधित है: जहां n गैस के मोल की संख्या है, R = 8.31431 J / mol। K) - गैस स्थिरांक इस नियम का पालन करने वाली गैस, आदर्श कहलाती है। गैस कानून
11 स्लाइड
स्लाइड का विवरण:
गैस के नियम स्थिर तापमान और द्रव्यमान पर, गैस का आयतन उसके दबाव के व्युत्क्रमानुपाती होता है स्थिर दबाव पर गैस के दिए गए द्रव्यमान का आयतन निरपेक्ष तापमान के समानुपाती होता है स्थिर आयतन पर गैस के दिए गए द्रव्यमान का दबाव सीधे होता है बोल्ट्जमान स्थिरांक के निरपेक्ष तापमान के समानुपाती: k=R/NA=1.38 10-23 J/K
12 स्लाइड
स्लाइड का विवरण:
आदर्श गैसों का दाढ़ आयतन समान होता है। एन पर वाई = 22.4140 dm3 (l) अन्य तापमानों और दबावों पर, यह मान भिन्न होगा! गैस कानून
13 स्लाइड
स्लाइड का विवरण:
वे आदर्श गैसों के नियमों का पालन नहीं करते हैं। विचलन के मुख्य कारण गैस के अणुओं का पारस्परिक आकर्षण और उनके स्वयं के आयतन की उपस्थिति हैं। दाढ़ की मात्रा विचलन की विशेषता के रूप में काम कर सकती है वास्तविक गैसें
14 स्लाइड
स्लाइड का विवरण:
वास्तविक गैसें वास्तविक गैसें मेंडलीफ-क्लैपेरॉन समीकरण का पालन नहीं करती हैं। n मोल a के लिए एक मोल के लिए एक वास्तविक गैस (वैन डेर वाल्स समीकरण) की स्थिति का समीकरण - इंटरमॉलिक्युलर इंटरैक्शन को ध्यान में रखता है; बी - अणुओं की आंतरिक मात्रा को ध्यान में रखता है। विभिन्न गैसों के गुणांक a और b भिन्न हैं, इसलिए वैन डेर वाल्स समीकरण सार्वभौमिक नहीं है। कम दबाव और उच्च तापमान पर, वैन डेर वाल्स समीकरण एक आदर्श गैस के लिए राज्य का समीकरण बन जाता है।
15 स्लाइड
स्लाइड का विवरण:
एक तरल की मुख्य संपत्ति, जो इसे एकत्रीकरण के अन्य राज्यों से अलग करती है, व्यावहारिक रूप से मात्रा बनाए रखते हुए, स्पर्शरेखा यांत्रिक तनावों की कार्रवाई के तहत अनिश्चित काल तक अपने आकार को बदलने की क्षमता है, यहां तक कि मनमाने ढंग से छोटे भी। तरल अवस्था को आमतौर पर एक ठोस और गैस के बीच मध्यवर्ती माना जाता है: एक गैस न तो मात्रा और न ही आकार को बरकरार रखती है, जबकि एक ठोस दोनों को बरकरार रखता है। द्रव्य की द्रव अवस्था
16 स्लाइड
स्लाइड का विवरण:
अणुओं की कंपन-अनुवादात्मक गति, आंतरिक दबाव के कारण असम्पीडितता, संघ (ध्रुवीय अणुओं के मामले में), लंबी दूरी के क्रम के अभाव में शॉर्ट-रेंज ऑर्डर की उपस्थिति, सतह तनाव, चिपचिपाहट। तरल पदार्थ के गुण:
17 स्लाइड
इसी तरह के दस्तावेज़
रासायनिक प्रतिक्रिया की दर पर तापमान का प्रभाव। द्विपक्षीय और एकतरफा प्रतिक्रियाएं, उनकी आणविकता, क्रम, गतिज वर्गीकरण। सक्रिय टकराव का सिद्धांत। श्रृंखला प्रतिक्रियाएं, थर्मल विस्फोट। फोटोकैमिकल प्रक्रियाओं के प्रकार, क्वांटम उपज।
व्याख्यान का पाठ्यक्रम, जोड़ा गया 12/10/2015
विषय और वस्तु के लक्षण, भौतिक और कोलाइडल रसायन विज्ञान के लक्ष्य और उद्देश्य। ऊष्मप्रवैगिकी की मूल अवधारणाओं का विवरण। रासायनिक गतिकी: रासायनिक प्रतिक्रिया दर, अरहेनियस समीकरण, उत्प्रेरक प्रक्रियाएं, सजातीय कटैलिसीस और ऑटोकैटलिसिस।
ट्यूटोरियल, जोड़ा गया 05/02/2014
रासायनिक ऊष्मप्रवैगिकी की समस्याएं। चरण संतुलन और समाधान। इलेक्ट्रोलाइट्स का थर्मोडायनामिक और इलेक्ट्रोस्टैटिक सिद्धांत। रासायनिक प्रतिक्रियाओं के कैनेटीक्स। ऊर्जा के रासायनिक और विद्युत रासायनिक रूपों के पारस्परिक परिवर्तन से जुड़े पैटर्न।
मैनुअल, जोड़ा गया 11/21/2016
कटैलिसीस उत्प्रेरक नामक पदार्थों की उपस्थिति में रासायनिक प्रतिक्रियाओं की दर को बदलने की प्रक्रिया है। औद्योगिक उत्प्रेरण और पारिस्थितिकी में इसकी भूमिका के बारे में जानकारी। ऊर्जा अवरोध, सजातीय और विषम उत्प्रेरण से गुजरना।
सार, जोड़ा गया 07.11.2009
एक रासायनिक प्रतिक्रिया की दर। सजातीय और विषम प्रतिक्रियाएं। सक्रिय जनता का कानून। सक्रियण ऊर्जा। उत्प्रेरक का प्रभाव। रासायनिक संतुलन स्थिरांक। ले चेटेलियर के सिद्धांत का सार। रासायनिक गतिकी में आणविकता और प्रतिक्रिया क्रम की अवधारणा।
प्रस्तुति, जोड़ा गया 04/23/2013
रासायनिक गतिकी की अवधारणा। अभिकारकों की सांद्रता, सूक्ष्मता, तापमान और उत्प्रेरक या अवरोधक की उपस्थिति जैसे कारक। "प्रतिक्रिया की आणविकता" अवधारणा की परिभाषा। उत्प्रेरक का सार और रासायनिक प्रतिक्रियाओं में इसकी क्रिया।
मैनुअल, जोड़ा गया 04/27/2016
स्थिर थर्मोडायनामिक संतुलन में एक भौतिक रासायनिक प्रणाली के विषम संतुलन के नियम का अध्ययन। बहु-घटक तरल पदार्थों की समीक्षा। कैनेटीक्स और कटैलिसीस का विश्लेषण। किसी पदार्थ की सांद्रता और रासायनिक प्रतिक्रियाओं के वर्गीकरण पर निबंध।
प्रस्तुति, जोड़ा गया 09/29/2013
रासायनिक प्रतिक्रियाओं के सार, संकेत और शर्तों का विश्लेषण। विभिन्न मानदंडों के अनुसार रासायनिक प्रतिक्रियाओं का वर्गीकरण। रासायनिक प्रतिक्रिया की दर का निर्धारण। उत्प्रेरक की अवधारणा की परिभाषा, साथ ही रासायनिक प्रतिक्रिया की दर पर इसके प्रभाव का विवरण।
सार, जोड़ा गया 06/28/2017
रासायनिक गतिकी की अवधारणा, रासायनिक प्रतिक्रिया की दर। रासायनिक गतिकी का मूल नियम। रासायनिक प्रतिक्रियाओं की दर पर तापमान का प्रभाव। कटैलिसीस की अवधारणा और सार, उत्प्रेरक का सिद्धांत। रासायनिक संतुलन की गणितीय स्थिति।
मैनुअल, जोड़ा गया 09/18/2015
पदार्थों की सांद्रता, दबाव, अभिकर्मकों की संपर्क सतह, रासायनिक प्रतिक्रिया की दर पर तापमान का प्रभाव। सक्रिय जनता का कानून। कटैलिसीस की अवधारणा एक प्रतिक्रिया की सक्रियता ऊर्जा में कमी है, और निषेध इसकी सक्रियण ऊर्जा में वृद्धि है।
डी. एक्स. एन। , प्रोफेसर, भौतिक रसायन विभाग के प्रमुख, रूसी रासायनिक तकनीकी विश्वविद्यालय के नाम पर। डी. आई. मेंडेलीवा कोन्यूखोव वालेरी युरीविच [ईमेल संरक्षित]आरयू vkontakte. एन
 साहित्य विश्नाकोव ए.वी., किज़िम एन.एफ. भौतिक रसायन। मॉस्को: केमिस्ट्री, 2012 फिजिकल केमिस्ट्री // एड। के एस क्रास्नोवा। एम.: हायर स्कूल, 2001 स्ट्रोमबर्ग ए.जी., सेमचेंको डी.पी. फिजिकल केमिस्ट्री। एम।: हायर स्कूल, 1999। भौतिक रसायन विज्ञान के मूल सिद्धांत। सिद्धांत और कार्य: प्रोक। विश्वविद्यालयों के लिए भत्ता / वी. वी. एरेमिन एट अल. एम.: 2005.
साहित्य विश्नाकोव ए.वी., किज़िम एन.एफ. भौतिक रसायन। मॉस्को: केमिस्ट्री, 2012 फिजिकल केमिस्ट्री // एड। के एस क्रास्नोवा। एम.: हायर स्कूल, 2001 स्ट्रोमबर्ग ए.जी., सेमचेंको डी.पी. फिजिकल केमिस्ट्री। एम।: हायर स्कूल, 1999। भौतिक रसायन विज्ञान के मूल सिद्धांत। सिद्धांत और कार्य: प्रोक। विश्वविद्यालयों के लिए भत्ता / वी. वी. एरेमिन एट अल. एम.: 2005.
 साहित्य एटकिंस पी। भौतिक रसायन। एम.: मीर. 1980. करापेटियंट्स एम.के.एच. रासायनिक ऊष्मप्रवैगिकी। मॉस्को: रसायन विज्ञान, 1975।
साहित्य एटकिंस पी। भौतिक रसायन। एम.: मीर. 1980. करापेटियंट्स एम.के.एच. रासायनिक ऊष्मप्रवैगिकी। मॉस्को: रसायन विज्ञान, 1975।



 LOMONOSOV मिखाइल वासिलीविच (1711-65), विश्व महत्व के पहले रूसी प्राकृतिक वैज्ञानिक, एक कवि जिन्होंने आधुनिक रूसी साहित्यिक भाषा की नींव रखी, एक कलाकार, एक इतिहासकार, राष्ट्रीय शिक्षा, विज्ञान और अर्थशास्त्र के विकास के पैरोकार। 8 नवंबर (19) को एक पोमोर परिवार में डेनिसोव्का (अब लोमोनोसोवो का गाँव) गाँव में जन्मे। 19 साल की उम्र में उन्होंने अध्ययन करना छोड़ दिया (1731 से मॉस्को में स्लाव-ग्रीक-लैटिन अकादमी में, 1735 से सेंट पीटर्सबर्ग में अकादमिक विश्वविद्यालय में, जर्मनी में 1736-41 में)। 1742 से, सेंट पीटर्सबर्ग एकेडमी ऑफ साइंसेज के 1745 शिक्षाविद से।
LOMONOSOV मिखाइल वासिलीविच (1711-65), विश्व महत्व के पहले रूसी प्राकृतिक वैज्ञानिक, एक कवि जिन्होंने आधुनिक रूसी साहित्यिक भाषा की नींव रखी, एक कलाकार, एक इतिहासकार, राष्ट्रीय शिक्षा, विज्ञान और अर्थशास्त्र के विकास के पैरोकार। 8 नवंबर (19) को एक पोमोर परिवार में डेनिसोव्का (अब लोमोनोसोवो का गाँव) गाँव में जन्मे। 19 साल की उम्र में उन्होंने अध्ययन करना छोड़ दिया (1731 से मॉस्को में स्लाव-ग्रीक-लैटिन अकादमी में, 1735 से सेंट पीटर्सबर्ग में अकादमिक विश्वविद्यालय में, जर्मनी में 1736-41 में)। 1742 से, सेंट पीटर्सबर्ग एकेडमी ऑफ साइंसेज के 1745 शिक्षाविद से।
 1748 में उन्होंने विज्ञान अकादमी में रूस में पहली रासायनिक प्रयोगशाला की स्थापना की। लोमोनोसोव की पहल पर, मॉस्को विश्वविद्यालय की स्थापना (1755) हुई थी। उन्होंने पदार्थ की संरचना के बारे में परमाणु और आणविक विचार विकसित किए। कैलोरी के सिद्धांत के प्रभुत्व के दौरान, उन्होंने तर्क दिया कि गर्मी कणिकाओं की गति के कारण होती है। उन्होंने पदार्थ और गति के संरक्षण का सिद्धांत तैयार किया। फ्लॉजिस्टन को रासायनिक एजेंटों की संख्या से बाहर रखा गया है। भौतिक रसायन विज्ञान की नींव रखी।
1748 में उन्होंने विज्ञान अकादमी में रूस में पहली रासायनिक प्रयोगशाला की स्थापना की। लोमोनोसोव की पहल पर, मॉस्को विश्वविद्यालय की स्थापना (1755) हुई थी। उन्होंने पदार्थ की संरचना के बारे में परमाणु और आणविक विचार विकसित किए। कैलोरी के सिद्धांत के प्रभुत्व के दौरान, उन्होंने तर्क दिया कि गर्मी कणिकाओं की गति के कारण होती है। उन्होंने पदार्थ और गति के संरक्षण का सिद्धांत तैयार किया। फ्लॉजिस्टन को रासायनिक एजेंटों की संख्या से बाहर रखा गया है। भौतिक रसायन विज्ञान की नींव रखी।
 वायुमंडलीय बिजली और गुरुत्वाकर्षण की जांच की। रंग के सिद्धांत का प्रस्ताव रखा। कई ऑप्टिकल उपकरणों का निर्माण किया। शुक्र ग्रह पर वातावरण की खोज की। पृथ्वी की संरचना का वर्णन किया, कई खनिजों और खनिजों की उत्पत्ति की व्याख्या की। धातु विज्ञान के लिए एक गाइड प्रकाशित किया। उन्होंने साइबेरिया के विकास, उत्तरी समुद्री मार्ग की खोज के महत्व पर जोर दिया। उन्होंने मोज़ाइक की कला और स्माल्ट के उत्पादन को पुनर्जीवित किया, अपने छात्रों के साथ मोज़ेक पेंटिंग बनाई। कला अकादमी के सदस्य (1763)। उन्हें 18 वीं शताब्दी के नेक्रोपोलिस में सेंट पीटर्सबर्ग में दफनाया गया था।
वायुमंडलीय बिजली और गुरुत्वाकर्षण की जांच की। रंग के सिद्धांत का प्रस्ताव रखा। कई ऑप्टिकल उपकरणों का निर्माण किया। शुक्र ग्रह पर वातावरण की खोज की। पृथ्वी की संरचना का वर्णन किया, कई खनिजों और खनिजों की उत्पत्ति की व्याख्या की। धातु विज्ञान के लिए एक गाइड प्रकाशित किया। उन्होंने साइबेरिया के विकास, उत्तरी समुद्री मार्ग की खोज के महत्व पर जोर दिया। उन्होंने मोज़ाइक की कला और स्माल्ट के उत्पादन को पुनर्जीवित किया, अपने छात्रों के साथ मोज़ेक पेंटिंग बनाई। कला अकादमी के सदस्य (1763)। उन्हें 18 वीं शताब्दी के नेक्रोपोलिस में सेंट पीटर्सबर्ग में दफनाया गया था।
 लोमोनोसोव की परिभाषा: "भौतिक रसायन विज्ञान एक विज्ञान है जो भौतिकी के प्रावधानों और प्रयोगों के आधार पर अध्ययन करता है कि रासायनिक संचालन के दौरान जटिल निकायों में क्या होता है .... भौतिक रसायन विज्ञान को रासायनिक दर्शन कहा जा सकता है।
लोमोनोसोव की परिभाषा: "भौतिक रसायन विज्ञान एक विज्ञान है जो भौतिकी के प्रावधानों और प्रयोगों के आधार पर अध्ययन करता है कि रासायनिक संचालन के दौरान जटिल निकायों में क्या होता है .... भौतिक रसायन विज्ञान को रासायनिक दर्शन कहा जा सकता है।

 पश्चिमी यूरोप में, 1888 को भौतिक रसायन विज्ञान के निर्माण के वर्ष पर विचार करने की प्रथा है, जब डब्ल्यू। ओस्टवाल्ड ने व्यावहारिक अभ्यास के साथ इस पाठ्यक्रम को पढ़ना शुरू किया, और पत्रिका Zeitschtift fur physikalische Chemie प्रकाशित करना शुरू किया। उसी वर्ष, डब्ल्यू ओस्टवाल्ड के नेतृत्व में लीपज़िग विश्वविद्यालय में भौतिक रसायन विज्ञान विभाग का आयोजन किया गया था।
पश्चिमी यूरोप में, 1888 को भौतिक रसायन विज्ञान के निर्माण के वर्ष पर विचार करने की प्रथा है, जब डब्ल्यू। ओस्टवाल्ड ने व्यावहारिक अभ्यास के साथ इस पाठ्यक्रम को पढ़ना शुरू किया, और पत्रिका Zeitschtift fur physikalische Chemie प्रकाशित करना शुरू किया। उसी वर्ष, डब्ल्यू ओस्टवाल्ड के नेतृत्व में लीपज़िग विश्वविद्यालय में भौतिक रसायन विज्ञान विभाग का आयोजन किया गया था।

 लंबे समय तक रूसी साम्राज्य में जन्मे और रहे, 35 साल की उम्र में उन्होंने रूसी नागरिकता को जर्मन में बदल दिया। लीपज़िग में, उन्होंने अपना अधिकांश जीवन बिताया, जहाँ उन्हें "रूसी प्रोफेसर" कहा जाता था। 25 साल की उम्र में उन्होंने "वॉल्यूम-केमिकल और ऑप्टोकेमिकल रिसर्च" विषय पर अपने डॉक्टरेट शोध प्रबंध का बचाव किया।
लंबे समय तक रूसी साम्राज्य में जन्मे और रहे, 35 साल की उम्र में उन्होंने रूसी नागरिकता को जर्मन में बदल दिया। लीपज़िग में, उन्होंने अपना अधिकांश जीवन बिताया, जहाँ उन्हें "रूसी प्रोफेसर" कहा जाता था। 25 साल की उम्र में उन्होंने "वॉल्यूम-केमिकल और ऑप्टोकेमिकल रिसर्च" विषय पर अपने डॉक्टरेट शोध प्रबंध का बचाव किया।
 1887 में, उन्होंने लीपज़िग में जाने का प्रस्ताव स्वीकार कर लिया, जहाँ उन्होंने विश्वविद्यालय में भौतिकी और रसायन विज्ञान संस्थान की स्थापना की, जिसे उन्होंने 1905 तक निर्देशित किया। 1888 में, उन्होंने लीपज़िग विश्वविद्यालय में भौतिक और अकार्बनिक रसायन विज्ञान के बहुत प्रतिष्ठित विभाग पर कब्जा कर लिया। . उन्होंने इस पद पर 12 साल तक काम किया।
1887 में, उन्होंने लीपज़िग में जाने का प्रस्ताव स्वीकार कर लिया, जहाँ उन्होंने विश्वविद्यालय में भौतिकी और रसायन विज्ञान संस्थान की स्थापना की, जिसे उन्होंने 1905 तक निर्देशित किया। 1888 में, उन्होंने लीपज़िग विश्वविद्यालय में भौतिक और अकार्बनिक रसायन विज्ञान के बहुत प्रतिष्ठित विभाग पर कब्जा कर लिया। . उन्होंने इस पद पर 12 साल तक काम किया।
 डब्ल्यू। ओस्टवाल्ड के "लीपज़िग स्कूल" से आए: नोबेल पुरस्कार विजेता एस। अरहेनियस, जे। वैंट हॉफ, डब्ल्यू। नर्नस्ट, प्रसिद्ध भौतिक विज्ञानी जी। टैमन और एफ। डोनन, कार्बनिक रसायनज्ञ जे। विस्लिसेंस, प्रसिद्ध अमेरिकी रसायनज्ञ जी। एन। लुईस। इन वर्षों में, रूसी रसायनज्ञों ने ओस्टवाल्ड में प्रशिक्षित किया: I. A. Kablukov, V. A. Kistyakovsky, L. V. Pisarzhevsky, A. V. Rakovsky, N. A. Shilov और अन्य।
डब्ल्यू। ओस्टवाल्ड के "लीपज़िग स्कूल" से आए: नोबेल पुरस्कार विजेता एस। अरहेनियस, जे। वैंट हॉफ, डब्ल्यू। नर्नस्ट, प्रसिद्ध भौतिक विज्ञानी जी। टैमन और एफ। डोनन, कार्बनिक रसायनज्ञ जे। विस्लिसेंस, प्रसिद्ध अमेरिकी रसायनज्ञ जी। एन। लुईस। इन वर्षों में, रूसी रसायनज्ञों ने ओस्टवाल्ड में प्रशिक्षित किया: I. A. Kablukov, V. A. Kistyakovsky, L. V. Pisarzhevsky, A. V. Rakovsky, N. A. Shilov और अन्य।
 ओस्टवाल्ड की अनूठी विशेषताओं में से एक परमाणु-आणविक सिद्धांत की उनकी कई वर्षों की सक्रिय अस्वीकृति थी (हालांकि उन्होंने "मोल" शब्द का प्रस्ताव दिया था)। "रसायनज्ञ कोई परमाणु नहीं देखता है। "वह केवल सरल और समझने योग्य कानूनों की खोज करता है जो अभिकर्मकों के द्रव्यमान और मात्रा अनुपात को नियंत्रित करते हैं।"
ओस्टवाल्ड की अनूठी विशेषताओं में से एक परमाणु-आणविक सिद्धांत की उनकी कई वर्षों की सक्रिय अस्वीकृति थी (हालांकि उन्होंने "मोल" शब्द का प्रस्ताव दिया था)। "रसायनज्ञ कोई परमाणु नहीं देखता है। "वह केवल सरल और समझने योग्य कानूनों की खोज करता है जो अभिकर्मकों के द्रव्यमान और मात्रा अनुपात को नियंत्रित करते हैं।"
 डब्ल्यू. ओस्टवाल्ड ने एक विशाल रसायन शास्त्र की पाठ्यपुस्तक लिखने का प्रयास किया जिसमें "परमाणु" शब्द का कभी उल्लेख नहीं किया गया। 19 अप्रैल, 1904 को लंदन में केमिकल सोसाइटी के सदस्यों को एक बड़ी रिपोर्ट के साथ बोलते हुए, ओस्टवाल्ड ने यह साबित करने की कोशिश की कि परमाणु मौजूद नहीं हैं, और "जिसे हम पदार्थ कहते हैं वह केवल एक निश्चित स्थान पर एकत्रित ऊर्जाओं का एक संग्रह है।"
डब्ल्यू. ओस्टवाल्ड ने एक विशाल रसायन शास्त्र की पाठ्यपुस्तक लिखने का प्रयास किया जिसमें "परमाणु" शब्द का कभी उल्लेख नहीं किया गया। 19 अप्रैल, 1904 को लंदन में केमिकल सोसाइटी के सदस्यों को एक बड़ी रिपोर्ट के साथ बोलते हुए, ओस्टवाल्ड ने यह साबित करने की कोशिश की कि परमाणु मौजूद नहीं हैं, और "जिसे हम पदार्थ कहते हैं वह केवल एक निश्चित स्थान पर एकत्रित ऊर्जाओं का एक संग्रह है।"
 वी। ओस्टवाल्ड के सम्मान में, टार्टू विश्वविद्यालय के क्षेत्र में एस्टोनियाई, जर्मन और अंग्रेजी में एक शिलालेख के साथ एक स्मारक पट्टिका स्थापित की गई थी।
वी। ओस्टवाल्ड के सम्मान में, टार्टू विश्वविद्यालय के क्षेत्र में एस्टोनियाई, जर्मन और अंग्रेजी में एक शिलालेख के साथ एक स्मारक पट्टिका स्थापित की गई थी।



 भविष्यवाणी करें कि क्या प्रतिक्रिया स्वचालित रूप से आगे बढ़ सकती है; यदि प्रतिक्रिया आगे बढ़ती है, तो कितनी गहरी (प्रतिक्रिया उत्पादों की संतुलन सांद्रता क्या हैं); अगर प्रतिक्रिया आगे बढ़ती है, तो किस दर से।
भविष्यवाणी करें कि क्या प्रतिक्रिया स्वचालित रूप से आगे बढ़ सकती है; यदि प्रतिक्रिया आगे बढ़ती है, तो कितनी गहरी (प्रतिक्रिया उत्पादों की संतुलन सांद्रता क्या हैं); अगर प्रतिक्रिया आगे बढ़ती है, तो किस दर से।



 1. पदार्थ की संरचना इस खंड में, क्वांटम यांत्रिकी (श्रोडिंगर के समीकरण) के आधार पर, परमाणुओं और अणुओं की संरचना (परमाणुओं और अणुओं के इलेक्ट्रॉनिक ऑर्बिटल्स), ठोस के क्रिस्टल जाली, आदि की व्याख्या की जाती है, पदार्थ की कुल अवस्थाएँ हैं माना।
1. पदार्थ की संरचना इस खंड में, क्वांटम यांत्रिकी (श्रोडिंगर के समीकरण) के आधार पर, परमाणुओं और अणुओं की संरचना (परमाणुओं और अणुओं के इलेक्ट्रॉनिक ऑर्बिटल्स), ठोस के क्रिस्टल जाली, आदि की व्याख्या की जाती है, पदार्थ की कुल अवस्थाएँ हैं माना।
 2. ऊष्मप्रवैगिकी के नियमों (शुरुआत) के आधार पर रासायनिक थर्मोडायनामिक्स आपको अनुमति देता है: रासायनिक प्रतिक्रियाओं और भौतिक-रासायनिक प्रक्रियाओं के थर्मल प्रभावों की गणना करें, रासायनिक प्रतिक्रियाओं की दिशा की भविष्यवाणी करें, अभिकारकों और प्रतिक्रिया उत्पादों की संतुलन सांद्रता की गणना करें।
2. ऊष्मप्रवैगिकी के नियमों (शुरुआत) के आधार पर रासायनिक थर्मोडायनामिक्स आपको अनुमति देता है: रासायनिक प्रतिक्रियाओं और भौतिक-रासायनिक प्रक्रियाओं के थर्मल प्रभावों की गणना करें, रासायनिक प्रतिक्रियाओं की दिशा की भविष्यवाणी करें, अभिकारकों और प्रतिक्रिया उत्पादों की संतुलन सांद्रता की गणना करें।
 3. चरण संतुलन के थर्मोडायनामिक्स वह एक-घटक और बहु-घटक (समाधान) प्रणालियों में चरण संक्रमण की नियमितताओं का अध्ययन करता है। इसका मुख्य उद्देश्य इन प्रणालियों के लिए चरण संतुलन आरेखों का निर्माण करना है।
3. चरण संतुलन के थर्मोडायनामिक्स वह एक-घटक और बहु-घटक (समाधान) प्रणालियों में चरण संक्रमण की नियमितताओं का अध्ययन करता है। इसका मुख्य उद्देश्य इन प्रणालियों के लिए चरण संतुलन आरेखों का निर्माण करना है।


 4. विद्युत रसायन यह इलेक्ट्रोलाइट समाधानों के गुणों का अध्ययन करता है, आणविक समाधानों की तुलना में उनके व्यवहार की विशेषताओं का अध्ययन करता है, विद्युत रासायनिक (गैल्वेनिक) कोशिकाओं और इलेक्ट्रोलाइज़र के संचालन के दौरान रासायनिक प्रतिक्रियाओं और विद्युत ऊर्जा की ऊर्जा के अंतर-रूपांतरण के पैटर्न की पड़ताल करता है।
4. विद्युत रसायन यह इलेक्ट्रोलाइट समाधानों के गुणों का अध्ययन करता है, आणविक समाधानों की तुलना में उनके व्यवहार की विशेषताओं का अध्ययन करता है, विद्युत रासायनिक (गैल्वेनिक) कोशिकाओं और इलेक्ट्रोलाइज़र के संचालन के दौरान रासायनिक प्रतिक्रियाओं और विद्युत ऊर्जा की ऊर्जा के अंतर-रूपांतरण के पैटर्न की पड़ताल करता है।
 5. रासायनिक गतिकी और उत्प्रेरक वह समय पर रासायनिक प्रतिक्रियाओं के पाठ्यक्रम की नियमितता का अध्ययन करता है, थर्मोडायनामिक मापदंडों (दबाव, तापमान, आदि) के प्रभाव की जांच करता है, प्रतिक्रियाओं की दर और तंत्र पर उत्प्रेरक और अवरोधकों की उपस्थिति।
5. रासायनिक गतिकी और उत्प्रेरक वह समय पर रासायनिक प्रतिक्रियाओं के पाठ्यक्रम की नियमितता का अध्ययन करता है, थर्मोडायनामिक मापदंडों (दबाव, तापमान, आदि) के प्रभाव की जांच करता है, प्रतिक्रियाओं की दर और तंत्र पर उत्प्रेरक और अवरोधकों की उपस्थिति।
 एक अलग विज्ञान में, कोलॉइड रसायन भौतिक रसायन विज्ञान के एक खंड द्वारा प्रतिष्ठित है - सतह की घटनाओं और फैलाव प्रणालियों की भौतिक रसायन शास्त्र।
एक अलग विज्ञान में, कोलॉइड रसायन भौतिक रसायन विज्ञान के एक खंड द्वारा प्रतिष्ठित है - सतह की घटनाओं और फैलाव प्रणालियों की भौतिक रसायन शास्त्र।

 शास्त्रीय ऊष्मप्रवैगिकी सैद्धांतिक भौतिकी की एक शाखा है और गर्मी और काम (टर्मो - हीट, डायनेमो - मूवमेंट) के रूप में सिस्टम के बीच विभिन्न प्रकार की ऊर्जा और ऊर्जा संक्रमण के अंतर-रूपांतरण के पैटर्न का अध्ययन करती है।
शास्त्रीय ऊष्मप्रवैगिकी सैद्धांतिक भौतिकी की एक शाखा है और गर्मी और काम (टर्मो - हीट, डायनेमो - मूवमेंट) के रूप में सिस्टम के बीच विभिन्न प्रकार की ऊर्जा और ऊर्जा संक्रमण के अंतर-रूपांतरण के पैटर्न का अध्ययन करती है।
 थर्मोडायनामिक्स उन कारणों से सार निकालता है जो किसी भी प्रक्रिया का कारण बनते हैं, और वह समय जिसके दौरान यह प्रक्रिया होती है, लेकिन केवल किसी भी भौतिक और रासायनिक प्रक्रिया में शामिल सिस्टम के प्रारंभिक और अंतिम मापदंडों के साथ संचालित होती है। व्यक्तिगत अणुओं के गुणों को ध्यान में नहीं रखा जाता है, लेकिन कई अणुओं से युक्त प्रणालियों की औसत विशेषताओं का उपयोग किया जाता है।
थर्मोडायनामिक्स उन कारणों से सार निकालता है जो किसी भी प्रक्रिया का कारण बनते हैं, और वह समय जिसके दौरान यह प्रक्रिया होती है, लेकिन केवल किसी भी भौतिक और रासायनिक प्रक्रिया में शामिल सिस्टम के प्रारंभिक और अंतिम मापदंडों के साथ संचालित होती है। व्यक्तिगत अणुओं के गुणों को ध्यान में नहीं रखा जाता है, लेकिन कई अणुओं से युक्त प्रणालियों की औसत विशेषताओं का उपयोग किया जाता है।


 रासायनिक ऊष्मप्रवैगिकी के कार्य हैं: रासायनिक प्रतिक्रियाओं और भौतिक रासायनिक प्रक्रियाओं के थर्मल प्रभावों की माप और गणना, प्रतिक्रियाओं की दिशा और गहराई की भविष्यवाणी, रासायनिक और चरण संतुलन का विश्लेषण, आदि।
रासायनिक ऊष्मप्रवैगिकी के कार्य हैं: रासायनिक प्रतिक्रियाओं और भौतिक रासायनिक प्रक्रियाओं के थर्मल प्रभावों की माप और गणना, प्रतिक्रियाओं की दिशा और गहराई की भविष्यवाणी, रासायनिक और चरण संतुलन का विश्लेषण, आदि।
 1. टीडी की मूल अवधारणाएं और परिभाषाएं ऊष्मप्रवैगिकी में, हमारे लिए रुचि की सभी प्रक्रियाएं थर्मोडायनामिक प्रणालियों में होती हैं। प्रणाली - एक शरीर या निकायों का समूह, वास्तव में या मानसिक रूप से पर्यावरण में एक पर्यवेक्षक द्वारा पहचाना जाता है।
1. टीडी की मूल अवधारणाएं और परिभाषाएं ऊष्मप्रवैगिकी में, हमारे लिए रुचि की सभी प्रक्रियाएं थर्मोडायनामिक प्रणालियों में होती हैं। प्रणाली - एक शरीर या निकायों का समूह, वास्तव में या मानसिक रूप से पर्यावरण में एक पर्यवेक्षक द्वारा पहचाना जाता है।
 प्रणाली आसपास की दुनिया का वह हिस्सा है जिसमें हम विशेष रूप से रुचि रखते हैं। ब्रह्मांड में बाकी सब कुछ पर्यावरण (पर्यावरण) है। यह आम तौर पर स्वीकार किया जाता है कि पर्यावरण इतना बड़ा है (एक अनंत मात्रा है) कि थर्मोडायनामिक प्रणाली के साथ ऊर्जा का आदान-प्रदान इसका तापमान नहीं बदलता है।
प्रणाली आसपास की दुनिया का वह हिस्सा है जिसमें हम विशेष रूप से रुचि रखते हैं। ब्रह्मांड में बाकी सब कुछ पर्यावरण (पर्यावरण) है। यह आम तौर पर स्वीकार किया जाता है कि पर्यावरण इतना बड़ा है (एक अनंत मात्रा है) कि थर्मोडायनामिक प्रणाली के साथ ऊर्जा का आदान-प्रदान इसका तापमान नहीं बदलता है।
 पर्यावरण के साथ ऊर्जा और पदार्थ के आदान-प्रदान की प्रकृति के अनुसार, प्रणालियों को वर्गीकृत किया जाता है: पृथक - वे न तो पदार्थ या ऊर्जा का आदान-प्रदान कर सकते हैं; बंद - ऊर्जा का आदान-प्रदान कर सकता है, लेकिन नहीं कर सकता - पदार्थ; खुला - पदार्थ और ऊर्जा दोनों का आदान-प्रदान कर सकता है।
पर्यावरण के साथ ऊर्जा और पदार्थ के आदान-प्रदान की प्रकृति के अनुसार, प्रणालियों को वर्गीकृत किया जाता है: पृथक - वे न तो पदार्थ या ऊर्जा का आदान-प्रदान कर सकते हैं; बंद - ऊर्जा का आदान-प्रदान कर सकता है, लेकिन नहीं कर सकता - पदार्थ; खुला - पदार्थ और ऊर्जा दोनों का आदान-प्रदान कर सकता है।
 चरणों की संख्या के अनुसार, सिस्टम में विभाजित हैं: सजातीय - एक चरण (पानी में Na। Cl समाधान) से मिलकर बनता है; विषम - प्रणाली में इंटरफेस द्वारा एक दूसरे से अलग किए गए कई चरण शामिल हैं। विषम प्रणालियों का एक उदाहरण पानी में तैरती बर्फ है, दूध (वसा की बूंदें - एक चरण, जलीय वातावरण - दूसरा)।
चरणों की संख्या के अनुसार, सिस्टम में विभाजित हैं: सजातीय - एक चरण (पानी में Na। Cl समाधान) से मिलकर बनता है; विषम - प्रणाली में इंटरफेस द्वारा एक दूसरे से अलग किए गए कई चरण शामिल हैं। विषम प्रणालियों का एक उदाहरण पानी में तैरती बर्फ है, दूध (वसा की बूंदें - एक चरण, जलीय वातावरण - दूसरा)।
 एक चरण एक प्रणाली के सजातीय भागों का एक समूह है जिसमें समान रासायनिक और भौतिक गुण होते हैं और चरण इंटरफेस द्वारा सिस्टम के अन्य भागों से अलग होते हैं। प्रत्येक चरण एक विषम प्रणाली का एक सजातीय हिस्सा है
एक चरण एक प्रणाली के सजातीय भागों का एक समूह है जिसमें समान रासायनिक और भौतिक गुण होते हैं और चरण इंटरफेस द्वारा सिस्टम के अन्य भागों से अलग होते हैं। प्रत्येक चरण एक विषम प्रणाली का एक सजातीय हिस्सा है
 घटकों की संख्या के अनुसार, सिस्टम को एक-दो-, तीन-घटक और बहु-घटक में विभाजित किया गया है। घटक व्यक्तिगत रसायन होते हैं जो एक प्रणाली बनाते हैं जिसे सिस्टम से अलग किया जा सकता है और इसके बाहर मौजूद हो सकता है।
घटकों की संख्या के अनुसार, सिस्टम को एक-दो-, तीन-घटक और बहु-घटक में विभाजित किया गया है। घटक व्यक्तिगत रसायन होते हैं जो एक प्रणाली बनाते हैं जिसे सिस्टम से अलग किया जा सकता है और इसके बाहर मौजूद हो सकता है।
 किसी भी थर्मोडायनामिक प्रणाली को बड़ी संख्या में भौतिक और रासायनिक गुणों के एक सेट द्वारा विशेषता दी जा सकती है जो कुछ निश्चित मूल्यों को लेते हैं: तापमान, दबाव, तापीय चालकता, गर्मी क्षमता, घटक सांद्रता, ढांकता हुआ स्थिरांक, आदि।
किसी भी थर्मोडायनामिक प्रणाली को बड़ी संख्या में भौतिक और रासायनिक गुणों के एक सेट द्वारा विशेषता दी जा सकती है जो कुछ निश्चित मूल्यों को लेते हैं: तापमान, दबाव, तापीय चालकता, गर्मी क्षमता, घटक सांद्रता, ढांकता हुआ स्थिरांक, आदि।
 रासायनिक ऊष्मप्रवैगिकी में, कोई उन गुणों से संबंधित होता है जिन्हें एक प्रणाली में तापमान, दबाव, मात्रा या पदार्थों की सांद्रता के कार्यों के रूप में स्पष्ट रूप से व्यक्त किया जा सकता है। इन गुणों को थर्मोडायनामिक गुण कहा जाता है।
रासायनिक ऊष्मप्रवैगिकी में, कोई उन गुणों से संबंधित होता है जिन्हें एक प्रणाली में तापमान, दबाव, मात्रा या पदार्थों की सांद्रता के कार्यों के रूप में स्पष्ट रूप से व्यक्त किया जा सकता है। इन गुणों को थर्मोडायनामिक गुण कहा जाता है।

 एक थर्मोडायनामिक प्रणाली की स्थिति को तब माना जाता है जब इसकी रासायनिक संरचना, चरण संरचना और स्वतंत्र थर्मोडायनामिक मापदंडों के मूल्यों का संकेत दिया जाता है। स्वतंत्र मापदंडों में शामिल हैं: दबाव (पी), आयतन (वी), तापमान (टी), पदार्थ की मात्रा एन कई मोल के रूप में या सांद्रता (सी) के रूप में। उन्हें राज्य पैरामीटर कहा जाता है।
एक थर्मोडायनामिक प्रणाली की स्थिति को तब माना जाता है जब इसकी रासायनिक संरचना, चरण संरचना और स्वतंत्र थर्मोडायनामिक मापदंडों के मूल्यों का संकेत दिया जाता है। स्वतंत्र मापदंडों में शामिल हैं: दबाव (पी), आयतन (वी), तापमान (टी), पदार्थ की मात्रा एन कई मोल के रूप में या सांद्रता (सी) के रूप में। उन्हें राज्य पैरामीटर कहा जाता है।
 इकाइयों की वर्तमान प्रणाली (एसआई) के अनुसार, मुख्य थर्मोडायनामिक पैरामीटर निम्नलिखित इकाइयों में सेट किए गए हैं: [एम 3] (वॉल्यूम); [पा] (दबाव); [मोल] (एन); [के] (तापमान)। एक अपवाद के रूप में, रासायनिक ऊष्मप्रवैगिकी में, इसे दबाव की एक ऑफ-सिस्टम इकाई, सामान्य भौतिक वातावरण (एटीएम) का उपयोग करने की अनुमति है, जो 101 के बराबर है। 325 k. Pa
इकाइयों की वर्तमान प्रणाली (एसआई) के अनुसार, मुख्य थर्मोडायनामिक पैरामीटर निम्नलिखित इकाइयों में सेट किए गए हैं: [एम 3] (वॉल्यूम); [पा] (दबाव); [मोल] (एन); [के] (तापमान)। एक अपवाद के रूप में, रासायनिक ऊष्मप्रवैगिकी में, इसे दबाव की एक ऑफ-सिस्टम इकाई, सामान्य भौतिक वातावरण (एटीएम) का उपयोग करने की अनुमति है, जो 101 के बराबर है। 325 k. Pa
 थर्मोडायनामिक पैरामीटर और गुण हो सकते हैं: गहन - वे सिस्टम के द्रव्यमान (मात्रा) पर निर्भर नहीं करते हैं। ये तापमान, दबाव, रासायनिक क्षमता आदि हैं। व्यापक - ये सिस्टम के द्रव्यमान (आयतन) पर निर्भर करते हैं। ये ऊर्जा, एन्ट्रापी, एन्थैल्पी आदि हैं। जब एक जटिल प्रणाली बनती है, तो गहन गुण संरेखित होते हैं, और व्यापक गुणों को अभिव्यक्त किया जाता है।
थर्मोडायनामिक पैरामीटर और गुण हो सकते हैं: गहन - वे सिस्टम के द्रव्यमान (मात्रा) पर निर्भर नहीं करते हैं। ये तापमान, दबाव, रासायनिक क्षमता आदि हैं। व्यापक - ये सिस्टम के द्रव्यमान (आयतन) पर निर्भर करते हैं। ये ऊर्जा, एन्ट्रापी, एन्थैल्पी आदि हैं। जब एक जटिल प्रणाली बनती है, तो गहन गुण संरेखित होते हैं, और व्यापक गुणों को अभिव्यक्त किया जाता है।

 कोई भी परिवर्तन जो सिस्टम में होता है और कम से कम एक थर्मोडायनामिक स्टेट पैरामीटर (सिस्टम गुण) में बदलाव के साथ होता है, थर्मोडायनामिक प्रक्रिया कहलाता है। यदि प्रक्रिया के क्रम में सिस्टम की रासायनिक संरचना बदल जाती है, तो ऐसी प्रक्रिया को रासायनिक प्रतिक्रिया कहा जाता है।
कोई भी परिवर्तन जो सिस्टम में होता है और कम से कम एक थर्मोडायनामिक स्टेट पैरामीटर (सिस्टम गुण) में बदलाव के साथ होता है, थर्मोडायनामिक प्रक्रिया कहलाता है। यदि प्रक्रिया के क्रम में सिस्टम की रासायनिक संरचना बदल जाती है, तो ऐसी प्रक्रिया को रासायनिक प्रतिक्रिया कहा जाता है।

 आमतौर पर, प्रक्रिया के दौरान, किसी एक (या कई) मापदंडों को स्थिर रखा जाता है। तदनुसार, वे भेद करते हैं: एक स्थिर तापमान पर एक इज़ोटेर्मल प्रक्रिया (टी = स्थिरांक); समदाब रेखीय प्रक्रिया - निरंतर दबाव पर (P = const); समस्थानिक प्रक्रिया - एक स्थिर आयतन पर (V = const); पर्यावरण के साथ ऊष्मा विनिमय की अनुपस्थिति में रुद्धोष्म प्रक्रिया (Q = 0)।
आमतौर पर, प्रक्रिया के दौरान, किसी एक (या कई) मापदंडों को स्थिर रखा जाता है। तदनुसार, वे भेद करते हैं: एक स्थिर तापमान पर एक इज़ोटेर्मल प्रक्रिया (टी = स्थिरांक); समदाब रेखीय प्रक्रिया - निरंतर दबाव पर (P = const); समस्थानिक प्रक्रिया - एक स्थिर आयतन पर (V = const); पर्यावरण के साथ ऊष्मा विनिमय की अनुपस्थिति में रुद्धोष्म प्रक्रिया (Q = 0)।
 जब गैर-पृथक प्रणालियों में प्रक्रियाएं होती हैं, तो गर्मी को अवशोषित या छोड़ा जा सकता है। इस विशेषता के अनुसार, प्रक्रियाओं को एक्ज़ोथिर्मिक (गर्मी जारी की जाती है) और एंडोथर्मिक (गर्मी अवशोषित होती है) में विभाजित किया जाता है।
जब गैर-पृथक प्रणालियों में प्रक्रियाएं होती हैं, तो गर्मी को अवशोषित या छोड़ा जा सकता है। इस विशेषता के अनुसार, प्रक्रियाओं को एक्ज़ोथिर्मिक (गर्मी जारी की जाती है) और एंडोथर्मिक (गर्मी अवशोषित होती है) में विभाजित किया जाता है।

 प्रक्रिया के दौरान, प्रणाली एक संतुलन अवस्था से दूसरी संतुलन अवस्था में जाती है। थर्मोडायनामिक संतुलन उस प्रणाली की स्थिति है जिसमें पर्यावरण के साथ और सिस्टम के चरणों के बीच थर्मल, मैकेनिकल और रासायनिक (इलेक्ट्रोकेमिकल) संतुलन देखा जाता है।
प्रक्रिया के दौरान, प्रणाली एक संतुलन अवस्था से दूसरी संतुलन अवस्था में जाती है। थर्मोडायनामिक संतुलन उस प्रणाली की स्थिति है जिसमें पर्यावरण के साथ और सिस्टम के चरणों के बीच थर्मल, मैकेनिकल और रासायनिक (इलेक्ट्रोकेमिकल) संतुलन देखा जाता है।
 संतुलन राज्य हैं: स्थिर; मेटास्टेबल एक प्रक्रिया को संतुलन (अर्ध-स्थिर) कहा जाता है यदि यह प्रणाली के संतुलन राज्यों के निरंतर अनुक्रम के माध्यम से असीम रूप से धीरे-धीरे गुजरती है।
संतुलन राज्य हैं: स्थिर; मेटास्टेबल एक प्रक्रिया को संतुलन (अर्ध-स्थिर) कहा जाता है यदि यह प्रणाली के संतुलन राज्यों के निरंतर अनुक्रम के माध्यम से असीम रूप से धीरे-धीरे गुजरती है।


 ऐसी प्रक्रियाएँ जो स्वयं घटित होती हैं और उनके कार्यान्वयन के लिए बाहरी ऊर्जा की आवश्यकता नहीं होती है, स्वतःस्फूर्त (सकारात्मक) प्रक्रिया कहलाती हैं। जब प्रक्रिया के कार्यान्वयन के लिए पर्यावरण से ऊर्जा निकाली जाती है, यानी सिस्टम पर काम किया जाता है, तो प्रक्रिया को गैर-सहज (नकारात्मक) कहा जाता है।
ऐसी प्रक्रियाएँ जो स्वयं घटित होती हैं और उनके कार्यान्वयन के लिए बाहरी ऊर्जा की आवश्यकता नहीं होती है, स्वतःस्फूर्त (सकारात्मक) प्रक्रिया कहलाती हैं। जब प्रक्रिया के कार्यान्वयन के लिए पर्यावरण से ऊर्जा निकाली जाती है, यानी सिस्टम पर काम किया जाता है, तो प्रक्रिया को गैर-सहज (नकारात्मक) कहा जाता है।

 राज्य कार्य राज्य कार्य प्रणाली गुण हैं (आंतरिक ऊर्जा यू, एन्थैल्पी एच, एन्ट्रॉपी एस, आदि), वे सिस्टम की दी गई स्थिति की विशेषता रखते हैं। प्रक्रिया के दौरान उनके परिवर्तन इसके पथ पर निर्भर नहीं करते हैं और केवल सिस्टम की प्रारंभिक और अंतिम अवस्थाओं द्वारा निर्धारित किए जाते हैं।
राज्य कार्य राज्य कार्य प्रणाली गुण हैं (आंतरिक ऊर्जा यू, एन्थैल्पी एच, एन्ट्रॉपी एस, आदि), वे सिस्टम की दी गई स्थिति की विशेषता रखते हैं। प्रक्रिया के दौरान उनके परिवर्तन इसके पथ पर निर्भर नहीं करते हैं और केवल सिस्टम की प्रारंभिक और अंतिम अवस्थाओं द्वारा निर्धारित किए जाते हैं।

 इस फलन में एक अतिसूक्ष्म परिवर्तन d का कुल अंतर है। यू, डी. एस आदि:
इस फलन में एक अतिसूक्ष्म परिवर्तन d का कुल अंतर है। यू, डी. एस आदि:


 प्रक्रिया (संक्रमण) कार्य प्रक्रिया कार्य (गर्मी क्यू, कार्य डब्ल्यू) - वे सिस्टम के गुण नहीं हैं (वे सिस्टम में नहीं हैं), वे उस प्रक्रिया के दौरान उत्पन्न होते हैं जिसमें सिस्टम भाग लेता है।
प्रक्रिया (संक्रमण) कार्य प्रक्रिया कार्य (गर्मी क्यू, कार्य डब्ल्यू) - वे सिस्टम के गुण नहीं हैं (वे सिस्टम में नहीं हैं), वे उस प्रक्रिया के दौरान उत्पन्न होते हैं जिसमें सिस्टम भाग लेता है।
 यदि सिस्टम में कोई गर्मी और काम नहीं है, तो उनके परिवर्तन के बारे में बात करना व्यर्थ है, हम केवल एक विशेष प्रक्रिया में उनकी मात्रा क्यू या डब्ल्यू के बारे में बात कर सकते हैं। उनकी मात्रा प्रक्रिया के तरीके पर निर्भर करती है। अपरिमित रूप से छोटी मात्राओं को Q, W से निरूपित किया जाता है।
यदि सिस्टम में कोई गर्मी और काम नहीं है, तो उनके परिवर्तन के बारे में बात करना व्यर्थ है, हम केवल एक विशेष प्रक्रिया में उनकी मात्रा क्यू या डब्ल्यू के बारे में बात कर सकते हैं। उनकी मात्रा प्रक्रिया के तरीके पर निर्भर करती है। अपरिमित रूप से छोटी मात्राओं को Q, W से निरूपित किया जाता है।

 गति पदार्थ का गुण है। गति का माप, यानी मात्रात्मक और गुणात्मक विशेषता, ऊर्जा है। ऊर्जा प्रणाली की स्थिति का एक कार्य है। किसी विशेष प्रक्रिया में इसका परिवर्तन प्रक्रिया के पथ पर निर्भर नहीं करता है और केवल सिस्टम की प्रारंभिक और अंतिम अवस्थाओं द्वारा निर्धारित किया जाता है।
गति पदार्थ का गुण है। गति का माप, यानी मात्रात्मक और गुणात्मक विशेषता, ऊर्जा है। ऊर्जा प्रणाली की स्थिति का एक कार्य है। किसी विशेष प्रक्रिया में इसका परिवर्तन प्रक्रिया के पथ पर निर्भर नहीं करता है और केवल सिस्टम की प्रारंभिक और अंतिम अवस्थाओं द्वारा निर्धारित किया जाता है।
 ऊर्जा के कई अलग-अलग प्रकार ज्ञात हैं: यांत्रिक, विद्युत, रासायनिक, आदि, लेकिन ऊर्जा केवल दो रूपों में एक प्रणाली से दूसरे सिस्टम में जा सकती है: गर्मी या काम के रूप में।
ऊर्जा के कई अलग-अलग प्रकार ज्ञात हैं: यांत्रिक, विद्युत, रासायनिक, आदि, लेकिन ऊर्जा केवल दो रूपों में एक प्रणाली से दूसरे सिस्टम में जा सकती है: गर्मी या काम के रूप में।
 संपर्क प्रणाली के कणों (अणुओं, परमाणुओं, आयनों, आदि) की अराजक गति के कारण ऊष्मा (क्यू) एक प्रणाली से प्रणाली में ऊर्जा हस्तांतरण का एक रूप है।
संपर्क प्रणाली के कणों (अणुओं, परमाणुओं, आयनों, आदि) की अराजक गति के कारण ऊष्मा (क्यू) एक प्रणाली से प्रणाली में ऊर्जा हस्तांतरण का एक रूप है।
 ऊष्मप्रवैगिकी में, सिस्टम को आपूर्ति की गई गर्मी को सकारात्मक माना जाता है (उदाहरण के लिए, एक एंडोथर्मिक प्रतिक्रिया की गर्मी), और सिस्टम से निकाली गई गर्मी नकारात्मक है (एक एक्सोथर्मिक प्रतिक्रिया की गर्मी)। थर्मोकैमिस्ट्री में, विपरीत सच है।
ऊष्मप्रवैगिकी में, सिस्टम को आपूर्ति की गई गर्मी को सकारात्मक माना जाता है (उदाहरण के लिए, एक एंडोथर्मिक प्रतिक्रिया की गर्मी), और सिस्टम से निकाली गई गर्मी नकारात्मक है (एक एक्सोथर्मिक प्रतिक्रिया की गर्मी)। थर्मोकैमिस्ट्री में, विपरीत सच है।
 कार्य सूक्ष्म या स्थूल-निकायों के निर्देशित संचलन के कारण एक प्रणाली से दूसरे तंत्र में ऊर्जा हस्तांतरण का एक रूप है। साहित्य में, काम को या तो डब्ल्यू (अंग्रेजी "काम" से) या ए (जर्मन "आर्बिट" से) द्वारा दर्शाया जाता है।
कार्य सूक्ष्म या स्थूल-निकायों के निर्देशित संचलन के कारण एक प्रणाली से दूसरे तंत्र में ऊर्जा हस्तांतरण का एक रूप है। साहित्य में, काम को या तो डब्ल्यू (अंग्रेजी "काम" से) या ए (जर्मन "आर्बिट" से) द्वारा दर्शाया जाता है।
 विभिन्न प्रकार के कार्य हैं: यांत्रिक, विद्युत, चुंबकीय, सतह परिवर्तन, आदि। किसी भी प्रकार के एक असीम रूप से छोटे कार्य को सामान्यीकृत बल के उत्पाद और सामान्यीकृत समन्वय में परिवर्तन के रूप में दर्शाया जा सकता है, उदाहरण के लिए:
विभिन्न प्रकार के कार्य हैं: यांत्रिक, विद्युत, चुंबकीय, सतह परिवर्तन, आदि। किसी भी प्रकार के एक असीम रूप से छोटे कार्य को सामान्यीकृत बल के उत्पाद और सामान्यीकृत समन्वय में परिवर्तन के रूप में दर्शाया जा सकता है, उदाहरण के लिए:

 बाहरी दबाव पी की ताकतों के खिलाफ काम के अपवाद के साथ सभी प्रकार के कार्यों का योग - विस्तार का कार्य - संपीड़न, उपयोगी कार्य डब्ल्यू कहा जाता है:
बाहरी दबाव पी की ताकतों के खिलाफ काम के अपवाद के साथ सभी प्रकार के कार्यों का योग - विस्तार का कार्य - संपीड़न, उपयोगी कार्य डब्ल्यू कहा जाता है:


 ऊष्मप्रवैगिकी में, कार्य को सकारात्मक माना जाता है यदि यह सिस्टम द्वारा ही किया जाता है और यदि यह सिस्टम पर किया जाता है तो नकारात्मक माना जाता है। IUPAC की सिफारिशों के अनुसार, सिस्टम पर किए गए कार्य को सकारात्मक मानने की प्रथा है ("अहंवादी" सिद्धांत सकारात्मक है जो आंतरिक ऊर्जा को बढ़ाता है)
ऊष्मप्रवैगिकी में, कार्य को सकारात्मक माना जाता है यदि यह सिस्टम द्वारा ही किया जाता है और यदि यह सिस्टम पर किया जाता है तो नकारात्मक माना जाता है। IUPAC की सिफारिशों के अनुसार, सिस्टम पर किए गए कार्य को सकारात्मक मानने की प्रथा है ("अहंवादी" सिद्धांत सकारात्मक है जो आंतरिक ऊर्जा को बढ़ाता है)

 विभिन्न प्रक्रियाओं में एक आदर्श गैस के विस्तार का कार्य 1. निर्वात में विस्तार: डब्ल्यू = 0. 2. आइसोकोरिक प्रतिवर्ती विस्तार: डी। वी = 0 डब्ल्यू = 0
विभिन्न प्रक्रियाओं में एक आदर्श गैस के विस्तार का कार्य 1. निर्वात में विस्तार: डब्ल्यू = 0. 2. आइसोकोरिक प्रतिवर्ती विस्तार: डी। वी = 0 डब्ल्यू = 0







 ऊष्मप्रवैगिकी के निष्कर्ष और संबंध दो अभिधारणाओं और तीन नियमों के आधार पर तैयार किए जाते हैं। कोई भी पृथक प्रणाली अंततः एक संतुलन स्थिति में आती है और अनायास इससे बाहर नहीं निकल सकती है (पहली अभिधारणा) यानी, थर्मोडायनामिक्स खगोलीय पैमाने की प्रणालियों और कणों की एक छोटी संख्या के साथ माइक्रोसिस्टम का वर्णन नहीं करता है (
ऊष्मप्रवैगिकी के निष्कर्ष और संबंध दो अभिधारणाओं और तीन नियमों के आधार पर तैयार किए जाते हैं। कोई भी पृथक प्रणाली अंततः एक संतुलन स्थिति में आती है और अनायास इससे बाहर नहीं निकल सकती है (पहली अभिधारणा) यानी, थर्मोडायनामिक्स खगोलीय पैमाने की प्रणालियों और कणों की एक छोटी संख्या के साथ माइक्रोसिस्टम का वर्णन नहीं करता है (
 एक गैर-संतुलन अवस्था से एक संतुलन अवस्था में स्वतःस्फूर्त संक्रमण को विश्राम कहा जाता है। यही है, संतुलन की स्थिति अनिवार्य रूप से पहुंच जाएगी, लेकिन ऐसी प्रक्रिया की अवधि परिभाषित नहीं है, और समय की कोई अवधारणा नहीं है।
एक गैर-संतुलन अवस्था से एक संतुलन अवस्था में स्वतःस्फूर्त संक्रमण को विश्राम कहा जाता है। यही है, संतुलन की स्थिति अनिवार्य रूप से पहुंच जाएगी, लेकिन ऐसी प्रक्रिया की अवधि परिभाषित नहीं है, और समय की कोई अवधारणा नहीं है।
 दूसरा अभिधारणा यदि सिस्टम A, सिस्टम B के साथ थर्मल संतुलन में है, और सिस्टम B सिस्टम C के साथ थर्मल संतुलन में है, तो सिस्टम A और C भी थर्मल संतुलन में हैं
दूसरा अभिधारणा यदि सिस्टम A, सिस्टम B के साथ थर्मल संतुलन में है, और सिस्टम B सिस्टम C के साथ थर्मल संतुलन में है, तो सिस्टम A और C भी थर्मल संतुलन में हैं


 किसी भी थर्मोडायनामिक सिस्टम यू की आंतरिक ऊर्जा सभी कणों (अणुओं, नाभिक, इलेक्ट्रॉनों, क्वार्क, आदि) की गतिज (गति ऊर्जा) और संभावित (इंटरैक्शन ऊर्जा) ऊर्जा का योग है, जो अज्ञात प्रकार सहित सिस्टम बनाते हैं। ऊर्जा।
किसी भी थर्मोडायनामिक सिस्टम यू की आंतरिक ऊर्जा सभी कणों (अणुओं, नाभिक, इलेक्ट्रॉनों, क्वार्क, आदि) की गतिज (गति ऊर्जा) और संभावित (इंटरैक्शन ऊर्जा) ऊर्जा का योग है, जो अज्ञात प्रकार सहित सिस्टम बनाते हैं। ऊर्जा।

 एक प्रणाली की आंतरिक ऊर्जा उसके द्रव्यमान (व्यापक संपत्ति) पर निर्भर करती है, सिस्टम के पदार्थ की प्रकृति और थर्मोडायनामिक मापदंडों पर: U = f(V, T) या U = (P, T) को J/mol में मापा जाता है। या जे / किग्रा। यू एक राज्य कार्य है, इसलिए यू प्रक्रिया के पथ पर निर्भर नहीं है, लेकिन सिस्टम की प्रारंभिक और अंतिम स्थिति से निर्धारित होता है। डी। यू कुल अंतर है।
एक प्रणाली की आंतरिक ऊर्जा उसके द्रव्यमान (व्यापक संपत्ति) पर निर्भर करती है, सिस्टम के पदार्थ की प्रकृति और थर्मोडायनामिक मापदंडों पर: U = f(V, T) या U = (P, T) को J/mol में मापा जाता है। या जे / किग्रा। यू एक राज्य कार्य है, इसलिए यू प्रक्रिया के पथ पर निर्भर नहीं है, लेकिन सिस्टम की प्रारंभिक और अंतिम स्थिति से निर्धारित होता है। डी। यू कुल अंतर है।
 केवल ऊष्मा या कार्य के रूप में पर्यावरण के साथ ऊर्जा के आदान-प्रदान के परिणामस्वरूप प्रणाली की आंतरिक ऊर्जा बदल सकती है।
केवल ऊष्मा या कार्य के रूप में पर्यावरण के साथ ऊर्जा के आदान-प्रदान के परिणामस्वरूप प्रणाली की आंतरिक ऊर्जा बदल सकती है।
 यह तथ्य, जो मानव जाति के व्यावहारिक अनुभव का एक सामान्यीकरण है, उष्मागतिकी के पहले नियम (शुरुआत) को बताता है: यू = क्यू - डब्ल्यू विभेदक रूप में (प्रक्रिया के एक असीम भाग के लिए): डी। यू = क्यूडब्ल्यू
यह तथ्य, जो मानव जाति के व्यावहारिक अनुभव का एक सामान्यीकरण है, उष्मागतिकी के पहले नियम (शुरुआत) को बताता है: यू = क्यू - डब्ल्यू विभेदक रूप में (प्रक्रिया के एक असीम भाग के लिए): डी। यू = क्यूडब्ल्यू

 "सिस्टम को आपूर्ति की जाने वाली गर्मी सिस्टम की आंतरिक ऊर्जा और सिस्टम द्वारा काम के प्रदर्शन को बढ़ाने के लिए जाती है।"
"सिस्टम को आपूर्ति की जाने वाली गर्मी सिस्टम की आंतरिक ऊर्जा और सिस्टम द्वारा काम के प्रदर्शन को बढ़ाने के लिए जाती है।"
 एक पृथक प्रणाली के लिए, क्यू = 0 और डब्ल्यू = 0, यानी, यू = 0 और यू = कास्ट। एक पृथक प्रणाली की आंतरिक ऊर्जा स्थिर होती है
एक पृथक प्रणाली के लिए, क्यू = 0 और डब्ल्यू = 0, यानी, यू = 0 और यू = कास्ट। एक पृथक प्रणाली की आंतरिक ऊर्जा स्थिर होती है
 क्लॉसियस के सूत्रीकरण में: "दुनिया की ऊर्जा स्थिर है"। पहली तरह की एक सतत गति मशीन (पेरपेटम मोबाइल) असंभव है। ऊर्जा के विभिन्न रूप कड़ाई से समान मात्रा में एक दूसरे में गुजरते हैं। ऊर्जा न तो उत्पन्न होती है और न ही नष्ट होती है, बल्कि केवल एक प्रणाली से दूसरे तंत्र में प्रवाहित होती है।
क्लॉसियस के सूत्रीकरण में: "दुनिया की ऊर्जा स्थिर है"। पहली तरह की एक सतत गति मशीन (पेरपेटम मोबाइल) असंभव है। ऊर्जा के विभिन्न रूप कड़ाई से समान मात्रा में एक दूसरे में गुजरते हैं। ऊर्जा न तो उत्पन्न होती है और न ही नष्ट होती है, बल्कि केवल एक प्रणाली से दूसरे तंत्र में प्रवाहित होती है।
 फलन U योगात्मक है। इसका मतलब यह है कि यदि यू 1 और यू 2 के मूल्यों की विशेषता वाली दो प्रणालियों को एक एकल प्रणाली में जोड़ा जाता है, तो परिणामी आंतरिक ऊर्जा यू 1+2 इसके घटक भागों की ऊर्जा के योग के बराबर होगी: यू 1+ 2 = यू 1 + यू 2
फलन U योगात्मक है। इसका मतलब यह है कि यदि यू 1 और यू 2 के मूल्यों की विशेषता वाली दो प्रणालियों को एक एकल प्रणाली में जोड़ा जाता है, तो परिणामी आंतरिक ऊर्जा यू 1+2 इसके घटक भागों की ऊर्जा के योग के बराबर होगी: यू 1+ 2 = यू 1 + यू 2

 सामान्य स्थिति में, ऊष्मा Q प्रक्रिया का एक कार्य है, अर्थात इसकी मात्रा प्रक्रिया के पथ पर निर्भर करती है, लेकिन अभ्यास के लिए महत्वपूर्ण दो मामलों में, ऊष्मा एक राज्य फ़ंक्शन के गुणों को प्राप्त कर लेती है, अर्थात, Q का मान समाप्त हो जाता है प्रक्रिया के पथ पर निर्भर करता है, और यह केवल सिस्टम की प्रारंभिक और अंतिम अवस्थाओं को निर्धारित करता है।
सामान्य स्थिति में, ऊष्मा Q प्रक्रिया का एक कार्य है, अर्थात इसकी मात्रा प्रक्रिया के पथ पर निर्भर करती है, लेकिन अभ्यास के लिए महत्वपूर्ण दो मामलों में, ऊष्मा एक राज्य फ़ंक्शन के गुणों को प्राप्त कर लेती है, अर्थात, Q का मान समाप्त हो जाता है प्रक्रिया के पथ पर निर्भर करता है, और यह केवल सिस्टम की प्रारंभिक और अंतिम अवस्थाओं को निर्धारित करता है।

 हम मानते हैं कि प्रक्रिया के दौरान केवल बाहरी दबाव की ताकतों के खिलाफ काम किया जा सकता है, और उपयोगी कार्य डब्ल्यू = 0: क्यू = डी। यू+पी डी. वी, और चूंकि वी = कास्ट, फिर पी डी। वी = 0: क्यूवी = डी। यू या अभिन्न रूप में: क्यूवी \u003d यूके - यूएन
हम मानते हैं कि प्रक्रिया के दौरान केवल बाहरी दबाव की ताकतों के खिलाफ काम किया जा सकता है, और उपयोगी कार्य डब्ल्यू = 0: क्यू = डी। यू+पी डी. वी, और चूंकि वी = कास्ट, फिर पी डी। वी = 0: क्यूवी = डी। यू या अभिन्न रूप में: क्यूवी \u003d यूके - यूएन

 फिर से हम मानते हैं कि उपयोगी कार्य W = 0, तो: Q = d। यू+पी डी. V, चूँकि P = const, हम लिख सकते हैं: QP = d। यू + डी (पीवी), क्यूपी = डी (यू + पी वी)। निरूपित करें: Н यू + पी वी (एन्थैल्पी) क्यूР = डी। एच या: क्यूपी \u003d एचके - एचएन
फिर से हम मानते हैं कि उपयोगी कार्य W = 0, तो: Q = d। यू+पी डी. V, चूँकि P = const, हम लिख सकते हैं: QP = d। यू + डी (पीवी), क्यूपी = डी (यू + पी वी)। निरूपित करें: Н यू + पी वी (एन्थैल्पी) क्यूР = डी। एच या: क्यूपी \u003d एचके - एचएन
 इस प्रकार, रासायनिक प्रतिक्रिया का ऊष्मीय प्रभाव P = const: QP = H पर एक अवस्था फलन के गुण प्राप्त कर लेता है; वी = कास्ट के लिए: क्यूवी = यू।
इस प्रकार, रासायनिक प्रतिक्रिया का ऊष्मीय प्रभाव P = const: QP = H पर एक अवस्था फलन के गुण प्राप्त कर लेता है; वी = कास्ट के लिए: क्यूवी = यू।
 चूंकि रासायनिक प्रतिक्रियाओं और भौतिक रासायनिक प्रक्रियाओं को अक्सर एक स्थिर दबाव (खुली हवा में, यानी पी = कॉन्स = 1 एटीएम पर) पर किया जाता है, व्यवहार में, एन्थैल्पी की अवधारणा का उपयोग अक्सर आंतरिक के बजाय गणना के लिए किया जाता है। ऊर्जा। कभी-कभी प्रक्रिया के शब्द "गर्मी" को "थैलेपी" द्वारा और स्पष्टीकरण के बिना बदल दिया जाता है, और इसके विपरीत। उदाहरण के लिए, वे कहते हैं "गठन की गर्मी", लेकिन f लिखें। एन।
चूंकि रासायनिक प्रतिक्रियाओं और भौतिक रासायनिक प्रक्रियाओं को अक्सर एक स्थिर दबाव (खुली हवा में, यानी पी = कॉन्स = 1 एटीएम पर) पर किया जाता है, व्यवहार में, एन्थैल्पी की अवधारणा का उपयोग अक्सर आंतरिक के बजाय गणना के लिए किया जाता है। ऊर्जा। कभी-कभी प्रक्रिया के शब्द "गर्मी" को "थैलेपी" द्वारा और स्पष्टीकरण के बिना बदल दिया जाता है, और इसके विपरीत। उदाहरण के लिए, वे कहते हैं "गठन की गर्मी", लेकिन f लिखें। एन।
 लेकिन अगर हमारे लिए ब्याज की प्रक्रिया वी = कॉन्स्ट (एक आटोक्लेव में) पर आगे बढ़ती है, तो अभिव्यक्ति का उपयोग किया जाना चाहिए: क्यूवी = यू।
लेकिन अगर हमारे लिए ब्याज की प्रक्रिया वी = कॉन्स्ट (एक आटोक्लेव में) पर आगे बढ़ती है, तो अभिव्यक्ति का उपयोग किया जाना चाहिए: क्यूवी = यू।

 आइए व्यंजक में अंतर करें: = U + P V d। एच = डी। यू+पीडी. वी + वीडी। पी, निरंतर दबाव वी डी। पी = 0 और डी। एच = डी। यू+पी डी. वी अभिन्न रूप में: एच = यू + पी वी
आइए व्यंजक में अंतर करें: = U + P V d। एच = डी। यू+पीडी. वी + वीडी। पी, निरंतर दबाव वी डी। पी = 0 और डी। एच = डी। यू+पी डी. वी अभिन्न रूप में: एच = यू + पी वी
 एक आदर्श गैस के लिए, क्लैपेरॉन-मेंडेलीव समीकरण मान्य है: P V \u003d n R T, जहां n गैस के मोल की संख्या है, R 8, 314 J / mol K सार्वभौमिक गैस स्थिरांक है। तब (T = const पर) P V = n R T. अंत में, हमें प्राप्त होता है: H = U + n R T n अभिक्रिया के दौरान गैसीय पदार्थों के मोलों की संख्या में परिवर्तन है।
एक आदर्श गैस के लिए, क्लैपेरॉन-मेंडेलीव समीकरण मान्य है: P V \u003d n R T, जहां n गैस के मोल की संख्या है, R 8, 314 J / mol K सार्वभौमिक गैस स्थिरांक है। तब (T = const पर) P V = n R T. अंत में, हमें प्राप्त होता है: H = U + n R T n अभिक्रिया के दौरान गैसीय पदार्थों के मोलों की संख्या में परिवर्तन है।
 उदाहरण के लिए, प्रतिक्रिया के लिए: एन 2 (जी) + 3 एच 2 (जी) \u003d 2 एनएच 3 (जी) एन \u003d -2, और प्रतिक्रिया के लिए: 2 एच 2 ओ (जी) 2 एच 2 (जी) ) + ओ 2 (डी) एन = 3।
उदाहरण के लिए, प्रतिक्रिया के लिए: एन 2 (जी) + 3 एच 2 (जी) \u003d 2 एनएच 3 (जी) एन \u003d -2, और प्रतिक्रिया के लिए: 2 एच 2 ओ (जी) 2 एच 2 (जी) ) + ओ 2 (डी) एन = 3।
 QV और QP के बीच अंतर केवल तभी महत्वपूर्ण होते हैं जब गैसीय पदार्थ प्रतिक्रिया में भाग लेते हैं। यदि कोई नहीं है, या यदि n = 0 है, तो QV = QP।
QV और QP के बीच अंतर केवल तभी महत्वपूर्ण होते हैं जब गैसीय पदार्थ प्रतिक्रिया में भाग लेते हैं। यदि कोई नहीं है, या यदि n = 0 है, तो QV = QP।

 प्रतिक्रिया के थर्मल प्रभाव के तहत गर्मी के रूप में प्रतिक्रिया के दौरान जारी या अवशोषित ऊर्जा की मात्रा को समझें, बशर्ते: पी = कॉन्स या वी = कॉन्स्ट; प्रारंभिक सामग्री का तापमान प्रतिक्रिया उत्पादों के तापमान के बराबर है; कि तंत्र में संकुचन के विस्तार के कार्य को छोड़कर कोई अन्य कार्य (उपयोगी) नहीं किया जाता है।
प्रतिक्रिया के थर्मल प्रभाव के तहत गर्मी के रूप में प्रतिक्रिया के दौरान जारी या अवशोषित ऊर्जा की मात्रा को समझें, बशर्ते: पी = कॉन्स या वी = कॉन्स्ट; प्रारंभिक सामग्री का तापमान प्रतिक्रिया उत्पादों के तापमान के बराबर है; कि तंत्र में संकुचन के विस्तार के कार्य को छोड़कर कोई अन्य कार्य (उपयोगी) नहीं किया जाता है।

 विभिन्न प्रक्रियाओं के दौरान एन्थैल्पी परिवर्तन प्रक्रिया मापन स्थितियां हो, के. जे/मोल सी 2 एच 6 ओ (एल) + 3 ओ 2 (जी) → 2 सीओ 2 (जी) + 3 एच 2 ओ (एल) पी = 1 एटीएम टी = 298 K - 1 370. 68 वियोजन की ऊष्मा: H 2 O(l) → H+ + OH- P = 1 atm T = 298 K +57। 26 उदासीनीकरण की गर्मी: एच+ + ओएच- → एच 2 ओ (एल) पी = 1 एटीएम टी = 298 के - 57. 26 वाष्पीकरण की गर्मी: एच 2 ओ (एल) → एच 2 ओ (जी) पी = 1 एटीएम टी = 373 के+40। 67 संलयन की गर्मी: एच 2 ओ (सीआर) → एच 2 ओ (एल) पी = 1 एटीएम टी = 273 के +6। 02
विभिन्न प्रक्रियाओं के दौरान एन्थैल्पी परिवर्तन प्रक्रिया मापन स्थितियां हो, के. जे/मोल सी 2 एच 6 ओ (एल) + 3 ओ 2 (जी) → 2 सीओ 2 (जी) + 3 एच 2 ओ (एल) पी = 1 एटीएम टी = 298 K - 1 370. 68 वियोजन की ऊष्मा: H 2 O(l) → H+ + OH- P = 1 atm T = 298 K +57। 26 उदासीनीकरण की गर्मी: एच+ + ओएच- → एच 2 ओ (एल) पी = 1 एटीएम टी = 298 के - 57. 26 वाष्पीकरण की गर्मी: एच 2 ओ (एल) → एच 2 ओ (जी) पी = 1 एटीएम टी = 373 के+40। 67 संलयन की गर्मी: एच 2 ओ (सीआर) → एच 2 ओ (एल) पी = 1 एटीएम टी = 273 के +6। 02

 क्यूवी या क्यूपी की स्थिरता का तथ्य, एक विज्ञान के रूप में रासायनिक थर्मोडायनामिक्स के गठन से बहुत पहले, प्रयोगात्मक रूप से जी.आई. हेस द्वारा स्थापित किया गया था (गर्मी रकम की स्थिरता का कानून या हेस का नियम): रासायनिक प्रतिक्रिया का गर्मी प्रभाव निर्भर करता है प्रारंभिक पदार्थों और प्रतिक्रिया उत्पादों का प्रकार और स्थिति और उन्हें एक दूसरे में बदलने के तरीकों पर निर्भर नहीं करता है।
क्यूवी या क्यूपी की स्थिरता का तथ्य, एक विज्ञान के रूप में रासायनिक थर्मोडायनामिक्स के गठन से बहुत पहले, प्रयोगात्मक रूप से जी.आई. हेस द्वारा स्थापित किया गया था (गर्मी रकम की स्थिरता का कानून या हेस का नियम): रासायनिक प्रतिक्रिया का गर्मी प्रभाव निर्भर करता है प्रारंभिक पदार्थों और प्रतिक्रिया उत्पादों का प्रकार और स्थिति और उन्हें एक दूसरे में बदलने के तरीकों पर निर्भर नहीं करता है।
 जर्मन इवानोविच हेस (1802 - 1850) - सबसे बड़े रूसी वैज्ञानिकों में से एक, सेंट पीटर्सबर्ग में तकनीकी संस्थान में प्रोफेसर। जिनेवा में जन्मे, और सेंट पीटर्सबर्ग में कम उम्र से ही पले-बढ़े। उन्होंने युरीव में अपनी चिकित्सा शिक्षा प्राप्त की, विश्वविद्यालय से स्नातक होने के बाद उन्होंने स्टॉकहोम में जे। बर्ज़ेलियस के साथ काम किया। हेस ने अपने प्रयोगों में बहु-ऊष्मीय अनुपातों के नियम को स्थापित करने का प्रयास किया (डी. डाल्टन के बहु-अनुपातों के नियम के समान)। वह इसमें सफल नहीं हुआ (प्रकृति में ऐसा कोई कानून नहीं है), लेकिन प्रयोगात्मक अध्ययनों के परिणामस्वरूप, हेस ने गर्मी रकम (हेस का नियम) की स्थिरता का कानून निकाला। 1842 में प्रकाशित यह कार्य ऊष्मागतिकी के प्रथम नियम की प्रत्याशा है।
जर्मन इवानोविच हेस (1802 - 1850) - सबसे बड़े रूसी वैज्ञानिकों में से एक, सेंट पीटर्सबर्ग में तकनीकी संस्थान में प्रोफेसर। जिनेवा में जन्मे, और सेंट पीटर्सबर्ग में कम उम्र से ही पले-बढ़े। उन्होंने युरीव में अपनी चिकित्सा शिक्षा प्राप्त की, विश्वविद्यालय से स्नातक होने के बाद उन्होंने स्टॉकहोम में जे। बर्ज़ेलियस के साथ काम किया। हेस ने अपने प्रयोगों में बहु-ऊष्मीय अनुपातों के नियम को स्थापित करने का प्रयास किया (डी. डाल्टन के बहु-अनुपातों के नियम के समान)। वह इसमें सफल नहीं हुआ (प्रकृति में ऐसा कोई कानून नहीं है), लेकिन प्रयोगात्मक अध्ययनों के परिणामस्वरूप, हेस ने गर्मी रकम (हेस का नियम) की स्थिरता का कानून निकाला। 1842 में प्रकाशित यह कार्य ऊष्मागतिकी के प्रथम नियम की प्रत्याशा है।
 एच 1 \u003d एच 2 + एच 3 \u003d एच 4 + एच 5 + एच 6
एच 1 \u003d एच 2 + एच 3 \u003d एच 4 + एच 5 + एच 6



 सीओ 2 सी + ओ 2 \u003d सीओ 2 सीओ + 1/2 ओ 2 \u003d सीओ 2 सी + 1/2 ओ 2 \u003d सीओ एच 2 एच 1 सी सीओ एच 3 एच 1 \u003d एच 2 + एच 3
सीओ 2 सी + ओ 2 \u003d सीओ 2 सीओ + 1/2 ओ 2 \u003d सीओ 2 सी + 1/2 ओ 2 \u003d सीओ एच 2 एच 1 सी सीओ एच 3 एच 1 \u003d एच 2 + एच 3

 गठन की गर्मी - साधारण पदार्थों से दिए गए पदार्थ के 1 मोल के गठन का ताप प्रभाव: च। H. साधारण पदार्थ एक ही प्रकार के परमाणुओं से बने पदार्थ कहलाते हैं। यह, उदाहरण के लिए, नाइट्रोजन एन 2, ऑक्सीजन ओ 2, ग्रेफाइट सी, आदि है।
गठन की गर्मी - साधारण पदार्थों से दिए गए पदार्थ के 1 मोल के गठन का ताप प्रभाव: च। H. साधारण पदार्थ एक ही प्रकार के परमाणुओं से बने पदार्थ कहलाते हैं। यह, उदाहरण के लिए, नाइट्रोजन एन 2, ऑक्सीजन ओ 2, ग्रेफाइट सी, आदि है।
 यह परिभाषा से निम्नानुसार है कि पानी के गठन की गर्मी प्रतिक्रिया के थर्मल प्रभाव के बराबर है: एच 2 + 1/2 ओ 2 = एच 2 ओ क्यूपी = एफ। एच
यह परिभाषा से निम्नानुसार है कि पानी के गठन की गर्मी प्रतिक्रिया के थर्मल प्रभाव के बराबर है: एच 2 + 1/2 ओ 2 = एच 2 ओ क्यूपी = एफ। एच
 यदि अभिक्रिया P = 1 atm पर की जाती है, तो अभिक्रिया की मापी गई ऊष्मा f के बराबर होगी। हो पानी के निर्माण की मानक ऊष्मा है। आमतौर पर f का मान। लेकिन व्यवहार में प्रयुक्त लगभग सभी पदार्थों के लिए 298 K पर सारणीबद्ध: f. हो 298 (एच 2 ओ)।
यदि अभिक्रिया P = 1 atm पर की जाती है, तो अभिक्रिया की मापी गई ऊष्मा f के बराबर होगी। हो पानी के निर्माण की मानक ऊष्मा है। आमतौर पर f का मान। लेकिन व्यवहार में प्रयुक्त लगभग सभी पदार्थों के लिए 298 K पर सारणीबद्ध: f. हो 298 (एच 2 ओ)।

 प्रतिक्रिया उत्पाद एच उत्पाद एफ आर एच प्रारंभिक सामग्री एच रेफरी। सी-सी च सरल पदार्थ
प्रतिक्रिया उत्पाद एच उत्पाद एफ आर एच प्रारंभिक सामग्री एच रेफरी। सी-सी च सरल पदार्थ
 एक रासायनिक प्रतिक्रिया का ऊष्मीय प्रभाव: ए 1 ए 1 + ए 2 ए 2 + = बी 1 बी 1 + बी 2 बी 2 + प्रतिक्रिया उत्पादों के गठन की गर्मी के योग के बराबर होता है, जिसमें से गर्मी का योग होता है प्रारंभिक पदार्थों का निर्माण (स्टोइकोमेट्रिक गुणांक एआई और बीजे को ध्यान में रखते हुए):
एक रासायनिक प्रतिक्रिया का ऊष्मीय प्रभाव: ए 1 ए 1 + ए 2 ए 2 + = बी 1 बी 1 + बी 2 बी 2 + प्रतिक्रिया उत्पादों के गठन की गर्मी के योग के बराबर होता है, जिसमें से गर्मी का योग होता है प्रारंभिक पदार्थों का निर्माण (स्टोइकोमेट्रिक गुणांक एआई और बीजे को ध्यान में रखते हुए):
 उदाहरण 1: बेंजीन वाष्प हाइड्रोजनीकरण प्रतिक्रिया के गर्मी प्रभाव की गणना करें (यह प्रतिक्रिया विषम उत्प्रेरक - प्लैटिनम धातुओं की सतह पर की जाती है): सी 6 एच 6 + 3 एच 2 \u003d सी 6 एच 12 298 के और पी \ u003d 1 एटीएम:
उदाहरण 1: बेंजीन वाष्प हाइड्रोजनीकरण प्रतिक्रिया के गर्मी प्रभाव की गणना करें (यह प्रतिक्रिया विषम उत्प्रेरक - प्लैटिनम धातुओं की सतह पर की जाती है): सी 6 एच 6 + 3 एच 2 \u003d सी 6 एच 12 298 के और पी \ u003d 1 एटीएम:
 सी 6 एच 6 (जी) एफ। हो 298, क्यू। जे / एमओएल 82.93 सी 6 एच 6 (जी) 49.04 सी 6 एच 12 (जी) एच 2 -123.10 0 पदार्थ आर। एच 0298 \u003d -123.10 - (82.93 +3 0) \u003d -206.03 के। जे आर। एच 0298 \u003d -123, 10– (49, 04 + 3 0) \u003d -72, 14 के। जे आईएसपी। एच 0 \u003d 82.93 - 49.04 \u003d +33.89 के। जे / मोल
सी 6 एच 6 (जी) एफ। हो 298, क्यू। जे / एमओएल 82.93 सी 6 एच 6 (जी) 49.04 सी 6 एच 12 (जी) एच 2 -123.10 0 पदार्थ आर। एच 0298 \u003d -123.10 - (82.93 +3 0) \u003d -206.03 के। जे आर। एच 0298 \u003d -123, 10– (49, 04 + 3 0) \u003d -72, 14 के। जे आईएसपी। एच 0 \u003d 82.93 - 49.04 \u003d +33.89 के। जे / मोल

 दहन की गर्मी किसी पदार्थ (उच्च आक्साइड के लिए) के गहरे ऑक्सीकरण (दहन) की प्रतिक्रिया का थर्मल प्रभाव है। हाइड्रोकार्बन के मामले में, उच्च ऑक्साइड एच 2 ओ (एल) और सीओ 2 हैं। इस मामले में, उदाहरण के लिए, मीथेन का कैलोरी मान प्रतिक्रिया के थर्मल प्रभाव के बराबर है: सीएच 4 + 2 ओ 2 \ u003d सीओ 2 + 2 एच 2 ओ (एल) क्यूपी \u003d बैल। एच
दहन की गर्मी किसी पदार्थ (उच्च आक्साइड के लिए) के गहरे ऑक्सीकरण (दहन) की प्रतिक्रिया का थर्मल प्रभाव है। हाइड्रोकार्बन के मामले में, उच्च ऑक्साइड एच 2 ओ (एल) और सीओ 2 हैं। इस मामले में, उदाहरण के लिए, मीथेन का कैलोरी मान प्रतिक्रिया के थर्मल प्रभाव के बराबर है: सीएच 4 + 2 ओ 2 \ u003d सीओ 2 + 2 एच 2 ओ (एल) क्यूपी \u003d बैल। एच
 बैल मूल्य। हो 298 को दहन की मानक ऊष्मा कहा जाता है, उन्हें 298 K पर सारणीबद्ध किया जाता है। यहाँ सूचकांक "o" इंगित करता है कि ऊष्मा मानक अवस्था (P \u003d 1 atm) पर निर्धारित की जाती है, सूचकांक "ओह" अंग्रेजी से आता है - ऑक्सीकरण - ऑक्सीकरण।
बैल मूल्य। हो 298 को दहन की मानक ऊष्मा कहा जाता है, उन्हें 298 K पर सारणीबद्ध किया जाता है। यहाँ सूचकांक "o" इंगित करता है कि ऊष्मा मानक अवस्था (P \u003d 1 atm) पर निर्धारित की जाती है, सूचकांक "ओह" अंग्रेजी से आता है - ऑक्सीकरण - ऑक्सीकरण।

 दहन उत्पाद (सीओ 2, एच 2 ओ) ओह। एच रेफरी। इन-इन ओह। एन उत्पाद प्रतिक्रिया उत्पाद आर। एच प्रारंभिक सामग्री
दहन उत्पाद (सीओ 2, एच 2 ओ) ओह। एच रेफरी। इन-इन ओह। एन उत्पाद प्रतिक्रिया उत्पाद आर। एच प्रारंभिक सामग्री
 एक रासायनिक प्रतिक्रिया का ऊष्मीय प्रभाव: ए 1 ए 1 + ए 2 ए 2 + = बी 1 बी 1 + बी 2 बी 2 + प्रारंभिक पदार्थों के दहन की गर्मी के योग के बराबर है, के तापों का योग प्रतिक्रिया उत्पादों का दहन (स्टोइकोमेट्रिक गुणांक एआई और बीजे को ध्यान में रखते हुए):
एक रासायनिक प्रतिक्रिया का ऊष्मीय प्रभाव: ए 1 ए 1 + ए 2 ए 2 + = बी 1 बी 1 + बी 2 बी 2 + प्रारंभिक पदार्थों के दहन की गर्मी के योग के बराबर है, के तापों का योग प्रतिक्रिया उत्पादों का दहन (स्टोइकोमेट्रिक गुणांक एआई और बीजे को ध्यान में रखते हुए):
 उदाहरण 2: पदार्थों के दहन की ऊष्मा का उपयोग करके, ग्लूकोज को किण्वित करके इथेनॉल (वाइन अल्कोहल) के उत्पादन के लिए प्रतिक्रिया के ऊष्मा प्रभाव की गणना करें। सी 6 एच 12 ओ 6 \u003d 2 सी 2 एच 5 ओएच + 2 सीओ 2 आर। एच 0298 \u003d 2815.8 - 2 1366.91 2 ∙ 0 \u003d 81.98 केजे सीओ 2 के दहन की गर्मी शून्य है।
उदाहरण 2: पदार्थों के दहन की ऊष्मा का उपयोग करके, ग्लूकोज को किण्वित करके इथेनॉल (वाइन अल्कोहल) के उत्पादन के लिए प्रतिक्रिया के ऊष्मा प्रभाव की गणना करें। सी 6 एच 12 ओ 6 \u003d 2 सी 2 एच 5 ओएच + 2 सीओ 2 आर। एच 0298 \u003d 2815.8 - 2 1366.91 2 ∙ 0 \u003d 81.98 केजे सीओ 2 के दहन की गर्मी शून्य है।
 ताप क्षमता तापमान पर निर्भर करती है। इसलिए, औसत और वास्तविक ताप क्षमता के बीच अंतर किया जाता है। तापमान रेंज टी 1 - टी 2 में सिस्टम की औसत गर्मी क्षमता इस अंतराल के मूल्य के लिए सिस्टम क्यू को आपूर्ति की गई गर्मी की मात्रा के अनुपात के बराबर है:
ताप क्षमता तापमान पर निर्भर करती है। इसलिए, औसत और वास्तविक ताप क्षमता के बीच अंतर किया जाता है। तापमान रेंज टी 1 - टी 2 में सिस्टम की औसत गर्मी क्षमता इस अंतराल के मूल्य के लिए सिस्टम क्यू को आपूर्ति की गई गर्मी की मात्रा के अनुपात के बराबर है:
 वास्तविक ताप क्षमता समीकरण द्वारा निर्धारित की जाती है: सही और औसत ताप क्षमता के बीच संबंध समीकरण द्वारा व्यक्त किया जाता है:
वास्तविक ताप क्षमता समीकरण द्वारा निर्धारित की जाती है: सही और औसत ताप क्षमता के बीच संबंध समीकरण द्वारा व्यक्त किया जाता है:
 किसी निकाय की ऊष्मा क्षमता उसके द्रव्यमान (या पदार्थ की मात्रा) पर निर्भर करती है, अर्थात यह निकाय का एक व्यापक गुण है। यदि ताप क्षमता को एक द्रव्यमान इकाई के लिए जिम्मेदार ठहराया जाता है, तो एक गहन मूल्य प्राप्त होता है - विशिष्ट ताप क्षमता कोर्ट [J / kg K]। यदि, हालांकि, हम सिस्टम के पदार्थ की मात्रा के लिए C को विशेषता देते हैं, तो हमें मोलर ताप क्षमता सेमी [J / mol K] प्राप्त होती है।
किसी निकाय की ऊष्मा क्षमता उसके द्रव्यमान (या पदार्थ की मात्रा) पर निर्भर करती है, अर्थात यह निकाय का एक व्यापक गुण है। यदि ताप क्षमता को एक द्रव्यमान इकाई के लिए जिम्मेदार ठहराया जाता है, तो एक गहन मूल्य प्राप्त होता है - विशिष्ट ताप क्षमता कोर्ट [J / kg K]। यदि, हालांकि, हम सिस्टम के पदार्थ की मात्रा के लिए C को विशेषता देते हैं, तो हमें मोलर ताप क्षमता सेमी [J / mol K] प्राप्त होती है।
 वहाँ हैं: निरंतर दबाव Cp पर ऊष्मा क्षमता; स्थिर आयतन Cv पर ऊष्मा क्षमता। एक आदर्श गैस के मामले में, ये ऊष्मा क्षमताएं समीकरण द्वारा परस्पर जुड़ी होती हैं: р = С v + R
वहाँ हैं: निरंतर दबाव Cp पर ऊष्मा क्षमता; स्थिर आयतन Cv पर ऊष्मा क्षमता। एक आदर्श गैस के मामले में, ये ऊष्मा क्षमताएं समीकरण द्वारा परस्पर जुड़ी होती हैं: р = С v + R

 पदार्थों की ऊष्मा क्षमता तापमान पर निर्भर करती है। उदाहरण के लिए, बर्फ की गर्मी क्षमता 34.70 J/mol K से 250 K से 37.78 J/mol K 273 K पर भिन्न होती है। ठोस पदार्थों के लिए, डेबी ने एक समीकरण प्राप्त किया, जो 0 K के करीब तापमान के लिए देता है: СV= a T 3 (टी-क्यूब्स का डेबी का नियम), और उच्च के लिए: СV=3 R।
पदार्थों की ऊष्मा क्षमता तापमान पर निर्भर करती है। उदाहरण के लिए, बर्फ की गर्मी क्षमता 34.70 J/mol K से 250 K से 37.78 J/mol K 273 K पर भिन्न होती है। ठोस पदार्थों के लिए, डेबी ने एक समीकरण प्राप्त किया, जो 0 K के करीब तापमान के लिए देता है: СV= a T 3 (टी-क्यूब्स का डेबी का नियम), और उच्च के लिए: СV=3 R।
 आमतौर पर, तापमान पर ताप क्षमता की निर्भरता को रूप के अनुभवजन्य समीकरणों का उपयोग करके प्रेषित किया जाता है: जहां ए, बी और सी स्थिरांक हैं, उन्हें पदार्थों के भौतिक-रासायनिक गुणों की संदर्भ पुस्तकों में दिया गया है।
आमतौर पर, तापमान पर ताप क्षमता की निर्भरता को रूप के अनुभवजन्य समीकरणों का उपयोग करके प्रेषित किया जाता है: जहां ए, बी और सी स्थिरांक हैं, उन्हें पदार्थों के भौतिक-रासायनिक गुणों की संदर्भ पुस्तकों में दिया गया है।
 यदि गणितीय निर्भरता r. टी से सीपी अज्ञात है, लेकिन विभिन्न तापमानों पर प्रतिक्रिया प्रतिभागियों की गर्मी क्षमता के प्रयोगात्मक मूल्य हैं, फिर निर्देशांक आर में एक ग्राफ प्लॉट किया जाता है। कं पी \u003d एफ (टी) और 298 - टी 2 के भीतर वक्र के नीचे के क्षेत्र की रेखांकन की गणना करें, यह अभिन्न के बराबर है:
यदि गणितीय निर्भरता r. टी से सीपी अज्ञात है, लेकिन विभिन्न तापमानों पर प्रतिक्रिया प्रतिभागियों की गर्मी क्षमता के प्रयोगात्मक मूल्य हैं, फिर निर्देशांक आर में एक ग्राफ प्लॉट किया जाता है। कं पी \u003d एफ (टी) और 298 - टी 2 के भीतर वक्र के नीचे के क्षेत्र की रेखांकन की गणना करें, यह अभिन्न के बराबर है:
 यदि विचाराधीन तापमान रेंज में एक या अधिक चरण संक्रमण होते हैं, तो आर की गणना करते समय उनके थर्मल प्रभावों को ध्यान में रखा जाना चाहिए। एच:
यदि विचाराधीन तापमान रेंज में एक या अधिक चरण संक्रमण होते हैं, तो आर की गणना करते समय उनके थर्मल प्रभावों को ध्यान में रखा जाना चाहिए। एच:
 गणना योजना आर. एक मनमाना तापमान T पर H अभिक्रियाएँ इस प्रकार हैं। सबसे पहले, आर की गणना पदार्थों के दहन के गठन या गर्मी के मानक ताप से की जाती है। एच 298 प्रतिक्रिया (जैसा कि ऊपर वर्णित है)। इसके अलावा, किरचॉफ समीकरण के अनुसार, थर्मल प्रभाव की गणना किसी भी तापमान टी पर की जाती है:
गणना योजना आर. एक मनमाना तापमान T पर H अभिक्रियाएँ इस प्रकार हैं। सबसे पहले, आर की गणना पदार्थों के दहन के गठन या गर्मी के मानक ताप से की जाती है। एच 298 प्रतिक्रिया (जैसा कि ऊपर वर्णित है)। इसके अलावा, किरचॉफ समीकरण के अनुसार, थर्मल प्रभाव की गणना किसी भी तापमान टी पर की जाती है:

 सारणियां लगभग सभी पदार्थों के लिए गठन f की मानक ऊष्मा (एंथैल्पी) दिखाती हैं। हो 0 0 K पर और मान: तापमान T पर (उन्हें 100 K के अंतराल के साथ दिया जाता है)।
सारणियां लगभग सभी पदार्थों के लिए गठन f की मानक ऊष्मा (एंथैल्पी) दिखाती हैं। हो 0 0 K पर और मान: तापमान T पर (उन्हें 100 K के अंतराल के साथ दिया जाता है)।
 रासायनिक प्रतिक्रिया के ऊष्मीय प्रभाव की गणना समीकरण द्वारा की जाती है: r। एच 0 टी = आर। एच00+
रासायनिक प्रतिक्रिया के ऊष्मीय प्रभाव की गणना समीकरण द्वारा की जाती है: r। एच 0 टी = आर। एच00+
 आर। एच 00 की गणना उसी तरह की जाती है जैसे आर। एच 0298 यानी, उत्पादों और प्रारंभिक सामग्री के गठन की गर्मी के योग के बीच अंतर के रूप में (लेकिन 0 के पर):
आर। एच 00 की गणना उसी तरह की जाती है जैसे आर। एच 0298 यानी, उत्पादों और प्रारंभिक सामग्री के गठन की गर्मी के योग के बीच अंतर के रूप में (लेकिन 0 के पर):
 मानों की गणना की जाती है: = ठेस रेफरी। इन-इन, प्रतिक्रिया के स्टोइकोमेट्रिक गुणांक को ध्यान में रखते हुए।
मानों की गणना की जाती है: = ठेस रेफरी। इन-इन, प्रतिक्रिया के स्टोइकोमेट्रिक गुणांक को ध्यान में रखते हुए।