Առավել բնորոշ է անուշաբույր ածխաջրածիններին ռեակցիաներ փոխարինում. Այս դեպքում ռեակցիաների արդյունքում էլեկտրոնների անուշաբույր սեքստետը չի քայքայվում։ Հայտնի են նաև ռեակցիաների բազմաթիվ օրինակներ։ արմատական հալոգենացումև օքսիդացումալկիլբենզոլների կողային շղթաներ։ Գործընթացները, որոնցում ոչնչացվում է կայուն անուշաբույր համակարգը, այնքան էլ բնորոշ չեն։
IV.1 Էլեկտրաֆիլ արոմատիկ փոխարինում (seAr)
ԲԱՅՑ. ՄեխանիզմՍ Ե Ar (Փոխարինող էլեկտրոֆիլ Արենեսում)
Էլեկտրաֆիլային փոխարինումը անուշաբույր միջուկում ամենալավ ուսումնասիրված և լայնորեն օգտագործվող օրգանական ռեակցիաներից մեկն է: Ամենից հաճախ էլեկտրոֆիլ փոխարինման վերջնական արդյունքը բուրավետ միջուկում ջրածնի ատոմի փոխարինումն է մեկ այլ ատոմով կամ ատոմների խմբի հետ.
Էլեկտրաֆիլային փոխարինման ռեակցիաները արոմատիկ միջուկում (ինչպես նաև էլեկտրոֆիլ միանալըդեպի C=C կապ) սկսվում են ձևավորմամբ - համալիր - էլեկտրոֆիլ նյութը համակարգված է բենզոլի մոլեկուլի հետ վերջինիս էլեկտրոնային համակարգի շնորհիվ.

Բենզոլային օղակում - համակարգը, լինելով կայուն (կայունացման էներգիա, տես Բաժին II), չի խախտվում այնքան հեշտությամբ, որքան ալկեններում: Հետևաբար, համապատասխան բարդույթը կարող է ֆիքսվել ոչ միայն ֆիզիկաքիմիական մեթոդներով, այլև հատկացված.(ծանոթագրություն 24)
Որպես կանոն, α-համալիրի առաջացման փուլն ընթանում է արագ և ոչ սահմանները արագությունամբողջ գործընթացը։
Այնուհետև, արոմատիկ համակարգը կոտրված է, և առաջանում է էլեկտրոֆիլի կովալենտային կապ բենզոլի օղակի ածխածնի ատոմի հետ: Այս դեպքում կոմպլեքսը վերածվում է կարբոկատիոնի (կարբենիումի իոն), որի դեպքում դրական լիցքը տեղակայվում է դիենային համակարգում, իսկ էլեկտրոֆիլի կողմից հարձակված ածխածնի ատոմը անցնում է sp 2 - մեջ sp 3 հիբրիդային վիճակ. Նման կատիոն կոչվում է - համալիր . Սովորաբար, կրթության փուլ- բարդությունը որոշիչ է. Դրական լիցքի տեղաբաշխումը համալիրում միատեսակ չի իրականացվում հինգ ածխածնի ատոմների միջև, այլ բենզոլի օղակի 2,4,6 դիրքերի շնորհիվ (համեմատեք ալիլ կատիոնի հետ, որտեղ դրական լիցքը բաշխված է 1,3-դիրքեր):

Ալկենների էլեկտրոֆիլ հավելման ժամանակ նույնպես սկզբում ձևավորվում է α-համալիր, որն այնուհետև անցնում է α-համալիրի, սակայն α-համալիրի հետագա ճակատագիրը ալկենների և արենների էլեկտրաֆիլ ռեակցիաների դեպքում տարբեր է։ -Ալկեններից առաջացած բարդույթը կայունանում է տրանս- նուկլեոֆիլի ավելացում; - անուշաբույր համակարգից առաջացած բարդույթը կայունանում է անուշաբույր սեքստետ-էլեկտրոնների վերածնմամբ. (Ծանոթագրություն 25)

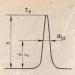
Ստորև ներկայացված է նման ռեակցիայի էներգետիկ պրոֆիլը (Ծանոթագրություն 27) (E a-ն համապատասխան քայլի ակտիվացման էներգիան է).

Եվս մեկ անգամ շեշտում ենք, որ S Е Ar ռեակցիաները, որոնք, ըստ արդյունքի, են փոխարինում, իրականում ըստ մեխանիզմի՝ դրանք ավելացման ռեակցիաներ են, որին հաջորդում է վերացումը.
Բ. Ավելացման կողմնորոշումը մոնոփոխարինված բենզոլներում
Երբ դիտարկվում են էլեկտրոֆիլային փոխարինման ռեակցիաները մոնոփոխարինված բենզոլներում, առաջանում է երկու խնդիր. 1. Նոր փոխարինողը կարող է մտնել օրթո-, մետա- կամ զույգ- պաշտոններ, ինչպես նաև փոխարինել գոյություն ունեցող փոխարինողին (վերջինս, այսպես կոչված ipso փոխարինում , ավելի քիչ տարածված - տես բաժին IV.1.E (նիտրացիա): 2. Փոխարինման արագությունը կարող է ավելի մեծ կամ փոքր լինել, քան բենզոլում փոխարինման արագությունը:
Բենզոլային օղակում առկա փոխարինողի ազդեցությունը կարելի է բացատրել դրա էլեկտրոնային ազդեցության հիման վրա: Այս հիման վրա փոխարինողները կարելի է բաժանել 3 հիմնական խմբի.
1. Փոխարինիչներ, որոնք արագացնում են ռեակցիան՝ համեմատած չփոխարինված բենզոլի հետ ( ակտիվացնելով ) և փոխարինման ուղեցույցներ օրթո ,- զույգ - պաշտոններ.
2. Փոխարինիչներ, որոնք դանդաղեցնում են ռեակցիան ( ապաակտիվացում ) և փոխարինման ուղեցույցներ օրթո,-պարա- դիրքեր .
3. Փոխարինիչներ, որոնք դանդաղեցնում են ռեակցիան ( ապաակտիվացում ) և փոխարինման ուղեցույցներ մետա - դրույթներ.
Փոխարինիչներ նշված p.p. 1.2 ( ortho-, para-orientators ) կոչվում են 1-ին տեսակի փոխարինողներ ; նշված է 3-րդ կետում ( մետա կողմնորոշիչներ ) - երկրորդ տեսակի փոխարինիչներ . Ստորև տրված է սովորաբար հանդիպող փոխարինիչների նշանակումը՝ ըստ դրանց էլեկտրոնային էֆեկտների:
Ակնհայտ է, որ տեղի կունենա էլեկտրոֆիլային փոխարինում որքան արագ, այնքան ավելի շատ էլեկտրոն նվիրաբերող փոխարինող միջուկում, և որքան դանդաղ է, այնքան ավելի շատ էլեկտրոններ քաշող փոխարինող միջուկում.
Բացատրության համար կողմնորոշումփոխարինում, հաշվի առնենք հարձակման տակ գտնվող համալիրների կառուցվածքը օրթո-, մետա- և զույգ- մոնոփոխարինված բենզոլի դիրքերը (ինչպես արդեն նշվել է, կոմպլեքսների ձևավորումը սովորաբար էլեկտրոֆիլ փոխարինման արագությունը որոշող քայլ է, հետևաբար, դրանց ձևավորման հեշտությունը պետք է որոշի տվյալ դիրքում փոխարինման հեշտությունը).

Եթե Z խումբը էլեկտրոնի դոնոր է (լինի ինդուկտիվ, թե մեզոմեր), ապա ժամը օրթո- կամ զույգ-հարձակում, այն կարող է անմիջականորեն ներգրավվել համալիրում դրական լիցքի տեղակայման մեջ (III, IV, VI, VII կառուցվածքներ): Եթե Z-ը էլեկտրոն ընդունող է, ապա այդ կառուցվածքները կլինեն էներգետիկ առումով անբարենպաստ (էլեկտրոն քաշող փոխարինողի հետ կապված ածխածնի ատոմի վրա մասնակի դրական լիցքի առկայության պատճառով), և այս դեպքում նախընտրելի է մետա-հարձակումը. որոնք նման կառույցներ չեն առաջանում։
Վերոնշյալ բացատրությունը տրվում է այսպես կոչվածի հիման վրա դինամիկ ազդեցություն , այսինքն. Էլեկտրոնների խտության բաշխումները արձագանքող մոլեկուլում: Մոնոփոխարինված բենզոլներում էլեկտրոֆիլ փոխարինման կողմնորոշումը կարող է բացատրվել նաև դիրքից. ստատիկ էլեկտրոնային էֆեկտներ - էլեկտրոնի խտության բաշխումը չհակազդող մոլեկուլում. Էլեկտրոնների խտության տեղաշարժը բազմաթիվ կապերի վրա դիտարկելիս կարելի է տեսնել, որ էլեկտրոն նվիրաբերող փոխարինողի առկայության դեպքում ամենից շատ. ավելացել էէլեկտրոնի խտությունը օրթո- և զույգ- դիրքերը, իսկ էլեկտրոնները հանող փոխարինողի առկայության դեպքում այս դիրքերը ամենաշատն են սպառվածէլեկտրոններ:

Հալոգենները հատուկ դեպք են. լինելով բենզոլի միջուկի փոխարինիչներ՝ նրանք ապաակտիվացնում են այն էլեկտրոֆիլ փոխարինման ռեակցիաներում, սակայն դրանք օրթո-, զույգ- կողմնորոշիչներ. Ապաակտիվացումը (էլեկտրոֆիլների հետ ռեակցիայի արագության նվազում) պայմանավորված է նրանով, որ, ի տարբերություն այլ խմբերի, որոնք ունեն ոչ կիսված էլեկտրոնային զույգեր (օրինակ՝ -OH, -NH 2 և այլն), որոնք ունեն դրական մեզոմերիկ (+M) և բացասական. ինդուկտիվ էֆեկտ (-I), հալոգենները բնութագրվում են ինդուկտիվ էֆեկտի գերակշռությամբ մեզոմերականի նկատմամբ (+ M< -I).(прим.30)

Միաժամանակ հալոգենի ատոմներն են օրթո, զույգ- կողմնորոշիչներ, քանի որ նրանք ի վիճակի են դրական մեզոմերային էֆեկտի շնորհիվ մասնակցել ընթացքում ձևավորված համալիրում դրական լիցքի տեղակայմանը. օրթո- կամ զույգ- հարձակվել (վերը նշված սխեմայով IV, VII կառուցվածքները) և դրանով իսկ նվազեցնել դրա ձևավորման էներգիան:
Եթե բենզոլի միջուկը ունի ոչ թե մեկ, այլ երկու փոխարինող, ապա նրանց կողմնորոշիչ գործողությունը կարող է համընկնել ( համաձայնեցված կողմնորոշում ) թե չհամընկնել ( անհամապատասխան կողմնորոշում ): Առաջին դեպքում կարելի է հույս դնել որոշ կոնկրետ իզոմերների գերակշռող առաջացման վրա, իսկ երկրորդում կստացվեն բարդ խառնուրդներ (Ծանոթագրություն 31):
Ստորև բերված են երկու փոխարինողների համակարգված կողմնորոշման օրինակներ. երրորդ փոխարինողի արտոնյալ մուտքի վայրը ցուցադրվում է սլաքով:

Բենզոլի պահանջարկը որոշվում է այն սպառող արդյունաբերության զարգացմամբ: Բենզոլի կիրառման հիմնական ոլորտներն են էթիլբենզոլի, կումենի և ցիկլոհեքսանի և անիլինի արտադրությունը։
Առավել լայնորեն օգտագործվող բենզոլի ռեակցիան ջրածնի մեկ կամ մի քանի ատոմների փոխարինումն է էլեկտրոֆիլ խմբով։ Այս կերպ սինթեզվում են շատ կարևոր նյութեր։ Ֆունկցիոնալ խմբերի ընտրությունը, որոնք, այսպիսով, կարող են ներառվել արոմատիկ միացությունների մեջ, շատ լայն է, և ի լրումն, այդ խմբերից մի քանիսը կարող են փոխակերպվել այլ խմբերի բենզոլային օղակի մեջ մտնելուց հետո: Ընդհանուր ռեակցիայի հավասարումը հետևյալն է.
Ստորև ներկայացված են այս տեսակի հինգ ամենատարածված ռեակցիաները և դրանց օգտագործման օրինակները:
Նիտրացիա:

Սուլֆոնացիա:
Dkylation ըստ Friedel-Crafts.
Friedel-Crafts ացիլացիա.
Հալոգենացում (միայն քլորացում և բրոմացում).

Հետևյալ ռեակցիաները հաճախ օգտագործվում են անուշաբույր էլեկտրոֆիլային փոխարինման արդյունքում առաջացող միացությունների հետագա փոխակերպման համար.
Կողային շղթայի վերականգնում.

Նիտրո խմբի վերականգնում.

Դիազոտիզացիա և հետագա փոխակերպումներ
Անիլինը և դրա փոխարինողը կարող են վերածվել բարձր ռեակտիվ միացությունների, որոնք կոչվում են դիազոնիումի աղեր.

Դիազոնիումի աղերը ծառայում են որպես մեկնարկային նյութեր անուշաբույր միացությունների լայն տեսականի սինթեզի համար (սխեմա 9-1): Շատ դեպքերում դիազոնիումի աղերի միջոցով սինթեզի մեթոդը միակ միջոցն է ցանկացած ֆունկցիոնալ խումբ անուշաբույր միացության մեջ ներմուծելու համար։
Դիազոնիումի խմբի փոխարինումը քլորի և բրոմի ատոմներով, ինչպես նաև ցիանո խմբով ձեռք է բերվում դիազոնիումի աղերի փոխազդեցությամբ պղնձի աղերի հետ (1)։ Յոդի և ֆտորի ատոմները չեն կարող ներթափանցվել արոմատիկ օղակի մեջ ուղղակի հալոգենացման միջոցով: Արոմատիկ յոդիդները և ֆտորիդները ստացվում են դիազոնիումի աղերը համապատասխանաբար կալիումի յոդիդով և հիդրոբորաթթվով մշակելով։
Անուշաբույր կարբոքսիլաթթուները կարող են ստացվել կա՛մ նիտրիլային խմբի հիդրոլիզով, կա՛մ ածխածնի երկօքսիդի ազդեցությամբ Grignard ռեագենտի վրա (այս ռեակցիայի մասին ավելին կքննարկվի 12-րդ գլխում): Ֆենոլները լաբորատորիայում առավել հաճախ ստանում են դիազոնիումի աղերի հիդրոլիզով։

Դիագրամ 9-2. Դիազոնիումի աղերի ռեակցիաները
Դիազոնիումի խումբը (հետևաբար նաև ամինո խումբը և նիտրո խումբը) կարող է հեռացվել (այսինքն՝ փոխարինվել ջրածնի ատոմով) դիազոնիումի աղերը հիպոֆոսֆորային թթուով մշակելու միջոցով։
Վերջապես, դիազոնիումի աղերի փոխազդեցությունը ակտիվացված անուշաբույր միացությունների հետ հանգեցնում է ազո ներկերի առաջացմանը։ Ներկանյութերը կարող են լինել շատ տարբեր գույների՝ կախված երկու անուշաբույր օղակների փոխարինիչների բնույթից:
Ազոտային թթուն, որն օգտագործվում է դիազոնիումի աղերի պատրաստման համար, ցածր կայուն նյութ է և պատրաստվում է տեղում (այսինքն՝ անմիջապես ռեակցիայի անոթում) նատրիումի նիտրիտից և աղաթթվից։ Ռեակցիայի սխեմայում ազոտային թթուով բուժումը կարող է ցուցադրվել երկու եղանակներից մեկով, որոնք կիրառվում են ստորև.

Ահա դիազոնիումի աղերի ռեակցիաների մի քանի օրինակ.

Էլեկտրաֆիլական փոխարինման ռեակցիաների միջոցով գործնականում կարևոր նյութերի ստացում
Ներկանյութեր.Մեթիլ նարնջի սինթեզը ներկայացված է ստորև։ Եթե բնօրինակ միացությունները վերցնեք այլ փոխարինիչներով անուշաբույր օղակների մեջ, ապա ներկի գույնը տարբեր կլինի:

Պոլիմերներ.Պոլիստիրոլը ստացվում է ստիրոլի պոլիմերացման արդյունքում (տես գլ. 6), որն, իր հերթին, կարող է սինթեզվել հետևյալ կերպ. Բենզոլը ացիլացվում է ըստ Friedel-Crafts-ի՝ օգտագործելով քացախաթթու անհիդրիդ՝ ացետիլքլորիդի փոխարեն, ստացված կետոնը վերածվում է ալկոհոլի, որն այնուհետև ջրազրկվում է՝ օգտագործելով կալիումի ջրածնի սուլֆատը՝ որպես թթվային կատալիզատոր.

Դեղորայք.սուլֆանիլամիդի (streptocide) սինթեզում առաջին երկու քայլերը ռեակցիաներ են, որոնց մենք արդեն հանդիպել ենք: Երրորդ փուլը ամինախմբի պաշտպանությունն է։ Սա անհրաժեշտ է կանխելու համար քլորոսուլֆոնաթթվի փոխազդեցությունը ամինային խմբի հետ: Այն բանից հետո, երբ խումբը արձագանքեց ամոնիակով, պաշտպանիչ խումբը կարող է հեռացվել:

Streptocid-ը սուլֆոնամիդների խմբի առաջին հակամանրէային միջոցներից էր: Այն կիրառվում է նույնիսկ հիմա։
Էլեկտրաֆիլային փոխարինման ռեակցիաները թույլ են տալիս բազմաթիվ տարբեր խմբերի ներմուծել արոմատիկ օղակ: Այդ խմբերից շատերը կարող են հետագայում փոխակերպվել սինթեզի ընթացքում:
Արոմատիկ էլեկտրոֆիլ փոխարինման մեխանիզմ
Հաստատվել է, որ անուշաբույր միացություններում էլեկտրոֆիլ փոխարինումն ընթանում է երկու փուլով. Նախ, բենզոլային օղակին կցվում է էլեկտրոֆիլ (որը կարող է առաջանալ տարբեր մեթոդներով): Այս դեպքում ձևավորվում է ռեզոնանսային կայունացված ածխաջրածին կատիոն (ներքևում` փակագծերում): Այնուհետև այս կատիոնը կորցնում է պրոտոնը և վերածվում անուշաբույր միացության:

Այստեղ, պարզության համար, արոմատիկ միացությունների բանաձևերը ցուցադրվում են կրկնակի կապերով։ Բայց դուք, իհարկե, հիշում եք, որ իրականում գոյություն ունի տեղայնացված էլեկտրոնների ամպ:
Ստորև ներկայացված են երկու ռեակցիաների մեխանիզմները, ներառյալ էլեկտրոֆիլների առաջացման քայլը: Հաոգենացում
Էլեկտրաֆիլային սերունդ.
Փոխարինում.

Friedel-Crafts acylation Էլեկտրաֆիլային սերունդ.

Փոխարինում.

Պատգամավորների ազդեցությունը
Երբ փոխարինված բենզոլը փոխազդում է էլեկտրոֆիլի հետ, բենզոլային օղակի վրա արդեն առկա փոխարինողի կառուցվածքը էական ազդեցություն ունի փոխարինման կողմնորոշման և դրա արագության վրա:

Ըստ էլեկտրոֆիլ փոխարինման արագության և կողմնորոշման վրա ունեցած ազդեցության՝ բոլոր հնարավոր փոխարինիչները կարելի է բաժանել երեք խմբի.
1. Օրթոպարա-օրիենտանտների ակտիվացում. Անուշաբույր միացության մեջ այս խմբի փոխարինողի առկայության դեպքում այն ավելի արագ է արձագանքում, քան չփոխարինված բենզոլը, և էլեկտրոֆիլն ուղղվում է դեպի օրթո, իսկ պարա դիրքերը՝ փոխարինողին և առաջանում է օրթո և պարա դիփոխարինված բենզոլների խառնուրդ։ Այս խումբը ներառում է հետևյալ փոխարինիչները.

2. Ապաակտիվացնելով մետա-կողմնորոշող գործակալները: Այս փոխարինիչները դանդաղեցնում են ռեակցիան՝ համեմատած բենզոլի հետ և ուղղորդում էլեկտրոֆիլին դեպի մետա դիրք։ Այս խումբը ներառում է.
3. Օրթո-, պարաորոշիչների ապաակտիվացում: Այս խումբը ներառում է ալոգենների ատոմներ։
Էլեկտրաֆիլային փոխարինման կողմնորոշման օրինակներ.


Փոխարինիչների ազդեցության բացատրություն
Ինչո՞ւ են տարբեր փոխարինիչներ այդքան տարբեր ազդեցություն ունենում էլեկտրոֆիլ փոխարինման բնույթի վրա: Այս հարցի պատասխանը կարելի է ստանալ՝ վերլուծելով յուրաքանչյուր դեպքում ձևավորված միջանկյալ նյութերի կայունությունը։ Այս միջանկյալ կարբոկատիոններից մի քանիսը կլինեն ավելի կայուն, մյուսները՝ ավելի քիչ կայուն: Հիշեք, որ եթե միացությունը կարող է արձագանքել մեկից ավելի ձևերով, ռեակցիան կանցնի այն ճանապարհով, որն արտադրում է ամենակայուն միջանկյալ նյութը:
Ստորև ներկայացված են միջանկյալ մասնիկների ռեզոնանսային կառուցվածքները, որոնք ձևավորվել են կատիոնի էլեկտրոֆիլային հարձակման ժամանակ ֆենոլի օրթո-մետա և պարա-դիրքերում, որն ունի հզոր ակտիվացնող փոխարինող՝ օրթո, պարաուղղորդող, տոլուոլ, որն ունի փոխարինող։ նույն, բայց շատ ավելի քիչ արտահայտված հատկությունները և նիտրոբենզոլը, որը հասանելի է, որտեղ նիտրո խումբը մեգդ կողմնորոշիչ է և անջատում է օղակը.

Երբ էլեկտրոֆիլը հարձակվում է ֆենոլի և՛ օրթո, և՛ պարա դիրքերում, ստացված միջանկյալ նյութի համար կարող են գրվել ավելի շատ ռեզոնանսային կառուցվածքներ, քան մետա փոխարինման ժամանակ միջանկյալի համար: Ընդ որում, այս «լրացուցիչ» կառուցվածքը (շրջանված վանդակում) առանձնապես մեծ ներդրում ունի
կատիոնի կայունացման մեջ, քանի որ դրանում բոլոր ատոմներն ունեն էլեկտրոնների օկտետ: Այսպիսով, էլեկտրոֆիլի հարձակման օրթո- կամ պարա-կողմնորոշման ժամանակ հայտնվում է ավելի կայուն կատիոն, քան մետա-դիրքի հարձակման ժամանակ, հետևաբար, փոխարինումը տեղի է ունենում հիմնականում օրթո- և պարա-դիրքերում: Քանի որ նման փոխարինումից առաջացող կատիոնն ավելի կայուն է, քան չփոխարինված բենզոլից առաջացած կատիոնը, ֆենոլը շատ ավելի հեշտ է մտնում էլեկտրոֆիլ փոխարինման ռեակցիաների մեջ, քան բենզոլը։ Նկատի ունեցեք, որ բոլոր փոխարինիչները, որոնք ուժեղ կամ չափավոր ակտիվացնում են անուշաբույր օղակը էլեկտրոֆիլ փոխարինման ռեակցիաներում, օղակին կցված է մեկ միայնակ ատոմ: Այս էլեկտրոնները կարող են սնվել օղակի մեջ: Այս դեպքում էլեկտրաբացասական ատոմի (թթվածին կամ ազոտ) վրա դրական լիցքով առաջանում է ռեզոնանսային կառուցվածք։ Այս ամենը կայունացնում է միջանկյալը և մեծացնում ռեակցիայի արագությունը (ռեզոնանսային ակտիվացում):
Տոլուոլի դեպքում և՛ օրթո- և՛ d- դիրքերում փոխարինումը հանգեցնում է ավելի կայուն կատիոնի, քան երբ էլեկտրոֆիլը հարձակվում է մետա դիրքում:

Արկղային ռեզոնանսային կառուցվածքներում դրական լիցքը գտնվում է երրորդական ածխածնի ատոմների վրա (երրորդականը կարբոկացիայով, տես Գլուխ 5): Երբ հարձակվում են մետա դիրքում, երրորդական կարբոկացիա չի առաջանում: Այստեղ կրկին օրթո- և պարա-փոխարինումը անցնում է մի փոքր ավելի կայուն միջանկյալ տեսակների միջով, քան մետա-փոխարինումը և բուն բենզոլում փոխարինումը: Հետևաբար, տոլուոլի փոխարինումն ուղղված է դեպի օրթո և պարա դիրքերը և մի փոքր ավելի արագ է ընթանում, քան փոխարինումը Լիզոլում (ակտիվացում ինդուկտիվ էֆեկտի շնորհիվ):
Բոլոր ապաակտիվացնող խմբերը, ներառյալ նիտրո խումբը, ունեն բուրմունքի օղակից էլեկտրոններ հանելու հատկություն: Սրա արդյունքը միջանկյալ կատիոնի ապակայունացումն է։ Հատկապես

(սեղմեք սկանը դիտելու համար)
միջանկյալ նյութերը, որոնք առաջանում են օրթո և պարա դիրքերում հարձակման ժամանակ, խիստ ապակայունացված են, քանի որ մասնակի դրական լիցքը գտնվում է անմիջապես նիտրո խմբի կողքին (համապատասխան ռեզոնանսային կառուցվածքները շրջապատված են): Հետևաբար, մետա-փոխարինումը գերադասելի է օրթո- և պարա-փոխարինման փոխարեն: Նիտրոբենզոլը ենթարկվում է էլեկտրոֆիլային փոխարինման շատ ավելի դժվարին, քան բենզոլը, քանի որ օղակում էլեկտրոնի խտությունը նվազում է, իսկ անուշաբույր օղակի և էլեկտրոֆիլի փոխադարձ ձգողականությունը թուլանում է։

Էլեկտրաֆիլային հավելման ռեակցիաներն ընթանում են երկու փուլով՝ միջանկյալ կատիոնի ձևավորմամբ։ Բենզոլային օղակի տարբեր փոխարինիչներ տարբեր ազդեցություն ունեն փոխարինման արագության և կողմնորոշման վրա: Այս ազդեցությունը կարելի է բացատրել՝ հաշվի առնելով յուրաքանչյուր դեպքում ձևավորված միջանկյալ նյութերի կայունությունը։

Կենտրոնացված ազոտական թթվի կամ խտացված ազոտական և ծծմբական թթուների խառնուրդի (նիտրացնող խառնուրդ) ազդեցության տակ բենզոլի օղակի ջրածնի ատոմները փոխարինվում են նիտրոխմբով.
նիտրոբենզոլ
Նիտրացմանը նախորդում է էլեկտրոֆիլ ռեագենտի առաջացումը ՈՉ 2 - նիտրոնի կատիոն.
Բենզոլի նիտրացման ռեակցիայի մեջ նիտրացնող խառնուրդով նիտրոնիումի կատիոն (ՈՉ 2 ) ձևավորվել է ազոտական թթվի պրոտոնացիայով՝ խտացված ծծմբաթթվի առկայությամբ.

Հետագա նիտրացումը դժվար է, քանի որ նիտրո խումբը երկրորդ տեսակի փոխարինող է և դժվարացնում է էլեկտրոֆիլ ռեակտիվների հետ ռեակցիաները.

նիտրոբենզոլ 1,3-դինիտրոբենզոլ 1,3,5-տրինիտրոբենզոլ
Բենզոլի հոմոլոգները (տոլուոլ, քսիլեն) նիտրատվում են ավելի հեշտ, քան բենզոլը, քանի որ ալկիլային խմբերը առաջին տեսակի փոխարինիչներ են և հեշտացնում են ռեակցիաները էլեկտրոֆիլ ռեակտիվների հետ.
1,3,5-տրինիտրոբենզոլ

տոլուոլ օրթո-նիտրոտոլուեն պարա-նիտրոտոլուեն

1,3,5-տրինիտրոբենզոլ


1.2. Սուլֆոնացման ռեակցիաներ.
Երբ բենզոլը և նրա հոմոլոգները մշակվում են խտացված ծծմբաթթվով կամ ծծմբի եռօքսիդով, բենզոլի միջուկում ջրածնի ատոմները փոխարինվում են սուլֆո խմբով.

բենզոլսուլֆոնաթթու
ռեակցիայի մեխանիզմ
Սուլֆոնացիան նախորդում է էլեկտրոֆիլ ռեագենտի ձևավորումը HSO + 3 - հիդրոսուլֆոնիումի իոն:
3H 2 SO 4 → H 3 O + + HSO + 3 + 2HSO - 4
π-complex σ-complex
H + + HSO - 4 → H 2 SO 4
Էլ ավելի ակտիվ էլեկտրոֆիլ ռեագենտ է ծծմբի եռօքսիդ, որի դեպքում ծծմբի ատոմի վրա առկա է էլեկտրոնային խտության դեֆիցիտ.

σ-բարդ
երկբևեռ իոն

Բենզոլի հոմոլոգները ավելի հեշտ են սուլֆոնացվում, քան բենզինը, քանի որ ալկիլային խմբերը առաջին տեսակի փոխարինիչներ են և հեշտացնում են ռեակցիաները էլեկտրոֆիլ ռեակտիվների հետ.

1.3. հալոգենացման ռեակցիաներ.
Լյուիս թթվային կատալիզատորների առկայության դեպքում (AlCl 3 ; ԱլԲր 3 ; FeCl 3 ; փետր 3 ; ZnCl 2 ) սենյակային ջերմաստիճանում բենզոլի օղակի ջրածնի ատոմները փոխարինվում են հալոգենի ատոմներով.

Ավելին, քլորը անուշաբույր միջուկում ավելի ակտիվորեն փոխարինում է ջրածնին, քան բրոմը, և գործնականում անհնար է իրականացնել արենների յոդացում և ֆտորացում՝ յոդի անբավարար ակտիվության և ֆտորի ավելորդ ակտիվության պատճառով։
Կատալիզատորի դերը կա՛մ դրական հալոգեն իոն կամ հալոգեն-Լյուիս թթու համալիր ձևավորելն է՝ հալոգեն-հալոգեն կապի բևեռացումով.
1) դրական հալոգեն իոնի ձևավորում.

2) հալոգենի համալիրի առաջացում Լյուիս թթվի հետ հալոգեն-հալոգեն կապի բևեռացումով.

Հետագա հալոգենացումը դժվար է, քանի որ հալոգենները խանգարում են ռեակցիաներին էլեկտրոֆիլ ռեակտիվների հետ, բայց դրանք օրթո- և պարա-կողմնորոշիչներ են.

բրոմոբենզոլ 1,2-դիբրոմոբենզոլ 1,4-դիբրոմոբենզոլ
Բենզոլի հոմոլոգները հալոգենացվում են ավելի հեշտ, քան բենզոլը, քանի որ ալկիլային խմբերն առաջին տեսակի փոխարինիչներ են և հեշտացնում են ռեակցիաները էլեկտրոֆիլ ռեակտիվների հետ.

տոլուոլ օրթո-քլորոտոլուոլ պարա-քլորոտոլուոլ
Էլեկտրաֆիլային փոխարինման ռեակցիաները ավելի դժվար են, քան բենզոլինը, ինչը պայմանավորված է նիտրո խմբի էլեկտրոնների հեռացման ուժեղ ազդեցությամբ։ Փոխարինումը տեղի է ունենում մետա դիրքում, քանի որ նիտրո խումբը երկրորդ տեսակի կողմնորոշիչ է (S E 2 arom):
Հետևաբար, էլեկտրոֆիլային փոխարինման ռեակցիաները կատարվում են միայն ուժեղ ռեակտիվներով (նիտրացիա, սուլֆոնացում, հալոգենացում) ավելի խիստ պայմաններում.

Նուկլեոֆիլային փոխարինման ռեակցիաներ
Նուկլեոֆիլ փոխարինման ռեակցիաներում (S N 2 arom) նիտրո խումբն ուղղորդում է նուկլեոֆիլին դեպի օրթո և պարա դիրքեր։
Օրինակ, նիտրոբենզոլի միաձուլումը KOH-ի հետ 100 0 C ջերմաստիճանում հանգեցնում է օրթո- և պարա-նիտրոֆենոլների արտադրությանը.

Օրթո դիրքի վրա հարձակումն ավելի նախընտրելի է, քանի որ նիտրո խմբի բացասական ինդուկտիվ ազդեցությունը, որը գործում է փոքր հեռավորության վրա, ստեղծում է էլեկտրոնների ավելի մեծ պակաս օրթո, քան պարա դիրքում:
Երկու և հատկապես երեք նիտրո խմբերի առկայությունը միմյանց նկատմամբ մետա դիրքում ավելի է նպաստում նուկլեոֆիլ ռեակտիվների հետ ռեակցիաներին:
Այսպիսով, օրինակ, երբ մետա-դինիտրոբենզոլը փոխազդում է ալկալիի կամ նատրիումի ամիդի հետ, ջրածնի ատոմներից մեկը օրթո կամ պարա դիրքերում փոխարինվում է խմբի կողմից. Օ,կամ ժամը ՆՀ 2 :

2,4-դինիտրոֆենոլ

2,6-դինիտրոանիլին
Սիմետրիկ տրինիտրոբենզոլը փոխազդում է ալկալիների հետ՝ առաջացնելով պիկրաթթու.

2,4,6-տրինիտրոֆենոլ
պիկրին թթու
Նիտրո խմբի ազդեցությունը ռեակտիվության վրա
այլ խմբեր բենզոլային ռինգում
Նիտրո խմբի նուկլեոֆիլային փոխարինում
Եթե նիտրո խմբերը միմյանց նկատմամբ գտնվում են օրթո- և պարա-դիրքերում, ապա դրանք ակտիվացնում են միմյանց, և նիտրիտային իոնի հեռացմամբ հնարավոր է նիտրո խմբի նուկլեոֆիլ փոխարինում.


Հալոգենների և այլ խմբերի նուկլեոֆիլային փոխարինում
Նիտրո խումբն ակտիվացնում է նուկլեոֆիլ փոխարինումը ոչ միայն ջրածնի ատոմի, այլ նաև բենզոլային օղակում գտնվող այլ խմբերի, որոնք գտնվում են նիտրո խմբի նկատմամբ օրթո և պարա դիրքերում:
Հալոգենի ատոմները՝ -OH, -OR, -NR 2 և այլ խմբեր հեշտությամբ փոխարինվում են նուկլեոֆիլներով։
Նիտրո խմբի դերը ոչ միայն փոխարինող խմբի հետ կապված ածխածնի ատոմի վրա դրական լիցք ստեղծելն է, այլև բացասական ϭ-համալիրը կայունացնելը, քանի որ. Նիտրո խումբը նպաստում է բացասական լիցքի տեղակայմանը:
Օրինակ, օրթո- և պարա-նիտրոքլորբենզոլներում հալոգենը, նիտրո խմբի ազդեցության տակ, հեշտությամբ փոխարինվում է նուկլեոֆիլ մասնիկներով.


:Nu: -- = ՆԱ -- , ՆՀ 2 -- , Ի -- , -- OCH 3
Երկու և հատկապես երեք նիտրո խմբերի առկայությունը արագացնում է նուկլեոֆիլային փոխարինումը, և դա առավել ցայտուն է այն դեպքերում, երբ նիտրո խմբերը գտնվում են փոխարինվող խմբի համեմատ օրթո կամ պարա դիրքում.

2,4-դինիտրոքլորբենզոլ
Հալոգենի ատոմը ամենահեշտ փոխարինվում է 2,4,6-տրինիտրոքլորբենզոլով (պիկրիլ քլորիդ).

2,4,6-տրինիտրոքլորբենզոլ
(պիկրիլ քլորիդ)
Ջրածնի ատոմների շարժունակության հետ կապված ռեակցիաներ
ալկիլային ռադիկալներ
Էլեկտրոններ քաշող խիստ արտահայտված բնույթի շնորհիվ նիտրո խումբը զգալի ազդեցություն ունի իր նկատմամբ օրթո և պարա դիրքերում գտնվող ալկիլ ռադիկալների ջրածնի ատոմների շարժունակության վրա։
ա) խտացման ռեակցիաներ ալդեհիդների հետ
Պարա-նիտրոտոլուենում մեթիլ խմբի ջրածնի ատոմները նիտրո խմբի ազդեցությամբ ձեռք են բերում բարձր շարժունակություն և, արդյունքում, պարանիտրոտոլուենը մտնում է խտացման ռեակցիաների մեջ ալդեհիդների հետ՝ որպես մեթիլենի բաղադրիչ.

բ) ազոտաթթուների առաջացումը
Ջրածնի ատոմները α-ածխածնի ատոմում, ϭ,π-կոնյուգացիայի շնորհիվ, ունեն բարձր շարժունակություն և կարող են գաղթել դեպի նիտրո խմբի թթվածին տաուտոմերային ազոտաթթվի ձևավորմամբ։
Նիտրոնային թթուների ձևավորումը անուշաբույր նիտրոմիացություններում օղակում նիտրո խմբի հետ կապված է բենզոլային օղակը քինոիդ կառուցվածքի վերածելու հետ.
Օրինակ, օրթո-նիտրոտոլուենը ցուցադրում է ֆոտոքրոմիզմ. ձևավորվում է վառ կապույտ ազոտաթթու (քվինոիդային կառուցվածքները հաճախ ինտենսիվ գունավորվում են.

ortho-nitrotoluene nitronic թթու
Էլեկտրաֆիլային փոխարինումը, անկասկած, արոմատիկ միացությունների ռեակցիաների ամենակարևոր խումբն է։ Դժվար թե կա ռեակցիաների որևէ այլ դաս, որն այսքան մանրամասնորեն, խորությամբ և համապարփակ ուսումնասիրված լինի և՛ մեխանիզմի, և՛ օրգանական սինթեզում կիրառման տեսակետից։ Հենց էլեկտրոֆիլ արոմատիկ փոխարինման ոլորտում առաջին անգամ դրվեց կառուցվածքի և ռեակտիվության փոխհարաբերության խնդիրը, որը ֆիզիկական օրգանական քիմիայի ուսումնասիրության հիմնական առարկան է։ Ընդհանուր առմամբ, անուշաբույր միացությունների այս տեսակի ռեակցիաները կարող են ներկայացվել հետևյալ կերպ.
ԱրԷ+Հ+
1. Գրականության ակնարկ
1.1 Էլեկտրաֆիլային փոխարինում արոմատիկ շարքում
Այս ռեակցիաները բնորոշ են ոչ միայն բենզոլին, այլև ընդհանրապես բենզոլային օղակին, որտեղ էլ որ այն լինի, ինչպես նաև այլ արոմատիկ ցիկլերի համար՝ բենզենոիդ և ոչ բենզենոիդ։ Էլեկտրաֆիլային փոխարինման ռեակցիաները ներառում են ռեակցիաների լայն շրջանակ. նիտրացում, հալոգենացում, սուլֆոնացում և Ֆրիդել-Կրաֆթսի ռեակցիաները բնորոշ են գրեթե բոլոր անուշաբույր միացություններին; ռեակցիաները, ինչպիսիք են նիտրոզացումը և ազո զուգավորումը, բնորոշ են միայն ակտիվության բարձրացում ունեցող համակարգերին. ռեակցիաներ, ինչպիսիք են ծծմբազրկումը, իզոտոպային փոխանակումը և բազմաթիվ ցիկլացման ռեակցիաներ, որոնք առաջին հայացքից միանգամայն տարբեր են թվում, բայց որոնք նույնպես տեղին են վերաբերվում նույն տեսակի ռեակցիաներին:
Էլեկտրաֆիլային նյութեր E +, թեև լիցքի առկայությունը պարտադիր չէ, քանի որ էլեկտրոֆիլը կարող է լինել նաև չլիցքավորված էլեկտրոնի պակաս ունեցող մասնիկ (օրինակ՝ SO 3, Hg(OCOCH 3) 2 և այլն)։ Պայմանականորեն դրանք կարելի է բաժանել երեք խմբի՝ ուժեղ, միջին ուժի և թույլ։
NO 2 + (նիտրոնիումի իոն, նիտրոյլ կատիոն); Cl 2 կամ Br 2 համալիրներ տարբեր Lewis թթուներով (FeCl 3 , AlBr 3 , AlCl 3 , SbCl 5 և այլն); H 2 OCl +, H 2 OBr +, RSO 2 +, HSO 3 +, H 2 S 2 O 7: Ուժեղ էլեկտրական սղոցները փոխազդում են բենզոլային շարքի միացությունների հետ, որոնք պարունակում են ինչպես էլեկտրոն նվիրաբերող, այնպես էլ գործնականում ցանկացած էլեկտրոն քաշող փոխարինիչներ:
Միջին ուժի էլեկտրոֆիլներ
Լյուիս թթուներով ալկիլ հալոգենիդների կամ ացիլ հալոգենիդների համալիրներ (RCl . AlCl 3 , RBr . GaBr 3 , RCOCl . AlCl 3 և այլն); սպիրտների համալիրներ ուժեղ Լյուիս և Բրոնսթեդ թթուներով (ROH . BF 3 , ROH . H 3 PO 4 , ROH . HF): Նրանք արձագանքում են բենզոլի և նրա ածանցյալների հետ, որոնք պարունակում են էլեկտրոն նվիրաբերող (ակտիվացնող) փոխարինիչներ կամ հալոգենի ատոմներ (թույլ ապաակտիվացնող փոխարինիչներ), բայց սովորաբար չեն արձագանքում բենզոլի ածանցյալների հետ, որոնք պարունակում են ուժեղ ապաակտիվացնող էլեկտրոններ քաշող փոխարինիչներ (NO 2, SO 3 H, COR, CN): և այլն):
Թույլ էլեկտրոֆիլներ
Diazonium կատիոններ ArN +є N, iminium CH 2 \u003d N + H 2, nitrosonium NO + (nitrosoyl cation); ածխածնի երկօքսիդ (IY) CO 2 (ամենաթույլ էլեկտրոֆիլներից մեկը): թույլ էլեկտրոֆիլները փոխազդում են միայն բենզոլի ածանցյալների հետ, որոնք պարունակում են շատ ուժեղ էլեկտրոն նվիրաբերող (+M) տիպի փոխարինիչներ (OH, OR, NH 2, NR 2, O- և այլն):
1.1.2 Էլեկտրաֆիլային արոմատիկ փոխարինման մեխանիզմ
Ներկայումս արոմատիկ էլեկտրոֆիլ փոխարինումը դիտվում է որպես երկաստիճան ավելացում-վերացման ռեակցիա՝ արենոնիումի իոնի միջանկյալ ձևավորմամբ, որը կոչվում է σ-համալիր:

I-Արենիումի իոն (
- բարդ), սովորաբար կարճատև: Նման մեխանիզմը կոչվում է S E Ar, այսինքն. S E (արենոնիում): Այս դեպքում, առաջին փուլում, էլեկտրոֆիլի հարձակման արդյունքում, բենզոլի ցիկլային անուշաբույր 6-էլեկտրոնային π-համակարգը անհետանում է և միջանկյալ I-ում փոխարինվում է ցիկլոհեքսադիենիլի ոչ ցիկլային 4-էլեկտրոնային կոնյուգացիոն համակարգով։ կատիոն. Երկրորդ փուլում արոմատիկ համակարգը կրկին վերականգնվում է պրոտոնի վերացման շնորհիվ:Արենոնիումի իոնի I կառուցվածքը պատկերված է տարբեր ձևերով.
Առաջին բանաձևը ամենատարածվածն է. σ-համալիրը շատ ավելի լավ կկայունացվի դոնոր փոխարինողների կողմից օրթո և պարա դիրքերում, քան դոնոր փոխարինողները մետա դիրքում:
π -Համալիրներ
Ինչպես հայտնի է, արենները π-հիմքեր են և բազմաթիվ էլեկտրոֆիլ ռեագենտներով կարող են ձևավորել դոնոր-ընդունիչ կոմպլեքսներ, կազմի մոլեկուլային կոմպլեքսների ձևավորում 1:1 (G.Brown, 1952):
Այս բարդույթները գունավոր չեն, անուշաբույր ածխաջրածիններում դրանց լուծույթները ոչ հաղորդիչ են: Գազային DCl-ի տարրալուծումը բենզոլում, տոլուոլում, քսիլեններում, մեզիտիլենում և պենտամեթիլբենզոլում չի հանգեցնում H-ի փոխանակմանը D-ի հետ: Քանի որ համալիրների լուծույթները չեն փոխանցում էլեկտրական հոսանք, դրանք իոնային տեսակներ չեն. Սրանք արենոնիումի իոններ չեն։
Նման դոնոր-ընդունիչ համալիրները կոչվում են π-համալիրներ: Օրինակ, բենզոլային համալիրների բյուրեղները բրոմով կամ քլորով 1:1 բաղադրությամբ, ըստ ռենտգենյան դիֆրակցիայի տվյալների, բաղկացած են բաղադրության π-դոնորի (C 6 H 6) փոփոխական մոլեկուլների և ընդունիչից ( Cl 2, Br 2), որտեղ հալոգենի մոլեկուլը գտնվում է օղակի հարթությանը ուղղահայաց առանցքի, որն անցնում է նրա համաչափության կենտրոնով:
σ-համալիրներ (արենոնիումի իոններ)
Երբ HCl-ը և DCl-ը ներմուծվում են AlCl 3 կամ AlBr 3 ալկիլբենզոլներում լուծույթի մեջ, լուծումը սկսում է էլեկտրական հոսանք վարել: Նման լուծույթները գունավորվում են, և դրանց գույնը փոխվում է դեղինից նարնջագույն-կարմիր՝ պարաքսիլենից պենտամեթիլբենզոլ անցնելիս։ ArH-DCl-AlCl 3 կամ ArH-DF-BF 3 համակարգերում արոմատիկ օղակի ջրածնի ատոմներն արդեն փոխանակվում են դեյտերիումով։ Լուծումների էլեկտրական հաղորդունակությունը միանշանակ ցույց է տալիս իոնների առաջացումը եռյակ համակարգում արեն-ջրածին հալոգենիդ-ալյումին հալոգենիդ: Նման իոնների կառուցվածքը որոշվել է 1 H և 13 C NMR սպեկտրոսկոպիայի միջոցով ArH-HF (հեղուկ)-BF 3 կամ ArH-HF-SbF 5 համակարգում SO 2 ClF ցածր ջերմաստիճանում:
1.1.3 Փոխարինիչների դասակարգում
Մոնոփոխարինված C 6 H 5 X բենզոլները կարող են քիչ թե շատ ռեակտիվ լինել, քան բենզոլը: Եթե C 6 H 5 X-ի և C 6 H 6-ի համարժեք խառնուրդ ներմուծվի ռեակցիա, ապա փոխարինումը տեղի կունենա ընտրովի. առաջին դեպքում C 6 H 5 X-ը գերակշռում է արձագանքելու, իսկ երկրորդ դեպքում՝ հիմնականում բենզինը: .
Ներկայումս փոխարինիչները բաժանվում են երեք խմբի՝ հաշվի առնելով դրանց ակտիվացնող կամ ապաակտիվացնող ազդեցությունը, ինչպես նաև բենզոլային օղակում փոխարինման կողմնորոշումը։
1. Օրթո-պարա-կողմնորոշող խմբերի ակտիվացում. Դրանք ներառում են՝ NH 2, NHR, NR 2, NHAc, OH, OR, OAc, Alk և այլն:
2. Օրթո-պարա-կողմնորոշող խմբերի ապաակտիվացում: Սրանք F, Cl, Br և I հալոգեններն են:
3. Մետա-կողմնորոշող խմբերի ապաակտիվացում: Այս խումբը բաղկացած է NO 2 , NO, SO 3 H, SO 2 R, SOR, C(O)R, COOH, COOR, CN, NR 3+, CCl 3 և այլն, որոնք երկրորդ տեսակի կողմնորոշիչներ են։
Բնականաբար, կան նաև միջանկյալ բնույթի ատոմների խմբավորումներ, որոնք որոշում են խառը կողմնորոշումը։ Սրանք, օրինակ, ներառում են. 2 SR 2 + id.
1.2 Էլեկտրաֆիլային փոխարինում π-ավելցուկային հետերոցիկլերում
Ֆուրանը, պիրոլը և թիոֆենը խիստ ռեակտիվ են սովորական էլեկտրոֆիլ ռեակտիվների հետ: Այս առումով նրանք նման են բենզոլի ամենաակտիվ ածանցյալներին, ինչպիսիք են ֆենոլները և անիլինները: Էլեկտրաֆիլային փոխարինման նկատմամբ զգայունության բարձրացումը պայմանավորված է այս հետերոցիկլներում լիցքի ասիմետրիկ բաշխմամբ, ինչը հանգեցնում է օղակի ածխածնի ատոմների ավելի մեծ բացասական լիցքի, քան բենզոլի: Ֆուրանը որոշ չափով ավելի ռեակտիվ է, քան պիրոլը, մինչդեռ թիոֆենը ամենաքիչ ռեակտիվն է:
1.2.1 Պիրոլի էլեկտրաֆիլ փոխարինում
Թեև պիրոլը և նրա ածանցյալները հակված չեն նուկլեոֆիլային ավելացման և փոխարինման ռեակցիաներին, նրանք շատ զգայուն են էլեկտրոֆիլ ռեակտիվների նկատմամբ, և պիրոլի ռեակցիաները նման ռեակտիվների հետ ընթանում են գրեթե բացառապես որպես փոխարինման ռեակցիաներ: Չփոխարինված պիրոլը, N- և C-մոնոալկիլպիրոլները և, ավելի քիչ, C, C-դիալկիլ ածանցյալները պոլիմերացվում են խիստ թթվային միջավայրում, ուստի բենզոլի ածանցյալների դեպքում օգտագործվող էլեկտրոֆիլ ռեակտիվների մեծ մասը կիրառելի չէ պիրոլի և նրա ալկիլի համար: ածանցյալներ.
Այնուամենայնիվ, եթե պիրոլի ցիկլում կան էլեկտրոններ հանող խմբեր, որոնք կանխում են պոլիմերացումը, օրինակ, եթերային խմբերը, հնարավոր է դառնում օգտագործել ուժեղ թթվային միջավայրեր, նիտրացնող և սուլֆոնացնող նյութեր:
պրոտոնացիա
Լուծման մեջ նկատվում է պրոտոնի շրջելի ավելացում պիրոլի օղակի բոլոր դիրքերում։ Ազոտի ատոմը պրոտոնացվում է ամենաարագը, 2-րդ դիրքում պրոտոնի ավելացումը երկու անգամ ավելի արագ է, քան 3-րդ դիրքում: Գազային փուլում, երբ օգտագործվում են չափավոր ուժի թթուներ, ինչպիսիք են C 4 H 9 + և NH 4 +, պիրոլը: պրոտոնացվում է բացառապես ածխածնի ատոմներում, և 2-րդ դիրքում պրոտոնը միացնելու հակվածությունը ավելի բարձր է, քան 3-րդ դիրքում: Թերմոդինամիկորեն ամենակայուն կատիոնը՝ 2H-պիրոլիումի իոնը, ձևավորվում է 2-րդ դիրքում պրոտոնի և pKa-ի ավելացումից հետո: Պիրոլի համար որոշված արժեքը կապված է հենց այս կատիոնի հետ: Պիրոլի թույլ N-հիմնականությունը պայմանավորված է 1H-պիրոլիումի կատիոնում դրական լիցքի մեզոմերային տեղակայման բացակայությամբ։