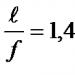Hibridisasi orbital atom. Konsep metode orbital molekul. Diagram energi pembentukan orbital molekul untuk molekul homonuklear biner. Ketika ikatan kimia terbentuk, sifat-sifat atom yang berinteraksi berubah, terutama energi dan pendudukan orbital luarnya.
Bagikan pekerjaan di jejaring sosial
Jika karya ini tidak cocok untuk Anda, ada daftar karya serupa di bagian bawah halaman. Anda juga dapat menggunakan tombol pencarian
halaman 13
Lebedev Yu.A. Kuliah 0 2
Kuliah #0 2
Ikatan kimia. Karakteristik ikatan kimia: energi, panjang, sudut ikatan. Jenis ikatan kimia. Polaritas komunikasi. Ide mekanika kuantum tentang sifat ikatan kovalen. Konsep metode ikatan valensi. Hibridisasi orbital atom.- (c yigma) dan  (pi)-ikatan. Konfigurasi geometris molekul. Momen listrik dipol molekul. Konsep metode orbital molekul. Diagram energi pembentukan orbital molekul untuk molekul homonuklear biner. Sigma (
(pi)-ikatan. Konfigurasi geometris molekul. Momen listrik dipol molekul. Konsep metode orbital molekul. Diagram energi pembentukan orbital molekul untuk molekul homonuklear biner. Sigma ( ) dan Pi(
) dan Pi(  )-orbital molekul. Molekul dia- dan paramagnetik.
)-orbital molekul. Molekul dia- dan paramagnetik.
PENGINGAT
persamaan Schrödinger. - fungsi gelombang.
E \u003d f (n, l, m, s).
Ikatan kimia. Karakteristik ikatan kimia: energi, panjang, sudut ikatan.
Kami telah mempertimbangkan struktur tingkat elektronik atom terisolasi. Ini adalah objek yang sangat langka dalam praktik. Satu-satunya pengecualian adalah argon gas inert dengan rumus elektronik 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 . Dan meskipun "hanya" 0,93% vol di atmosfer, masing-masing dari Anda benar-benar "menelan" sekitar tiga ratus triliun keping atom argon dalam satu napas.
Semua zat dan bahan lain yang kami tangani mengandungterikat secara kimiaatom. Interaksi atom bebas satu sama lain mengarah pada pembentukan molekul, ion, dan kristal. Ini adalah objek kimia "klasik". Baru-baru ini, bagaimanapun, objek seperti struktur nano, senyawa permukaan, berthollides, dan sejumlah objek kimia "non-klasik" praktis penting lainnya telah memperoleh peran penting.
Ikatan kimia terjadi karena interaksi elektron di kulit elektron terluar atom.Orbital yang berperan dalam pembentukan ikatan kimia disebutorbital valensi, dan elektron yang terletak di atasnya adalah elektron valensi.
Ketika ikatan kimia terbentuk, sifat-sifat atom yang berinteraksi berubah dan, di atas segalanya, energi dan hunian orbital luarnya.
Ketika ikatan kimia terbentuk, energi total elektron dalam orbital valensi lebih kecil daripada energinya dalam atom bebas. Perbedaan energi ini disebut energi ikatan kimia.
Energi ikatan kimia yang khas adalah ratusan kJ/mol.
Karakteristik kuantitatif penting dari ikatan kimia adalah panjangnya.Panjang ikatan adalah jarak antara inti atom yang terikat secara kimia dalam keadaan molekul yang stabil.
Panjang khas ikatan kimia adalah sepersepuluh nanometer. 1
Jika dua atau lebih atom lain mengambil bagian dalam pembentukan molekul ketika berinteraksi dengan atom tertentu, maka muncul pertanyaan tentang struktur geometris atau struktur kimianya. Dasar-dasar teori struktur kimia molekul ditempatkan oleh A.M. Butlerov 2
Salah satu karakteristik kuantitatif yang paling penting dari struktur molekul kompleks adalah sudut ikatan - sudut yang dibentuk oleh dua arah ikatan kimia yang berasal dari satu atom.
Jenis ikatan kimia. Polaritas komunikasi.
Menurut sifat interaksi elektron valensi dan jenis orbital yang terbentuk selama interaksi,ikatan kimia dibagi menjadi beberapa jenis utama berikut:kovalen (polar dan nonpolar), ionik, donor-akseptor, hidrogen dan antarmolekul (juga disebut van der Waals).
Kembali pada tahun 1916, ahli kimia Amerika G.N. Lewis 3 menyatakan gagasan bahwa ikatan kimia dibentuk oleh pasangan elektron, yang secara grafis diwakili oleh garis valensi:
F + F = F 2 (F-F).
Jika elektronegativitas atom sama, maka ikatan semacam itu disebut non-polar. Jika berbeda - kutub.
Ketika ikatan kovalen polar terbentuk, atom memperoleh muatan tambahan - negatif untuk atom dengan elektronegativitas lebih tinggi dan positif untuk atom dengan elektronegativitas lebih rendah:
H + Cl = HCl ( 
 )
)
Dalam kasus ketika perbedaan keelektronegatifan atom yang berinteraksi besar, ikatan dianggap ionik:
Na + Cl \u003d NaCl (Na + Cl -).
Jika pasangan elektron yang membentuk ikatan milik salah satu atom sebelum interaksi, maka ikatan semacam itu disebut ikatan donor-akseptor. Sebuah atom yang telah memberikan pasangan elektron disebut donor, dan atom yang telah menerimanya ke dalam orbital bebas disebut akseptor.
Munculnya ikatan donor-akseptor sangat khas. d - logam yang bebas atau terisi sebagian d orbital untuk membentuk senyawa kompleks.
Kami akan berbicara tentang jenis komunikasi lain nanti.
Ide mekanika kuantum tentang sifat ikatan kovalen.
Dari sudut pandang modern, ikatan kovalen muncul selama interaksi mekanika kuantum dari semua elektron dari semua atom yang berinteraksi. Namun, seperti yang kami katakan di kuliah No. 1, tidak ada solusi eksak untuk persamaan Schrödinger yang menjelaskan orbital banyak elektron dalam molekul. Tugas deskripsi mekanika kuantum dari ikatan kimia difasilitasi oleh fakta bahwa selama pembentukannya peran elektron yang terletak di kulit elektron dalam dan luar berbeda secara signifikan.
Oleh karena itu, dimungkinkan untuk membuat berbagai metode perkiraan untuk menggambarkan ikatan kimia.
Kimia kuantum memiliki banyak program terapan yang memungkinkan untuk melakukan perhitungan dengan akurasi tinggi untuk kelas molekul dan ion yang luas. 4
Namun, masih belum ada algoritma kimia kuantum yang universal dan cukup akurat.
Untuk pemahaman kualitatif tentang struktur senyawa kimia dua metode yang digunakan -metode ikatan valensi (MVS) dan metode orbital molekul (MO).
Konsep metode ikatan valensi. Konfigurasi geometris molekul. Momen listrik dipol molekul.
Postulat utama dari metode ikatan valensi adalah:
1. Ikatan kimia kovalen tunggal dilakukan oleh dua elektron valensi yang menempati dua orbital - satu dari masing-masing atom yang berinteraksi. Dalam hal ini, spin elektron yang membentuk pasangan valensi harus berlawanan (ikatan dibentuk oleh elektron dengan spin antiparalel).
2. Orbital atom awal (AO) mempertahankan bentuknya dalam komposisi molekul juga.
3. Ikatan terbentuk karena tumpang tindih orbital, yang mengarah pada peningkatan kerapatan elektron antara inti atom yang berinteraksi ke arah yang memberikan tumpang tindih maksimum.
Pertimbangkan pembentukan ikatan kimia oleh MHS dalam molekul uap air - H2O.
Sebuah molekul terdiri dari satu atom oksigen HAI dan dua atom hidrogen H . Rumus elektronik atom oksigen 1 s 2 2 s 2 2 hal 4 . Di luar tingkat energi ada 6 elektron. Subtingkat 2 s diisi. Di sublevel 2 p di salah satu p -orbital (misalkan py ,) ada pasangan elektron, dan pada dua lainnya ( p x dan p z ) - satu elektron tidak berpasangan. Merekalah yang akan berpartisipasi dalam pembentukan ikatan kimia.

Rumus elektron atom hidrogen 1 s 1 . Hidrogen memiliki satu s -elektron yang garis orbitnya berbentuk bola, dan akan ikut tumpang tindih dengan p - orbital oksigen, membentuk ikatan kimia. Jumlah seperti itu sp Akan ada dua tumpang tindih dalam molekul air. Dan struktur molekulnya akan terlihat seperti ini:

Seperti dapat dilihat dari gambar, molekul air memiliki dua ikatan kimia kovalen yang diarahkan sepanjang sumbu Z dan X . Oleh karena itu, sudut ikatan dalam model ini adalah 90 tentang . Percobaan menunjukkan bahwa sudut ini adalah 104,5 Hai.
Cukup cocok untuk model kualitatif paling sederhana tanpa perhitungan apa pun!
Keelektronegatifan Mulliken dari oksigen adalah 3,5 dan hidrogen adalah 2,1. Oleh karena itu, masing-masing ikatan akan bersifat polar, dan muatan - akan menggunakan oksigen, dan
- akan menggunakan oksigen, dan + - pada hidrogen, mis. tiga pusat terbentuk muatan listrik. Dua dipol listrik terbentuk dalam molekul.
+ - pada hidrogen, mis. tiga pusat terbentuk muatan listrik. Dua dipol listrik terbentuk dalam molekul.
Dipol adalah dua muatan yang sama besar yang dipisahkan oleh jarak berhingga. aku dari satu sama lain. Dipol dicirikan oleh momen dipol
 =
=

Dipol adalah vektor yang diarahkan dari kutub negatif ke kutub positif. Dalam molekul air, dua momen dipol ikatan terbentuk, yang bila ditambahkan, memberikan momen dipol total molekul. Skema momen dipol molekul air menurut model MVS memiliki bentuk:

Penting untuk ditekankan bahwa momen dipol ikatan bertambah secara vektor dan momen dipol total bergantung pada geometri molekul. Seperti yang Anda lihat, dalam hal ini, karena fakta bahwa ikatan diarahkan pada sudut kanan satu sama lain, molekul secara keseluruhan ternyata bersifat polar. Dan percobaan menegaskan hal ini - momen dipol molekul air adalah 1,84 Debye. (1 debye sama dengan 0,33*10-29 C*m)
Struktur geometris ikatan dalam molekul bisa sangat beragam. Ikatan dapat ditempatkan baik di bidang maupun di luar angkasa, membentuk molekul dalam bentuk benda tiga dimensi dengan berbagai konfigurasi (trigonal, tetragonal, piramida heksagonal, bipiramid, cincin yang terbuat dari piramida, dll.)
Baca lebih lanjut tentang hubungan antara struktur ikatan kimia dan geometri molekul di buku teks halaman 119-128).
 - (c yigma) dan
- (c yigma) dan  (pi)-ikatan.
(pi)-ikatan.
Mari kembali ke tumpang tindih orbital dalam pembentukan ikatan. Dalam contoh kitaluas tumpang tindih maksimum orbital s dan p terletak pada garis yang menghubungkan pusat-pusat atom. Jenis penutup ini disebut -koneksi.
-koneksi.
Pertimbangkan kasus lain - molekul oksigen O2 . Seperti yang telah kita lihat, atom oksigen memiliki dua p Orbital yang mengandung elektron yang dapat membentuk ikatan kimia. Rumus struktur oksigen yang terkenal O=O . Molekul oksigen memiliki ikatan rangkap. Salah satunya adalah yang baru saja dibahas. -koneksi. Dan yang kedua? Ternyata ikatan kedua terbentuk karena tumpang tindih orbital jenis lain, yang disebut
-koneksi. Dan yang kedua? Ternyata ikatan kedua terbentuk karena tumpang tindih orbital jenis lain, yang disebut -komunikasi.
-komunikasi.
Konsep dari  dan
dan  koneksi yang dikemukakan oleh F. Hund.
koneksi yang dikemukakan oleh F. Hund.
Di pendidikan  -ikatan orbital tumpang tindih sedemikian rupa sehingga dua daerah yang tumpang tindih terbentuk, dan mereka terletak secara simetris terhadap bidang tempat inti atom yang berinteraksi berada.
-ikatan orbital tumpang tindih sedemikian rupa sehingga dua daerah yang tumpang tindih terbentuk, dan mereka terletak secara simetris terhadap bidang tempat inti atom yang berinteraksi berada.
Secara geometris terlihat seperti ini:

Harap dicatat bahwa -koneksi dibentuk oleh bagian-bagian yang lebih kecil p -orbital, di mana kerapatan "awan elektron" lebih besar, dan oleh karena itu ikatan ini lebih kuat
-koneksi dibentuk oleh bagian-bagian yang lebih kecil p -orbital, di mana kerapatan "awan elektron" lebih besar, dan oleh karena itu ikatan ini lebih kuat -koneksi. Memang, percobaan menunjukkan bahwa dalam senyawa karbon, etana C 2 H 6 (CH 3 - CH 3 - satu
-koneksi. Memang, percobaan menunjukkan bahwa dalam senyawa karbon, etana C 2 H 6 (CH 3 - CH 3 - satu  -ikatan), etilena C 2 H 4 (CH 2 \u003d CH 2 - satu
-ikatan), etilena C 2 H 4 (CH 2 \u003d CH 2 - satu  - komunikasi dan satu
- komunikasi dan satu  -ikatan) dan asetilena C 2 H 2 (C NS H - satu
-ikatan) dan asetilena C 2 H 2 (C NS H - satu  - koneksi dan dua
- koneksi dan dua  -ikatan) energi pecahnya masing-masing adalah 247, 419, dan 515 kJ/mol.
-ikatan) energi pecahnya masing-masing adalah 247, 419, dan 515 kJ/mol.
Sekarang kita dapat melengkapi daftar postulat MVS:
4.
Jika ikatan rangkap (ganda dan rangkap tiga) terbentuk dalam molekul, maka salah satunya adalah - komunikasi, dan lain-lain -
- komunikasi, dan lain-lain - -koneksi).
-koneksi).
Perhatikan bahwa dalam koneksi d- dan f -logam, pembentukan jenis ikatan lain dimungkinkan - -ikatan, ketika tumpang tindih terjadi di empat wilayah spasial dan bidang simetri tegak lurus terhadap garis yang menghubungkan inti atom.
-ikatan, ketika tumpang tindih terjadi di empat wilayah spasial dan bidang simetri tegak lurus terhadap garis yang menghubungkan inti atom.
Hibridisasi orbital atom.
Ketika ikatan kimia terbentuk, sebuah fenomena penting dapat terjadi, yang disebuthibridisasi orbital.
Pertimbangkan atom berilium Menjadi . Miliknya rumus elektronik– 1 s 2 2 s 2 . Dilihat dari fakta bahwa semua elektron berilium dipasangkan, atom semacam itu harus berperilaku kimia seperti gas inert - tidak masuk ke dalam interaksi kimia.
Namun, mari kita perhatikan dengan seksama diagram difraksi elektron atom berilium:

Dapat dilihat dari diagram yang dimiliki atom berilium, selain 2 . yang terisi s -3 lebih banyak orbital bebas 2 p -orbital! Benar, energi orbital ini lebih besar daripada energi 2 s -orbital per magnitudo E . Tetapi energi ini kecil dan kurang dari energi yang dilepaskan selama pembentukan ikatan kimia. Oleh karena itu, atom cenderung mengatur ulang orbitalnya selama interaksi untuk mencapai keadaan akhir yang menguntungkan secara energetik. Untuk penataan ulang seperti itu, energi kinetik partikel yang berinteraksi dengan atom tertentu digunakan. Kami akan berbicara tentang sumber energi ini secara lebih rinci ketika membahas pertanyaan tentang kinetika kimia. 5
E . Tetapi energi ini kecil dan kurang dari energi yang dilepaskan selama pembentukan ikatan kimia. Oleh karena itu, atom cenderung mengatur ulang orbitalnya selama interaksi untuk mencapai keadaan akhir yang menguntungkan secara energetik. Untuk penataan ulang seperti itu, energi kinetik partikel yang berinteraksi dengan atom tertentu digunakan. Kami akan berbicara tentang sumber energi ini secara lebih rinci ketika membahas pertanyaan tentang kinetika kimia. 5
Penataan ulang ini disebut hibridisasi orbital, karena selama proses ini orbital baru muncul dari "dua jenis" orbital.
Dalam bahasa fungsi gelombang, hal ini dijelaskan dengan persamaan yang menghubungkan fungsi gelombang hibrid dari orbital yang dihasilkan dengan fungsi gelombang aslinya.
Jumlah orbital hibrid yang terbentuk sama dengan jumlah orbital yang ikut dalam proses hibridisasi.
Secara grafis, proses ini dapat diwakili oleh diagram berikut:

Perhatikan bahwa energi yang dibutuhkan untuk hibridisasi E hibrida kurang dari perbedaan energi antara orbital hibridisasi E.
Dalam penunjukan orbital hibrida, penunjukan orbital asli dipertahankan. Jadi, dalam hal ini (atom Menjadi ), hibridisasi satu s dan satu p -orbital, dan kedua orbital hibrid dilambangkan sebagai sp -orbital. Perlunya hibridisasi hanya dua orbital disebabkan oleh fakta bahwa atom berilium hanya memiliki dua elektron pada tingkat energi terluarnya.
Dalam kasus lain, ketika beberapa orbital identik berpartisipasi dalam hibridisasi, jumlahnya ditandai dengan eksponen. Misalnya, ketika hibridisasi satu s dan dua p diperoleh tiga orbital sp 2 -orbital, dan ketika hibridisasi satu s dan tiga p -orbital - empat orbital sp3.
Dalam kasus yang sedang dipertimbangkan, sesuai dengan aturan Hund, atom berilium menerima dua elektron yang tidak berpasangan dan kemampuan untuk membentuk dua ikatan kimia kovalen.
orbital hibrid terbentuk s , p dan genap d -orbital sedikit berbeda dalam bentuk dan terlihat seperti ini ("halter asimetris"):

Perhatikan bahwa jumlah orbital hibrida sama dengan jumlah orbital yang terlibat dalam pembuatannyaterlepas dari jumlah dan jenis orbital hibridisasi.
Lokasi orbital hibrida di ruang angkasa ditentukan oleh jumlah mereka.
Secara khusus, atom berilium memiliki dua hibrid sp Orbital terletak di sepanjang satu garis lurus (pada sudut 180 Hai ), yang sesuai dengan kecenderungan elektron bermuatan serupa yang menempatinya untuk menjauh satu sama lain sejauh mungkin:

Lagi tentang metode ikatan valensi dan hibridisasi dapat dibaca disini :
http://center.fio.ru/method/resources/Alikberovalyu/2004/stroenie/gl_10.html#104
Molekul sering memiliki orbital yang ditempati oleh pasangan elektron ("pasangan elektron mandiri"). Orbital semacam itu tidak mengambil bagian dalam pembentukan ikatan kimia, tetapi mempengaruhi struktur geometris molekul.
Modifikasi MVS, yang memperhitungkan pengaruh orbital semacam itu, disebut teori tolakan pasangan elektron orbital valensi (VEPR) dan Anda dapat mempelajarinya di buku teks di halaman 124 - 128.
Konsep metode orbital molekul.
Kami telah mempertimbangkan fenomena hibridisasi AO dalam kerangka MVS. Ternyata ide hibridisasi juga bermanfaat untuk pemodelan ikatan kimia yang lebih dalam. Ini adalah dasar dari metode kedua dari deskripsi mereka, yang dipertimbangkan dalam kursus kami - metodeorbital molekul(MO).
Postulat utama dari metode ini adalah pernyataan bahwa AO atom yang berinteraksi satu sama lain kehilangan individualitasnya dan membentuk MO umum, yaitu. bahwa elektron dalam molekul tidak "milik" atom tertentu, tetapi bergerak secara mekanis kuantum di seluruh struktur molekul.
Ada beberapa jenis metode MO yang memperhitungkan b tentang lebih atau lebih sedikit faktor dan, karenanya, lebih atau kurang kompleks secara matematis. Yang paling sederhana adalah pendekatan yang memperhitungkan hanya efek linier dari interaksi elektron. Pendekatan ini disebut metode MO LCAO (kombinasi linier orbital atom).
di lidah mekanika kuantum pernyataan ini untuk kasus paling sederhana dari interaksi dua orbital ditulis sebagai berikut:
Di mana  - Fungsi gelombang MO,
- Fungsi gelombang MO, adalah fungsi gelombang AO dari atom pertama,
adalah fungsi gelombang AO dari atom pertama, adalah fungsi gelombang AO dari atom kedua, a dan b adalah koefisien numerik yang mencirikan kontribusi AO ini terhadap struktur keseluruhan MO.
adalah fungsi gelombang AO dari atom kedua, a dan b adalah koefisien numerik yang mencirikan kontribusi AO ini terhadap struktur keseluruhan MO.
Karena polinomial linier ditulis di sisi kanan, modifikasi metode MO ini disebut LCAO.
Dari persamaan tersebut dapat diketahui bahwaketika dua AO berinteraksi, dua MO diperoleh. Salah satunya disebut mengikat MO, dan yang lainnya - melonggarkan MO.
Mengapa mereka mendapat nama seperti itu jelas dari gambar, yang menunjukkan diagram energi orbital dalam molekul:

Seperti dapat dilihat dari gambar, MO yang mengikat memiliki energi yang lebih rendah daripada energi AO awal, dan MO yang melepaskan memiliki energi yang lebih tinggi. (masing-masing,). Secara alami, sesuai dengan prinsip energi minimum, elektron dalam molekul akan menempati orbital ikatan terlebih dahulu ketika ikatan terbentuk.
Secara umum, saat berinteraksi N AO menjadi N MO .
Sigma (  ) dan pi(
) dan pi(  )-orbital molekul.
)-orbital molekul.
Dari hasil perhitungan kuantitatif dengan menggunakan metode MO LCAO, ternyata konsep dan
dan  simetri orbital juga dipertahankan dalam metode MO LCAO.
simetri orbital juga dipertahankan dalam metode MO LCAO.
Begini tampilan garis besarnya -mengikat (dilambangkan sebagai
-mengikat (dilambangkan sebagai atau dan
atau dan  -melonggarkan (dilambangkan sebagai atau) orbital dalam metode MO LCAO:
-melonggarkan (dilambangkan sebagai atau) orbital dalam metode MO LCAO:

Dan seperti inilah garis besarnya - mengikat (
- mengikat (  ) dan
) dan  - melonggarkan (
- melonggarkan (  *
) orbital dengan metode MO LCAO:
*
) orbital dengan metode MO LCAO:


Diagram energi pembentukan orbital molekul untuk molekul homonuklear biner.
Menghitung energi orbital molekul untuk molekul kompleks yang mencakup inti berbagai elemen (molekul heteronuklear) adalah tugas komputasi yang kompleks bahkan untuk komputer modern. Oleh karena itu, setiap perhitungan molekul individu adalah karya kreatif yang terpisah.
Namun demikian, ternyata diagram energi untuk molekul homonuklear biner unsur-unsur periode kedua dari sistem periodik D.I. Mendeleev bersifat universal dan memiliki bentuk:

Terkadang literatur memberikan diagram yang berbeda untuk elemen B ,C,N dan selanjutnya O, F, Ne , namun penelitian sifat magnetik molekul B2 pada suhu sangat rendah tidak secara tegas menegaskan perlunya memperumit bentuk diagram energi untuk B,C,N
Molekul dia- dan paramagnetik. Multiplisitas obligasi menurut MO LCAO.
Salah satu keuntungan serius dari metode MO LCAO dibandingkan dengan metode VS adalah deskripsi yang lebih tepat tentang sifat magnetik molekul dan, khususnya, penjelasan tentang paramagnetisme oksigen molekuler. 6
Mari kita ingat kembali struktur molekul oksigen menurut MHS, yang telah kita bahas sebelumnya. Menurut struktur ini, semua elektron valensi dan dan
dan  -ikatan dalam molekul O2 membentuk pasangan elektron dan total spin molekul adalah nol.
-ikatan dalam molekul O2 membentuk pasangan elektron dan total spin molekul adalah nol.
Struktur orbital molekul ini menurut metode MO LCAO, diperoleh dengan mengisi elektron MO sesuai dengan diagram energi di atas, memiliki bentuk:

Seperti yang dapat dilihat dari diagram ini, molekul oksigen mengandung dua elektron tidak berpasangan pada antiikatan dan
dan  orbital. Momen magnetik mereka bertambah dan memberikan momen magnetik total molekul. Percobaan menunjukkan bahwa momen magnet molekul oksigen adalah 2,8
orbital. Momen magnetik mereka bertambah dan memberikan momen magnetik total molekul. Percobaan menunjukkan bahwa momen magnet molekul oksigen adalah 2,8 (Momen magnetik intrinsik elektron adalah 1
(Momen magnetik intrinsik elektron adalah 1 ). Mempertimbangkan bahwa momen magnetik total mencakup momen orbital selain momen elektronik intrinsik, kesepakatan kuantitatif dengan sangat meyakinkan membuktikan keabsahan metode MO.
). Mempertimbangkan bahwa momen magnetik total mencakup momen orbital selain momen elektronik intrinsik, kesepakatan kuantitatif dengan sangat meyakinkan membuktikan keabsahan metode MO.
Dengan adanya momen magnet, materi menjadiparamagnetik -itu "ditarik oleh magnet". 7 Dengan tidak adanya momen magnet, zat diamagnetik - itu "didorong keluar" oleh medan magnet. 8
Selain sifat magnetik, analisis diagram energi MO LCAO memungkinkan untuk menentukanbanyaknya (atau urutan) ikatan kimia (CS atau PS).
KS \u003d (N ikatan - N razr)
dimana N terhubung adalah jumlah total elektron dalam orbital ikatan; N res adalah jumlah total elektron dalam orbital antiikatan).
Kami telah mempertimbangkan berbagai kasus manifestasi dan deskripsi ikatan kimia kovalen. Ini adalah jenis utama ikatan kimia, karena sebagian besar unsur kimia memiliki alasan untuk terjadinya - adanya elektron valensi.
Namun, dalam beberapa kasus, interaksi atom muncul kondisi khusus, yang menghasilkan jenis koneksi khusus, yang akan kita bahas di kuliah berikutnya.
Di mana satu mol ikatan tertentu putus. Diasumsikan bahwa zat awal dan produk reaksi berada dalam keadaan standar gas ideal hipotetis pada tekanan 1 atm dan suhu 25 0 C. Sinonim untuk energi pemutusan ikatan kimia adalah: energi ikatan, energi disosiasi molekul diatomik, energi pembentukan ikatan kimia.
Energi pemutusan ikatan kimia dapat ditentukan cara yang berbeda, Misalnya
Dari data spektroskopi massa (spektrometri massa).
Energi pemutusan ikatan kimia dalam berbagai senyawa tercermin dalam buku referensi.
Energi pemutusan ikatan kimia mencirikan kekuatan ikatan kimia.
| Menggabungkan | Menggabungkan | Energi pemutusan ikatan, kkal/mol | |
|---|---|---|---|
| H-H | 104,2 | CH 3 -H | 104 |
| HO-H | 119 | CH 3 CH 2 -H | 98 |
| CH 3 O-H | 102 | (CH 3) 2 CH-H | 94,5 |
| C 6 H 5 O-H | 85 | (CH 3) 3 C-H | 91 |
| F-H | 135,8 | C 6 H 5 -H | 103 |
| Cl-H | 103,0 | CH 2 \u003d CH-H | 103 |
| Br-H | 87,5 | HC≡C-H | 125 |
| AKU H | 71,3 | H 2 N-H | 103 |
Energi pemutusan ikatan C-C
Lihat juga
Catatan
Yayasan Wikimedia. 2010 .
Lihat apa itu "Energi Pemutus Ikatan Kimia" di kamus lain:
Ini sama dengan pekerjaan yang harus dikeluarkan untuk membagi molekul menjadi dua bagian (atom, kelompok atom) dan memisahkan mereka dari satu sama lain pada jarak yang tak terbatas. Misalnya, jika E. x dianggap. Dengan. H3CH H dalam molekul metana, maka ... ... Ensiklopedia Besar Soviet
Reaksi eksoterm adalah reaksi kimia yang disertai dengan pelepasan kalor. Kebalikan dari reaksi endoterm. Jumlah total energi dalam sistem kimia sangat sulit untuk diukur atau dihitung... Wikipedia
Gambar 1. Ikatan rangkap tiga dalam kerangka teori ikatan valensi Ikatan rangkap tiga adalah ikatan kovalen dua atom dalam suatu molekul melalui tiga pasangan elektron ikatan yang sama. Gambar pertama dari struktur visual ikatan rangkap tiga diberikan di ... Wikipedia
Ciri khas alkohol adalah gugus hidroksil pada atom karbon jenuh pada gambar yang disorot dalam warna merah (oksigen) dan abu-abu (hidrogen). Alkohol (dari bahasa Latin ... Wikipedia
C (carboneum), unsur kimia non-logam dari subkelompok IVA (C, Si, Ge, Sn, Pb) dari Tabel Periodik Unsur. Itu terjadi di alam dalam bentuk kristal berlian (Gbr. 1), grafit atau fullerene dan bentuk lainnya dan merupakan bagian dari ... ... Ensiklopedia Collier
Energi ikatan merupakan konsep penting dalam kimia. Ini menentukan jumlah energi yang dibutuhkan untuk memutuskan ikatan kovalen antara dua atom gas. Konsep ini tidak berlaku untuk ikatan ionik. Ketika dua atom bergabung untuk membentuk molekul, seseorang dapat menentukan seberapa kuat ikatan di antara mereka - cukup untuk menemukan energi yang harus dikeluarkan untuk memutuskan ikatan ini. Ingat bahwa atom tunggal tidak memiliki energi ikat, energi ini mencirikan kekuatan ikatan antara dua atom dalam sebuah molekul. Untuk menghitung energi ikat untuk setiap reaksi kimia, cukup tentukan jumlah total ikatan yang putus dan kurangi jumlah ikatan yang terbentuk darinya.
Langkah
Bagian 1
Identifikasi ikatan yang putus dan terbentuk- Putusnya ikatan kimia tunggal, rangkap dua dan rangkap tiga dianggap sebagai satu ikatan putus. Meskipun ikatan ini memiliki energi yang berbeda, dalam setiap kasus satu ikatan dianggap putus.
- Hal yang sama berlaku untuk pembentukan ikatan tunggal, rangkap dua atau rangkap tiga. Setiap kasus tersebut dianggap sebagai pembentukan satu koneksi baru.
- Dalam contoh kita, semua ikatan adalah tunggal.
-
Tentukan tautan mana yang terputus di ruas kiri persamaan. Sisi kiri persamaan kimia berisi reaktan, dan itu mewakili semua ikatan yang putus sebagai akibat dari reaksi. Ini adalah proses endotermik, yaitu, dibutuhkan sejumlah energi untuk memutuskan ikatan kimia.
- Untuk contoh kita, ruas kiri persamaan reaksi mengandung satu koneksi H-H dan satu ikatan Br-Br.
-
Hitung jumlah ikatan yang terbentuk pada ruas kanan persamaan. Produk reaksi ditunjukkan di sebelah kanan. Bagian persamaan ini mewakili semua ikatan yang terbentuk sebagai hasil reaksi kimia. Ini adalah proses eksotermik dan melepaskan energi (biasanya dalam bentuk panas).
- Dalam contoh kita, ruas kanan persamaan mengandung dua ikatan H-Br.
Bagian 2
Hitung energi ikat-
Temukan energi ikat yang dibutuhkan. Ada banyak tabel yang mencantumkan energi ikat untuk berbagai senyawa. Tabel semacam itu dapat ditemukan di Internet atau buku referensi tentang kimia. Harus diingat bahwa energi ikat selalu diberikan untuk molekul dalam keadaan gas.
-
Kalikan energi ikatan dengan jumlah ikatan yang putus. Dalam sejumlah reaksi, satu ikatan dapat diputus beberapa kali. Misalnya, jika suatu molekul terdiri dari 4 atom hidrogen, maka energi ikat hidrogen harus diperhitungkan 4 kali, yaitu dikalikan dengan 4.
- Dalam contoh kita, setiap molekul memiliki satu ikatan, sehingga energi ikatan dikalikan dengan 1.
- H-H = 436 x 1 = 436 kJ/mol
- Br-Br \u003d 193 x 1 \u003d 193 kJ / mol
-
Jumlahkan semua energi ikatan yang terputus. Setelah Anda mengalikan energi ikat dengan jumlah ikatan yang sesuai di sisi kiri persamaan, Anda perlu menemukan totalnya.
- Mari kita cari energi total dari ikatan putus untuk contoh kita: H-H + Br-Br = 436 + 193 = 629 kJ/mol.
Tuliskan persamaan untuk menghitung energi ikat. Menurut definisi, energi ikatan adalah jumlah dari ikatan yang putus dikurangi jumlah ikatan yang terbentuk: H = H (ikatan putus) - H (ikatan yang terbentuk) . H menunjukkan perubahan energi ikat, yang juga disebut entalpi ikat, dan H sesuai dengan jumlah energi ikat untuk kedua sisi persamaan reaksi kimia.
Tuliskan persamaan kimia dan beri label semua ikatan antara unsur-unsur individu. Jika persamaan reaksi diberikan dalam bentuk simbol dan angka kimia, akan berguna untuk menulis ulang persamaan tersebut dan menunjukkan semua ikatan antar atom. Rekaman visual seperti itu akan memungkinkan Anda untuk dengan mudah menghitung ikatan yang putus dan terbentuk selama reaksi ini.
Pelajari aturan untuk menghitung ikatan yang putus dan terbentuk. Dalam kebanyakan kasus, nilai rata-rata energi ikat digunakan dalam perhitungan. Ikatan yang sama dapat memiliki energi yang sedikit berbeda, tergantung pada molekul tertentu, sehingga energi ikatan rata-rata biasanya digunakan. .
Perbandingan data jumlah elektron pada kulit terluar dengan jumlah ikatan kimia yang dapat dibentuk oleh atom tertentu menunjukkan bahwa prinsip-prinsip pembentukan ikatan kimia, yang diungkapkan dalam studi molekul hidrogen, juga berlaku untuk atom lain. Ini karena ikatannya bersifat listrik dan dibentuk oleh dua elektron (satu dari setiap atom). Oleh karena itu, korelasi harus diharapkan antara energi ionisasi pertama (PEI) atom (memiliki asal elektrostatik) dan energi ikatnya dalam molekul diatomik.
Data eksperimen tentang penentuan energi ikat sejumlah molekul diatomik (dalam fase gas) yang terbentuk dari atom-atom periode ke-2 dan ke-3 ditunjukkan pada Tabel 4.2 dan pada gambar. 4.2.1.
Tabel 4.2
|
Molekul A2 |
Energi ikatan (kJ/mol) |
Molekul |
Energi ikatan (kJ/mol) |
||
Beras. 4.2-1 Energi ikat dalam molekul dari unsur-unsur periode kedua dan ketiga tergantung pada PEI unsur tersebut
Data ini (lihat Tabel 4.2, Gambar 4.2-1) menunjukkan bahwa energi ikat antar atom praktis tidak bergantung pada SEI atom yang terikat.
Mungkinkah dalam molekul diatomik (di mana terdapat lebih dari satu elektron) ikatan terbentuk menurut mekanisme yang berbeda dan ada tambahan kekuatan yang sebelumnya diabaikan oleh kita?
Sebelum melanjutkan ke identifikasi kekuatan-kekuatan ini, mari kita coba jelaskan ini kemerdekaan berdasarkan interaksi yang ada.
Mari kita mulai dengan belajar faktor tambahan, yang menjelaskan tidak adanya korelasi yang diharapkan dan kemerdekaan data eksperimen tentang pengukuran PEI dari energi ikat dalam molekul diatomik.
Kami membagi tabel (4.2) menjadi empat kelompok:
grup A termasuk molekul yang terdiri dari atom identik dengan energi ikat di bawah 40 kJ/mol. Dalam fase gas, molekul-molekul ini terurai menjadi atom.
Grup B termasuk molekul diatomik yang terdiri dari atom-atom identik, energi ikatnya berkisar antara 400 kJ/mol hingga 1000 kJ/mol. Memang, energi ikat dalam molekul-molekul ini berbeda secara signifikan ke atas dibandingkan dengan energi ikat dalam molekul hidrogen, yaitu 429 kJ/mol.
KelompokDARI termasuk molekul diatomik yang terdiri dari atom yang berbeda, energi ikat yang bervariasi dari 340 kJ/mol sampai 550 kJ/mol.
KelompokD termasuk molekul diatomik dengan atom identik, energi ikatnya adalah 50-350 kJ/mol.
MEJA 4.4
ENERGI KOMUNIKASIDALAM MOLEKUL
|
grup A |
grup B |
||
| molekul | energi ikat | molekul | energi ikat |
| Jadilah 2 | 30 | C2 | 602 |
| Ne 2 | 4 | N 2 | 941 |
| 7.6 | O2 | 493 | |
| Ar 2 | 7 | P2 | 477 |
| S2 | 421 | ||
|
grup C |
grup D |
||
| molekul | energi | molekul | energi |
| LiF | 572 | B2 | 274 |
| NaF | 447 | Br2 | 190 |
| LiCl | 480 | Cl2 | 239 |
| NaCl | 439 | F2 | 139 |
| Li 2 | 110 | ||
| Tidak 2 | 72 | ||
Sebelum kita memulai penjelasan, mari kita klarifikasi masalah yang perlu kita bahas.
Pertama pertanyaan:
Mengapa energi ikat antara atom multielektron jauh lebih sedikit atau lebih banyak (Tabel 4.2) daripada dalam molekul hidrogen (H2)?
Untuk menjelaskan penyimpangan yang signifikan dari energi ikat dalam molekul poliatomik dari energi ikat dalam molekul hidrogen, perlu untuk memperdalam pemahaman kita tentang alasan mengapa jumlah elektron di kulit terluar terbatas.
Pelekatan elektron ke atom terjadi ketika ada peningkatan energi, atau, dengan kata lain, jika mutlak nilai energi potensial sistem atom + elektron meningkat sebagai akibat dari ikatan antara elektron dan atom. Data afinitas atom terhadap elektron, ditunjukkan pada Tabel 4.3, memberi kita nilai numerik dari perolehan energi ketika elektron terikat pada atom.
Meja 4.3
|
Afinitas |
|
Afinitas |
Ketika elektron melekat pada atom, energi total tarikan elektron ke inti meningkat karena peningkatan jumlah elektron yang tertarik ke inti. Di sisi lain, energi tolakan antarelektron meningkat karena peningkatan jumlah elektron. Artinya, pengikatan elektron ke atom terjadi jika, sebagai akibat dari hubungan ini, perolehan energi tarik-menarik lebih besar daripada kehilangan energi karena peningkatan energi tolakan.
Menghitung perubahan energi ketika elektron ditambahkan ke atom hidrogen memberikan keuntungan energi sebesar 3,4 eV. Artinya, atom hidrogen harus memiliki afinitas elektron positif. Inilah yang diamati dalam percobaan.
Perhitungan serupa tentang perubahan energi potensial ketika elektron melekat pada atom helium menunjukkan bahwa penambahan elektron tidak menyebabkan peningkatan energi potensial, tetapi penurunannya. Memang, afinitas atom helium, menurut percobaan, kurang dari nol.
Oleh karena itu, kemungkinan melekat atau tidaknya suatu elektron pada suatu atom ditentukan oleh perbedaan perubahan nilai mutlak energi potensial tarik-menarik semua elektron ke inti dan saling tolak-menolak antarelektronik. Jika perbedaan ini lebih besar dari nol, maka elektron akan bergabung, dan jika kurang dari nol, maka tidak.
Data afinitas atom terhadap elektron yang diberikan pada Tabel 4.3 menunjukkan bahwa untuk atom periode 1, 2 dan 3, selain menjadi,mg,Tidak,Ar peningkatan energi tarik-menarik selama penempelan elektron ke inti lebih besar daripada peningkatan energi tolakan.
Dalam kasus atom menjadi,mg,Tidak,Ar, peningkatan energi tarik-menarik selama penempelan elektron ke inti lebih rendah daripada peningkatan energi tolakan antarelektron. Konfirmasi independen dari kesimpulan ini adalah informasi tentang PEI untuk atom periode ke-2 dan ke-3 yang diberikan pada Tabel 4.2 (golongan A).
Ketika ikatan kimia terbentuk, jumlah elektron di kulit elektron terluar atom bertambah satu elektron, dan menurut perhitungan model molekul hidrogen H2, muatan efektif atom terikat berubah. Muatan efektif dari inti terikat berubah karena tarikan inti bermuatan, dan karena peningkatan jumlah elektron di kulit terluar atom terikat.
Dalam molekul hidrogen, pendekatan inti menyebabkan peningkatan gaya tarik elektron pengikat ke inti sebesar 50%, yang sama dengan peningkatan muatan efektif inti terikat sebesar 0,5 unit proton (lihat Bab 3) .
Dalam hal perolehan energi, pembentukan ikatan adalah sesuatu seperti proses peralihan antara penempelan elektron ke atom netral (afinitas elektron terukur) dan penempelan elektron ke atom yang muatan nuklirnya meningkat 1 unit.
Berdasarkan Tabel 4.3, ketika beralih dari litium (PEI - 519 kJ/mol) ke berilium (PEI - 900 kJ/mol), PEI meningkat sebesar 400 kJ/mol, dan ketika beralih dari berilium ke boron (PEI - 799 kJ/mol ) perolehan energi berkurang menjadi 100 kJ/mol.
Mari kita ingat bahwa eksternal kulit elektron boron memiliki 3 elektron, dan berilium memiliki 2 elektron di kulit terluarnya. Artinya, ketika sebuah elektron bergabung dengan berilium dengan peningkatan simultan dalam muatan inti oleh satu unit proton, elektron terikat memasuki kulit terluar berilium, sedangkan perolehan energi akan menjadi 100 kJ/mol lebih kecil daripada ketika elektron memasuki kulit terluar. lithium (selama transisi dari lithium ke berilium).
Sekarang, penurunan tajam dalam energi ikat atom dengan afinitas atom-ke-elektron negatif, yang ditunjukkan pada Tabel 4.3, cukup dapat dimengerti. Namun, meskipun Tidak,menjadi,mg,Ar tidak melampirkan elektron, mereka menciptakan molekul, karena muatan inti efektif meningkat. Energi ikat dalam molekul-molekul ini (gugus TETAPI) jauh lebih rendah daripada molekul lain.
Sekarang mari kita jawab kedua pertanyaan: Mengapa energi ikat pada molekul diatomik golongan B ditunjukkan pada Tabel 4.2. 1,5-2 kali lebih besar dari energi ikat dalam molekul hidrogen?
Pada kulit terluar atom karbon (C) nitrogen (N) dan oksigen (Hai) berturut-turut adalah 4, 5 dan 6 elektron. Jumlah ikatan yang terbentuk dari atom-atom ini dibatasi oleh jumlah elektron tambahan yang dapat masuk ke kulit terluar ketika ikatan terbentuk. Jadi atom karbon (C) nitrogen (N) dan oksigen (HAI) dapat membentuk 4, 3 dan 2 ikatan kimia, masing-masing. Dengan demikian, antara dua atom yang ditunjukkan pada Tabel 4.4, tidak hanya satu, tetapi beberapa ikatan kimia dapat terbentuk, yang menyiratkan perolehan energi yang jauh lebih besar, dibandingkan dengan pembentukan 1 ikatan dalam molekul diatomik, di mana atom-atom yang terikat memiliki 1 elektron di kulit terluar
Jika atom-atom dihubungkan oleh satu ikatan kimia, maka ikatan semacam itu disebut ikatan tunggal. ikatan kimia atau ikatan kimia umum. Ketika atom dihubungkan oleh beberapa ikatan kimia (ganda atau rangkap tiga), ikatan seperti itu disebut ikatan ganda. Ikatan ganda, misalnya, dalam molekul nitrogen (N 2) dan oksigen (O2) dijelaskan dengan rumus struktur: N N dan O = O.
Sekarang pertimbangkan grupnya DARI: Mengapa energi ikat pada beberapa molekul diatomik yang terdiri dari atom yang berbeda jauh lebih besar daripada molekul lain yang terdiri dari atom yang sama?
Mari kita bongkar molekulnya NaCl. Atom natrium dan klor sangat berbeda dalam afinitas elektron. Kami menyajikan pembentukan ikatan sebagai proses dua tahap. Pada tahap pertama, perolehan energi diperoleh karena afinitas atom terhadap elektron. Artinya, dari sudut pandang ini, perolehan energi selama pembentukan molekul Cl2, harus lebih besar daripada saat membentuk molekul NaCl oleh perbedaan afinitas elektron mereka.
Saat menghitung molekul hidrogen (Bab 3), energi ikat (energi yang diperlukan untuk memisahkan molekul menjadi atom) adalah jumlah dari dua komponen:
perbedaan antara energi elektronik dari molekul hidrogen dan dua atom hidrogen;
energi tambahan yang dihabiskan untuk memanaskan molekul yang tidak terpisahkan.
Menghitung komponen pertama, kami menghitung energi molekul, yang sama dengan perbedaan antara energi tarik inti atom hidrogen ke pasangan elektron pengikat dan jumlah energi tolak gaya antarelektronik dan antarnuklear.
Untuk memperkirakan energi tarik-menarik inti terhadap pasangan elektron pengikat, serta memperkirakan energi tolakan antarelektron, pertama-tama kita harus mencari nilai muatan efektif inti terikat.
Potensi ionisasi dan energi ikat dalam molekul diatomik
tutorial
Astrakhan
Ikatan kimia: tutorial/ Ryabukhin Yu.I. - Astrakhan: Astrakhan. negara teknologi un-t, 2013. - 40 hal.
Dirancang untuk mahasiswa spesialisasi teknik dan non-kimia.
Sesuai dengan standar pendidikan negara bagian pendidikan profesional yang lebih tinggi
Ilustrasi: 15 pic., Tabel: 1, daftar pustaka: 6 judul, aplikasi.
Dicetak dengan keputusan departemen "Umum, anorganik dan kimia Analisis”(Berita No. __ tanggal _________ 2013)
Pengulas: Cand. kimia Ilmu Pengetahuan, Associate Professor Lebedeva A.P.
© Ryabukhin Yu.I., 2013
© ASTU, 2013
PENGANTAR
Di alam unsur kimia dalam bentuk atom bebas (dengan pengecualian gas mulia - unsur-unsur golongan VIIIA) praktis tidak ditemukan. Biasanya, atom suatu unsur kimia berinteraksi satu sama lain atau dengan atom unsur lain, membentuk ikatan kimia dengan penampilan zat sederhana atau kompleks. Pada saat yang sama, molekul zat yang berbeda berinteraksi satu sama lain.
Doktrin ikatan kimia adalah dasar dari semua teori kimia.
Ikatan kimia 1 - ini adalah seperangkat kekuatan yang mengikat atom satu sama lain menjadi struktur yang lebih stabil - molekul atau kristal.
Pembentukan molekul dan kristal terutama disebabkan oleh gaya tarik Coulomb antara elektron dan inti atom.
Sifat ikatan kimia baru dipahami setelah penemuan hukum mekanika kuantum (gelombang) yang mengatur dunia mikro. Teori modern menjawab pertanyaan mengapa ikatan kimia terjadi dan apa sifat kekuatannya.
Pembentukan ikatan kimia adalah proses spontan; jika tidak, tidak akan ada zat sederhana maupun kompleks. Dari sudut pandang termodinamika, alasan pembentukan ikatan kimia adalah penurunan energi sistem.
Pembentukan ikatan kimia disertai dengan pelepasan energi, dan pemutusannya membutuhkan pengeluaran energi.
Ciri-ciri ikatan kimia adalah energi dan panjangnya.
Energi ikatan kimia adalah energi yang dilepaskan dalam proses pembentukannya dan karakterisasi kekuatannya; energi ikat dinyatakan dalam kJ per mol zat yang terbentuk (E St. , kJ/mol) 2 .
Semakin besar energi ikatan kimia, semakin kuat ikatannya. Energi ikatan kimia molekul diatomik diperkirakan dengan membandingkannya dengan keadaan sebelum pembentukannya. Untuk molekul poliatomik dengan jenis ikatan yang sama, energi ikatan kimia rata-rata dihitung (misalnya, untuk H 2 O atau CH 4).
Energi ikatan kimia rata-rata ditentukan dengan membagi energi pembentukan molekul dengan jumlah ikatannya.
Panjang ikatan kimia disebut jarak antara inti atom dalam suatu molekul.
Panjang ikatan ditentukan oleh ukuran atom ikatan dan tingkat tumpang tindih kulit elektronnya.
Misalnya, untuk hidrogen fluorida dan hidrogen iodida:

aku HF< aku HAI
Tergantung pada jenis partikel yang terhubung (atom atau molekul), ada: ikatan intramolekul melalui mana molekul terbentuk, dan ikatan antarmolekul, mengarah pada pembentukan asosiasi dari molekul atau pengikatan atom dari kelompok fungsional individu dalam sebuah molekul. Jenis ikatan ini sangat berbeda dalam energi: untuk ikatan intramolekul, energinya adalah 100–1000 kJ/mol 1, dan untuk ikatan antarmolekul, biasanya tidak melebihi 40 kJ/mol.
Pertimbangkan Pendidikan intramolekul ikatan kimia pada contoh interaksi atom hidrogen.
Ketika dua atom hidrogen saling mendekat, interaksi pertukaran yang kuat terjadi antara elektron mereka dengan spin antiparalel, yang mengarah pada munculnya pasangan elektron yang sama. Ini meningkatkan kerapatan elektron di ruang internuklear, yang berkontribusi pada daya tarik inti, atom yang berinteraksi. Akibatnya, energi sistem berkurang dan sistem menjadi lebih stabil - ikatan kimia(Gbr. 1).

Beras. 1. Diagram energi pembentukan ikatan kimia antara atom hidrogen
Sistem memiliki energi minimum pada jarak tertentu antara inti atom; dengan pendekatan lebih lanjut dari atom, energi meningkat karena peningkatan gaya tolak antara inti.
Tergantung pada bagaimana pasangan elektron umum berinteraksi dengan inti atom yang bergabung, ada tiga jenis utama ikatan kimia: ikatan oval, ionik, logam, dan hidrogen.