Хибридизация на атомни орбитали. Концепцията за метода на молекулярните орбитали. Енергийни диаграми на образуването на молекулярни орбитали за бинарни хомонуклеарни молекули. Когато се образува химическа връзка, свойствата на взаимодействащите атоми се променят, преди всичко енергията и заемането на техните външни орбитали.
Споделяйте работата си в социалните мрежи
Ако тази работа не ви устройва, в долната част на страницата има списък с подобни произведения. Можете също да използвате бутона за търсене
Страница 13
Лебедев Ю.А. Лекция 0 2
Лекция №0 2
Химическа връзка. Характеристики на химичната връзка: енергия, дължина, ъгъл на свързване. Видове химична връзка. Комуникационна полярност. Квантово-механични идеи за природата на ковалентната връзка. Концепцията за метода на валентните връзки. Хибридизация на атомни орбитали.- (c yigma) и  (pi)-връзки. Геометрична конфигурация на молекулите. Електрически момент на дипола на молекула. Концепцията за метода на молекулярните орбитали. Енергийни диаграми на образуването на молекулярни орбитали за бинарни хомонуклеарни молекули. Сигма (
(pi)-връзки. Геометрична конфигурация на молекулите. Електрически момент на дипола на молекула. Концепцията за метода на молекулярните орбитали. Енергийни диаграми на образуването на молекулярни орбитали за бинарни хомонуклеарни молекули. Сигма ( ) и Pi(
) и Pi(  )-молекулярни орбитали. Диа- и парамагнитни молекули.
)-молекулярни орбитали. Диа- и парамагнитни молекули.
НАПОМНЕНИЕ
уравнение на Шрьодингер. - вълнова функция.
E \u003d f (n, l, m, s).
Химическа връзка. Характеристики на химичната връзка: енергия, дължина, ъгъл на свързване.
Разгледахме структурата на електронните нива на изолирани атоми. Това са много редки обекти на практика. Единственото изключение е инертният газ аргон с електронна формула 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 . И въпреки че е „само“ 0,93% vol в атмосферата, всеки от вас буквално „поглъща“ около триста квинтилони парчета аргонови атоми на един дъх.
Всички други вещества и материали, с които работим, съдържатхимически свързаниатоми. Взаимодействието на свободните атоми един с друг води до образуването на молекули, йони и кристали. Това са „класически“ химически обекти. Напоследък обаче важна роля придобиват такива обекти като наноструктури, повърхностни съединения, бертолиди и редица други практически важни „некласически“ химически обекти.
Химическата връзка се дължи на взаимодействието на електроните във външните електронни обвивки на атомите.Тези орбитали, които участват в образуването на химическа връзка, се наричатвалентни орбитали, а електроните, разположени върху тях, са валентни електрони.
Когато се образува химическа връзка, свойствата на взаимодействащите атоми се променят и преди всичко енергията и заетостта на техните външни орбитали.
Когато се образува химическа връзка, общата енергия на електроните във валентни орбитали е по-малка от енергията им в свободните атоми. Тази разлика в енергията се нарича енергия на химическата връзка.
Типичната енергия на химическата връзка е стотици kJ/mol.
Важна количествена характеристика на химическата връзка е нейната дължина.Дължината на връзката е разстоянието между ядрата на химически свързани атоми в стабилно състояние на молекулата.
Типичната дължина на химическа връзка е десети от нанометъра. 1
Ако два или повече други атома участват в образуването на молекула при взаимодействие с даден атом, тогава възниква въпросът за неговата геометрична структура или химическа структура. Основите на теорията за химическата структура на молекулите са положени от A.M. Butlerov 2
Една от най-важните количествени характеристики на структурата на сложните молекули есвързващ ъгъл - ъгълът, образуван от две посоки на химични връзки, произлизащи от един атом.
Видове химична връзка. Комуникационна полярност.
Според естеството на взаимодействието на валентните електрони и вида на орбиталите, образувани по време на взаимодействието,химичните връзки са разделени на следните основни видове:ковалентни (полярни и неполярни), йонни, донорно-акцепторни, водородни и междумолекулни (наричани още ван дер Ваалс).
Още през 1916 г. американският химик Г. Н. Луис 3 изрази идеята, че химическа връзка се образува от електронна двойка, която е графично представена с валентна линия:
F + F = F 2 (F-F).
Ако електроотрицателността на атомите е еднаква, тогава такава връзка се нарича неполярна. Ако е различно - полярно.
Когато се образува полярна ковалентна връзка, атомите придобиват допълнителен заряд - отрицателен за атом с по-висока електроотрицателност и положителен за атом с по-ниска електроотрицателност:
H + Cl = HCl ( 
 )
)
В случай, че разликата в електроотрицателността на взаимодействащите атоми е голяма, връзкатасчита се за йонен:
Na + Cl \u003d NaCl (Na + Cl -).
Ако електронната двойка, която образува връзката, е принадлежала на един от атомите преди взаимодействието, тогава такава връзка се нарича донорно-акцепторна връзка. Атом, който е предоставил електронна двойка, се нарича донор, а атом, който го е приел в свободна орбитала, се нарича акцептор.
Особено характерна е появата на донорно-акцепторни връзки.д - метали със свободно или частично запълванед -орбитали за образуване на комплексни съединения.
За други видове комуникация ще говорим по-късно.
Квантово-механични идеи за природата на ковалентната връзка.
От съвременна гледна точка ковалентна връзка възниква по време на квантово механичното взаимодействие на всички електрони на всички взаимодействащи атоми. Но, както казахме в лекция № 1, няма точно решение на уравнението на Шрьодингер, описващо орбиталите на много електрони в молекулите. Задачата на квантово-механичното описание на химическата връзка се улеснява от факта, че по време на нейното образуване ролята на електроните, разположени върху вътрешната и външната електронна обвивка, е значително различна.
Следователно беше възможно да се създадат различни приблизителни методи за описание на химическата връзка.
Квантовата химия разполага с богат арсенал от приложни програми, които позволяват да се извършват изчисления с висока точност за широк клас молекули и йони. 4
Все още обаче няма универсален и достатъчно точен квантово-химичен алгоритъм.
За качествено разбиране на структурата на химичните съединения се използват два метода -метод на валентна връзка (MVS)и молекулярно орбитален метод (МО).
Концепцията за метода на валентните връзки. Геометрична конфигурация на молекулите. Електрически момент на дипола на молекула.
Основните постулати на метода на валентните връзки са:
1. Единична ковалентна химична връзка се осъществява от два валентни електрона, които заемат две орбитали - по една от всеки от взаимодействащите атоми. В този случай спиновете на електроните, образуващи валентната двойка, трябва да са противоположни (връзката се образува от електрони с антипаралелни спинове).
2. Първоначалните атомни орбитали (АО) запазват формата си и в състава на молекулата.
3. Връзката се образува поради припокриването на орбитали, което води до увеличаване на електронната плътност между ядрата на взаимодействащите атоми в посоката, която осигурява максимално припокриване.
Помислете за образуването на химическа връзка от MHS в молекула на водна пара - H2O.
Молекулата се състои от един кислороден атомО и два водородни атомаХ . Електронна формула на кислородния атом 1 s 2 2 s 2 2 p 4 . Във външното енергийно ниво има 6 електрона. Подниво 2с е запълнена. На подниво 2 p на една от p -орбитали (да речем py ,) има електронна двойка, а на другите две ( p x и p z ) - един несдвоен електрон. Именно те ще участват в образуването на химическа връзка.

Електронна формула на водородния атом 1с 1 . Водородът има такъвс -електрон, чийто орбитален контур е сфера и той ще участва в припокриване сстр - кислородна орбитала, образуваща химическа връзка. Общо такива sp В молекулата на водата ще има две припокривания. И структурата на молекулата ще изглежда така:

Както се вижда от фигурата, водната молекула има две ковалентни химически връзки, насочени по осите Z и X . Следователно ъгълът на свързване в този модел е 90относно . Експериментът показва, че този ъгъл е 104,5о.
Доста добро съвпадение за най-простия качествен модел без никакви изчисления!
Електроотрицателността на Мъликен на кислорода е 3,5, а тази на водорода е 2,1. Следователно всяка от връзките ще бъде полярна, а зарядът - ще бъде на кислород, и
- ще бъде на кислород, и + - на водород, т.е. образуват се три центъра на електрически заряд. В молекулата се образуват два електрически дипола.
+ - на водород, т.е. образуват се три центъра на електрически заряд. В молекулата се образуват два електрически дипола.
Диполът е два еднакви заряда, разделени на крайно разстояние.л един от друг. Диполът се характеризира с диполен момент
 =
=

Диполът е вектор, насочен от отрицателния полюс към положителния. В молекулата на водата се образуват два диполни момента на връзките, които при добавяне дават общия диполен момент на молекулата. Схемата на диполните моменти на водна молекула според MVS модела има формата:

Важно е да се подчертае, че диполните моменти на връзката се сумират векторно и общият диполен момент зависи от геометрията на молекулата. Както можете да видите, в този случай, поради факта, че връзките са насочени под прав ъгъл една спрямо друга, молекулата като цяло се оказва полярна. И експериментът потвърждава това – диполният момент на водната молекула е 1,84 Дебай. (1 дебай е равно на 0,33*10-29 C*m)
Геометричната структура на връзките в молекулите може да бъде много разнообразна. Връзките могат да бъдат разположени както в равнината, така и в пространството, образувайки молекули под формата на триизмерни тела с различни конфигурации (тригонални, тетрагонални, шестоъгълни пирамиди, бипирамиди, пръстени, съставени от пирамиди и др.)
Прочетете повече за връзката между структурата на химичните връзки и геометрията на молекулите в учебника на стр. 119-128).
 - (c yigma) и
- (c yigma) и  (pi)-връзки.
(pi)-връзки.
Да се върнем към припокриването на орбитали при образуването на връзки. В нашия примерплощ на максимално припокриване s и p орбитали лежи на линията, свързваща центровете на атомите. Този тип покритие се нарича -връзки.
-връзки.
Помислете за друг случай - кислородната молекула O2 . Както видяхме, кислородният атом има двастр Орбитали, които съдържат електрони, които могат да образуват химическа връзка. Добре познатата структурна формула на кислородаО=О . Молекулата на кислорода има двойна връзка. Един от тях е току-що обсъденият. -Връзка. А вторият? Оказва се, че втората връзка се образува поради друг вид орбитално припокриване, което се нарича
-Връзка. А вторият? Оказва се, че втората връзка се образува поради друг вид орбитално припокриване, което се нарича -комуникация.
-комуникация.
Концепцията на  и
и  връзки, изтъкнати от F. Hund.
връзки, изтъкнати от F. Hund.
В образованието  -връзките на орбиталите се припокриват по такъв начин, че се образуват две припокриващи се области и те са разположени симетрично спрямо равнината, на която лежат ядрата на взаимодействащите атоми.
-връзките на орбиталите се припокриват по такъв начин, че се образуват две припокриващи се области и те са разположени симетрично спрямо равнината, на която лежат ядрата на взаимодействащите атоми.
Геометрично изглежда така:

Моля, имайте предвид, че -връзката се образува от по-малки частистр -орбитали, в които плътността на "електронния облак" е по-голяма и следователно тази връзка е по-силна
-връзката се образува от по-малки частистр -орбитали, в които плътността на "електронния облак" е по-голяма и следователно тази връзка е по-силна -връзки. Всъщност експериментът показва, че във въглеродните съединения етан С 2 H 6 (CH 3 - CH 3 - един
-връзки. Всъщност експериментът показва, че във въглеродните съединения етан С 2 H 6 (CH 3 - CH 3 - един  -връзка), етилен C 2 H 4 (CH 2 = CH 2 - един
-връзка), етилен C 2 H 4 (CH 2 = CH 2 - един  - комуникация и един
- комуникация и един  -връзка) и ацетилен С 2 H 2 (C NS H - един
-връзка) и ацетилен С 2 H 2 (C NS H - един  - комуникация и две
- комуникация и две  -връзки) тяхната енергия на разкъсване е съответно 247, 419 и 515 kJ/mol.
-връзки) тяхната енергия на разкъсване е съответно 247, 419 и 515 kJ/mol.
Сега можем да завършим списъка с постулати на MVS:
4.
Ако в молекулата се образуват множество (двойни и тройни) връзки, тогава една от тях ще бъде - комуникация и други -
- комуникация и други - -връзки).
-връзки).
Имайте предвид, че в връзките d- и f -метали, е възможно образуването на друг вид връзки - -връзки, когато припокриването се случва в четири пространствени области и равнината на симетрия е перпендикулярна на линията, свързваща ядрата на атомите.
-връзки, когато припокриването се случва в четири пространствени области и равнината на симетрия е перпендикулярна на линията, свързваща ядрата на атомите.
Хибридизация на атомни орбитали.
Когато се образуват химични връзки, може да възникне важно явление, което се наричаорбитална хибридизация.
Помислете за атом на берилийБъда . Електронната му формула е 1 s 2 2 s 2 . Съдейки по факта, че всички електрони на берилия са сдвоени, такъв атом трябва да се държи химически като инертни газове - да не влиза в химични взаимодействия.
Нека обаче разгледаме внимателно диаграмата на електронната дифракция на берилиевия атом:

От диаграмата може да се види, че берилиевият атом има освен запълнените 2с -3 още свободни орбитали 2стр -орбитали! Вярно е, че енергията на тези орбитали е по-голяма от енергията на 2с -орбитали на величина Е . Но тази енергия е малка и по-малка от тази, която се отделя при образуването на химическа връзка. Следователно атомът има тенденция да пренарежда своите орбитали в хода на взаимодействието, за да постигне енергийно благоприятно крайно състояние. За такова пренареждане се използва кинетичната енергия на частиците, взаимодействащи с даден атом. Ще говорим за този енергиен източник по-подробно, когато обсъждаме въпросите на химическата кинетика. 5
Е . Но тази енергия е малка и по-малка от тази, която се отделя при образуването на химическа връзка. Следователно атомът има тенденция да пренарежда своите орбитали в хода на взаимодействието, за да постигне енергийно благоприятно крайно състояние. За такова пренареждане се използва кинетичната енергия на частиците, взаимодействащи с даден атом. Ще говорим за този енергиен източник по-подробно, когато обсъждаме въпросите на химическата кинетика. 5
Това пренареждане се нарича хибридизация на орбитали, тъй като по време на този процес от „двата вида” орбитали възниква ново.
На езика на вълновите функции това се описва с уравнение, свързващо хибридната вълнова функция на получените орбитали с оригиналните вълнови функции.
Броят на образуваните хибридни орбитали е равен на броя на орбиталите, които са участвали в процеса на хибридизация.
Графично този процес може да бъде представен със следната диаграма:

Имайте предвид, че енергията, необходима за хибридизацияЕ хибрид по-малко от енергийната разлика между хибридизиращите орбиталиЕ.
При обозначаването на хибридни орбитали се запазват обозначенията на оригиналните орбитали. Така че, в този случай (атомБъда ), хибридизирайте един s и една стр -орбитала, а двете хибридни орбитали се означават като sp -орбитали. Необходимостта от хибридизация само на две орбитали се дължи на факта, че берилиевият атом има само два електрона във външното си енергийно ниво.
В други случаи, когато няколко еднакви орбитали участват в хибридизацията, техният брой се отбелязва с степен. Например при хибридизиране на един s и две стр получават се три орбитали sp 2 -орбитали, а при хибридизиране една s и три стр -орбитали - четири sp 3 орбитали.
В разглеждания случай, в съответствие с правилото на Хунд, берилиевият атом получава два несдвоени електрона и способността да образува две ковалентни химични връзки.
образуват се хибридни орбитали s, p и дори d -орбиталите се различават малко по форма и изглеждат така („асиметрична дъмбел“):

Имайте предвид, че броят на хибридните орбитали е равен на броя на орбиталите, участващи в тяхното създаваненезависимо от броя и вида на хибридизиращите орбитали.
Разположението на хибридните орбитали в космоса се определя от техния брой.
По-конкретно, берилиевият атом има два хибрида sp Орбиталите са разположени по една права линия (под ъгъл 180о ), което съответства на тенденцията на подобно заредените електрони, които ги заемат, да се отдалечават един от друг колкото е възможно повече:

| Повече ▼ за метода на валентните връзки и хибридизация можете да прочетете тук:
http://center.fio.ru/method/resources/Alikberovalyu/2004/stroenie/gl_10.html#104
Молекулите често имат орбитали, заети от електронна двойка („самотна електронна двойка“). Такива орбитали не участват в образуването на химични връзки, но влияят върху геометричната структура на молекулата.
Модификацията на MVS, като се отчита влиянието на такива орбитали, се нарича теория на отблъскването на електронните двойки валентни орбитали (VEPR) и можете да се запознаете с нея в учебника на стр. 124 - 128.
Концепцията за метода на молекулярните орбитали.
Разгледахме феномена на АО хибридизация в рамките на MVS. Оказа се, че идеята за хибридизация е плодотворна и за по-дълбоко моделиране на химичните връзки. Той е в основата на втория метод за тяхното описание, който се разглежда в нашия курс - методътмолекулярни орбитали(МО).
Основният постулат на този метод е твърдението, че АО на атоми, взаимодействащи един с друг, губят своята индивидуалност и образуват обобщени МО, т.е. че електроните в молекулите не "принадлежат" на нито един отделен атом, а се движат квантово механично в цялата молекулна структура.
Има няколко разновидности на MO метода, които вземат предвид bотносно повече или по-малко фактори и съответно повече или по-малко сложни математически. Най-простото е приближението, което отчита само линейните ефекти от взаимодействието на електрони. Това приближение се нарича метод MO LCAO (линейна комбинация от атомни орбитали).
На езика на квантовата механика това твърдение за най-простия случай на взаимодействие на две орбитали се записва по следния начин:
Където  - MO вълнова функция,
- MO вълнова функция, е вълновата функция на AO на първия атом,
е вълновата функция на AO на първия атом, е вълновата функция на AO на втория атом,а и б са числови коефициенти, характеризиращи приноса на даден АО към цялостната структура на МО.
е вълновата функция на AO на втория атом,а и б са числови коефициенти, характеризиращи приноса на даден АО към цялостната структура на МО.
Тъй като от дясната страна е изписан линеен полином, тази модификация на MO метода се нарича LCAO.
От уравнението може да се види, чекогато две AO взаимодействат, се получават две MO. Един от тях се наричазадължителен МО, а другият - разхлабващ МО.
Защо са получили такова име става ясно от фигурата, която показва енергийната диаграма на орбиталите в молекула:

Както се вижда от фигурата, свързващият МО има енергия, по-ниска от енергиите на първоначалния AO, а разхлабващият МО има по-висока енергия. (Съответно,). Естествено, в съответствие с принципа на минималната енергия, електроните в една молекула ще заемат свързващата орбитала на първо място, когато се образува връзка.
Като цяло, при взаимодействие N AO става N MO .
Сигма (  ) и пи(
) и пи(  )-молекулярни орбитали.
)-молекулярни орбитали.
В резултат на количествени изчисления по метода MO LCAO се оказа, че концепциите на и
и  симетриите на орбиталите също се запазват в метода MO LCAO.
симетриите на орбиталите също се запазват в метода MO LCAO.
Ето как изглеждат очертанията -свързване (означено като
-свързване (означено като или) и
или) и  -разхлабване (означено като или) орбитали в метода MO LCAO:
-разхлабване (означено като или) орбитали в метода MO LCAO:

А ето как изглеждат очертанията - подвързване (
- подвързване (  ) и
) и  - разхлабване (
- разхлабване (  *
) орбитали по метода MO LCAO:
*
) орбитали по метода MO LCAO:


Енергийни диаграми на образуването на молекулярни орбитали за бинарни хомонуклеарни молекули.
Изчисляването на енергията на молекулярните орбитали за сложни молекули, които включват ядрата на различни елементи (хетеронуклеарни молекули) е сложна изчислителна задача дори за съвременните компютри. Следователно всяко изчисление на отделни молекули е отделна творческа работа.
Въпреки това се оказа, че енергийната диаграма за бинарни хомонуклеарни молекули на елементи от втория период на Периодичната система на Д. И. Менделеев е универсална и има формата:

Понякога литературата дава различни диаграми за елементитеБ ,C,N и последващиО, Ф, Не , обаче, изследвания на магнитните свойства на молекулата B2 при свръхниски температури не потвърждават недвусмислено необходимостта от усложняване на формата на енергийните диаграми за B,C,N
Диа- и парамагнитни молекули. Множество на връзките според MO LCAO.
Едно от сериозните предимства на метода MO LCAO в сравнение с метода VS е по-правилното описание на магнитните свойства на молекулите и по-специално обяснението на парамагнетизма на молекулния кислород. 6
Нека си припомним структурата на кислородната молекула според MHS, която разгледахме по-рано. Според тази структура всички валентни електрони и и
и  -връзки в молекула O2 образуват електронни двойки и общият спин на молекулата е нула.
-връзки в молекула O2 образуват електронни двойки и общият спин на молекулата е нула.
Структурата на орбиталите на тази молекула съгласно метода MO LCAO, получена чрез запълване с електрони MO в съответствие с горната енергийна диаграма, има формата:

Както може да се види от тази диаграма, кислородната молекула съдържа два несдвоени електрона на антисвързването и
и  орбитали. Техните магнитни моменти се сумират и дават общия магнитен момент на молекулата. Експериментът показва, че магнитният момент на кислородната молекула е 2,8
орбитали. Техните магнитни моменти се сумират и дават общия магнитен момент на молекулата. Експериментът показва, че магнитният момент на кислородната молекула е 2,8 (Вътрешният магнитен момент на електрона е 1
(Вътрешният магнитен момент на електрона е 1 ). Като се има предвид, че общият магнитен момент включва и орбиталния в допълнение към вътрешния електронен момент, количественото съгласие много убедително свидетелства в полза на валидността на МО метода.
). Като се има предвид, че общият магнитен момент включва и орбиталния в допълнение към вътрешния електронен момент, количественото съгласие много убедително свидетелства в полза на валидността на МО метода.
При наличие на магнитен момент материята ставапарамагнитен -то е "привлечено от магнит". 7 При липса на магнитен момент веществотодиамагнитен - то е "изтласкано" от магнитното поле. 8
В допълнение към магнитните свойства, анализът на енергийните диаграми на MO LCAO дава възможност да се определимножествеността (или реда) на химическа връзка (CS или PS).
KS \u003d ½ (N връзки - N razr)
където N е свързан е общият брой на електроните в свързващите орбитали; N рез е общият брой електрони в антисвързващи орбитали).
Разгледахме различни случаи на проявление и описание на ковалентни химични връзки. Това е основният тип химична връзка, тъй като по-голямата част от химичните елементи имат причина за възникването му - наличието на валентни електрони.
Но в някои случаи на взаимодействие на атоми възникват специални условия, които пораждат специални видове връзки, които ще разгледаме в следващата лекция.
При което един мол от дадена връзка се разрушава. Приема се, че изходното вещество и реакционните продукти са в стандартните си състояния на хипотетичен идеален газ при налягане 1 атм и температура 25 0 С. Синоними на енергията на разрушаване на химическа връзка са: енергия на връзката, енергия на дисоциация на двуатомни молекули, енергия на образуване на химическа връзка.
Енергията на разрушаване на химическа връзка може да се определи по различни начини, например
От мас-спектроскопски данни (масова спектрометрия).
Енергията на разкъсване на химичните връзки в различни съединения е отразена в справочника.
Енергията на разрушаване на химичните връзки характеризира силата на химическата връзка.
| Съединение | Съединение | Енергия на разрушаване на връзката, kcal/mol | |
|---|---|---|---|
| H-H | 104,2 | CH3-H | 104 |
| HO-H | 119 | CH3CH2-H | 98 |
| CH3O-H | 102 | (CH3)2CH-H | 94,5 |
| C6H5O-H | 85 | (CH3)3C-H | 91 |
| F-H | 135,8 | C6H5-H | 103 |
| Cl-H | 103,0 | CH 2 \u003d CH-H | 103 |
| Br-H | 87,5 | HC≡C-H | 125 |
| I-H | 71,3 | H2N-H | 103 |
Енергията на прекъсване на връзката C-C.
Вижте също
Бележки
Фондация Уикимедия. 2010 г.
Вижте какво представлява "Енергия за разрушаване на химическа връзка" в други речници:
То е равно на работата, която трябва да се изразходва, за да се раздели една молекула на две части (атоми, групи от атоми) и да се отстранят една от друга на безкрайно разстояние. Например, ако се разглежда E. x. с. H3CH H в молекула на метан, тогава такъв ... ... Голяма съветска енциклопедия
Екзотермичната реакция е химична реакция, придружена от отделяне на топлина. Обратното на ендотермичната реакция. Общото количество енергия в една химическа система е изключително трудно за измерване или изчисляване... Wikipedia
Фиг.1 Тройна връзка в рамките на теорията на валентните връзки Тройната връзка е ковалентна връзка на два атома в една молекула чрез три общи свързващи електронни двойки. Първата снимка на визуалната структура на тройната връзка е дадена в ... Wikipedia
Отличителна черта на алкохолите е хидроксилната група при наситен въглероден атом на фигурата, подчертана в червено (кислород) и сиво (водород). Алкохоли (от латински ... Wikipedia
C (карбон), неметален химичен елемент от подгрупата IVA (C, Si, Ge, Sn, Pb) от Периодичната таблица на елементите. Среща се в природата под формата на диамантени кристали (фиг. 1), графит или фулерен и други форми и е част от органични ... ... Енциклопедия на Collier
Енергията на връзката е важно понятие в химията. Той определя количеството енергия, необходимо за прекъсване на ковалентна връзка между два газови атома. Тази концепция не е приложима за йонни връзки. Когато два атома се комбинират, за да образуват молекула, може да се определи колко силна е връзката между тях – достатъчно е да се намери енергията, която трябва да се изразходва, за да се разруши тази връзка. Не забравяйте, че един атом няма енергия на свързване, тази енергия характеризира силата на връзката между два атома в една молекула. За да изчислите енергията на връзката за всяка химическа реакция, просто определете общия брой на разкъсаните връзки и извадете броя на връзките, образувани от него.
Стъпки
Част 1
Идентифицирайте счупени и образувани връзки- Прекъсванията на единична, двойна и тройна химическа връзка се считат за една скъсана връзка. Въпреки че тези връзки имат различни енергии, във всеки случай една връзка се счита за прекъсната.
- Същото важи и за образуването на единична, двойна или тройна връзка. Всеки такъв случай се разглежда като образуване на една нова връзка.
- В нашия пример всички облигации са единични.
-
Определете кои връзки са прекъснати от лявата страна на уравнението.Лявата страна на химическото уравнение съдържа реагентите и представлява всички връзки, които се разкъсват в резултат на реакцията. Това е ендотермичен процес, тоест отнема определено количество енергия за разрушаване на химическите връзки.
- За нашия пример лявата страна на уравнението на реакцията съдържа една H-H връзка и една Br-Br връзка.
-
Пребройте броя на връзките, образувани от дясната страна на уравнението.Продуктите на реакцията са показани вдясно. Тази част от уравнението представя всички връзки, които се образуват в резултат на химическа реакция. Това е екзотермичен процес и освобождава енергия (обикновено под формата на топлина).
- В нашия пример дясната страна на уравнението съдържа две H-Br връзки.
Част 2
Изчислете енергията на свързване-
Намерете необходимите енергии на свързване.Има много таблици, които изброяват енергии на свързване за голямо разнообразие от съединения. Такива таблици могат да бъдат намерени в интернет или справочник по химия. Трябва да се помни, че енергията на свързване винаги се дава за молекули в газообразно състояние.
-
Умножете енергиите на връзките по броя на прекъснатите връзки.При редица реакции една връзка може да бъде разкъсана няколко пъти. Например, ако една молекула се състои от 4 водородни атома, тогава енергията на свързване на водорода трябва да се вземе предвид 4 пъти, тоест умножена по 4.
- В нашия пример всяка молекула има една връзка, така че енергиите на връзката просто се умножават по 1.
- Н-Н = 436 х 1 = 436 kJ/mol
- Br-Br = 193 x 1 = 193 kJ / mol
-
Съберете всички енергии на разбитите връзки.След като умножите енергиите на свързване по съответния брой връзки от лявата страна на уравнението, трябва да намерите общата сума.
- Нека намерим общата енергия на прекъснатите връзки за нашия пример: H-H + Br-Br = 436 + 193 = 629 kJ/mol.
Запишете уравнение за изчисляване на енергията на свързване.По дефиниция енергията на връзката е сумата от разкъсаните връзки минус сумата от образуваните връзки: ΔH = ∑H (скъсани връзки) - ∑H (образувани връзки). ΔH означава промяната в енергията на свързване, която също се нарича енталпия на свързване, а ∑H съответства на сумата от енергии на свързване за двете страни на уравнението на химическата реакция.
Запишете химичното уравнение и маркирайте всички връзки между отделните елементи.Ако уравнението на реакцията е дадено под формата на химически символи и числа, е полезно да го пренапишете и да посочите всички връзки между атомите. Такъв визуален запис ще ви позволи лесно да преброите връзките, които са счупени и образувани по време на тази реакция.
Научете правилата за броене на счупени и образувани връзки.В повечето случаи при изчисленията се използват средните стойности на енергията на свързване. Една и съща връзка може да има малко различни енергии, в зависимост от конкретната молекула, така че обикновено се използват средни енергии на връзката. .
Сравнението на данните за броя на електроните във външната обвивка с броя на химическите връзки, които даден атом може да образува, показа, че принципите на образуване на химична връзка, разкрити при изследването на водородната молекула, са валидни и за други атоми. Това е така, защото връзката е електрическа по природа и се образува от два електрона (по един от всеки атом). Следователно трябва да се очаква корелация между първата йонизираща енергия (PEI) на атомите (имащи електростатичен произход) и тяхната енергия на свързване в двуатомни молекули.
Експериментални данни за определяне на енергията на свързване за редица двуатомни молекули (в газовата фаза), образувани от атоми от 2-ри и 3-ти периоди, са показани в Таблица 4.2 и на Фиг. 4.2.1.
Таблица 4.2
|
Молекула А 2 |
Енергия на връзката (kJ/mol) |
Молекула |
Енергия на връзката (kJ/mol) |
||
Ориз. 4.2-1 Енергия на свързване в молекули от елементи от втория и третия период в зависимост от PEI на елемента
Тези данни (виж Таблица 4.2, Фиг. 4.2-1) показват, че енергията на свързване между атомите е практически независима от SEI на свързаните атоми.
Възможно ли е в двуатомните молекули (където има повече от един електрон) връзката да се образува по различен механизъм и да има допълнителенсили, игнорирани преди от нас?
Преди да пристъпим към идентифицирането на тези сили, нека се опитаме да обясним това независимоствъз основа на съществуващи взаимодействия.
Нека започнем с разглеждане на допълнителни фактори, които обясняват липсата на очаквана корелация и независимостекспериментални данни за измерване на PEI от енергията на свързване в двуатомни молекули.
Разделяме таблицата (4.2) на четири групи:
Група Авключва молекули, състоящи се от идентични атоми с енергия на свързване под 40 kJ/mol. В газовата фаза тези молекули се разпадат на атоми.
Група Бвключва двуатомни молекули, състоящи се от идентични атоми, енергията на свързване в които варира от 400 kJ/mol до 1000 kJ/mol. Наистина, енергията на свързване в тези молекули се различава значително нагоре в сравнение с енергията на свързване в молекулата на водорода, която е 429 kJ/mol.
ГрупаСвключва двуатомни молекули, състоящи се от различни атоми, чиято енергия на свързване варира от 340 kJ/mol до 550 kJ/mol.
Групадвключва двуатомни молекули с еднакви атоми, чиято енергия на свързване е 50-350 kJ/mol.
ТАБЛИЦА 4.4
КОМУНИКАЦИОННА ЕНЕРГИЯВ МОЛЕКУЛИ
|
група А |
група Б |
||
| молекула | Свързваща енергия | молекула | Свързваща енергия |
| бъде 2 | 30 | C2 | 602 |
| Не 2 | 4 | N 2 | 941 |
| 7.6 | O2 | 493 | |
| Ар 2 | 7 | P2 | 477 |
| S2 | 421 | ||
|
група С |
група D |
||
| молекула | енергия | молекула | енергия |
| LiF | 572 | B2 | 274 |
| NaF | 447 | Br2 | 190 |
| LiCl | 480 | Cl2 | 239 |
| NaCl | 439 | F2 | 139 |
| Ли 2 | 110 | ||
| на 2 | 72 | ||
Преди да започнем с обяснението, нека изясним проблемите, които трябва да обхванем.
Първовъпрос:
Защо енергията на свързване между многоелектронни атоми е много по-малка или много повече (Таблица 4.2), отколкото в молекула на водород (H2)?
За да обясним значителното отклонение на енергията на свързване в многоатомните молекули от енергията на свързване в молекулата на водорода, е необходимо да задълбочим разбирането си за причината, поради която броят на електроните във външната обвивка е ограничен.
Прикрепването на електрон към атом се случва, когато има печалба в енергията или, с други думи, ако абсолютенстойността на потенциалната енергия на системата атом + електроннараства в резултат на връзката между електрона и атома. Данните за афинитета на атом към електрон, посочени в Таблица 4.3, ни дават числената стойност на печалбата в енергията, когато електрон е прикрепен към атом.
Таблица 4.3
|
Афинитет |
|
Афинитет |
Когато електронът е прикрепен към атом, общата енергия на привличане на електрони към ядрото се увеличава поради увеличаване на броя на електроните, привлечени от ядрото. От друга страна, енергията на междуелектронното отблъскване се увеличава поради увеличаване на броя на електроните. Тоест, прикрепването на електрон към атом се случва, ако в резултат на тази връзка печалбата в енергията на привличане е по-голяма от загубата на енергия поради увеличаване на енергията на отблъскване.
Изчисляване на промяната в енергията при добавяне на електрон към атом водороддава енергийна печалба от 3,4 eV. Тоест, водородният атом трябва да има положителен електронен афинитет. Това се наблюдава в експеримента.
Подобно изчисление на промяната в потенциалната енергия, когато електрон е прикрепен към атом хелийпоказва, че добавянето на електрон води не до увеличаване на потенциалната енергия, а до нейното намаляване. Всъщност афинитетът на хелиевия атом, според експеримента, е по-малък от нула.
Следователно възможността за прикрепяне или неприкрепване на електрон към атом се определя от разликите в промяната в абсолютните стойности на потенциалната енергия на привличане на всички електрони към ядрото и взаимното междуелектронно отблъскване. Ако тази разлика е по-голяма от нула, тогава електронът ще се присъедини, а ако е по-малка от нула, тогава не.
Данните за афинитета на атомите към електрона, дадени в Таблица 4.3 показват, че за атоми от 1-ви, 2-ри и 3-ти период, освен бъда,mg,не,Арувеличаването на енергията на привличане по време на прикрепването на електроните към ядрото е по-голямо от увеличаването на енергията на отблъскване.
В случай на атоми бъда,mg,не,Ар,увеличаването на енергията на привличане по време на прикрепването на електроните към ядрото е по-ниско от увеличаването на енергията на междуелектронното отблъскване. Независимо потвърждение на това заключение е информацията за PEI за атоми от 2-ри и 3-ти периоди, дадена в Таблица 4.2 (група А).
Когато се образува химическа връзка, броят на електроните във външните електронни обвивки на атомите се увеличава с един електрон и според изчислението на модела на водородната молекула H 2,променят се ефективните заряди на свързаните атоми. Ефективните заряди на свързаните ядра се променят поради привличането на заредени ядра и поради увеличаване на броя на електроните във външните обвивки на свързаните атоми.
В молекула на водорода приближаването на ядрата води до увеличаване на силата на привличане на свързващите електрони към ядрата с 50%, което е равно на увеличаване на ефективния заряд на свързаните ядра с 0,5 протонни единици (вижте глава 3) .
По отношение на енергийната печалба, образуването на връзка е нещо като междинен процес между прикрепването на електрон към неутрален атом (измерен електронен афинитет) и прикрепването на електрон към атом, чийто ядрен заряд се увеличава с 1 единица.
Според Таблица 4.3 при преминаване от литий (PEI - 519 kJ/mol) към берилий (PEI - 900 kJ/mol), PEI се увеличава с 400 kJ/mol, а при преминаване от берилий към бор (PEI - 799 kJ/mol ) енергийната печалба намалява до 100 kJ/mol.
Припомнете си, че външната електронна обвивка на бора има 3 електрона, а външната обвивка на берилия има 2 електрона. Тоест, когато електрон се присъедини към берилия с едновременно увеличаване на ядрения заряд с една протонна единица, свързаният електрон влиза във външната обвивка на берилия, докато енергийната печалба ще бъде 100 kJ/mol по-малка, отколкото когато електрон влезе във външната обвивка на литий (при прехода от литий към берилий).
Сега рязкото намаляване на енергията на свързване на атоми с отрицателен афинитет между атоми и електрони, посочено в Таблица 4.3, е напълно разбираемо. Въпреки това, въпреки че не,бъда,mg,Арне прикачват електрони, те създават молекули, т.к ефективният ядрен заряд се увеличава. Енергията на свързване в тези молекули (група НО) е много по-нисък, отколкото в други молекули.
Сега да отговорим второвъпрос: Защо енергията на свързване в двуатомните молекули от група В е показана в таблица 4.2. 1,5-2 пъти по-голяма от енергията на свързване в молекулата на водорода?
Върху външните обвивки на въглеродните атоми (° С)азот (Н)и кислород (о)са съответно 4, 5 и 6 електрона. Броят на връзките, които тези атоми образуват, е ограничен от броя на допълнителните електрони, които могат да влязат във външната обвивка, когато връзката се образува. Значи въглеродни атоми (° С)азот (Н)и кислород (О) могат да образуват съответно 4, 3 и 2 химически връзки. Съответно, между двата атома, показани в Таблица 4.4, могат да се образуват не една, а няколко химически връзки, което предполага много по-голямо увеличение на енергията в сравнение с образуването на 1 връзка в двуатомна молекула, където свързаните атоми имат 1 електрон във външната обвивка
Ако атомите са свързани с една химическа връзка, тогава такава връзка се нарича единична връзка. химическа връзкаили обща химическа връзка.Когато атомите са свързани с няколко химически връзки (двойни или тройни), такива връзки се наричат множество облигации. Множество връзки, например, в азотни молекули (N 2)и кислород (O2)се описват със структурни формули: N ≡ Nи О=О.
Сега помислете за групата С: Защо енергията на свързване в някои от двуатомните молекули, състоящи се от различни атоми, е много по-голяма, отколкото в други молекули, които са съставени от същите атоми?
Нека разглобим молекулата NaCl. Натриевите и хлорните атоми са много различни по електронен афинитет. Представяме образуването на връзки като двуетапен процес. На първия етап се получава печалбата в енергията поради афинитета на атомите към електроните. Тоест, от тази гледна точка, печалбата в енергията по време на образуването на молекула Cl2, трябва да бъде по-голямо, отколкото при образуване на молекула NaClчрез разликата в техния електронен афинитет.
При изчисляването на водородната молекула (Глава 3), енергията на свързване (енергията, необходима за разделяне на молекулите на атоми) е сумата от два компонента:
разликата между електронната енергия на една водородна молекула и два водородни атома;
допълнителна енергия, изразходвана за нагряване на неразделени молекули.
Изчислявайки първия компонент, изчисляваме енергията на молекулата, която е равна на разликата между енергията на привличане на ядрата на водородните атоми към свързващата двойка електрони и сумата от енергията на отблъскване на междуелектронните и междуядрените сили.
За да оценим енергията на привличане на ядрата към свързващите двойки електрони, както и да оценим енергията на междуелектронното отблъскване, първо трябва да разберем стойността на ефективния заряд на свързаните ядра.
Йонизационен потенциал и енергия на свързване в двуатомни молекули
Урок
Астрахан
Химическа връзка: Учебник / Рябухин Ю. И. - Астрахан: Астрахан. състояние технология ун-т, 2013. - 40 с.
Предназначен за студенти от инженерни и нехимически специалности.
Съответства на държавните образователни стандарти за висше професионално образование
Ил.: 15 сн., Таблица: 1, библиография: 6 заглавия, прил.
Отпечатано по решение на катедра "Обща, неорганична и аналитична химия" (протокол № __ от _________ 2013 г.)
Рецензент: канд. хим. наук, доцент Лебедева A.P.
© Рябухин Ю.И., 2013
© ASTU, 2013
ВЪВЕДЕНИЕ
В природата практически не се срещат химически елементи под формата на свободни атоми (с изключение на благородни газове - елементи от групата VIIIA). Обикновено атомите на химичен елемент взаимодействат или помежду си, или с атоми на други елементи, образувайки химични връзки с появата съответно на прости или сложни вещества. В същото време молекулите на различни вещества взаимодействат помежду си.
Доктрината за химическата връзка е в основата на цялата теоретична химия.
Химическа връзка 1 - това е набор от сили, които свързват атомите един с друг в по-стабилни структури - молекули или кристали.
Образуването на молекули и кристали се дължи главно на кулоновското привличане между електрони и атомни ядра.
Природата на химическата връзка е разбрана едва след откриването на законите на квантовата (вълнова) механика, които управляват микросвета. Съвременната теория отговаря на въпросите защо възниква химическа връзка и каква е природата на нейните сили.
Образуването на химични връзки е спонтанен процес; в противен случай не биха съществували нито прости, нито сложни вещества. От термодинамична гледна точка причината за образуването на химическа връзка е намаляването на енергията на системата.
Образуването на химическа връзка е придружено от освобождаване на енергия, а разрушаването й изисква изразходване на енергия.
Характеристиките на химичната връзка са нейната енергия и дължина.
Енергия на химическа връзка е енергията, освободена в процеса на неговото формиране и характеризираща неговата сила; енергията на свързване се изразява в kJ на мол от образуваното вещество (E Св. , kJ/mol) 2 .
Колкото по-голяма е енергията на химическата връзка, толкова по-силна е връзката. Енергията на химичната връзка на двуатомната молекула се оценява чрез сравняването й със състоянието, предхождащо образуването й. За многоатомни молекули със същия тип връзка се изчислява средната енергия на химическата връзка (например за H 2 O или CH 4).
Средна енергия на химическата връзкасе определя чрез разделяне на енергията на образуване на молекула на броя на нейните връзки.
Дължина на химическа връзканаречено разстоянието между ядрата на атомите в една молекула.
Дължината на връзката се определя от размера на свързващите атоми и степента на припокриване на техните електронни обвивки.
Например за флуороводород и йодид:

л HF< лЗдрасти
В зависимост от вида на свързаните частици (атоми или молекули), има вътрешномолекулни връзкичрез които се образуват молекули и междумолекулни връзки,водещи до образуване на асоциати от молекули или до свързване на атоми на отделни функционални групи в една молекула. Тези видове връзки се различават рязко по енергия: за вътрешномолекулните връзки енергията е 100–1000 kJ/mol 1, а за междумолекулните връзки обикновено не надвишава 40 kJ/mol.
Помислете за образованието вътрешномолекулно химическа връзкана примера на взаимодействието на водородните атоми.
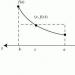
Когато два водородни атома се доближат един до друг, между техните електрони се получава силно обменно взаимодействие с антипаралелни завъртания, което води до появата на обща електронна двойка. Това увеличава електронната плътност в междуядреното пространство, което допринася за привличането на ядра, взаимодействащи атоми. В резултат на това енергията на системата намалява и системата става по-стабилна - химическа връзка(Фиг. 1).

Ориз. 1. Енергийна диаграма на образуването на химична връзка между водородни атоми
Системата има минимум енергия на определено разстояние между ядрата на атомите; при по-нататъшно приближаване на атомите енергията нараства поради увеличаването на силите на отблъскване между ядрата.
В зависимост от това как общата електронна двойка взаимодейства с ядрата на свързаните атоми, има три основни типа химична връзка: овални, йонни, метални и водородни връзки.