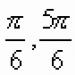К щелочноземельным металлам относятся металлы IIA группы Периодической системы Д.И. Менделеева – кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Кроме них в главную подгруппу II группы входят бериллий (Be) и магний (Mg). На внешнем энергетическом уровне щелочноземельных металлов находится два валентных электрона. Электронная конфигурация внешнего энергетического уровня щелочноземельных металлов – ns 2 . В своих соединениях они проявляют единственную степень окисления равную +2. В ОВР являются восстановителями, т.е. отдают электрон.
С увеличением заряда ядра атомов элементов, входящих в группу щелочноземельных металлов, энергия ионизации атомов уменьшается, а радиусы атомов и ионов увеличиваются, металлические признаки химических элементов усиливаются.
Физические свойства щелочноземельных металлов
В свободном состоянии Be – металл серо-стального цвета, обладающий плотной гексагональной кристаллической решеткой, достаточно твердый и хрупкий. На воздухе Be покрывается оксидной пленкой, что придает ему матовый оттенок и снижает его химическую активность.
Магний в виде простого вещества представляет собой белый металл, который, также, как и Be, при нахождении на воздухе приобретает матовый оттенок за счет образующейся оксидной пленки. Mg мягче и пластичнее бериллия. Кристаллическая решетка Mg – гексагональная.
Ca, Ba и Sr в свободном виде – серебристо-белые металлы. При нахождении на воздухе мгновенно покрываются желтоватой пленкой, которая представляет собой продукты их взаимодействия с составными частями воздуха. Кальций – достаточно твердый металл, Ba и Sr – мягче.
Ca и Sr имею кубическую гранецентрированную кристаллическую решетку, барий – кубическую объемоцентрированную кристаллическую решетку.
Все щелочноземельные металлы характеризуются наличием металлического типа химической связи, что обуславливает их высокую тепло- и электропроводность. Температуры кипения и плавления щелочноземельных металлов выше, чем щелочных металлов.
Получение щелочноземельных металлов
Получение Be осуществляют по реакции восстановления его фторида. Реакция протекает при нагревании:
BeF 2 + Mg = Be + MgF 2
Магний, кальций и стронций получают электролизом расплавов солей, чаще всего – хлоридов:
CaCl 2 = Ca + Cl 2
Причем, при получении Mg электролизом расплава дихлорида для понижения температуры плавления в реакционную смесь добавляют NaCl.
Для получения Mg в промышленности используют металло- и углетермические методы:
2(CaO×MgO) (доломит) + Si = Ca 2 SiO 4 + Mg
Основной способ получения Ba – восстановление оксида:
3BaO + 2Al = 3Ba + Al 2 O 3
Химические свойства щелочноземельных металлов
Поскольку в н.у. поверхность Be и Mg покрыта оксидной пленкой – эти металлы инертны по отношению к воде. Ca, Sr и Ba растворяются в воде с образованием гидроксидов, проявляющих сильные основные свойства:
Ba + H 2 O = Ba(OH) 2 + H 2
Щелочноземельные металлы способны реагировать с кислородом, причем все они, за исключением бария, в результате этого взаимодействия образуют оксиды, барий – пероксид:
2Ca + O 2 = 2CaO
Ba + O 2 = BaO 2
Оксиды щелочноземельных металлов, за исключением бериллия, проявляют основные свойства, Be – амфотерные свойства.
При нагревании щелочноземельные металлы способны к взаимодействию с неметаллами (галогенами, серой, азотом и др.):
Mg + Br 2 =2MgBr
3Sr + N 2 = Sr 3 N 2
2Mg + 2C = Mg 2 C 2
2Ba + 2P = Ba 3 P 2
Ba + H 2 = BaH 2
Щелочноземельные металлы реагируют с кислотами – растворяются в них:
Ca + 2HCl = CaCl 2 + H 2
Mg + H 2 SO 4 = MgSO 4 + H 2
Бериллий реагирует с водными растворами щелочей – растворяется в них:
Be + 2NaOH + 2H 2 O = Na 2 + H 2
Качественные реакции
Качественной реакцией на щелочноземельные металлы является окрашивание пламени их катионами: Ca 2+ окрашивает пламя в темно-оранжевый цвет, Sr 2+ — в темно-красный, Ba 2+ — в светло-зеленый.
Качественной реакцией на катион бария Ba 2+ являются анионы SO 4 2- , в результате чего образуется белый осадок сульфата бария (BaSO 4), нерастворимый в неорганических кислотах.
Ba 2+ + SO 4 2- = BaSO 4 ↓
Примеры решения задач
ПРИМЕР 1
| Задание | Осуществите ряд превращений: Ca→CaO→Ca(OH) 2 →Ca(NO 3) 2 |
| Решение | 2Ca + O 2 →2CaO
CaO + H 2 O→Ca(OH) 2 Ca(OH) 2 + 2HNO 3 →Ca(NO 3) 2 + 2H 2 O |
Свежая поверхность Э быстро темнеет вследствие образования оксидной пленки. Пленка эта относительно плотна - с течением времени весь металл медленно окисляется. Пленка состоит из ЭО, а также ЭО 2 и Э 3 N 2 . Нормальные электродные потенциалы реакций Э-2е = Э 2+ равны =-2,84В(Са), =-2,89(Sr). Э очень активные элементы: растворяются в воде и кислотах, вытесняют большинство металлов из их оксидов, галогенидов, сульфидов. Первично (200-300 о С) кальций взаимодействует с водяным паром по схеме:
2Са + Н 2 О = СаО + СаН 2 .
Вторичные реакции имеют вид:
CаН 2 + 2Н 2 О = Са(ОН) 2 + 2Н 2 и СаО + Н 2 О = Са(ОН) 2 .
В крепкой серной кислоте Э почти не растворяются ввиду образования пленки из малорастворимых ЭSO 4 . С разбавленными минеральными кислотами Э реагируют бурно с выделением водорода. Кальций при нагревании выше 800 о С с метаном реагирует по схеме:
3Cа + СН 4 = СаН 2 + СаС 2 .
Э при нагревании реагируют с водородом, с серой и с газообразным аммиаком. По химическим свойствам радий ближе всего к Ва, но он более активен. При комнатной температуре он заметно соединяется с кислородом и азотом воздуха. В общем, его химические свойства немного более выражены чем у его аналогов. Все соединения радия медленно разлагаются под действием собственного излучения, приобретая при этом желто-ватую или коричневую окраску. Соединения радия обладают свойством автолюминесценции. В результате радиоактивного распада 1 г Ra каждый час выделяет 553,7 Дж тепла. Поэтому температура радия и его соединений всегда выше температуры окружающей среды на 1,5 град. Также известно, что 1 г радия в сутки выделяет 1 мм 3 радона(226 Ra = 222 Rn + 4 He), на чем основано его применение как источника радона для радоновых ванн.
Гидриды Э - белые, кристаллические солеобразные вещества. Их получают непосредственно из элементов при нагревании. Температуры начала реакции Э + Н 2 = ЭН 2 равны 250 о С (Са), 200 о С (Sr), 150 о С (Ва). Термическая диссоциация ЭН 2 начинается при 600 о С. В атмосфере водорода СаН 2 не разлагается при температуре плавления (816 о С). В отсутствии влаги гидриды щелочноземельных металлов устойчивы на воздухе при обычной температуре. Они не реагируют с галогенами. Однако при нагревании химическая активность ЭН 2 возрастает. Они способны восстанавливать оксиды до металлов(W, Nb, Ti, Се, Zr, Ta), например
2СаН 2 + ТiO 2 = 2CaO + 2H 2 + Ti.
Реакция СаН 2 с Al 2 O 3 идет при 750 о С:
3СаН 2 + Al 2 O 3 = 3СаО + 3Н 2 + 2Аl,
СаН 2 + 2Al = CaAl 2 + H 2 .
С азотом СаН2 при 600оС реагирует по схеме:
3СаН 2 + N 2 = Ca 3 N 2 +3H 2 .
При поджигании ЭН 2 они медленно сгорают:
ЭН 2 + О 2 = Н 2 О + СаО.
В смеси с твердыми окислителями взрывоопасны. При действии воды на ЭН 2 выделяется гидроокись и водород. Эта реакция сильно экзотермична: смоченный водой на воздухе ЭН 2 самовоспламеняется. С кислотами ЭН 2 реагирует, например по схеме:
2HCl + CaH 2 = CaCl 2 + 2H 2 .
ЭН 2 применяют для получения чистого водорода, а также для определения следов воды в органических растворителях. Нитриды Э представляют собой бесцветные тугоплавкие вещества. Они получаются непосредственно из элементов при повышенной температуре. Водой они разлагаются по схеме:
Э 3 N 2 + 6H 2 O = 3Э(ОН) 2 + 2NH 3 .
Э 3 N 2 реагируют при нагревании с СО по схеме:
Э 3 N 2 + 3СО = 3ЭО + N 2 + 3C.
Процессы которые происходят при нагревании Э 3 N 2 с углем выглядят так:
Э3N2 + 5С = ЭCN2 + 2ЭС2; (Э = Са, Sr); Ва3N2 + 6С = Ва(СN)2 + 2ВаC2;
Нитрид стронция реагирует с HCl, давая хлориды Sr и аммония. Фосфиды Э 3 Р 2 образуются непосредственно из элементов или прокаливанием трехзамещенных фосфатов с углем:
Cа 3 (РО 4) 2 + 4С = Са 3 Р 2 + 4СО
Они гидролизуются водой по схеме:
Э 3 Р 2 + 6Н 2 О = 2РН 3 + 3Э(ОН) 2 .
С кислотами фосфиды щелочноземельных металлов дают соответствующую соль и фосфин. На этом основано их применение для получения фосфина в лаборатории.
Комплексные аммиакаты состава Э(NН 3) 6 - твердые вещества с металлическим блеском и высокой электропроводностью. Их получают действием жидкого аммиака на Э. На воздухе они самовоспламеняются. Без доступа воздуха они разлагаются на соответствующие амиды: Э(NH 3) 6 = Э(NH 2) 2 + 4NH 3 + Н 2 . При нагревании они энергично разлагаются по этой же схеме.
Карбиды щелочноземельных металлов которые получаются прокаливанием Э с углем разлагаются водой с выделением ацетилена:
ЭС 2 + 2Н 2 О = Э(ОН) 2 + С 2 Н 2 .
Реакция с ВаС 2 идет настолько бурно, что он воспламеняется в контакте с водой. Теплоты образования ЭС 2 из элементов для Са и Ва равны 14 и 12 ккалмоль. При нагревании с азотом ЭС 2 дают СаСN 2 , Ba(CN) 2 , SrCN 2 . Известны силициды (ЭSi и ЭSi 2). Их можно получить при нагревании непосредственно из элеменов. Они гидролизуются водой и реагируют с кислотами, давая H 2 Si 2 O 5 , SiH 4 , соответствующее соединение Э и водород. Известны бориды ЭВ 6 получаемые из элементов при нагревании.
Окиси кальция и его аналогов - белые тугоплавкие(T кип СаО = 2850 о С) вещества, энергично поглощающие воду. На этом основано применение ВаО для получения абсолютного спирта. Они бурно реагируют с водой, выделяя много тепла (кроме SrO растворение которой эндотермично). ЭО растворяются в кислотах и хлориде аммония:
ЭО + 2NH 4 Cl = SrCl 2 + 2NH 3 + H 2 O.
Получают ЭО прокаливанием карбонатов, нитратов, перекисей или гидроксидов соответствующих металлов. Эффективные заряды бария и кислорода в ВаО равны 0,86. SrO при 700 о С реагирует с цианистым калием:
KCN + SrO = Sr + KCNO.
Окись стронция растворяется в метаноле с образованием Sr(ОСН 3) 2 . При магнийтермическом восстановлении ВаО может быть получен промежуточный окисел Ва 2 О, который неустойчив и диспропорционирует.
Гидроокиси щелочноземельных металлов - белые растворимые в воде вещества. Они являются сильными основаниями. В ряду Са-Sr-Ba основной характер и растворимость гидроокисей увеличиваются. рПР(Са(ОН) 2) = 5,26, рПР(Sr(ОН) 2) = 3,5, рПР(Bа(ОН) 2) = 2,3. Из растворов гидроокисей обычно выделяются Ва(ОН) 2 . 8Н 2 О, Sr(ОН) 2 . 8Н 2 О, Cа(ОН) 2 . Н 2 О. ЭО присоединяют воду с образованием гидроокисей. На этом основано использование СаО в строительстве. Тесная смесь Са(ОН) 2 и NaOH в весовом соотношении 2:1 носит название натронная известь, и широко используется как поглотитель СО 2 . Са(ОН) 2 при стоянии на воздухе поглощает СО 2 по схеме:
Ca(OH)2 + CO2 = CaCO3 + Н2О.
Около 400 о С Са(ОН) 2 реагирует с угарным газом:
СО + Ca(OH) 2 = СаСО 3 + Н 2 .
Баритовая вода реагирует с СS 2 при 100 о С:
СS 2 + 2Ва(ОН) 2 = ВаСО 3 + Ва(НS) 2 + Н 2 О.
Алюминий реагирует с баритовой водой:
2Al + Ba(OH) 2 + 10H 2 O = Ba 2 + 3H 2 . Э(ОН) 2
используются для открытия угольного ангидрида.
Э образуют перекиси белого цвета. Они существенно менее стабильны в отличие от окисей и являются сильными окислителями. Практическое значение имеет наиболее устойчивая ВаО 2 , которая представляет собой белый, парамагнитный порошок с плотностью 4,96 г1см 3 и т. пл. 450°. BaО 2 устойчива при обычной температуре (может храниться годами), плохо растворяется в воде, спирте и эфире, растворяется в разбавленных кислотах с выделением соли и перекиси водорода. Термическое разложение перекиси бария ускоряют окислы, Cr 2 O 3 , Fe 2 O 3 и CuО. Перекись бария реагирует при нагревании с водородом, серой, углеродом, аммиаком, солями аммония, феррицианидом калия и т. д. С концентрированной соляной кислотой перекись бария реагирует, выделяя хлор:
ВаO 2 + 4НСl = BaCl 2 + Cl 2 + 2H 2 O.
Она окисляет воду до перекиси водорода:
Н 2 О + ВаО 2 = Ва(ОН) 2 + Н 2 О 2 .
Эта реакция обратима и в присутствии даже угольной кислоты равновесие смещено вправо. ВаО 2 используется как исходный продукт для получения Н 2 О 2 , а также как окислитель в пиротехнических составах. Однако, ВаО 2 может выступать и в качестве восстановителя:
HgCl 2 + ВаО 2 = Hg + BaCl 2 + O 2 .
Получают ВаО 2 нагреванием ВаО в токе воздуха до 500 о С по схеме:
2ВаО + О 2 = 2ВаО 2 .
При повышении температуры имеет место обратный процесс. Поэтому при горении Ва выделяется только окись. SrO 2 и СаО 2 менее устойчивы. Общим методом получения ЭО 2 является взаимодействие Э(ОН) 2 с Н 2 О 2 , при этом выделяются ЭО 2 . 8Н 2 О. Термический распад ЭО 2 начинается при 380 о С (Са), 480 о С (Sr), 790 о С (Ва). При нагревании ЭО 2 с концентрированной перекисью водорода могут быть получены желтые неустойчивые вещества -- надпероксиды ЭО 4 .
Соли Э как правило бесцветны. Хлориды, бромиды, иодиды и нитраты хорошо растворимы в воде. Фториды, сульфаты, карбонаты и фосфаты плохо растворимы. Ион Ва 2+ - токсичен. Галиды Э делятся на две группы: фториды и все остальные. Фториды почти не растворимы в воде и кислотах, и не образуют кристаллогидратов. Напротив хлориды, бромиды, и иодиды хорошо растворимы в воде и выделяются из растворов в виде кристаллогидратов. Некоторые свойства ЭГ 2 представлены ниже:
При получении путем обменного разложения в растворе фториды выделяются в виде объемистых слизистых осадков, довольно легко образующих коллоидные растворы. ЭГ 2 можно получить действуя соответствующими галогенами на соответствующие Э. Расплавы ЭГ 2 способны растворять до 30% Э. При изучении электропроводности расплавов хлоридов элементов второй группы главной подгруппы было установлено, что их молекулярно-ионный состав очень различен. Степени диссоциации по схеме ЭСl 2 = Э 2+ + 2Cl- равны: BeCl 2 - 0,009%, MgCl 2 - 14,6%, CaCl 2 - 43,3%, SrCl 2 - 60,6%, BaCl 2 - 80,2%. Галогениды (кроме фторидов) Э содержат кристаллизационную воду: CaCl 2 . 6Н 2 О, SrCl 2 . 6Н 2 О и ВаCl 2 . 2Н 2 О. Рентгеноструктурным анализом установлено строение Э[(ОН 2) 6 ]Г 2 для кристаллогидратов Са и Sr. При медленном нагревании кристаллогидратов ЭГ 2 можно получить безводные соли. CaCl 2 легко образует пересыщенные растворы. Природный СаF 2 (флюорит) применяют в керамической промышленности, а также он используется для производства HF и является минералом фтора. Безводный CaCl 2 используют как осушитель ввиду его гидроскопичности. Кристаллогидрат хлористого кальция используют для приготовления холодильных смесей. ВаСl 2 - используют в сх и для открытия
SO 4 2- (Ва 2+ + SO 4 2- = ВаSO 4).
Сплавлением ЭГ2 и ЭН2 могут быть получены гидрогалиды:
ЭГ 2 + ЭН 2 = 2ЭНГ.
Эти вещества плавятся без разложения но гидролизуются водой:
2ЭНГ + 2H 2 O = ЭГ 2 + 2Н 2 + Э(ОН) 2 .
Растворимость в воде хлоратов , броматов и иодатов в воде уменьшается по рядам Сa - Sr - Ba и Cl - Br - I. Ba(ClO 3) 2 - используется в пиротехнике. Перхлораты Э хорошо растворимы не только в воде но и в органических растворителях. Наиболее важным из Э(ClO 4) 2 является Ва(ClO 4) 2 . 3Н 2 О. Безводный перхлорат бария является хорошим осушителем. Его термический распад начинается только при 400 о С. Гипохлорит кальция Са(СlO) 2 . nH 2 O (n=2,3,4) получают действием хлора на известковое молоко. Он является окислителем и хорошо растворим в воде. Хлорную известь можно получить действуя хлором на твердую гашеную известь. Она разлагается водой и пахнет хлором в присутствии влаги. Реагирует с СО 2 воздуха:
СО 2 + 2CaOCl 2 = CаСO 3 + CaCl 2 + Cl 2 O.
Хлорная известь применяется как окислитель, отбеливатель и как дезинфицирующее средство.
Для щелочноземельных металлов известны азиды Э(N 3) 2 и роданиды Э(CNS) 2 . 3Н 2 О. Азиды по сравнению с азидом свинца гораздо менее взрывоопасны. Роданиды при нагревании легко теряют воду. Они хорошо растворимы в воде и органических растворителях. Ва(N 3) 2 и Ba(CNS) 2 могут быть использованы для получения азидов и роданидов других металлов из сульфатов обменной реакцией.
Нитраты кальция и стронция существуют обычно в виде кристаллогидратов Са(NO 3) 2 . 4H 2 O и Sr(NO 3) 2 . 4H 2 O. Для нитрата бария не свойственно образование кристаллогидрата. При нагревании Са(NO 3) 2 . 4H 2 O и Sr(NO 3) 2 . 4H 2 O легко теряю воду. В инертной атмосфере нитраты Э термически устойчивы до 455 o C (Са), 480 o C (Sr), 495 o C (Ba). Расплав кристаллогидрата нитрата кальция имеет кислую среду при 75 о С. Особенностью нитрата бария является малая скорость растворения его кристаллов в воде. Склонность к комплексообразованию проявляет лишь нитрат бария, для которого известен нестойкий комплекс K 2 . Нитрат кальция растворим в спиртах, метилацетате, ацетоне. Нитраты стронция и бария там же почти не растворимы. Температуры плавления нитратов Э оцениваются в 600 о С, однако при этой же температуре начинается распад:
Э(NO 3) 2 = Э(NO 2) 2 + O 2 .
Дальнейший распад идет при более высокой температуре:
Э(NO 2) 2 = ЭО + NO 2 + NO.
Нитраты Э уже издавна использовались в пиротехнике. Легколетучие соли Э окрашивают пламя в соответствующие цвета: Са - в оранжево-желтый, Sr - в красно-карминовый, Ba - в желто-зеленый. Разберемся в сущности этого на примере Sr: у Sr 2+ есть две ВАО: 5s и 5p или 5s и 4d. Сообщим энергию этой системе - нагреем. Электроны с более близлежащих к ядру орбиталей перейдут на эти ВАО. Но такая система не устойчива и выделит энергию в виде кванта света. Как раз Sr 2+ и излучает кванты с частотой, соответствующей длинам красных волн. При получении пиротехнических составов удобно использовать селитру, т.к. она не только окрашивает пламя, но и является окислителем, выделяя кислород при нагревании. Пиротехнические составы состоят из твердого окислителя, твердого восстановителя и некоторых органических веществ, обесцвечивающих пламя восстановителя, и являющихся связывающим агентом. Нитрат кальция используется как удобрение.
Все фосфаты и гидрофосфаты Э плохо растворимы в воде. Их можно получить растворением соответствующего количества СаО или СаСO 3 в ортофосфорной килоте. Также они осаждаются при обменных реакциях типа:
(3-х)Са 2+ + 2H x PO 4 -(3-х) = Са (3-х) (H x PO 4) 2 .
Практическое значение (как удобрение) имеет однозамещенный ортофосфат кальция, который наряду с Са(SO 4) входит в состав суперфосфата. Его получают по схеме:
Cа 3 (PO 4) 2 + 2H 2 SO 4 = Ca(H 2 PO 4) 2 + 2CаSO 4
Оксалаты тоже мало растворимы в воде. Практическое значение имеет оксалат кальция, который при 200 о С обезвоживается, а при 430 о С разлагается по схеме:
СаС 2 О 4 = СаСО 3 + СО.
Ацетаты Э выделяются в виде кристаллогидратов, и хорошо растворимы в воде.
Сульфаты Э - белые, плохо растворимые в воде вещества. Растворимость СaSO 4 . 2Н 2 О на 1000 г. воды при обычной температуре составляет 8 . 10 -3 моль, SrSO 4 - 5 . 10 -4 моль, ВаSO 4 - 1 . 10 -5 моль, RaSO 4 - 6 . 10 -6 моль. В ряду Са - Ra растворимость сульфатов быстро уменьшается. Ва 2+ является реактивом на сульфат-ион. Сульфат кальция содержит кристаллизационную воду. Выше 66 о С из раствора выделяется безводный сульфат кальция, ниже - гипс СаSO 4 . 2Н 2 О. Нагревание гипса выше 170 о С сопровождается выделением гидратной воды. При замешивании гипса с водой эта масса быстро твердеет вследствие образования кристал-логидрата. Это свойство гипса используется в строительстве. Египтяне использовали это знание еще 2000 лет назад. Растворимость ЭSO 4 в крепкой серной кислоте намного выше, чем в воде (ВаSO 4 до 10%), что свидетельствует о комплексообразовании. Соответствующие комплексы ЭSO 4 . Н 2 SO 4 могут быть получены в свободном состоянии. Двойные соли с сульфатами щелочных металлов и аммония известны только для Са и Sr. (NH 4) 2 растворим в воде и используется в аналитической химии для отделения Са от Sr, т.к. (NH 4) 2 мало растворим. Гипс применяют для комбинированного получения серной кислоты и цемента, т.к. при нагревании с восстановителем (углем) гипс разлагается:
СаSO 4 + С = СаО + SO 2 + СО.
При более высокой температуре (900 o C) сера еще больше восстанавливается по схеме:
СаSO 4 + 3С = СаS + CO 2 + 2СО.
Подобный распад сульфатов Sr и Ва начинается при более высоких температурах. ВаSO 4 нетоксичен и используется в медицине и производстве минеральных красок.
Сульфиды Э представляют собой белые твердые вещества, кристаллизующиеся по типу NaCl. Теплоты их образования и энергии кристаллических решеток равны (ккалмоль): 110 и 722 (Са), 108 и 687 (Sr), 106 и 656 (Ва). Могут быть получены синтезом из элементов при нагревании или прокаливанием сульфатов с углем:
ЭSO4 + 3С = ЭS + CO2 + 2СО.
Менее всех растворим СаS (0,2 гл). ЭS вступает в следующие реакции при нагревании:
ЭS + H 2 O = ЭO + H 2 S; ЭS + Г 2 = S + ЭГ 2 ; ЭS + 2O 2 = ЭSO 4 ; ЭS + xS = ЭS x+1 (x=2,3).
Сульфиды щелочноземельных металлов в нейтральном растворе нацело гидролизованы по схеме:
2ЭS + 2Н 2 О = Э(НS) 2 + Э(ОН) 2 .
Кислые сульфиды могут быть получены и в свободном состоянии упариванием раствора сульфидов. Они вступают в реакции с серой:
Э(НS) 2 + хS = ЭS x+1 + H 2 S (x=2,3,4).
Из кристаллогидратов известны ВаS . 6H 2 O и Са(HS) 2 . 6Н 2 О, Ва(HS) 2 . 4Н 2 О. Са(HS) 2 применяют для удаления волос. ЭS подвержены явлению фосфоресценции. Известны полисульфиды Э: ЭS 2 , ЭS 3 , ЭS 4 , ЭS 5 . Они получаются при кипячении взвеси ЭS в воде с серой. На воздухе ЭS окисляются: 2ЭS + 3О 2 = 2ЭSО 3 . Пропусканием воздуха через суспензию СаS можно получить тиосульфат Са по схеме:
2СаS + 2О 2 + Н 2 О = Са(ОН) 2 + СаS 2 О 3
Он хорошо растворим в воде. В ряду Са - Sr - Ва растворимость тиосульфатов падает. Теллуриды Э мало растворимы в воде и тоже подвержены гидролизу, но в меньшей степени чем сульфиды.
Растворимость хроматов Э в ряду Са - Ва падает также резко, как и в случае с сульфатами. Эти вещества желтого цвета получаются при взаимодействии растворимых солей Э с хроматами (или дихроматами) щелочных металлов:
Э 2+ + СrO 4 2- = ЭCrO4.
Хромат кальция выделяется в виде кристаллогидрата - СаCrO 4 . 2H 2 O (рПР СаCrO 4 = 3,15). Еще до температуры плавления он теряет воду. SrCrO 4 и ВаCrO 4 кристаллогидратов не образуют. pПР SrCrO 4 = 4,44, рПР ВаCrO 4 = 9,93.
Карбонаты Э белые, плохо растворимые в воде вещества. При нагревании ЭСО 3 переходят в ЭО, отщепляя СО 2 . В ряду Са - Ва термическая устойчивость карбонатов возрастает. Наиболее практически важен из них карбонат кальция (известняк). Он непосредственно используется в строительстве, а также служит сырьем для получения извести и цемента. Ежегодная мировая добыча извести из известняка исчисляется десятками миллионов тонн. Термическая диссоциация СаСО 3 эндотермична:
СаСО 3 = СаО + СО 2
и требует затраты 43 ккал на моль известняка. Обжиг СаСО 3 проводят в шахтных печах. Побочным продуктом обжига является ценный углекислый газ. СаО важный строительный материал. При замешивании с водой происходит кристаллизация за счет образования гидроокиси, а затем карбоната по схемам:
СаО + Н 2 О = Са(ОН) 2 и Са(ОН) 2 + СО 2 = СаСО 3 + Н 2 О.
Колоссально важную практическую роль играет цемент - зеленовато-серый порошок, состоящий из смеси различных силикатов и алюминатов кальция. Будучи замешан с водой он отвердевает за счет гидратации. При его производстве смесь СаСО 3 с глиной обжигают до начала спекания (1400-1500 о С). Затем смесь перемалывают. Состав цемента можно выразить процентным соотношением компонентов СаО, SiO 2 , Al 2 O 3 , Fe 2 O 3 , причем СаО представляет основание, а все остальное - ангидриды кислот. Состав силикатного (портладского) цемента слагается в основном из Са 3 SiO 5 , Ca 2 SiO 4 , Ca 3 (AlO 3) 2 и Ca(FeO 2) 2 . Его схватывание проходит по схемам:
Са 3 SiO 5 + 3Н 2 О = Ca 2 SiO 4 . 2Н 2 О + Са(ОН) 2
Ca 2 SiO 4 + 2Н 2 О = Ca 2 SiO 4 . 2Н 2 О
Ca 3 (AlO 3) 2 + 6Н 2 О = Ca 3 (AlO 3) 2 . 6Н 2 О
Ca(FeO 2) 2 + nH 2 O = Ca(FeO 2) 2 . nH 2 O.
Природный мел вводят в состав различных замазок. Мелкокристаллический, осажденный из раствора СаСО 3 входит в состав зубных порошков. Из ВаСО 3 прокаливанием с углем получают ВаО по схеме:
ВаСО 3 + С = ВаО + 2СО.
Если процесс вести при более высокой температуре в токе азота образуется цианид бария:
ВаСО 3 + 4С +N 2 = 3CO + Ba(CN) 2 .
Ва(СN) 2 хорошо растворим в воде. Ва(СN) 2 может использован для производства цианидов других металлов путем обменного разложения с сульфатами. Гидрокарбонаты Э растворимы в воде и могут быть получены лишь в растворе например, пропусканием углекислого газа в взвесь СаСО 3 в воде:
СО 2 + СаСО 3 + Н 2 О = Са(НСО 3) 2 .
Эта реакция обратима и при нагревании смещается влево. Наличие гидрокарбонатов кальция и магния в природных водах обуславливает жесткость воды.
На уроке будет раскрыта тема «Металлы и их свойства. Щелочные металлы. Щелочноземельные металлы. Алюминий». Вы узнаете общие свойства и закономерности щелочных и щелочноземельных элементов, изучите по отдельности химические свойства щелочных и щелочноземельных металлов и их соединения. С помощью химических уравнений будет рассмотрено такое понятие, как жесткость воды. Познакомитесь с алюминием, его свойствами и сплавами. Вы узнаете, что такое смеси, регенерирующие кислород, озониды, пероксид бария и получение кислорода.
Тема: Основные металлы и неметаллы
Урок: Металлы и их свойства. Щелочные металлы. Щелочноземельные металлы. Алюминий
Главную подгруппу I группы Периодической системы Д.И. Менделеева составляют литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr. Элементы этой подгруппы относят к . Их общее название - щелочные металлы.
Щелочноземельные металлы находятся в главной подгруппе II группы Периодической системы Д.И. Менделеева. Это магний Mg, кальций Ca, стронций Sr, барий Ba и радий Ra.
Щелочные и щелочноземельные металлы как типичные металлы проявляют ярко выраженные восстановительные свойства. У элементов главных подгрупп металлические свойства с увеличением радиуса возрастают. Особенно сильно восстановительные свойства проявляются у щелочных металлов. Настолько сильно, что практически невозможно проводить их реакции с разбавленными водными растворами, так как в первую очередь будет идти реакция взаимодействия их с водой. У щелочноземельных металлов ситуация аналогичная. Они тоже взаимодействуют с водой, но гораздо менее интенсивно, чем щелочные металлы.
Электронные конфигурации валентного слоя щелочных металлов - ns 1 , где n - номер электронного слоя. Их относят к s-элементам. У щелочноземельных металлов - ns 2 (s-элементы). У алюминия валентные электроны …3 s 2 3р 1 (p-элемент). Эти элементы образуют соединения с ионным типом связи. При образовании соединений для них степень окисления соответствует номеру группы.
Обнаружение ионов металла в солях
Ионы металлов легко определить по изменению окраски пламени. Рис. 1.
Соли лития - карминово-красная окраска пламени. Соли натрия - желтый. Соли калия - фиолетовый через кобальтовое стекло. Рубидия - красный, цезия - фиолетово-синий.

Рис. 1
Соли щелочноземельных металлов: кальция - кирпично-красный, стронция - карминово-красный и бария - желтовато-зеленый. Соли алюминия окраску пламени не меняют. Соли щелочных и щелочноземельных металлов используются для создания фейерверков. И можно легко определить по окраске, соли какого металла применялись.
Свойства металлов
Щелочные металлы - это серебристо-белые вещества с характерным металлическим блеском. Они быстро тускнеют на воздухе из-за окисления. Это мягкие металлы, по мягкости Na, K, Rb, Cs подобны воску. Они легко режутся ножом. Они легкие. Литий - самый легкий металл с плотностью 0,5 г/см 3 .
Химические свойства щелочных металлов
1. Взаимодействие с неметаллами
Из-за высоких восстановительных свойств щелочные металлы бурно реагируют с галогенами с образованием соответствующего галогенида. При нагревании реагируют с серой, фосфором и водородом с образованием сульфидов, гидридов, фосфидов.
2Na + Cl 2 → 2NaCl
Литий - это единственный металл, который реагирует с азотом уже при комнатной температуре.
6Li + N 2 = 2Li 3 N, образующийся нитрид лития подвергается необратимому гидролизу.
Li 3 N + 3H 2 O → 3LiOH + NH 3
2. Взаимодействие с кислородом
Только с литием сразу образуется оксид лития.
4Li + О 2 = 2Li 2 О, а при взаимодействии кислорода с натрием образуется пероксид натрия.
2Na + О 2 = Na 2 О 2 . При горении всех остальных металлов образуются надпероксиды.
К + О 2 = КО 2
3. Взаимодействие с водой
По реакции с водой можно наглядно увидеть, как изменяется активность этих металлов в группе сверху вниз. Литий и натрий спокойно взаимодействуют с водой, калий - со вспышкой, а цезий - уже с взрывом.
2Li + 2H 2 O → 2LiOH + H 2
4.
8K + 10HNO 3 (конц) → 8KNO 3 + N 2 O +5 H 2 O
8Na + 5H 2 SO 4 (конц) → 4Na 2 SO 4 + H 2 S + 4H 2 O
Получение щелочных металлов
Из-за высокой активности металлов, получать их можно при помощи электролиза солей, чаще всего хлоридов.
Соединения щелочных металлов находят большое применение в разных отраслях промышленности. См. Табл. 1.
|
РАСПРОСТРАНЕННЫЕ СОЕДИНЕНИЯ ЩЕЛОЧНЫХ МЕТАЛЛОВ |
|
|
Едкий натр (каустическая сода) |
|
|
Поваренная соль |
|
|
Чилийская селитра |
|
|
Na 2 SO 4 ∙10H 2 O |
Глауберова соль |
|
Na 2 CO 3 ∙10H 2 O |
Сода кристаллическая |
|
Едкое кали |
|
|
Хлорид калия (сильвин) |
|
|
Индийская селитра |
|
Их название связано с тем, что гидроксиды этих металлов являются щелочами, а оксиды раньше называли «земли». Например, оксид бария BaO - бариевая земля. Бериллий и магний чаще всего к щелочноземельным металлам не относят. Мы не будем рассматривать и радий, так как он радиоактивный.
Химические свойства щелочноземельных металлов.
1. Взаимодействие с неметаллами
Сa + Cl 2 → 2СaCl 2
Сa + H 2 СaH 2
3Сa + 2P Сa 3 P 2-
2. Взаимодействие с кислородом
2Сa + O 2 → 2CaO
3. Взаимодействие с водой
Sr + 2H 2 O → Sr(OH) 2 + H 2 , но взаимодействие более спокойное, чем с щелочными металлами.
4. Взаимодействие с кислотами - сильными окислителями
4Sr + 5HNO 3 (конц) → 4Sr(NO 3) 2 + N 2 O +4H 2 O
4Ca + 10H 2 SO 4 (конц) → 4CaSO 4 + H 2 S + 5H 2 O
Получение щелочноземельных металлов
Металлический кальций и стронций получают электролизом расплава солей, чаще всего хлоридов.
CaCl 2 Сa + Cl 2
Барий высокой чистоты можно получить алюмотермическим способом из оксида бария
3BaO +2Al 3Ba + Al 2 O 3
РАСПРОСТРАНЕННЫЕ СОЕДИНЕНИЯ ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ
Самыми известными соединениями щелочноземельным металлов являются: CaО - негашеная известь. Ca(OH) 2 - гашеная известь, или известковая вода. При пропускании углекислого газа через известковую воду происходит помутнение, так как образуется нерастворимый карбонат кальция СаСО 3. Но надо помнить, что при дальнейшем пропускании углекислого газа образуется уже растворимый гидрокарбонат и осадок исчезает.

Рис. 2
СaO + H 2 O → Ca(OH) 2
Ca(OH) 2 + CO 2 → CaCO 3 ↓+ H 2 O
CaCO 3 ↓+ H 2 O + CO 2 → Ca(HCO 3) 2
Гипс - это CaSO 4 ∙2H 2 O, алебастр - CaSO 4 ∙0,5H 2 O. Гипс и алебастр используются в строительстве, в медицине и для изготовления декоративных изделий. Рис. 2.
Карбонат кальция CaCO 3 образует множество различных минералов. Рис. 3.

Рис. 3
Фосфат кальция Ca 3 (PO 4) 2 - фосфорит, фосфорная мука используется как минеральное удобрение.
Чистый безводный хлорид кальция CaCl 2 - это гигроскопичное вещество, поэтому широко применяется в лабораториях как осушитель.
Карбид кальция - CaC 2 . Его можно получить так:
СaO + 2C →CaC 2 +CO. Одно из его применений - это получение ацетилена.
CaC 2 + 2H 2 O →Ca(OH) 2 + C 2 H 2
Сульфат бария BaSO 4 - барит. Рис. 4. Используется как эталон белого в некоторых исследованиях.

Рис. 4
Жесткость воды
В природной воде содержатся соли кальция и магния. Если они содержатся в заметных концентрациях, то в такой воде не мылится мыло из-за образования нерастворимых стеаратов. При её кипячении образуется накипь.
Временная жесткость обусловлена присутствием гидрокарбонатов кальция и магния Ca(HCO 3) 2 и Mg(HCO 3) 2 . Такую жесткость воды можно устранить кипячением.
Ca(HCO 3) 2 CaCO 3 ↓ + СО 2 + Н 2 О
Постоянная жесткость воды обусловлена наличием катионов Ca 2+ ., Mg 2+ и анионов H 2 PO 4 - ,Cl - , NO 3 - и др. Постоянная жесткость воды устраняется только благодаря реакциям ионного обмена, в результате которых ионы магния и кальция будут переведены в осадок.
Домашнее задание
1. №№3, 4, 5-а (с. 173) Габриелян О.С. Химия. 11 класс. Базовый уровень. 2-е изд., стер. - М.: Дрофа, 2007. - 220 с.
2. Какую реакцию среды имеет водный раствор сульфида калия? Ответ подтвердите уравнением реакции гидролиза.
3. Определите массовую долю натрия в морской воде, которая содержит 1,5% хлорида натрия.
Металлы главных подгрупп I и II групп. Жесткость воды
В периодической системе элементов металлы в основном располагаются в главных подгруппах I-Ill групп, а также в побочных подгруппах.
В IA группе у атомов элементов на внешнем энергетическом уровне находится 1 электрон в состоянии s 1 , во IIA группе у атомов на внешнем ЭУ 2 электрона в состоянии s 2 . Эти элементы относятся к s-элементам. В IIIA группе у всех элементов на внешнем ЭУ 3 электрона в состоянии s 2 p 1 . Они относятся к p-элементам.
В IA группу входят щелочные металлы Li, Na, K, Rb, Cs, Fr, активность которых при движении сверху вниз увеличивается вследствие увеличения радиуса атомов, металлические свойства возрастают также, как и у щелочеземельных металлов IIA группы Be, Mg, Ca, Sr, Ba, Ra и металлов IIIA группы Al, Ga, In, Tl.
Оксиды типа R 2 O характерны только для Li, для всех остальных щелочных металлов характерны пероксиды R 2 O 2 , которые являются сильными окислителями.
Все металлы этих групп образуют основные оксиды и гидроксиды, кроме Be и Al, которые проявляют амфотерные свойства.

Физические свойства
В свободном состоянии все металлы – серебристо-белые вещества. Магний и щелочноземельные металлы – ковкие и пластичные, довольно мягкие, хотя тверже щелочных. Бериллий отличается значительной твердостью и хрупкостью, барий при резком ударе раскалывается.
В кристаллическом состоянии при обычных условиях бериллий и магний имеют гексагональную кристаллическую решетку, кальций, стронций – кубическую гранецентрированную кристаллическую решетку, барий – кубическую объемоцентрированную кристаллическую решетку с металлическим типом химической связи, что обуславливает их высокую тепло- и электропроводность.
Металлы имеют температуры плавления и кипения выше, чем у щелочных металлов, причем с увеличением порядкового номера элемента температура плавления металла изменяется немонотонно, что связано с изменением типа кристаллической решетки.
Бериллий и магний покрыты прочной оксидной пленкой и не изменяются на воздухе. Щелочноземельные металлы очень активны, их хранят в запаянных ампулах, под слоем вазелинового масла или керосина.
Некоторые физические свойства бериллия, магния и щелочно-земельных металлов приведены в таблице.
Щелочные металлы – это серебристо-белые вещества с характерным металлическим блеском. Они быстро тускнеют на воздухе из-за окисления. Это мягкие металлы, по мягкости Na, K, Rb, Cs подобны воску. Они легко режутся ножом. Они легкие. Литий – самый легкий металл с плотностью 0,5 г/см 3 .
Химические свойства щелочных металлов
1. Взаимодействие с неметаллами
Из-за высоких восстановительных свойств щелочные металлы бурно реагируют с галогенами с образованием соответствующего галогенида. При нагревании реагируют с серой, фосфором и водородом с образованием сульфидов, гидридов, фосфидов.
2Na + Cl 2 → 2NaCl
2Na + S → Na 2 S
2Na + H 2 → 2NaH
3Na + P → Na 3 P
Литий – это единственный металл, который реагирует с азотом уже при комнатной температуре.
6Li + N 2 = 2Li 3 N, образующийся нитрид лития подвергается необратимому гидролизу.
Li 3 N + 3H 2 O → 3LiOH + NH 3
Только с литием сразу образуется оксид лития.
4Li + О 2 = 2Li 2 О, а при взаимодействии кислорода с натрием образуется пероксид натрия.
2Na + О 2 = Na 2 О 2 . При горении всех остальных металлов образуются надпероксиды.
К + О 2 = КО 2
По реакции с водой можно наглядно увидеть, как изменяется активность этих металлов в группе сверху вниз. Литий и натрий спокойно взаимодействуют с водой, калий – со вспышкой, а цезий – уже с взрывом.
2Li + 2H 2 O → 2LiOH + H 2
4.
8K + 10HNO 3 (конц) → 8KNO 3 + N 2 O +5 H 2 O
8Na + 5H 2 SO 4 (конц) → 4Na 2 SO 4 + H 2 S + 4H 2 O
Получение щелочных металлов
Из-за высокой активности металлов, получать их можно при помощи электролиза солей, чаще всего хлоридов.
Соединения щелочных металлов находят большое применение в разных отраслях промышленности.
Щелочноземельные металлы
Их название связано с тем, что гидроксиды этих металлов являются щелочами, а оксиды раньше называли «земли». Например, оксид бария BaO – бариевая земля. Бериллий и магний чаще всего к щелочноземельным металлам не относят. Мы не будем рассматривать и радий, так как он радиоактивный.
Химические свойства щелочноземельных металлов
1. Взаимодействие с неметаллами
Сa + Cl 2 → 2СaCl 2
Сa + S → СaS
Сa + H 2 → СaH 2
3Сa + 2P → Сa 3 P 2-
2. Взаимодействие с кислородом
2Сa + O 2 → 2CaO
3. Взаимодействие с водой
Sr + 2H 2 O → Sr(OH) 2 + H 2 , но взаимодействие более спокойное, чем с щелочными металлами.
4. Взаимодействие с кислотами – сильными окислителями
4Sr + 5HNO 3 (конц) → 4Sr(NO 3) 2 + N 2 O +4H 2 O
4Ca + 10H 2 SO 4 (конц) → 4CaSO 4 + H 2 S + 5H 2 O
Получение щелочноземельных металлов
Металлический кальций и стронций получают электролизом расплава солей, чаще всего хлоридов.
CaCl 2 Сa + Cl 2
Барий высокой чистоты можно получить алюмотермическим способом из оксида бария
щёлочноземельные металлы и, щёлочноземельные металлы химияЩёлочноземе́льные мета́ллы - химические элементы 2-й группы периодической таблицы элементов: кальций, стронций, барий и радий.
- 1 Физические свойства
- 2 Химические свойства
- 2.1 Простые вещества
- 2.2 Оксиды
- 2.3 Гидроксиды
- 3 Нахождение в природе
- 4 Биологическая роль
- 5 Примечания
Физические свойства
К щёлочноземельным металлам относят только кальций, стронций, барий и радий, реже магний. Первый элемент этой подгруппы, бериллий, по большинству свойств гораздо ближе к алюминию, чем к высшим аналогами группы, в которую он входит. Второй элемент этой группы, магний, в некоторых отношениях значительно отличается от щелочноземельных металлов по ряду химических свойств. Все щёлочноземельные металлы серые, твёрдые при комнатной температуре вещества. отличие от щелочных металлов, они существенно более твёрдые, и ножом преимущественно не режутся (исключение - стронций. Рост плотности щёлочноземельных металлов наблюдается только начиная с кальция. Самый тяжёлый - радий, по плотности сравнимый с германием (ρ= 5,5 г/см3).
| Атомный номер |
Название, символ |
Число природных изотопов | Атомная масса | Энергия ионизации, кДж моль−1 | Сродство к электрону, кДж моль−1 | ЭО | Металл. радиус, нм | Ионный радиус, нм | tпл, °C |
tкип, °C |
ρ, г/см³ |
ΔHпл, кДж моль−1 | ΔHкип, кДж моль−1 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 4 | Бериллий Be | 1+11а | 9,012182 | 898,8 | 0,19 | 1,57 | 0,169 | 0,034 | 1278 | 2970 | 1,848 | 12,21 | 309 |
| 12 | Магний Mg | 3+19а | 24,305 | 737,3 | 0,32 | 1,31 | 0,24513 | 0,066 | 650 | 1105 | 1,737 | 9,2 | 131,8 |
| 20 | Кальций Ca | 5+19а | 40,078 | 589,4 | 0,40 | 1,00 | 0,279 | 0,099 | 839 | 1484 | 1,55 | 9,20 | 153,6 |
| 38 | Стронций Sr | 4+35а | 87,62 | 549,0 | 1,51 | 0,95 | 0,304 | 0,112 | 769 | 1384 | 2,54 | 9,2 | 144 |
| 56 | Барий Ba | 7+43а | 137,327 | 502,5 | 13,95 | 0,89 | 0,251 | 0,134 | 729 | 1637 | 3,5 | 7,66 | 142 |
| 88 | Радий Ra | 46а | 226,0254 | 509,3 | - | 0,9 | 0,2574 | 0,143 | 700 | 1737 | 5,5 | 8,5 | 113 |
а Радиоактивные изотопы
Химические свойства
Щёлочноземельные металлы имеют электронную конфигурацию внешнего энергетического уровня ns², и являются s-элементами, наряду с щелочными металлами. Имея два валентных электрона, щёлочноземельные металлы легко их отдают, и во всех соединениях имеют степень окисления +2 (очень редко +1).
Химическая активность щёлочноземельных металлов растёт с ростом порядкового номера. Бериллий в компактном виде не реагирует ни с кислородом, ни с галогенами даже при температуре красного каления (до 600 °C, для реакции с кислородом и другими халькогенами нужна ещё более высокая температура, фтор - исключение). Магний защищён оксидной плёнкой при комнатной температуре и более высоких (до 650 °C) температурах и не окисляется дальше. Кальций медленно окисляется и при комнатной температуре вглубь (в присутствии водяных паров), и сгорает при небольшом нагревании в кислороде, но устойчив в сухом воздухе при комнатной температуре. Стронций, барий и радий быстро окисляются на воздухе, давая смесь оксидов и нитридов, поэтому их, подобно щелочным металлам и кальцию, хранят под слоем керосина.
Также, в отличие от щелочных металлов, щелочноземельные металлы не образуют надпероксиды и озониды.
Оксиды и гидроксиды щёлочноземельных металлов имеют тенденцию к усилению основных свойств с ростом порядкового номера.
Простые вещества
Бериллий реагирует со слабыми и сильными растворами кислот с образованием солей:
однако пассивируется холодной концентрированной азотной кислотой.
Реакция бериллия с водными растворами щелочей сопровождается выделением водорода и образованием гидроксобериллатов:
При проведении реакции с расплавом щелочи при 400-500 °C образуются диоксобериллаты:
Магний, кальций, стронций, барий и радий реагируют с водой с образованием щелочей (кроме магния, реакция которого с водой происходит только при внесении раскалённого порошка магния в воду):
Также, кальций, стронций, барий и радий реагируют с водородом, азотом, бором, углеродом и другими неметаллами с образованием соответствующих бинарных соединений:
Оксиды
Оксид бериллия - амфотерный оксид, растворяется в концентрированных минеральных кислотах и щелочах с образованием солей:
но с менее сильными кислотами и основаниями реакция уже не идет.
Оксид магния не реагирует с разбавленными и концентрированными основаниями, но легко реагирует с кислотами и водой:
Оксиды кальция, стронция, бария и радия - основные оксиды, реагируют с водой, сильными и слабыми растворами кислот и амфотерными оксидами и гидроксидами:
Гидроксиды
Гидроксид бериллия амфотерен, при реакциях с сильными основаниями образует бериллаты, с кислотами - бериллиевые соли кислот:
Гидроксиды магния, кальция, стронция, бария и радия - основания, сила увеличивается от слабого до очень сильного, являющегося сильнейшим коррозионным веществом, по активности превышающим гидроксид калия. Хорошо растворяются в воде (кроме гидроксидов магния и кальция). Для них характерны реакции с кислотами и кислотными оксидами и с амфотерными оксидами и гидроксидами:
Нахождение в природе
Все щёлочноземельные металлы имеются (в разных количествах) в природе. Ввиду своей высокой химической активности все они в свободном состоянии не встречаются. Самым распространённым щёлочноземельным металлом является кальций, количество которого равно 3,38 % (от массы земной коры). Немногим ему уступает магний, количество которого равно 2,35 % (от массы земной коры). Распространены в природе также барий и стронций, которых соответственно 0,05 и 0,034 % от массы земной коры. Бериллий является редким элементом, количество которого составляет 6·10−4% от массы земной коры. Что касается радия, который радиоактивен, то это самый редкий из всех щёлочноземельных металлов, но он в небольшом количестве всегда содержится в уранновых рудах. частности, он может быть выделен оттуда химическим путём. Его содержание равно 1·10−10% (от массы земной коры).
Биологическая роль
Магний содержится в тканях животных и растений (хлорофилл), является кофактором многих ферметативных реакций, необходим при синтезе АТФ, участвует в передаче нервных импульсов, активно применяется в медицине (бишофитотерапия и др.). Кальций - распространенный макроэлемент в организме растений, животных и человека. организме человека и других позвоночных большая его часть находится в скелете и зубах. костях кальций содержится в виде гидроксиапатита. Из различных форм карбоната кальция (извести) состоят «скелеты» большинства групп беспозвоночных (губки, коралловые полипы, моллюски и др.). Ионы кальция участвуют в процессах свертывания крови, а также служат одним из универсальных вторичных посредников внутри клеток и регулируют самые разные внутриклеточные процессы - мышечное сокращение, экзоцитоз, в том числе секрецию гормонов и нейромедиаторов. Стронций может замещать кальций в природных тканях, так как схож с ним по свойствам. организме человека масса стронция составляет около 1 % от массы кальция.
На данный момент о биологической роли бериллия, бария и радия ничего не известно. Все соединения бария и бериллия ядовиты. Радий чрезвычайно радиотоксичен. организме он ведёт себя подобно кальцию - около 80 % поступившего в организм радия накапливается в костной ткани. Большие концентрации радия вызывают остеопороз, самопроизвольные переломы костей и злокачественные опухоли костей и кроветворной ткани. Опасность представляет также радон - газообразный радиоактивный продукт распада радия.
Примечания
- По новой классификации ИЮПАК. По устаревшей классификации относятся к главной подгруппе II группы периодической таблицы.
- Nomenclature of Inorganic Chemistry. IUPAC Recommendations 2005. - International Union of Pure and Applied Chemistry, 2005. - P. 51.
- Group 2 - Alkaline Earth Metals, Royal Society of Chemistry.
- Золотой фонд. Школьная энциклопедия. Химия. М.: Дрофа, 2003.
| Периодическая система химических элементов Д. И. Менделеева | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo |
| 8 | Uue | Ubn | Ubu | Ubb | Ubt | Ubq | Ubp | Ubh | ||||||||||||||||||||||||
щёлочноземельные металлы в, щёлочноземельные металлы и, щёлочноземельные металлы химия, щёлочноземельные металлын