Հելիում
ՀԵԼԻՈՒՄ- Ես; մ.[հունարենից. helios - արև]: Քիմիական տարր (He), առանց հոտի քիմիապես իներտ գազ, ամենաթեթևը ջրածնից հետո։
◁ Հելիում, րդ, թ. G-րդ միջուկ.
Հելիում(լատ. Հելիում), պարբերական համակարգի VIII խմբի քիմիական տարր, պատկանում է ազնիվ գազերին; անգույն և անհոտ, խտությունը՝ 0,178 գ/լ։ Այն ավելի դժվար է հեղուկացնել, քան բոլոր հայտնի գազերը (-268,93ºC-ում); միակ նյութը, որը չի ամրանում նորմալ ճնշման դեպքում, անկախ նրանից, թե որքան խորը սառչում է: Հեղուկ հելիումը քվանտային հեղուկ է, որն ունի 2,17ºK (-270,98ºC) ցածր գերհոսունություն: Փոքր քանակությամբ հելիում կա օդում և երկրակեղևում, որտեղ այն անընդհատ ձևավորվում է ուրանի և այլ α-ռադիոակտիվ տարրերի քայքայման ժամանակ (α-մասնիկները հելիումի ատոմների միջուկներն են)։ Հելիումը շատ ավելի տարածված է Տիեզերքում, օրինակ՝ Արեգակի վրա, որտեղ այն առաջին անգամ հայտնաբերվել է (այստեղից էլ անվանումը՝ հունարեն hēlios - Արև): Հելիումը ստացվում է բնական գազերից։ Օգտագործվում են կրիոգեն տեխնոլոգիայում, իներտ միջավայրեր ստեղծելու համար, ավիացիոն ոլորտում (ստրատոսֆերային օդապարիկներ, օդապարիկներ և այլն լցնելու համար)։
ՀԵԼԻՈՒՄՀԵԼԻՈՒՄ (լատ. Helium), He (կարդալ՝ «հելիում»), ատոմային համարով 2, ատոմային զանգված 4,002602 քիմիական տարր։ Պատկանում է իներտ, կամ ազնիվ գազերի խմբին (պարբերական համակարգի VIIIA խումբ), գտնվում է 1-ին շրջանում։
Բնական հելիումը բաղկացած է երկու կայուն նուկլիդներից՝ 3 He (0,00013% ծավալով) և 4 He: Հելիում-4-ի գրեթե ամբողջական գերակշռությունը կապված է ուրանի, թորիումի, ռադիումի և այլ ատոմների ռադիոակտիվ քայքայման ժամանակ այս նուկլիդի միջուկների ձևավորման հետ, որը տեղի է ունեցել Երկրի երկար պատմության ընթացքում։
Հելիումի չեզոք ատոմի շառավիղը 0,122 նմ է։ Չեզոք չգրգռված ատոմի էլեկտրոնային կոնֆիգուրացիա 1 վ 2
. Չեզոք ատոմի հաջորդական իոնացման էներգիաները համապատասխանաբար 24,587 և 54,416 էՎ են (բոլոր տարրերի չեզոք ատոմներից հելիումի ատոմն ունի առաջին էլեկտրոնի անջատման ամենաբարձր էներգիան)։
Պարզ նյութը հելիումը թեթև միատոմ գազ է՝ առանց գույնի, համի և հոտի։
Հայտնաբերման պատմություն
Հելիումի հայտնաբերումը սկսվել է 1868 թվականին, երբ ֆրանսիացի աստղագետներ Պ. Ջ. Յանսենը դիտել է արևի խավարումը։ (սմ.Յանսեն Պիեռ Ժյուլ Սեզար)եւ անգլիացի D. N. Lockyer (սմ.Դարակ Ջոզեֆ Նորման)ինքնուրույն հայտնաբերված արեգակնային պսակի սպեկտրում (սմ.ԱՐԵՎԱՅԻՆ ՊԻՍԱԿ)դեղին գիծ (այն կոչվում էր Դ 3 տող), որը չէր կարող վերագրվել այն ժամանակ հայտնի տարրերից որևէ մեկին: 1871 թվականին Լոկյերը բացատրեց իր ծագումը Արեգակի վրա նոր տարրի առկայությամբ։ 1895 թվականին անգլիացի Վ.Ռեմզեյը (սմ.ՌԱՄԶԱՅ Ուիլյամ)բնական ռադիոակտիվ հանքաքարի կլեվեիտից առանձնացրել է գազ, որի սպեկտրում նույն Դ 3 տող. Լոկյերը նոր տարրին տվել է իր հայտնաբերման պատմությունն արտացոլող անուն (հունարեն Հելիոս, արև): Քանի որ Լոկյերը կարծում էր, որ հայտնաբերված տարրը մետաղ է, նա օգտագործեց «lim» վերջավորությունը տարրի լատիներեն անվանման մեջ (համապատասխանում է ռուսերեն «ij» վերջավորությանը), որը սովորաբար օգտագործվում է մետաղների անվան մեջ։ Այսպիսով, հելիումը, Երկրի վրա իր հայտնաբերումից շատ առաջ, ստացել է անուն, որն այն տարբերում է վերջավորությամբ այլ իներտ գազերի անվանումներից։
Բնության մեջ լինելը
Մթնոլորտային օդում հելիումի պարունակությունը շատ ցածր է և կազմում է մոտ 5,27·10 -4% ծավալով։ Երկրակեղևում այն կազմում է 0,8 10 -6%, ծովի ջրում՝ 4 10 -10%։ Հելիումի աղբյուրը նավթն ու հելիում պարունակող բնական գազերն են, որոնցում հելիումի պարունակությունը հասնում է 2-3%-ի, իսկ հազվադեպ դեպքերում՝ 8-10% ծավալի։ Սակայն տիեզերքում հելիումը երկրորդ ամենատարածված տարրն է (ջրածնից հետո). այն կազմում է տիեզերական զանգվածի 23%-ը:
Անդորրագիր
Հելիումի արտադրության տեխնոլոգիան շատ բարդ է. այն մեկուսացված է բնական հելիում պարունակող գազերից՝ խորը սառեցման մեթոդով։ Նման գազերի հանքավայրեր կան Ռուսաստանում, ԱՄՆ-ում, Կանադայում և Հարավային Աֆրիկայում։ Հելիումը պարունակում է նաև որոշ հանքանյութեր (մոնազիտ, թորիանիտ և այլն), մինչդեռ 1 կգ հանքանյութից, երբ տաքացվում է, կարելի է առանձնացնել մինչև 10 լիտր հելիում։
Ֆիզիկական հատկություններ
Հելիումը թեթև ոչ այրվող գազ է, բնականոն պայմաններում գազային հելիումի խտությունը 0,178 կգ/մ 3 է (միայն ջրածնային գազն է ավելի քիչ)։ Հելիումի եռման կետը (նորմալ ճնշման դեպքում) կազմում է մոտ 4,2K (կամ -268,93°C, որը ամենացածր եռման կետն է)։
Նորմալ ճնշման դեպքում հեղուկ հելիումը չի կարող վերածվել պինդ նյութի նույնիսկ բացարձակ զրոյին մոտ ջերմաստիճանում (0K): Մոտ 3,76 ՄՊա ճնշման դեպքում հելիումի հալման կետը 2,0 Կ է։ Ամենացածր ճնշումը, որի դեպքում նկատվում է հեղուկ հելիումի անցումը պինդ վիճակի, 2,5 ՄՊա է (25 ատմ), մինչդեռ հելիումի հալման կետը մոտ 1,1 Կ է (–272,1 °C)։
0,86 մլ հելիումը լուծվում է 100 մլ ջրի մեջ 20 °C ջերմաստիճանում, իսկ դրա լուծելիությունը նույնիսկ ավելի ցածր է օրգանական լուծիչներում։ Թեթև հելիումի մոլեկուլները լավ են անցնում (ցրվում) տարբեր նյութերի միջով (պլաստմասսա, ապակի, որոշ մետաղներ)։
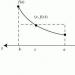
-270,97 °C-ից ցածր սառեցված հեղուկ հելիում-4-ի դեպքում նկատվում են մի շարք անսովոր էֆեկտներ, ինչը հիմք է տալիս այս հեղուկը դիտարկել որպես հատուկ, այսպես կոչված, քվանտային հեղուկ։ Այս հեղուկը սովորաբար կոչվում է հելիում-II, ի տարբերություն հեղուկ հելիում-I-ի, հեղուկ, որը գոյություն ունի մի փոքր ավելի բարձր ջերմաստիճաններում: Ջերմաստիճանի փոփոխություններով հեղուկ հելիումի ջերմունակության գրաֆիկը նման է հունական լամբդա (l) տառին։ Հելիում-I-ի հելիում-II-ի անցման ջերմաստիճանը 2,186 Կ է: Այս ջերմաստիճանը հաճախ կոչվում է l-կետ:
Հեղուկ հելիում-II-ն ունակ է արագ ներթափանցել ամենափոքր անցքերով և մազանոթներով՝ առանց մածուցիկության բացահայտման (այսպես կոչված՝ գերհոսունություն): (սմ.ԳԵՐԼՈՒՅԴՈՒԹՅՈՒՆ)հեղուկ հելիում-II): Բացի այդ, հելիում-II թաղանթները արագորեն շարժվում են պինդ մարմինների մակերեսով, ինչի արդյունքում հեղուկը արագ հեռանում է այն անոթից, որի մեջ տեղադրվել է։ Հելիում-II-ի այս հատկությունը կոչվում է գերսողացող: Հելիում-II-ի գերհոսքը հայտնաբերվել է 1938 թվականին խորհրդային ֆիզիկոս Պ.Լ.Կապիցայի կողմից։ (սմ.ԿԱՊԻՑ Պյոտր Լեոնիդովիչ)(Ֆիզիկայի Նոբելյան մրցանակ, 1978): Հելիում-II-ի յուրահատուկ հատկությունների բացատրությունը տվել է մեկ այլ խորհրդային ֆիզիկոս Լ. Դ. Լանդաուն (սմ. LANDAU Լև Դավիդովիչ) 1941-1944 թվականներին (Ֆիզիկայի Նոբելյան մրցանակ, 1962)։
Հելիումը չի առաջացնում որևէ քիմիական միացություն։ Ճիշտ է, հազվադեպ իոնացված հելիումում հնարավոր է հայտնաբերել բավականաչափ կայուն երկատոմային He 2 + իոններ:
Դիմում
Հելիումն օգտագործվում է մետաղների եռակցման, կտրման և հալման ժամանակ իներտ և պաշտպանիչ մթնոլորտ ստեղծելու, հրթիռային վառելիք մղելիս, օդանավերը և օդապարիկները լցնելու համար՝ որպես հելիումի լազերային միջավայրի բաղադրիչ: Հեղուկ հելիումը, Երկրի ամենացուրտ հեղուկը, եզակի սառնագենտ է փորձարարական ֆիզիկայում, որը թույլ է տալիս օգտագործել ծայրահեղ ցածր ջերմաստիճաններ գիտական հետազոտություններում (օրինակ՝ էլեկտրական գերհաղորդականության ուսումնասիրության ժամանակ (սմ.ԳԵՐհաղորդունակություն)): Շնորհիվ այն բանի, որ հելիումը շատ վատ է լուծվում արյան մեջ, այն օգտագործվում է որպես շնչառության համար ջրասուզակներին մատակարարվող արհեստական օդի անբաժանելի մաս։ Ազոտը հելիումով փոխարինելը կանխում է դեպրեսիայի հիվանդությունը (սմ.Կեսոնի հիվանդություն)(սովորական օդը ներշնչելիս բարձր ճնշման տակ ազոտը լուծվում է արյան մեջ, այնուհետև դրանից դուրս է գալիս փոքր անոթները խցանող փուչիկների տեսքով):
Հանրագիտարանային բառարան. 2009 .
Հոմանիշներ:Տեսեք, թե ինչ է «հելիումը» այլ բառարաններում.
- (լատ. Հելիում) Նա, պարբերական համակարգի VIII խմբի քիմիական տարր, ատոմային թիվ 2, ատոմային զանգված 4,002602, պատկանում է ազնիվ գազերին; անգույն և անհոտ, խտությունը՝ 0,178 գ/լ։ Այն ավելի դժվար է հեղուկացնել, քան բոլոր հայտնի գազերը (268,93 ° C ջերմաստիճանում); ... ... Մեծ Հանրագիտարանային բառարան
- (հունարեն, helyos sun-ից): Տարրական մարմին, որը հայտնաբերվել է արեգակնային սպեկտրում և առկա է երկրի վրա որոշ հազվագյուտ միներալներում. օդում առկա է հետքի քանակով: Ռուսերենում ներառված օտար բառերի բառարան. Չուդինով Ա.Ն. Ռուսաց լեզվի օտար բառերի բառարան
- (խորհրդանիշ Նա), գազային ոչ մետաղական տարր, NOBLE GAS, հայտնաբերված 1868 թվականին: Առաջին անգամ ստացվել է 1895 թվականին հանքանյութի կլեվիտից (ուրանիտի տարատեսակ): Ներկայումս դրա հիմնական աղբյուրը բնական գազն է: Պարունակվում է նաև... Գիտատեխնիկական հանրագիտարանային բառարան
Ես, ամուսին: , հին Էլի, Ի. Հայր՝ Գելիևիչ, Գելիևնա Ածանցյալներ՝ Գելյա (Գելա); Էլյա Ծագումը՝ (հունարենից. hēlios sun.) Անվան օր՝ հուլիսի 27 Անձնանունների բառարան. Հելիում Տես Էլիուս. Օրվա հրեշտակ. Հղում… Անձնական անունների բառարան
ՀԵԼԻՈՒՄ- քիմ. տարր, խորհրդանիշ He (lat. Helium), ատ. n. 2, ժամը. մ 4.002, վերաբերում է իներտ (ազնիվ) գազերին. անգույն և անհոտ, խտությունը՝ 0,178 կգ/մ3։ Նորմալ պայմաններում ջրածինը միատոմ գազ է, որի ատոմը բաղկացած է միջուկից և երկու էլեկտրոնից; ձևավորված... Մեծ պոլիտեխնիկական հանրագիտարան
- (հելիում), He, պարբերական համակարգի VIII խմբի քիմիական տարր, ատոմային թիվ 2, ատոմային զանգված 4,002602; վերաբերում է ազնիվ գազերին. ամենացածր եռացող նյութը (tbp 268.93shC), միակը, որը չի ամրանում նորմալ ճնշման տակ; ... ... Ժամանակակից հանրագիտարան
Քիմ. ութերորդ տարր. պարբերական համակարգ, սերիական համար 2; իներտ գազ հետ. մեջ 4.003. Բաղկացած է երկու կայուն իզոտոպներից՝ He4 և He3։ Սոդեր. դրանք փոփոխական են և կախված են առաջացման աղբյուրից, սակայն ծանր իզոտոպը միշտ գերակշռում է։ AT…… Երկրաբանական հանրագիտարան
Հելիում- (հելիում), He, պարբերական համակարգի VIII խմբի քիմիական տարր, ատոմային թիվ 2, ատոմային զանգված 4,002602; վերաբերում է ազնիվ գազերին. ամենացածր եռացող նյութը (tbp 268,93 ° C), միակը, որը չի ամրանում նորմալ ճնշման տակ; ... ... Պատկերազարդ հանրագիտարանային բառարան
Հելիում(Նա) իներտ գազ է, որը հանդիսանում է տարրերի պարբերական համակարգի երկրորդ տարրը, ինչպես նաև երկրորդ տարրը թեթևության և տարածվածության առումով Տիեզերքում։ Այն պատկանում է պարզ նյութերին և ստանդարտ պայմաններում (Ստանդարտ ջերմաստիճան և ճնշում) միատոմ գազ է։
Հելիումչունի համ, գույն, հոտ և չի պարունակում տոքսիններ։
Բոլոր պարզ նյութերի մեջ հելիումն ունի ամենացածր եռման կետը (T = 4,216 Կ): Մթնոլորտային ճնշման դեպքում անհնար է ստանալ պինդ հելիում, նույնիսկ բացարձակ զրոյին մոտ ջերմաստիճանում. պինդ ձևի անցնելու համար հելիումին անհրաժեշտ է 25 մթնոլորտից բարձր ճնշում: Հելիումի քիմիական միացությունները քիչ են և բոլորն էլ անկայուն են ստանդարտ պայմաններում։
Բնականաբար գոյություն ունեցող հելիումը բաղկացած է երկու կայուն իզոտոպներից՝ He և 4He: «Նա» իզոտոպը շատ հազվադեպ է (իզոտոպների առատությունը 0,00014%)՝ 99,99986% 4He իզոտոպի համար: Բացի բնականից, հայտնի են նաև հելիումի 6 արհեստական ռադիոակտիվ իզոտոպներ։
Տիեզերքում գրեթե ամեն ինչի՝ հելիումի հայտնվելը առաջնային նուկլեոսինթեզն էր, որը տեղի ունեցավ Մեծ պայթյունից հետո առաջին րոպեներին։
Ներկայումս գրեթե բոլորը հելիումԱյն առաջանում է ջրածնից աստղերի ինտերիերում տեղի ունեցող ջերմամիջուկային միաձուլման արդյունքում։ Մեր մոլորակում հելիումը ձևավորվում է ծանր տարրերի ալֆա քայքայման գործընթացում: Հելիումի այն մասը, որը կարողանում է թափանցել Երկրի ընդերքը, դուրս է գալիս որպես բնական գազի մի մաս և կարող է կազմել նրա բաղադրության մինչև 7%-ը։ Ինչ պետք է ընդգծել հելիումբնական գազից օգտագործվում է կոտորակային թորում` տարրերի ցածր ջերմաստիճանի բաժանման գործընթաց:
Հելիումի հայտնաբերման պատմությունը
1868 թվականի օգոստոսի 18-ին սպասվում էր Արեգակի ամբողջական խավարում։ Աշխարհի աստղագետներն ակտիվորեն պատրաստվում էին այս օրվան։ Նրանք հույս ունեին լուծել ցայտունների առեղծվածը` լուսային ելուստները, որոնք տեսանելի էին արևի ամբողջական խավարման ժամանակ արեգակնային սկավառակի եզրերի երկայնքով: Որոշ աստղագետներ կարծում էին, որ ցայտունները բարձր լուսնային լեռներ են, որոնք Արեգակի ամբողջական խավարման ժամանակ լուսավորվում են Արեգակի ճառագայթներով. Մյուսները կարծում էին, որ այդ գագաթները լեռներ են հենց Արեգակի վրա. դեռ ուրիշներ արեգակնային մթնոլորտի կրակոտ ամպեր տեսան արեգակնային ելուստներում: Մեծամասնությունը կարծում էր, որ ցայտունները ոչ այլ ինչ են, քան օպտիկական պատրանք:
1851 թվականին, Եվրոպայում դիտված արևի խավարման ժամանակ, գերմանացի աստղագետ Շմիդտը ոչ միայն տեսավ արեգակնային կանխատեսումներ, այլև հասցրեց նկատել, որ դրանց ուրվագծերը փոխվում են ժամանակի ընթացքում։ Հիմնվելով իր դիտարկումների վրա՝ Շմիդտը եզրակացրեց, որ ցայտունները շիկացած գազային ամպեր են, որոնք հսկա ժայթքումների հետևանքով արտանետվում են արևի մթնոլորտ։ Այնուամենայնիվ, նույնիսկ Շմիդտի դիտարկումներից հետո շատ աստղագետներ դեռևս կրակոտ եզրերը համարում էին օպտիկական պատրանք:
Միայն 1860 թվականի հուլիսի 18-ի ամբողջական խավարումից հետո, որը նկատվեց Իսպանիայում, երբ շատ աստղագետներ իրենց աչքերով տեսան արևի ելուստները, իսկ իտալացի Սեկկին և ֆրանսիացի Դելլարը կարողացան ոչ միայն ուրվագծել, այլև լուսանկարել դրանք, ոչ ոք ինչ-որ կասկածներ ուներ նշանավոր վայրերի գոյության վերաբերյալ:
1860 թվականին արդեն հայտնագործվել էր սպեկտրոսկոպ՝ սարք, որը հնարավորություն է տալիս, դիտարկելով օպտիկական սպեկտրի տեսանելի մասը, որոշել մարմնի որակական կազմը, որից ստացվում է դիտարկվող սպեկտրը։ Այնուամենայնիվ, արևի խավարման օրը աստղագետներից և ոչ մեկը սպեկտրոսկոպ չօգտագործեց՝ դիտելու ցայտունների սպեկտրը։ Սպեկտրոսկոպը հիշվեց, երբ խավարումն արդեն ավարտվել էր։
Այդ իսկ պատճառով, նախապատրաստվելով 1868 թվականի արևի խավարմանը, յուրաքանչյուր աստղագետ դիտարկման գործիքների ցանկում ներառել է սպեկտրոսկոպ։ Հայտնի ֆրանսիացի գիտնական Ժյուլ Յանսենը չմոռացավ այս գործիքը, երբ գնաց Հնդկաստան՝ դիտելու նշանավոր վայրեր, որտեղ արևի խավարումը դիտելու պայմանները, աստղագետների հաշվարկներով, լավագույնն էին։
Այն պահին, երբ Արեգակի շողշողացող սկավառակն ամբողջությամբ ծածկված էր Լուսնի կողմից, Ժյուլ Յանսենը, սպեկտրոսկոպով ուսումնասիրելով Արեգակի մակերևույթից ցրվող նարնջագույն-կարմիր բոցերը, տեսավ սպեկտրում, բացի ջրածնի երեք ծանոթ գծերից։ կարմիր, կանաչ-կապույտ և կապույտ, նոր, անծանոթ՝ վառ դեղին: Այն ժամանակվա քիմիկոսներին հայտնի նյութերից ոչ մեկն այդպիսի գիծ չուներ սպեկտրի այն հատվածում, որտեղ այն հայտնաբերել էր Ժյուլ Յանսենը։ Նույն հայտնագործությունը, բայց տանը՝ Անգլիայում, արել է աստղագետ Նորման Լոքերը։
1868 թվականի հոկտեմբերի 25-ին Փարիզի գիտությունների ակադեմիան ստացավ երկու նամակ. Մեկը, որը գրվել է արևի խավարման հաջորդ օրը, եկել է Գյունթուրից՝ Հնդկաստանի արևելյան ափին գտնվող փոքրիկ քաղաքից, Ժյուլ Յանսենից; Մեկ այլ նամակ՝ թվագրված 1868 թվականի հոկտեմբերի 20-ով, Անգլիայից էր Նորման Լոկյերից:
Ստացված նամակներն ընթերցվել են Փարիզի գիտությունների ակադեմիայի պրոֆեսորների հանդիպման ժամանակ։ Դրանցում Ժյուլ Յանսենը և Նորման Լոկյերը միմյանցից անկախ հայտնել են նույն «արևային նյութի» հայտնաբերման մասին։ Այս նոր նյութը, որը հայտնաբերվել է Արեգակի մակերեսին սպեկտրոսկոպի միջոցով, Լոկյերն առաջարկել է հելիումն անվանել հունարեն «արև» բառից՝ «հելիոս»:
Նման զուգադիպությունը զարմացրել է ակադեմիաների դասախոսների գիտական հավաքին և միևնույն ժամանակ վկայում է նոր քիմիական նյութի հայտնաբերման օբյեկտիվության մասին։ Ի պատիվ արևային ջահերի նյութի հայտնաբերման, շքանշան է տապալվել։ Այս շքանշանի մի կողմում փորագրված են Յանսենի և Լոկյերի դիմանկարները, իսկ մյուս կողմում՝ հին հունական արևի աստված Ապոլլոնի պատկերը՝ չորս ձիերով քաշված կառքի մեջ։ Կառքի տակ ֆրանսերեն մակագրություն կար՝ «1868 թվականի օգոստոսի 18-ի արևային ելուստների վերլուծություն»։
1895 թվականին լոնդոնցի քիմիկոս Հենրի Մայերսը անգլիացի հայտնի ֆիզիկաքիմիկոս Ուիլյամ Ռեմսեյի ուշադրությունը հրավիրեց երկրաբան Հիլդեբրանդի այն ժամանակ մոռացված հոդվածի վրա։ Այս հոդվածում Հիլդեբրանդը պնդում էր, որ որոշ հազվագյուտ հանքանյութեր, երբ տաքացվում են ծծմբաթթվի մեջ, արտանետում են գազ, որը չի այրվում և չի աջակցում այրմանը: Այս հազվագյուտ միներալներից էր կլեվեյտը, որը գտել է Նորվեգիայում բևեռային շրջանների հայտնի շվեդ հետազոտող Նորդենսկիոլդը:
Ռեմզեյը որոշել է հետաքննել կլեվեիտում պարունակվող գազի բնույթը։ Լոնդոնի բոլոր քիմիական խանութներում Ռեմսիի օգնականներին հաջողվել է գնել միայն ... մեկ գրամ զրպարտություն՝ դրա դիմաց վճարելով ընդամենը 3,5 շիլլինգ։ Ստացված կլեյվիտի քանակից մի քանի խորանարդ սանտիմետր գազ մեկուսացնելով և մաքրելով այն կեղտից՝ Ռամզին այն ուսումնասիրեց սպեկտրոսկոպով։ Արդյունքն անսպասելի էր. կլեվեյտից արձակված գազը պարզվեց, որ ... հելիում է:
Չվստահելով իր հայտնագործությանը, Ռեմզեյը դիմեց Ուիլյամ Քրուքսին՝ այն ժամանակ Լոնդոնի սպեկտրային վերլուծության առաջատար մասնագետին՝ խնդրանքով հետաքննել կլեյվիտից արտազատվող գազը:
Crookes-ը ուսումնասիրել է գազը: Հետազոտության արդյունքը հաստատել է Ռեմսիի հայտնագործությունը։ Այսպիսով, 1895 թվականի մարտի 23-ին Երկրի վրա հայտնաբերվեց մի նյութ, որը հայտնաբերվել էր Արեգակի վրա 27 տարի առաջ։ Նույն օրը Ռամզեյը հրապարակեց իր հայտնագործությունը՝ մի ուղերձ հղելով Լոնդոնի թագավորական ընկերությանը, մյուսը՝ ֆրանսիացի հայտնի քիմիկոս ակադեմիկոս Բերթելոյին։ Բերթելոտին ուղղված նամակում Ռեմզին խնդրել է իր հայտնագործության մասին տեղեկացնել Փարիզի ակադեմիայի պրոֆեսորների գիտական ժողովին։
Ռեմսայից տասնհինգ օր անց, անկախ նրանից, շվեդ քիմիկոս Լանգլին մեկուսացրեց հելիումը կլեվեյտից և, ինչպես Ռեմզին, իր հայտնաբերման մասին զեկուցեց քիմիկոս Բերտելոտին:
Երրորդ անգամ հելիումը հայտնաբերվեց օդում, որտեղ, ըստ Ռեմսիի, այն պետք է ստացվեր հազվագյուտ միներալներից (կլեվեիտ և այլն) Երկրի վրա ոչնչացման և քիմիական փոխակերպումների ժամանակ։
Փոքր քանակությամբ հելիում է հայտնաբերվել նաև որոշ հանքային աղբյուրների ջրում։ Այսպես, օրինակ, Ռամզեյը գտել է Պիրենեներում գտնվող Կոտրի բուժիչ աղբյուրում, անգլիացի ֆիզիկոս Ջոն Ուիլյամ Ռեյլին այն գտել է հայտնի Բաթ հանգստավայրի աղբյուրների ջրերում, գերմանացի ֆիզիկոս Կայզերը հելիում է հայտնաբերել հելիումի մեջ: Սեւ անտառի լեռներում։ Այնուամենայնիվ, ամենից շատ հելիումը հայտնաբերվել է որոշ հանքանյութերում: Հանդիպում է սամարսկիտում, ֆերգուսոնիտի, կոլումբիտի, մոնազիտի և ուրանիտի մեջ։ Ցեյլոն կղզու թորիանիտի հանքանյութը պարունակում է հատկապես մեծ քանակությամբ հելիում։ Մեկ կիլոգրամ թորիանիտը շիկացած տաքացնելիս արտազատում է 10 լիտր հելիում։
Շուտով պարզվեց, որ հելիում կա միայն այն հանքանյութերում, որոնք պարունակում են ռադիոակտիվ ուրան և թորիում։ Որոշ ռադիոակտիվ տարրերի արձակած ալֆա ճառագայթները ոչ այլ ինչ են, քան հելիումի ատոմների միջուկներ։
Պատմությունից...
Նրա անսովոր հատկությունները հնարավորություն են տալիս լայնորեն օգտագործել հելիումը տարբեր նպատակների համար: Առաջինը, միանգամայն տրամաբանական, ելնելով դրա թեթևությունից, օդապարիկների և օդանավերի մեջ օգտագործումն է։ Ընդ որում, ի տարբերություն ջրածնի, այն պայթուցիկ չէ։ Հելիումի այս հատկությունը գերմանացիներն օգտագործել են առաջին համաշխարհային պատերազմում մարտական օդանավերի վրա։ Դրա կիրառման թերությունն այն է, որ հելիումով լցված օդանավը չի թռչի այնքան բարձր, որքան ջրածնայինը։
Խոշոր քաղաքների՝ հիմնականում Անգլիայի և Ֆրանսիայի մայրաքաղաքների ռմբակոծման համար առաջին համաշխարհային պատերազմում գերմանական հրամանատարությունն օգտագործել է օդանավեր (ցեպելիններ)։ Դրանք լցնելու համար օգտագործվել է ջրածին։ Հետևաբար, նրանց դեմ պայքարը համեմատաբար պարզ էր. օդանավի պատյանն ընկած հրկիզվող արկը բռնկվեց ջրածնի մեջ, որն անմիջապես բռնկվեց, և ապարատը այրվեց: Առաջին համաշխարհային պատերազմի տարիներին Գերմանիայում կառուցված 123 օդանավերից 40-ը այրվել են հրկիզվող արկերից։ Բայց մի օր բրիտանական բանակի գլխավոր շտաբը զարմացավ առանձնահատուկ նշանակություն ունեցող հաղորդագրությունից. Գերմանական զեպելինի վրա հրկիզվող արկերի ուղիղ հարվածներն արդյունք չեն տվել։ Դիրանավը չի բռնկվել, բայց դանդաղորեն դուրս հոսելով ինչ-որ անհայտ գազից՝ հետ է թռչել։
Ռազմական փորձագետները տարակուսած էին և, չնայած հրկիզվող արկերից զեպելինի չդյուրավառ լինելու հարցի հրատապ և մանրամասն քննարկմանը, նրանք չկարողացան գտնել անհրաժեշտ բացատրություն։ Հանելուկը լուծել է անգլիացի քիմիկոս Ռիչարդ Թրելֆոլը։ Բրիտանական ծովակալությանը ուղղված նամակում նա գրել է. «... Ես կարծում եմ, որ գերմանացիները հելիումի մեծ քանակությամբ արդյունահանման ինչ-որ միջոց են հորինել, և այս անգամ նրանք լցրել են իրենց զեպելինի պատյանը ոչ թե ջրածնով, ինչպես միշտ, այլ հելիումով։ ..."
Թրելֆոլի փաստարկների համոզիչությունը, սակայն, նվազեց այն հանգամանքով, որ Գերմանիայում հելիումի նշանակալի աղբյուրներ չկային։ Ճիշտ է, հելիումը պարունակվում է օդում, բայց դա բավարար չէ՝ մեկ խորանարդ մետր օդը պարունակում է ընդամենը 5 խորանարդ սանտիմետր հելիում։ Linde համակարգի սառնարանային մեքենան, որը մեկ ժամում մի քանի հարյուր խորանարդ մետր օդը վերածում է հեղուկի, այս ընթացքում կարող էր արտադրել ոչ ավելի, քան 3 լիտր հելիում։
3 լիտր հելիում ժամում! Իսկ ցեպելինը լցնելու համար անհրաժեշտ է 5÷6 հազար խմ։ մ.Հելիումի նման քանակություն ստանալու համար Լինդի մեկ մեքենան պետք է աշխատեր առանց կանգ առնելու մոտ երկու հարյուր տարի, երկու հարյուր նման մեքենաները մեկ տարում տալիս էին հելիումի անհրաժեշտ քանակությունը։ Հելիում արտադրելու համար օդը հեղուկի վերածելու համար 200 գործարանների կառուցումը տնտեսապես շատ անշահավետ է և գործնականում անիմաստ։
Գերմանացի քիմիկոսները որտեղի՞ց են հելիում ստացել:
Այս հարցը, ինչպես պարզվեց ավելի ուշ, լուծվեց համեմատաբար պարզ. Պատերազմից շատ առաջ գերմանական շոգենավերի ընկերություններին, որոնք ապրանքներ են առաքում Հնդկաստան և Բրազիլիա, հանձնարարվել է վերադարձող շոգենավերը բեռնել ոչ թե սովորական բալաստով, այլ մոնազիտ ավազով, որը պարունակում է հելիում։ Այսպիսով, ստեղծվել է «հելիումի հումքի» պաշար՝ մոտ 5 հազար տոննա մոնազիտ ավազ, որից հելիում են ստացել զեպելինների համար։ Բացի այդ, Նաուհեյմ հանքային աղբյուրի ջրից արդյունահանվել է հելիում, որը տվել է մինչև 70 խմ։ մ հելիում օրական.
Չհրկիզվող զեպելինի հետ կապված միջադեպը խթան հանդիսացավ հելիումի նոր որոնման համար: Քիմիկոսները, ֆիզիկոսները, երկրաբանները սկսեցին ինտենսիվ փնտրել հելիում։ Այն հանկարծակի մեծ արժեք է ստացել։ 1916 թվականին հելիումի 1 խորանարդ մետրն արժեր 200 000 ոսկի ռուբլի, այսինքն՝ մեկ լիտրը 200 ռուբլի։ Եթե հաշվի առնենք, որ հելիումի մեկ լիտրը կշռում է 0,18 գ, ապա դրա 1 գ-ն արժե ավելի քան 1000 ռուբլի։
Հելիումը դարձել է վաճառականների, սպեկուլյանտների, բորսայի դիլերների որսի առարկա։ Հելիումը զգալի քանակությամբ հայտնաբերվել է երկրի աղիքներից դուրս եկող բնական գազերում Ամերիկայում՝ Կանզաս նահանգում, որտեղ Ամերիկայի պատերազմի մեջ մտնելուց հետո Հելիումի գործարան կառուցվեց Ֆորտ Ուորթ քաղաքի մոտ։ Բայց պատերազմն ավարտվեց, հելիումի պաշարները մնացին չօգտագործված, հելիումի արժեքը կտրուկ ընկավ և 1918 թվականի վերջին կազմեց մոտ չորս ռուբլի մեկ խորանարդ մետրի համար։
Նման դժվարությամբ արդյունահանված հելիումն ամերիկացիներն օգտագործել են միայն 1923 թվականին՝ այժմ խաղաղ «Շենանդոա» օդանավը լցնելու համար։ Դա աշխարհում առաջին և միակ օդային բեռնատար-ուղևորատար նավն էր, որը լցված էր հելիումով: Սակայն նրա «կյանքը» կարճ տեւեց։ Նրա ծնվելուց երկու տարի անց Շենանդոան ավերվեց փոթորիկի պատճառով: 55 հազար խմ մ, հելիումի գրեթե ողջ համաշխարհային պաշարը, որը հավաքվել էր վեց տարի, մթնոլորտում առանց հետքի ցրվեց ընդամենը 30 րոպե տևած փոթորկի ժամանակ։
Հելիումի կիրառում






Հելիումը բնության մեջ
Հիմնականում ցամաքային հելիումառաջանում է ուրան-238, ուրան-235, թորիումի և դրանց քայքայման անկայուն արգասիքների ռադիոակտիվ քայքայման ժամանակ։ Սամարիում-147-ի և բիսմութի դանդաղ քայքայման արդյունքում հելիումի անհամեմատ ավելի փոքր քանակություններ են արտադրվում: Այս բոլոր տարրերից առաջանում է միայն հելիումի ծանր իզոտոպը՝ He 4 , որի ատոմները կարելի է համարել որպես ալֆա մասնիկների մնացորդներ՝ թաղված երկու զույգ էլեկտրոնների թաղանթում՝ էլեկտրոնային կրկնակի մեջ։ Վաղ երկրաբանական ժամանակաշրջաններում հավանաբար եղել են նաև այլ բնական ռադիոակտիվ տարրեր, որոնք արդեն անհետացել էին Երկրի երեսից՝ հագեցնելով մոլորակը հելիումով: Դրանցից մեկը այժմ արհեստականորեն վերստեղծված նեպտունային շարքն էր:
Ըստ ժայռի կամ հանքանյութի մեջ թակարդված հելիումի՝ կարելի է դատել նրանց բացարձակ տարիքը։ Այս չափումները հիմնված են ռադիոակտիվ քայքայման օրենքների վրա. օրինակ, ուրանի 238-ի կեսը 4,52 միլիարդ տարում վերածվում է. հելիումև կապար:
Հելիումդանդաղ կուտակվում է երկրակեղևում: Մեկ տոննա գրանիտը, որը պարունակում է 2 գ ուրան և 10 գ թորիում, միլիոն տարվա ընթացքում արտադրում է ընդամենը 0,09 մգ հելիում` կես խորանարդ սանտիմետր: Ուրանով և թորիումով հարուստ շատ քիչ հանքանյութերը պարունակում են բավականին մեծ քանակությամբ հելիում` մի քանի խորանարդ սանտիմետր հելիում մեկ գրամի դիմաց: Այնուամենայնիվ, այս հանքանյութերի տեսակարար կշիռը բնական հելիումի արտադրության մեջ մոտ է զրոյի, քանի որ դրանք շատ հազվադեպ են:
Երկրի վրա հելիում քիչ կա. 1 մ 3 օդը պարունակում է ընդամենը 5,24 սմ 3 հելիում, իսկ ցամաքային նյութի յուրաքանչյուր կիլոգրամը պարունակում է 0,003 մգ հելիում: Սակայն Տիեզերքում տարածվածության առումով հելիումը ջրածնից հետո երկրորդն է. հելիումը կազմում է տիեզերական զանգվածի մոտ 23%-ը: Ամբողջ հելիումի մոտավորապես կեսը կենտրոնացած է երկրակեղևում, հիմնականում նրա գրանիտե թաղանթում, որտեղ կուտակվել են ռադիոակտիվ տարրերի հիմնական պաշարները։ Երկրակեղևում հելիումի պարունակությունը փոքր է՝ 3 x 10 -7% կշռով։ Հելիումը կուտակվում է աղիքների և յուղերի ազատ գազային կուտակումներում. նման հանքավայրերը հասնում են արդյունաբերական մասշտաբի։ Հելիումի առավելագույն կոնցենտրացիաները (10-13%) հայտնաբերվել են ազատ գազի կուտակումներում և ուրանի հանքավայրերի գազերում և (20-25%) ստորերկրյա ջրերից ինքնաբուխ արտանետվող գազերում: Որքան մեծ է գազատար նստվածքային ապարների տարիքը և որքան բարձր է դրանցում ռադիոակտիվ տարրերի պարունակությունը, այնքան ավելի շատ է հելիումը բնական գազերի բաղադրության մեջ։
Հելիումի արդյունահանում
Արդյունաբերական մասշտաբով հելիումի արտադրությունն իրականացվում է ինչպես ածխաջրածնի, այնպես էլ ազոտի բաղադրության բնական և նավթային գազերից: Ըստ հումքի որակի՝ հելիումի հանքավայրերը բաժանվում են՝ հարուստ (He պարունակությունը > 0,5% ծավալով); սովորական (0,10-0,50) և աղքատ< 0,10). Значительные его концентрации известны в некоторых месторождениях природного газа Канады, США (шт. Канзас, Техас, Нью-Мексико, Юта).
Հելիումի համաշխարհային պաշարները կազմում են 45,6 միլիարդ խորանարդ մետր։ Խոշոր ավանդները գտնվում են ԱՄՆ-ում (համաշխարհային ռեսուրսների 45%-ը), որին հաջորդում են Ռուսաստանը (32%), Ալժիրը (7%), Կանադան (7%) և Չինաստանը (4%)։
ԱՄՆ-ն առաջատար է նաև հելիումի արդյունահանմամբ (տարեկան 140 մլն խմ), որին հաջորդում է Ալժիրը (16 մլն):
Ռուսաստանն աշխարհում երրորդ տեղն է զբաղեցնում՝ տարեկան 6 մլն խմ։ Օրենբուրգի հելիումի գործարանը ներկայումս հելիումի արտադրության միակ ներքին աղբյուրն է, և գազի արդյունահանումը նվազում է: Այս առումով առանձնահատուկ նշանակություն ունեն Արևելյան Սիբիրի և Հեռավոր Արևելքի գազային հանքավայրերը՝ հելիումի բարձր կոնցենտրացիաներով (մինչև 0,6%)։ Ամենահեռանկարայիններից մեկը Կովիկտա հան է zocondensate դաշտը գտնվում է Իրկուտսկի մարզի հյուսիսում: Ըստ մասնագետների՝ այն պարունակում է աշխարհի մոտ 25%-ը x հելիումի պաշարներ.
|
Ցուցանիշի անվանումը |
Հելիում (դասարան A) (ըստ TU 51-940-80) |
Հելիում (դասարան B) (ըստ TU 51-940-80) |
Բարձր մաքրության հելիում, 5.5 աստիճան (ըստ TU 0271-001-45905715-02) |
Բարձր մաքրության հելիում, ապրանքանիշ 6.0 (ըստ TU 0271-001-45905715-02) |
|
Հելիում, ոչ պակաս |
||||
|
Ազոտ, ոչ ավելին |
||||
|
Թթվածին + արգոն |
||||
|
Նեոն, ոչ ավելին |
||||
|
Ջրի գոլորշի, ոչ ավելին |
||||
|
Ածխաջրածիններ, ոչ ավելին |
||||
|
CO2 + CO, ոչ ավելին |
||||
|
Ջրածին, ոչ ավելին |
Անվտանգություն
– Հելիումը ոչ թունավոր է, ոչ դյուրավառ, ոչ պայթուցիկ
- Հելիումը թույլատրվում է օգտագործել ցանկացած մարդաշատ վայրերում՝ համերգների, ակցիաների, մարզադաշտերի, խանութների:
– Գազային հելիումը ֆիզիոլոգիապես իներտ է և վտանգ չի ներկայացնում մարդկանց համար:
– Հելիումը վտանգավոր չէ նաև շրջակա միջավայրի համար, հետևաբար բալոններում դրա մնացորդների չեզոքացում, օգտագործում և վերացում չի պահանջվում։
– Հելիումը շատ ավելի թեթև է, քան օդը և ցրվում է Երկրի մթնոլորտի վերին շերտերում:
|
Հելիում (A և B դասարաններ՝ ըստ TU 51-940-80) |
|
|
Տեխնիկական անվանումը |
Հելիում գազային |
|
Քիմիական բանաձև |
|
|
ՄԱԿ-ի համարը |
|
|
Տրանսպորտային վտանգի դաս |
|
|
Ֆիզիկական հատկություններ |
|
|
Ֆիզիկական վիճակ |
Նորմալ պայմաններում՝ գազ |
|
Խտությունը, կգ/մ³ |
Նորմալ պայմաններում (101,3 կՊա, 20 C), 1627 թ |
|
Եռման կետ, C 101,3 կՊա |
|
|
3-րդ կետի ջերմաստիճանը և դրա հավասարակշռության ճնշումը C, (MPa) |
|
|
Լուծելիություն ջրի մեջ |
անչափահաս |
|
Հրդեհի և պայթյունի վտանգ |
հրդեհի և պայթյունի ապացույց |
|
Կայունություն և ռեակտիվություն |
|
|
Կայունություն |
կայուն |
|
Ռեակտիվություն |
իներտ գազ |
|
Մարդկային վտանգ |
|
|
Թունավոր ազդեցություն |
Ոչ թունավոր |
|
բնապահպանական վտանգ |
Շրջակա միջավայրի վրա վնասակար ազդեցություն չունի |
|
հարմարություններ |
Ցանկացած միջոց կիրառելի է։ |
Հելիումի պահպանում և տեղափոխում
Գազային հելիումը կարող է փոխադրվել տրանսպորտի բոլոր եղանակներով՝ համապատասխան տրանսպորտի որոշակի եղանակով ապրանքների փոխադրման կանոններին: Փոխադրումն իրականացվում է հատուկ շագանակագույն պողպատե բալոններով և հելիումով տարաներով։ Հեղուկ հելիումը տեղափոխվում է տրանսպորտային նավերով, ինչպիսիք են STG-40, STG-10 և STG-25, 40, 10 և 25 լիտր ծավալով:
Տեխնիկական գազերով բալոնների փոխադրման կանոններ
Ռուսաստանի Դաշնությունում վտանգավոր ապրանքների փոխադրումը կարգավորվում է հետևյալ փաստաթղթերով.
1. «Վտանգավոր բեռների ավտոմոբիլային փոխադրման կանոններ» (փոփոխված է Ռուսաստանի Դաշնության տրանսպորտի նախարարության 1999 թ. Ռուսաստանի Դաշնության 1995 թվականի դեկտեմբերի 18-ին, գրանցման թիվ 997):
2. «Վտանգավոր ապրանքների ավտոմոբիլային փոխադրման մասին եվրոպական համաձայնագիր» (ADR), որին Ռուսաստանը պաշտոնապես միացել է 1994 թվականի ապրիլի 28-ին (Ռուսաստանի Դաշնության Կառավարության 03.02.1994 թ. թիվ 76 որոշում):
3. «Ճանապարհի կանոններ» (SDA 2006), մասնավորապես հոդված 23.5, որը սահմանում է, որ «վտանգավոր բեռների փոխադրումը ... իրականացվում է հատուկ կանոնների համաձայն»:
4. «Վարչական իրավախախտումների վերաբերյալ Ռուսաստանի Դաշնության օրենսգիրք», որի 12.21-րդ հոդվածի 2-րդ մասը նախատեսում է պատասխանատվություն վտանգավոր ապրանքների փոխադրման կանոնների խախտման համար՝ «վարորդների նկատմամբ վարչական տուգանքի՝ մեկից մինչև նվազագույն աշխատավարձի եռապատիկի չափով կամ տրանսպորտային միջոցներ վարելու իրավունքից զրկելը մեկից երեք ամիս ժամկետով, փոխադրումների համար պատասխանատու պաշտոնատար անձանց համար՝ նվազագույն աշխատավարձի տասնապատիկից քսանապատիկի չափով:
Համաձայն 1.2-րդ կետի 3-րդ կետի՝ «Կանոնները չեն տարածվում ... մեկ փոխադրամիջոցով սահմանափակ քանակությամբ վտանգավոր նյութերի փոխադրման վրա, որի փոխադրումը կարող է համարվել ոչ վտանգավոր բեռների փոխադրում»: Այն նաև բացատրում է, որ «Վտանգավոր ապրանքների սահմանափակ քանակությունը սահմանվում է որոշակի տեսակի վտանգավոր բեռների անվտանգ փոխադրման պահանջներում: Դրա որոշման ժամանակ հնարավոր է օգտագործել «Վտանգավոր ապրանքների միջազգային փոխադրման մասին» եվրոպական համաձայնագրի պահանջները: (ADR)»: Այսպիսով, նյութերի առավելագույն քանակի հարցը, որոնք կարող են փոխադրվել որպես ոչ վտանգավոր ապրանքներ, կրճատվում է ADR-ի 1.1.3 բաժնի ուսումնասիրությամբ, որը սահմանում է տարբեր հանգամանքների հետ կապված վտանգավոր ապրանքների փոխադրման եվրոպական կանոններից բացառություններ:
Այսպիսով, օրինակ, համաձայն 1.1.3.1 կետի «ՎԱԴ-ի դրույթները չեն տարածվում ... մասնավոր անձանց կողմից վտանգավոր բեռների փոխադրման վրա, երբ այդ ապրանքները փաթեթավորված են մանրածախ վաճառքի համար և նախատեսված են նրանց անձնական սպառման, օգտագործման համար: առօրյա կյանքում, հանգստի կամ սպորտի ժամանակ, եթե միջոցներ են ձեռնարկվում փոխադրման նորմալ պայմաններում պարունակության արտահոսքը կանխելու համար»։
Այնուամենայնիվ, վտանգավոր ապրանքների փոխադրման կանոններով պաշտոնապես ճանաչված բացառությունների խումբը բացառություններ են՝ կապված մեկ տրանսպորտային միավորով տեղափոխվող քանակությունների հետ (կետ 1.1.3.6):
Բոլոր գազերը ըստ ADR դասակարգման դասվում են նյութերի երկրորդ դասին: Չդյուրավառ, ոչ թունավոր գազերը (A խմբեր՝ չեզոք և O՝ օքսիդացնող) պատկանում են տրանսպորտային երրորդ կատեգորիային՝ 1000 միավոր առավելագույն քանակի սահմանաչափով։ Դյուրավառ (F խումբ) - մինչև երկրորդը, առավելագույնը 333 միավոր: «Միավոր» ասելով այստեղ նկատի ունի սեղմված գազ պարունակող անոթի 1 լիտր տարողությամբ կամ 1 կգ հեղուկացված կամ լուծված գազ։ Այսպիսով, մեկ տրանսպորտային միավորում որպես ոչ վտանգավոր բեռ տեղափոխվող գազերի առավելագույն քանակը հետևյալն է.
Մենք բոլորս գիտենք հելիումը՝ շատ թեթև գազ, որի շնորհիվ օդ են բարձրանում օդապարիկներն ու օդանավերը։ Հելիումն ունի անվտանգության շատ կարևոր առավելություն՝ ջրածնի պես չի այրվում կամ պայթում: Այս գազը նաև օդային խառնուրդների անբաժանելի մասն է, որն օգտագործվում է խորը ծովային սուզորդների կողմից շնչառության մեջ. ի տարբերություն ազոտի, այն գրեթե չի լուծվում արյան կամ լիպիդների մեջ (ճարպային բաղադրիչներ) նույնիսկ շատ բարձր ճնշման պայմաններում:
Հելիումն օգնում է անել առանց ազոտային անզգայացում, որի նյարդային համակարգը (60% լիպիդներ) հագեցած է ազոտով, ինչի հետևանքով ջրասուզակներն այնպիսի զգացողություն են ունենում, կարծես 30 մետր խորության վրա մեկ martini են խմել։ Այս գազը նաև օգնում է խուսափել դեկոմպրեսիոն հիվանդության առաջացումից, կամ ինչպես այն կոչվում է նաև դեկոմպրեսիոն հիվանդություն: Սա ցավոտ և վտանգավոր պայման է, երբ ջրասուզակի արյան, նյարդային համակարգի, հոդերի և մաշկի տակ ազոտի պղպջակներ են ձևավորվում, երբ ճնշումը շատ արագ իջնում է, երբ ջրասուզակը բարձրանում է մակերես: Հելիումի և թթվածնի խառնուրդը (կոչվում է հելիում) ձայնը շատ ճռճռացող է դարձնում. դա պայմանավորված է նրանով, որ ձայնը հելիումով շատ ավելի արագ է անցնում, քան օդով, և հենց հելիումի այս հատկության շնորհիվ է, որ այս զվարճանքը սիրված կատակ է: տոները, երբ փուչիկները փչում են հելիումով:
Հելիումը երկրորդ ամենաթեթև քիմիական տարրն է և ունի շատ զարմանալի հատկություններ. Այս գազը ստացել է իր անվանումը այն փաստից, որ այն առաջին անգամ հայտնաբերվել է արևի լույսի պատկերով (հունարեն հելիոս), նախքան Երկրի վրա հայտնաբերելը: Բոլոր գազերը, երբ բավականաչափ սառչում են, խտանում են հեղուկ վիճակի, և հելիումն ունի ամենացածր ցողի կետը բոլոր հայտնի նյութերից (-269°C կամ -452°F): Ի տարբերություն այլ քիմիական տարրերի՝ հելիումը երբեք չի սառչում, որքան էլ ցուրտ լինի, բացառությամբ շատ բարձր ճնշման պայմաններում։ Բացի այդ, հելիումի հեղուկ ձևը, երբ սառչում է մինչև -271°C (-456°F) ցածր ջերմաստիճանում, ձևավորում է եզակի փուլ, որը կոչվում է գերհեղուկ. գերհեղուկհոսում է պարզապես կատարյալ, առանց որևէ դիմադրության (մածուցիկության):
Ենթադրվում է, որ հելիումը արևի վրա առաջացել է միջուկային միաձուլում . Սա այն գործընթացն է, որով ջրածնի միջուկները՝ ամենաթեթև տարրը, միաձուլվում են՝ ձևավորելով հելիում՝ ազատելով ահռելի քանակությամբ էներգիա։
Երկրի վրա այս գազն առաջանում է հիմնականում ռադիոակտիվության արդյունքում ալֆա(ա) - քայքայվել. Հայտնի նորզելանդացի ֆիզիկոս Էռնեստ Ռադերֆորդը (1871–1937) առաջին անգամ բացահայտեց, որ ալֆա մասնիկները իրականում հելիումի ատոմների միջուկներն են։ Ահա թե ինչպես է հելիումը գոյանում ապարում պարունակվող ռադիոակտիվ տարրերից, ինչպիսիք են ուրանը կամ թորիումը, և դրանցից այն մտնում է օդ։
Գիտնականները կարող են որոշել, թե որքան արագ է առաջանում հելիումը, որքան արագ է այն դուրս գալիս ժայռերից և որքան է մտնում օդ, և որքան հելիում կարող է կորցնել օդից տիեզերք: Նրանք կարող են նաև չափել հելիումի քանակը քարի և օդի մեջ: Դրա հիման վրա գիտնականները կարող են հաշվարկել ապարների և օդի առավելագույն տարիքը։Արդյունքները տարակուսելի են նրանց համար, ովքեր հավատում են միլիարդավոր տարիների: Իհարկե, բոլոր նման հաշվարկները հիմնված են անցյալի մասին ենթադրությունների վրա, ինչպիսիք են սկզբնական պայմանների և տարբեր գործընթացների մշտական գործակիցների մասին ենթադրությունները։ Նրանք երբեք չեն կարող ապացուցելինչ-որ բանի տարիքը. Սա պահանջում է ականատես, ով ամեն ինչ տեսել է իր աչքերով ( տեսնել Հոբ 38։4 ).
Հելիումը մթնոլորտում
Օդը հիմնականում բաղկացած է ազոտից (78,1%) և թթվածնից (20,1%)։ Նրանում հելիումի քանակը շատ փոքր է (0,0005%)։ Այնուամենայնիվ, սա շատ հելիում է, մասնավորապես 3,71 միլիարդ տոննա: Այնուամենայնիվ, քանի որ ամեն վայրկյան 67 գրամ հելիում երկրակեղևից մտնում է մթնոլորտ, դա կպահանջի մոտ երկու միլիոն տարի , նույնիսկ եթե հենց սկզբում այն ընդհանրապես չկար։
Էվոլյուցիոնիստները կարծում են, որ մեր երկիրը 2500 անգամ ավելի հին է, այսինքն՝ այն 4,5 միլիարդ տարի. Իհարկե, Երկիրը կարող էր ստեղծվել դիտարկված հելիումի մեծ մասով, ուստի երկու միլիոն տարի է առավելագույն տարիքը . (Այս տարիքը կարող է շատ ավելի քիչ լինել, օրինակ՝ 6000 տարի):
Բացի այդ, պետք է նշել, որ նախկինում հելիումի առաջացումը տեղի կունենար ավելի արագ, քան ներկայում, քանի որ ռադիոակտիվ աղբյուրները քայքայվում էին: Սա էլ ավելի կնվազեցնի Երկրի տարիքային սահմանները:
Այս խնդիրը լուծելու միակ միջոցը ենթադրելն է, որ հելիումը պարզապես արտահոսում է տիեզերք: Բայց որպեսզի դա տեղի ունենա, հելիումի ատոմները պետք է այնքան արագ շարժվեն, որպեսզի խուսափեն Երկրի ձգումից (այսինքն՝ ավելի արագ, քան փախչող արագություն): Ատոմների միջև բախումները դանդաղեցնում են նրանց շարժումը, բայց կրիտիկական բարձրության մակարդակից բարձր ( էկզաբազա), գետնից մոտ 500 կիլոմետր բարձրության վրա, բախումները շատ հազվադեպ են։ Ատոմները, որոնք հատում են այս բարձրությունը, փախչելու հնարավորություն ունեն, եթե բավական արագ են շարժվում՝ վայրկյանում առնվազն 10,75 կիլոմետր: Նկատի ունեցեք, որ թեև օդապարիկում հելիումը լողում է, բաց լինելու դեպքում այն պարզապես միատեսակ խառնվում է բոլոր մյուս գազերի հետ, ինչը սովորական է բոլոր նորմալ գազերի համար:
Ատոմների միջին արագությունը կարելի է հաշվարկել, եթե գիտեք ջերմաստիճանը, քանի որ այն ուղղակիորեն կապված է ատոմների կամ մոլեկուլների միջին էներգիայի հետ։ Հայտնի ֆիզիկոս (և կրեացիոնիստ) Ջեյմս Քլերք Մաքսվել հաշվարկել, թե գազի քանի ատոմ (կամ մոլեկուլ) կունենա տվյալ արագություն ցանկացած ջերմաստիճանում և զանգվածում: Այս կերպ մենք կարող ենք հաշվարկել, թե քանի ատոմ բավական արագ կանցնեն էկզաբազան՝ տիեզերք փախչելու համար:
Էկզաբազան շատ տաք է։ Բայց նույնիսկ եթե ենթադրենք 1500 Կ (1227°C կամ 2241°F) ջերմաստիճան, որը միջինից բարձր է, հելիումի ատոմների ամենատարածված արագությունը վայրկյանում ընդամենը 2,5 կիլոմետր է (5625 մ/ժ), կամ քառորդից պակաս: արտահոսքի տոկոսադրույքը. Միայն մի քանի ատոմներ են շարժվում ավելի արագ, քան միջին արագությունը, և այնուամենայնիվ, հելիումի քանակը, որը հոսում է արտաքին տարածություն, մոտավորապես մոտավորապես է. 1/40 քանակությամբ հելիումոր մտնում է մթնոլորտ։ Փախուստի այլ մեխանիզմները նույնպես չեն կարողանում հաշվի առնել օդում հելիումի փոքր քանակությունը, որը կազմում է մոտ 1/2000 այն, ինչ օդը պետք է պարունակի միլիարդավոր տարիներ անց:
Սա չլուծված խնդիր է մթնոլորտային ֆիզիկոսի համար, ով հավատում է երկրագնդի պատմության երկար դարերին, Կ.Գ. Ուոքերը, ով ասաց հետևյալը. «Ինչ վերաբերում է մթնոլորտում հելիումի մակարդակին, ապա այստեղ մենք խնդիր ունենք».. Մեկ այլ մասնագետ՝ Դ.Վ. Չեմբերլենը նաև ասաց, որ այս խնդիրը վերաբերում է հելիումի կուտակմանը «...ինքնուրույն չի անցնի և կմնա չլուծված»..
Էվոլյուցիոն հասարակությունը հուսահատորեն փորձում է այլ բացատրություններ գտնել հելիումի այս պակասի համար, բայց դրանցից ոչ մեկը հարմար չէ: Խնդրի պարզ լուծումը կարելի է գտնել, եթե ընդունենք, որ Երկիրը այնքան էլ հին չէ, որքան կարծում են էվոլյուցիոնիստները։ Ստեղծագործող, գիտնական Լարի Վարդիման, ով ուսումնասիրել է մթնոլորտը, ավելի խորը ուսումնասիրել է այս հարցը և գրել այս հարցի վերաբերյալ ավելի մանրամասն ուսումնասիրություն։
Հելիումը ժայռերի մեջ
Ինչպես արդեն ասացինք, երկրի վրա հելիումի մեծ մասը գոյանում է ապարների ռադիոակտիվ քայքայման արդյունքում։ Հելիումի գազի փոքր ատոմները ժայռերից դուրս են հոսում մթնոլորտ՝ առանց խնդիրների։
Մենք նաև վերևում ասացինք, որ հելիումի մթնոլորտ մտնելու արագությունը ֆիքսված է։ Բայց մենք կարող ենք նաև չափել ժայռերից հելիումի արտահոսքի արագությունը: Այս պրոցեսն ավելի արագ է տեղի ունենում ավելի տաք ժայռերի մեջ, և որքան խորանում եք երկրի ընդերքը, այնքան ժայռերը տաքանում են:
Ստեղծագործության ֆիզիկոս Ռոբերտ Ջենտրին ուսումնասիրել է խորը նստած գրանիտը որպես ատոմակայաններից վտանգավոր ռադիոակտիվ թափոնների անվտանգ պահպանման հնարավոր միջոց: Անվտանգ պահեստավորումը պահանջում է, որ տարրերը շատ արագ չանցնեն ժայռի միջով:
Գրանիտը պարունակում է հանքային բյուրեղներ, որոնք կոչվում են ցիրկոններ(ցիրկոնիումի սիլիկատ, ZrSiO 4), որոնք հաճախ պարունակում են ռադիոակտիվ տարրեր։ Սա նշանակում է, որ նրանք պետք է ձևավորեն հելիում, որը պետք է հոսի մթնոլորտ։
Սակայն Ջենտրին պարզեց, որ նույնիսկ խորը նստած տաք ցիրկոնները (197°C կամ 387°F) պարունակում են չափազանց շատ հելիում-այսինքն, եթե միլիարդավոր տարիներ ունեին դուրս հոսելու։
Այնուամենայնիվ, եթե իրականում ընդամենը մի քանի հազար տարի էր, որ այս հելիումը մտավ մթնոլորտ, ապա զարմանալի չէ, որ այդքան հելիում մնաց այնտեղ։
[Նորություններ 2002 թվականի հոկտեմբերի համար. տե՛ս հոդվածում արագացված միջուկային քայքայման տվյալները Միջուկային քայքայումը. վկայություն աշխարհի երիտասարդության մասին գրված է կրեացիոնիստ միջուկային ֆիզիկոսի կողմից Դոկտոր Ռասել Համֆրիս .]
Եզրակացություն
Օդում և ժայռերում հելիումի քանակությունը լիովին անհամապատասխան է այն մտքին, որ մեր երկիրը միլիարդավոր տարեկան է, ինչպես պնդում են էվոլյուցիոնիստները և առաջադեմ կրեացիոնիստները: Հելիումի այս քանակությունը ավելի շուտ փոքր տարիքի գիտական ապացույցը, որը հստակ և հստակ նշված է Ծննդոց գրքում.
Հելիումն իսկապես ազնիվ գազ է։ Նրան դեռ չի հաջողվել ստիպել մտնել ինչ-որ արձագանքների մեջ։ Հելիումի մոլեկուլը միատոմ է։ Թեթևությամբ այս գազը զիջում է միայն ջրածնին, օդը 7,25 անգամ ծանր է հելիումից։ Հելիումը գրեթե չի լուծվում ջրի և այլ հեղուկների մեջ։ Եվ նույն կերպ հեղուկ հելիումի մեջ ոչ մի նյութ նկատելիորեն չի լուծվում։
Պինդ հելիում հնարավոր չէ ստանալ ցանկացած ջերմաստիճանում, եթե ճնշումը չբարձրացվի:
Այս տարրի հայտնաբերման, հետազոտության և կիրառման պատմության մեջ կան բազմաթիվ ականավոր ֆիզիկոսների և քիմիկոսների անուններ տարբեր երկրներից։ Հետաքրքրվեցին հելիումով, աշխատեցին հելիումով՝ Յանսեն (Ֆրանսիա), Լոկյեր, Ռամսեյ, Քրուկս, Ռադերֆորդ (Անգլիա), Պալմիերի (Իտալիա), Կեսոմ, Կամերլինգ-Օննես (Հոլանդիա), Ֆեյնման, Օնսագեր (ԱՄՆ), Կապիցա, Կիկոյն։ , Լանդաու (Խորհրդային Միություն) և շատ այլ ականավոր գիտնականներ։
Հելիումի ատոմի արտաքին տեսքի յուրահատկությունը որոշվում է նրանում երկու զարմանալի բնական կառուցվածքների համադրությամբ՝ կոմպակտության և ուժի առումով բացարձակ չեմպիոններ։ Հելիումի միջուկում՝ հելիում-4, երկու ներմիջուկային թաղանթները հագեցած են՝ և՛ պրոտոն, և՛ նեյտրոն: Այս միջուկը շրջանակող էլեկտրոնային երկտողը նույնպես հագեցած է: Այս նմուշներում - հելիումի հատկությունները հասկանալու բանալին: Այստեղից էլ նրա ֆենոմենալ քիմիական իներտությունը և ատոմի ռեկորդային փոքր չափերը:
Հելիումի ատոմի՝ ալֆա մասնիկների միջուկի դերը միջուկային ֆիզիկայի ձևավորման և զարգացման պատմության մեջ հսկայական է։ Եթե հիշում եք, հենց ալֆա մասնիկների ցրման ուսումնասիրությունն էր, որ Ռադերֆորդին հանգեցրեց ատոմային միջուկի հայտնաբերմանը: Երբ ազոտը ռմբակոծվեց ալֆա մասնիկներով, առաջին անգամ իրականացվեց տարրերի փոխակերպումը, ինչի մասին ալքիմիկոսների շատ սերունդներ երազել են դարեր շարունակ: Ճիշտ է, այս ռեակցիայի ժամանակ ոչ թե սնդիկը վերածվեց ոսկու, այլ ազոտը՝ թթվածնի, բայց դա գրեթե նույնքան դժվար է անել։ Նույն ալֆա մասնիկները ներգրավված են եղել նեյտրոնի հայտնաբերման և առաջին արհեստական իզոտոպի արտադրության մեջ։ Հետագայում ալֆա մասնիկների միջոցով սինթեզվել են կուրիումը, բերկելիումը, կալիֆորնիումը, մենդելևիումը։
Մենք թվարկել ենք այս փաստերը միայն մեկ նպատակով՝ ցույց տալու, որ #2 տարրը շատ անսովոր տարր է:
երկրային հելիում
Հելիումը անսովոր տարր է, և նրա պատմությունը անսովոր է. Այն հայտնաբերվել է Արեգակի մթնոլորտում 13 տարի շուտ, քան Երկրի վրա։ Ավելի ճիշտ, արեգակնային պսակի սպեկտրում հայտնաբերվեց վառ դեղին D գիծ, և այն, ինչ թաքնված էր դրա հետևում, հուսալիորեն հայտնի դարձավ միայն ռադիոակտիվ տարրեր պարունակող երկրային հանքանյութերից հելիումի արդյունահանումից հետո:
Երկրակեղևում կա 29 իզոտոպ, որոնց ռադիոակտիվ քայքայման ժամանակ առաջանում են ալֆա մասնիկներ՝ հելիումի ատոմների բարձր ակտիվ, բարձր էներգիայի միջուկներ։
Հիմնականում երկրային հելիումը ձևավորվում է ուրանի-238, ուրան-235, թորիումի և դրանց անկայուն քայքայման արտադրանքի ռադիոակտիվ քայքայման ժամանակ: Սամարիում-147-ի և բիսմութի դանդաղ քայքայման արդյունքում հելիումի անհամեմատ ավելի փոքր քանակություններ են արտադրվում: Այս բոլոր տարրերը առաջացնում են միայն հելիումի ծանր իզոտոպը՝ 4 Նա, որի ատոմները կարելի է համարել որպես ալֆա մասնիկների մնացորդներ՝ թաղված երկու զույգ էլեկտրոնների թաղանթում՝ էլեկտրոնային երկտողում։ Վաղ երկրաբանական ժամանակաշրջաններում հավանաբար եղել են նաև այլ բնական ռադիոակտիվ տարրեր, որոնք արդեն անհետացել էին Երկրի երեսից՝ հագեցնելով մոլորակը հելիումով: Դրանցից մեկը այժմ արհեստականորեն վերստեղծված նեպտունային շարքն էր:
Քարի կամ հանքանյութի մեջ փակված հելիումի քանակով կարելի է դատել դրանց բացարձակ տարիքը։ Այս չափումները հիմնված են ռադիոակտիվ քայքայման օրենքների վրա. օրինակ, ուրանի 238-ի կեսը 4,52 միլիարդ տարում վերածվում է. հելիումև կապար:
Երկրակեղևում հելիումը դանդաղ է կուտակվում։ Մեկ տոննա գրանիտը, որը պարունակում է 2 գ ուրան և 10 գ թորիում, միլիոն տարվա ընթացքում արտադրում է ընդամենը 0,09 մգ հելիում` կես խորանարդ սանտիմետր: Ուրանով և թորիումով հարուստ շատ քիչ հանքանյութերում հելիումի պարունակությունը բավականին բարձր է՝ մի քանի խորանարդ սանտիմետր հելիում մեկ գրամի դիմաց: Այնուամենայնիվ, այս հանքանյութերի տեսակարար կշիռը բնական հելիումի արտադրության մեջ մոտ է զրոյի, քանի որ դրանք շատ հազվադեպ են:
Հելիումը և Արևը հայտնաբերել են ֆրանսիացի Ջ. Յանսենը, ով իր դիտարկումներն արել է Հնդկաստանում 1868 թվականի օգոստոսի 10-ին, իսկ անգլիացի Ջ. Լոկյերը՝ նույն թվականի հոկտեմբերի 20-ին։ Երկու գիտնականների նամակները Փարիզ են հասել նույն օրը և ընթերցվել հոկտեմբերի 26-ին Փարիզի գիտությունների ակադեմիայի նիստում՝ մի քանի րոպե ընդմիջումով։ Ակադեմիկոսները, զարմացած նման տարօրինակ զուգադիպությամբ, որոշեցին այս իրադարձության պատվին նոկաուտի ենթարկել ոսկե մեդալը:
Ալֆա-ակտիվ իզոտոպներ պարունակող բնական միացությունները միայն հիմնական աղբյուրն են, բայց ոչ հումքը հելիումի արդյունաբերական արտադրության համար: Ճիշտ է, խիտ կառուցվածքով որոշ օգտակար հանածոներ՝ բնիկ մետաղներ, մագնիտիտ, նռնաքար, ապատիտ, ցիրկոն և այլն, ամուր պահում են իրենց մեջ պարփակված հելիումը։ Այնուամենայնիվ, օգտակար հանածոների մեծ մասը ի վերջո ենթարկվում է եղանակային ազդեցության, վերաբյուրեղացման և այլնի գործընթացներին, և հելիումը հեռանում է դրանցից:
Բյուրեղային կառուցվածքներից արձակված հելիումի փուչիկները ճամփորդություն են սկսել երկրակեղևով: Դրանց շատ փոքր մասը լուծվում է ստորերկրյա ջրերում։ Հելիումի քիչ թե շատ խտացված լուծույթների առաջացումը պահանջում է հատուկ պայմաններ, առաջին հերթին բարձր ճնշումներ։ Քոչվոր հելիումի մեկ այլ մասը մթնոլորտ է ներթափանցում հանքանյութերի ծակոտիների և ճեղքերի միջոցով։ Մնացած գազի մոլեկուլները ընկնում են ստորգետնյա թակարդների մեջ, որտեղ դրանք կուտակվում են տասնյակ, հարյուրավոր միլիոնավոր տարիներ: Թակարդները չամրացված ապարների շերտեր են, որոնց բացերը լցված են գազով։ Նման գազի ջրամբարների հունը սովորաբար ջուրն ու նավթն է, իսկ վերեւից դրանք արգելափակված են խիտ ապարների գազամուղ շերտերով։
Քանի որ այլ գազեր նույնպես թափառում են երկրակեղևում (հիմնականում մեթան, ազոտ, ածխաթթու գազ), և ավելին, շատ ավելի մեծ քանակությամբ, զուտ հելիումի կուտակումներ չկան։ Հելիումը բնական գազերում առկա է որպես չնչին աղտոտվածություն: Դրա բովանդակությունը չի գերազանցում հազարերորդականը, հարյուրերորդը, հազվադեպ՝ տոկոսի տասներորդը։ Մեթան-ազոտի հանքավայրերում հելիումի մեծ (1,5-10%) պարունակությունը չափազանց հազվադեպ երեւույթ է։
Պարզվեց, որ բնական գազերը հելիումի արդյունաբերական արտադրության համար գործնականում հումքի միակ աղբյուրն են։ Այլ գազերից բաժանվելու համար օգտագործվում է հելիումի բացառիկ անկայունությունը, որը կապված է նրա ցածր հեղուկացման ջերմաստիճանի հետ: Այն բանից հետո, երբ բնական գազի մյուս բաղադրիչները խտանում են խորը սառեցման միջոցով, հելիում գազը դուրս է մղվում: Այնուհետև այն մաքրվում է կեղտից։ Գործարանային հելիումի մաքրությունը հասնում է 99,995%-ի։
Երկրի վրա հելիումի պաշարները գնահատվում են 54014 մ 3; Դատելով հաշվարկներից՝ այն գոյացել է երկրակեղևում ավելի քան 2 միլիարդ տարի տասն անգամ ավելի: Տեսության և պրակտիկայի միջև այս անհամապատասխանությունը հասկանալի է: Հելիումը թեթև գազ է և, ինչպես ջրածինը (թեև ավելի դանդաղ), այն մթնոլորտից դուրս է գալիս արտաքին տարածություն։ Հավանաբար, Երկրի գոյության ընթացքում մեր մոլորակի հելիումը բազմիցս թարմացվել է. հինը փախել է տիեզերք, իսկ դրա փոխարեն Երկրի կողմից թարմ՝ «արտաշնչված» մթնոլորտ է մտել:
Լիտոսֆերայում առնվազն 200,000 անգամ ավելի շատ հելիում կա, քան մթնոլորտում; նույնիսկ ավելի շատ պոտենցիալ հելիում է պահվում Երկրի «արգանդում»՝ ալֆա-ակտիվ տարրերում: Սակայն այս տարրի ընդհանուր պարունակությունը Երկրում և մթնոլորտում փոքր է։ Հելիումը հազվագյուտ և ցրված գազ է։ 1 կգ ցամաքային նյութի համար կա ընդամենը 0,003 մգ հելիում, իսկ օդում դրա պարունակությունը կազմում է 0,00052 ծավալային տոկոս։ Նման ցածր կոնցենտրացիան դեռ թույլ չի տալիս օդից հելիումի խնայողաբար արդյունահանումը։
Իներտ, բայց շատ անհրաժեշտ հելիում
Անցյալ դարի վերջին անգլիական Punch ամսագիրը հրապարակեց մուլտֆիլմ, որտեղ հելիումը պատկերված էր որպես խորամանկ աչքով անող մարդ՝ Արևի բնակիչ: Նկարի տակ գրված է. «Վերջապես նրանք ինձ բռնեցին Երկրի վրա: Բավական երկար է անցել։ Հետաքրքիր է, որքա՞ն ժամանակ կանցնի, մինչև նրանք հասկանան, թե ինչ անեն ինձ հետ»:
Իրոք, 34 տարի է անցել երկրային հելիումի հայտնաբերումից (այս մասին առաջին զեկույցը հրապարակվել է 1881 թվականին), մինչև այն գործնական կիրառություն գտնի։ Այստեղ որոշակի դեր խաղացին հելիումի սկզբնական ֆիզիկական, տեխնիկական, էլեկտրական և, ավելի քիչ, քիմիական հատկությունները, որոնք պահանջում էին երկար ուսումնասիրություն։ Հիմնական խոչընդոտներն էին թերակղզությունը և թիվ 2 տարրի բարձր արժեքը: Դրա պատճառով հելիումը գործնականում հասանելի չէր:
Գերմանացիներն առաջինն են օգտագործել հելիում։ 1915 թվականին նրանք սկսեցին դրանով լցնել Լոնդոնը ռմբակոծող իրենց օդանավերը։ Շուտով թեթև, բայց ոչ դյուրավառ հելիումը դարձավ ավիացիոն մեքենաների համար անփոխարինելի լցոնիչ: 1930-ականների կեսերից սկսված օդանավերի արդյունաբերության անկումը հանգեցրեց հելիումի արտադրության մի փոքր անկման, բայց միայն կարճ ժամանակով։ Այս գազն ավելի ու ավելի էր գրավում քիմիկոսների, մետալուրգների և մեքենաշինողների ուշադրությունը։
Շատ տեխնոլոգիական գործընթացներ և գործողություններ չեն կարող իրականացվել օդում։ Ստացված նյութի (կամ հումքի) օդային գազերի հետ փոխազդեցությունից խուսափելու համար ստեղծվում են հատուկ պաշտպանիչ միջավայրեր. և չկա ավելի հարմար գազ այդ նպատակների համար, քան հելիումը:
Իներտ, թեթև, շարժական, ջերմության լավ հաղորդիչ, հելիումը իդեալական միջոց է դյուրավառ հեղուկներն ու փոշիները մի տարայից մյուսը տեղափոխելու համար. Հենց այս գործառույթներն են նա կատարում հրթիռների և կառավարվող հրթիռների դեպքում: Հելիումային պաշտպանիչ միջավայրում միջուկային վառելիքի ստացման առանձին փուլեր են տեղի ունենում։ Միջուկային ռեակտորների վառելիքի տարրերը պահվում և տեղափոխվում են հելիումով լցված տարաներում։ Հատուկ արտահոսքի դետեկտորների օգնությամբ, որոնց գործողությունը հիմնված է հելիումի բացառիկ դիֆուզիոն կարողության վրա, նրանք հայտնաբերում են ճնշման կամ վակուումի տակ գտնվող միջուկային ռեակտորներում կամ այլ համակարգերում արտահոսքի նվազագույն հավանականությունը:
Վերջին տարիները նշանավորվել են օդանավերի կառուցման նոր աճով, այժմ ավելի բարձր գիտական և տեխնիկական հիմքերի վրա: Մի շարք երկրներում կառուցվել և կառուցվում են 100-ից 3000 տոննա բեռնատարողությամբ հելիումով լցված օդանավեր, որոնք տնտեսող են, հուսալի և հարմար են մեծածավալ բեռներ տեղափոխելու համար՝ գազատարներ, նավթավերամշակման գործարաններ, էլեկտրահաղորդման աշտարակներ։ 85% հելիումից և 15% ջրածնից լցոնումը հրակայուն է և միայն 7%-ով նվազեցնում է բարձրացումը՝ համեմատած ջրածնի լցման հետ:
Սկսեցին գործել նոր տեսակի բարձր ջերմաստիճան միջուկային ռեակտորներ, որոնցում հելիումը ծառայում է որպես հովացուցիչ նյութ։
Հեղուկ հելիումը լայնորեն օգտագործվում է գիտական հետազոտությունների և ճարտարագիտության մեջ: Չափազանց ցածր ջերմաստիճանները նպաստում են նյութի և դրա կառուցվածքի խորը իմացությանը. ավելի բարձր ջերմաստիճաններում էներգիայի սպեկտրների նուրբ մանրամասները քողարկվում են ատոմների ջերմային շարժումով:
Արդեն գոյություն ունեն հատուկ համաձուլվածքներից պատրաստված գերհաղորդիչ սոլենոիդներ, որոնք հեղուկ հելիումի ջերմաստիճանում ստեղծում են ուժեղ մագնիսական դաշտեր (մինչև 300000 էերստեդներ)՝ աննշան էներգիայի ծախսերով։
Հեղուկ հելիումի ջերմաստիճանում շատ մետաղներ և համաձուլվածքներ դառնում են գերհաղորդիչներ։ Գերհաղորդչային ռելեներ՝ կրիոտրոններն ավելի ու ավելի են օգտագործվում էլեկտրոնային համակարգիչների նախագծման մեջ: Նրանք պարզ են, հուսալի, շատ կոմպակտ: Գերհաղորդիչները, և նրանց հետ միասին հեղուկ հելիումը, կարևոր են դառնում էլեկտրոնիկայի համար: Դրանք ներառված են ինֆրակարմիր ճառագայթման դետեկտորների, մոլեկուլային ուժեղացուցիչների (մազերների), օպտիկական քվանտային գեներատորների (լազերների) և միկրոալիքային հաճախականությունների չափման սարքերի նախագծման մեջ։
Իհարկե, այս օրինակները չեն սպառում հելիումի դերը ժամանակակից տեխնոլոգիաներում։ Բայց եթե չլինեին սահմանափակ բնական ռեսուրսները, ոչ հելիումի ծայրահեղ ցրվածությունը, նա շատ ավելի շատ կիրառումներ կգտնի: Հայտնի է, օրինակ, որ հելիումային միջավայրում պահպանվելիս սննդամթերքը պահպանում է իր սկզբնական համն ու բույրը։ Բայց «հելիում» պահածոները դեռ մնում են «ինքնին բան», քանի որ հելիումը բավարար չէ և այն օգտագործվում է միայն ամենակարևոր ոլորտներում և որտեղ այն անփոխարինելի է։ Հետևաբար, հատկապես վիրավորական է գիտակցել, որ այրվող բնական գազով հելիումի շատ ավելի մեծ քանակություններ անցնում են քիմիական սինթեզի սարքերով, վառարաններով և վառարաններով և մտնում մթնոլորտ, քան հելիում պարունակող աղբյուրներից արդյունահանվողները:
Այժմ հելիումի առանձնացումը ձեռնտու է համարվում միայն այն դեպքերում, երբ դրա պարունակությունը բնական գազում 0,05%-ից ոչ պակաս է։ Նման գազի պաշարները անընդհատ նվազում են, և հնարավոր է, որ դրանք սպառվեն մինչև մեր դարի վերջը։ Այնուամենայնիվ, «հելիումի պակասի» խնդիրը, հավանաբար, մինչ այս պահը կլուծվի՝ մասամբ գազերի տարանջատման նոր, ավելի առաջադեմ մեթոդների ստեղծման, դրանցից ամենաթանկ, թեև աննշան ֆրակցիաների արդյունահանման, մասամբ՝ վերահսկվող ջերմամիջուկային միաձուլման շնորհիվ։ . Հելիումը կլինի «արհեստական արևների» կարևոր, թեև կողմնակի արտադրանքը:
Հելիումի իզոտոպները Բնության մեջ կան հելիումի երկու կայուն իզոտոպներ՝ հելիում-3 և հելիում-4: Թեթև իզոտոպը Երկրի վրա միլիոն անգամ ավելի քիչ տարածված է, քան ծանր իզոտոպը: Այն մեր մոլորակի վրա գոյություն ունեցող կայուն իզոտոպներից ամենահազվագյուտն է: Արհեստական ճանապարհով ձեռք են բերվել հելիումի ևս երեք իզոտոպներ։ Դրանք բոլորն էլ ռադիոակտիվ են։ Հելիում-5-ի կիսամյակը 2,440-21 վայրկյան է, հելիում-6-ը՝ 0,83 վայրկյան, հելիում-8-ը՝ 0,18 վայրկյան։ Ամենածանր իզոտոպը, որը հետաքրքիր է նրանով, որ իր միջուկներում մեկ պրոտոնի հաշվով երեք նեյտրոն կա, առաջին անգամ ստացվել է Դուբնայում 60-ականներին: Հելիում-10 ձեռք բերելու փորձերը մինչ այժմ անհաջող են եղել:
ՎԵՐՋԻՆ պինդ ԳԱԶ. Հելիումը բոլոր գազերից վերջինն էր, որը վերածվեց հեղուկ և պինդ վիճակի: Հելիումի հեղուկացման և պնդացման հատուկ դժվարությունները բացատրվում են նրա ատոմի կառուցվածքով և ֆիզիկական հատկությունների որոշ առանձնահատկություններով։ Մասնավորապես, հելիումը, ինչպես ջրածինը, -250°C-ից բարձր ջերմաստիճանում, ընդարձակվելով, չի սառչում, այլ տաքանում է։ Մյուս կողմից, հելիումի կրիտիկական ջերմաստիճանը չափազանց ցածր է։ Այդ պատճառով հեղուկ հելիումն առաջին անգամ ստացվել է միայն 1908 թվականին, իսկ պինդը՝ 1926 թվականին։
ՀԵԼԻՈՒՄ ՕԴ. Օդը, որտեղ ազոտի ամբողջ կամ մեծ մասը փոխարինվել է հելիումով, այսօր այլևս նորություն չէ: Այն լայնորեն կիրառվում է ցամաքում, ստորգետնյա և ստորջրյա:
Հելիումի օդը երեք անգամ ավելի թեթև է և շատ ավելի շարժուն, քան սովորական օդը։ Այն ավելի ակտիվ է վարվում թոքերում՝ արագ ներս է բերում թթվածին և արագ էվակուացնում ածխաթթու գազը: Այդ պատճառով շնչառական խանգարումներով և որոշ վիրահատություններով հիվանդներին տրվում է հելիումի օդ։ Ազատում է շնչահեղձությունը, բուժում է բրոնխիալ ասթման և կոկորդի հիվանդությունները։
Հելիումի օդ շնչելը գործնականում վերացնում է ազոտային էմբոլիան (կեյսոնի հիվանդություն), որին ենթակա են սուզորդներն ու այլ մասնագիտությունների մասնագետները, որոնց աշխատանքը տեղի է ունենում բարձր ճնշման պայմաններում, բարձր ճնշումից նորմալին անցնելու ժամանակ։ Այս հիվանդության պատճառը բավականին նշանակալի է, հատկապես արյան բարձր ճնշման, արյան մեջ ազոտի լուծելիության դեպքում։ Ճնշման նվազման հետ այն արտազատվում է գազի պղպջակների տեսքով, որոնք կարող են խցանել արյունատար անոթները, վնասել նյարդային հանգույցները... Ի տարբերություն ազոտի՝ հելիումը գործնականում չի լուծվում մարմնի հեղուկներում, ուստի այն չի կարող առաջացնել դեկոպրեսիոն հիվանդություն: Բացի այդ, հելիումի օդը վերացնում է «ազոտային անզգայացման» առաջացումը, արտաքուստ նման է ալկոհոլային թունավորմանը:
Վաղ թե ուշ մարդկությունը պետք է սովորի, թե ինչպես երկար ապրել և աշխատել ծովի հատակում, որպեսզի լրջորեն օգտվի դարակի հանքային և պարենային պաշարներից։ Իսկ մեծ խորություններում, ինչպես ցույց են տվել խորհրդային, ֆրանսիացի և ամերիկացի հետազոտողների փորձերը, հելիումի օդը դեռևս անփոխարինելի է։ Կենսաբաններն ապացուցել են, որ հելիումի օդով երկարատև շնչառությունը բացասական փոփոխություններ չի առաջացնում մարդու մարմնում և չի սպառնում գենետիկական ապարատի փոփոխություններին. հելիումի մթնոլորտը չի ազդում բջիջների զարգացման և մուտացիաների հաճախականության վրա: Կան աշխատություններ, որոնց հեղինակները համարում են հելիումի օդը որպես օպտիմալ օդային միջավայր տիեզերանավերի համար, որոնք երկար թռիչքներ են կատարում դեպի Տիեզերք:
ՄԵՐ ՀԵԼԻՈՒՄԸ. 1980-ին գիտնականների և մասնագետների մի խումբ Ի. Լ. Անդրեևի գլխավորությամբ արժանացել է պետական մրցանակի՝ համեմատաբար վատ հելիում պարունակող գազերից հելիումի խտանյութեր ստանալու տեխնոլոգիայի ստեղծման և ներդրման համար: Օրենբուրգի գազի հանքավայրում կառուցվել է հելիումի գործարան, որը դարձել է «արևային գազի» մեր հիմնական մատակարարը տարբեր ոլորտների կարիքների համար։
Հելիումի ՀԱՄԱԼԻՐ. 1978 թվականին, ամինաթթվի գլիկինի մոլեկուլում ներառված տրիտիումի միջուկների քայքայման ժամանակ, ակադեմիկոս Վ.Ա. նկատել. Սա մինչ այժմ հելիումի քիմիայի ամենամեծ ձեռքբերումն է:
Հելիում(լատ. Հելիում), խորհրդանիշ He, պարբերական համակարգի VIII խմբի քիմիական տարր, վերաբերում է իներտ գազերին. սերիական համար 2, ատոմային զանգված 4,0026; անգույն և անհոտ գազ. Բնական հելիումը բաղկացած է 2 կայուն իզոտոպներից՝ 3 He և 4 He (4 He-ի պարունակությունը կտրուկ գերակշռում է)։
Պատմության տեղեկանք.Հելիումը առաջին անգամ հայտնաբերվել է ոչ թե Երկրի վրա, որտեղ այն քիչ է, այլ Արեգակի մթնոլորտում։ 1868 թվականին ֆրանսիացի J. Jansen-ը և անգլիացի J. N. Lockyer-ը սպեկտրոսկոպիկ կերպով ուսումնասիրեցին արեգակնային ցայտունների բաղադրությունը։ Նրանց ստացած պատկերները պարունակում էին վառ դեղին գիծ (այսպես կոչված D3 գիծ), որը չէր կարող վերագրվել այն ժամանակ հայտնի տարրերից որևէ մեկին։ 1871 թվականին Լոկյերը բացատրեց իր ծագումը Արեգակի վրա նոր տարրի առկայությամբ, որը նրանք անվանեցին հելիում (հունարեն հելիոսից՝ Արև): Երկրի վրա հելիումն առաջին անգամ մեկուսացվել է 1895 թվականին անգլիացի Վ. Ռեմզեյի կողմից ռադիոակտիվ միներալ կլեվիտից: Նույն գիծը հայտնվեց կլեվեյտի տաքացման ժամանակ արձակված գազի սպեկտրում։
Հելիումի բաշխումը բնության մեջ.Երկրի վրա հելիում քիչ կա. 1 մ 3 օդը պարունակում է ընդամենը 5,24 սմ 3 հելիում, իսկ ցամաքային նյութի յուրաքանչյուր կիլոգրամը պարունակում է 0,003 մգ հելիում: Տիեզերքում տարածվածության առումով հելիումը ջրածնից հետո երկրորդն է. հելիումը կազմում է տիեզերական զանգվածի մոտ 23%-ը:
Երկրի վրա հելիումը (ավելի ճիշտ՝ 4 He իզոտոպը) անընդհատ ձևավորվում է ուրանի, թորիումի և այլ ռադիոակտիվ տարրերի քայքայման ժամանակ (ընդհանուր առմամբ, երկրի ընդերքը պարունակում է մոտ 29 ռադիոակտիվ իզոտոպներ, որոնք արտադրում են 4 He):
Ամբողջ հելիումի մոտավորապես կեսը կենտրոնացած է երկրակեղևում, հիմնականում նրա գրանիտե թաղանթում, որտեղ կուտակվել են ռադիոակտիվ տարրերի հիմնական պաշարները։ Երկրակեղևում հելիումի պարունակությունը փոքր է՝ 3·10 -7% կշռով։ Հելիումը կուտակվում է աղիքների և յուղի ազատ գազային կուտակումներում. նման հանքավայրերը հասնում են արդյունաբերական մասշտաբի։ Հելիումի առավելագույն կոնցենտրացիաները (10-13%) հայտնաբերվել են ազատ գազի կուտակումներում և ուրանի հանքերից ստացված գազերում և (20-25%) ստորերկրյա ջրերից ինքնաբուխ արտանետվող գազերում: Որքան մեծ է գազատար նստվածքային ապարների տարիքը և որքան բարձր է դրանցում ռադիոակտիվ տարրերի պարունակությունը, այնքան ավելի շատ է հելիումը բնական գազերի բաղադրության մեջ։ Հրաբխային գազերը սովորաբար բնութագրվում են հելիումի ցածր պարունակությամբ:
Արդյունաբերական մասշտաբով հելիումի արտադրությունն իրականացվում է ինչպես ածխաջրածնի, այնպես էլ ազոտի բաղադրության բնական և նավթային գազերից: Ըստ հումքի որակի՝ հելիումի հանքավայրերը բաժանվում են՝ հարուստ (He պարունակությունը > 0,5% ծավալով); սովորական (0,10-0,50) և աղքատ (<0,10). В СССР природный Гелий содержится во многих нефтегазовых месторождениях. Значительные его концентрации известны в некоторых месторождениях природного газа Канады, США (штаты Канзас, Техас, Нью-Мексико, Юта).
Հելիումի իզոտոպներ, ատոմ և մոլեկուլ:Ցանկացած ծագման բնական հելիումում (մթնոլորտային, բնական գազերից, ռադիոակտիվ միներալներից, երկնաքարից և այլն) գերակշռում է 4 He իզոտոպը։ 3 He-ի պարունակությունը սովորաբար ցածր է (կախված Հելիումի աղբյուրից՝ այն տատանվում է 1,3·10 -4-ից մինչև 2,10 -8%) և միայն երկնաքարերից մեկուսացված Հելիումում այն հասնում է 17-31,5%-ի։ Ռադիոակտիվ քայքայման ժամանակ 4 He-ի առաջացման արագությունը ցածր է. 1 տոննա գրանիտում, որը պարունակում է, օրինակ, 3 գ ուրան և 15 գ թորիում, 7,9 միլիոն տարում առաջանում է 1 մգ հելիում; սակայն, քանի որ այս գործընթացը շարունակվում է, Երկրի գոյության ընթացքում այն պետք է ապահովեր հելիումի պարունակությունը մթնոլորտում, լիթոսֆերայում և հիդրոսֆերայում, ինչը զգալիորեն գերազանցում է ներկայիսը (այն կազմում է մոտ 5 10 14 մ 3): Հելիումի նման պակասը բացատրվում է մթնոլորտից դրա մշտական ցնդմամբ։ Հելիումի թեթև ատոմները, ընկնելով մթնոլորտի վերին շերտերը, աստիճանաբար ձեռք են բերում երկրորդ տիեզերականից բարձր արագություն և դրանով իսկ հնարավորություն են ստանում հաղթահարել երկրի ձգողականության ուժերը։ Հելիումի միաժամանակ առաջացումը և ցնդումը հանգեցնում են նրան, որ նրա կոնցենտրացիան մթնոլորտում գործնականում հաստատուն է:
3 He իզոտոպը, մասնավորապես, ձևավորվում է մթնոլորտում ծանր ջրածնի իզոտոպի՝ տրիտիումի (T) β-քայքայման ժամանակ, որն, իր հերթին, առաջանում է տիեզերական ճառագայթման նեյտրոնների օդի ազոտի հետ փոխազդեցության ժամանակ.
14 7 N + 3 0 n → 12 6 C + 3 1 T.
4 He ատոմի (կազմված 2 պրոտոնից և 2 նեյտրոնից) միջուկները, որոնք կոչվում են ալֆա մասնիկներ կամ հելիոններ, ամենակայունն են բարդ միջուկներից։ Նուկլոնների (պրոտոններ և նեյտրոններ) կապող էներգիան 4 He-ում ունի առավելագույն արժեք՝ համեմատած այլ տարրերի միջուկների հետ (28,2937 ՄէՎ); հետեւաբար ջրածնի միջուկներից (պրոտոններ) 1 H 4 He միջուկների առաջացումը ուղեկցվում է հսկայական քանակությամբ էներգիայի արտազատմամբ։ Ենթադրվում է, որ այս միջուկային ռեակցիան.
4 1 H = 4 He + 2β + + 2n
[4 He-ի հետ միաժամանակ ձևավորվում են երկու պոզիտրոն (β +) և երկու նեյտրինո (ν)] Արեգակի և նրան նման այլ աստղերի էներգիայի հիմնական աղբյուրն է։ Այս գործընթացի շնորհիվ Տիեզերքում Հելիումի շատ զգալի պաշարներ են կուտակվում։
Հելիումի ֆիզիկական հատկությունները.Նորմալ պայմաններում հելիումը միատոմ գազ է, անգույն և առանց հոտի։ Խտությունը 0,17846 գ/լ, t բալա -268,93°С, t pl -272,2°С։ Ջերմահաղորդականություն (0°C-ում) 143.8 10 -3 Վտ / (սմ Կ) . Հելիումի ատոմի շառավիղը, որը որոշվում է տարբեր մեթոդներով, տատանվում է 0,85-ից 1,33 Å: Մոտ 8,8 մլ հելիում լուծվում է 1 լիտր ջրի մեջ 20°C ջերմաստիճանում։ Հելիումի առաջնային իոնացման էներգիան ավելի մեծ է, քան ցանկացած այլ տարրի էներգիան՝ 39,38 10 -13 Ջ (24,58 էՎ); Հելիումը էլեկտրոնային կապ չունի: Հեղուկ հելիումը, որը բաղկացած է միայն 4 He-ից, ցուցադրում է մի շարք եզակի հատկություններ:
Հելիումի քիմիական հատկությունները.Մինչ այժմ հելիումի կայուն քիմիական միացություններ ստանալու փորձերն ավարտվել են անհաջողությամբ։
Հելիում ստանալը.Արդյունաբերության մեջ հելիումը ստացվում է հելիում պարունակող բնական գազերից (ներկայումս հիմնականում շահագործվում են > 0,1% հելիում պարունակող հանքավայրերը)։ Հելիումը այլ գազերից առանձնացվում է խորը սառեցման միջոցով՝ օգտագործելով այն փաստը, որ այն ավելի դժվար է հեղուկացնել, քան մնացած բոլոր գազերը։
Հելիումի կիրառություն.Իր իներտության շնորհիվ հելիումը լայնորեն օգտագործվում է ակտիվ մետաղների հալման, կտրման և եռակցման ժամանակ պաշտպանիչ մթնոլորտ ստեղծելու համար։ Հելիումը ավելի քիչ էլեկտրահաղորդիչ է, քան մեկ այլ իներտ գազ՝ արգոն, և, հետևաբար, հելիումի մթնոլորտում էլեկտրական աղեղը տալիս է ավելի բարձր ջերմաստիճան, ինչը զգալիորեն մեծացնում է աղեղային եռակցման արագությունը: Իր ցածր խտության պատճառով՝ զուգորդված չայրվողության հետ, հելիումն օգտագործվում է ստրատոստատները լցնելու համար։ Հելիումի բարձր ջերմահաղորդականությունը, քիմիական իներտությունը և նեյտրոնների հետ միջուկային ռեակցիայի մեջ մտնելու չափազանց ցածր ունակությունը հնարավորություն են տալիս օգտագործել հելիումը միջուկային ռեակտորները սառեցնելու համար։ Հեղուկ հելիումը Երկրի ամենացուրտ հեղուկն է և ծառայում է որպես սառնագենտ տարբեր գիտական հետազոտություններում: Դրանց բացարձակ տարիքի որոշման մեթոդներից մեկը հիմնված է ռադիոակտիվ միներալներում հելիումի պարունակության որոշման վրա։ Շնորհիվ այն բանի, որ հելիումը շատ վատ է լուծվում արյան մեջ, այն օգտագործվում է որպես սուզորդների կողմից շնչելու համար մատակարարվող արհեստական օդի անբաժանելի մաս (ազոտը հելիումով փոխարինելը կանխում է դեկոմպրեսիոն հիվանդության առաջացումը): Ուսումնասիրվում են նաեւ տիեզերանավի խցիկի մթնոլորտում հելիումի օգտագործման հնարավորությունները։
Հելիումի հեղուկ.Հելիումի ատոմների համեմատաբար թույլ փոխազդեցությունը հանգեցնում է նրան, որ այն մնում է գազային մինչև ցանկացած այլ գազից ցածր ջերմաստիճան: Առավելագույն ջերմաստիճանը, որից ցածր այն կարող է հեղուկացվել (նրա կրիտիկական ջերմաստիճանը T k) 5,20 Կ է: Հեղուկ հելիումը միակ չսառչող հեղուկն է. նորմալ ճնշման դեպքում հելիումը մնում է հեղուկ կամայական ցածր ջերմաստիճաններում և ամրանում է միայն 25 MN-ից ավելի ճնշման դեպքում: / մ 2 (25 ժամը):