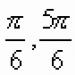··· Орловский выпуск ···
Г.А.БЕЛУХА
,
школа № 4, г. Ливны, Орловская обл.
Работа газа в термодинамике
При изучении работы газа в термодинамике учащиеся неизбежно сталкиваются с трудностями, обусловленными слабыми навыками вычисления работы переменной силы. Поэтому к восприятию этой темы необходимо готовиться, начиная уже с изучения работы в механике и решая с этой целью задачи на работу переменной силы путём суммирования элементарных работ на всём пути с помощью интегрирования.
Например, при вычислениях работы силы Архимеда, силы упругости, силы всемирного тяготения и т.п. надо учиться суммировать элементарные величины с помощью простейших дифференциальных соотношений типа dA = Fds . Опыт показывает, что старшеклассники легко справляются с этой задачей, – дугу траектории, на которой сила увеличивается или уменьшается, нужно разбить на такие промежутки ds , на которых силу F можно считать постоянной величиной, а затем, зная зависимость F = F (s ), подставить её под знак интеграла. Например,
Работа этих сил вычисляется с помощью
простейшего табличного интеграла 
Такая методика облегчает адаптацию будущих студентов к восприятию курса физики в вузе и устраняет методические сложности, связанные с умением находить работу переменной силы в термодинамике и др.
После того как учащиеся усвоили, что такое внутренняя энергия и как найти её изменение, целесообразно дать обобщающую схему:


Усвоив, что работа – это один из способов изменения внутренней энергии, десятиклассники легко рассчитывают работу газа в изобарном процессе. На данном этапе необходимо подчеркнуть, что сила давления газа на всём пути не меняется, и по третьему закону Ньютона |F 2 | = |F 1 |, знак работы находим из формулы A = Fs cos. Если = 0°, то A > 0, если = 180°, то A < 0. На графике зависимости р (V ) работа численно равна площади под графиком.
Пусть газ расширяется или сжимается изотермически. Например, газ сжимается под поршнем, давление изменяется, и в любой момент времени
При бесконечно малом перемещении
поршня на dl
мы получим бесконечно малое
изменение объёма dV
, а давление р
можно
считать постоянным. По аналогии с нахождением
механической работы переменной силы, составим
простейшее дифференциальное соотношение dA
= pdV
,
тогда и, зная
зависимость р
(V
), запишем  Это табличный интеграл
типа
Это табличный интеграл
типа  Работа
газа в этом случае отрицательна, т.к. = 180°:
Работа
газа в этом случае отрицательна, т.к. = 180°:
![]()
т.к. V 2 < V 1 .
Полученную формулу можно переписать,
используя соотношение 
Для закрепления решим задачи.
1. Газ переходит из состояния 1 (объём V 1 , давление р 1) в состояние 2 (объём V 2 , давление р 2) в процессе, при котором его давление зависит от объёма линейно. Найдите работу газа.
Решение. Построим примерный график зависимости p от V . Работа равна площади под графиком, т.е. площади трапеции:
![]()

2. Один моль воздуха, находящийся при нормальных условиях, расширяется от объёма V 0 до 2V 0 двумя способами – изотермически и изобарно. Сравните работу, совершённую воздухом в этих процессах.
Решение
При изобарном процессе A p = р 0 V , но р 0 = RT 0 /V 0 , V = V 0 , следовательно, A p = RT 0 .
При изотермическом процессе:
![]()
Сравним: ![]()
Изучив первый закон термодинамики и его применение к изопроцессам и закрепив решением задач тему о работе в термодинамике, учащиеся подготовились к восприятию наиболее сложной части термодинамики «Работа циклов и КПД тепловых машин». Этот материал я излагаю в следующей последовательности: работа циклов – цикл Карно – КПД тепловых машин – круговые процессы.
 Круговым
процессом (или циклом) называется
термодинамический процесс, в результате
которого тело, пройдя ряд состояний,
возвращается в исходное состояние. Если все
процессы в цикле равновесные, то цикл считается
равновесным. Его можно изобразить графически в
виде замкнутой кривой.
Круговым
процессом (или циклом) называется
термодинамический процесс, в результате
которого тело, пройдя ряд состояний,
возвращается в исходное состояние. Если все
процессы в цикле равновесные, то цикл считается
равновесным. Его можно изобразить графически в
виде замкнутой кривой.
На рисунке показан график зависимости давления p от объёма V (диаграмма p , V ) для некоторого цикла 1–2–3–4–1. На участках 1–2 и 4–1 газ расширяется и совершает положительную работу А 1 , численно равную площади фигуры V 1 412V 2 . На участке 2–3–4 газ сжимается и совершает работу А 2 , модуль которой равен площади фигуры V 2 234V 1 . Полная работа газ за цикл А = А 1 + А 2 , т.е. положительна и равна площади фигуры 12341 .
Если равновесный цикл изображается замкнутой кривой на р , V -диаграмме, которая обходится по часовой стрелке, то работа тела положительна, а цикл накзывается прямым. Если замкнутая кривая на р , V -диаграмме обходится против часовой стрелки, то газ совершает отрицательную работу за цикл, а цикл называется обратным. В любом случае модуль работы газа за цикл равен площади фигуры, ограниченной графиком цикла на р , V -диаграмме.
В круговом процессе рабочее тело
возвращается в исходное состояние, т.е. в
состояние с первоначальной внутренней энергией.
Это значит, что изменение внутренней энергии за
цикл равно нулю: U
= 0.
Так как, по первому закону термодинамики, для
всего цикла Q
= U
+ A
, то Q
= A
.
Итак, алгебраическая сумма всех количеств
теплоты, полученных за цикл, равна работе тела за
цикл: A
ц = Q
н + Q
х = Q
н
– |Q
х |. 
Рассмотрим один из круговых процессов – цикл Карно. Он состоит из двух изотермических и двух адиабатических процессов. Пусть рабочим телом является идеальный газ. Тогда на участке 1–2 изотермического расширения, согласно первому закону термодинамики, всё получаемое газом тепло идёт на совершение положительной работы: Q 12 = A 12 . То есть нет никаких потерь тепла в окружающее пространство и никакого изменения внутренней энергии: U = 0, т.к. T 12 = const (потому что газ – идеальный).
На участке 2–3 адиабатного расширения газ совершает положительную работу за счёт изменения внутренней энергии, т.к. Q ад = 0 = U 23 + A г23 A г23 = –U 23 . Здесь также нет потерь тепла, по определению адиабатного процесса.
На участке 3–4 над газом совершается положительная работа внешней силой, но он не нагревается (изотермический процесс). Благодаря достаточно медленно протекающему процессу и хорошему контакту с холодильником газ успевает отдавать получаемую за счёт работы энергию в виде тепла холодильнику. Сам же газ совершает при этом отрицательную работу: Q 34 = A г34 < 0.
На участке 4–1 газ адиабатно (без теплообмена) сжимается до исходного состояния. При этом он совершает отрицательную работу, а внешние силы – положительную: 0 = U 41 + A г41 A г41 = –U 41 .
Таким образом, за цикл газ получает тепло только на участке 1–2 , изотермически расширяясь:
![]()
Холодильнику тепло отдаётся только при изотермическом сжатии газа на участке 3–4 :
![]()
Согласно первому закону термодинамики
A ц = Q н – |Q x |;
![]()
КПД машины, работающей по циклу Карно,
найдём по формуле 
Согласно закону Бойля–Мариотта для процессов 1–2 и 3–4 , а также уравнению Пуассона для процессов 2–3 и 4–1 , легко доказать, что
После сокращений получим формулу КПД тепловой машины, работающей по циклу Карно:
 Работу тепловых машин, работающих по
обратному циклу, методически правильно, как
показывает опыт, изучать на примере работы
обратного цикла Карно, т.к. он обратим и его можно
провести в обратном направлении: расширять газ
при понижении температуры от T
н до T
x
(процесс 1–4
) и при низкой температуре T
x
(процесс 4–3
), а затем сжимать (процессы 3–2
и 2–1
). Теперь двигатель совершает работу,
чтобы привести в действие холодильную машину.
Рабочее тело отнимает количество теплоты Q
x
у продуктов внутри при низкой температуре T
х,
а отдаёт количество теплоты Q
н
окружающим телам, за пределами холодильника, при
более высокой температуре T
н. Таким
образом, машина, работающая по обратному циклу
Карно, уже не тепловая, а идеальная холодильная.
Роль нагревателя (отдающего тепло) выполняет
тело с более низкой температурой. Но, сохранив
названия элементов, как в тепловой машине,
работающей по прямому циклу, мы можем
представить блок-схему холодильника в следующем
виде:
Работу тепловых машин, работающих по
обратному циклу, методически правильно, как
показывает опыт, изучать на примере работы
обратного цикла Карно, т.к. он обратим и его можно
провести в обратном направлении: расширять газ
при понижении температуры от T
н до T
x
(процесс 1–4
) и при низкой температуре T
x
(процесс 4–3
), а затем сжимать (процессы 3–2
и 2–1
). Теперь двигатель совершает работу,
чтобы привести в действие холодильную машину.
Рабочее тело отнимает количество теплоты Q
x
у продуктов внутри при низкой температуре T
х,
а отдаёт количество теплоты Q
н
окружающим телам, за пределами холодильника, при
более высокой температуре T
н. Таким
образом, машина, работающая по обратному циклу
Карно, уже не тепловая, а идеальная холодильная.
Роль нагревателя (отдающего тепло) выполняет
тело с более низкой температурой. Но, сохранив
названия элементов, как в тепловой машине,
работающей по прямому циклу, мы можем
представить блок-схему холодильника в следующем
виде:

Обратим внимание, что тепло от холодного тела переходит в холодильной машине к телу с более высокой температурой не самопроизвольно, а за счёт работы внешней силы.
Важнейшей характеристикой холодильника является холодильный коэффициент , определяющий эффективность работы холодильника и равный отношению количества теплоты, отнятого от холодильной камеры Q х к затраченной энергии внешнего источника
За один обратный цикл рабочее тело получает от холодильника количество теплоты Q х и отдаёт в окружающее пространство количество теплоты Q н, что больше Q х на работу A дв, совершаемую электродвигателем над газом за цикл: |Q н | = |Q х | + А дв.
Энергия, затраченная двигателем (электроэнергия в случае компрессорных электрических холодильников), идёт на полезную работу над газом, а также на потери при нагревании обмоток двигателя электрическим током Q R и на трение в схеме А тр.
Если пренебречь потерями на трение и джоулево тепло в обмотках двигателя, то холодильный коэффициент
![]()
Учитывая, что в прямом цикле
после несложных преобразований получим:
Последнее соотношение между холодильным коэффициентом и КПД тепловой машины, которая может работать и по обратному циклу, показывает, что холодильный коэффициент может быть больше единицы. В этом случае тепла отнимается от холодильной камеры и возвращается в комнату больше, чем для этого используется энергии двигателем.
В случае идеальной тепловой машины, работающей по обратному циклу Карно (идеального холодильника), холодильный коэффициент имеет максимальное значение:
В реальных холодильниках т.к. не вся получаемая двигателем энергия идёт на работу над рабочим телом, о чём написано выше.
Решим задачу:
Оцените стоимость изготовления 1 кг льда в домашнем холодильнике, если температура испарения фреона –t х °С, температура радиатора t н °С. Стоимость одного киловатт-часа электроэнергии равна Ц. Температура в комнате t .
Дано :
m
, c
, t
, t
н, t
х,
, Ц.
____________
Д – ?
Решение
Стоимость Д изготовления льда равна произведению работы электродвигателя на тариф Ц: Д = ЦА.
Для превращения воды в лёд с температурой 0 °С необходимо отвести от неё количество теплоты Q = m (ct + ). Считаем приближённо, что над фреоном совершается обратный цикл Карно с изотермами при температурах T н и T х. Используем формулы для холодильного коэффициента: по определению, = Q /A и для идеального холодильника ид = T х /(T н – T х). Из условия следует, что ид.
Решаем совместно три последних уравнения:
Разбирая с учащимися эту задачу,
необходимо обратить внимание на то, что основная
работа холодильного устройства идёт не на
охлаждение продуктов, а на поддержание
температуры внутри холодильного шкафа путём
периодической откачки тепла, проникающего
сквозь стенки холодильника.
Для закрепления темы можно решить задачу:
КПД тепловой машины, работающей по циклу, состоящему из изотермического процесса 1–2 , изохорического 2–3 и адиабатического 3–1 , равен , а разность максимальной и минимальной температур газа в цикле равна T . Найдите работу, совершённую моль одноатомного идеального газа в изотермическом процессе.
Решение
При решении задач, в которых фигурирует КПД цикла, полезно предварительно проанализировать все участки цикла, используя первый закон термодинамики, и выявить участки, где тело получает и отдаёт тепло. Проведём мысленно ряд изотерм на р , V -диаграмме. Тогда станет ясно, что максимальная температура в цикле на изотерме, а минимальная – в т. 3 . Обозначим их через T 1 и T 3 соответственно.
На участке 1–2 изменение внутренней энергии идеального газа U 2 – U 1 = 0. По первому закону термодинамики, Q 12 = (U 2 – U 1) + А 12 . Так как на участке 1–2 газ расширялся, то работа газа А 12 > 0. Значит, и подведённое к газу количество теплоты на этом участке Q 12 > 0, причём Q 12 = А 12 .
На участке 2–3 работа газа равна нулю. Поэтому Q 23 = U 3 – U 2 .
Воспользовавшись выражениями U 2 = c V T 1 и тем, что T 1 – T 3 = T , получим Q 23 = –c V T < 0. Это означает, что на участке 2–3 газ получает отрицательное количество теплоты, т.е. отдаёт тепло.
На участке 3–1
теплообмена нет,
т.е. Q
31 = 0 и, по первому закону
термодинамики, 0 = (U
1 – U
3) + A
31 .
Тогда работа газа
A
31 = U
3 – U
1 = c V
(T
3 –T
1) = –c V
T
.
Итак, за цикл газ совершил работу A 12 + А 31 = А 12 – c V T и получил тепло только на участке 1–2 . КПД цикла
![]()
Так как то работа газа на изотерме равна
Геннадий Антонович Белуха – заслуженный учитель РФ, педагогический стаж 20 лет, ежегодно его ученики занимают призовые места на различных этапах всероссийской олимпиады по физике. Хобби – компьютерная техника.
При деформации конструкций происходит перемещение точек приложения внешних сил, при этом внешние силы на заданных перемещениях совершают работу.
Вычислим работу некоторой обобщенной силы (рис. 2.2.4), которая возрастает от нуля до заданной величины достаточно медленно, чтобы можно было пренебречь силами инерции перемещаемых масс. Такую нагрузку принято называть статической.

Рис.2.2.4
Пусть в произвольный момент деформации
силе
 соответствует обобщенное перемещение
соответствует обобщенное перемещение .
Бесконечно малое приращение силы на
величину
.
Бесконечно малое приращение силы на
величину вызовет бесконечно малое приращение
перемещения
вызовет бесконечно малое приращение
перемещения .
Очевидно, что элементарная работа
внешней силы, если пренебречь бесконечно
малыми величинами второго порядка,
.
Очевидно, что элементарная работа
внешней силы, если пренебречь бесконечно
малыми величинами второго порядка,
Полная работа, совершенная статически
приложенной обобщенной силой
 ,
вызвавшей обобщенное перемещение
,
вызвавшей обобщенное перемещение ,
,
 . (2.2.5)
. (2.2.5)
Полученный интеграл представляет собой
площадь диаграммы
 ,
которая для линейно деформированных
систем является площадью треугольника
с основанием окончательного значения
перемещения
,
которая для линейно деформированных
систем является площадью треугольника
с основанием окончательного значения
перемещения и высотой окончательного значения силы
и высотой окончательного значения силы
 (2.2.6)
(2.2.6)

Рис. 2.2.5
Таким образом, действительная работа при статическом действии обобщенной силы на упругую систему равна половине произведения окончательного значения силы на окончательное значение соответствующего ей обобщенного перемещения (теорема Клапейрона).
В случае статического действия на упругую систему нескольких обобщенных сил работа деформаций равна полусумме произведений окончательного значения каждой силы на окончательное значение соответствующего суммарного перемещения
 (2.2.7)
(2.2.7)
и не зависит от порядка нагружения системы.
Работа внутренних сил.
Внутренние силы, возникающие при деформировании упругих систем, также совершают работу.
Рассмотрим элемент стержня длиной
 (рис. 2.2.6). В общем случае для плоского
изгиба действие удаленных частей стержня
на оставленный элемент выражается
равнодействующими осевыми силами
(рис. 2.2.6). В общем случае для плоского
изгиба действие удаленных частей стержня
на оставленный элемент выражается
равнодействующими осевыми силами ,
поперечными силами
,
поперечными силами и изгибающими моментами
и изгибающими моментами .
Эти усилия, показанные на рис 2.2.6 сплошными
линиями, по отношению к выделенному
элементу являются внешними.
.
Эти усилия, показанные на рис 2.2.6 сплошными
линиями, по отношению к выделенному
элементу являются внешними.

Рис.2.2.6
Внутренние силы, показанные штриховыми линиями, препятствуют деформации, вызываемой внешними силами, равны им по величине и обратны по направлению.
Вычислим работу, совершенную отдельно каждым внутренним силовым фактором.
Пусть элемент испытывает только действие осевых усилий, равномерно распределенных по сечению (рис. 2.2.6).

Рис. 2.2.7
Удлинение элемента в результате этого
 ,
,
Работа, постепенно возрастающих от нуля
до величины
 внутренних сил на этом перемещении.
внутренних сил на этом перемещении.
 . (2.2.8)
. (2.2.8)
Работа внутренних сил отрицательна, поэтому в полученной формуле стоит знак «минус».
Рассмотрим теперь элемент, находящийся под действием изгибающих моментов (рис. 2.2.8).
Взаимный угол поворота сечений элемента
 .
.
Работа изгибающих моментов
 . (2.2.9)
. (2.2.9)

Рис. 2.2.8
Работу постепенно возрастающих внутренних поперечных сил с учетом распределения касательных напряжений по поперечному сечению и на основании закона Гука можно записать в следующем виде
 , (2.2.10)
, (2.2.10)
где
 - коэффициент, зависящий от формы
поперечного сечения.
- коэффициент, зависящий от формы
поперечного сечения.
Если стержень подвергается кручению, элементарная работа постепенно возрастающих крутящих моментов
 (2.2.11)
(2.2.11)
Наконец в общем случае действия на брус в сечениях имеем шесть внутренних силовых факторов, работу которых можно определить по формуле
При рассмотрении термодинамических процессов механическое перемещение макротел в целом не рассматривается. Понятие работы здесь связывается с изменением объема тела, т.е. перемещением частей макротела друг относительно друга. Процесс этот приводит к изменению расстояния между частицами, а также часто к изменению скоростей их движения, следовательно, к изменению внутренней энергии тела.
Пусть в цилиндре с подвижным поршнем находится газ при температуре T 1 (рис. 1). Будем медленно нагревать газ до температуры T 2 . Газ будет изобарически расширяться, и поршень переместится из положения 1 в положение 2 на расстояние Δl . Сила давления газа при этом совершит работу над внешними телами. Так как p = const, то и сила давления F = pS тоже постоянная. Поэтому работу этой силы можно рассчитать по формуле
\(~A = F \Delta l = pS \Delta l = p \Delta V, \qquad (1)\)
где ΔV - изменение объема газа. Если объем газа не изменяется (изохорный процесс), то работа газа равна нулю.
Сила давления газа выполняет работу только в процессе изменения объема газа .
При расширении (ΔV > 0) газа совершается положительная работа (А > 0); при сжатии (ΔV < 0) газа совершается отрицательная работа (А < 0), положительную работу совершают внешние силы А’ = -А > 0.
Запишем уравнение Клапейрона-Менделеева для двух состояний газа:
\(~pV_1 = \frac mM RT_1 ; pV_2 = \frac mM RT_2 \Rightarrow\) \(~p(V_2 - V_1) = \frac mM R(T_2 - T_1) .\)
Следовательно, при изобарном процессе
\(~A = \frac mM R \Delta T .\)
Если m = М (1 моль идеального газа), то при ΔΤ = 1 К получим R = A . Отсюда вытекает физический смысл универсальной газовой постоянной: она численно равна работе, совершаемой 1 моль идеального газа при его изобарном нагревании на 1 К.
На графике p = f (V ) при изобарном процессе работа равна площади заштрихованного на рисунке 2, а прямоугольника.

Если процесс не изобарный (рис. 2, б), то кривую p = f (V ) можно представить как ломаную, состоящую из большого количества изохор и изобар. Работа на изохорных участках равна нулю, а суммарная работа на всех изобарных участках будет
\(~A = \lim_{\Delta V \to 0} \sum^n_{i=1} p_i \Delta V_i\), или \(~A = \int p(V) dV,\)
т.е. будет равна площади заштрихованной фигуры. При изотермическом процессе (Т = const) работа равна площади заштрихованной фигуры, изображенной на рисунке 2, в.
Определить работу, используя последнюю формулу, можно только в том случае, если известно, как изменяется давление газа при изменении его объема, т.е. известен вид функции p (V ).
Таким образом, газ при расширении совершает работу. Приборы и агрегаты, действия которых основаны на свойстве газа в процессе расширения совершать работу, называются пневматическими . На этом принципе действуют пневматические молотки, механизмы для закрывания и открывания дверей на транспорте и др.
Литература
Аксенович Л. А. Физика в средней школе: Теория. Задания. Тесты: Учеб. пособие для учреждений, обеспечивающих получение общ. сред, образования / Л. А. Аксенович, Н.Н.Ракина, К. С. Фарино; Под ред. К. С. Фарино. - Мн.: Адукацыя i выхаванне, 2004. - C. 155-156.
Основные формулы термодинамики и молекулярной физики, которые вам пригодятся. Еще один отличный день для практических занятий по физике. Сегодня мы соберем вместе формулы, которые чаще всего используются при решении задач в термодинамике и молекулярной физике.
Итак, поехали. Попытаемся изложить законы и формулы термодинамики кратко.
Идеальный газ
Идеальный газ – это идеализация, как и материальная точка. Молекулы такого газа являются материальными точками, а соударения молекул – абсолютно упругие. Взаимодействием же молекул на расстоянии пренебрегаем. В задачах по термодинамике реальные газы часто принимаются за идеальные. Так гораздо легче жить, и не нужно иметь дела с массой новых членов в уравнениях.
Итак, что происходит с молекулами идеального газа? Да, они движутся! И резонно спросить, с какой скоростью? Конечно, помимо скорости молекул нас интересует еще и общее состояние нашего газа. Какое давление P он оказывает на стенки сосуда, какой объем V занимает, какая у него температура T.
Для того, чтобы узнать все это, есть уравнение состояния идеального газа, или уравнение Клапейрона-Менделеева
Здесь m – масса газа, M – его молекулярная масса (находим по таблице Менделеева), R – универсальная газовая постоянная, равная 8,3144598(48) Дж/(моль*кг).
Универсальная газовая постоянная может быть выражена через другие константы (постоянная Больцмана и число Авогадро )

Масс у , в свою очередь, можно вычислить, как произведение плотности и объема .

Основное уравнение молекулярно-кинетической теории (МКТ)
Как мы уже говорили, молекулы газа движутся, причем, чем выше температура – тем быстрее. Существует связь между давлением газа и средней кинетической энергией E его частиц. Эта связь называется основным уравнением молекулярно-кинетической теории и имеет вид:

Здесь n – концентрация молекул (отношение их количества к объему), E – средняя кинетическая энергия. Найти их, а также среднюю квадратичную скорость молекул можно, соответственно, по формулам:

Подставим энергию в первое уравнение, и получим еще один вид основного уравнения МКТ

Первое начало термодинамики. Формулы для изопроцессов
Напомним Вам, что первый закон термодинамики гласит: количество теплоты, переданное газу, идёт на изменение внутренней энергии газа U и на совершение газом работы A. Формула первого закона термодинамики записывается так:

Как известно, с газом что-то происходит, мы можем сжать его, можем нагреть. В данном случае нас интересуют такие процессы, которые протекают при одном постоянном параметре. Рассмотрим, как выглядит первое начало термодинамики в каждом из них.
Кстати! Для всех наших читателей сейчас действует скидка 10% на любой вид работы .
Изотермический процесс протекает при постоянной температуре. Тут работает закон Бойля-Мариотта: в изотермическом процессе давление газа обратно пропорционально его объёму. В изотермическом процессе:

протекает при постоянном объеме. Для этого процесса характерен закон Шарля: При постоянном объеме давление прямо пропорционально температуре. В изохорном процессе все тепло, подведенное к газу, идет на изменение его внутренней энергии.

идет при постоянном давлении. Закон Гей-Люссака гласит, что при постоянном давлении газа его объём прямо пропорционален температуре. При изобарном процессе тепло идет как на изменение внутренней энергии, так и на совершение газом работы.

. Адиабатный процесс – это такой процесс, который проходит без теплообмена с окружающей средой. Это значит, что формула первого закона термодинамики для адиабатного процесса выглядит так:

Внутренняя энергия одноатомного и двухатомного идеального газа

Теплоемкость
Удельная теплоемкость равна количеству теплоты, которое необходимо для нагревания одного килограмма вещества на один градус Цельсия.

Помимо удельной теплоемкости, есть молярная теплоемкость (количество теплоты, необходимое для нагревания одного моля вещества на один градус) при постоянном объеме, и молярная теплоемкость при постоянном давлении. В формулах ниже, i – число степеней свободы молекул газа. Для одноатомного газа i=3, для двухатомного – 5.

Тепловые машины. Формула КПД в термодинамике
Тепловая машина , в простейшем случае, состоит из нагревателя, холодильника и рабочего тела. Нагреватель сообщает тепло рабочему телу, оно совершает работу, затем охлаждается холодильником, и все повторяется вно вь. Типичным примером тепловой машины является двигатель внутреннего сгорания.
Коэффициент полезного действия тепловой машины вычисляется по формуле

Вот мы и собрали основные формулы термодинамики, которые пригодятся в решении задач. Конечно, это не все все формулы из темы термодинамика, но их знание действительно может сослужить хорошую службу. А если возникнут вопросы – помните о студенческом сервисе , специалисты которого готовы в любой момент прийти на выручку.
Историческая справка.
1) М.В. Ломоносов, проведя стройные рассуждения и простые опыты, пришел к выводу, что «причина теплоты состоит во внутреннем движении частиц связанной материи… Весьма известно, что тепло возбуждается движением: руки от взаимного трения согреваются, дерево загорается, искры вылетают при ударе кремнием о сталь, железо накаливается при ковании его частиц сильными ударами»
2) Б. Румфорд, работая на заводе по изготовлению пушек, заметил, что при сверлении пушечного ствола он сильно нагревается. Например, он помещал металлический цилиндр массой около 50 кг в ящик с водой и, сверля цилиндр сверлом, доводил воду в ящике до кипения за 2.5часа.
3) Дэви в 1799 году осуществил интересный опыт. Два куска льда при трении одного о другой начали таять и превращаться в воду.
4) Корабельный врач Роберт Майер в 1840 году во время плавания на остров Яву заметил, что после шторма вода в море всегда теплее, чем до него.
Вычисление работы.
В механике
работа определяется как произведение модулей силы и перемещения: A=FS. При
рассмотрении термодинамических процессов механическое перемещение макротел в
целом не рассматривается. Понятие работы здесь связывается с изменением объема
тела, т.е. перемещением частей макротела друг относительно друга. Процесс этот
приводит к изменению расстояния между частицами, а также часто к изменению
скоростей их движения, следовательно, к изменению внутренней энергии тела.
Пусть в цилиндре с подвижным поршнем находится газ при температуре T 1 (рис.). Будем медленно нагревать газ до температуры T 2 . Газ будет изобарно расширяться, и поршень переместится из положения 1 в положение 2 на расстояние Δl . Сила давления газа при этом совершит работу над внешними телами. Так как p = const, то и сила давления F = pS тоже постоянная. Поэтому работу этой силы можно рассчитать по формуле A =F Δ l =pS Δ l =p Δ V , A= p Δ V
где ΔV - изменение объема газа. Если объем газа не изменяется (изохорный процесс), то работа газа равна нулю.
Почему при сжатии или расширении меняется внутренняя энергия тела? Почему при сжатии газ нагревается, а при расширении охлаждается?
Причиной изменения температуры газа при сжатии и расширении является следующее: при упругих соударениях молекул с движущимся поршнем их кинетическая энергия изменяется .
- Если газ сжимается, то при столкновении движущийся навстречу поршень передаёт молекулам часть своей механической энергии, в результате чего газ нагревается;
- Если газ расширяется, то после столкновения с удаляющимся поршнем скорости молекул уменьшаются. в результате чего газ охлаждается.
При сжатии и расширении меняется и средняя потенциальная энергия взаимодействия молекул, так как при этом меняется среднее расстояние между молекулами.
Работа внешних сил, действующих на газ
- При сжатии газа, когда ΔV = V 2 – V 1 < 0 , A>0, направления силы и перемещения совпадают;
- При расширении, когда ΔV = V 2 – V 1 > 0 , A<0, направления силы и перемещения противоположны.
Запишем уравнение Клапейрона-Менделеева для двух состояний газа:
pV 1 = m/M*RT 1 ; pV 2 =m/M* RT 2 ⇒
p (V 2 − V 1 )= m/M* R (T 2 − T 1 ).
Следовательно, при изобарном процессе
A = m/M* R Δ T .
Если m = М (1 моль идеального газа), то при ΔΤ = 1 К получим R = A . Отсюда вытекает физический смысл универсальной газовой постоянной : она численно равна работе, совершаемой 1 моль идеального газа при его изобарном нагревании на 1 К.
Геометрическое истолкование работы:
На графике p = f(V) при изобарном процессе работа равна площади заштрихованного на рисунке а) прямоугольника.
Если процесс
не изобарный (рис. б), то кривую p
= f
(V
) можно
представить как ломаную, состоящую из большого количества изохор и изобар.
Работа на изохорных участках равна нулю, а суммарная работа на всех изобарных
участках будет равна площади заштрихованной фигуры. При изотермическом процессе
(Т
= const) работа равна площади заштрихованной фигуры, изображенной на
рисунке в.