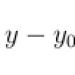Аминокислотами называются карбоновые кислоты, содержащие аминогруппу и карбоксильную группу. Природные аминокислоты являются 2-аминокарбоновыми кислотами, или α-аминокислотами, хотя существуют такие аминокислоты как β-аланин, таурин, γ-аминомасляная кислота. Обобщенная формула α-аминокислоты выглядит так:
У α-аминокислот при 2 атоме углерода имеются четыре разных заместителя, то есть все α-аминокислоты, кроме глицина, имеют асимметрический (хиральный) атом углерода и существуют в виде двух энантиомеров – L- и D-аминокислот. Природные аминокислоты относятся к L-ряду. D-аминокислоты встречаются в бактериях и пептидных антибиотиках.
Все аминокислоты в водных растворах могут существовать в виде биполярных ионов, причем их суммарный заряд зависит от рН среды. Величина рН, при которой суммарный заряд равен нулю, называется изоэлектрической точкой. В изоэлектрической точке аминокислота является цвиттер-ионом, то есть аминная группа у нее протонирована, а карбоксиль-ная – диссоциирована. В нейтральной области рН большинство аминокислот являются цвиттер-ионами:
Аминокислоты не поглощают свет в видимой области спектра, ароматические аминокислоты поглощают свет в УФ области спектра: триптофан и тирозин при 280 нм, фенилаланин – при 260 нм.
Для аминокислот характерны некоторые химические реакции, имеющие большое значение для лабораторной практики: цветная нингидриновая проба на α-аминогруппу, реакции, характерные для сульфгидрильных, фенольных и других групп радикалов аминокислот, ацелирование и образование оснований Шиффа по аминогруппам, этерификация по карбоксильным группам.
Биологическая роль аминокислот:
1) являются структурными элементами пептидов и белков, так называемые протеиногенные аминокислоты. В состав белков входят 20 аминокислот, которые кодируются генетическим кодом и включаются в белки в про-цессе трансляции, некоторые из них могут быть фосфорилированы, ацилированы или гидроксилированы;
2) могут быть структурными элементами других природных соединений – коферментов, желчных кислот, антибиотиков;
3) являются сигнальными молекулами. Некоторые из аминокислот являются нейромедиаторами или предшественниками нейромедиаторов, гормонов и гистогормонов;
4) являются важнейшими метаболитами, например, некоторые аминокислоты являются предшественниками алкалоидов растений, или служат донорами азота, или являются жизненно важными компонентами питания.
Классификация протеиногенных аминокислот основана на строении и на полярности боковых цепей:
1. Алифатические аминокислоты:
Глицин, гли , G, Gly
Аланин, ала , А, Ala
Валин, вал , V, Val*
Лейцин, лей , L, Leu*
Изолейцин, иле, I, Ile*
Эти аминокислоты не содержат в боковой цепи гетероатомов, циклических группировок и характеризуется отчетливо выраженной низкой полярностью.
Цистеин, цис , C, Cys
Метионин, мет , M, Met*
3. Ароматические аминокислоты:
Фенилаланин, фен , F, Phe*
Тирозин, тир , Y, Tyr
Триптофан, три , W, Trp*
Гистидин, гис , H, His
Ароматические аминокислоты содержат мезомерные резонансно стабилизированные циклы. В этой группе только аминокислота фенилаланин проявляет низкую полярность, тирозин и триптофан характеризуются заметной, а гистидин – даже высокой полярностью. Гистидин может быть отнесен также к основным аминокислотам.
4. Нейтральные аминокислоты:
Серин, сер , S, Ser
Треонин, тре , T, Thr*
Аспарагин, асн, N, Asn
Глутамин, глн, Q, Gln
Нейтральные аминокислоты содержат гидроксильные или карбоксамидные группы. Хотя амидные группы неионогенны, молекулы аспарагина и глута-мина высоко полярны.
5. Кислые аминокислоты:
Аспарагиновая кислота (аспартат), асп , D, Asp
Глутаминовая кислота (глутамат), глу, E, Glu
Карбоксильные группы боковых цепей кислых аминокислот полностью ионизированы во всем диапазоне физиологических значений рН.
6. Основные аминокислоты:
Лизин, лиз, K, Lys*
Аргинин, арг , R, Arg
Боковые цепи основных аминокислот полностью протонированы в нейтраль-ной области рН. Сильно основной и очень полярной аминокислотой является аргинин, содержащий гуанидиновую группировку.
7. Иминокислота:
Пролин, про , P, Pro
Боковая цепь пролина состоит из пятичленного цикла, включающего α-углеродный атом и α-аминогруппу. Поэтому пролин, строго говоря, является не амино-, а иминокислотой. Атом азота в кольце является слабым основанией и не протонируется при физиологических значениях рН. Благодаря циклической структуре пролин вызывает изгибы полипептидной цепи, что очень существенно для структуры коллагена.
Некоторые из перечисленных аминокислот не могут синтезироваться в организме человека и должны поступать вместе с пищей. Это незаменимые аминокислоты отмечены звездочками.
Как было указано выше, протеиногенные аминокислоты являются предшественниками некоторых ценных биологически активных молекул.
Два биогенных амина β-аланин и цистеамин входят в состав кофермента А (коферменты – производные водорастворимых витаминов, образующие активный центр сложных ферментов). β-Аланин образуется путем декарбоксилирования аспарагиновой кислоты, а цистеамин путем декарбоксилирования цистеина:
β-аланин цистеамин
Остаток глутаминовой кислоты входит в состав другого кофермента – тетрагидрофолиевой кислоты, производного витамина В с.
Другими биологически ценными молекулами являются конъюгаты желчных кислот с аминокислотой глицином. Эти конъюгаты являются более сильными кислотами, чем базовые, образуются в печени и присутствуют в желчи в виде солей.
Гликохолевая кислота
Протеиногенные аминокислоты являются предшественниками некоторых антибиотиков – биологически активных веществ, синтезируемых микроорганизмами и подавляющих размножение бактерий, вирусов и клеток. Наиболее известными из них являются пенициллины и цефалоспорины, составляющие группу β-лактамных антибиотиков и продуцирумые плесенью рода Penicillium . Для них характерно наличие в структуре реакционноспособного β-лактамного кольца, с помощью которого они ингибируют синтез клеточных стенок грамотрицательных микроорганизмов.
Общая формула пенициллинов
Из аминокислот путем декарбоксилирования получаются биогенные амины – нейромедиаторы, гормоны и гистогормоны.
Аминокислоты глицин и глутамат сами по себе являются нейромедиаторами в центральной нервной системе.
дофамин (нейромедиатор) норадреналин (нейромедиатор)
адреналин (гормон) гистамин (медиатор и гистогормон)
серотонин (нейромедиатор и гистогормон) ГАМК (нейромедиатор)
Тироксин (гормон)
Производным аминокислоты триптофана является наиболее известный из встречающихся в природе ауксин – индолилуксусная кислота. Ауксины – это регуляторы роста растений, они стимулируют дифференцировку растущих тканей, рост камбия, корней, ускоряют рост плодов и опадение старых листьев, их антагонистами является абсцизовая кислота.
Индолилуксусная кислота
Производными аминокислот также являются алкалоиды – природные азотсодержащие соединения основного характера, образующиеся в расте-ниях. Данные соединения являются исключительно активными физиологическими соединениями, широко используемыми в медицине. Примерами алкалоидов могут служить производное фенилаланина папаверин, изохинолиновый алкалоид мака снотворного (спазмолитик), и производное триптофана физостигмин, индольный алкалоид из калабар-ских бобов (антихолинэстеразный препарат):
папаверин физостигмин
Аминокислоты являются чрезвычайно популярными объектами биотехнологии. Существует множество вариантов химического синтеза аминокислот, однако в результате получаются рацематы аминокислот. Так как для пищевой промышленности и медицины пригодны только L-изомеры аминокислот, рацемические смеси необходимо разделять на энантиомеры, что представляет серьезную проблему. Поэтому более популярен биотехнологический подход: ферментативный синтез с помощью иммобилизированных ферментов и микробиологический синтез с помощью целых микробных клеток. В обоих последних случаях получаются чистые L-изомеры.
Аминокислоты используются как пищевые добавки и компоненты кормов. Глутаминовая кислота усиливает вкус мяса, валин и лейцин улучшают вкус хлебобулочных изделий, глицин и цистеин используются в качестве антиоксидантов при консервировании. D-триптофан может быть заменителем сахара, так как во много раз его слаще. Лизин добавляют в корм сельскохозяйственным животным, так как большинство растительных белков содержит малое количество незаменимой аминокислоты лизина.
Аминокислоты широко используются в медицинской практике. Это такие аминокислоты как метионин, гистидин, глутаминовая и аспарагиновая кислоты, глицин, цистеин, валин.
В последнее десятилетие аминокислоты начали добавлять в космети-ческие средства по уходу за кожей и волосами.
Химически модифицированные аминокислоты также широко используются в промышленности в качестве поверхностно-активных веществ в синтезе полимеров, при производстве моющих средств, эмульгаторов, добавок к топливу.
БЕЛКИ
Белки – это высокомолекулярные вещества, состоящие из аминокислот, соединенных пептидной связью.
Именно белки являются продуктом генетической информации, передаваемой из поколения в поколение, и осуществляют все процессы жизнедеятельности в клетке.
Функции белков:
1. Каталитическая функция. Наиболее многочисленную группу белков составляют ферменты – белки с каталитической активностью, ускоряющие химические реакции. Примерами ферментов являются пепсин, алкогольдегидрогеназа, глутаминсинтетаза.
2. Структурообразующая функция. Структурные белки отвечают за поддер-жание формы и стабильности клеток и тканей, к ним относятся кератины, коллаген, фиброин.
3. Транспортная функция. Транспортные белки переносят молекулы или ионы из одного органа в другой или через мембраны внутри клетки, например, гемоглобин, сывороточный альбумин, ионные каналы.
4. Защитная функция. Белки системы гомеостаза защищают организм от возбудителей болезней, чужеродной информации, потери крови – иммуноглобулины, фибриноген, тромбин.
5. Регуляторная функция. Белки осуществляют функции сигнальных веществ – некоторых гормонов, гистогормонов и нейромедиаторов, являются рецепторами к сигнальным веществам любого строения, обеспечивают дальнейшую передачу сигнала в биохимических сигнальных цепях клетки. Примерами могут служить гормон роста соматотропин, гормон инсулин, Н- и М-холинорецепторы.
6. Двигательная функция. С помощью белков осуществляются процессы сокращения и другого биологического движения. Примерами могут служить тубулин, актин, миозин.
7. Запасная функция. В растениях содержатся запасные белки, являющиеся ценными пищевыми веществами, в организмах животных мышечные белки служат резервными питательными веществами, которые мобилизуются при крайней необходимости.
Для белков характерным является наличие нескольких уровней структурной организации.
Первичной структурой белка называют последовательность аминокислотных остатков в полипептидной цепи. Пептидная связь – это карбоксамидная связь между α-карбоксильной группой одной аминокислоты и α-аминогруппой другой аминокислоты.
Аланилфенилаланилцистеилпролин
У пептидной связи есть несколько особенностей:
а) она резонансно стабилизирована и поэтому находится практически в одной плоскости – планарна; вращение вокруг связи С-N требует больших затрат энергии и затруднено;
б) у связи -CO-NH- особый характер, она меньше, чем обычная, но больше, чем двойная, то есть существует кето-енольная таутомерия:
в) заместители по отношению к пептидной связи находятся в транс -положении;
г) пептидный остов окружен разнообразными по своей природе боковыми цепями, взаимодействуя с окружающими молекулами растворителя, свободные карбоксильные и аминогруппы ионизируются, образуя катионные и анионные центры молекулы белка. В зависимости от их соотношения белковая молекула получает суммарный положительный или отрицательный заряд, а также характеризуется тем или иным значением рН среды при достижении изоэлектрической точки белка. Радикалы образуют солевые, эфирные, дисульфидные мостики внутри молекулы белка, а также определяют круг реакций, свойственных белкам.
В настоящее время условились считать белками полимеры, состоящие из 100 и более аминокислотных остатков, полипептидами – полимеры, состоящие из 50-100 аминокислотных остатков, низкомолекулярными пептидами – полимеры, состоящие из менее 50 аминокислотных остатков.
Некоторые низкомолекулярные пептиды играют самостоятельную биологическую роль. Примеры некоторых таких пептидов:
Глутатион – γ-глу-цис-гли – один из наиболее широко распространен-ных внутриклеточных пептидов, принимает участие в окислительно-восстановительных процессах в клетках и переносе аминокислот через биологические мембраны.
Карнозин – β-ала-гис – пептид, содержащийся в мышцах животных, устраняет продукты перекисного расщепления липидов, ускоряет процесс распада углеводов в мышцах и в виде фосфата вовлекается в энергетический обмен в мышцах.
Вазопрессин – гормон задней доли гипофиза, участвующий в регуля-ции водного обмена организма:
Фаллоидин – ядовитый полипептид мухомора, в ничтожных концентрациях вызывает гибель организма вследствие выхода ферментов и ионов калия из клеток:
Грамицидин – антибиотик, действующий на многие грамположительные бактерии, изменяет проницаемость биологических мембран для низкомолекулярных соединений и вызывает гибель клеток:
Мет -энкефалин – тир-гли-гли-фен-мет – пептид, синтезирующийся в нейронах и ослабляющий болевые ощущения.
Вторичная структура белка – это пространственная структура, образующаяся в результате взаимодействий между функциональными группами пептидного остова.
Пептидная цепь содержит множество СО- и NH-групп пептидных связей, каждая из которых потенциально способна участвовать в образовании водородных связей. Существуют два главных типа структур, которые позволяют это осуществить: α-спираль, в которую цепь свертывается как шнур от телефонной трубки, и складчатая β-структура, в которой бок о бок уложены вытянутые участки одной или нескольких цепей. Обе эти структуры весьма стабильны.
α-Спираль характеризуется предельно плотной упаковкой скрученной полипептидной цепи, на каждый виток правозакрученной спирали приходится 3,6 аминокислотных остатка, радикалы которых направлены всегда наружу и немного назад, то есть в начало полипептидной цепи.
Основные характеристики α-спирали:
1) α-спираль стабилизируется водородными связями между атомом водорода при азоте пептидной группы и карбонильным кислородом остатка, отстоящего от данного вдоль цепи на четыре позиции;
2) в образовании водородной связи участвуют все пептидные группы, это обеспечивает максимальную стабильность α-спирали;
3) в образовании водородных связей вовлечены все атомы азота и кислорода пептидных групп, что в значительной мере снижает гидрофильность α-спиральных областей и увеличивает их гидрофобность;
4) α-спираль образуется самопроизвольно и является наиболее устойчивой конформацией полипептидной цепи, отвечающей минимуму свободной энергии;
5) в полипептидной цепи из L-аминокислот правая спираль, обычно обнаруживаемая в белках, намного стабильнее левой.
Возможность образования α-спирали обусловлена первичной структурой белка. Некоторые аминокислоты препятствуют закручиванию пептидного остова. Например, расположенные рядом карбоксильные группы глутамата и аспартата взаимно отталкиваются друг от друга, что препятствует образованию водородных связей в α-спирали. По этой же причине затруднена спирализация цепи в местах близко расположенных друг к другу положительно заряженных остатков лизина и аргинина. Однако наибольшую роль в нарушении α-спирали играет пролин. Во-первых, в пролине атом азота входит в состав жесткого кольца, что препятствует вращению вокруг связи N-C, во-вторых, пролин не образует водородную связь из-за отсутствия водорода при атоме азота.
β-складчатость – это слоистая структура, образуемая водородными связями между линейно расположенными пептидными фрагментами. Обе цепи могут быть независимыми или принадлежать одной молекуле полипептида. Если цепи ориентированы в одном направлении, то такая β-структура называется параллельной. В случае противоположного направления цепей, то есть когда N-конец одной цепи совпадает с С-концом другой цепи, β-структура называется антипараллельной. Энергетически более предпочтительна антипараллельная β-складчатость с почти линейными водородными мостиками.
параллельная β-складчатость антипараллельная β-складчатость
В отличие от α-спирали, насыщенной водородными связями, каждый участок цепи β-складчатости открыт для образования дополнительных водородных связей. Боковые радикалы аминокислот ориентированы почти перпендикулярно плоскости листа попеременно вверх и вниз.
В тех участках, где пептидная цепь изгибается достаточно круто, часто находится β-петля. Это короткий фрагмент, в котором 4 аминокислотных остатка изгибаются на 180 о и стабилизируются одним водородным мостиком между первым и четвертым остатками. Большие аминокислотные радикалы мешают образованию β-петли, поэтому в нее чаще всего входит самая маленькая аминокислота глицин.
Надвторичная структура белка – это некоторый специфический порядок чередования вторичных структур. Под доменом понимают обособленную часть молекулы белка, обладающую в определенной степени структурной и функциональной автономией. Сейчас домены считают фундаментальными элементами структуры белковых молекул и соотношение и характер компоновки α-спиралей и β-слоев дает для понимания эволюции белковых молекул и филогенетических связей больше, чем сопоставление первичных структур. Главной задачей эволюции является конструирование все новых белков. Бесконечно мал шанс случайно синтезировать такую аминокислотную последовательность, которая бы удовлетворила условиям упаковки и обеспечила выполнение функциональных задач. Поэтому часто встречаются белки с различной функцией, но сходные по структуре настолько, что кажется, что они имели одного общего предка или произошли друг от друга. Похоже, что эволюция, столкнувшись с необходимостью решить определенную задачу, предпочитает не конструировать для этого белки сначала, а приспособить для этого уже хорошо отлаженные структуры, адаптируя их для новых целей.
Некоторые примеры часто повторяющихся надвторичных структур:
1) αα’ – белки, содержащие только α-спирали (миоглобин, гемоглобин);
2) ββ’ – белки, содержащие только β-структуры (иммуноглобулины, супероксиддисмутаза);
3) βαβ’ – структура β-бочонка, каждый β-слой расположен внутри бочонка и связан с α-спиралью, находящейся на поверхности молекулы (триозофосфоизомераза, лактатдегидрогеназа);
4) «цинковый палец» – фрагмент белка, состоящий из 20 аминокислотных остатков, атом цинка связан с двумя остатками цистеина и двумя гистидина, в результате чего образуется «палец» из примерно 12 амино-кислотных остатков, может связываться с регуляторными участками молекулы ДНК;
5) «лейциновая застежка-молния» – взаимодействующие белки имеют α-спиральный участок, содержащий по крайней мере 4 остатка лейцина, они расположены через 6 аминокислот один от другого, то есть находятся на поверхности каждого второго витка и могут образовывать гидрофобные связи с лейциновыми остатками другого белка. С помощью лейциновых застежек, например, молекулы сильноосновных белков гистонов могут объединяться в комплексы, преодолевая положительный заряд.
Третичная структура белка – это пространственное расположение молекулы белка, стабилизируемое связями между боковыми радикалами аминокислот.
Типы связей, стабилизирующих третичную структуру белка:
электростатическое водородные гидрофобные дисульфидные
взаимодействие связи взаимодействия связи
В зависимости от складывания третичной структуры белки можно классифицировать на два основных типа – фибриллярные и глобулярные.
Фибриллярные белки – нерастворимые в воде длинные нитевидные молекулы, полипептидные цепи которых вытянуты вдоль одной оси. В основном это структурные и сократительные белки. Несколько примеров самых распространенных фибриллярных белков:
1. α-Кератины. Синтезируются клетками эпидермиса. На их долю приходится почти весь сухой вес волос, шерсти, перьев, рогов, ногтей, когтей, игл, чешуи, копыт и черепашьего панциря, а также значительная часть веса наружного слоя кожи. Это целое семейство белков, они сходны по аминокислотному составу, содержат много остатков цистеина и имеют одинаковое пространственное расположение полипептидных цепей. В клетках волос полипептидные цепи кератина сначала организуются в волокна, из которых затем формируются структуры наподобие каната или скрученного кабеля, заполняющего в конце концов все пространство клетки. Клетки волос становятся при этом уплощенными и, наконец, отмирают, а клеточные стенки образуют вокруг каждого волоса трубчатый чехол, называемый кутикулой. В α-кератине полипептидные цепи имеют форму α-спирали, скручены одна вокруг другой в трехжильный кабель с образованием поперечных дисульфидных связей. N-концевые остатки расположены с одной стороны (параллельны). Кератины нерастворимы в воде из-за преобладания в их составе аминокислот с неполярными боковыми радикалами, которые обращены в сторону водной фазы. При химической завивке происходят следующие процессы: вначале путем восстановления тиолами разрушаются дисульфидные мостики, а затем при придании волосам необходимой формы их высушивают нагреванием, при этом за счет окисления кислородом воздуха образуются новые дисульфидные мостики, которые сохраняют форму прически.
2. β-Кератины. К ним относятся фиброин шелка и паутины. Представляют из себя антипараллельные β-складчатые слои с преобладанием глицина, аланина и серина в составе.
3. Коллаген. Самый распространенный белок у высших животных и главный фибриллярный белок соединительных тканей. Коллаген синтезируется в фибробластах и хондроцитах – специализированных клетках соединительной ткани, из которых затем выталкивается. Коллагеновые волокна находятся в коже, сухожилиях, хрящах и костях. Они не растяги-ваются, по прочности превосходят стальную проволоку, коллагеновые фибриллы характеризуются поперечной исчерченностью. При кипячении в воде волокнистый, нерастворимый и неперевариваемый коллаген превращается в желатин в результате гидролиза некоторых ковалентных связей. Коллаген содержит 35% глицина, 11% аланина, 21% пролина и 4-гидроксипролина (аминокислоты, свойственной только для коллагена и эластина). Такой состав определяет относительно низкую питательную ценность желатина как пищевого белка. Фибриллы коллагена состоят из повторяющихся полипептидных субъединиц, называемых тропоколлагеном. Эти субъединицы уложены вдоль фибриллы в виде параллельных пучков по типу «голова к хвосту». Сдвинутость головок и придает характерную поперечную исчерченность. Пустоты в этой структуре при необходимости могут служить местом отложения кристаллов гидроксиапатита Са 5 (ОН)(РО 4) 3 , играющего важную роль в минерализации костей.
Тропоколлагеновые субъединицы состоят из трех полипептидных цепей, плотно скрученных в виде трехжильного каната, отличающегося от α- и β-кератинов. В одних коллагенах все три цепи имеют одинаковую аминокислотную последовательность, тогда как в других идентичны только две цепи, а третья отличается от них. Полипептидная цепь тропоколлагена образует левую спираль, на один виток которой приходится только три аминокислотных остатка из-за изгибов цепи, обусловленной пролином и гидроксипролином. Три цепи связаны между собой кроме водородных связей связью ковалентного типа, образующейся между двумя остатками лизина, находящимися в соседних цепях:
По мере того как мы становимся старше, в тропоколлагеновых субъединицах и между ними образуется все большее число поперечных связей, что делает фибриллы коллагена более жесткими и хрупкими, и это изменяет механические свойства хрящей и сухожилий, делает более ломкими кости и понижает прозрачность роговицы глаза.
4. Эластин. Содержится в желтой эластичной ткани связок и эластическом слое соединительной ткани в стенках крупных артерий. Основная субъединица фибрилл эластина – тропоэластин. Эластин богат глицином и аланином, содержит много лизина и мало пролина. Спиральные участки эластина растягиваются при натяжении, но возвращаются при снятии нагрузки к исходной длине. Остатки лизина четырех разных цепей образуют ковалентные связи между собой и позволяют эластину обратимо растягиваться во всех направлениях.
Глобулярные белки – белки, полипептидная цепь которых свернута в компактную глобулу, способны выполнять самые разнообразные функции.
Третичную структуру глобулярных белков удобнее всего рассмотреть на примере миоглобина. Миоглобин – это относительно небольшой кислород-связывающий белок, присутствующий в мышечных клетках. Он запасает связанный кислород и способствует его переносу в митохондрии. В молекуле миоглобина находится одна полипептидная цепь и одна гемогруппа (гем) – комплекс протопорфирина с железом. Основные свойства миоглобина:
а) молекула миоглобина настолько компактна, что внутри нее может уместиться всего 4 молекулы воды;
б) все полярные аминокислотные остатки, за исключением двух, расположены на внешней поверхности молекулы, причем все они находятся в гидратированном состоянии;
в) большая часть гидрофобных аминокислотных остатков расположена внутри молекулы миоглобина и, таким образом, защищена от соприкосно-вения с водой;
г) каждый из четырех остатков пролина в молекуле миоглобина находится в месте изгиба полипептидной цепи, в других местах изгиба расположены остатки серина, треонина и аспарагина, так как такие аминокислоты препятствуют образованию α-спирали, если находятся друг с другом;
д) плоская гемогруппа лежит в полости (кармане) вблизи поверхности молекулы, атом железа имеет две координационные связи, направленные перпендикулярно плоскости гемма, одна из них связана с остатком гистидина 93, а другая служит для связывания молекулы кислорода.
Начиная с третичной структуры белок становится способным выполнять свойственные ему биологические функции. В основе функционирования белков лежит то, что при укладке третичной структуры на поверхности белка образуются участки, которые могут присоединять к себе другие молекулы, называемые лигандами. Высокая специфичность взаимодействия белка с лигандом обеспечивается комплементарностью структуры активного центра структуре лиганда. Комплементарность – это пространственное и химическое соответствие взаимодействующих поверхностей. Для большей части белков третичная структура – максимальный уровень укладки.
Четвертичная структура белка – характерна для белков, состоящих из двух и более полипептидных цепей, связанных между собой исключительно нековалентными связями, в основном электростатическими и водородными. Чаще всего белки содержат две или четыре субъединицы, более четырех субъединиц обычно содержат регуляторные белки.
Белки, имеющие четвертичную структуру, часто называются олигомерными. Различают гомомерные и гетеромерные белки. К гомо-мерным относятся белки, у которых все субъединицы имеют одинаковое строение, например, фермент каталаза состоит их четырех абсолютно одинаковых субъединиц. Гетеромерные белки имеют разные субъединицы, например, фермент РНК-полимераза состоит из пяти разных по строению субъединиц, выполняющих разные функции.
Взаимодействие одной субъединицы со специфическим лигандом вызывает конформационные изменения всего олигомерного белка и изменяет сродство других субъединиц к лигандам, это свойство лежит в основе способности олигомерных белков к аллостерической регуляции.
Четвертичную структуру белка можно рассмотреть на примере гемоглобина. Содержит четыре полипептидных цепи и четыре простетические группы гема, в которых атомы железа находятся в закисной форме Fe 2+ . Белковая часть молекулы – глобин – состоит из двух α-цепей и двух β-цепей, содержащих до 70% α-спиралей. Каждая из четырех цепей имеет характерную для нее третичную структуру, с каждой цепью связана одна гемогруппа. Гемы разных цепей сравнительно далеко расположены друг от друга и имеют разный угол наклона. Между двумя α-цепями и двумя β-цепями образуется мало прямых контактов, тогда как между α- и β-цепями возникают многочисленные контакты типа α 1 β 1 и α 2 β 2 , образованные гидрофобными радикалами. Между α 1 β 1 и α 2 β 2 остается канал.
В отличие от миоглобина гемоглобин характеризуется значительно более низким сродством к кислороду, что позволяет ему при существующих в тканях низких парциальных давлениях кислорода отдавать им значительную часть связанного кислорода. Кислород легче связывается железом гемоглобина при более высоких значениях рН и низкой концентрации СО 2 , свойственные альвеолам легких; освобождению кислорода из гемоглобина благоприятствуют более низкие значения рН и высокие концентрации СО 2 , свойственные тканям.
Кроме кислорода гемоглобин переносит ионы водорода, которые связываются с остатками гистидина в цепях. Также гемоглобин переносит углекислый газ, который присоединяет к концевой аминогруппе каждой из четырех полипептидных цепей, в результате чего образуется карбаминогемоглобин:
В эритроцитах в достаточно больших концентрациях присутствует вещество 2,3-дифосфоглицерат (ДФГ), его содержание увеличивается при подъеме на большую высоту и при гипоксии, облегчая высвобождение кислорода из гемоглобина в тканях. ДФГ располагается в канале между α 1 β 1 и α 2 β 2 , взаимодействуя с положительно зараженными группами β-цепей. При связывании гемоглобином кислорода ДФГ вытесняется из полости. В эритроцитах некоторых птиц содержится не ДФГ, а инозитолгекса-фосфат, который еще больше снижает сродство гемоглобина к кислороду.
2,3-дифосфоглицерат (ДФГ)
HbA – нормальный гемоглобин взрослого человека, HbF – фетальный гемоглобин, имеет большее сродство к О 2 , HbS – гемоглобин при серповидноклеточной анемии. Серповидноклеточная анемия – это серьезное наследственное заболевание, связанное с генетической аномалией гемоглобина. В крови больных людей наблюдается необычно большое количество тонких серповидных эритроцитов, которые, во-первых, легко разрываются, во-вторых, закупоривают кровеносные капилляры. На молеку-лярном уровне гемоглобин S отличается от гемоглобина А по одному аминокислотному остатку в положении 6 β-цепей, где вместо остатка глутаминовой кислоты находится валин. Таким образом, гемоглобин S содержит на два отрицательных заряда меньше, появление валина приводит к возникновению «липкого» гидрофобного контакта на поверхности молекулы, в результате при дезоксигенации молекулы дезоксигемоглобина S слипаются и образуют нерастворимые аномально длинные нитевидные агрегаты, приводящие к деформации эритроцитов.
Нет никаких оснований думать, что существует независимый генетический контроль за формированием уровней структурной организации белка выше первичного, поскольку первичная структура определяет и вторичную, и третичную, и четвертичную (если она имеется). Нативной конформацией белка является термодинамически наиболее устойчивая в данных условиях структура.
Современно протеиновое питание невозможно представить без рассмотрения роли отдельных аминокислот. Даже при общем положительном протеиновом балансе организм животного может испытывать недостаток протеина. Это связано с тем, что усвоение отдельных аминокислот взаимосвязано в друг другом, недостаток или избыток одной аминокислоты может приводить к недостатку другой.
Часть аминокислот не синтезируется в организме человека и животных. Они получили название незаменимых. Таких аминокислот всего десять. Четыре из них являются критическими (лимитирующими)- они чаще всего ограничивают рост и развитие животных.
В рационах для птицы главными лимитирующими аминокислотами являются метионин и цистин, в рационах для свиней – лизин. Организм должен получать достаточное количество главной лимитирующей кислоты с кормом для того, чтобы и другие аминокислоты могли эффективно использоваться для синтеза белка.
Этот принцип иллюстрирован «бочкой Либиха», где уровень заполнения бочки представляет собой уровень синтеза протеина в организме животного. Самая короткая доска в бочке «ограничивает» возможность удержания в ней жидкости. Если же эта доска будет удлинена, то и объем удерживаемой в бочке жидкости увеличится до уровня второй лимитирующей доски.
Самый важный фактор, определяющий продуктивность животных, - это сбалансированность содержащихся в нем аминокислот в соответствии с физиологическими потребностями. Многочисленными исследованиями было доказано, что у свиней, в зависимости от породы и пола, потребность в аминокислотах отличается количественно. А вот отношение незаменимых аминокислот для синтеза 1 г протеина является одинаковым. Такое соотношение незаменимых аминокислот к лизину, как основной лимитирующей аминокислоте, и называется «идеальным протеином» или «идеальным профилем аминокислот». (
Лизин
входит в состав практически всех белков животного, растительного и микробного происхождения, однако протеины злаковых культур бедны лизином.
- Лизин регулирует воспроизводительную функцию, при его недостатке нарушается образование спермиев и яйцеклеток.
- Необходим для роста молодняка, образования тканевых белков. Лизин принимает участие в синтезе нуклеопротеидов, хромопротеидов (гемоглобин), тем самым регулирует пигментацию шерсти животных. Регулирует количество продуктов распада белка в тканях и органах.
- Способствует всасыванию кальция
- Участвует в функциональной деятельности нервной и эндокринной систем, регулирует обмен белков и углеводов, однако реагируя с углеводами, лизин переходит в недоступную для усвоения форму.
- Лизин является исходным веществом при образовании карнитина, играющего важную роль в жировом обмене.
Метионин и цистин серосодержащие аминокислоты. При этом метионин может трансформироваться в цистин, поэтому эти аминокислоты нормируются вместе, а при недостатке в рацион вводятся метиониновые добавки. Обе эти аминокислоты участвуют в образовании производных кожи - волоса, пера; вместе с витамином Е регулируют удаление избытков жира из печени, необходимы для роста и размножения клеток, эритроцитов. При недостатке метионина цистин неактивен. Однако значительного избытка метионина в рационе не следует допускать.
Метионин
способствует отложению жира в мышцах, необходим для образования новых органических соединений холина (витамина В4), креатина, адреналина, ниацина (витамина В5) и др.
Дефицит метионина в рационах приводит к снижению уровня плазменных белков (альбуминов), вызывает анемию (снижается уровень гемоглобина крови), при одновременном недостатке витамина Е и селена способствует развитию мышечной дистрофии. Недостаточное количество метионина в рационе вызывает отставание в росте молодняка, потерю аппетита, снижение продуктивности, увеличение затрат корма, жировое перерождение печени, нарушение функций почек, анемию и истощение.
Избыток метионина ухудшает использование азота, вызывает дегенеративные изменения в печени, почках, поджелудочной железе, увеличивает потребность в аргинине, глицине. При большом избытке метионина наблюдается дисбаланс (нарушается равновесие аминокислот, в основе которого лежат резкие отклонения от оптимального соотношения незаменимых аминокислот в рационе), который сопровождается нарушением обмена веществ и торможением скорости роста у молодняка.
Цистин - серосодержащая аминокислота, взаимозаменяемая с метионином, участвует в окислительно-восстановительных процессах, обмене белков, углеводов и желчных кислот, способствует образованию веществ, обезвреживающих яды кишечника, активизирует инсулин, вместе с триптофаном цистин участвует в синтезе в печени желчных кислот, необходимых для всасывания продуктов переваривания жиров из кишечника, используется для синтеза глютатиона. Цистин обладает способностью поглощать ультрафиолетовые лучи. При недостатке цистина отмечается цирроз печени, задержка оперяемости и роста пера у молодняка, ломкость и выпадение (выщипывание) перьев у взрослой птицы, снижение сопротивляемости к инфекционным заболеваниям.
Триптофан
определяет физиологическую активность ферментов пищеварительного тракта, окислительных ферментов в клетках и ряда гормонов, участвует в обновлении белков плазмы крови, обуславливает нормальное функционирование эндокринного и кроветворного аппаратов, половой системы, синтез гамма - глобулинов, гемоглобина, никотиновой кислоты, глазного пурпура и др. При недостатке в рационе триптофана замедляется рост молодняка, снижается яйценоскость несушек, повышаются затраты корма на продукцию, атрофируются эндокринные и половые железы, возникает слепота, развивается анемия (снижается количество эритроцитов и уровень гемоглобина в крови), понижается резистентность и иммунные свойства организма, оплодотворённость и выводимость яиц. У свиней, получавших рацион, бедный триптофаном, снижается потребление корма, появляется извращенный аппетит, огрубение щетины и истощение, отмечается ожирение печени. Дефицит этой аминокислоты приводит также к стерильности, повышенной возбудимости, конвульсиям, образованию катаракты, отрицательному балансу азота и потере живой массы. Триптофан, являясь предшественником (провитамином) никотиновой кислоты, предупреждает развитие пеллагры.
Аминокислотами называются карбоновые кислоты, содержащие аминогруппу и карбоксильную группу. Природные аминокислоты являются 2-аминокарбоновыми кислотами, или α-аминокислотами, хотя существуют такие аминокислоты как β-аланин, таурин, γ-аминомасляная кислота. Обобщенная формула α-аминокислоты выглядит так:
У α-аминокислот при 2 атоме углерода имеются четыре разных заместителя, то есть все α-аминокислоты, кроме глицина, имеют асимметрический (хиральный) атом углерода и существуют в виде двух энантиомеров – L- и D-аминокислот. Природные аминокислоты относятся к L-ряду. D-аминокислоты встречаются в бактериях и пептидных антибиотиках.
Все аминокислоты в водных растворах могут существовать в виде биполярных ионов, причем их суммарный заряд зависит от рН среды. Величина рН, при которой суммарный заряд равен нулю, называется изоэлектрической точкой. В изоэлектрической точке аминокислота является цвиттер-ионом, то есть аминная группа у нее протонирована, а карбоксиль-ная – диссоциирована. В нейтральной области рН большинство аминокислот являются цвиттер-ионами:

Аминокислоты не поглощают свет в видимой области спектра, ароматические аминокислоты поглощают свет в УФ области спектра: триптофан и тирозин при 280 нм, фенилаланин – при 260 нм.
Для аминокислот характерны некоторые химические реакции, имеющие большое значение для лабораторной практики: цветная нингидриновая проба на α-аминогруппу, реакции, характерные для сульфгидрильных, фенольных и других групп радикалов аминокислот, ацелирование и образование оснований Шиффа по аминогруппам, этерификация по карбоксильным группам.
Биологическая роль аминокислот:
являются структурными элементами пептидов и белков, так называемые протеиногенные аминокислоты. В состав белков входят 20 аминокислот, которые кодируются генетическим кодом и включаются в белки в про-цессе трансляции, некоторые из них могут быть фосфорилированы, ацилированы или гидроксилированы;
могут быть структурными элементами других природных соединений – коферментов, желчных кислот, антибиотиков;
являются сигнальными молекулами. Некоторые из аминокислот являются нейромедиаторами или предшественниками нейромедиаторов, гормонов и гистогормонов;
являются важнейшими метаболитами, например, некоторые аминокислоты являются предшественниками алкалоидов растений, или служат донорами азота, или являются жизненно важными компонентами питания.
Классификация протеиногенных аминокислот основана на строении и на полярности боковых цепей:
1. Алифатические аминокислоты:
 глицин,гли
,G,Gly
глицин,гли
,G,Gly
 аланин,ала
, А,Ala
аланин,ала
, А,Ala
 валин,вал
,V,Val*
валин,вал
,V,Val*
 лейцин,лей
,L,Leu*
лейцин,лей
,L,Leu*
 изолейцин,иле,
I,Ile*
изолейцин,иле,
I,Ile*
Эти аминокислоты не содержат в боковой цепи гетероатомов, циклических группировок и характеризуется отчетливо выраженной низкой полярностью.
 цистеин,цис
,C,Cys
цистеин,цис
,C,Cys
 метионин,мет
,M,Met*
метионин,мет
,M,Met*
3. Ароматические аминокислоты:
 фенилаланин,фен
,F,Phe*
фенилаланин,фен
,F,Phe*
 тирозин,тир
,Y,Tyr
тирозин,тир
,Y,Tyr
 триптофан,три
,W,Trp*
триптофан,три
,W,Trp*
 гистидин,гис
,H,His
гистидин,гис
,H,His
Ароматические аминокислоты содержат мезомерные резонансно стабилизированные циклы. В этой группе только аминокислота фенилаланин проявляет низкую полярность, тирозин и триптофан характеризуются заметной, а гистидин – даже высокой полярностью. Гистидин может быть отнесен также к основным аминокислотам.
4. Нейтральные аминокислоты:
 серин,сер
,S,Ser
серин,сер
,S,Ser
 треонин,тре
,T,Thr*
треонин,тре
,T,Thr*
 аспарагин,асн,
N,Asn
аспарагин,асн,
N,Asn
 глутамин,глн,
Q,Gln
глутамин,глн,
Q,Gln
Нейтральные аминокислоты содержат гидроксильные или карбоксамидные группы. Хотя амидные группы неионогенны, молекулы аспарагина и глута-мина высоко полярны.
5. Кислые аминокислоты:
 аспарагиновая
кислота (аспартат),асп
,D,Asp
аспарагиновая
кислота (аспартат),асп
,D,Asp
 глутаминовая
кислота (глутамат),глу,
E,Glu
глутаминовая
кислота (глутамат),глу,
E,Glu
Карбоксильные группы боковых цепей кислых аминокислот полностью ионизированы во всем диапазоне физиологических значений рН.
6. Основные аминокислоты:
 лизин,
лиз,
K,Lys*
лизин,
лиз,
K,Lys*
 аргинин,арг
,R,Arg
аргинин,арг
,R,Arg
Боковые цепи основных аминокислот полностью протонированы в нейтраль-ной области рН. Сильно основной и очень полярной аминокислотой является аргинин, содержащий гуанидиновую группировку.
7. Иминокислота:
 пролин,про
,P,Pro
пролин,про
,P,Pro
Боковая цепь пролина состоит из пятичленного цикла, включающего α-углеродный атом и α-аминогруппу. Поэтому пролин, строго говоря, является не амино-, а иминокислотой. Атом азота в кольце является слабым основанией и не протонируется при физиологических значениях рН. Благодаря циклической структуре пролин вызывает изгибы полипептидной цепи, что очень существенно для структуры коллагена.
Некоторые из перечисленных аминокислот не могут синтезироваться в организме человека и должны поступать вместе с пищей. Это незаменимые аминокислоты отмечены звездочками.
Как было указано выше, протеиногенные аминокислоты являются предшественниками некоторых ценных биологически активных молекул.
Два биогенных амина β-аланин и цистеамин входят в состав кофермента А (коферменты – производные водорастворимых витаминов, образующие активный центр сложных ферментов). β-Аланин образуется путем декарбоксилирования аспарагиновой кислоты, а цистеамин путем декарбоксилирования цистеина:
β-аланин цистеамин
цистеамин
Остаток глутаминовой кислоты входит в состав другого кофермента – тетрагидрофолиевой кислоты, производного витамина В с.
Другими биологически ценными молекулами являются конъюгаты желчных кислот с аминокислотой глицином. Эти конъюгаты являются более сильными кислотами, чем базовые, образуются в печени и присутствуют в желчи в виде солей.
 гликохолевая
кислота
гликохолевая
кислота
Протеиногенные аминокислоты являются предшественниками некоторых антибиотиков – биологически активных веществ, синтезируемых микроорганизмами и подавляющих размножение бактерий, вирусов и клеток. Наиболее известными из них являются пенициллины и цефалоспорины, составляющие группу β-лактамных антибиотиков и продуцирумые плесенью рода Penicillium . Для них характерно наличие в структуре реакционноспособного β-лактамного кольца, с помощью которого они ингибируют синтез клеточных стенок грамотрицательных микроорганизмов.
 общая
формула пенициллинов
общая
формула пенициллинов
Из аминокислот путем декарбоксилирования получаются биогенные амины – нейромедиаторы, гормоны и гистогормоны.
Аминокислоты глицин и глутамат сами по себе являются нейромедиаторами в центральной нервной системе.


дофамин (нейромедиатор) норадреналин (нейромедиатор)


адреналин (гормон) гистамин (медиатор и гистогормон)

серотонин (нейромедиатор и гистогормон) ГАМК (нейромедиатор)
 тироксин
(гормон)
тироксин
(гормон)
Производным аминокислоты триптофана является наиболее известный из встречающихся в природе ауксин – индолилуксусная кислота. Ауксины – это регуляторы роста растений, они стимулируют дифференцировку растущих тканей, рост камбия, корней, ускоряют рост плодов и опадение старых листьев, их антагонистами является абсцизовая кислота.
 индолилуксусная
кислота
индолилуксусная
кислота
Производными аминокислот также являются алкалоиды – природные азотсодержащие соединения основного характера, образующиеся в расте-ниях. Данные соединения являются исключительно активными физиологическими соединениями, широко используемыми в медицине. Примерами алкалоидов могут служить производное фенилаланина папаверин, изохинолиновый алкалоид мака снотворного (спазмолитик), и производное триптофана физостигмин, индольный алкалоид из калабар-ских бобов (антихолинэстеразный препарат):


папаверин физостигмин
Аминокислоты являются чрезвычайно популярными объектами биотехнологии. Существует множество вариантов химического синтеза аминокислот, однако в результате получаются рацематы аминокислот. Так как для пищевой промышленности и медицины пригодны только L-изомеры аминокислот, рацемические смеси необходимо разделять на энантиомеры, что представляет серьезную проблему. Поэтому более популярен биотехнологический подход: ферментативный синтез с помощью иммобилизированных ферментов и микробиологический синтез с помощью целых микробных клеток. В обоих последних случаях получаются чистые L-изомеры.
Аминокислоты используются как пищевые добавки и компоненты кормов. Глутаминовая кислота усиливает вкус мяса, валин и лейцин улучшают вкус хлебобулочных изделий, глицин и цистеин используются в качестве антиоксидантов при консервировании. D-триптофан может быть заменителем сахара, так как во много раз его слаще. Лизин добавляют в корм сельскохозяйственным животным, так как большинство растительных белков содержит малое количество незаменимой аминокислоты лизина.
Аминокислоты широко используются в медицинской практике. Это такие аминокислоты как метионин, гистидин, глутаминовая и аспарагиновая кислоты, глицин, цистеин, валин.
В последнее десятилетие аминокислоты начали добавлять в космети-ческие средства по уходу за кожей и волосами.
Химически модифицированные аминокислоты также широко используются в промышленности в качестве поверхностно-активных веществ в синтезе полимеров, при производстве моющих средств, эмульгаторов, добавок к топливу.
БЕЛКИ
Белки – это высокомолекулярные вещества, состоящие из аминокислот, соединенных пептидной связью.
Именно белки являются продуктом генетической информации, передаваемой из поколения в поколение, и осуществляют все процессы жизнедеятельности в клетке.
Функции белков:
Каталитическая функция. Наиболее многочисленную группу белков составляют ферменты – белки с каталитической активностью, ускоряющие химические реакции. Примерами ферментов являются пепсин, алкогольдегидрогеназа, глутаминсинтетаза.
Структурообразующая функция. Структурные белки отвечают за поддер-жание формы и стабильности клеток и тканей, к ним относятся кератины, коллаген, фиброин.
Транспортная функция. Транспортные белки переносят молекулы или ионы из одного органа в другой или через мембраны внутри клетки, например, гемоглобин, сывороточный альбумин, ионные каналы.
Защитная функция. Белки системы гомеостаза защищают организм от возбудителей болезней, чужеродной информации, потери крови – иммуноглобулины, фибриноген, тромбин.
Регуляторная функция. Белки осуществляют функции сигнальных веществ – некоторых гормонов, гистогормонов и нейромедиаторов, являются рецепторами к сигнальным веществам любого строения, обеспечивают дальнейшую передачу сигнала в биохимических сигнальных цепях клетки. Примерами могут служить гормон роста соматотропин, гормон инсулин, Н- и М-холинорецепторы.
Двигательная функция. С помощью белков осуществляются процессы сокращения и другого биологического движения. Примерами могут служить тубулин, актин, миозин.
Запасная функция. В растениях содержатся запасные белки, являющиеся ценными пищевыми веществами, в организмах животных мышечные белки служат резервными питательными веществами, которые мобилизуются при крайней необходимости.
Для белков характерным является наличие нескольких уровней структурной организации.
Первичной структурой белка называют последовательность аминокислотных остатков в полипептидной цепи. Пептидная связь – это карбоксамидная связь между α-карбоксильной группой одной аминокислоты и α-аминогруппой другой аминокислоты.
 аланилфенилаланилцистеилпролин
аланилфенилаланилцистеилпролин
У пептидной связи есть несколько особенностей:
а) она резонансно стабилизирована и поэтому находится практически в одной плоскости – планарна; вращение вокруг связи С-N требует больших затрат энергии и затруднено;
б) у связи -CO-NH- особый характер, она меньше, чем обычная, но больше, чем двойная, то есть существует кето-енольная таутомерия:

в) заместители по отношению к пептидной связи находятся в транс -положении;
г) пептидный остов окружен разнообразными по своей природе боковыми цепями, взаимодействуя с окружающими молекулами растворителя, свободные карбоксильные и аминогруппы ионизируются, образуя катионные и анионные центры молекулы белка. В зависимости от их соотношения белковая молекула получает суммарный положительный или отрицательный заряд, а также характеризуется тем или иным значением рН среды при достижении изоэлектрической точки белка. Радикалы образуют солевые, эфирные, дисульфидные мостики внутри молекулы белка, а также определяют круг реакций, свойственных белкам.
В настоящее время условились считать белками полимеры, состоящие из 100 и более аминокислотных остатков, полипептидами – полимеры, состоящие из 50-100 аминокислотных остатков, низкомолекулярными пептидами – полимеры, состоящие из менее 50 аминокислотных остатков.
Некоторые низкомолекулярные пептиды играют самостоятельную биологическую роль. Примеры некоторых таких пептидов:
Глутатион – γ-глу-цис-гли – один из наиболее широко распространен-ных внутриклеточных пептидов, принимает участие в окислительно-восстановительных процессах в клетках и переносе аминокислот через биологические мембраны.
Карнозин – β-ала-гис – пептид, содержащийся в мышцах животных, устраняет продукты перекисного расщепления липидов, ускоряет процесс распада углеводов в мышцах и в виде фосфата вовлекается в энергетический обмен в мышцах.
Вазопрессин – гормон задней доли гипофиза, участвующий в регуля-ции водного обмена организма:

Фаллоидин – ядовитый полипептид мухомора, в ничтожных концентрациях вызывает гибель организма вследствие выхода ферментов и ионов калия из клеток:

Грамицидин – антибиотик, действующий на многие грамположительные бактерии, изменяет проницаемость биологических мембран для низкомолекулярных соединений и вызывает гибель клеток:

Мет -энкефалин – тир-гли-гли-фен-мет – пептид, синтезирующийся в нейронах и ослабляющий болевые ощущения.
Вторичная структура белка – это пространственная структура, образующаяся в результате взаимодействий между функциональными группами пептидного остова.
Пептидная цепь содержит множество СО- и NH-групп пептидных связей, каждая из которых потенциально способна участвовать в образовании водородных связей. Существуют два главных типа структур, которые позволяют это осуществить: α-спираль, в которую цепь свертывается как шнур от телефонной трубки, и складчатая β-структура, в которой бок о бок уложены вытянутые участки одной или нескольких цепей. Обе эти структуры весьма стабильны.
α-Спираль характеризуется предельно плотной упаковкой скрученной полипептидной цепи, на каждый виток правозакрученной спирали приходится 3,6 аминокислотных остатка, радикалы которых направлены всегда наружу и немного назад, то есть в начало полипептидной цепи.
Основные характеристики α-спирали:
α-спираль стабилизируется водородными связями между атомом водорода при азоте пептидной группы и карбонильным кислородом остатка, отстоящего от данного вдоль цепи на четыре позиции;
в образовании водородной связи участвуют все пептидные группы, это обеспечивает максимальную стабильность α-спирали;
в образовании водородных связей вовлечены все атомы азота и кислорода пептидных групп, что в значительной мере снижает гидрофильность α-спиральных областей и увеличивает их гидрофобность;
α-спираль образуется самопроизвольно и является наиболее устойчивой конформацией полипептидной цепи, отвечающей минимуму свободной энергии;
в полипептидной цепи из L-аминокислот правая спираль, обычно обнаруживаемая в белках, намного стабильнее левой.
Возможность образования α-спирали обусловлена первичной структурой белка. Некоторые аминокислоты препятствуют закручиванию пептидного остова. Например, расположенные рядом карбоксильные группы глутамата и аспартата взаимно отталкиваются друг от друга, что препятствует образованию водородных связей в α-спирали. По этой же причине затруднена спирализация цепи в местах близко расположенных друг к другу положительно заряженных остатков лизина и аргинина. Однако наибольшую роль в нарушении α-спирали играет пролин. Во-первых, в пролине атом азота входит в состав жесткого кольца, что препятствует вращению вокруг связи N-C, во-вторых, пролин не образует водородную связь из-за отсутствия водорода при атоме азота.
β-складчатость – это слоистая структура, образуемая водородными связями между линейно расположенными пептидными фрагментами. Обе цепи могут быть независимыми или принадлежать одной молекуле полипептида. Если цепи ориентированы в одном направлении, то такая β-структура называется параллельной. В случае противоположного направления цепей, то есть когда N-конец одной цепи совпадает с С-концом другой цепи, β-структура называется антипараллельной. Энергетически более предпочтительна антипараллельная β-складчатость с почти линейными водородными мостиками.


параллельная β-складчатость антипараллельная β-складчатость
В отличие от α-спирали, насыщенной водородными связями, каждый участок цепи β-складчатости открыт для образования дополнительных водородных связей. Боковые радикалы аминокислот ориентированы почти перпендикулярно плоскости листа попеременно вверх и вниз.
В тех участках, где пептидная цепь изгибается достаточно круто, часто находится β-петля. Это короткий фрагмент, в котором 4 аминокислотных остатка изгибаются на 180 о и стабилизируются одним водородным мостиком между первым и четвертым остатками. Большие аминокислотные радикалы мешают образованию β-петли, поэтому в нее чаще всего входит самая маленькая аминокислота глицин.
Надвторичная структура белка – это некоторый специфический порядок чередования вторичных структур. Под доменом понимают обособленную часть молекулы белка, обладающую в определенной степени структурной и функциональной автономией. Сейчас домены считают фундаментальными элементами структуры белковых молекул и соотношение и характер компоновки α-спиралей и β-слоев дает для понимания эволюции белковых молекул и филогенетических связей больше, чем сопоставление первичных структур. Главной задачей эволюции является конструирование все новых белков. Бесконечно мал шанс случайно синтезировать такую аминокислотную последовательность, которая бы удовлетворила условиям упаковки и обеспечила выполнение функциональных задач. Поэтому часто встречаются белки с различной функцией, но сходные по структуре настолько, что кажется, что они имели одного общего предка или произошли друг от друга. Похоже, что эволюция, столкнувшись с необходимостью решить определенную задачу, предпочитает не конструировать для этого белки сначала, а приспособить для этого уже хорошо отлаженные структуры, адаптируя их для новых целей.
Некоторые примеры часто повторяющихся надвторичных структур:
αα’ – белки, содержащие только α-спирали (миоглобин, гемоглобин);
ββ’ – белки, содержащие только β-структуры (иммуноглобулины, супероксиддисмутаза);
βαβ’ – структура β-бочонка, каждый β-слой расположен внутри бочонка и связан с α-спиралью, находящейся на поверхности молекулы (триозофосфоизомераза, лактатдегидрогеназа);
«цинковый палец» – фрагмент белка, состоящий из 20 аминокислотных остатков, атом цинка связан с двумя остатками цистеина и двумя гистидина, в результате чего образуется «палец» из примерно 12 амино-кислотных остатков, может связываться с регуляторными участками молекулы ДНК;
«лейциновая застежка-молния» – взаимодействующие белки имеют α-спиральный участок, содержащий по крайней мере 4 остатка лейцина, они расположены через 6 аминокислот один от другого, то есть находятся на поверхности каждого второго витка и могут образовывать гидрофобные связи с лейциновыми остатками другого белка. С помощью лейциновых застежек, например, молекулы сильноосновных белков гистонов могут объединяться в комплексы, преодолевая положительный заряд.
Третичная структура белка – это пространственное расположение молекулы белка, стабилизируемое связями между боковыми радикалами аминокислот.
Типы связей, стабилизирующих третичную структуру белка:

электростатическое водородные гидрофобные дисульфидные
взаимодействие связи взаимодействия связи
В зависимости от складывания третичной структуры белки можно классифицировать на два основных типа – фибриллярные и глобулярные.
Фибриллярные белки – нерастворимые в воде длинные нитевидные молекулы, полипептидные цепи которых вытянуты вдоль одной оси. В основном это структурные и сократительные белки. Несколько примеров самых распространенных фибриллярных белков:
α-Кератины. Синтезируются клетками эпидермиса. На их долю приходится почти весь сухой вес волос, шерсти, перьев, рогов, ногтей, когтей, игл, чешуи, копыт и черепашьего панциря, а также значительная часть веса наружного слоя кожи. Это целое семейство белков, они сходны по аминокислотному составу, содержат много остатков цистеина и имеют одинаковое пространственное расположение полипептидных цепей. В клетках волос полипептидные цепи кератина сначала организуются в волокна, из которых затем формируются структуры наподобие каната или скрученного кабеля, заполняющего в конце концов все пространство клетки. Клетки волос становятся при этом уплощенными и, наконец, отмирают, а клеточные стенки образуют вокруг каждого волоса трубчатый чехол, называемый кутикулой. В α-кератине полипептидные цепи имеют форму α-спирали, скручены одна вокруг другой в трехжильный кабель с образованием поперечных дисульфидных связей. N-концевые остатки расположены с одной стороны (параллельны). Кератины нерастворимы в воде из-за преобладания в их составе аминокислот с неполярными боковыми радикалами, которые обращены в сторону водной фазы. При химической завивке происходят следующие процессы: вначале путем восстановления тиолами разрушаются дисульфидные мостики, а затем при придании волосам необходимой формы их высушивают нагреванием, при этом за счет окисления кислородом воздуха образуются новые дисульфидные мостики, которые сохраняют форму прически.
β-Кератины. К ним относятся фиброин шелка и паутины. Представляют из себя антипараллельные β-складчатые слои с преобладанием глицина, аланина и серина в составе.
Коллаген. Самый распространенный белок у высших животных и главный фибриллярный белок соединительных тканей. Коллаген синтезируется в фибробластах и хондроцитах – специализированных клетках соединительной ткани, из которых затем выталкивается. Коллагеновые волокна находятся в коже, сухожилиях, хрящах и костях. Они не растяги-ваются, по прочности превосходят стальную проволоку, коллагеновые фибриллы характеризуются поперечной исчерченностью. При кипячении в воде волокнистый, нерастворимый и неперевариваемый коллаген превращается в желатин в результате гидролиза некоторых ковалентных связей. Коллаген содержит 35% глицина, 11% аланина, 21% пролина и 4-гидроксипролина (аминокислоты, свойственной только для коллагена и эластина). Такой состав определяет относительно низкую питательную ценность желатина как пищевого белка. Фибриллы коллагена состоят из повторяющихся полипептидных субъединиц, называемых тропоколлагеном. Эти субъединицы уложены вдоль фибриллы в виде параллельных пучков по типу «голова к хвосту». Сдвинутость головок и придает характерную поперечную исчерченность. Пустоты в этой структуре при необходимости могут служить местом отложения кристаллов гидроксиапатита Са 5 (ОН)(РО 4) 3 , играющего важную роль в минерализации костей.


Тропоколлагеновые субъединицы состоят из трех полипептидных цепей, плотно скрученных в виде трехжильного каната, отличающегося от α- и β-кератинов. В одних коллагенах все три цепи имеют одинаковую аминокислотную последовательность, тогда как в других идентичны только две цепи, а третья отличается от них. Полипептидная цепь тропоколлагена образует левую спираль, на один виток которой приходится только три аминокислотных остатка из-за изгибов цепи, обусловленной пролином и гидроксипролином. Три цепи связаны между собой кроме водородных связей связью ковалентного типа, образующейся между двумя остатками лизина, находящимися в соседних цепях:

По мере того как мы становимся старше, в тропоколлагеновых субъединицах и между ними образуется все большее число поперечных связей, что делает фибриллы коллагена более жесткими и хрупкими, и это изменяет механические свойства хрящей и сухожилий, делает более ломкими кости и понижает прозрачность роговицы глаза.
Эластин. Содержится в желтой эластичной ткани связок и эластическом слое соединительной ткани в стенках крупных артерий. Основная субъединица фибрилл эластина – тропоэластин. Эластин богат глицином и аланином, содержит много лизина и мало пролина. Спиральные участки эластина растягиваются при натяжении, но возвращаются при снятии нагрузки к исходной длине. Остатки лизина четырех разных цепей образуют ковалентные связи между собой и позволяют эластину обратимо растягиваться во всех направлениях.
Глобулярные белки – белки, полипептидная цепь которых свернута в компактную глобулу, способны выполнять самые разнообразные функции.
Третичную структуру глобулярных белков удобнее всего рассмотреть на примере миоглобина. Миоглобин – это относительно небольшой кислород-связывающий белок, присутствующий в мышечных клетках. Он запасает связанный кислород и способствует его переносу в митохондрии. В молекуле миоглобина находится одна полипептидная цепь и одна гемогруппа (гем) – комплекс протопорфирина с железом. Основные свойства миоглобина:
а) молекула миоглобина настолько компактна, что внутри нее может уместиться всего 4 молекулы воды;
б) все полярные аминокислотные остатки, за исключением двух, расположены на внешней поверхности молекулы, причем все они находятся в гидратированном состоянии;
в) большая часть гидрофобных аминокислотных остатков расположена внутри молекулы миоглобина и, таким образом, защищена от соприкосно-вения с водой;
г) каждый из четырех остатков пролина в молекуле миоглобина находится в месте изгиба полипептидной цепи, в других местах изгиба расположены остатки серина, треонина и аспарагина, так как такие аминокислоты препятствуют образованию α-спирали, если находятся друг с другом;
д) плоская гемогруппа лежит в полости (кармане) вблизи поверхности молекулы, атом железа имеет две координационные связи, направленные перпендикулярно плоскости гемма, одна из них связана с остатком гистидина 93, а другая служит для связывания молекулы кислорода.
Начиная с третичной структуры белок становится способным выполнять свойственные ему биологические функции. В основе функционирования белков лежит то, что при укладке третичной структуры на поверхности белка образуются участки, которые могут присоединять к себе другие молекулы, называемые лигандами. Высокая специфичность взаимодействия белка с лигандом обеспечивается комплементарностью структуры активного центра структуре лиганда. Комплементарность – это пространственное и химическое соответствие взаимодействующих поверхностей. Для большей части белков третичная структура – максимальный уровень укладки.
Четвертичная структура белка – характерна для белков, состоящих из двух и более полипептидных цепей, связанных между собой исключительно нековалентными связями, в основном электростатическими и водородными. Чаще всего белки содержат две или четыре субъединицы, более четырех субъединиц обычно содержат регуляторные белки.
Белки, имеющие четвертичную структуру, часто называются олигомерными. Различают гомомерные и гетеромерные белки. К гомо-мерным относятся белки, у которых все субъединицы имеют одинаковое строение, например, фермент каталаза состоит их четырех абсолютно одинаковых субъединиц. Гетеромерные белки имеют разные субъединицы, например, фермент РНК-полимераза состоит из пяти разных по строению субъединиц, выполняющих разные функции.
Взаимодействие одной субъединицы со специфическим лигандом вызывает конформационные изменения всего олигомерного белка и изменяет сродство других субъединиц к лигандам, это свойство лежит в основе способности олигомерных белков к аллостерической регуляции.
Четвертичную структуру белка можно рассмотреть на примере гемоглобина. Содержит четыре полипептидных цепи и четыре простетические группы гема, в которых атомы железа находятся в закисной форме Fe 2+ . Белковая часть молекулы – глобин – состоит из двух α-цепей и двух β-цепей, содержащих до 70% α-спиралей. Каждая из четырех цепей имеет характерную для нее третичную структуру, с каждой цепью связана одна гемогруппа. Гемы разных цепей сравнительно далеко расположены друг от друга и имеют разный угол наклона. Между двумя α-цепями и двумя β-цепями образуется мало прямых контактов, тогда как между α- и β-цепями возникают многочисленные контакты типа α 1 β 1 и α 2 β 2 , образованные гидрофобными радикалами. Между α 1 β 1 и α 2 β 2 остается канал.
В отличие от миоглобина гемоглобин характеризуется значительно более низким сродством к кислороду, что позволяет ему при существующих в тканях низких парциальных давлениях кислорода отдавать им значительную часть связанного кислорода. Кислород легче связывается железом гемоглобина при более высоких значениях рН и низкой концентрации СО 2 , свойственные альвеолам легких; освобождению кислорода из гемоглобина благоприятствуют более низкие значения рН и высокие концентрации СО 2 , свойственные тканям.
Кроме кислорода гемоглобин переносит ионы водорода, которые связываются с остатками гистидина в цепях. Также гемоглобин переносит углекислый газ, который присоединяет к концевой аминогруппе каждой из четырех полипептидных цепей, в результате чего образуется карбаминогемоглобин:

В эритроцитах в достаточно больших концентрациях присутствует вещество 2,3-дифосфоглицерат (ДФГ), его содержание увеличивается при подъеме на большую высоту и при гипоксии, облегчая высвобождение кислорода из гемоглобина в тканях. ДФГ располагается в канале между α 1 β 1 и α 2 β 2 , взаимодействуя с положительно зараженными группами β-цепей. При связывании гемоглобином кислорода ДФГ вытесняется из полости. В эритроцитах некоторых птиц содержится не ДФГ, а инозитолгекса-фосфат, который еще больше снижает сродство гемоглобина к кислороду.
 2,3-дифосфоглицерат
(ДФГ)
2,3-дифосфоглицерат
(ДФГ)
HbA – нормальный гемоглобин взрослого человека, HbF – фетальный гемоглобин, имеет большее сродство к О 2 , HbS – гемоглобин при серповидноклеточной анемии. Серповидноклеточная анемия – это серьезное наследственное заболевание, связанное с генетической аномалией гемоглобина. В крови больных людей наблюдается необычно большое количество тонких серповидных эритроцитов, которые, во-первых, легко разрываются, во-вторых, закупоривают кровеносные капилляры. На молеку-лярном уровне гемоглобин S отличается от гемоглобина А по одному аминокислотному остатку в положении 6 β-цепей, где вместо остатка глутаминовой кислоты находится валин. Таким образом, гемоглобин S содержит на два отрицательных заряда меньше, появление валина приводит к возникновению «липкого» гидрофобного контакта на поверхности молекулы, в результате при дезоксигенации молекулы дезоксигемоглобина S слипаются и образуют нерастворимые аномально длинные нитевидные агрегаты, приводящие к деформации эритроцитов.
Нет никаких оснований думать, что существует независимый генетический контроль за формированием уровней структурной организации белка выше первичного, поскольку первичная структура определяет и вторичную, и третичную, и четвертичную (если она имеется). Нативной конформацией белка является термодинамически наиболее устойчивая в данных условиях структура.
Белки составляют материальную основу химической деятельности клетки. Функции белков в природе универсальны. Названию белки, наиболее принятому в отечественной литературе, соответствует термин протеины (от греч. proteios - первый). К настоящему времени достигнуты большие успехи в установлении соотношения структуры и функций белков, механизма их участия в важнейших процессах жизнедеятельности организма и в понимании молекулярных основ патогенеза многих болезней.
В зависимости от молекулярной массы различают пептиды и белки. Пептиды имеют меньшую молекулярную массу, чем белки. Для пептидов более свойственна регуляторная функция (гормоны, ингибиторы и активаторы ферментов, переносчики ионов через мембраны, антибиотики, токсины и др.).
12.1. α -Аминокислоты
12.1.1. Классификация
Пептиды и белки построены из остатков α-аминокислот. Общее число встречающихся в природе аминокислот превышает 100, но некоторые из них обнаружены лишь в определенном сообществе орга- низмов, 20 наиболее важных α-аминокислот постоянно встречаются во всех белках (схема 12.1).
α-Аминокислоты - гетерофункциональные соединения, молекулы которых содержат одновременно аминогруппу и карбоксильную группу у одного и того же атома углерода.
Схема 12.1. Важнейшие α-аминокислоты*

* Сокращенные обозначения применяются только для записи аминокислотных остатков в молекулах пептидов и белков. ** Незаменимые аминокислоты.
Названия α-аминокислот могут быть построены по заместительной номенклатуре, но чаще используются их тривиальные названия.

Тривиальные названия α-аминокислот обычно связаны с источниками выделения. Серин входит в состав фиброина шелка (от лат. serieus - шелковистый); тирозин впервые выделен из сыра (от греч. tyros - сыр); глутамин - из злаковой клейковины (от нем. Gluten - клей); аспарагиновая кислота - из ростков спаржи (от лат. asparagus - спаржа).
Многие α-аминокислоты синтезируются в организме. Некоторые аминокислоты, необходимые для синтеза белков, в организме не образуются и должны поступать извне. Такие аминокислоты называют незаменимыми (см. схему 12.1).
К незаменимым α-аминокислотам относятся:
валин изолейцин метионин триптофан
лейцин лизин треонин фенилаланин
α-Аминокислоты классифицируют несколькими способами в зависимости от признака, положенного в основу их деления на группы.
Одним из классификационных признаков служит химическая природа радикала R. По этому признаку аминокислоты делятся на алифатические, ароматические и гетероциклические (см. схему 12.1).
Алифатические α-аминокислоты. Это наиболее многочисленная группа. Внутри нее аминокислоты подразделяют с привлечением дополнительных классификационных признаков.
В зависимости от числа карбоксильных групп и аминогрупп в молекуле выделяют:
Нейтральные аминокислоты - по одной группе NH 2 и СООН;
Основные аминокислоты - две группы NH 2 и одна группа
СООН;
Кислые аминокислоты - одна группа NH 2 и две группы СООН.
Можно отметить, что в группе алифатических нейтральных аминокислот число атомов углерода в цепи не бывает больше шести. При этом не существует аминокислоты с четырьмя атомами углерода в цепи, а аминокисоты с пятью и шестью атомами углерода имеют только разветвленное строение (валин, лейцин, изолейцин).
В алифатическом радикале могут содержаться «дополнительные» функциональные группы:
Гидроксильная - серин, треонин;
Карбоксильная - аспарагиновая и глутаминовая кислоты;
Тиольная - цистеин;
Амидная - аспарагин, глутамин.
Ароматические α-аминокислоты. К этой группе относятся фенилаланин и тирозин, построенные таким образом, что бензольные кольца в них отделены от общего α-аминокислотного фрагмента метиленовой группой -СН 2-.

Гетероциклические α-аминокислоты. Относящиеся к этой группе гистидин и триптофан содержат гетероциклы - имидазол и индол соответственно. Строение и свойства этих гетероциклов рассмотрены ниже (см. 13.3.1; 13.3.2). Общий принцип построения гетероциклических аминокислот такой же, как и ароматических.
Гетероциклические и ароматические α-аминокислоты можно рассматривать как β-замещенные производные аланина.

К героциклическим относится также аминокислота пролин, в которой вторичная аминогруппа включена в состав пирролидинового

В химии α-аминокислот большое внимание уделяется строению и свойствам «боковых» радикалов R, которые играют важную роль в формировании структуры белков и выполнении ими биологических функций. Большое значение имеют такие характеристики, как полярность «боковых» радикалов, наличие в радикалах функциональных групп и способность этих функциональных групп к ионизации.
В зависимости от бокового радикала выделяют аминокислоты с неполярными (гидрофобными) радикалами и аминокислоты c поляр- ными (гидрофильными) радикалами.
К первой группе относятся аминокислоты с алифатическими боковыми радикалами - аланин, валин, лейцин, изолейцин, метионин - и ароматическими боковыми радикалами - фенилаланин, триптофан.
Ко второй группе принадлежат аминокислоты, у которых в радикале имеются полярные функциональные группы, способные к иони- зации (ионогенные) или не способные переходить в ионное состояние (неионогенные) в условиях организма. Например, в тирозине гидроксильная группа ионогенная (имеет фенольный характер), в серине - неионогенная (имеет спиртовую природу).

Полярные аминокислоты с ионогенными группами в радикалах в определенных условиях могут находиться в ионном (анионном или катионном) состоянии.

12.1.2. Стереоизомерия
Основной тип построения α-аминокислот, т. е. связь одного и того же атома углерода с двумя разными функциональными группами, радикалом и атомом водорода, уже сам по себе предопределяет хираль- ность α-атома углерода. Исключение составляет простейшая аминокислота глицин H 2 NCH 2 COOH, не имеющая центра хиральности.
Конфигурация α-аминокислот определяется по конфигурационному стандарту - глицериновому альдегиду. Расположение в стандартной проекционной формуле Фишера аминогруппы слева (подобно группе ОН в l-глицериновом альдегиде) соответствует l-конфи- гурации, справа - d-конфигурации хирального атома углерода. По R, S-системе α-атом углерода у всех α-аминокислот l-ряда имеет S-, а у d-ряда - R-конфигурацию (исключение составляет цистеин, см. 7.1.2).
Большинство α-аминокислот содержит в молекуле один асимметрический атом углерода и существует в виде двух оптически активных энантиомеров и одного оптически неактивного рацемата. Почти все природные α-аминокислоты принадлежат к l-ряду.

Аминокислоты изолейцин, треонин и 4-гидроксипролин содержат в молекуле по два центра хиральности.

Такие аминокислоты могут существовать в виде четырех стереоизомеров, представляющих собой две пары энантиомеров, каждая из которых образует рацемат. Для построения белков животных организмов используется только один из энантиомеров.
Стереоизомерия изолейцина аналогична рассмотренной ранее стереоизомерии треонина (см. 7.1.3). Из четырех стереоизомеров в состав белков входит l-изолейцин с S-конфигурацией обоих асимметрических атомов углерода С-α и С-β. В названиях другой пары энантиомеров, являющихся диастереомерами по отношению к лейцину, используется приставка алло-.

Расщепление рацематов. Источником получения α-аминокислот l-ряда служат белки, которые подвергают для этого гидролитическому расщеплению. В связи с большой потребностью в отдельных энантиомерах (для синтеза белков, лекарственных веществ и т. п.) разработаны химические методы расщепления синтетических рацемических аминокислот. Предпочтителен ферментативный способ расщепления с использованием ферментов. В настоящее время для разделения рацемических смесей используют хроматографию на хиральных сорбентах.
12.1.3. Кислотно-основные свойства
Амфотерность аминокислот обусловлена кислотными (СООН) и основными (NH 2) функциональными группами в их молекулах. Аминокислоты образуют соли как со щелочами, так и с кислотами.
В кристаллическом состоянии α-аминокислоты существуют как диполярные ионы H3N+ - CHR-COO- (обычно используемая запись
строения аминокислоты в неионизированной форме служит лишь для удобства).
В водном растворе аминокислоты существуют в виде равновесной смеси диполярного иона, катионной и анионной форм.

Положение равновесия зависит от рН среды. У всех аминокислот преобладают катионные формы в сильнокислых (рН 1-2) и анион- ные - в сильнощелочных (рН >11) средах.
Ионное строение обусловливает ряд специфических свойств аминокислот: высокую температуру плавления (выше 200 ?С), растворимость в воде и нерастворимость в неполярных органических растворителях. Способность большинства аминокислот хорошо растворяться в воде является важным фактором обеспечения их биологического функционирования, с нею связаны всасывание аминокислот, их транспорт в организме и т. п.
Полностью протонированная аминокислота (катионная форма) с позиций теории Брёнстеда является двухосновной кислотой,
Отдавая один протон, такая двухосновная кислота превращается в слабую одноосновную кислоту - диполярный ион с одной кислотной группой NH 3 + . Депротонирование диполярного иона приводит к получению анионной формы аминокислоты - карбоксилат-иона, являющегося основанием Брёнстеда. Значения характеризую-
щие кислотные свойства карбоксильной группы аминокислот, обычно лежат в интервале от 1 до 3; значения рK а2 характеризующие кислотность аммониевой группы, - от 9 до 10 (табл. 12.1).
Таблица 12.1. Кислотно-основные свойства важнейших α-аминокислот

Положение равновесия, т. е. соотношение различных форм аминокислоты, в водном растворе при определенных значениях рН существенно зависит от строения радикала, главным образом от присутствия в нем ионогенных групп, играющих роль дополнительных кислотных и основных центров.
Значение рН, при котором концентрация диполярных ионов максимальна, а минимальные концентрации катионных и анионных форм аминокислоты равны, называется изоэлектрической точкой (p/).
Нейтральные α-аминокислоты. Эти аминокислоты имеют значения рI несколько ниже 7 (5,5-6,3) вследствие большей способности к ионизации карбоксильной группы под влиянием -/-эффекта группы NH 2 . Например, у аланина изоэлектрическая точка находится при рН 6,0.

Кислые α-аминокислоты. Эти аминокислоты имеют в радикале дополнительную карбоксильную группу и в сильнокислой среде находятся в полностью протонированной форме. Кислые аминокислоты являются трехосновными (по Брёндстеду) с тремя значениями рК а, как это видно на примере аспарагиновой кислоты (р/ 3,0).

У кислых аминокислот (аспарагиновой и глутаминовой) изоэлектрическая точка находится при рН много ниже 7 (см. табл. 12.1). В организме при физиологических значениях рН (например, рН крови 7,3-7,5) эти кислоты находятся в анионной форме, так как у них ионизированы обе карбоксильные группы.
Основные α-аминокислоты. В случае основных аминокислот изоэлектрические точки находятся в области рН выше 7. В сильно- кислой среде эти соединения также представляют собой трехосновные кислоты, этапы ионизации которых показаны на примере лизина (р/ 9,8).

В организме основные аминокислоты находятся в виде катионов, т. е. у них протонированы обе аминогруппы.
В целом ни одна α -аминокислота in vivo не находится в своей изоэлектрической точке и не попадает в состояние, отвечающее наименьшей растворимости в воде. Все аминокислоты в организме находятся в ионной форме.
12.1.4. Аналитически важные реакции α -аминокислот
α-Аминокислоты как гетерофункциональные соединения вступают в реакции, характерные как для карбоксильной, так и для аминогруппы. Некоторые химические свойства аминокислот обусловлены функциональными группами в радикале. В настоящем разделе рассматриваются реакции, имеющие практическое значение для идентификации и анализа аминокислот.
Этерификация. При взаимодействии аминокислот со спиртами в присутствии кислотного катализатора (например, газообразный хлороводород) с хорошим выходом получаются сложные эфиры в виде гидрохлоридов. Для выделения свободных эфиров реакционную смесь обрабатывают газообразным аммиаком.

Сложные эфиры аминокислот не имеют диполярного строения, поэтому, в отличие от исходных кислот, они растворяются в органических растворителях и обладают летучестью. Так, глицин - крис- таллическое вещество с высокой температурой плавления (292 ?С), а его метиловый эфир - жидкость с температурой кипения 130 ?С. Анализ эфиров аминокислот можно проводить с помощью газожидкостной хроматографии.
Реакция с формальдегидом. Практическое значение имеет реакция с формальдегидом, которая лежит в основе количественного определения аминокислот методом формольного титрования (метод Сёренсена).
Амфотерность аминокислот не позволяет проводить непосредственно титрование их щелочью в аналитических целях. При взаимодействии аминокислот с формальдегидом получаются относительно устойчивые аминоспирты (см. 5.3) - N-гидроксиметильные производные, свободную карбоксильную группу которых затем титруют щелочью.
Качественные реакции. Особенность химии аминокислот и белков заключается в использовании многочисленных качественных (цветных) реакций, составлявших ранее основу химического анализа. В настоящее время, когда исследования проводятся с помощью физико-химических методов, многие качественные реакции продолжают применять для обнаружения α-аминокислот, например, в хроматографическом анализе.
Хелатообразование. С катионами тяжелых металлов α-аминокислоты как бифункциональные соединения образуют внутрикомплексные соли, например, со свежеприготовленным гидроксидом меди(11) в мягких условиях получаются хорошо кристаллизующиеся хелатные
соли меди(11) синего цвета (один из неспецифических способов обнаружения α-аминокислот).

Нингидринная реакция. Общая качественная реакция α-аминокислот - реакция с нингидрином. Продукт реакции имеет синефиолетовый цвет, что используется для визуального обнаружения аминокислот на хроматограммах (на бумаге, в тонком слое), а также для спектрофотометрического определения на аминокислотных анализаторах (продукт поглощает свет в области 550-570 нм).

Дезаминирование. В лабораторных условиях эта реакция осуществляется при действии азотистой кислоты на α-аминокислоты (см. 4.3). При этом образуется соответствующая α-гидроксикислота и выделяется газообразный азот, по объему которого судят о количестве вступившей в реакцию аминокислоты (метод Ван-Слайка).
Ксантопротеиновая реакция. Эта реакция используется для обнаружения ароматических и гетероциклических аминокислот - фенилаланина, тирозина, гистидина, триптофана. Например, при действии концентрированной азотной кислоты на тирозин образуется нитропроизводное, окрашенное в желтый цвет. В щелочной среде окраска становится оранжевой в связи с ионизацией фенольной гидроксильной группы и увеличением вклада аниона в сопряжение.

Существует также ряд частных реакций, позволяющих обнаруживать отдельные аминокислоты.
Триптофан обнаруживают при помощи реакции с п-(диметиламино)бензальдегидом в среде серной кислоты по появляющемуся красно-фиолетовому окрашиванию (реакция Эрлиха). Эта реакция используется для количественного анализа триптофана в продуктах расщепления белков.
Цистеин обнаруживают с помощью нескольких качественных реакций, основанных на реакционной способности содержащейся в нем меркаптогруппы. Например, при нагревании раствора белка с ацетатом свинца (СНзСОО)2РЬ в щелочной среде образуется черный осадок сульфида свинца PbS, что указывает на присутствие в белках цистеина.
12.1.5. Биологически важные химические реакции
В организме под действием различных ферментов осуществляется ряд важных химических превращений аминокислот. К таким пре- вращениям относятся трансаминирование, декарбоксилирование, элиминирование, альдольное расщепление, окислительное дезаминирование, окисление тиольных групп.
Трансаминирование является основным путем биосинтеза α-ами- нокислот из α-оксокислот. Донором аминогруппы служит аминокислота, имеющаяся в клетках в достаточном количестве или избытке, а ее акцептором - α-оксокислота. Аминокислота при этом превращается в оксокислоту, а оксокислота - в аминокислоту с соответствующим строением радикалов. В итоге трансаминирование представляет обратимый процесс взаимообмена амино- и оксо- групп. Пример такой реакции - получение l-глутаминовой кислоты из 2-оксоглутаровой кислоты. Донорной аминокислотой может служить, например, l-аспарагиновая кислота.

α-Аминокислоты содержат в α-положении к карбоксильной группе электроноакцепторную аминогруппу (точнее, протонированную аминогруппу NH 3 +), в связи с чем способны к декарбоксилированию.
Элиминирование свойственно аминокислотам, у которых в боковом радикале в β-положении к карбоксильной группе содержится электроноакцепторная функциональная группа, например гидроксильная или тиольная. Их отщепление приводит к промежуточным реакционноспособным α-енаминокислотам, легко переходящим в таутомерные иминокислоты (аналогия с кето-енольной таутомерией). α-Иминокислоты в результате гидратации по связи C=N и последующего отщепления молекулы аммиака превращаются в α-оксокислоты.

Такой тип превращений имеет название элиминирование-гидратация. Примером служит получение пировиноградной кислоты из серина.
Альдольное расщепление происходит в случае α-аминокислот, у которых в β-положении содержится гидроксильная группа. Например, серин расщепляется с образованием глицина и формальдегида (последний не выделяется в свободном виде, а сразу связывается с коферментом).
Окислительное дезаминирование может осуществляться с участием ферментов и кофермента НАД+ или НАДФ+ (см. 14.3). α-Аминокислоты могут превращаться в α-оксокислоты не только через трансаминирование, но и путем окислительного дезаминирования. Например, из l-глутаминовой кислоты образуется α-оксоглутаровая кислота. На первой стадии реакции осуществляется дегид- рирование (окисление) глутаминовой кислоты до α-иминоглутаровой
кислоты. На второй стадии происходит гидролиз, в результате которого получаются α-оксоглутаровая кислота и аммиак. Стадия гидролиза протекает без участия фермента.

В обратном направлении протекает реакция восстановительного аминирования α-оксокислот. Всегда содержащаяся в клетках α-оксоглутаровая кислота (как продукт метаболизма углеводов) превращается этим путем в L-глутаминовую кислоту.
Окисление тиольных групп лежит в основе взаимопревращений цистеиновых и цистиновых остатков, обеспечивающих ряд окислительно-восстановительных процессов в клетке. Цистеин, как и все тиолы (см. 4.1.2), легко окисляется с образованием дисульфида - цистина. Дисульфидная связь в цистине легко восстанавливается с образованием цистеина.

Благодаря способности тиольной группы к легкому окислению цистеин выполняет защитную функцию при воздействии на орга- низм веществ с высокой окислительной способностью. Кроме того, он был первым лекарственным средством, проявившим противолучевое действие. Цистеин используется в фармацевтической практике в качестве стабилизатора лекарственных препаратов.
Превращение цистеина в цистин приводит к образованию дисульфидных связей, например, в восстановленном глутатионе
(см. 12.2.3).
12.2. Первичная структура пептидов и белков
Условно считают, что пептиды содержат в молекуле до 100 (что соответствует молекулярной массе до 10 тыс.), а белки - более 100 аминокислотных остатков (молекулярная масса от 10 тыс. до нескольких миллионов).
В свою очередь, в группе пептидов принято различать олигопептиды (низкомолекулярные пептиды), содержащие в цепи не более 10 аминокислотных остатков, и полипептиды, в состав цепи которых входит до 100 аминокислотных остатков. Макромолекулы с числом аминокислотных остатков, приближающимся или немного превышающим 100, не разграничивают по понятиям полипептиды и белки, эти термины часто используют как синонимы.
Пептидную и белковую молекулу формально можно представить как продукт поликонденсации α-аминокислот, протекающей с обра- зованием пептидной (амидной) связи между мономерными звеньями (схема 12.2).
Конструкция полиамидной цепи одинакова для всего многообразия пептидов и белков. Эта цепь имеет неразветвленное строение и состоит из чередующихся пептидных (амидных) групп -СО-NH- и фрагментов -CH(R)-.
Один конец цепи, на котором находится аминокислота со свободной группой NH 2, называют N-концом, другой - С-концом,
Схема 12.2. Принцип построения пептидной цепи

на котором находится аминокислота со свободной группой СООН. Пептидные и белковые цепи записывают с N-конца.
12.2.1. Строение пептидной группы
В пептидной (амидной) группе -СО-NH- атом углерода находится в состоянии sp2-гибридизации. Неподеленная пара электронов атома азота вступает в сопряжение с π-электронами двойной связи С=О. С позиций электронного строения пептидная группа представляет собой трехцентровую p,π-сопряженную систему (см. 2.3.1), электронная плотность в которой смещена в сторону более электроотрицательного атома кислорода. Атомы С, Ои N, образующие сопряженную систему, находятся в одной плоскости. Распределение электронной плотности в амидной группе можно представить с по- мощью граничных структур (I) и (II) или смещения электронной плотности в результате +M- и - M-эффектов групп NH и C=O соответственно (III).

В результате сопряжения происходит некоторое выравнивание длин связей. Двойная связь С=О удлиняется до 0,124 нм против обычной длины 0,121 нм, а связь С-N становится короче - 0,132 нм по сравнению с 0,147 нм в обычном случае (рис. 12.1). Плоская сопряженная система в пептидной группе служит причиной затруднения вращения вокруг связи С-N (барьер вращения составляет 63-84 кДж/моль). Таким образом, электронное строение предопре- деляет достаточно жесткую плоскую структуру пептидной группы.
Как видно из рис. 12.1, α-атомы углерода аминокислотных остатков располагаются в плоскости пептидной группы по разные стороны от связи С-N, т. е. в более выгодном тpанс-положении: боковые радикалы R аминокислотных остатков в этом случае будут наиболее удалены друг от друга в пространстве.
Полипептидная цепь имеет удивительно однотипное строение и может быть представлена в виде ряда расположенных под углом друг

Рис. 12.1. Плоскостное расположение пептидной группы -CO-NH- и α-атомов углерода аминокислотных остатков
к другу плоскостей пептидных групп, соединенных между собой через α-атомы углерода связями Сα-N и Сα-Сsp 2 (рис. 12.2). Вращение вокруг этих одинарных связей весьма ограничено вследствие затруднений в пространственном размещении боковых радикалов аминокислотных остатков. Таким образом, электронное и пространственное строение пептидной группы во многом предопределяет структуру полипептидной цепи в целом.

Рис. 12.2. Взаимное положение плоскостей пептидных групп в полипептидной цепи
12.2.2. Состав и аминокислотная последовательность
При единообразно построенной полиамидной цепи специфичность пептидов и белков определяется двумя важнейшими характе- ристиками - аминокислотным составом и аминокислотной последовательностью.
Аминокислотный состав пептидов и белков - это природа и количественное соотношение входящих в них α-аминокислот.
Аминокислотный состав устанавливается путем анализа пептидных и белковых гидролизатов в основном хроматографическими методами. В настоящее время такой анализ осуществляется с помощью аминокислотных анализаторов.
Амидные связи способны гидролизоваться как в кислой, так и щелочной среде (см. 8.3.3). Пептиды и белки гидролизуются с образованием либо более коротких цепей - это так называемый частичный гидролиз, либо смеси аминокислот (в ионной форме) - полный гидролиз. Обычно гидролиз осуществляют в кислой среде, так как в условиях щелочного гидролиза многие аминокислоты неустойчивы. Следует отметить, что гидролизу подвергаются также амидные группы аспарагина и глутамина.

Первичная структура пептидов и белков - это аминокислотная последовательность, т. е. порядок чередования α-аминокислотных остатков.
Первичную структуру определяют путем последовательного отщепления аминокислот с какого-либо конца цепи и их идентификации.
12.2.3. Строение и номенклатура пептидов
Названия пептидов строят путем последовательного перечисления аминокислотных остатков, начиная с N-конца, с добавлением суффикса -ил, кроме последней С-концевой аминокислоты, для которой сохраняется ее полное название. Другими словами, названия
аминокислот, вступивших в образование пептидной связи за счет «своей» группы СООН, оканчиваются в названии пептида на -ил: аланил, валил и т. п. (для остатков аспарагиновой и глутаминовой кислот используют названия «аспартил» и «глутамил» соответствен- но). Названия и символы аминокислот означают их принадлежность к l -ряду, если не указано иное (d или dl ).

Иногда в сокращенной записи символами Н (как часть аминогруппы) и ОН (как часть карбоксильной группы) уточняется незамещенность функциональных групп концевых аминокислот. Этим способом удобно изображать функциональные производные пептидов; например, амид приведенного выше пептида по С-концевой аминокислоте записывается Н-Asn-Gly-Phe-NH2.
Пептиды содержатся во всех организмах. В отличие от белков они имеют более разнородный аминокислотный состав, в частнос- ти, довольно часто включают аминокислоты d -ряда. В структурном отношении они также более разнообразны: содержат циклические фрагменты, разветвленные цепи и т. д.
Один из наиболее распространенных представителей трипептидов - глутатион - содержится в организме всех животных, в растениях и бактериях.

Цистеин в составе глутатиона обусловливает возможность существования глутатиона как в восстановленной, так и окисленной форме.

Глутатион участвует в ряде окислительно-восстановительных процессов. Он выполняет функцию протектора белков, т. е. вещества, предохраняющего белки со свободными тиольными группами SH от окисления с образованием дисульфидных связей -S-S-. Это касается тех белков, для которых такой процесс нежелателен. Глутатион в этих случаях принимает на себя действие окислителя и таким образом «защищает» белок. При окислении глутатиона происходит межмолекулярное сшивание двух трипептидных фрагментов за счет дисульфидной связи. Процесс обратим.
12.3. Вторичная структура полипептидов и белков
Для высокомолекулярных полипептидов и белков наряду с первичной структурой характерны и более высокие уровни организа- ции, которые называют вторичной, третичной и четвертичной струк- турами.
Вторичная структура описывается пространственной ориентацией основной полипептидной цепи, третичная - трехмерной архитектурой всей белковой молекулы. Как вторичная, так и третичная структура связана с упорядоченным расположением макромолекулярной цепи в пространстве. Третичная и четвертичная структура белков рассматривается в курсе биохимии.
Расчетным путем было показано, что для полипептидной цепи одной из наиболее выгодных конформаций является расположение в пространстве в виде правозакрученной спирали, названной α-спиралью (рис. 12.3, а).
Пространственное расположение α-спирализованной полипептидной цепи можно представить, вообразив, что она обвивает некий

Рис. 12.3. α-Спиральная конформация полипептидной цепи
цилиндр (см. рис. 12.3, б). На один виток спирали в среднем приходится 3,6 аминокислотного остатка, шаг спирали составляет 0,54 нм, диаметр - 0,5 нм. Плоскости двух соседних пептидных групп располагаются при этом под углом 108?, а боковые радикалы аминокислот находятся на наружной стороне спирали, т. е. направлены как бы от поверхности цилиндра.
Основную роль в закреплении такой конформации цепи играют водородные связи, которые в α-спирали образуются между кар- бонильным атомом кислорода каждого первого и атомом водорода NН-группы каждого пятого аминокислотного остатка.

Водородные связи направлены почти параллельно оси α-спирали. Они удерживают цепь в закрученном состоянии.
Обычно белковые цепи спирализованы не полностью, а лишь частично. В таких белках, как миоглобин и гемоглобин, содержатся довольно длинные α-спиральные участки, например цепь миоглобина
спирализована на 75%. Во многих других белках доля спиральных участков в цепи может быть небольшой.
Другим видом вторичной структуры полипептидов и белков является β-структура, называемая также складчатым листом, или складчатым слоем. В складчатые листы укладываются вытянутые полипептидные цепи, связываемые множеством водородных связей между пептидными группами этих цепей (рис. 12.4). Во многих белках одновременно содержатся α-спиральные и β-складчатые структуры.

Рис. 12.4. Вторичная структура полипептидной цепи в виде складчатого листа (β-структура)
В кислой среде α-аминокислоты выступают как основания (по аминогруппе), а в щелочной - как кислоты (по карбоксильной группе). У некоторых аминокислот может ионизироваться также радикал (R), в связи, с чем все аминокислоты можно разделить на заряженные и незаряженные (при физиологическом значении рН=6,0 - 8,0) (см. табл. 4). В качестве примера первых можно привести аспарагиновую кислоту и лизин:
Если радикалы аминокислот нейтральные, то они не оказывают влияния на диссоциацию α-карбоксильной или α-аминогруппы, и величинырК (отрицательный логарифм, показывающий значение рН, при котором эти группы наполовину диссоциированы) остаются относительно постоянными.
Величины рК для α-карбоксилыюй (pK 1) и α-аминогруппы (рК 2) сильно различаются. При рН < pK 1 почти все молекулы аминокислоты протежированы и заряжены положительно. Напротив, при рН > рК 2 практически все молекулы аминокислоты являются отрицательно заряженными, так как α-карбоксильная группа находится в диссоциированном состоянии.
Следовательно, в зависимости от рН среды аминокислоты имеют суммарный нулевой положительный или отрицательный заряд. Значение рН, при котором суммарный заряд молекулы равен нулю, и она не перемещается в электрическом поле ни к катоду, ни к аноду, называется изоэлектрической точкой и обозначается pI.
Для нейтральных α-аминокислот значение pI находят как среднее арифметическое между двумя значениями рК:
![]()
При рН раствора меньше pI аминокислоты протонируются и, заряжаясь положительно, перемещаются в электрическом поле к катоду. Обратная картина наблюдается при рН > pI.
Для аминокислот, содержащих заряженные (кислотные или основные) радикалы, изоэлектрическая точка зависит от кислотности или основности этих радикалов и их рК (рК 3). Значение pI для них находят по следующим формулам:
для кислых аминокислот:
![]()
для основных аминокислот:
![]()
В клетках и межклеточной жидкости организма человека и животных рН среды близко к нейтральному, поэтому основные аминокислоты (лизин, аргинин) имеют положительный заряд (катионы), кислые аминокислоты (аспарагиновая, глутаминовая) имеют отрицательный заряд (анионы), а остальные существуют в виде биполярного цвиттер-иона.
Стереохимия аминокислот
Важной особенностью белковых α-аминокислот является их оптическая активность. За исключением глицина все они построены асимметрично, в связи с чем, будучи растворены в воде или в соляной кислоте, способны вращать плоскость поляризации света. Аминокислоты существуют в виде пространственных изомеров, относящихся к D- или L-ряду. L- или D-конфигурация определяется типом строения соединения относительно асимметрического атома углерода (атом углерода, связанный с четырьмя различными атомами или группами атомов). В формулах асимметрический атом углерода обозначают звездочкой. На рис.3 показаны проекционные модели L- и D- конфигураций аминокислот, которые являются как бы зеркальным отображением друг друга. Все 18 оптически активных белковых аминокислот относятся к L -ряду. Однако в клетках многих микроорганизмов и в антибиотиках, продуцируемых некоторыми из них, обнаружены D-аминокислоты.

Рис. 3. Конфигурация L- и D- аминокислот
Строение белков
Исходя из результатов изучения продуктов гидролиза белков и выдвинутых А.Я. Данилевским идей о роли пептидных связей -CO-NH- в построении белковой молекулы, немецкий ученый Э.Фишер предложил в начале XX века пептидную теорию строения белков. Согласно этой теории, белки представляют собой линейные полимеры α-аминокислот, связанных пептиднойсвязью - полипептиды:

В каждом пептиде один концевой аминокислотный остаток имеет свободную α-аминогруппу (N-конец), а другой - свободную α-карбоксильную группу (С-конец). Структуру пептидов принято изображать, начиная с N-концевой аминокислоты. При этом аминокислотные остатки обозначаются символами. Например: Ala-Tyr-Leu-Ser-Tyr- - Cys. Этой записью обозначен пептид, в котором N-концевой α-аминокислотой яв ляется аланин, а С-концевой - цистеин. При чтении такой записи окончания названий всех кислот, кроме последних меняются на - "ил": аланил-тирозил-лейцил-серил-тирозил- -цистеин. Длина пептидной цепи в пептидах и белках, встречающихся в организме, колеблется от двух до сотен и тысяч аминокислотных остатков.
Для определения аминокислотного состава белки (пептиды) подвергают гидролизу:

В нейтральной среде эта реакция протекает очень медленно, но ускоряется в присутствии кислот или щелочей. Обычно гидролиз белков проводят в запаянной ампуле в 6М растворе соляной кислоты при 105 °С; в таких условиях полный распад происходит примерно за сутки. В некоторых случаях белок гидролизуют в более мягких условиях (при температуре 37-40 °С) под действием биологических катализаторов-ферментов в течение нескольких часов.
Затем аминокислоты гидролизата разделяют методом хроматографии на ионообменных смолах (сульфополистирольный катионит), выделяя отдельно фракцию каждой аминокислоты. Для вымывания аминокислот с ионнообменной колонки используют буферы с возрастающим значением рН. Первым снимается аспартат, имеющий кислотную боковую цепь; аргинин с основной боковой цепью вымывается последним. Последовательность снятия аминокислот с колонки определяют по профилю вымывания стандартных аминокислот. Фракционированные аминокислоты определяют по окраске, образующейся при нагревании с нингидрином:

В этой реакции бесцветный нингидрин превращается; в синефиолетовый продукт, интенсивность окраски которого (при 570 нм) пропорциональна количеству аминокислоты (только пролин дает желтое окрашивание). Измерив, интенсивность окрашивания, можно рассчитать концентрацию каждой аминокислоты в гидролизате и число остатков каждой из них в исследуемом белке.
В настоящее время такой анализ проводят с помощью автоматических приборов - аминокислотных анализаторов (см. ниже рис. Схемы прибора). Результат анализа прибор выдаёт в виде графика концентраций отдельных аминокислот. Этот метод нашел широкое применение в исследовании состава пищевых веществ, клинической практике; с его помощью за 2-3 часа можно получить полную картину качественного состава аминокислот продуктов и биологических жидкостей.