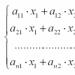Закон Авогадро
На заре развития атомной теории () А. Авогадро выдвинул гипотезу, согласно которой при одинаковых температуре и давлении в равных объёмах идеальных газов содержится одинаковое число молекул. Позже было показано, что эта гипотеза есть необходимое следствие кинетической теории, и сейчас она известна как закон Авогадро. Его можно сформулировать так: один моль любого газа при одинаковых температуре и давлении занимает один и тот же объем, при нормальных условиях равный 22,41383 . Эта величина известна как молярный объем газа .
Сам Авогадро не делал оценок числа молекул в заданном объёме, но понимал, что это очень большая величина. Первую попытку найти число молекул, занимающих данный объем, предпринял в году Й. Лошмидт . Из вычислений Лошмидта следовало, что для воздуха количество молекул на единицу объёма составляет 1,81·10 18 см −3 , что примерно в 15 раз меньше истинного значения. Через 8 лет Максвелл привёл гораздо более близкую к истине оценку «около 19 миллионов миллионов миллионов» молекул на кубический сантиметр, или 1,9·10 19 см −3 . В действительности в 1 см³ идеального газа при нормальных условиях содержится 2,68675·10 19 молекул . Эта величина была названа числом (или постоянной) Лошмидта . С тех пор было разработано большое число независимых методов определения числа Авогадро. Превосходное совпадение полученных значений является убедительным свидетельством реального количества молекул.
Измерение константы
| Данные в этой статье приведены по состоянию на декабрь 2011 года. |
Официально принятое на сегодня значение числа Авогадро было измерено в 2010 году . Для этого использовались две сферы, сделанные из кремния-28 . Сферы были получены в Институте кристаллографии имени Лейбница и отполированы в австралийском Центре высокоточной оптики настолько гладко, что высоты выступов на их поверхности не превышали 98 нм . Для их производства был использован высокочистый кремний-28, выделенный в нижегородском Институте химии высокочистых веществ РАН из высокообогащённого по кремнию-28 тетрафторида кремния, полученного в Центральном конструкторском бюро машиностроения в Санкт-Петербурге.
Располагая такими практически идеальными объектами, можно с высокой точностью подсчитать число атомов кремния в шаре и тем самым определить число Авогадро. Согласно полученным результатам, оно равно 6,02214084(18)×10 23 моль −1 .
Связь между константами
- Через произведение постоянной Больцмана Универсальная газовая постоянная , R =kN A .
- Через произведение элементарного электрического заряда на число Авогадро выражается постоянная Фарадея , F =eN A .
См. также
Примечания
Литература
- Число Авогадро // Большая советская энциклопедия
Wikimedia Foundation . 2010 .
Смотреть что такое "Число Авогадро" в других словарях:
- (постоянная Авогадро, обозначение L), постоянная, равная 6,022231023, соответствует числу атомов или молекул, содержащихся в одном МОЛЕ вещества … Научно-технический энциклопедический словарь
число Авогадро - Avogadro konstanta statusas T sritis chemija apibrėžtis Dalelių (atomų, molekulių, jonų) skaičius viename medžiagos molyje, lygus (6,02204 ± 0,000031)·10²³ mol⁻¹. santrumpa(os) Santrumpą žr. priede. priedas(ai) Grafinis formatas atitikmenys:… … Chemijos terminų aiškinamasis žodynas
число Авогадро - Avogadro konstanta statusas T sritis fizika atitikmenys: angl. Avogadro’s constant; Avogadro’s number vok. Avogadro Konstante, f; Avogadrosche Konstante, f rus. постоянная Авогадро, f; число Авогадро, n pranc. constante d’Avogadro, f; nombre… … Fizikos terminų žodynas
Авогадро постоянная (число Авогадро) - число частиц (атомов, молекул, ионов) в 1 моле вещества (моль это количество вещества, в котором содержится столько же частиц, сколько атомов содержится точно в 12 граммах изотопа углерода 12), обозначаемое символом N = 6,023 1023. Одна из… … Начала современного естествознания
- (число Авогадро), число структурных элементов (атомов, молекул, ионов или др. ч ц) в ед. кол ва в ва (в одном моле). Названа в честь А. Авогадро, обозна чается NA. А. п. одна из фундаментальных физических констант, существенная для определения мн … Физическая энциклопедия
- (число Авогадро; обозначается NА), число молекул или атомов в 1 моле вещества, NА = 6,022045(31) х 1023моль 1; назв. по имени А. Авогадро … Естествознание. Энциклопедический словарь
- (число Авогадро), число частиц (атомов, молекул, ионов) в 1 моле в ва. Обозначается NA и равна (6,022045 … Химическая энциклопедия
Na = (6,022045±0,000031)*10 23 число молекул в моле любого вещества или число атомов в моле простого вещества. Одна из фундаментальных постоянных, с помощью которой можно определить такие величины, как, например, массу атома или молекулы (см.… … Энциклопедия Кольера
В Википедии есть статьи о других людях с такой фамилией, см. Авогадро. Амедео Авогадро, граф Куаренья и Черрето Lorenzo Romano Amedeo Carlo Avogadro di Quaregna e Cerreto … Википедия
- (Avogadro, Amedeo) АМЕДЕО АВОГАДРО (1776 1856), итальянский физик и химик. Родился 9 августа 1776 в Турине в семье чиновника судебного ведомства. Получил юридическое образование и в 1796 стал доктором права. Уже в юности заинтересовался… … Энциклопедия Кольера
Книги
- Число Авогадро. Как увидеть атом , Мейлихов Евгений Залманович , Итальянский ученый Амадео Авогадро (современник А. С. Пушкина) был первым, кто понял, что количество атомов (молекул) в одном грамм-атоме (моле) вещества одинаково длявсех веществ. Знание же… Категория:
Закон Авогадро был сформулирован итальянским химиком Амадео Авогадро в 1811 году и имел большое значение для развития химии того времени. Впрочем, и сегодня он не потерял своей актуальности и значимости. Попробуем же сформулировать закон Авогадро, звучать он будет примерно так.
Формулировка закона Авогадро
Итак, закон Авогадро гласит, что при одинаковых температурах и давлении в равных объемах газов будет содержаться одинаковое число молекул, независимо, как от их химической природы, так и физических свойств. Данное число является некой физической константой, равной количеству , молекул, ионов содержащихся в одном моле.
Первоначально закон Авогадро был лишь гипотезой ученого, но позже эта гипотеза была подтверждена большим количеством экспериментов, после чего она и вошла в науку под названием «закон Авогадро», которому суждено было стать основным законом для идеальных газов.
Формула закона Авогадро
Сам первооткрыватель закона полагал, что физической константа является большой величиной, но какой именно не знал. Уже после его смерти в ходе многочисленных экспериментов было установлено точное число атомов, содержащихся в 12 г углерода (именно 12 г – атомная единица массы углерода) или же в молярном объеме газа равному 22,41 л. Константу эту на честь ученого назвали «числом Авогадро», обозначают его как NA, реже L и она равна 6,022*1023. Иными словами число молекул любого газа в объеме 22,41 л будет одинаковым как для легких, так и тяжелых газов.
Математическую формулу закона Авогадро можно написать так:
Где, V - объем газа; n - количество вещества, которое является отношением массы вещества к его молярной массе; VM - константа пропорциональности или молярный объем.
Применение закона Авогадро
Дальнейшее практическое применение закона Авогадро очень сильно помогло химикам определить химические формулы многих соединений.
Моль и число Авогадро, видео
И в завершение образовательное видео по теме нашей статьи.
Итальянский физик и химик Лоренцо Романо Амедео Карло Авогадро родился в 1776 году в Турине в дворянской семье. Так как в то время принято было передавать профессии по наследству Авогадро в 16 лет окончил Туринский университет, а в 20 получил ученую степень доктора церковного права.
С 25 лет самостоятельно занимается изучением физики и математики. И в 1803 году Амедео представил свою первую научную работу по изучению свойств электричества в Туринскую академию. В 1809 году учёному предложили должность профессора в колледже города Верчелли, а с 1820 года учёный успешно преподаёт в Туринском университете. Преподавательской деятельностью занимался до 1850 года.
Авогадро проводил различные исследования по изучению физических и химических свойств и явлений. Его научные работы посвящены электрохимической теории, электричеству, удельной теплоемкости, номенклатуре химических соединений. Авогадро впервые определил атомные массы углерода, азота, кислорода, хлора и других элементов; установил количественный состав молекул многих веществ, среди которых водород, вода, аммиак, азот и другие. Но химики отвергали теории Авогадро, и работы учёного были непризнанны.
Лишь в 1860 году благодаря усилиям С. Канниццаро многие работы Авогадро были пересмотрены и оправданы. В честь фамилии ученого названо постоянное число молекул в 1 моле идеального газа – число Авогадро (физическая постоянная величина, численно равная количеству специфицированных структурных единиц (атомов, молекул, ионов, электронов или любых других частиц) в 1 моле вещества = 6,0222310 23 . С этого времени начал широко применятся в химии закон Авогадро.
В 1811 году Авогадро установил закон, который утверждал, что в одинаковых объемах газов содержится равное число молекул при одинаковых температурах и давлении. А в 1814 году появляется статья учёного «Очерк об относительных массах молекул простых тел, или предполагаемых плотностях их газа, и о конституции некоторых из их соединений», в которой четко формулируется закон Авогадро.
Каким образом учёный пришёл к такому заключению?
 Авогадро тщательно проанализировал результаты экспериментов Гей-Люссака и других ученых
и понял, как устроена молекула газа. Известно, что при протекании химической реакции между газами соотношение объемов этих газов такое же, как и их молекулярное соотношение. Получается, что можно, измеряя плотность разных газов, определять относительные массы молекул, из которых эти газы состоят, и атомов. То есть, если в 1 литре кислорода содержится столько молекул, сколько и в 1 литре водорода, то отношение плотностей этих газов равно отношение масс молекул. Авогадро отметил, что молекулы простых газах могут состоять и из нескольких атомов.
Авогадро тщательно проанализировал результаты экспериментов Гей-Люссака и других ученых
и понял, как устроена молекула газа. Известно, что при протекании химической реакции между газами соотношение объемов этих газов такое же, как и их молекулярное соотношение. Получается, что можно, измеряя плотность разных газов, определять относительные массы молекул, из которых эти газы состоят, и атомов. То есть, если в 1 литре кислорода содержится столько молекул, сколько и в 1 литре водорода, то отношение плотностей этих газов равно отношение масс молекул. Авогадро отметил, что молекулы простых газах могут состоять и из нескольких атомов.
Закон Авогадро широко используется при расчетах по химическим формулам и уравнениям химических реакций, позволяет определять относительные молекулярные массы газов и количество молекул в моле любого вещества.
Если у Вас появились вопросы, Вы хотите более детально остановиться на данном материале или необходима помощь при решении задач, онлайн репетиторы всегда готовы помочь. В любое время и в любом месте ученик может обратиться за помощью к онлайн репетитору и получить консультацию по любому предмету школьной программы. Обучение проходит посредством специально разработанного программного обеспечения. Квалифицированные педагоги оказывают помощь при выполнении домашних заданий, объяснении непонятного материала; помогают подготовиться к ГИА и ЕГЭ. Ученик выбирает сам, проводить занятия с выбранным репетитором на протяжении длительного времени, или использовать помощь педагога только в конкретных ситуациях, когда возникают сложности с определённым заданием.
сайт, при полном или частичном копировании материала ссылка на первоисточник обязательна.
В равных объемах газов (V) при одинаковых условиях (температуре Т и давлении Р) содержится одинаковое число молекул.
Пусть температура постоянна (\(T=const \) ), давление не изменяется (\(p=const \) ), объем постоянный \((V=const) \) : \((N) \) - число частиц (молекул) любого идеального газа величина неизменная. Это утверждение называется законом Авогадро.
Закон Авогадро звучит следующим образом:
В равных объемах газов (V ) при одинаковых условиях (температуре Т и давлении Р ) содержится одинаковое число молекул.
Закон Авогадро был открыт в 1811 г Амедео Авогадро . Предпосылкой для этого стало правило кратных отношений: при одинаковых условиях объемы газов, вступающих в реакцию, находятся в простых соотношениях, как 1:1, 1:2, 1:3 и т. д.
Французский ученый Ж.Л. Гей-Люссак установил закон объемных отношений:
Объемы вступающих в реакцию газов при одинаковых условиях (температуре и давлении) относятся друг к другу как простые целые числа.
Например, 1 л хлора соединяется с 1 л водорода, образуя 2 л хлороводорода; 2 л оксида серы (IV) соединяются с 1 л кислорода, образуя 1 л оксида серы (VI).
Реальные газы, как правило, являются смесью чистых газов - кислорода, водорода, азота, гелия и т. п. Например, воздух состоит из 77 % азота, 21 % кислорода, 1 % водорода, остальные - инертные и прочие газы. Каждый из них создает давление на стенки сосуда, в котором находится.
Парциальное давление Давление, которое в смеси газов создает каждый газ в отдельности, как будто он один занимает весь объем, называется парциальным давлением (от лат. partialis - частичный)
Нормальные условия: p = 760 мм рт. ст. или 101 325 Па , t = 0 °С или 273 К .
Следствия из закона Авогадро
Следствие 1 из закона Авогадро Один моль любого газа при одинаковых условиях занимает одинаковый объем. В частности при нормальных условиях объем одного моля идеального газа равен 22,4 л . Этот объем называют молярным объемом \(V_{\mu} \)
где \(V_{\mu} \) - молярный объем газа (размерность л/моль); \(V \) - объем вещества системы; \(n \) - количество вещества системы. Пример записи: \(V_{\mu} \) газа (н.у.) = 22,4 л/моль.
Следствие 2 из закона Авогадро Отношение масс одинаковых объемов двух газов есть величина постоянная для данных газов. Эта величина называется относительной плотностью \(D \)
где \(m_1 \) и \(m_2 \) - молярные массы двух газообразных веществ.
Величина \(D \) определяется экспериментально как отношение масс одинаковых объемов исследуемого газа \(m_1 \) и эталонного газа с известной молекулярной массой (М2). По величинам \(D \) и \(m_2 \) можно найти молярную массу исследуемого газа: \(m_1 = D \cdot m_2 \)
Таким образом, при нормальных условиях (н.у.) молярный объем любого газа \(V_{\mu} = 22,4 \) л/моль.
Относительную плотность чаще всего вычисляют по отношению к воздуху или водороду, используя, что молярные массы водорода и воздуха известны и равны, соответственно:
\[ {\mu }_{H_2}=2\cdot {10}^{-3}\frac{кг}{моль} \]
\[ {\mu }_{vozd}=29\cdot {10}^{-3}\frac{кг}{моль} \]
Очень часто при решении задач используется то, что при нормальных условиях (н.у.) (давлении в одну атмосферу или, что тоже самое \(p={10}^5Па=760\ мм\ рт.ст,\ t=0^o C \) ) молярный объем любого идеального газа:
\[ \frac{RT}{p}=V_{\mu }=22,4\cdot {10}^{-3}\frac{м^3}{моль}=22,4\frac{л}{моль}\ . \]
Концентрацию молекул идеального газа при нормальных условиях:
\[ n_L=\frac{N_A}{V_{\mu }}=2,686754\cdot {10}^{25}м^{-3}\ , \]
называют числом Лошмидта .
В вашем браузере отключен Javascript.Чтобы произвести расчеты, необходимо разрешить элементы ActiveX!
Высчитать объём, молярную массу, количество газообразного вещества и относительную плотность газа помогает закон Авогадро в химии. Гипотеза была сформулирована Амедео Авогадро в 1811 году, а позже была подтверждена экспериментально.
Закон
Первым исследовал реакции газов Жозеф Гей-Люссак в 1808 году. Он сформулировал законы теплового расширения газов и объёмных отношений, получив из хлористого водорода и аммиака (двух газов) кристаллическое вещество - NH 4 Cl (хлорид аммония). Выяснилось, что для его создания необходимо взять одинаковые объёмы газов. При этом если один газ был в избытке, то «лишняя» часть после реакции оставалась неиспользованной.
Чуть позже Авогадро сформулировал вывод о том, что при одинаковых температурах и давлении равные объёмы газов содержат одинаковое количество молекул. При этом газы могут обладать разными химическими и физическими свойствами.

Рис. 1. Амедео Авогадро.
Из закона Авогадро вытекает два следствия:
- первое - один моль газа при равных условиях занимает одинаковый объём;
- второе - отношение масс одинаковых объёмов двух газов равно отношению их молярных масс и выражает относительную плотность одного газа по другому (обозначается D).
Нормальными условиями (н.у.) считаются давление Р=101,3 кПа (1 атм) и температура Т=273 К (0°С). При нормальных условиях молярный объём газов (объём вещества к его количеству) составляет 22,4 л/моль, т.е. 1 моль газа (6,02 ∙ 10 23 молекул - постоянное число Авогадро) занимает объём 22,4 л. Молярный объём (V m) - постоянная величина.

Рис. 2. Нормальные условия.
Решение задач
Главное значение закона - возможность проводить химические расчёты. На основе первого следствия закона можно вычислить количество газообразного вещества через объём по формуле:
где V - объём газа, V m - молярный объём, n - количество вещества, измеряемое в молях.
Второй вывод из закона Авогадро касается расчёта относительной плотности газа (ρ). Плотность высчитывается по формуле m/V. Если рассматривать 1 моль газа, то формула плотности будет выглядеть следующим образом:
ρ (газа) = M/V m ,
где M - масса одного моля, т.е. молярная масса.
Для расчёта плотности одного газа по другому газу необходимо знать плотности газов. Общая формула относительной плотности газа выглядит следующим образом:
D (y) x = ρ(x) / ρ(y),
где ρ(x) - плотность одного газа, ρ(y) - второго газа.
Если подставить в формулу подсчёт плотности, то получится:
D (y) x = M(х) / V m / M(y) / V m .
Молярный объём сокращается и остаётся
D (y) x = M(х) / M(y).
Рассмотрим практическое применение закона на примере двух задач:
- Сколько литров СО 2 получится из 6 моль MgCO 3 при реакции разложения MgCO 3 на оксид магния и углекислый газ (н.у.)?
- Чему равна относительная плотность CO 2 по водороду и по воздуху?
Сначала решим первую задачу.
n(MgCO 3) = 6 моль
MgCO 3 = MgO+CO 2
Количество карбоната магния и углекислого газа одинаково (по одной молекуле), поэтому n(CO 2) = n(MgCO 3) = 6 моль. Из формулы n = V/V m можно вычислить объём:
V = nV m , т.е. V(CO 2) = n(CO 2) ∙ V m = 6 моль ∙ 22,4 л/моль = 134,4 л
Ответ: V(СО 2) = 134,4 л
Решение второй задачи:
- D (H2) CO 2 = M(CO 2) / M(H 2) = 44 г/моль / 2 г/моль = 22;
- D (возд) CO 2 = M(CO 2) / M (возд) = 44 г/моль / 29 г/моль = 1,52.

Рис. 3. Формулы количества вещества по объёму и относительной плотности.
Формулы закона Авогадро работают только для газообразных веществ. Они не применимы к жидкостям и твёрдым веществам.
Что мы узнали?
Согласно формулировке закона равные объёмы газов при одинаковых условиях содержат одинаковое количество молекул. При нормальных условиях (н.у.) величина молярного объёма постоянна, т.е. V m для газов всегда равняется 22,4 л/моль. Из закона следует, что одинаковое количество молекул разных газов при нормальных условиях занимают одинаковый объём, а также относительная плотность одного газа по другому - отношение молярной массы одного газа к молярной массе второго газа.
Тест по теме
Оценка доклада
Средняя оценка: 4 . Всего получено оценок: 62.