KALCIJ (latinski kalcij), Ca, kemijski element II skupina kratkog oblika (2. skupina dugog oblika) periodični sustav; odnosi se na zemnoalkalijske metale; atomski broj 20; atomska masa 40.078. U prirodi postoji 6 stabilnih izotopa: 40 Ca (96,941%), 42 Ca (0,647%), 43 Ca (0,135%), 44 Ca (2,086%), 46 Ca (0,004%), 48 Ca (0,187%) ; umjetno dobiveni radioizotopi s masenim brojevima 34-54.
Referenca za povijest. Mnogi prirodni spojevi kalcija bili su poznati u antičko doba i bili su široko korišteni u građevinarstvu (na primjer, gips, vapno, mramor). Metalni kalcij je prvi izolirao G. Davy 1808. tijekom elektrolize smjese CaO i HgO oksida i naknadnom razgradnjom nastalog kalcijevog amalgama. Ime dolazi od latinskog calx ( Genitiv calcis) - vapno, meki kamen.
Rasprostranjenost u prirodi. Sadržaj kalcija u Zemljina kora iznosi 3,38% masenog udjela. Zbog svoje visoke kemijske aktivnosti ne javlja se u slobodnom stanju. Najčešći minerali su anortit Ca, anhidrit CaSO 4, apatit Ca 5 (PO 4) 3 (F, Cl, OH), gips CaSO 4 2H 2 O, kalcit i aragonit CaCO 3, perovskit CaTiO 3, fluorit CaF 2, šelit CaWO četiri . Minerali kalcija su dio sedimentnih (na primjer, vapnenac), magmatskih i metamorfnih stijena. Spojevi kalcija nalaze se u živim organizmima: glavni su sastojci koštanog tkiva kralježnjaka (hidroksiapatit, fluorapatit), skeleta koralja, školjki mekušaca (kalcijev karbonat i fosfati) itd. Prisutnost iona Ca 2+ određuje tvrdoću vode .
Svojstva. Vanjska konfiguracija elektronska ljuska atom kalcija 4s 2; u spojevima pokazuje oksidacijsko stanje +2, rijetko +1; Paulingova elektronegativnost 1,00, atomski polumjer 180 pm, polumjer iona Ca 2+ 114 pm (koordinacijski broj 6). kalcij je srebrno-bijeli meki metal; do 443 °S, modifikacija s kubičnom kristalnom rešetkom usmjerenom na lice je stabilna, iznad 443 °S - s kubičnom rešetkom usmjerenom na tijelo; t pl 842°S, t kip 1484 °S, gustoća 1550 kg/m3; toplinska vodljivost 125,6 W/(m K).
Kalcij je metal visoke kemijske aktivnosti (pohranjen u hermetički zatvorenim posudama ili ispod sloja mineralnog ulja). U normalnim uvjetima lako stupa u interakciju s kisikom (nastaje kalcijev oksid CaO), kada se zagrijava - s vodikom (CaH 2 hidrid), halogenima (kalcijevi halogenidi), borom (CaB 6 borid), ugljikom (kalcijev karbid CaC 2), silicijem (Ca silicidi 2 Si, CaSi, CaSi 2, Ca 3 Si 4), dušik (Ca 3 N 2 nitrid), fosfor (Ca 3 P 2, CaP, CaP 5 fosfidi), halkogeni (CaX halkogenidi, gdje je X S, Se, oni). Kalcij u interakciji s drugim metalima (Li, Cu, Ag, Au, Mg, Zn, Al, Pb, Sn, itd.) tvori intermetalne spojeve. Metalni kalcij reagira s vodom i nastaje kalcijev hidroksid Ca(OH) 2 i H 2 . Snažno stupa u interakciju s većinom kiselina, tvoreći odgovarajuće soli (na primjer, kalcijev nitrat, kalcijev sulfat, kalcijev fosfat). Otapa se u tekućem amonijaku da nastane tamnoplava otopina s metalnom vodljivošću. Kada amonijak ispari, amonijak se oslobađa iz takve otopine. Postupno, kalcij reagira s amonijakom da nastane amid Ca(NH 2) 2 . Oblici razni složeni spojevi Najveću važnost imaju kompleksi s polidentatnim ligandima koji sadrže kisik, na primjer Ca kompleksonati.
Biološka uloga. Kalcij se odnosi na biogene elemente. Dnevna potreba čovjeka za kalcijem je oko 1 g. U živim organizmima kalcijevi ioni sudjeluju u procesima kontrakcije mišića i prijenosa živčanih impulsa.
Priznanica. Metalni kalcij dobiva se elektrolitičkim i metalotermnim metodama. Elektrolitička metoda temelji se na elektrolizi rastaljenog kalcijevog klorida dodirnom katodom ili tekućom bakreno-kalcijevom katodom. Kalcij se destilira iz dobivene legure bakra i kalcija pri temperaturi od 1000-1080 °C i tlaku od 13-20 kPa. Metalotermna metoda temelji se na redukciji kalcija iz njegovog oksida aluminijem ili silicijem pri 1100-1200 °C. Time nastaje aluminat ili kalcijev silikat, kao i plinoviti kalcij, koji se zatim kondenzira. Svjetska proizvodnja kalcijevih spojeva i materijala koji sadrže kalcij, oko 1 milijardu tona godišnje (1998.).
Primjena. Kalcij se koristi kao redukcijsko sredstvo u proizvodnji mnogih metala (Rb, Cs, Zr, Hf, V, itd.). Silicidi kalcija, kao i legure kalcija s natrijem, cinkom i drugim metalima, koriste se kao deoksidatori i desulfurizatori za neke legure i ulja, za pročišćavanje argona od kisika i dušika te kao apsorber plina u vakuumskim uređajima. CaCl 2 klorid se koristi kao sredstvo za sušenje u kemijskoj sintezi, gips se koristi u medicini. Kalcijevi silikati su glavne komponente cementa.
Lit .: Rodyakin VV Kalcij, njegovi spojevi i legure. M., 1967; Spitsyn V.I., Martynenko L.I. Anorganska kemija. M., 1994. 2. dio; Anorganska kemija / Uredio Yu. D. Tretyakov. M., 2004. T. 2.
L. N. Komissarova, M. A. Ryumin.
Povijest kalcija
Kalcij je 1808. otkrio Humphry Davy, koji je elektrolizom gašenog vapna i živinog oksida dobio kalcijev amalgam, kao rezultat destilacije žive od koje je ostao metal, koji je dobio ime kalcija. na latinskom vapno zvuči vapno, upravo je ovo ime odabrao engleski kemičar za otkrivenu tvar.
Kalcij je element glavne podskupine II skupine IV razdoblja periodnog sustava kemijskih elemenata D.I. Mendeljejev, ima atomski broj 20 i atomsku masu 40,08. Prihvaćena oznaka- Ca (od latinskog - kalcij).
Fizička i kemijska svojstva
Kalcij je reaktivna meka alkalni metal srebro- bijela boja. Zbog interakcije s kisikom i ugljičnim dioksidom, površina metala tamni, pa je kalciju potreban poseban režim skladištenja - dobro zatvorena posuda u koju se metal ulijeva slojem tekućeg parafina ili kerozina.
Kalcij je najpoznatiji od elemenata u tragovima potrebnih za osobu, dnevna potreba za njim je od 700 do 1500 mg za zdravu odraslu osobu, ali se povećava tijekom trudnoće i dojenja, to se mora uzeti u obzir i kalcij treba biti uzimaju u obliku lijekova.

Biti u prirodi
Kalcij ima vrlo visoku kemijsku aktivnost, stoga se u slobodnom (čistom) obliku ne pojavljuje u prirodi. Ipak, peti je najčešći u zemljinoj kori, u obliku spojeva nalazi se u sedimentima (vapnenac, kreda) i stijenama (granit), anorit feldspat sadrži puno kalcija.
Široko je rasprostranjena u živim organizmima, prisutna je u biljnim, životinjskim i ljudskim organizmima, gdje je prisutna uglavnom u sastavu zuba i koštanog tkiva.

Apsorpcija kalcija
Prepreka normalnoj apsorpciji kalcija iz hrane je konzumacija ugljikohidrata u obliku slatkiša i lužina, koji neutraliziraju klorovodičnu kiselinu želuca koja je neophodna za otapanje kalcija. Proces apsorpcije kalcija je dosta kompliciran, pa ga ponekad nije dovoljno unositi samo hranom, potreban je dodatni unos mikroelementa.
Interakcija s drugima
Da bi se poboljšala apsorpcija kalcija u crijevima, potrebno je, što nastoji olakšati proces apsorpcije kalcija. Prilikom uzimanja kalcija (u obliku suplemenata) u procesu prehrane, apsorpcija je blokirana, ali uzimanje dodataka kalcija odvojeno od hrane ne utječe ni na koji način na ovaj proces.
Gotovo sav tjelesni kalcij (1 do 1,5 kg) nalazi se u kostima i zubima. Kalcij sudjeluje u procesima podražljivosti živčanog tkiva, kontraktilnosti mišića, procesima zgrušavanja krvi, dio je jezgre i membrana stanica, staničnih i tkivnih tekućina, djeluje antialergijsko i protuupalno, sprječava acidozu, aktivira niz enzimi i hormoni. Kalcij također sudjeluje u regulaciji propusnosti stanične membrane i ima suprotan učinak.

Znakovi nedostatka kalcija
Znakovi nedostatka kalcija u tijelu su takvi, na prvi pogled, nepovezani simptomi:
- nervoza, pogoršanje raspoloženja;
- kardiopalmus;
- konvulzije, utrnulost udova;
- usporavanje rasta i djeca;
- visoki krvni tlak;
- raslojavanje i krhkost noktiju;
- bol u zglobovima, snižavanje "praga boli";
- obilna menstruacija.
Uzroci nedostatka kalcija
Uzroci nedostatka kalcija mogu biti neuravnotežena prehrana (osobito gladovanje), nizak udio kalcija u hrani, pušenje i ovisnost o kavi i kofeinskim pićima, disbakterioza, bolesti bubrega, štitnjače, trudnoća, razdoblja dojenja i menopauza.
Višak kalcija, koji se može javiti prekomjernom konzumacijom mliječnih proizvoda ili nekontroliranim unosom lijekova, karakterizira jaka žeđ, mučnina, povraćanje, gubitak apetita, slabost i pojačano mokrenje.

Korištenje kalcija u životu
Kalcij je našao primjenu u metalotermnoj proizvodnji urana, u obliku prirodnih spojeva koristi se kao sirovina za proizvodnju gipsa i cementa, kao sredstvo za dezinfekciju (svima je poznato izbjeljivač).
DEFINICIJA
Kalcij- dvadeseti element periodnog sustava. Oznaka - Ca od latinskog "kalcij". Smješten u četvrtom razdoblju, IIA grupa. Odnosi se na metale. Naboj jezgre je 20.
Kalcij je jedan od najzastupljenijih elemenata u prirodi. Sadrži približno 3% (masenih) u zemljinoj kori. Javlja se kao brojne naslage vapnenca i krede, kao i mramora, koji su prirodne varijante kalcijevog karbonata CaCO 3 . U velikim količinama nalaze se i gips CaSO 4 × 2H 2 O, fosforit Ca 3 (PO 4) 2 i, konačno, razni silikati koji sadrže kalcij.
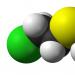
Kao jednostavna tvar kalcij je savitljiv, prilično tvrd bijeli metal (slika 1). Na zraku se brzo prekriva slojem oksida, a kada se zagrije, gori svijetlim crvenkastim plamenom. IZ hladna voda kalcij reagira relativno sporo, ali brzo istiskuje vodik iz vruće vode, stvarajući hidroksid.
Riža. 1. Kalcij. Izgled.
Atomska i molekularna težina kalcija
Relativna molekulska masa tvari (M r) je broj koji pokazuje koliko je puta masa dane molekule veća od 1/12 mase atoma ugljika, a relativna atomska masa elementa (Ar r) je koliko je puta prosječna masa atoma kemijskog elementa veća od 1/12 mase atoma ugljika.
Budući da u slobodnom stanju kalcij postoji u obliku jednoatomskih molekula Ca, vrijednosti njegovih atomskih i Molekularna težina podudarati. Oni su jednaki 40,078.
Izotopi kalcija
Poznato je da se u prirodi kalcij može naći u obliku četiri stabilna izotopa 40Ca, 42Ca, 43Ca, 44Ca, 46Ca i 48Ca, s jasnom prevlašću izotopa 40Ca (99,97%). Njihovi maseni brojevi su 40, 42, 43, 44, 46 i 48. Jezgra atoma izotopa kalcija 40 Ca sadrži dvadeset protona i dvadeset neutrona, a preostali izotopi od nje se razlikuju samo po broju neutrona.
Postoje umjetni izotopi kalcija s masenim brojevima od 34 do 57, među kojima je najstabilniji 41 Ca s poluživotom od 102 tisuće godina.
Kalcijevi ioni
Vani razina energije Atom kalcija ima dva valentna elektrona:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 .
Kao rezultat kemijska interakcija kalcij daruje svoje valentne elektrone, t.j. je njihov donor i pretvara se u pozitivno nabijeni ion:
Ca 0 -2e → Ca 2+.
Molekula i atom kalcija
U slobodnom stanju, kalcij postoji u obliku jednoatomskih molekula Ca. Evo nekih svojstava koja karakteriziraju atom i molekulu kalcija:
legure kalcija
Kalcij služi kao legirajuća komponenta nekih olovnih legura.
Primjeri rješavanja problema
PRIMJER 1
| Vježbajte | Napišite jednadžbe reakcija koje se mogu koristiti za provedbu sljedećih transformacija: Ca → Ca(OH) 2 → CaCO 3 → Ca(HCO 3) 2. |
| Odgovor | Otapanjem kalcija u vodi, možete dobiti zamućenu otopinu spoja poznatog kao "vapneno mlijeko" - kalcijev hidroksid: Ca + 2H 2 O → Ca (OH) 2 + H 2. Propuštanjem ugljičnog dioksida kroz otopinu kalcijevog hidroksida dobivamo kalcijev karbonat: 2Ca(OH) 2 + CO 2 → CaCO 3 + H 2 O. Dodavanjem vode u kalcijev karbonat i nastavljanjem propuštanja ugljičnog dioksida kroz ovu smjesu, dobivamo kalcijev bikarbonat: CaCO 3 + H 2 O + CO 2 → Ca(HCO 3) 2. |
Kalcij(Kalcij), Ca, kemijski element II skupine Mendeljejevskog periodnog sustava, atomski broj 20, atomska masa 40,08; srebrnobijeli laki metal. Prirodni element je mješavina šest stabilnih izotopa: 40 Ca, 42 Ca, 43 Ca, 44 Ca, 46 Ca i 48 Ca, od kojih je 40 Ca najčešći (96,97%).
Spojevi Ca - vapnenac, mramor, gips (kao i vapno - produkt gorenja vapnenca) koriste se u graditeljstvu od davnina. Sve do kraja 18. stoljeća kemičari su vapno smatrali jednostavnom tvari. 1789. A. Lavoisier je sugerirao da su vapno, magnezij, barit, aluminij i silicij složene tvari. Godine 1808. G. Davy je, podvrgavši smjesu vlažnog gašenog vapna sa živinim oksidom elektrolizi sa živinom katodom, pripremio amalgam Ca, a nakon što je izbacio živu iz njega, dobio je metal nazvan "Kalcij" (od latinskog calx , rod case calcis - vapno) .
Raspodjela kalcija u prirodi. Po zastupljenosti u zemljinoj kori Ca zauzima 5. mjesto (iza O, Si, Al i Fe); sadržaj 2,96% težinski. Snažno migrira i akumulira se u različitim geokemijskim sustavima tvoreći 385 minerala (4. mjesto po broju minerala). Malo je Ca u Zemljinom plaštu, a vjerojatno još manje u Zemljinoj jezgri (0,02% u željeznim meteoritima). U donjem dijelu zemljine kore prevladava Ca, akumulirajući se u osnovnim stijenama; većina Ca je zatvorena u feldspat - anortit Ca; sadržaj u bazičnim stijenama 6,72%, u kiselim (graniti i dr.) 1,58%. U biosferi se događa iznimno oštra diferencijacija Ca, uglavnom povezana s "karbonatnom ravnotežom": kada ugljični dioksid stupi u interakciju s CaCO 3 karbonatom, nastaje topljivi bikarbonat Ca (HCO 3) 2: CaCO 3 + H 2 O + CO 2 \ u003d Ca (HCO 3) 2 \u003d Ca 2+ + 2HCO 3-. Ova reakcija je reverzibilna i temelj je preraspodjele Ca. S visokim udjelom CO 2 u vodama, Ca je u otopini, a s niskim sadržajem CO 2 taloži se mineral kalcit CaCO 3 tvoreći snažne naslage vapnenca, krede i mramora.
Biogena migracija također igra veliku ulogu u povijesti Ca. U živoj tvari iz elemenata-metala glavni je Ca. Poznati su organizmi koji sadrže više od 10% Ca (više ugljika), a svoj kostur grade od spojeva Ca, uglavnom CaCO 3 (vapnenaste alge, mnogi mekušci, bodljikaši, koralji, rizomi itd.). Sa ukopom kostura mora. Životinje i biljke povezane su s nakupljanjem kolosalnih masa algi, koralja i drugih vapnenaca, koji se, uranjajući u dubine zemlje i mineralizirajući, pretvaraju u razne vrste mramora.
Ogromna područja s vlažnom klimom (šumske zone, tundra) karakterizira nedostatak Ca - ovdje se lako ispire iz tla. To je povezano s niskom plodnošću tla, niskom produktivnošću domaćih životinja, njihovom malom veličinom, a često i bolestima kostura. Stoga je od velike važnosti vapnenje tla, ishrana domaćih životinja i ptica itd. Naprotiv, CaCO 3 je slabo topiv u suhoj klimi, pa su stepski i pustinjski krajolici bogati Ca. U slanim močvarama i slanim jezerima često se nakuplja gips CaSO 4 2H 2 O.
Rijeke unose puno Ca u ocean, ali se ne zadržava u oceanskoj vodi (prosječni sadržaj je 0,04%), već se koncentrira u skeletima organizama i nakon njihove smrti taloži se na dno uglavnom u obliku CaCO 3 . Vapneni mulj rasprostranjen je na dnu svih oceana na dubinama ne većim od 4000 m (CaCO 3 se otapa na velikim dubinama, organizmi tamo često doživljavaju nedostatak Ca).
Podzemne vode igraju važnu ulogu u migraciji Ca. U vapnenačkim masivima mjestimice snažno ispiraju CaCO 3, što je povezano s razvojem krša, stvaranjem špilja, stalaktita i stalagmita. Osim kalcita, u morima prošlih geoloških era bilo je široko rasprostranjeno taloženje Ca fosfata (primjerice, nalazišta fosforita Karatau u Kazahstanu), dolomita CaCO 3 ·MgCO 3 i gipsa u lagunama tijekom isparavanja.
Tijekom geološke povijesti došlo je do povećanja biogenog karbonata, dok je kemijska precipitacija kalcita smanjena. U pretkambrijskim morima (prije više od 600 milijuna godina) nije bilo životinja s vapnenastim kosturom; postali su rašireni od kambrija (koralji, spužve itd.). To se pripisuje visokom sadržaju CO 2 u pretkambrijskoj atmosferi.
Fizička svojstva kalcija. Kristalna rešetka α-oblika Ca (stabilna na običnoj temperaturi) je kubična sa središtem lica, a = 5,56Å. Atomski radijus 1,97Å, ionski polumjer Ca 2+ 1,04Å. Gustoća 1,54 g/cm3 (20 °C). Iznad 464 °C, heksagonalni β-oblik je stabilan. t pl 851 °C, t kip 1482 °C; temperaturni koeficijent linearno širenje 22 10 -6 (0-300 °C); toplinska vodljivost na 20 °C 125,6 W/(m K) ili 0,3 cal/(cm s °C); specifični toplinski kapacitet (0-100 °C) 623,9 j/(kg K) ili 0,149 cal/(g °C); električna otpornost na 20 °C 4,6 10 -8 ohm m ili 4,6 10 -6 ohm cm; temperaturni koeficijent električnog otpora 4,57 10 -3 (20 °C). Modul elastičnosti 26 Gn / m 2 (2600 kgf / mm 2); vlačna čvrstoća 60 MN / m 2 (6 kgf / mm 2); granica elastičnosti 4 MN / m 2 (0,4 kgf / mm 2), granica popuštanja 38 MN / m 2 (3,8 kgf / mm 2); produljenje 50%; Tvrdoća po Brinellu 200-300 MN / m 2 (20-30 kgf / mm 2). Kalcij dovoljno visoke čistoće je plastičan, dobro prešan, valjan i može se strojno obrađivati.
Kemijska svojstva kalcija. Konfiguracija vanjske elektronske ljuske atoma Ca 4s 2, prema kojoj je Ca u spojevima 2-valentan. Kemijski je Ca vrlo aktivan. Na uobičajenim temperaturama Ca lako stupa u interakciju s kisikom i vlagom u zraku, pa se pohranjuje u hermetički zatvorenim posudama ili pod mineralnim uljem. Kada se zagrije na zraku ili kisiku, zapali se, dajući osnovni oksid CaO. Poznati su i peroksidi Ca-CaO 2 i CaO 4. Najprije Ca brzo reagira s hladnom vodom, a zatim se reakcija usporava zbog stvaranja Ca(OH) 2 filma. Ca snažno stupa u interakciju s Vruća voda i kiseline, oslobađajući H 2 (osim koncentrirane HNO 3). Reagira s fluorom na hladnom, a s klorom i bromom - iznad 400 ° C, dajući CaF 2, CaCl 2 i CaBr 2, respektivno. Ovi halogenidi u rastaljenom stanju tvore s Ca takozvane podspojeve - CaF, CaCl, u kojima je Ca formalno monovalentan. Kada se Ca zagrijava sa sumporom, dobiva se kalcijev sulfid CaS, potonji dodaje sumpor, stvarajući polisulfide (CaS 2, CaS 4 i drugi). U interakciji sa suhim vodikom na 300-400 ° C, Ca tvori hidrid CaH 2 - ionski spoj u kojem je vodik anion. Na 500 °C Ca i dušik daju Ca 3 N 2 nitrid; interakcija Ca s amonijakom na hladnom dovodi do kompleksnog amonijaka Ca 6 . Kada se zagrijava bez pristupa zraku s grafitom, silicijem ili fosforom, Ca daje kalcijev karbid CaC 2 , silicide Ca 2 Si, CaSi, CaSi 2 i fosfid Ca 3 P 2 , redom. Ca tvori intermetalne spojeve s Al, Ag, Au, Cu, Li, Mg, Pb, Sn i drugima.
Dobivanje kalcija. U industriji se Ca dobiva na dva načina: 1) zagrijavanjem briketirane smjese CaO i Al praha na 1200 °C u vakuumu od 0,01-0,02 mm Hg. Umjetnost.; oslobađa se reakcijom: para 6CaO + 2 Al \u003d 3CaO Al 2 O 3 + 3Ca Ca kondenzira se na hladnoj površini; 2) elektrolizom taline CaCl 2 i KCl s tekućom bakreno-kalcijevom katodom priprema se legura Cu - Ca (65% Ca) iz koje se Ca destilira na temperaturi od 950-1000 °C u vakuum od 0,1-0,001 mm Hg. Umjetnost.
Korištenje kalcija. U obliku čistog metala, Ca se koristi kao redukcijsko sredstvo za U, Th, Cr, V, Zr, Cs, Rb i neke rijetke zemne metale iz njihovih spojeva. Također se koristi za deoksidaciju čelika, bronce i drugih legura, za uklanjanje sumpora iz naftnih derivata, za dehidraciju organskih tekućina, za pročišćavanje argona od dušičnih nečistoća te kao apsorber plina u električnim vakuumskim uređajima. Antifrikcijski materijali sustava Pb-Na-Ca, kao i legure Pb-Ca, koje se koriste za izradu električnih školjki, dobili su veliku primjenu u tehnologiji. kabeli. Legura Ca-Si-Ca (silikokalcij) koristi se kao deoksidator i degazator u proizvodnji visokokvalitetnih čelika.
kalcija u tijelu. Ca je jedan od biogenih elemenata neophodnih za normalan tijek životnih procesa. Prisutan je u svim tkivima i tekućinama životinja i biljaka. Samo rijetki organizmi mogu se razviti u okruženju bez Ca. U nekim organizmima sadržaj Ca doseže 38%; kod ljudi - 1,4-2%. Stanice biljnih i životinjskih organizama trebaju strogo određene omjere iona Ca 2+, Na+ i K+ u izvanstaničnom mediju. Biljke dobivaju Ca iz tla. Prema odnosu prema Ca, biljke se dijele na kalcefile i kalcefobe. Životinje dobivaju Ca iz hrane i vode. Ca je neophodan za stvaranje niza staničnih struktura, održavanje normalne propusnosti vanjskih staničnih membrana, za oplodnju jajašaca riba i drugih životinja te aktiviranje niza enzima. Ca 2+ ioni prenose uzbuđenje na mišićno vlakno, uzrokujući njegovo kontrakciju, povećavaju snagu srčanih kontrakcija, povećavaju fagocitnu funkciju leukocita, aktiviraju sustav zaštitnih proteina krvi, sudjeluju u njenoj koagulaciji. U stanicama je gotovo sav Ca u obliku spojeva s proteinima, nukleinske kiseline, fosfolipidi, u kompleksima s anorganskim fosfatima i organskim kiselinama. U krvnoj plazmi ljudi i viših životinja samo 20-40% Ca može biti povezano s proteinima. Kod životinja s kosturom, do 97-99% cjelokupnog Ca koristi se kao građevinski materijal: u beskralježnjaka, uglavnom u obliku CaCO 3 (školjke mekušaca, koralji), u kralježnjacima, u obliku fosfata. Mnogi beskralješnjaci pohranjuju Ca prije linjanja kako bi izgradili novi kostur ili osigurali vitalne funkcije u nepovoljnim uvjetima.
Sadržaj Ca u krvi ljudi i viših životinja reguliran je hormonima paratireoidne i štitnjače. Najvažniju ulogu u tim procesima ima vitamin D. Apsorpcija Ca se događa u prednjem dijelu tankog crijeva. Asimilacija Ca pogoršava se smanjenjem kiselosti u crijevima i ovisi o omjeru Ca, P i masti u hrani. Optimalni omjer Ca/P u kravljem mlijeku je oko 1,3 (u krumpiru 0,15, u grahu 0,13, u mesu 0,016). Uz višak P ili oksalne kiseline u hrani, apsorpcija Ca se pogoršava. Žučne kiseline ubrzavaju njegovu apsorpciju. Optimalni omjer Ca/mast u ljudskoj hrani je 0,04-0,08 g Ca na 1 g masti. Izlučivanje Ca se događa uglavnom kroz crijeva. Sisavci tijekom laktacije gube puno Ca s mlijekom. Uz kršenje metabolizma fosfora i kalcija u mladih životinja i djece, razvija se rahitis, kod odraslih životinja - promjena u sastavu i strukturi kostura (osteomalacija).
Kalcij se nalazi u četvrtom velikom razdoblju, druga skupina, glavna podskupina, serijski broj elementa je 20. Prema Mendeljejevom periodnom sustavu, atomska težina kalcija je 40,08. Formula najvišeg oksida je CaO. Kalcij ima latinski naziv kalcija, pa je simbol atoma elementa Ca.
Karakterizacija kalcija kao jednostavne tvari
U normalnim uvjetima, kalcij je srebrno-bijeli metal. Imajući visoku kemijsku aktivnost, element je u stanju tvoriti mnoge spojeve različitih klasa. Element je od vrijednosti za tehničke i industrijske kemijske sinteze. Metal je široko rasprostranjen u zemljinoj kori: njegov udio je oko 1,5%. Kalcij pripada skupini zemnoalkalijskih metala: kada se otopi u vodi, daje lužine, ali u prirodi se javlja u obliku više minerala i. Morska voda sadrži kalcij u visokim koncentracijama (400 mg/l).
čisti natrijKarakteristike kalcija ovise o strukturi njegove kristalne rešetke. Ovaj element ima dvije vrste: kubično usmjereno na lice i usmjereno na volumen. Vrsta veze u molekuli je metalna.
Prirodni izvori kalcija:
- apatit;
- alabaster;
- gips;
- kalcit;
- fluorit;
- dolomit.
Fizikalna svojstva kalcija i metode za proizvodnju metala
U normalnim uvjetima, kalcij je u čvrstom agregacijskom stanju. Metal se topi na 842 °C. Kalcij je dobar električni i toplinski provodnik. Kada se zagrije, prvo prelazi u tekućinu, a zatim u parno stanje i gubi svoja metalna svojstva. Metal je vrlo mekan i može se rezati nožem. Vri na 1484 °C.
Pod pritiskom kalcij gubi svoja metalna svojstva i električnu vodljivost. No, tada se obnavljaju metalna svojstva i pojavljuju se svojstva supravodiča, nekoliko puta veća od ostalih u svojoj izvedbi.
Dugo vremena nije bilo moguće dobiti kalcij bez nečistoća: zbog svoje visoke kemijske aktivnosti, ovaj element se u prirodi ne pojavljuje u svom čistom obliku. Predmet je otvoren u početkom XIX stoljeća. Kalcij kao metal prvi je sintetizirao britanski kemičar Humphrey Davy. Znanstvenik je otkrio značajke interakcije talina čvrstih minerala i soli s elektro šok. Danas je elektroliza kalcijevih soli (mješavine kalcijevih i kalijevih klorida, mješavine kalcijevog fluorida i kalcijevog klorida) i dalje najrelevantnija metoda za proizvodnju metala. Kalcij se također ekstrahira iz njegovog oksida pomoću aluminotermije, metode uobičajene u metalurgiji.
Kemijska svojstva kalcija
Kalcij je aktivni metal koji ulazi u mnoge interakcije. U normalnim uvjetima, lako reagira, tvoreći odgovarajuće binarne spojeve: s kisikom, halogenima. Kliknite da biste saznali više o spojevima kalcija. Kada se zagrijava, kalcij reagira s dušikom, vodikom, ugljikom, silicijem, borom, fosforom, sumporom i drugim tvarima. Na otvorenom trenutačno stupa u interakciju s kisikom i ugljičnim dioksidom, stoga postaje prekriven sivim premazom.
Burno reagira s kiselinama, ponekad se zapali. U solima, kalcij pokazuje zanimljiva svojstva. Na primjer, špiljski stalaktiti i stalagmiti su kalcijev karbonat, koji postupno nastaje iz vode, ugljičnog dioksida i bikarbonata kao rezultat procesa unutar podzemnih voda.
Zbog svoje visoke aktivnosti u normalnom stanju, kalcij se pohranjuje u laboratorijima u tamnom zatvorenom staklenom posuđu ispod sloja parafina ili kerozina. Kvalitativna reakcija na kalcijev ion je bojanje plamena u bogatu ciglastocrvenu boju.
 Kalcij pocrveni plamen
Kalcij pocrveni plamen
Metal u sastavu spojeva može se identificirati po netopivim precipitatima nekih soli elementa (fluorid, karbonat, sulfat, silikat, fosfat, sulfit).
Reakcija vode s kalcijem
Kalcij se pohranjuje u staklenke ispod sloja zaštitne tekućine. Za provođenje, demonstriranje kako se događa reakcija vode i kalcija, ne možete samo dobiti metal i odrezati željeni komad od njega. Metalni kalcij u laboratoriju lakše je koristiti u obliku strugotina.
Ako nema metalnih strugotina, a u banci su samo veliki komadi kalcija, bit će potrebna kliješta ili čekić. Gotovi komad kalcija željene veličine stavlja se u tikvicu ili čašu vode. Kalcijeve strugotine stavljaju se u posudu u vrećicu od gaze.
Kalcij tone na dno, a počinje razvijanje vodika (prvo, na mjestu gdje se nalazi svježi lom metala). Postupno se oslobađa plin s površine kalcija. Proces nalikuje brzom vrenju, pri čemu se stvara talog kalcijevog hidroksida (gašeno vapno).
 gašenje vapna
gašenje vapna
Komad kalcija ispliva, pokupljeni mjehurići vodika. Nakon otprilike 30 sekundi, kalcij se otapa i voda postaje mutno bijela zbog stvaranja kaše hidroksida. Ako se reakcija ne provodi u čaši, već u epruveti, može se primijetiti razvijanje topline: epruveta se brzo zagrije. Reakcija kalcija s vodom ne završava spektakularnom eksplozijom, ali interakcija dviju tvari odvija se nasilno i izgleda spektakularno. Iskustvo je sigurno.
Ako se vrećica s preostalim kalcijem izvadi iz vode i drži na zraku, nakon nekog vremena, kao rezultat tekuće reakcije, doći će do jakog zagrijavanja, a ostatak u gazi će prokuhati. Ako se dio zamućene otopine filtrira kroz lijevak u čašu, tada kada se ugljični monoksid CO₂ propušta kroz otopinu, formira se talog. Za to nije potreban ugljični dioksid - možete ispuhati izdahnuti zrak u otopinu kroz staklenu cijev.