Iperit ima izraženo lokalno i resorptivno svojstvo. Karakteriziraju ga sljedeće značajke:
nema iritativnog učinka u trenutku kontakta;
navikavanje na njegov miris, kada osoba prestane mirisati senf (češnjak) nakon nekoliko minuta;
prisutnost skrivenog razdoblja;
upalno-nekrotični procesi u tkivima u koje prodire iperit;
spori procesi oporavka i često pridruživanje sekundarnim infekcijama;
preosjetljivost na ponovno izlaganje iperitu.
U slučaju dodira s tekućim iperitom na kožu brzo se otapa u lipidnom mazivu kože. Ako se otplinjavanje ne izvrši unutar 5 minuta, iperit prodire u duboke slojeve epiderme, akumulirajući se uglavnom u žlijezdama lojnicama i folikulima dlake kože. Na područjima s tanjom i osjetljivijom kožom i velikim brojem žlijezda lojnica i znojnica (koža vrata, prsa, pazuha i sl.) lezije su izraženije. Doza od 0,05 mg/cm2 uzrokuje eritem tijekom 5 minuta, doza od 0,1-0,25 mg/cm2 pod istim uvjetima izaziva pojavu mjehura.
skriveno razdoblje- 2-6 sati Zatim se javljaju znakovi lezija kože (crvenilo, svrbež, oteklina). U početku se pojavljuju mali mjehurići, ispunjeni bistrom tekućinom. Povećavajući volumen, mjehurići se spajaju u veće. Maksimalni razvoj mjehurića je na kraju 1-2 dana (ovisno o dozi iperita). Tada se ljuska mjehurića lomi i pojavljuju se čirevi koji se često inficiraju i polako zacjeljuju (tjednima, mjesecima). Na mjestu ulkusa u pravilu nastaju ožiljci, koji u području zglobova mogu ograničiti pokretljivost i poremetiti njihovu funkciju.
Parovi iperit u toksičnim dozama od 0,1-0,3 mg-min / l uzrokuju eritem; 0,2-1,0 mg-min / l - mjehurići i 0,75-1,5 ml * min / l - teške lezije kože s stvaranjem više mjehurića. Simptomi se obično razvijaju nakon nekoliko sati. Prvo se javlja crvenilo, a zatim pigmentacija, koja podsjeća na opekline od sunca; zatim - mjehurići, na čijem mjestu se nakon 2-3 dana formiraju čirevi. Pod djelovanjem para i aerosola iperita moguće su lezije na velikom području, što je obično popraćeno izraženim resorptivnim učinkom.
Oči su najosjetljivije na djelovanje iperit. Toksične doze iperita, jednake 0,07 mg-min / l, uzrokuju blago oštećenje oka (konjunktivitis); 0,1 mg-min / l - oštećenje oka s oštećenjem vida i 0,2 mg-min / l - teško oštećenje vida s invaliditetom. Simptomi lezije se razvijaju nakon 1-2 sata.Najprije se javlja neugodan osjećaj stranog predmeta u očima („osjećaj pijeska koji ulazi u oči“), zatim suzenje, fotofobija, crvenilo i oticanje kapaka, koji su obično zalijepljeni obilnim gnojnim iscjetkom. U pravilu, vid se pogoršava. Kod umjerenih do teških lezija javlja se upala rožnice (keratitis) s mogućom boli i naknadnim zamagljivanjem pa čak i nekrozom rožnice. U teškim slučajevima može doći do upale cijele očne jabučice. Najveći razvoj proces postiže 2-5. Oporavak traje tjednima i mjesecima.
Prilikom udisanja para i aerosola iperit karakterističan miris češnjaka (ili senfa) obično se osjeća pri 0,0015 mg/l, ali se miris brzo otupljuje. Ovo je karakteristična značajka djelovanja iperita: postupno osoba prestaje osjećati miris iperita, a pri koncentraciji reda 1-10-3 mg / l, što je 2 reda veličine niže od Cmax , javljaju se ozbiljne lezije. Simptomi lezije, u pravilu, bilježe se nakon 2-6 sati.Postoji osjećaj "bolnosti" u nazofarinksu, kašalj i curenje iz nosa. Kašalj se pogoršava. Glas postaje promukao, a ponekad i potpuno nestaje - razvija se afonija zbog oštećenja glasnica. Poremećaji glasa mogu trajati dugo (ponekad godinama).
Kada je izložena višim koncentracijama iperit zahvaćeni su dublji dijelovi dišnih organa. Kašljanjem se stvara obilni gnojni sputum. Temperatura raste do 38 ° C i više. Razvija se otežano disanje. Najčešće se smrtni slučajevi javljaju 2-4. i 7-9. dana nakon poraza. Uz povoljan tijek bolesti, oporavak počinje za 2-3 tjedna. Najčešće komplikacije su bronhitis (kronični), bronhiektazije, pneumoskleroza, koje je teško liječiti.
Na probavne organe iperit unesene kontaminiranom vodom i hranom. Latentno razdoblje - 1-3 sata ovisno o dozi. Zatim se javljaju bolovi u epigastričnoj regiji, mučnina, povraćanje, proljev (često s krvlju). U teškim slučajevima moguća je perforacija stijenki želuca i crijeva, praćena razvojem peritonitisa.
Obično kada je ozlijeđen iperit postoji resorptivni učinak.Promjene u središnjem živčanom sustavu očituju se općom letargijom, depresijom i pospanošću. Primjećuju smanjenje krvnog tlaka i kršenje srčane aktivnosti, metabolizma (gubitak težine - kaheksija). Sastav krvi se mijenja: prvih dana bilježi se leukocitoza, a sljedećih dana - leukopenija (do 2-3 tisuće leukocita na 1 mm3).
Godine 1943 u talijanskoj luci Bari dogodila se eksplozija na USS-u John Harvey, koji je prevozio kemijske granate senfa. Mornari su bili prisiljeni plivati u vodi kontaminiranoj senfom. Kod mnogih je, uz poraz kože, snažno izražen resorpcijski učinak iperita. Spašeni mornari umrli su u prva tri dana sa simptomima teške opće depresije i akutne hipotenzije, nalik stanju šoka. Drugi vrhunac mortaliteta zabilježen je 8-9. dana, kada se u oboljelih razvila teška leukopenija. To je bio glavni uzrok smrti - "sekundarne" infekcije i leukopenija. U pravilu su gotovo svi veterani Prvog svjetskog rata, zahvaćeni iperitom, u narednim desetljećima umrli s dijagnozama kronične bronhopneumonije, pneumoskleroze i tumora pluća. Kod utjecaja iperita najčešće dugotrajne posljedice su gubitak ili gubitak težine, ožiljci na koži koji mogu ograničiti funkcije udova, pneumoskleroza, bronhiektazije, leukopenija, smanjen imunitet, povećana osjetljivost na prehlade i zarazne bolesti, onkološke bolesti.
Nije postojao niti jedan otac iperita kojemu bi sumnjiva čast takvog otkrića u potpunosti pripala. Taj je plin otkriven dugo vremena - gotovo stotinu godina različiti kemičari uspješno su ga sintetizirali, ali to nije izazvalo nikakav interes, jer nisu otkrivena toksična svojstva ove tvari.
Situacija se promijenila 1913. U laboratoriju njemačkog kemičara Hermanna Fišera pala je tikvica sa sintetiziranim plinom. Incident je imao dvije posljedice. Prvo je Fisherov kolega, Englez Hans Clark, otišao u bolnicu na dva mjeseca. Drugo, Fischer je prijavio incident Njemačkom kemijskom društvu, koje je blisko surađivalo s njemačkom obrambenom industrijom. Do velikog rata ostala je godina dana, a generali su se zainteresirali za štetna svojstva tog plina.
Također napominjemo da ovaj plin danas nije odmah dobio uobičajeno ime. U početku se zvao IZGUBLJENO - prema prvim slovima imena njemačkih kemičara Lommela i Steinkopfa, koji su 1916. dobili instrukciju da se sjete formule novog plina i ostvare mogućnost njegove borbene uporabe na frontovima. Kemijski čisti plin bio je bez boje i mirisa, ali kada se proizvodio u vojne svrhe, dodavale su mu se nečistoće s mirisom senfa ili češnjaka, pa je LOST kasnije postao poznat kao iperit.
... i iperit je došao
Iza riječi "iperit" krije se cijela povijest Zapadne fronte Prvog svjetskog rata. Prvi svjetski rat, također zahvaljujući klasicima europske književnosti (o njemu smo, iz očitih razloga, pisali puno manje), povezan je s beskrajnim rovovima, nizovima žičanih ograda i velikim bitkama u kojima su stradale stotine tisuća ljudi. bez vidljivih promjena na prvoj crti bojišnice.
Jedna od tih bitaka bila je bitka kod belgijskog grada Ypresa na rijeci Yperl. Važno je napomenuti da je ovdje prvi put korišteno kemijsko oružje - na samom početku rata.
Borbe kod Ypresa trajale su od 1914. godine, a za bitke različitih godina koristili su se različiti nazivi. Bitke ljeta i jeseni poznate su kao bitka kod Passchendaelea, po imenu najbližeg sela. Passchendale su sudionici zapamtili po neprohodnom blatu u kojem su zapeli ljudi i alati: područje je bilo močvarno, a godina kišna. Na položaju njemačkih postrojbi na udaljenosti od nekoliko kilometara jedna od druge, dvojica Nijemca u vojničkim uniformama, međusobno nepoznati, čekala su zapovijed za napad. Ubrzo su ušli u svjetsku povijest: bili su Erich Maria Remarque i Adolf Hitler.
Do tada se Rusija povukla iz rata, a Nijemci su uspjeli prebaciti snage na Zapadni front. Nisu štedjeli truda i novca, računajući na dugo očekivani proboj. A u noći s 12. na 13. srpnja njemačko topništvo počelo je neobičnim granatama granatirati britanske položaje. Nečujno su pucali, ispuštajući plin s mirisom senfa na neprijateljske položaje. Na mjestu prve primjene novi plin je dobio ime.
- poručnik JW Brooke/IWM preko Getty Images
Od očiju do DNK
Te noći iperit je otrovao oko 2500 ljudi, od kojih je umrlo 87. Iperit ne ubija uvijek, samo 5% otrovanih umire. Ali ovaj plin nanosi nepopravljivu štetu zdravlju ljudi, čineći ih invalidima.
Iperit prvenstveno utječe na oči i kožu. Ako žrtvine oči nisu zaštićene, one mogu oslijepiti, privremeno ili trajno. U dodiru s iperitom na koži nastaju apscesi, a ulazak u pluća dovodi do teških oštećenja dišnih puteva. Osim toga, moderna istraživanja su pokazala da iperit može izazvati promjene DNK. Evo kako su ljudi upoznati s proizvodnjom iperita opisali učinke plina:
“Posljedice su se pokazale za nekoliko sati ili dan: crvenilo očiju, oštećenje glasnica, kašalj. Nakon nekoliko dana mirovanja i liječenja svi ti simptomi su nestali, a onda se sve ponavljalo iznova. Utjecaj iperita se kumulirao, te se u pravilu nakon nekoliko mjeseci javlja kronični bronhitis, zatim plućni emfizem, bronhijalne etaze, sklonost učestalim upalama pluća, neizlječiva profesionalna bolest i invalidnost.
Iperit se može tiho nakupljati u tijelu, osjeća se nekoliko sati nakon trovanja. Ljeti iperit zadržava svoja smrtonosna svojstva i nekoliko dana nakon prskanja, a u jesen i zimi žrtvu može čekati tjednima.
strašna lekcija
Tijekom Prvog svjetskog rata postalo je jasno: bolje je ne petljati se s plinskim oružjem, jer nalet vjetra može pretvoriti blisku pobjedu u užasan poraz. Međutim, borbena uporaba iperita nije tu završila. Iperit su Etiopljani otrovali talijanskim fašistima u drugoj polovici tridesetih, koristio ga je Sadam Hussein u ratu protiv Irana, poznati su i slučajevi korištenja tog plina od strane militanata IS* u Siriji.
Najzanimljiviji incident povezan s korištenjem iperita nakon Prvog svjetskog rata bilo je njemačko bombardiranje talijanske luke Bari 1943. u kojem su iskrcani saveznički brodovi. Amerikanci su u tajnosti pokušali na frontu dovesti značajan teret iperita. Njemački bombarderi uspjeli su potopiti transport plina, a kao rezultat toga, značajan broj civilnog stanovništva Barija patio je od iperita.
Korištenje iperita konačno je zabranjeno nakon stupanja na snagu Konvencije o kemijskom oružju 1997. godine. U trenutku njegovog potpisivanja u svijetu je ostalo 17.440 tona iperita. Ubrzo nakon potpisivanja uništeno je 86% svjetskih zaliha iperita, a njegovo uništavanje traje do danas.
*Islamska država (IS) je teroristička skupina zabranjena u Rusiji.
Ova skupina objedinjuje pretežno postojane tekuće tvari visokog ključanja, čiji je jedan od karakterističnih znakova oštećenja upala kože tijela različitog stupnja - od crvenila do stvaranja gnojnih infiltrata koji prelaze u čireve. Naravno, takve otrovne tvari u još većoj mjeri utječu na druge sustave tijela - osjetljivije i nježnije od kože: oči, unutarnje organe. Sredstva koja stvaraju mjehuri imaju i opći toksični učinak zbog svoje apsorpcije kroz kožu u krv. Neki predstavnici skupine također imaju nadražujuće djelovanje na sluznicu očiju i dišnih puteva.
Otrovne tvari mjehurastog djelovanja mogu uzrokovati smrtonosno trovanje ljudi i životinja. Uzimajući u obzir opskrbu suvremenih vojski pouzdanim sredstvima individualne i kolektivne zaštite, strani vojni stručnjaci ne postavljaju za cilj uništavanje ljudstva neprijatelja uz pomoć sredstava za mršavljenje kože. Namijenjeni su uglavnom za privremeno, iako dugotrajno, onesposobljavanje radne snage. Istodobno se rješavaju zadaće sputavanja borbenih djelovanja postrojbi i iscrpljivanja ljudstva. Prvi od njih je zbog sposobnosti blister agenata da dugo vremena zaraze teren i lokalne objekte, oružje i vojnu opremu, pozadinske objekte i naselja. Drugi se postiže visokom kožnom resorptivnom propusnošću OM-a, zbog čega je potrebno u potpunosti zaštititi tijelo. Svi predmeti kontaminirani blister agensima zahtijevaju otplinjavanje.
Za korištenje blister sredstava u stranim vojskama razvijene su kemijske topničke granate, eksplozivne kemijske zračne bombe i kemijske nagazne mine.
Učinak mjehura imaju predstavnici raznih klasa organskih spojeva, među kojima su najpoznatiji halogenirani tioeteri, tercijarni amini, primarni arsini, oksimi, ketoni i esteri jakih kiselina. Unatoč takvom heterogenom sastavu, tvari ove skupine imaju jedno zajedničko svojstvo - sve su alkilirajuća ili acilirajuća sredstva u odnosu na spojeve koji imaju atome sa slobodnim parovima elektrona.
Dakle, halogenirani tioeteri i tercijarni amini su sposobni alkilirati nukleofilne atome kisika, dušika i sumpora u različitim spojevima uz stvaranje novih veza element-ugljik - eter C-O, amin C-N. sulfid C-S. Sredstva za alkiliranje kože apscesa su stabilna, dugo zadržavaju svoja štetna svojstva, znakovi njihovog oštećenja obično se pojavljuju nakon određenog razdoblja latentnog djelovanja.
Acil halogenidi nekih dvobazičnih kiselina, kao što je fosgenoksim, a posebno halogenidi arsenske kiseline, imaju acilirajuća svojstva u odnosu na nukleofilne reagense. Oni aciliraju spojeve na atomima kisika, dušika ili sumpora, tvoreći s njima esterske, amidne ili tioeterske veze. Sredstva acilirajućeg djelovanja apscesa kože manje su otporna od alkilatora, njihov se toksični učinak očituje brže, budući da imaju i učinak kauterizacije.
Tvar HD (iperit) je od najvećeg interesa među sredstvima za stvaranje mjehura. Tvar L (lewisite), koja se može koristiti kao komponenta taktičkih smjesa, može biti od određene važnosti. Ne možemo u potpunosti isključiti mogućnost korištenja nekih predstavnika tzv. dušikovih iperita (sredstva HN1, HN2, HN3) za kontaminaciju izvora vode.

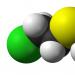
IPRIT - 2,2'-dikloretil tioeter
 Iperit |
 Dušična gorušica (agent HN3) |
 Luizit |
Priča. Od takozvanih OB sa žutim križem, bis-2-kloroetil tioeter nazvan "izgubljeni" prvi su upotrijebile njemačke trupe u noći s 12. na 13. srpnja 1917. u žestokoj borbi za Ypres. Poseban značaj ovog OB-a nije bio samo u tome da oboljele onesposobi za dulje vrijeme. S ovim novim OB usvojeno je sredstvo uništavanja od kojeg oprema za zaštitu dišnih organa nije štitila od već poznatih OB-a. Zbog posebnih svojstava iperita da prodire u uniforme i cipele i uzrokuje lezije na koži, već u malim količinama, napadnuti su bili prisiljeni zaštititi cijelo tijelo od njegovog djelovanja.
Kemijska stabilnost i iznimna fizikalna svojstva koja su osiguravala visoku otpornost iperita uzdigla su ovaj spoj na rang moćnog obrambenog oruđa kojemu se sputana njemačka vojska mogla učinkovito suprotstaviti ofenzivnim planovima saveznika dugo vremena.
U ožujku 1918. njemačke trupe ispalile su oko 250.000 mina iperita na dijelove 3. britanske armije. Saveznici su uspjeli upotrijebiti iperit, kojim je ovladala industrija, na liniji njemačke obrane tek u lipnju 1918. godine.
Gubici od iperita bili su veći nego od drugih OB. Prema britanskim podacima, njihovi gubici od iperita iznosili su 80% od ukupnog broja otrovanih OB; preostalih 20% uključivalo je one zahvaćene gušenjem OB i OB koji iritira nazofarinks.
Bis-2-kloretil tioeter dobiven u čistom obliku od Meyera 1886. sintetizirali su još ranije drugi kemičari: 1822. u Francuskoj Dupre, 1860. u Engleskoj Guthrie i u Njemačkoj Niemann. Dobili su ovaj spoj djelovanjem etilena na sumporov mono- ili diklorid. Već su Guthrie i Niemann utvrdili fiziološku aktivnost ove tvari, iako su je primili samo u nepročišćenom obliku. Oba kemičara su primijetila da je djelovanje ove tekućine i njezinih para na kožu uzrokovalo stvaranje mjehurića. Godine 1891. njemački oftalmolog Leber izvijestio je o svojim eksperimentima proučavanja učinka iperita na oči i nastalu upalu.
 Albert Niemann (20. svibnja 1834., Goslyar - 19. siječnja 1861., Goslyar) Njemački farmaceutski kemičar, tvorac iperita. Godine 1849. Niemann je postao ljekarnički šegrt u Göttingenu. Godine 1852., u dobi od 18 godina, upisao se na Sveučilište u Göttingenu na Odsjeku za tehnologiju farmaceutskih oblika Filozofskog fakulteta. Godine 1858. uspješno je položio ispit za farmaceuta i počeo raditi u laboratoriju Sveučilišta u Göttingenu kod profesora F. Wöhlera, koji je mladom istraživaču postavio dva zadatka: provesti kemijsku reakciju sumpor-klorida s etilenom i odrediti kemijski sastav listova koke. S oba zadatka Niemann se sjajno snašao. U prvom slučaju dobio je iperit (iperit), koji je tijekom Prvog svjetskog rata korišten kao kemijsko oružje. Kao rezultat prvog plinskog napada na rijeku Ypres, ubijeno je 5000 ljudi, a 15000 je ostalo invalida. Provodeći pokuse, Niemann se sam otrovao, jer nije znao ništa o toksičnim svojstvima iperita i nije poduzeo nikakve zaštitne mjere. Pateći od trovanja, on je ipak uspješno proveo istraživanje listova koke i 1860. godine izolirao alkaloid u čistom obliku kojem je dao naziv "coca-in" (tvar unutar koke). Niemann je opisao specifičnu utrnulost jezika nakon kontakta s kokainom u svojoj disertaciji "O novoj organskoj bazi sadržanoj u lišću koke". Prijavljen je za zvanje doktora kemije, ali 19. siječnja 1861. umire kod kuće u Goslaru od upale pluća u 26. godini života, ne dovršivši obećavajući znanstveni rad. |
 Victor Meyer (Victor Meyer) (8. rujna 1848., Berlin - 18. kolovoza 1897., Heidelberg) Studirao je kemiju u Heidelbergu i Berlinu. Godine 1871. pozvan je da vodi odjel za organsku kemiju na Sveučilištu u Stuttgartu. Od 1872. do 1885. radio je na Politehničkom institutu u Zürichu. Godine 1885. Viktor Meyer je radio kao profesor u Göttingenu i konačno 1889. na Sveučilištu u Heidelbergu. Victor Meyer je 1878. razvio metodu za određivanje molarne mase tekućih spojeva pomoću aparata nazvanog po njemu, Victor Meyer aparat. Otkrio je i organske nitro spojeve, otkrio 1882. novu tvar, koju je nazvao tiofen, te je prvi put izolirao u čistom obliku i opisao fiziološko djelovanje iperita (iperit, S-Lost). Smislio termin "stereokemija". Po njemu je nazvana reakcija koju je otkrio za sintezu nitro spojeva. |
 Frederic Guthrie (Frederick Guthrie) (1833 - 1886) Britanski znanstveni pisac i profesor. Godine 1874. postao je suosnivač Londonskog fizikalnog društva (danas Institut za fiziku) i bio njegov predsjednik od 1884. do 1886. godine. Guthrie je bio uvjeren da se znanost ne treba temeljiti na teoriji, već na eksperimentima. Guthrie je prvi opisao učinke "iperita" na ljude. Neovisno o Albertu Niemannu, sintetizirao je plin iperit 1860. koristeći reakciju etilena i sumporovog diklorida. Frédéric Guthrie je također bio lingvist, dramatičar i pjesnik. Pisao pod pseudonimom Frederick Cerny. Njegov sin Frederick Bikel Guthrie bio je poljoprivredni kemičar. |
Neposredno prije Prvog svjetskog rata, Englez Clark, učenik Emila Fischera, proučavao je neke reakcije bis-2-kloroetil tioetera koji je sam sintetizirao na Kemijskom institutu Sveučilišta u Berlinu.
Otkako je iperit postao poznat kao agens, bio je predmet znanstvenih istraživanja. Uz tehnološke promjene, načini za njegovo dobivanje u principu su se neznatno promijenili. Metode koje su opisali Meyer, Guthrie i drugi dodatno su razvijene i modificirane za korištenje u industrijskoj mjeri.
Od tada su talijanski fašisti tijekom okupacije Etiopije koristili iperit, a tijekom Drugog svjetskog rata velike zalihe ovog OM-a pripremale su mnoge zaraćene sile. Nipošto nije izgubio vojni značaj, unatoč postojanju učinkovitijih bojnih glava. Mogućnosti njegove uporabe u borbi za osiguranje ili ometanje borbenih djelovanja, kao i za postavljanje barijera, raznolike su, posebice uz pomoć suvremenih sredstava primjene.
Iperit se smatra jednim od važnih agenasa i spada u standardne agente mnogih vojski.
Metode primanja. Bis-2-kloretil tioeter se može dobiti na različite načine: kloriranjem bis-2-hidroksietil tioetera (tiodiglikola) s odgovarajućim sredstvima za kloriranje; izravna sinteza iz etilena i sumpornih klorida; fotokemijska sinteza iz etilen klorida i sumporovodika ili 2-kloretil merkaptana.
Metodu dobivanja iz tiodiglikola koristio je i Meyer, koji je kao sredstvo za kloriranje koristio fosfor triklorid:
3S(CH 2 CH 2 OH) 2 + 2PCl 3 → 3S(CH 2 CH 2 CI) 2 + 2H 3 PO 3
Clark je kasnije zamijenio fosforni triklorid s klorovodikom.
S (CH 2 CH 2 OH) 2 + 2HCl → S (CH 2 CH 2 CI) 2 + H 2 O
i Steinkopf i sur. preporučuje se korištenje sulfuril klorida ili tionil klorida:
S(CH 2 CH 2 OH) 2 + SOCI 2 → S(CH 2 CH 2 Cl) 2 + SO 2 + H 2 O
Tiodiglikol se dobiva analogno općoj metodi za sintezu tioetera reakcijom alkil halida, u ovom slučaju etilen klorohidrina, sa sulfidom alkalnog metala
2ClCH 2 CH 2 OH + Na 2 S → S(CH 2 CH 2 OH) 2 + 2NaCl
Ili od etilen oksida i sumporovodika:

Etilen-klorohidrin se dobiva djelovanjem hipoklorne kiseline na etilen ili, s istim uspjehom, iz etilen oksida i klorovodika:
CH 2 \u003d CH 2 + HOCl → CH 2 OH-CH 2 Cl

Izravnu sintezu iperita iz etilena i sumpornih klorida (razvoj eksperimentalnih istraživanja Guthriea i Niemanna) saveznici su tijekom Prvog svjetskog rata odabrali kao najprikladniju i najbržu. Koristili su razne mješavine mono- i diklorida sumpora i pritom dobivali velik broj proizvoda za čiju smjesu su smatrali čistim spojem.
Papa je izvršio sintezu iperita - od sumpor monoklorida i etilena na 70 ° C i jednoličnog snažnog miješanja koristeći aktivni ugljen kao katalizator:
S 2 Cl 2 + 2CH 2 \u003d CH 2 → S (CH 2 CH 2 Cl) 2 + S
Industrijske metode dobivanja. U velikim industrijskim razmjerima, proizvodnja iperita provodi se prema metodama Meyera i Guthriea. Moguća je industrijska fotokemijska sinteza, koja je uvedena u vodećim zemljama za proizvodnju organske tvari u vezi s reorganizacijom takvih poduzeća.
Dok se u Njemačkoj te u Prvom i Drugom svjetskom ratu pretežno koristio tzv. tiodiglikolni (oksol) proces (modificirana Meyerova metoda), proizvodnja iperita u Francuskoj, Engleskoj i SAD-u temeljila se na izravnoj sintezi iz etilen i sumporni kloridi.
U oksolnom procesu, polagana struja suhog klorovodika se propušta u tiodiglikol kako bi se zamijenile hidroksi skupine. Reaktori i cijeli komunikacijski sustav instalacije izrađeni su od olova ili olovom. Time se sprječava stvaranje soli željeza. Proces kloriranja provodi se na 50°C, održavajući temperaturu pomoću sustava grijanja i hlađenja. Nakon potpune apsorpcije klorovodika, dobiveni iperit visoke gustoće se uklanja iz reaktora i šalje u vakuum destilaciju, gdje se voda destilira pod sniženim tlakom. Iperit se pročišćava vakuumskom destilacijom ili obradom organskim otapalima.
U usporedbi s izravnom sintezom, proizvodnja iperita postupkom tiodiglikola je radno intenzivnija, ali dovodi do većeg prinosa (95%) proizvoda bolje kvalitete.
Izravna sinteza iperita, koju su koristili saveznici, bila je podvrgnuta stalnim poboljšanjima nakon Prvog svjetskog rata. Proces se sastoji od četiri faze: I) dobivanje sumpor-diklorida iz elemenata; 2) priprema otopine sumpor-diklorida u tetrakloridu ugljika; 3) dodavanje sumporovog diklorida etilenu propuštanjem etilena u otopinu, čime se dobiva razrijeđena otopina iperita; 4) odvajanje iperita od otapala radi njegove ponovne upotrebe u procesu.
Sva ova četiri proizvodna koraka mogu se izvoditi kontinuirano u jednom koraku. Reaktori koje su koristili Francuzi imali su visinu od 18 m. U cijelosti su bili izrađeni od olova i bili su opremljeni složenim sustavom rashladnih zavojnica. Svaki takav divovski stup imao je svoj masivni serpentinasti kondenzator napravljen od srebra.
Tijekom propuštanja etilena u otopinu ugljik tetraklorida, reakcijska temperatura je održavana na 60-70°C. Etilen se mora prethodno dobro osušiti i očistiti od alkohola. Prinos je bio oko 80%.
fizikalna svojstva.Čisti bis-2-kloretil tioeter je bezbojna uljasta tekućina bez mirisa. Tehnički proizvodi obojeni su nečistoćama u bojama od žute do tamno smeđe i karakterističnog slatkog mirisa. Ispod točke tečenja (13,5°C), tioeter kristalizira kao dugi bezbojni rombični kristali. Uz pomoć preciznih mjerenja, njegova točka taljenja je postavljena na 14,44-14,45°C; obično se podaci kreću od 14,1-14,5°C. Tehnički senf stvrdnjava se na temperaturi od 5 do 10°C.
Kada se zagrije do točke vrenja (oko 217 ° C), iperit se razgrađuje s stvaranjem smrdljivih proizvoda koji mirišu na senf ili češnjak.
Iperit američke proizvodnje, takozvani HD, ima balu tzv. 228°C, mp. 14°C.
Iperit je teži od vode (d 20 1,2741). Zbog neke površinske aktivnosti smanjuje površinsku napetost vode i u maloj mjeri se širi po njoj u tankom sloju, poput uljnog filma. Dodavanjem više tenzida koji se otapaju u iperitu može se povećati učinkovito širenje. Tlak pare bis-2-kloretil tioetera je prilično nizak (0,1 mmHg na 20°C).
Iako s porastom temperature zraka otpor iperita opada, ali zbog njegovog isparavanja, zrak se obogaćuje parama iperita. U vrućim danima bez vjetra stvara se koncentracija koja je gotovo 50 puta veća od uobičajeno potrebne koncentracije toksičnosti. Čak i uz brzinu vjetra od 2 m/s i gustoću infekcije od oko 5 g/m2, na otvorenim područjima pare iperita su i dalje učinkovite 3-4 sata.
Na temperaturama nižim od 15°C, osobito u predjelima s vegetacijom ili jako šumovitom, zaraza traje više od tjedan dana. Ispod 4°C, pri brzinama vjetra iznad 8 m/s, pare iperita u zraku više nisu učinkovite.
Kako bi se povećala stabilnost iperita, a time i njegova učinkovitost, dodaju se aditivi koji povećavaju njegovu viskoznost (tzv. viskozne formulacije). Ovi aditivi jamče ne samo dugotrajno djelovanje, već i otežavaju otplinjavanje, što je u ovom slučaju teško izvedivo s vodenim otopinama za otplinjavanje. Povećanje viskoznosti istovremeno potiskuje stvaranje aerosola i potiče stvaranje većih kapljica (umjesto dima) kada se raspršuju iz zrakoplova.
Topljivost bis-2-kloretil tioetera u vodi je niska, oko 0,8 g/l. U organskim otapalima - haloalkanima, benzenu, klorobenzenu - otapa se kao i u biljnim ili životinjskim mastima. Dok je topljivost OM u apsolutnom etanolu iznad 16°C gotovo 100%, u 92% etanolu doseže jedva 25%. Ima ograničenu mješljivost s otapalima kao što su nafta i dizelsko gorivo, a postoje područja koja se ne miješaju. Pri niskoj temperaturi za otapanje iperita mogu se koristiti samo frakcije niskog vrenja, kao što su laki benzin i petrolej eter, koji su izvrsna sredstva za ekstrakciju iperita.
Zbog svoje visoke difuzije iperit brzo prodire kroz brojne tvari i materijale. Dakle, tekući iperit brzo prodire kroz tkanine, kožu, karton, papir i tanku gumu. Brzo se upija u porozne nehomogene materijale kao što su cigla, beton, golo drvo i stari napukli uljni premazi.
Kemijska svojstva. Na običnoj temperaturi, bis-2-kloretil tioeter je stabilan spoj. Kada se zagrije iznad 170 ° C, razgrađuje se s stvaranjem otrovnih proizvoda neugodnog mirisa različitih sastava. Iznad 500°C dolazi do potpune toplinske razgradnje. Kratkotrajno zagrijavanje čak i iznad 300°C gotovo ne dovodi do stvaranja produkata raspadanja, pa se iperit smatra relativno otpornim na detonaciju.
U odnosu na metale na uobičajenoj temperaturi iperit je inertan. Kontaminirani proizvod, koji obično sadrži vodu i klorovodik, nagrizat će čelik. Rezultirajuće soli željeza doprinose koroziji. Zbog ispuštenih plinova - vodika, sumporovodika, etilena i drugih produkata raspadanja - mora se uzeti u obzir porast tlaka u zatvorenim spremnicima, minama, bombama i brodskim kontejnerima.
Hidroliza. U vodenim otopinama bis-2-kloretil tioeter se hidrolizira uz zamjenu atoma klora hidroksilnim skupinama. U prisutnosti viška klorovodične kiseline, reakcija je reverzibilna. Obično ide s stvaranjem netoksičnog tiodiglikola:
Voda koja sadrži male količine (~ I%) iperita može se otpliniti kuhanjem 15 minuta. Na temperaturama ispod 0°C hidroliza se nastavlja nekoliko dana. Jače onečišćena voda mora biti podvrgnuta uobičajenim metodama otplinjavanja i pročišćavanja.
Zbog hidrolize, koncentracija iperita u zraku nakon jednog dana smanjuje se za gotovo red veličine.
Zbog niske topljivosti bis-2-kloroetil tioetera, ovisno o prisutnoj količini, voda je duže vrijeme kontaminirana, jer umjesto hidroliziranog iperita u vodu postupno difundiraju novi dijelovi iperita. Eksperimenti pokazuju da RH pod vodom ostaje djelotvoran godinama ako se malo ili nimalo miješa.
Budući da je OM praktički netopiv u vodi, hidroliza se može dogoditi samo na samoj granici. Brza hidroliza nužno zahtijeva snažno miješanje. Ako miješanje nije dovoljno, tada, osobito pri korištenju tehničkih vrsta iperita, zbog nečistoća i nečistoća sadržanih u njemu, kao rezultat nuspojava, nastaje treća faza u kojoj je iperit slabo topiv i koja štiti i "čuva" ga od daljnje hidrolize.
Iz gore rečenog jasno je da je za postizanje potpune hidrolize potreban veliki višak vode i snažno miješanje ili zagrijavanje, a još bolje ako su sva tri faktora aktivna.
Kako bi se hidroliza dovela izvan granice faza heterogenog sustava, potrebno je smjese homogenizirati, recimo, dodavanjem otapala koja se mogu miješati i s vodom i s iperitom (metanol i sl.). Takvi se aditivi koriste, posebice, kada se koriste vodene otopine za otplinjavanje.
Brzina hidrolize bis-2-kloretil tioetera ovisi o koncentraciji vodikovih iona - tome pridonosi lužnata sredina, dok kisela sprječava i usporava hidrolizu.
Reakcija bis-2-kloretil tioetera s amonijakom, čak i pri temperaturama iznad 150°C, vrlo je spora. Međutim, pod pritiskom već na 60 ° C nastaje 1,4-tiazan - bezbojna tekućina koja dimi na zraku:

S primarnim aminima u alkoholnim otopinama u normalnim uvjetima dolazi do slične ciklizacije tioetera.
Oksidacija. Kao tipičan predstavnik tioetera, iperit se može lako oksidirati u sulfoksid ili sulfon prema jednadžbi:
Kao oksidirajuća sredstva prikladni su vodikov peroksid, dušična kiselina, kalijev permanganat, kromna kiselina, izbjeljivač, hipoklorit itd.
Iako su oksidacijski produkti iperita - sulfoksid i bis-(2-kloretil)-sulfon - vrlo toksični spojevi, a sulfoksid čak ima i stvaranje mjehura, oksidacija iperita jedna je od važnih reakcija otplinjavanja. Oksidacijski proizvodi su čvrste kristalne tvari, pa stoga nemaju svojstva resorpcije kože.
Pod djelovanjem jakih oksidacijskih sredstava ili u težim uvjetima, reakcija ide dalje od stvaranja sulfoksida i sulfona i završava potpunom razgradnjom tioetera.
Bis-2-kloretil tioeter se oksidira na 150°C s suviškom koncentrirane HNO3 u sulfoksid. Reakcija je brza i egzotermna. Može ići dalje - s oslobađanjem dušikovog dioksida i stvaranjem sulfona na kraju:

Pod djelovanjem dimljene dušične kiseline i zagrijavanjem nastaje npr. 2-kloroetansulfonska kiselina ClCH 2 CH 2 SO 2 OH.
Da bi se dobio bis-(2-kloretil)-sulfoksid, bis-2-kloretil tioeter se dodaje kap po kap na 20°C u koncentriranu HNO3. Ako se smjesa razrijedi s vodom, sulfoksid se taloži kao bijeli talog, koji se prekristalizira iz 60% etanola (bezbojne pahuljice, t.t. 110°C).
Kada se iperit obradi s krom-anhidridom u octenoj kiselini na 100°C (20 min zagrijavanja), nastaje čisti bis-(2-kloretil)-sulfon, t.t. 55-56°C.
Suho bjelilo uglavnom oksidira iperit, ali se istodobno događa i kloriranje. Pod određenim uvjetima, ova brza egzotermna reakcija je popraćena paljenjem neizreagiranog tioetera. Kao produkti reakcije identificirani su klorovodik, ugljični dioksid, sumporov dioksid, haloalkani (npr. dikloretan, kloroform), kloral, sumporni kloridi itd. Kada se koristi suspenzija izbjeljivača, reakcija teče mirnije s stvaranjem uglavnom sulfoksida i sulfona .
Hipokloriti u vodenim otopinama djelomično oksidiraju, djelomično kloriraju bis-2-kloretil tioeter.
Kloriranje. Pod djelovanjem klora i donekle drugih sredstava za kloriranje, kao što su dikloramin i sulfuril klorid, dobivaju se različiti klorirani tioeteri i sulfoksidi. Ispod su formule spojeva dobivenih kloriranjem iperita:

Svi osim prvog spoja, koji je krutina (bijele nestabilne iglice), su tekućine. Ovisno o broju atoma klora i njihovom položaju u molekuli, ovi produkti kloriranja imaju samo slabu ili nikakvu fiziološku aktivnost.
Reakcije s kloraminima. Mono- i dikloramini lako reagiraju s bis-2-kloretil tioeterom. Dikloramin ima prednost u odnosu na monokloramin u tome što se reakcija odvija u homogenom mediju, budući da je dikloramin relativno lako topiv u organskim otapalima. Produkti reakcije su netoksični.
Reakcija s heksametilentetraminom. Jedna od reakcija važnih za otplinjavanje kože je učinak heksametilentetramina na hidrolizu iperita koji su predložili Brewer i Bouchereau. Klorovodik koji se oslobađa tijekom hidrolize reagira s heksametilentetraminom i nastaje formaldehid, koji zbog učinka tamnjenja potiče lokalizaciju i bolje zacjeljivanje lezija senfa na koži. Korištenje heksametilentetramina kao stabilizatora ovog OM-a objašnjava se sličnom reakcijom.
Reakcija je izražena sljedećom jednadžbom:
2S (CH 2 CH 2 Cl) 2 + 10H 2 O + (CH 2) 6 N 4 → 2S (CH 2 CH 2 OH) 2 + 4NH 4 Cl + 6HCHO
Reakcije s metalnim solima. Poput nesupstituiranih tioetera, iperit ima sposobnost tvoriti adukte s metalnim solima, takozvane sulfonijeve soli. Nastali kompleksi ponekad su teško topljivi u vodi i imaju karakterističnu boju, zbog čega su našli primjenu u kvalitativnoj i kvantitativnoj analizi.
Najčešće se koriste halogenidi teških metala - jodid i živin klorid, kloridi bakra, cinka, titana, platine, paladija i zlata.
Bis-2-kloretil tioeter tvori kompleksni spoj sa zlatnim kloridom:
S (CH 2 CH 2 Cl) 2 + AuCl 3 → [Cl 2 AuS + (CH 2 CH 2 Cl) 2] Cl -
toksična svojstva. Gorušica djeluje kao kontaktni i inhalacijski otrov; pare i kapi iperita utječu na oči. Kao što je već spomenuto, zbog velike topljivosti iperita u lipidima ili njegove resorpcije u svim organima dolazi do opće intoksikacije koje su uzrok njegovog općeg toksičnog djelovanja.
Sposobnost iperita da prodre u kožu ovisi o temperaturi. Brzina resorpcije je proporcionalna porastu temperature: na 21-23°C iznosi oko 1,4·10 -3 mg/cm 2 ·min, na višoj temperaturi - oko 2,7·10 -3 mg/cm 2 ·min. Tijekom ovog pokusa, provedenog na podlaktici, relativna vlažnost zraka zasićenog parama iperita bila je oko 46%. Količine RH reda 6·10 -3 mg, prodirući kroz kožu, u 50% slučajeva uzrokovale su stvaranje mjehurića.
U 100% slučajeva dolazi do stvaranja eritema pri dozi iperita od 0,01 mg/cm 2 površine kože, mali mjehurići nastaju pri 0,1-0,15 mg/cm 2, veliki - na 0,5 mg/cm 2 .
Oči su pogođene malim količinama RH. Dakle, koncentracija od 1,2·10 -3 mg/l nakon 45 min ekspozicije uzrokuje fotofobiju, spazam kapaka i upalu konjunktive, koja traje do 4 tjedna. Oporavak nastupa nakon 3 mjeseca. Više koncentracije uz manju izloženost dovode do opasnih oštećenja oka.
Uz vrijeme izlaganja od 2-5 minuta, koncentracija od 0,03 mg/l je smrtonosna, koncentracije od 0,01 mg/l nakon izlaganja od 15 minuta su vrlo opasne, dovode do lezija kože i teške upale sluznice oči.
Uz subkutanu injekciju, smrtonosna doza je 40-60 mg/kg tjelesne težine.
Reference
Iperit, bis (2-kloretil) sulfid- organosumporni spoj sastava (ClCH 2 CH 2) 2 S. Plin iperit prvi je dobio njemački kemičar Viktor Meer 1886. godine. Tome je prethodio rad kemičara Despre (1822), Neman (1859), Gutman (1860), koji su istraživali ovu klasu spojeva, ali je nisu izolirali u čistom obliku.
Čisti iperit je uljna tvar bez boje i mirisa (tehnički iperit ima miris češnjaka i gorušice i žuto-smeđe boje). Slabo je topiv u vodi i neograničeno u mnogim organskim otapalima.
Tijekom Prvog svjetskog rata iperit se koristio kao sredstvo za mjehuriće. Međunarodna oznaka za iperit kao kemijsko oružje — HD. Municija s iperitom u Njemačkoj bila je označena žutim križem (dio je borbene smjese žuti križ, njemački Gelbkreuz, u SAD-u su kodirani s dva zelena prstena.
Godine 1993., kao rezultat potpisivanja Konvencije o kemijskom oružju, zabranjena je uporaba iperita kao kemijskog oružja. Uvršten je na listu 1. koja regulira proizvodnju i promet opasnih tvari.
Termin iperit dolazi od imena belgijskog grada Ypresa, u blizini kojeg su u noći 13. srpnja 1917. godine ovu tvar prvi put upotrijebile njemačke trupe kao kemijsko oružje.
Toksični učinak iperita je oštećenje očiju, kože i dišnih puteva. Simptomi trovanja pojavljuju se s latentnim razdobljem od 2:00, ali se za vrućeg vremena i mokre kože pojavljuju odmah. Posljedica kontakta s tvari je pojava vezikula sa žućkastom tekućinom, koji dugo zacjeljuju i ostavljaju ožiljke. Pri koncentraciji iperita u zraku od 0,03 mg/l smrt nastupa unutar 2-5 minuta.
Tvar brzo prodire u građevinske materijale, upija je tekstil, guma, papir, pa je moguće trovanje i pri kontaktu s kontaminiranim predmetima.
Fizička svojstva
Čisti iperit je bezbojna uljasta tekućina s blagim mirisom na ricinusovo ulje, tehnički proizvod je žute do tamnosmeđe boje i oštrog mirisa (češnjak ili senf). Gustoća pare u zraku je 3,5. Tlak pare na 20 ° C - 0,072 mm Hg. Umjetnost.
Talište čiste tvari je 14,5 °C, a za tehnički iperit, zbog prisutnosti nečistoća, nešto je niže. Kako bi se spriječilo smrzavanje tijekom Prvog svjetskog rata, dodani su mu kloropikrin, klorobenzen, tetraklorometan.
Slabo topiv u vodi (manje od 1%), beskonačno topiv u uljima, mastima, benzinu, kerozinu, acetonu, ugljičnom tetrakloridu, alkoholima, kloropikrinu. Miješa se s drugim otrovnim tvarima: etildikloroarsin, fenildikloroarsin, lewisite.
Hlapljivost iperita: 75 mg/m³ na 0°C (kruta), 610 mg/m³ na 20°C (tekućina), 2.860 mg/m³ na 40°C (tekućina).
Ne izaziva koroziju kada se skladišti u aluminijskim spremnicima; mjed brzo korodira na temperaturi od 65 ° C. U vlažnom zraku, industrijski iperit s nečistoćama koje nastaju kao rezultat njegove razgradnje (sumporovodik, klorovodik, etilen) uzrokuje korodiranje čelika.
Priznanica
Postoje tri glavna načina za sintetizaciju iperita: s oksiranom (etilen oksidom), etilenom i vinil kloridom.
Sinteza s oksiranom provodi se na temperaturi od 80 °C u dva stupnja: sulfoniranje s vodikovim sulfidom ili hidrosulfidima kako bi se dobio tiodiglikol, a zatim - kloriranje spoja:
Nakon vakuumske destilacije dobiva se iperit čistoće od 95%. Prinos sinteze je 90%. Ovu metodu prvi je proveo njemački kemičar W. Meer 1886. godine.
Sinteza iperita od etilena a sumporni kloridi razvijeni su tijekom Prvog svjetskog rata, a nakon njegova završetka. Prevladavajući način pripreme je reakcija sa SCl 2:
Sumporni klorid (II) obično ima nečistoće dikloropolisulfida (S 2 Cl 2, S 3 Cl 2, S 5 Cl 2), pa konačni proizvod može biti kontaminiran kloretilpolisulfidamom (ClCH 2 CH 2) 2 S x. Slobodni klor prisutan u reakcijskoj smjesi može tvoriti poliklorirane nečistoće.
Dobivanje iperita s vinil kloridom je najprikladniji, s obzirom na lakoću reakcije - događa se već na sobnoj temperaturi (15-25 ° C):
Kao inicijatori reakcije koriste se organski peroksidi i ultraljubičasto zračenje. Reakcija unutar 10 minuta s prinosom proizvoda od oko 75%. Kada se umjesto sumporovodika koristi 1-merkapto-2-kloroetan HSCH 2 CH 2 Cl, prinos reakcije se približava 100%.
Kemijska svojstva
Iperit se polagano hidrolizira u klorovodičnu kiselinu i tiodiglikol:
Slabo je topiv u vodi, pa možda neće dugo doživjeti hidrolizu. Proces hidrolize ubrzava se povećanjem temperature i prisutnošću lužina.
Jedna od najvažnijih reakcija je djelovanje urotropina tijekom hidrolize: produkt interakcije stvorene klorovodične kiseline s urotropinom je formaldehid, koji potiče zacjeljivanje rana:
Pod djelovanjem jakih oksidacijskih sredstava (kalijev permanganat, kromatna kiselina, dušična kiselina, hipoklorit) sulfid se oksidira u sulfoksid, a zatim u sulfon:
Iako su produkti oksidacije također otrovne tvari, ova metoda se koristi za otplinjavanje jer su kristalne tvari i ne utječu na kožu.
Kao i drugi tioeteri, iperit je sposoban tvoriti sulfonijeve spojeve s metalnim solima. Nastali kompleksi imaju karakterističnu boju i ponekad nisku topljivost, pa se ponekad koriste u analitičkoj kemiji. Češće se reakcija provodi s halogenidima teških metala: jodidi i kloridi bakra, cinka, titana, platine, aure:
Toksičnost
Gorušica djeluje na ljudsko tijelo ili je otrov za udisanje i kontakt: kapi i aerosoli iperita utječu na dišne puteve, kožu i oči.
Tvar može prodrijeti u tijelo kroz kožu. Ova sposobnost ovisi o temperaturi okoline: na 21-23 ° C penetracija je 1,4 10 -3 mg / (cm² min), pri visokim temperaturama - oko 2,7 10 -3 mg / (cm² min). Prodor iperita u količini od 6 · 10 -3 u polovici slučajeva uzrokuje pojavu mjehurića. Formiranje malog eritema javlja se u dozi od 0,01 mg / cm kože, velikog - u dozi od 0,5 mg / cm Oči su zahvaćene čak i iperitom niske koncentracije: njegov učinak u koncentraciji od 1,2 10 - 3 mg/l tijekom 45 minuta izaziva upalu očiju, grčeve kapaka, fotofobiju, koji traju i do 4 tjedna.
Djelovanje iperita u koncentraciji od 0,03 mg / l tijekom 2-5 minuta je smrtonosno. Koncentracija od 0,01 mg/l opasna je u roku od 15 minuta i dovodi do teških oštećenja očiju i kože.
Dodir iperita na kožu u početku ne uzrokuje nikakvu nelagodu. Tijekom prvih 2-5 minuta prodire u kožu, zatim se otapa u potkožnoj masnoći i nakon toga, nakon 20-30 minuta, potpuno se apsorbira i ulazi u krvotok. Nakon upijanja nastupa latentno razdoblje u trajanju od 2 sata do jednog dana, ovisno o dozi, temperaturi i vlažnosti zraka, strukturi i vlažnosti kože. U vrućem vremenu, s vrućom, vlažnom kožom ili njezinim osjetljivim područjima, razdoblje latentnog djelovanja značajno se smanjuje i može biti gotovo odsutno.
Prvi znakovi oštećenja nakon završetka razdoblja latentnog djelovanja očituju se u obliku svrbeža, peckanja i crvenila kože (eritema) na mjestima dodira s tekućim ili plinovitim iperitom. Koža se rasteže, postaje suha i topla. Uz male doze, ove pojave nestaju nakon nekoliko dana. Pri većim dozama razvija se oteklina, uz rubove koje se 16-30 sati nakon kontakta s otrovom pojavljuju mnogi mali mjehurići. U budućnosti se spajaju u veliki ili jedan veliki mjehur s bezbojnom ili žućkastom tekućinom. Mjehurići pucaju i na koži se stvaraju bolni čirevi gorušice čije cijeljenje može trajati više od 2 mjeseca. Sekundarna infekcija može dovesti do gnojne upale zahvaćenih područja kože. Ožiljci ostaju na svom mjestu.
Zaštita
Glavna zaštita od iperita, posebno očiju, lica i dišnih puteva, je plinska maska. Nakon dodira s pamučnom odjećom, iperit je potpuno impregnira u 3:00, što može dodatno dovesti do dodatnog oštećenja. Kako bi se spriječilo prodiranje smjese na i ispod odjeće, koriste se posebna zaštitna odijela.
Oksidirajuća sredstva i klorirajuća sredstva (hipoklorit, bjelilo, kloramidi) koriste se za tretiranje kože (uklanjanje manjih kapi iperita), odjeće ili predmeta koji su došli u dodir s iperitom.
Priča
Sintetizirali su ga u Njemačkoj Niemann (1859.) i (nezavisno) britanski znanstvenik Frederick Guthrie 1860. godine. Iperit je prvi put upotrijebila Njemačka 12. srpnja 1916. protiv anglo-francuskih trupa na koje su ispaljene mine s uljnom tekućinom u blizini belgijskog grada Ypresa (otuda naziv ove tvari).
Tijekom Drugog svjetskog rata Poljska je samo jednom upotrijebila iperit, pri čemu su dva njemačka vojnika poginula, a dvanaest je zadobilo različite stupnjeve ozljeda. Osim toga, iperit je korišten tijekom gušenja ustanka u Xinjiangu 1934. godine, u italo-etiopskom ratu 1935.-1936. U gradu Dzerzhinsk, tijekom Drugog svjetskog rata, postojala je tajna tvornica u kojoj su se bombe punile iperitom. Radnici ove biljke, koji su zadobili plućne lezije iperitom, u poslijeratnom razdoblju do 90-ih godina XX. stoljeća. godišnje podvrgnuti liječenju u posebnom sanatoriju "Karasan" 15 kilometara jugozapadno od Alushte (između Alushte i Jalte).
Priznanica
Gorušica se dobiva na dva načina:
Od etilena CH2=CH2 i sumpornih klorida kao što su S2Cl2 ili SCl2:
SCl2 + 2 C2H4 → (ClCH2CH2)2S
Od tiodiglikola S(CH2CH2OH)2 i fosfornog triklorida PCl3:
3(HO-CH2CH2)2S + 2PCl3 → 3(Cl-CH2CH2)2S + 2P(OH)3
ili tiodiglikola i klorovodične kiseline:
(HO-CH2CH2)2S + 2HCl → (Cl-CH2CH2)2S + 2H2O
Fizička svojstva
Iperit je bezbojna tekućina s mirisom češnjaka ili senfa. Tehnički iperit je tamnosmeđa, gotovo crna tekućina neugodnog mirisa. Talište je 14,5 °C, vrelište je 217 °C (uz djelomičnu razgradnju), gustoća je 1,280 g/cm³ (na 15 °C).
Iperit je lako topiv u organskim otapalima - haloalkanima, benzenu, klorobenzenu - kao iu biljnim ili životinjskim mastima; topljivost u vodi je 0,05%. Dok je topljivost u apsolutnom etanolu iznad 16°C gotovo 100%, u 92% etanolu jedva doseže 25%.
Zbog neke površinske aktivnosti smanjuje površinsku napetost vode i u maloj mjeri se širi po njoj u tankom sloju, poput uljnog filma. Kao rezultat dodavanja 1% visokomolekularnog amina C22H38O2NH2, širenje iperita u vodi povećava se za 39%.
Gorušica hidrolizira vrlo sporo s vodom, brzina hidrolize se naglo povećava u prisutnosti kaustičnih lužina, kada se zagrijava i miješa.
Iperit snažno reagira s klorirajućim i oksidirajućim sredstvima. Budući da se time stvaraju netoksični proizvodi, gornje reakcije se koriste za otplinjavanje. Sa solima teških metala iperit tvori složene obojene spojeve; otkrivanje iperita temelji se na ovom svojstvu.
Kemijska svojstva
Iperit je organski spoj koji ima sljedeću formulu: (ClCH2CH2)2S.
Na uobičajenim temperaturama iperit je stabilan spoj. Kada se zagrije iznad 170 °C, razgrađuje se i stvara otrovne produkte neugodnog mirisa različitog sastava. Na temperaturama iznad 500 °C dolazi do potpune toplinske razgradnje. Kratkotrajno zagrijavanje i iznad 300 °C gotovo ne dovodi do stvaranja produkata raspadanja, pa se iperit smatra relativno otpornim na detonaciju.
U odnosu na metale na običnoj temperaturi iperit je inertan, gotovo da nema utjecaja na olovo, mjed, cink, čelik, aluminij; Kada temperatura poraste, čelik se raspada. Kontaminirani iperit, koji obično sadrži vodu i klorovodik, korodira čelik. Rezultirajuće soli željeza doprinose koroziji. Zbog ispuštenih plinova (vodik, sumporovodik, etilen i drugi produkti raspadanja), potrebno je uzeti u obzir povećanje tlaka u zatvorenim spremnicima, minama, bombama i transportnim kontejnerima.
Inhibitori korozije i antioksidansi sprječavaju razgradnju tijekom skladištenja. Takve tvari mogu biti, na primjer, tetraalkilamonijevi halogenidi, heksametilentetramin, piridin, pikolin, kinolin i drugi derivati organskih amina.
U ljudskom tijelu iperit reagira s NH skupinama nukleotida koje su dio DNK. To pridonosi stvaranju poprečnih veza između lanaca DNA, zbog čega ovaj dio DNK postaje neoperabilan.
Šteta
Iperit utječe na ljudsko tijelo na nekoliko načina:
Čovjek nakon trovanja iperitom.
Uništavanje staničnih membrana;
Kršenje metabolizma ugljikohidrata;
- “izvlačenje” dušičnih baza iz DNK i RNA.
Iperit djeluje štetno na svaki način prodiranja u tijelo. Lezije sluznice očiju, nazofarinksa i gornjih dišnih puteva pojavljuju se čak i pri niskim koncentracijama iperita. U većim koncentracijama, uz lokalne lezije, dolazi do općeg trovanja tijela. Gorušica ima latentno razdoblje djelovanja (2-8 sati) i ima kumulativno djelovanje.
U trenutku kontakta s iperitom, iritacija kože i učinci boli su odsutni. Područja zahvaćena iperitom sklona su infekciji. Lezije kože počinju crvenilom, koje se pojavljuje 2-6 sati nakon izlaganja iperitu. Dan kasnije, na mjestu crvenila nastaju mali mjehurići, ispunjeni žutom prozirnom tekućinom, koji se naknadno spajaju. Nakon 2-3 dana mjehurići pucaju, a čir zacijeli tek nakon 20-30 dana. Ako infekcija uđe u čir, zacjeljivanje može potrajati do 2-3 mjeseca.
Prilikom udisanja para ili aerosolnog iperita nakon nekoliko sati pojavljuju se prvi znakovi oštećenja u obliku suhoće i peckanja u nazofarinksu, zatim dolazi do snažnog oticanja sluznice nazofarinksa, praćenog gnojnim iscjetkom. U teškim slučajevima razvija se upala pluća, smrt nastupa 3-4 dana od gušenja.