Najkarakterističniji za aromatične ugljikovodike reakcije zamjena. U ovom slučaju, kao rezultat reakcija, aromatični sekstet elektrona nije uništen. Poznati su i brojni primjeri reakcija. radikalno halogeniranje i oksidacija bočni lanci alkilbenzena. Procesi u kojima se uništava stabilan aromatski sustav nisu baš tipični.
IV.1 Elektrofilna aromatska supstitucija (seAr)
ALI. MehanizamS E Ar (supstitucijska elektrofilna u Arenima)
Elektrofilna supstitucija u aromatičnom prstenu jedna je od najbolje proučavanih i najčešće korištenih organskih reakcija. Najčešće je krajnji rezultat elektrofilne supstitucije zamjena atoma vodika u aromatskoj jezgri s drugim atomom ili skupinom atoma:
Elektrofilne supstitucijske reakcije u aromatskoj jezgri (kao i elektrofilne pristupanja na C=C veze) započinju stvaranjem -kompleks - elektrofilno sredstvo je usklađeno s molekulom benzena zbog -elektroničkog sustava potonjeg:

U benzenskom prstenu, -sustav, budući da je stabilan (energija stabilizacije; vidi odjeljak II), nije poremećen tako lako kao u alkenima. Stoga se odgovarajući -kompleks ne može fiksirati samo fizikalno-kemijskim metodama, već također dodijeljena.(bilješka 24)
U pravilu, faza formiranja α-kompleksa teče brzo i ne granice ubrzati cijeli proces.
Nadalje, aromatski sustav je prekinut i nastaje kovalentna veza elektrofila s ugljikovim atomom benzenskog prstena. U tom slučaju, -kompleks se pretvara u karbokation (karbenijev ion), u kojem se pozitivni naboj delokalizira u dienskom sustavu, a atom ugljika napadnut elektrofilom prelazi iz sp 2 - u sp 3 hibridno stanje. Takav kation se zove -kompleks . Obično, stupanj obrazovanja-kompleks određuje stopu. Delokalizacija pozitivnog naboja u -kompleksu se ne provodi jednoliko između pet ugljikovih atoma, već zbog 2,4,6-položaja benzenskog prstena (usporedi s alil kationom, gdje je pozitivni naboj raspoređen između 1,3-položaji):

U slučaju elektrofilnog dodavanja alkenima također prvo nastaje α-kompleks koji potom prelazi u α-kompleks, međutim daljnja sudbina α-kompleksa u slučaju elektrofilnih reakcija alkena i arena je drugačija. -Kompleks nastao od alkena stabiliziran je pomoću trans- dodavanje nukleofila; -kompleks nastao iz aromatskog sustava stabilizira se regeneracijom aromatskog seksteta -elektroni: (bilješka 25)

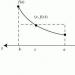
Ispod je energetski profil takve reakcije (bilješka 27) (E a je energija aktivacije odgovarajućeg koraka):

Još jednom naglašavamo da su reakcije S E Ar, koje su prema rezultatu zamjena, zapravo prema mehanizmu, to su reakcije adicije nakon kojih slijedi eliminacija.
B. Orijentacija adicije u monosupstituiranim benzenima
Kada se razmatraju reakcije elektrofilne supstitucije u monosupstituiranim benzenima, javljaju se dva problema: 1. Novi supstituent može ući u orto-, meta- ili par-pozicije, kao i za zamjenu postojećeg supstituta (potonjeg, tzv ipso zamjena , rjeđe - vidjeti odjeljak IV.1.E (nitracija). 2. Brzina supstitucije može biti veća ili manja od brzine supstitucije u benzenu.
Utjecaj supstituenta prisutnog u benzenskom prstenu može se objasniti na temelju njegovih elektronskih učinaka. Na temelju toga, supstituenti se mogu podijeliti u 3 glavne skupine:
1. Supstituenti koji ubrzavaju reakciju u usporedbi s nesupstituiranim benzenom ( aktiviranje ) i vodiči za zamjenu u orto ,- par - pozicije.
2. Supstituenti koji usporavaju reakciju ( deaktiviranje ) i vodiči za zamjenu u orto,-para- položaji .
3. Supstituenti koji usporavaju reakciju ( deaktiviranje ) i vodiči za zamjenu u meta - odredbe.
Supstituenti zabilježeni u p.p. 1.2( orto-, para-orijentatori ) se zovu supstituenti 1. vrste ; navedeno u stavku 3 ( meta orijentanata ) - supstituenti druge vrste . Dodjela uobičajenih supstituenata prema njihovim elektroničkim učincima data je u nastavku.
Očito će doći do elektrofilne supstitucije što je brži, to je više supstituenta koji daje elektrone u jezgri, i što je sporiji, supstituent koji više povlači elektrone u jezgri.
Za objašnjenje orijentacija zamjenu, razmotrite strukturu -kompleksa na udaru u orto-, meta- i par- položaji monosupstituiranog benzena (kao što je već napomenuto, formiranje - kompleksa je obično korak koji određuje brzinu elektrofilne supstitucije; stoga bi jednostavnost njihovog formiranja trebala odrediti lakoću supstitucije u danom položaju):

Ako je Z skupina donor elektrona (bilo induktivni ili mezomerni), tada na orto- ili par-napad, može biti izravno uključen u delokalizaciju pozitivnog naboja u -kompleksu (strukture III, IV, VI, VII). Ako je Z akceptor elektrona, tada će te strukture biti energetski nepovoljne (zbog prisutnosti djelomičnog pozitivnog naboja na atomu ugljika povezanog sa supstituentom koji povlači elektrone), te je u ovom slučaju poželjniji metanapad, u koje takve strukture ne nastaju.
Navedeno objašnjenje dato je na temelju tzv dinamički učinak , tj. raspodjele elektronske gustoće u molekuli koja reagira. Orijentacija elektrofilne supstitucije u monosupstituiranim benzenima također se može objasniti iz pozicije statički elektronski efekti - raspodjela elektronske gustoće u nereagirajućoj molekuli. Kada se razmatra pomak u gustoći elektrona preko više veza, može se vidjeti da u prisutnosti supstituenta koji daje elektron, najviše od svega povećana gustoća elektrona u orto- i par- položaji, a u prisutnosti supstituenta koji povlači elektrone, tih pozicija je najviše iscrpljena elektroni:

Halogeni su poseban slučaj - kao supstituenti u jezgri benzena, oni je deaktiviraju u reakcijama elektrofilne supstitucije, međutim, oni su orto-, par-orijentatori. Deaktivacija (smanjenje brzine reakcije s elektrofilima) nastaje zbog činjenice da, za razliku od drugih skupina s nepodijeljenim elektronskim parovima (kao što su -OH, -NH 2, itd.), koje imaju pozitivan mezomerni (+M) i negativan induktivni učinak (-I), halogene karakterizira prevlast induktivnog učinka nad mezomernim (+ M< -I).(прим.30)

Istovremeno su atomi halogena orto, par-orijentanti, budući da su sposobni zbog pozitivnog mezomernog učinka sudjelovati u delokalizaciji pozitivnog naboja u -kompleksu koji nastaje tijekom orto- ili par- napad (strukture IV, VII u gornjoj shemi), i time smanjiti energiju njegovog formiranja.
Ako benzenska jezgra nema jedan, već dva supstituenta, tada se njihovo orijentacijsko djelovanje može podudarati ( dogovorena orijentacija ) ili se ne podudaraju ( neusklađena orijentacija ). U prvom slučaju može se računati na prevladavajuće stvaranje nekih specifičnih izomera, a u drugom će se dobiti složene smjese (bilješka 31).
Slijede neki primjeri koordinirane orijentacije dvaju supstituenata; mjesto preferencijalnog unosa trećeg supstituenta prikazano je strelicom.

Potražnja za benzenom određena je razvojem industrija koje ga troše. Glavne primjene benzena su proizvodnja etilbenzena, kumena i cikloheksana i anilina.
Najrasprostranjenija reakcija benzena je zamjena jednog ili više atoma vodika elektrofilnom skupinom. Na taj se način sintetiziraju mnoge važne tvari. Izbor funkcionalnih skupina koje se tako mogu uvesti u aromatske spojeve vrlo je širok, a osim toga, neke od tih skupina mogu se transformirati u druge skupine nakon uvođenja u benzenski prsten. Opća jednadžba reakcije je:
U nastavku donosimo pet najčešćih reakcija ove vrste i primjere njihove uporabe.
nitracija:

sulfoniranje:
Dkylation prema Friedel-Craftsu:
Friedel-Crafts acilacija:
Halogenacija (samo kloriranje i bromiranje):

Sljedeće reakcije se često koriste za daljnju transformaciju spojeva koji su rezultat aromatske elektrofilne supstitucije.
Oporavak bočnog lanca:

Obnavljanje nitro grupe:

Diazotizacija i daljnje transformacije
Anilin i njegovi supstituirani spojevi mogu se pretvoriti u visoko reaktivne spojeve zvane diazonijeve soli:

Diazonijeve soli služe kao polazni materijali za sintezu širokog spektra aromatskih spojeva (Shema 9-1). U mnogim slučajevima, metoda sinteze preko diazonijevih soli je jedini način da se u aromatični spoj uvede bilo koja funkcionalna skupina.
Zamjena diazonijeve skupine atomima klora i broma, kao i cijano grupom, postiže se interakcijom diazonijevih soli s bakrenim solima (1). Atomi joda i fluora ne mogu se uvesti u aromatski prsten izravnim halogeniranjem. Aromatični jodidi i fluoridi se dobivaju obradom diazonijevih soli s kalijevim jodidom, odnosno borovodoničnom kiselinom.
Aromatske karboksilne kiseline mogu se dobiti ili hidrolizom nitrilne skupine, ili djelovanjem ugljičnog dioksida na Grignardov reagens (više o ovoj reakciji bit će riječi u 12. poglavlju). Fenoli se u laboratoriju najčešće dobivaju hidrolizom diazonijevih soli.

Dijagram 9-2. Reakcije diazonijevih soli
Diazonijeva skupina (a time i amino skupina i nitro skupina) mogu se ukloniti (tj. zamijeniti atomom vodika) obradom diazonijevih soli hipofosfornom kiselinom
Konačno, interakcija diazonijevih soli s aktiviranim aromatičnim spojevima dovodi do stvaranja azo boja. Boje mogu biti vrlo različitih boja ovisno o prirodi supstituenata na oba aromatična prstena.
Dušična kiselina, koja se koristi za pripremu diazonijevih soli, je slabo stabilna tvar i priprema se in situ (tj. izravno u reakcijskoj posudi) iz natrijevog nitrita i klorovodične kiseline. U reakcijskoj shemi liječenje dušičnom kiselinom može se prikazati na jedan od dva načina, koji se primjenjuju u nastavku:

Evo nekoliko primjera reakcija diazonijevih soli:

Dobivanje praktički važnih tvari pomoću reakcija elektrofilne supstitucije
Boje. Sinteza metil naranče prikazana je u nastavku. Ako uzmete izvorne spojeve s drugim supstituentima u aromatičnim prstenovima, tada će boja boje biti drugačija.

Polimeri. Polistiren se dobiva polimerizacijom stirena (vidi poglavlje 6), koji se, pak, može sintetizirati na sljedeći način. Benzen se acilira prema Friedel-Crafts, koristeći anhidrid octene kiseline umjesto acetil klorida, rezultirajući keton se reducira u alkohol, koji se zatim dehidrira korištenjem kalijevog hidrogen sulfata kao kiselog katalizatora:

Lijekovi. u sintezi sulfanilamida (streptocida), prva dva koraka su reakcije s kojima smo se već susreli. Treća faza je zaštita amino skupine. To je neophodno kako bi se spriječila interakcija klorosulfonske kiseline s amino grupom. Nakon što je skupina reagirala s amonijakom, zaštitna skupina se može ukloniti.

Streptocid je bio jedan od prvih antimikrobnih sredstava iz skupine sulfonamida. Primjenjuje se i sada.
Reakcije elektrofilne supstitucije omogućuju uvođenje mnogih različitih skupina u aromatični prsten. Mnoge od ovih skupina mogu se zatim transformirati tijekom sinteze.
Mehanizam aromatske elektrofilne supstitucije
Utvrđeno je da se elektrofilna supstitucija u aromatskim spojevima odvija u dva stupnja. Prvo, elektrofil (koji se može generirati raznim metodama) je vezan na benzenski prsten. U tom slučaju nastaje rezonantno stabilizirani ugljikohidratni kation (ispod u zagradama). Taj kation tada gubi proton i pretvara se u aromatični spoj.

Ovdje su, radi jasnoće, prikazane formule aromatskih spojeva s dvostrukim vezama. Ali vi, naravno, zapamtite da zapravo postoji oblak delokaliziranih elektrona.
Ispod su mehanizmi dviju reakcija, uključujući korak stvaranja elektrofila. Haogenacija
Generacija elektrofila:
Zamjena:

Friedel-Craftsova acilacija Generacija elektrofila:

Zamjena:

Utjecaj poslanika
Kada supstituirani benzen reagira s elektrofilom, struktura supstituenta koji je već prisutan na benzenskom prstenu ima značajan utjecaj na orijentaciju supstitucije i na njenu brzinu.

Prema njihovom učinku na brzinu i orijentaciju elektrofilne supstitucije, svi mogući supstituenti mogu se podijeliti u tri skupine.
1. Aktiviranje ortopara-orijentanata. U prisutnosti supstituenta ove skupine u aromatičnom spoju, on reagira brže od nesupstituiranog benzena, a elektrofil se usmjerava na orto i para položaj na supstituent i nastaje smjesa orto i para disupstituiranih benzena. Ova skupina uključuje sljedeće supstituente:

2. Deaktiviranje meta-orijentirajućih agenasa. Ovi supstituenti usporavaju reakciju u usporedbi s benzenom i usmjeravaju elektrofil u meta poziciju. Ova grupa uključuje:
3. Deaktiviranje orto-, paraorijentanata. Ova skupina uključuje atome alogena.
Primjeri orijentacije za elektrofilnu supstituciju:


Objašnjenje utjecaja supstituenata
Zašto različiti supstituenti imaju tako različit učinak na prirodu elektrofilne supstitucije? Odgovor na ovo pitanje može se dobiti analizom stabilnosti nastalih međuprodukta u svakom pojedinom slučaju. Neki od tih međukarbokationa bit će stabilniji, drugi manje stabilni. Podsjetimo da ako spoj može reagirati na više od jednog načina, reakcija će ići putem koji proizvodi najstabilniji međuprodukt.
U nastavku su prikazane rezonantne strukture međučestica koje nastaju tijekom elektrofilnog napada kationa u orto-meta- i para-položajima fenola, koji ima snažan aktivirajući supstituent - orto, para-orijentirajući, toluen, koji ima supstituent sa ista, ali puno manje izražena svojstva, i nitrobenzen, dostupan u kojem je nitro skupina megd orijentant i deaktivira prsten:

Kada je elektrofil napadnut i u orto i u para položaju fenola, može se napisati više rezonantnih struktura za rezultirajući međuprodukt nego za intermedijer nakon meta supstitucije. Štoviše, ova "ekstra" struktura (zaokružena u okviru) daje posebno velik doprinos
u stabilizaciju kationa, budući da u njemu svi atomi imaju oktet elektrona. Dakle, stabilniji kation pojavljuje se tijekom orto- ili para-orijentacije napada elektrofila nego tijekom napada na meta-poziciju, pa se supstitucija događa pretežno u orto- i para-položajima. Budući da je kation koji nastaje takvom supstitucijom stabilniji od kationa koji nastaje iz nesupstituiranog benzena, fenol puno lakše ulazi u reakcije elektrofilne supstitucije od benzena. Imajte na umu da svi supstituenti koji snažno ili umjereno aktiviraju aromatski prsten u reakcijama elektrofilne supstitucije imaju jedan jedini atom vezan na prsten. Ti se elektroni mogu uvesti u prsten. U tom slučaju nastaje rezonantna struktura s pozitivnim nabojem na elektronegativnom atomu (kisik ili dušik). Sve to stabilizira međuprodukt i povećava brzinu reakcije (rezonantna aktivacija).
U slučaju toluena, supstitucija u orto- i d-položaju rezultira stabilnijim kationom nego kada elektrofil napada u meta-položaju.

U okvirnim rezonantnim strukturama, pozitivni naboj je na tercijarnim atomima ugljika (tercijarni po karbokationu, vidi poglavlje 5). Kada se napadne u meta položaju, tercijarni karbokation ne nastaje. Ovdje opet, orto- i para-supstitucija prolazi kroz nešto stabilnije intermedijarne vrste od meta-supstitucije i od supstitucije u samom benzenu. Stoga je supstitucija u toluenu usmjerena na orto i para položaj i odvija se nešto brže od supstitucije u Lysolu (aktivacija zbog induktivnog učinka).
Sve deaktivirajuće skupine, uključujući nitro skupinu, imaju svojstvo povlačenja elektrona iz prstena arome. Rezultat toga je destabilizacija međukationa. Posebno

(kliknite za pregled skeniranja)
intermedijari koji nastaju napadom u orto i para položajima su snažno destabilizirani, budući da se djelomični pozitivni naboj nalazi neposredno uz nitro skupinu (odgovarajuće rezonantne strukture su zaokružene). Stoga je meta-supstitucija poželjnija u odnosu na orto- i para-supstituciju. Nitrobenzen podvrgava se elektrofilnoj supstituciji mnogo teže nego benzen, budući da je gustoća elektrona u prstenu smanjena, a međusobna privlačnost aromatskog prstena i elektrofila je oslabljena.

Reakcije elektrofilne adicije odvijaju se u dva stupnja kroz stvaranje međukationa. Različiti supstituenti na benzenskom prstenu imaju različite učinke na brzinu i orijentaciju supstitucije. Taj se utjecaj može objasniti uzimajući u obzir stabilnost međuprodukta koji nastaju u svakom slučaju.

Pod djelovanjem koncentrirane dušične kiseline ili smjese koncentrirane dušične i sumporne kiseline (smjesa za nitraciju), atomi vodika benzenskog prstena zamjenjuju se nitro grupom:
nitrobenzen
Nitraciji prethodi stvaranje elektrofilnog reagensa NE 2 - nitronijev kation.
U reakciji nitriranja benzena sa smjesom za nitriranje nitronijev kation (NE 2 ) nastaje protonacijom dušične kiseline s prisutnom koncentriranom sumpornom kiselinom:

Daljnje nitriranje je teško, jer je nitro skupina supstituent druge vrste i otežava reakcije s elektrofilnim reagensima:

nitrobenzen 1,3-dinitrobenzen 1,3,5-trinitrobenzen
Homolozi benzena (toluen, ksileni) nitriraju se lakše od benzena, budući da su alkilne skupine supstituenti prve vrste i olakšavaju reakcije s elektrofilnim reagensima:
1,3,5-trinitrobenzen

toluen orto-nitrotoluen para-nitrotoluen

1,3,5-trinitrobenzen


1.2. Reakcije sulfoniranja.
Kada se benzen i njegovi homolozi tretiraju koncentriranom sumpornom kiselinom ili sumpornim trioksidom, atomi vodika u jezgri benzena zamjenjuju se sulfo grupom:

benzensulfonska kiselina
mehanizam reakcije
Sulfoniranju prethodi stvaranje elektrofilnog reagensa HSO + 3 - hidrosulfonijev ion:
3H 2 SO 4 → H 3 O + + HSO + 3 + 2HSO - 4
π-kompleks σ-kompleks
H + + HSO - 4 → H 2 SO 4
Još aktivniji je elektrofilni reagens sumporov trioksid, u kojem postoji manjak gustoće elektrona na atomu sumpora:

σ-kompleks
bipolarni ion

Homolozi benzena sulfonirani su lakše od benzena, budući da su alkilne skupine supstituenti prve vrste i olakšavaju reakcije s elektrofilnim reagensima:

1.3. reakcije halogeniranja.
U prisutnosti katalizatora Lewisove kiseline (AlCl 3 ; AlBr 3 ; FeCl 3 ; FeBr 3 ; ZnCl 2 ) na sobnoj temperaturi, atomi vodika u benzenskom prstenu su zamijenjeni atomima halogena:

Štoviše, klor zamjenjuje vodik u aromatičnoj jezgri aktivnije od broma, te je praktički nemoguće provesti jodiranje i fluoriranje arena, zbog nedovoljne aktivnosti joda i prekomjerne aktivnosti fluora.
Uloga katalizatora je da formira ili pozitivan halogen ion ili kompleks halogena s Lewisovom kiselinom s polarizacijom halogen-halogene veze:
1) stvaranje pozitivnog iona halogena:

2) stvaranje kompleksa halogena s Lewisovom kiselinom uz polarizaciju halogen-halogene veze:

Daljnje halogeniranje je teško, jer halogeni ometaju reakcije s elektrofilnim reagensima, ali su orto- i para-orijentanti:

bromobenzen 1,2-dibromobenzen 1,4-dibromobenzen
Homolozi benzena se lakše halogeniraju od benzena, budući da su alkilne skupine supstituenti prve vrste i olakšavaju reakcije s elektrofilnim reagensima:

toluen orto-klorotoluen para-klorotoluen
Reakcije elektrofilne supstitucije teže su od reakcija benzena, što je posljedica snažnog učinka nitro skupine na povlačenje elektrona. Supstitucija se događa u meta položaju, budući da je nitro skupina orijentant druge vrste (S E 2 arom).
Stoga se reakcije elektrofilne supstitucije provode samo s jakim reagensima (nitriranje, sulfoniranje, halogeniranje) pod strožim uvjetima:

Reakcije nukleofilne supstitucije
U reakcijama nukleofilne supstitucije (S N 2 arom), nitro skupina usmjerava nukleofil na orto i para položaj.
Na primjer, fuzija nitrobenzena s KOH na 100 0 C dovodi do proizvodnje orto- i para-nitrofenola:

Napad na orto položaj je poželjniji, jer negativni induktivni učinak nitro skupine, djelujući na maloj udaljenosti, stvara veći nedostatak elektrona u orto položaju nego u para položaju.
Prisutnost dvije, a posebno tri nitro skupine u meta položaju jedna u odnosu na drugu, dodatno potiče reakcije s nukleofilnim reagensima.
Tako, na primjer, kada meta-dinitrobenzen reagira s alkalijom ili s natrijevim amidom, jedan od atoma vodika u orto ili para položaju zamjenjuje se grupom Oh, ili kod NH 2 :

2,4-dinitrofenol

2,6-dinitroanilin
Simetrični trinitrobenzen reagira s alkalijom da nastane pikrinska kiselina:

2,4,6-trinitrofenol
pikrinska kiselina
Utjecaj nitro skupine na reaktivnost
ostale skupine u benzenskom prstenu
Nukleofilna supstitucija nitro skupine
Ako su nitro skupine u orto- i para-položajima jedna u odnosu na drugu, tada se aktiviraju jedna drugu i moguća je nukleofilna supstitucija nitro skupine s odlaskom nitritnog iona:


Nukleofilna supstitucija halogena i drugih skupina
Nitro skupina aktivira nukleofilnu supstituciju ne samo atoma vodika, već i drugih skupina koje se nalaze u benzenskom prstenu na orto i para položajima u odnosu na nitro skupinu.
Atomi halogena, -OH, -OR, -NR2 i druge skupine lako se zamjenjuju nukleofilima.
Uloga nitro grupe nije samo stvaranje pozitivnog naboja na atomu ugljika povezanog sa supstituirajućom grupom, već i stabilizacija negativnog ϭ-kompleksa, jer nitro skupina pridonosi delokalizaciji negativnog naboja.
Na primjer, halogen u orto- i para-nitroklorobenzenima, pod utjecajem nitro skupine, lako se zamjenjuje nukleofilnim česticama:


:Nu: -- = JE LI ON -- , NH 2 -- , ja -- , -- OCH 3
Prisutnost dvije, a posebno tri nitro skupine ubrzava nukleofilnu supstituciju, a to je najizraženije u slučajevima kada su nitro skupine u orto ili para položaju u odnosu na grupu koja se zamjenjuje:

2,4-dinitroklorobenzen
Atom halogena najlakše se zamijeni u 2,4,6-trinitroklorobenzenu (pikril klorid):

2,4,6-trinitroklorobenzen
(pikril klorid)
Reakcije vezane uz pokretljivost atoma vodika
alkil radikali
Zbog jako izraženog elektron-povlačenja karaktera, nitro skupina ima značajan utjecaj na pokretljivost vodikovih atoma alkilnih radikala koji se nalaze u orto i para položajima u odnosu na nju.
a) reakcije kondenzacije s aldehidima
U para-nitrotoluenu, atomi vodika metilne skupine pod utjecajem nitro skupine dobivaju visoku mobilnost i kao rezultat toga para-nitrotoluen ulazi u kondenzacijske reakcije s aldehidima kao metilenskom komponentom:

b) stvaranje nitronskih kiselina
Atomi vodika na α-ugljikovom atomu zbog ϭ, π-konjugacije imaju veliku pokretljivost i mogu migrirati na kisik nitro skupine uz stvaranje tautomerne nitronske kiseline.
Stvaranje nitronske kiseline u aromatičnim nitro spojevima s nitro grupom u prstenu povezano je s transformacijom benzenskog prstena u kvinoidnu strukturu:
Na primjer, orto-nitrotoluen pokazuje fotokromizam: nastaje svijetloplava nitronska kiselina (kinoidne strukture često su intenzivno obojene:

orto-nitrotoluen nitronska kiselina
Elektrofilna supstitucija je nedvojbeno najvažnija skupina reakcija za aromatske spojeve. Gotovo da ne postoji neka druga klasa reakcija koja je proučavana tako detaljno, duboko i sveobuhvatno, kako sa stajališta mehanizma tako i sa stajališta primjene u organskoj sintezi. Upravo je u području elektrofilne aromatske supstitucije prvi put postavljen problem odnosa strukture i reaktivnosti, što je glavni predmet proučavanja fizikalne organske kemije. Općenito, ova vrsta reakcija aromatskih spojeva može se predstaviti na sljedeći način:
ArE+H+
1. Pregled literature
1.1 Elektrofilna supstitucija u aromatskom nizu
Ove reakcije karakteristične su ne samo za sam benzen, već i za benzenski prsten općenito, gdje god se on nalazio, kao i za druge aromatske cikluse - benzenoidne i nebenzenoidne. Reakcije elektrofilne supstitucije pokrivaju širok raspon reakcija: nitriranje, halogeniranje, sulfoniranje i Friedel-Craftsove reakcije karakteristične su za gotovo sve aromatske spojeve; reakcije kao što su nitrozacija i azo spajanje svojstvene su samo sustavima s povećanom aktivnošću; reakcije kao što su odsumporavanje, izotopska izmjena i brojne reakcije ciklizacije, koje se na prvi pogled čine sasvim različitim, ali koje se također pokazuju prikladnim odnositi se na reakcije istog tipa.
Elektrofilna sredstva E + , iako prisutnost naboja nije potrebna, jer elektrofil također može biti nenabijena čestica s nedostatkom elektrona (na primjer, SO 3 , Hg(OCOCH 3) 2, itd.). Konvencionalno se mogu podijeliti u tri skupine: jake, srednje snage i slabe.
NO 2 + (nitronijev ion, nitroil kation); kompleksi Cl 2 ili Br 2 s raznim Lewisovim kiselinama (FeCl 3 , AlBr 3 , AlCl 3 , SbCl 5 itd.); H 2 OCl + , H 2 OBr + , RSO 2 + , HSO 3 + , H 2 S 2 O 7 . Snažne električne pile stupaju u interakciju sa spojevima serije benzena koji sadrže i supstituente koji doniraju elektrone i praktički sve supstituente koji povlače elektrone.
Elektrofili srednje snage
Kompleksi alkil halogenida ili acil halogenida s Lewisovim kiselinama (RCl. AlCl 3, RBr. GaBr 3, RCOCl. AlCl 3 itd.); kompleksi alkohola s jakim Lewisovim i Bronstedovim kiselinama (ROH . BF 3 , ROH . H 3 PO 4 , ROH . HF). Oni reagiraju s benzenom i njegovim derivatima koji sadrže supstituente koji doniraju (aktiviraju) elektrone ili atome halogena (slabi deaktivirajući supstituenti), ali obično ne reagiraju s derivatima benzena koji sadrže jake deaktivirajuće supstituente za povlačenje elektrona (NO 2, SO 3 H, COR, CN itd.) .
Slabi elektrofili
Diazonijevi kationi ArN +ê N, iminij CH 2 \u003d N + H 2, nitrozonijev NO + (nitrozoil kation); ugljični monoksid (IY) CO 2 (jedan od najslabijih elektrofila). slabi elektrofili međusobno djeluju samo s derivatima benzena koji sadrže vrlo jake supstituente koji daju elektrone (+M) tipa (OH, OR, NH 2, NR 2 , O- itd.).
1.1.2 Mehanizam elektrofilne aromatske supstitucije
Trenutno se aromatska elektrofilna supstitucija smatra dvostupanjskom reakcijom adicije-eliminacije s međuformiranjem arenonijevog iona, nazvanog σ-kompleks

I-Arenium ion (
-složen), obično kratkotrajan. Takav mehanizam naziva se S E Ar, t.j. S E (arenonij). U ovom slučaju, u prvoj fazi, kao rezultat napada elektrofila, ciklički aromatski 6-elektronski π-sustav benzena nestaje i zamjenjuje se u međuproduktu I necikličkim 4-elektronskim konjugiranim sustavom cikloheksadienila kation. U drugoj fazi ponovno se obnavlja aromatski sustav zbog eliminacije protona.Struktura arenonijevog iona I prikazana je na različite načine:
Prva formula je najčešće korištena. σ-kompleks će se puno bolje stabilizirati donorskim supstituentima u orto i para položajima nego donorskim supstituentima u meta položaju.
π -Kompleksi
Kao što je poznato, areni su π-baze i mogu tvoriti donorsko-akceptorske komplekse s mnogim elektrofilnim reagensima.formiranje molekularnih kompleksa sastava 1:1 (G.Brown, 1952).
Ovi kompleksi nisu obojeni; njihove otopine u aromatičnim ugljikovodicima su nevodljive. Otapanje plinovitog DCl u benzenu, toluenu, ksilenima, mezitilenu i pentametilbenzenu ne rezultira izmjenom H za D. Budući da otopine kompleksa ne provode električnu struju, one nisu ionske vrste; To nisu arenonijevi ioni.
Takvi donor-akceptorski kompleksi nazivaju se π-kompleksi. Na primjer, kristali benzenskih kompleksa s bromom ili klorom sastava 1:1, prema podacima rendgenske difrakcije, sastoje se od lanaca izmjeničnih molekula π-donora sastava (C 6 H 6) i akceptora ( Cl 2 ,Br 2), u kojem je molekula halogena smještena okomito na ravninu prstena duž osi koja prolazi kroz njegovo središte simetrije.
σ-kompleksi (arenonijevi ioni)
Kada se HCl i DCl uvedu u otopinu u alkilbenzenima AlCl 3 ili AlBr 3, otopina počinje provoditi električnu struju. Takve otopine su obojene i njihova se boja mijenja iz žute u narančasto-crvenu pri prelasku iz para-ksilena u pentametilbenzen. U sustavima ArH-DCl-AlCl 3 ili ArH-DF-BF 3 atomi vodika aromatskog prstena već su izmijenjeni za deuterij. Električna vodljivost otopina definitivno ukazuje na stvaranje iona u ternarnom sustavu aren-vodikov halogenid-aluminij halid. Struktura takvih iona određena je pomoću 1H i 13C NMR spektroskopije u sustavu ArH-HF (tekućina)-BF 3 ili ArH-HF-SbF 5 u SO 2 ClF pri niskoj temperaturi.
1.1.3 Klasifikacija supstituenata
Monosupstituirani C 6 H 5 X benzeni mogu biti više ili manje reaktivni od samog benzena. Ako se u reakciju uvede ekvivalentna smjesa C 6 H 5 X i C 6 H 6, tada će se supstitucija dogoditi selektivno: u prvom slučaju će pretežno reagirati C 6 H 5 X, a u drugom slučaju uglavnom benzen .
Trenutno su supstituenti podijeljeni u tri skupine, uzimajući u obzir njihov aktivacijski ili deaktivirajući učinak, kao i orijentaciju supstitucije u benzenskom prstenu.
1. Aktiviranje orto-para-orijentacijskih grupa. To uključuje: NH2, NHR, NR2, NHAc, OH, OR, OAc, Alk, itd.
2. Deaktiviranje orto-para-orijentacijskih grupa. To su halogeni F, Cl, Br i I.
3. Deaktiviranje meta-orijentacijskih grupa. Ovu skupinu čine NO 2 , NO, SO 3 H, SO 2 R, SOR, C(O)R, COOH, COOR, CN, NR 3+, CCl 3 i dr. To su orijentanti druge vrste.
Naravno, postoje i skupine atoma srednje prirode, koje određuju mješovitu orijentaciju. To, na primjer, uključuje: CH 2 NO, CH 2 COCH 3, CH 2 F, CHCl 2, CH 2 NO 2, CH 2 CH 2 NO 2, CH 2 CH 2 NR 3 +, CH 2 PR 3 +, CH 2 SR 2 + id.
1.2 Elektrofilna supstitucija u heterociklima s π-viškom
Furan, pirol i tiofen su vrlo reaktivni s uobičajenim elektrofilnim reagensima. U tom smislu nalikuju najreaktivnijim derivatima benzena, kao što su fenoli i anilini. Povećana osjetljivost na elektrofilnu supstituciju posljedica je asimetrične raspodjele naboja u tim heterociklima, što rezultira većim negativnim nabojem na atomima ugljika u prstenu nego u benzenu. Furan je nešto reaktivniji od pirola, dok je tiofen najmanje reaktivan.
1.2.1 Elektrofilna supstitucija pirola
Dok pirol i njegovi derivati nisu skloni nukleofilnim reakcijama adicije i supstitucije, vrlo su osjetljivi na elektrofilne reagense, a reakcije pirola s takvim reagensima teku gotovo isključivo kao supstitucijske reakcije. Nesupstituirani pirol, N- i C-monoalkilpiroli i, u manjoj mjeri, C,C-dialkil derivati polimeriziraju se u jako kiselim medijima, tako da većina elektrofilnih reagensa koji se koriste u slučaju derivata benzena nije primjenjiva na pirol i njegov alkil izvedenice.
Međutim, ako u pirolnom ciklusu postoje skupine koje povlače elektrone koje sprječavaju polimerizaciju, kao što su esterske skupine, na primjer, postaje moguće koristiti jako kiseli medij, nitrirajuća i sulfonirajuća sredstva.
protonacija
U otopini se opaža reverzibilno dodavanje protona na svim pozicijama pirolnog prstena. Atom dušika se najbrže protonira, dodavanje protona na poziciji 2 je dvostruko brže nego na poziciji 3. U plinovitoj fazi, kada se koriste kiseline umjerene jačine, kao što su C 4 H 9 + i NH 4 + , pirol protonira se isključivo na atomima ugljika, a sklonost vezivanju protona na položaju 2 veća je nego na položaju 3. Termodinamički najstabilniji kation, 2H-pirolijev ion, nastaje dodatkom protona na poziciji 2, a pKa vrijednost određena za pirol povezana je upravo s tim kationom. Slaba N-bazičnost pirola je posljedica odsutnosti mezomerne delokalizacije pozitivnog naboja u 1H-pirolijevom kationu.