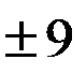Veća kalorijska vrijednost(vrhunska ogrjevna vrijednost): Količina topline koja se može osloboditi pri potpunom izgaranju određene količine plina u zraku na način da tlak p 1 pri kojem se odvija reakcija ostane konstantan i da svi produkti izgaranja poprime istu temperaturu. t 1, isto kao i temperatura reagensa. U tom su slučaju svi proizvodi u plinovitom stanju, osim vode, koja se kondenzira u tekućinu t 1 .
Donja ogrjevna vrijednost(inferiorna kalorična vrijednost): količina topline koja se može osloboditi nakon potpunog izgaranja određene količine plina u zraku tako da tlak str 1 pri kojoj se reakcija odvija ostaje konstantna, svi produkti izgaranja poprimaju istu temperaturu t 1 kao i temperatura reaktanata. U ovom slučaju svi proizvodi su u plinovitom stanju.
Vrijednost molarne topline izgaranja idealnog plina, određena na temelju vrijednosti molarnog udjela komponenata smjese poznatog sastava, na temperaturi t 1 izračunava se pomoću formule (5):
gdje je vrijednost idealne topline izgaranja smjese (veća ili manja);
– molarni udio j-te komponente;
– vrijednost idealne topline izgaranja j-te komponente (najveća ili najmanja).
Brojčane vrijednosti za t 1 =25 °C dane su u GOST 31369-2008 (tablica 3 odjeljka 10).
4.2.2 Izračun masene kalorične vrijednosti
Vrijednost masene topline izgaranja idealnog plina, određena na temelju vrijednosti masenog udjela komponenata smjese poznatog sastava, na temperaturi izračunava se pomoću formule (6):
gdje je molni udio j-ta komponenta;
-molekulska masa j th komponenta.
4.2.3 Izračun volumetrijske kalorične vrijednosti
Vrijednost topline izgaranja idealnog plina, izračunata na temelju vrijednosti volumnog udjela komponenata, za temperaturu izgaranja t 1 smjesa poznatog sastava, mjereno pri temperaturi t 2 i tlak str 1, izračunato formulom (8):
|
|
gdje je vrijednost idealne (najveće ili najniže) volumetrijske topline izgaranja smjese;
R– univerzalna plinska konstanta;
T 2 – apsolutna temperatura, K.
4.2.4 Izračun gustoće, relativne gustoće i Wobbeovog broja
Gustoća(gustoća): Masa uzorka plina podijeljena s njegovim volumenom pri određenim tlakovima i temperaturama.
Relativna gustoća(relativna gustoća): Gustoća plina podijeljena s gustoćom suhog zraka standardnog sastava (Dodatak B GOST 31369-2008) pri istim navedenim vrijednostima tlaka i temperature. Izraz "idealna relativna gustoća" koristi se u slučajevima kada se i plin i zrak smatraju medijima koji poštuju zakon idealnog plina; izraz "stvarna relativna gustoća" koristi se u slučajevima kada se i plin i zrak smatraju stvarnim medijima.
Wobbeov broj(Wobbeov indeks): Vrijednost bruto volumetrijske toplinske vrijednosti pri određenim standardnim uvjetima, podijeljena s kvadratnim korijenom relativne gustoće pri istim standardnim uvjetima mjerenja.
Wobbeov broj je karakteristika zapaljivog plina koja određuje međusobnu zamjenjivost zapaljivih plinova kada se spaljuju u kućanskim i industrijskim plamenicima, mjereno u megajoulima po kubnom metru.
Relativna gustoća idealni plin ne ovisi o izboru standardnog stanja, a izračunava se pomoću formule (9):
gdje je relativna gustoća idealnog plina;
– molarna masa j-te komponente;
Kemijske reakcije popraćene su apsorpcijom ili oslobađanjem energije, posebice topline. reakcije praćene apsorpcijom topline, kao i spojevi koji nastaju tijekom tog procesa nazivaju se endotermički . U endotermnim reakcijama zagrijavanje tvari koje reagiraju potrebno je ne samo za odvijanje reakcije, već i tijekom cijelog vremena njihovog odvijanja. Bez vanjskog zagrijavanja endotermna reakcija prestaje.
reakcije praćene oslobađanjem topline, kao i spojevi koji nastaju tijekom tog procesa nazivaju se egzotermna . Sve reakcije izgaranja su egzotermne. Zbog oslobađanja topline, oni, nastali u jednom trenutku, mogu se proširiti na cijelu masu reagirajućih tvari.
Količina topline koja se oslobađa tijekom potpunog izgaranja tvari i odnosi se na jedan mol, jedinicu mase (kg, g) ili volumena (m 3) zapaljive tvari naziva se toplina izgaranja. Toplina izgaranja može se izračunati iz tabličnih podataka pomoću Hessovog zakona. Ruski kemičar G.G. Hess je 1840. otkrio zakon koji je poseban slučaj zakona održanja energije. Hessov zakon glasi: toplinski učinak kemijske transformacije ne ovisi o putu na kojem se odvija reakcija, već samo o početnom i konačnom stanju sustava, pod uvjetom da su temperatura i tlak (ili volumen) na početak i kraj reakcije su isti.
Razmotrimo to na primjeru izračuna topline izgaranja metana. Metan se može proizvesti iz 1 mola ugljika i 2 mola vodika. Kada se metan spali, proizvodi se 2 mola vode i 1 mol ugljičnog dioksida.
C + 2H2 = CH4 + 74,8 kJ (Q 1).
CH 4 + 2O 2 = CO 2 + 2H 2 O + Q horizont.
Isti proizvodi nastaju izgaranjem vodika i ugljika. Tijekom ovih reakcija ukupna količina oslobođene topline iznosi 963,5 kJ.
2H2 + O2 = 2H20 + 570,6 kJ
C + O 2 = CO 2 + 392,9 kJ.
Budući da su početni i konačni produkt isti u oba slučaja, njihovi ukupni toplinski učinci moraju biti jednaki prema Hessovom zakonu, tj.
Q 1 + Q planine = Q,
Q planine = Q - Q 1. (1.11)
Stoga će toplina izgaranja metana biti jednaka
Q planine = 963,5 - 74,8 = 888,7 kJ/mol.
Dakle, toplina izgaranja kemijskog spoja (ili njihove smjese) jednaka je razlici između zbroja toplina nastajanja produkata izgaranja i topline nastajanja izgorjelog kemijskog spoja (ili tvari koje čine zapaljivu smjesu). ). Stoga se za određivanje topline izgaranja kemijski spojevi potrebno je poznavati toplinu njihova nastanka i toplinu nastanka produkata dobivenih nakon izgaranja.
Ispod su topline stvaranja nekih kemijskih spojeva:
|
Aluminijev oksid Al 2 O 3 ……… |
Metan CH 4 ………………………… |
||
|
Željezni oksid Fe 2 O 3 ………… |
Etan C 2 H 6 …………………… |
||
|
Ugljični monoksid CO…………. |
Acetilen C 2 H 2 ……………… |
||
|
Ugljični dioksid CO2……… |
Benzen C 6 H 6 ………………… |
||
|
Voda H 2 O ……………………………. |
Etilen C 2 H 4 ………………… |
||
|
Vodena para H 2 O …………… |
Toluen C 6 H 5 CH 3 ……………. |
Primjer 1.5 .Odredite temperaturu izgaranja etana ako je toplina njegovog nastankaQ 1 = 88,4 kJ. Napišimo jednadžbu izgaranja za etan.
C2H6 + 3,5O 2 = 2 CO 2 + 3 H 2 O + Qplanine.
Za određivanjeQplaninepotrebno je poznavati toplinu nastanka produkata izgaranja. toplina nastanka ugljičnog dioksida je 396,9 kJ, a vode 286,6 kJ. Stoga,Qbit će jednaki
Q = 2 × 396,9 + 3 × 286,6 = 1653,6 kJ,
a toplina izgaranja etana
Qplanine= Q - Q 1 = 1653,6 - 88,4 = 1565,2 kJ.
Toplina izgaranja eksperimentalno se određuje u kalorimetru bombe i plinskom kalorimetru. Postoje veće i niže kalorijske vrijednosti. Veća kalorijska vrijednost Q in je količina topline koja se oslobađa tijekom potpunog izgaranja 1 kg ili 1 m 3 zapaljive tvari, pod uvjetom da vodik sadržan u njoj izgara i nastaje tekuća voda. Niža kalorijska vrijednost Qn je količina topline koja se oslobađa pri potpunom izgaranju 1 kg ili 1 m 3 gorive tvari, pod uvjetom da vodik izgara dok ne nastane vodena para i ne ispari vlaga gorive tvari.
Više i niže topline izgaranja krutih i tekućih zapaljivih tvari mogu se odrediti pomoću formula D.I. Mendeljejev:
gdje je Q in, Q n - viša i donja kalorična vrijednost, kJ/kg; W – sadržaj ugljika, vodika, kisika, zapaljivog sumpora i vlage u zapaljivoj tvari, %.
Primjer 1.6. Odredite najnižu temperaturu izgaranja sumpornog loživog ulja koje se sastoji od 82,5% C, 10,65% H, 3,1%Si 0,5% O; A (pepeo) = 0,25%,W = 3%. Koristeći jednadžbu D.I. Mendeljejeva (1.13), dobivamo
=38622,7 kJ/kg
Donja ogrjevna vrijednost 1 m3 suhih plinova može se odrediti jednadžbom
Donja kalorična vrijednost nekih zapaljivih plinova i tekućina, dobivena pokusom, navedena je u nastavku:
|
Ugljikovodici: metan……………………….. |
|||
|
etan …………………………… |
|||
|
propan……………………… |
|||
|
metil…………………. |
|||
|
etil………………………… |
|||
|
propil……………………… |
Donja ogrjevna vrijednost nekih zapaljivih materijala, izračunata iz njihovog elementarnog sastava, ima sljedeće vrijednosti:
|
Benzin…………………… |
Sintetička guma |
||
|
Papir …………………… |
Kerozin……………… |
||
|
Drvo |
Organsko staklo.. |
||
|
suhi zrak……….. |
Guma ………………….. |
||
|
u građevinskim konstrukcijama... |
treset ( W = 20 %) ……. |
Postoji donja granica kalorične vrijednosti, ispod koje tvari postaju nesposobne za izgaranje u atmosferi zraka.
Pokusi pokazuju da su tvari nezapaljive ako nisu eksplozivne i ako im donja ogrjevna vrijednost u zraku ne prelazi 2100 kJ/kg. Prema tome, toplina izgaranja može poslužiti kao približna procjena zapaljivosti tvari. Međutim, treba napomenuti da zapaljivost krutih tvari i materijala uvelike ovisi o njihovom stanju. Dakle, list papira, koji se lako zapali plamenom šibice, kada se nanese na glatku površinu metalne ploče ili betonskog zida, postaje teško zapaljiv. Posljedično, zapaljivost tvari također ovisi o brzini odvođenja topline iz zone izgaranja.
U praksi, tijekom procesa izgaranja, posebno kod požara, toplina izgaranja navedena u tablicama nije u potpunosti oslobođena, jer je izgaranje popraćeno nedogorjevanjem. Poznato je da naftni derivati, kao i benzen, toluen, acetilen, tj. tvari bogate
ugljik, gori u požarima uz stvaranje značajne količine čađe. Čađa (ugljik) može gorjeti i proizvoditi toplinu. Ako se stvara tijekom izgaranja, tada zapaljiva tvar emitira manje topline od količine navedene u tablicama. Za tvari bogate ugljikom, koeficijent podgorijevanja h je 0,8 - 0,9. Posljedično, u požaru pri izgaranju 1 kg gume ne može se osloboditi 33520 kJ, već samo 33520´0,8 = 26816 kJ.
Veličina požara obično se karakterizira područjem požara. Količina topline koja se oslobađa po jedinici površine vatre po jedinici vremena naziva se toplina vatre Q str
QP= Qnυ mh ,
Gdje υ m– brzina izgaranja mase, kg/(m 2 ×s).
Specifična toplina požara tijekom unutarnjih požara karakterizira toplinsko opterećenje na konstrukcijama zgrada i građevina i koristi se za izračunavanje temperature požara.
1.6. Temperatura izgaranja
Toplina koja se oslobađa u zoni izgaranja percipiraju proizvodi izgaranja, pa se zagrijavaju do visoke temperature. Temperatura do koje se proizvodi izgaranja zagrijavaju tijekom izgaranja naziva se temperatura izgaranja . Postoje kalorimetrijske, teorijske i stvarne temperature izgaranja. Stvarna temperatura izgaranja za uvjete požara naziva se temperatura požara.
Pod kalorimetrijskom temperaturom izgaranja podrazumijeva se temperatura do koje se proizvodi potpunog izgaranja zagrijavaju pod sljedećim uvjetima:
1) sva toplina koja se oslobađa tijekom izgaranja troši se na zagrijavanje produkata izgaranja (gubitak topline je nula);
2) početne temperature zraka i zapaljivih tvari su 0 0 C;
3) količina zraka jednaka je teorijski potrebnoj (a = 1);
4) dolazi do potpunog izgaranja.
Kalorimetrijska temperatura izgaranja ovisi samo o sastavu zapaljive tvari i ne ovisi o njezinoj količini.
Teorijska temperatura, za razliku od kalorimetrijske temperature, karakterizira izgaranje uzimajući u obzir endotermni proces disocijacije produkata izgaranja na visokoj temperaturi.
2SO 2 2SO + O 2 - 566,5 kJ.
2H2O2H2 + O2 - 478,5 kJ.
U praksi, disocijacija produkata izgaranja mora se uzeti u obzir samo na temperaturama iznad 1700 0 C. Tijekom difuzijskog izgaranja tvari u uvjetima požara, stvarne temperature izgaranja ne dosežu takve vrijednosti, stoga, za procjenu stanja požara, samo kalorimetrijski koriste se temperatura izgaranja i temperatura vatre. Postoji razlika između unutarnje i vanjske temperature požara. Unutarnja temperatura požara je prosječna temperatura dima u prostoriji u kojoj je požar nastao. Vanjska temperatura požara – temperatura plamena.
Pri proračunu kalorimetrijske temperature izgaranja i unutarnje temperature požara pretpostavlja se da je donja toplina izgaranja Qn zapaljive tvari jednaka energiji qg potrebnoj za zagrijavanje produkata izgaranja od 0 0 C do kalorimetrijske temperature izgaranja.
, - toplinski kapacitet komponenata produkata izgaranja (toplinski kapacitet CO 2 uzima se za smjesu CO 2 i SO 2), kJ/(m 3 ? K).Zapravo, ne troši se sva toplina koja se oslobađa tijekom izgaranja u uvjetima požara na zagrijavanje produkata izgaranja. Većina se troši na zagrijavanje konstrukcija, pripremu zapaljivih tvari za izgaranje, zagrijavanje suvišnog zraka itd. Stoga je temperatura unutarnjeg požara znatno niža od kalorimetrijske temperature. Metoda izračuna temperature izgaranja pretpostavlja da se cijeli volumen produkata izgaranja zagrijava na istu temperaturu. U stvarnosti, temperatura na različitim točkama žarišta izgaranja nije ista. Najviša temperatura je u području prostora gdje se odvija reakcija izgaranja, tj. u zoni izgaranja (plamena). Temperatura je znatno niža na mjestima gdje se oslobađaju zapaljive pare i plinovi iz goruće tvari i produkti izgaranja pomiješani s viškom zraka.
Kako bi se procijenila priroda promjena temperature tijekom požara ovisno o različitim uvjetima izgaranja, uveden je koncept prosječne volumetrijske temperature požara, koja se shvaća kao prosječna vrijednost temperatura izmjerenih termometrima na različitim točkama unutarnjeg požara. Ova temperatura je određena iskustvom.
Toplina izgaranja, odnosno ogrjevna vrijednost (kalorična vrijednost), goriva Q je količina topline koja se oslobađa pri potpunom izgaranju 1 mola (kcal/mol), 1 kg (kcal/kg) ili 1 m3 goriva (kcal/m3 ),
Volumetrijska kalorična vrijednost obično se koristi u proračunima koji uključuju korištenje plinovitog goriva. U ovom slučaju razlikuje se toplina izgaranja 1 m3 plina u normalnim uvjetima, tj. pri temperaturi plina od 0 ° C i tlaku od 1 kgf / cm2, au standardnim uvjetima - pri temperaturi od 20 ° C i tlak od 760 mm Hg. Umjetnost.:
Vct - 293 "norma -
U ovoj knjizi dani su proračuni topline izgaranja plinovitog goriva za 1 m3 u normalnim uvjetima.
Za normalne uvjete izračunati su i volumeni produkata izgaranja svih vrsta goriva.
Pri analizi goriva iu termičkim proračunima treba imati posla s višim i nižim kaloričnim vrijednostima.
Veća kalorična vrijednost goriva QB, kao što je već spomenuto, je količina topline koja se oslobađa tijekom potpunog izgaranja jedinice goriva uz stvaranje CO2, HgO u tekuće stanje i SO2. Blizu najveće kalorične vrijednosti je kalorična vrijednost određena kada gorivo izgara u kalorimetrijskoj bombi u atmosferi kisika<2б. Незначительное отличие теплоты сгорания в бомбе от высшей теплоты сгорания QB обусловлено тем, что при сжигании в атмосфере кислорода топливо окисляется более глубоко, чем при его сгорании на воздухе. Так, например, сера топлива сгорает в калориметрической бомбе не до SO2, а до S03, и при сжигании топлива в бомбе образуются серная и азотная кислоты.
Donja kalorična vrijednost goriva QH, kao što je gore spomenuto, je količina topline koja se oslobađa tijekom potpunog izgaranja jedinice goriva uz stvaranje CO2, HgO u parnom stanju i SO2. Osim toga, pri izračunu donje kalorične vrijednosti uzima se u obzir utrošak topline za isparavanje vlage goriva.
Posljedično, niža toplina izgaranja razlikuje se od većeg utroška topline za isparavanje vlage sadržane u gorivu Wr i
Proizvedeno tijekom izgaranja vodika sadržanog u gorivu
Pri izračunu razlike između veće i donje ogrjevne vrijednosti uzima se u obzir utrošak topline za kondenzaciju vodene pare i hlađenje nastalog kondenzata na 0 °C. Ta razlika iznosi oko 600 kcal po 1 kg vlage, tj. 6 kcal za svaki postotak vlage sadržane u gorivu ili nastale izgaranjem vodika uključenog u smjesu goriva.
Vrijednosti viših i nižih kalorijskih vrijednosti raznih vrsta goriva dane su u tablici. 18.
Za goriva s niskim sadržajem vodika i vlage razlika između viših i nižih ogrjevnih vrijednosti je mala, primjerice za antracit i koks - samo oko 2%. Međutim, za goriva s visokim sadržajem vodika i vlage, ova razlika postaje prilično značajna. Dakle, za prirodni plin, koji se sastoji uglavnom od CH4 i sadrži 25% (prema imaos) H, veća kalorična vrijednost premašuje nižu za 11%.
Viša ogrjevna vrijednost zapaljive mase drva za ogrjev, treseta i mrkog ugljena, koja sadrži oko 6% H, premašuje nižu ogrjevnu vrijednost za 4-5%. Razlika između viših i nižih toplinskih vrijednosti radne mase ovih vrlo mokrih goriva znatno je veća. To je oko 20%.
Pri procjeni učinkovitosti korištenja ovih vrsta goriva bitno je koja se kalorijska vrijednost uzima u obzir - veća ili manja.
U SSSR-u iu većini stranih zemalja proračuni toplinske tehnike obično se izvode na temelju niže kalorične vrijednosti goriva, budući da temperatura dimnih plinova koji se uklanjaju iz postrojenja koja koriste gorivo prelazi 100 °C, pa stoga dolazi do kondenzacije ne pojavljuje se vodena para sadržana u produktima izgaranja.
U Ujedinjenom Kraljevstvu i SAD-u slični izračuni obično se izvode na temelju bruto kalorične vrijednosti goriva. Stoga je pri usporedbi podataka iz ispitivanja kotlova i ložišta izvedenih na temelju nižih i viših toplinskih vrijednosti potrebno napraviti odgovarajući preračun Qn i QB pomoću formule
Q„=QB-6(G + 9H) kcal/kg. (II.2)
U termotehničkim proračunima preporučljivo je koristiti obje vrijednosti kalorične vrijednosti. Dakle, za ocjenu učinkovitosti korištenja prirodnog plina u kotlovnicama opremljenim kontaktnim ekonomizatorima, pri temperaturi dimnih plinova od oko 30-40 °C, treba uzeti najvišu ogrjevnu vrijednost, a proračun u uvjetima kada dolazi do kondenzacije vodene pare. prikladnije je izvesti na temelju izgaranja niže kalorične vrijednosti.
Toplina izgaranja goriva određena je sastavom zapaljive mase i sadržajem balasta u radnoj masi goriva.
Toplina izgaranja zapaljivih gorivih elemenata značajno varira (vodika ima oko 4 puta više od ugljika, a 10 puta više od sumpora).
Toplina izgaranja 1 kg benzina, kerozina, loživog ulja, odnosno tekućeg goriva s visokim udjelom vodika, znatno premašuje toplinu izgaranja zapaljive mase koksa, antracita i drugih vrsta krutog goriva s visokim udjelom ugljika i vrlo nizak sadržaj vodika. Toplina izgaranja zapaljive mase goriva određena je njezinim elementarnim sastavom i kemijskim sastavom sastavnih spojeva.
Najveća toplina izgaranja atomskog vodika koja se stvara u posebnim instalacijama iznosi oko 85 500 kcal/kg-atoma, a najviša
|
Vrijednost više i niže ogrjevne moći pojedinih vrsta goriva
|
Toplina izgaranja molekularnog vodika sadržanog u plinovitom gorivu iznosi samo 68 000 kcal/mol. Razlika u toplini izgaranja (2-85.500-68.000), koja iznosi oko 103.000 kcal/mol, nastaje zbog utroška energije za kidanje veza između atoma vodika.
Naravno, razlika u količini topline koja se oslobađa pri izgaranju vodika, koji je dio zapaljive mase raznih vrsta goriva, neusporedivo je manja od razlike između toplina izgaranja atomskog i molekularnog vodika, ali ipak postoji. .
Priroda veza između ugljikovih atoma u molekuli također ima značajan utjecaj na toplinu izgaranja goriva.
Sastav raznih vrsta goriva uključuje ugljikovodike različitih homolognih serija. Utjecaj prirode kemijskih veza među atomima na toplinu izgaranja zapaljive mase goriva vidljiv je iz razmatranja sastava i topline izgaranja ugljikovodika.
1. Alkani (parafinski ugljikovodici) su zasićeni ugljikovodici alifatske strukture. Opća formula alkana je SpNgn+2, odnosno CH3-(CHg) p-2-CH3.
Najlakši ugljikovodik, metan CH4, uključen je u. sastav većine tehničkih plinova i glavna je komponenta prirodnih plinova: stavropoljski, šebelinski, tjumenski, orenburški i dr. Etan SgNv nalazi se u nafti i prirodnim plinovima, kao i u plinovima dobivenim suhom destilacijom krutih goriva. Ukapljeni plinovi uglavnom se sastoje od propana C3H8 i butana C4H10.
Alkani velike molekularne težine nalaze se u raznim vrstama tekućih goriva. U molekulama zasićenih ugljikovodika postoje sljedeće veze među atomima: C-H i C-C. Na primjer, strukturna formula normalnog heksana C6Hi4 je
ja ja ja ja ja ja n n n n n n
U molekuli heksana postoji 5 C-C veza i 14 C-H veza.
2. Ciklani su zasićeni ugljikovodici cikličke strukture. Opća formula ciklana je SpN2n.
|
6 C-C veza i 12 C-H veza. 3. Alkeni su nezasićeni monoolefinski ugljikovodici. Opća formula SpNgp. Najlakši ugljikovodik ovog homolognog niza, etilen (eten), nalazi se u koksnim i polukoksnim plinovima, u značajnim količinama uključen je u plinove rafinerija nafte. Veze među atomima: C-H, C-C i jedna dvostruka (olefinska) veza između dva atoma ugljika C = C; na primjer, u normalnom heksenu C6H12 (heksen-1) 5. Alkini - nezasićeni ugljikovodici alifatske strukture s trostrukom vezom C = C. Opća formula alkina je SpN2n-2. Najvažniji od ugljikovodika ove klase je acetilen HC = CH. Veze među atomima u alkinima: H-C, C-C i C=C. Toplina izgaranja i toplinska svojstva ugljikovodika su pod jakim utjecajem energije kidanja veza između atoma u molekuli. Topla? a kidanje H-H veze uz nastanak atomskog vodika iznosi oko 103 tisuće kcal/mol. U tablici 19 prikazuje podatke o toplinama cijepanja veze u ugljikovodicima prema Ya.K.Syrkinu i M.E.Dyatkinu G161 i prema L. Paulinu - GU. Tablica 19 |
Da biste saznali utjecaj prirode veza između atoma ugljika u molekuli ugljikovodika na toplinu njihovog izgaranja, preporučljivo je koristiti ne apsolutne vrijednosti energije veza između atoma, već razlike u energiji rezerva zbog različite prirode veza: između atoma u molekuli.
Kada se uspoređuju topline kidanja veza između atoma ugljika u molekuli ugljikovodika, lako je vidjeti da kidanje jedne dvostruke veze zahtijeva znatno manje energije nego kidanje dviju jednostrukih veza. Utrošak energije za kidanje jedne trostruke veze čak je manji od utroška energije za kidanje tri jednostruke veze. Utvrditi utjecaj razlika u toplinama cijepanja dvostrukih i jednostrukih veza između ugljikovih atoma na toplinu izgaranja.
29-
ugljikovodika, usporedimo dva ugljikovodika različite strukture: etilen H2C=CH2 i cikloheksan CeHi2. Oba ugljikovodika imaju dva atoma vodika po atomu ugljika. Međutim, nezasićeni ugljikovodik etilen ima dvostruku vezu između svojih ugljikovih atoma, dok zasićeni ciklički ugljikovodik cikloheksan ima jednostruke veze između svojih ugljikovih atoma.
Radi lakšeg izračuna, uspoređujemo tri mola etilena (3-C2H4) s jednim molom cikloheksana (CeHi2), jer u tom slučaju, kada se veze među atomima pokidaju, nastaje isti broj gram atoma ugljika i vodika .
Energija potrebna za kidanje veza između atoma u tri mola etilena C2H4 manja je od energije potrebne za kidanje veza u jednom molu cikloheksana SwH12. Naime, u oba slučaja potrebno je raskinuti 12 C-H veza između atoma ugljika i vodika, a uz to u prvom slučaju tri dvostruke C=C veze, au drugom slučaju šest jednostrukih C-C veza, što podrazumijeva veliku potrošnju energije.
Budući da je broj gram atoma ugljika i vodika dobivenih kidanjem veza u tri mola etilena i jednom molu cikloheksana isti, toplina izgaranja tri mola etilena trebala bi biti veća od topline izgaranja jednog mola cikloheksana. brojem kilokalorija koji odgovara razlici u toplinama kidanja veza između atoma u jednom molu cikloheksana i tri mola etilena.
Najniža toplina izgaranja tri mola etilena je 316-3 = 948 tisuća kcal, a jedan mol cikloheksana je 882 tisuće kcal.
Toplina stvaranja ugljikovodika iz grafita i molekularnog vodika može se izračunati pomoću formule
Gdje je Qc„Hm donja toplina izgaranja ugljikovodika, kcal/mol; Qc je toplina izgaranja ugljika u obliku grafita, kcal/kg-atom; n je broj ugljikovih atoma u molekuli ugljikovodika; Qh2 - donja toplina izgaranja molekularnog vodika, kcal/mol; t je broj vodikovih atoma u molekuli ugljikovodika.
U tablici Slika 20 prikazuje topline stvaranja grafita i molekularnog vodika iz nekih ugljikovodika i prikazuje omjere toplina stvaranja prema toplinama izgaranja odgovarajućih količina ugljika i molekularnog vodika.
Razmotrimo nekoliko primjera koji ilustriraju valjanost gore navedenih odredbi.
Metan CH4. Najniža kalorijska vrijednost je 191,8 tisuća kcal/mol. Sadržaj topline 1 kg atoma ugljika i 2 kmol vodika, što je ekvivalentno 1 kmol metana, jednak je 94 + 2-57,8 = 209,6 tisuća kcal. Dakle, toplina stvaranja grafita i molekularnog vodika iz metana je 191,8-209,6 = -17,8 tisuća kcal/mol.
Omjer topline stvaranja ugljika i vodika iz metana prema zbroju topline izgaranja ugljika i vodika nastalih iz metana jednak je
|
Tablica 20 Toplina izgaranja ugljikovodika i ekvivalentnih količina ugljika i vodika
|
Omjer topline stvaranja ugljika i vodika iz etana i zbroja topline izgaranja nastale iz etana, ugljika i vodika je 20-100
AC>=-ZbM~ = -5’5%-
Propan SzN8. Najniža toplina izgaranja propana je 488,7 tisuća kcal / mol. Zbroj toplina izgaranja ugljika i vodika ekvivalentan propanu jednak je
3-94+4-57,8=513,2 tisuća kcal/mol.
Toplina stvaranja grafita i vodika iz propana
488,7-513,2=-24,5 tisuća kcal/mol.
Omjer topline stvaranja ugljika i vodika iz propana prema zbroju toplina izgaranja nastalog ugljika i vodika jednak je -24,5-100
L<2=——— 513^- =-4,8%.
Etilen (eten) CaH4. Donja toplina izgaranja etilena je 316,3 tisuća kcal / mol. Zbroj topline izgaranja ekvivalentan jednom molu etilena, 2 kg-atoma ugljika i 2 kmol vodika jednak je 303,6 tisuća kcal/mol.
Toplina nastanka grafita i vodika iz etilena jednaka je
316,3-303,6 = 12,7 tisuća kcal/mol.
Posljedično, omjer topline stvaranja ugljika i vodika iz etilena prema zbroju topline izgaranja formiranog iz ugljika i vodika pomoću etilena je 12,7-100
A
Propilen (propen) C3Hb. Donja toplina izgaranja propilena je 460,6 tisuća kcal/mol.Zbroj topline izgaranja ekvivalentan 1 molu propilena, 3 kg atoma ugljika i 3 kmol vodika jednak je 455,4 tisuća kcal/mol.
Toplina nastanka grafita i vodika iz propilena je
460,6-455,4 = 5,2 tisuće kcal/mol,
Omjer topline stvaranja ugljika i vodika iz propilena prema zbroju njihovih toplina izgaranja jednak je
Toplina razgradnje na ugljik i molekularni vodik u prvim članovima odgovarajućeg homolognog niza nezasićenih ugljikovodika je pozitivna (reakcija je egzotermna), a s povećanjem molekulske mase toplina razgradnje opada i postaje negativna vrijednost. Prema tome, među nezasićenim ugljikovodicima mora postojati tvar određene molekularne težine, čija je toplina razgradnje na ugljik i vodik mala.
U nizu nezasićenih ugljikovodika s jednom dvostrukom vezom - alke - butilen je takav novi ugljik
CH2=CH-CH2-CHN.
Toplina razgradnje 1 kmol butilena na ugljik i molekularni vodik iznosi samo ~600 kcal, što je oko 0,1% od zbroja toplina izgaranja nastalih tijekom razgradnje butilena na ugljik i vodik.
Sukladno navedenom, toplina izgaranja ugljikovodika i drugih organskih tvari točnije se određuje njihovim grupnim komponentnim sastavom. Međutim, praktički je moguće odrediti toplinu izgaranja goriva na temelju njegovog grupnog komponentnog sastava samo za plinovito gorivo.
Određivanje grupnog sastava tekućeg, a posebno krutog goriva, toliko je teško da se mora ograničiti na određivanje samo elementarnog sastava goriva i izračunavanje topline izgaranja prema podacima elementarne analize zapaljive mase goriva i sadržaj balasta u radnoj masi goriva. Uz ugljik, vodik i sumpor, zapaljiva masa goriva uključuje dušik i kisik.
Svaki postotak dušika sadržan u zapaljivoj masi goriva smanjuje njegovu toplinu izgaranja za 1%. Sadržaj dušika u gorivoj masi tekućeg goriva obično je desetinke postotka, u krutom gorivu 1-2%. Dakle, prisutnost dušika u zapaljivoj masi tekućine i... kruto gorivo relativno malo utječe na njegovu ogrjevnu vrijednost.
U plinovitom gorivu, za razliku od tekućeg i krutog, dušik nije dio komponenti gorive mase, već je sadržan u obliku molekulskog dušika N2 i balastna je komponenta. Sadržaj dušika u nekim vrstama plinovitih goriva vrlo je visok i uvelike utječe na njegovu ogrjevnu vrijednost.
|
Ovisnost topline izgaranja i toplinske snage zapaljive mase krutog goriva o sadržaju kisika u njoj1
|
Kao što je gore spomenuto, svaki postotak kemijski vezanog kisika sadržanog u zapaljivoj masi smanjuje njezinu toplinu izgaranja za 26 kcal/kg.
Dakle, povećanje sadržaja kisika za 1% u zapaljivoj masi krutog goriva, na primjer, ugljena s ogrjevnom vrijednošću od oko 8000 kcal/kg, smanjuje toplinu izgaranja zapaljive mase goriva za 1% kao rezultat smanjenja sadržaja ugljika i vodika i to za (26-100) -,8000=0,32% zbog djelomične oksidacije sagorive mase goriva, a samo oko 1,3%. Posljedično, promjena udjela kisika u zapaljivoj masi goriva uvelike utječe na njegovu toplinu izgaranja.
Topline izgaranja zapaljive mase krutog goriva koja sadrži oko 6% vodika, relativno nizak udio sumpora i različite udjele kisika i ugljika dane su u tablici. 21.
Podaci prikazani u tablici pokazuju da je toplina izgaranja gorive mase masnog ugljena 80% veća od topline izgaranja gorive mase drva zbog nižeg udjela kisika, a time i većeg udjela ugljika.
Balast u gorivu naglo smanjuje svoju toplinu izgaranja, prvenstveno zbog odgovarajućeg smanjenja sadržaja zapaljive mase. Osim toga, dio topline se troši na isparavanje vlage, a ako gorivo sadrži znatnu mineralnu masu, i na njenu razgradnju pri visokim temperaturama u ložištima. Sukladno tome, smanjuje se udio korisne topline.
U kamenom ugljenu s kalorijskom vrijednošću od oko 6000 kcal/kg, povećanje udjela vlage za 1% smanjuje donju kaloričnu vrijednost za 66 kcal/kg, uključujući za 60 kcal/kg kao rezultat povećanja sadržaja balasta u goriva i za 6 kcal/kg zbog potrošnje topline za isparavanje vlage.
2 B M Rarich 33
Dakle, dodatni utrošak topline za isparavanje vlage je samo Vio od smanjenja kalorične vrijednosti zbog smanjenja sadržaja zapaljive mase u gorivu. Za loživo ulje s kaloričnom vrijednošću većom od 9000 kcal/kg udio dodatnog utroška topline za isparavanje vlage još je manji (tablica 22).
Tablica 22
|
Promjena donje ogrjevne vrijednosti goriva s povećanjem sadržaja vlage za 1%
|
Za gorivo s konstantnim sastavom zapaljive mase i niskim sadržajem pepela, kalorijska vrijednost izgaranja jasno je određena sadržajem vlage. Stoga, za takve vrste goriva kao što je ogrjevno drvo, donja kalorična vrijednost radne mase QS može se odrediti ovisno o sadržaju vlage pomoću formule
Qjj (100 - WV) - 600WP
QJ=—————— jqq————— kcal/kg,
Gdje je QJ donja kalorična vrijednost suhog goriva (malo varirajuća vrijednost, uzeta iz referentnih tablica), kcal/kg; - sadržaj vlage, određen analizom radnog goriva, % po masi).
Kod promjenjivog sadržaja pepela u gorivu donja toplina izgaranja radne mase izračunava se iz topline izgaranja zapaljive mase pomoću formule
600WP
Qk=———————- jqq—————— kcal/kg,
Gdje je Qh donja toplina izgaranja zapaljive mase, kcal/kg; Lr - sadržaj pepela u gorivu, %’. - vlažnost goriva, %
5. TOPLINSKA BILANSA IZGARANJA
Razmotrimo metode za izračunavanje toplinske bilance procesa izgaranja plinovitih, tekućih i krutih goriva. Proračun se svodi na rješavanje sljedećih problema.
· Određivanje topline izgaranja (kalorične vrijednosti) goriva.
· Određivanje teorijske temperature izgaranja.
5.1. TOPLINA IZGARANJA
Kemijske reakcije popraćene su oslobađanjem ili apsorpcijom topline. Kada se toplina oslobađa, reakcija se naziva egzotermna, a kada se toplina apsorbira, endotermna. Sve reakcije izgaranja su egzotermne, a produkti izgaranja su egzotermni spojevi.
Toplina koja se oslobađa (ili apsorbira) tijekom kemijske reakcije naziva se toplina reakcije. U egzotermnim reakcijama je pozitivan, u endotermnim reakcijama je negativan. Reakcija izgaranja uvijek je popraćena oslobađanjem topline. Toplina izgaranja Q g(J/mol) je količina topline koja se oslobađa pri potpunom izgaranju jednog mola tvari i pretvaranju zapaljive tvari u produkte potpunog izgaranja. Mol je osnovna SI jedinica količine tvari. Jedan mol je količina tvari koja sadrži isti broj čestica (atoma, molekula itd.) koliko ima atoma u 12 g izotopa ugljika-12. Masa količine tvari jednake 1 molu (molekularna ili molarna masa) numerički se podudara s relativnom molekulskom masom ove tvari.
Na primjer, relativna molekularna težina kisika (O 2) je 32, ugljičnog dioksida (CO 2) je 44, a odgovarajuće molekulske mase bit će M = 32 g/mol i M = 44 g/mol. Tako jedan mol kisika sadrži 32 grama ove tvari, a jedan mol CO 2 sadrži 44 grama ugljičnog dioksida.
U tehničkim proračunima najčešće se ne koristi toplina izgaranja. Q g, i kalorična vrijednost goriva Q(J/kg ili J/m 3). Kalorijska vrijednost tvari je količina topline koja se oslobodi pri potpunom izgaranju 1 kg ili 1 m 3 tvari. Za tekuće i čvrste tvari obračun se vrši po 1 kg, a za plinovite tvari - po 1 m 3.
Poznavanje topline izgaranja i kalorične vrijednosti goriva potrebno je za izračunavanje temperature izgaranja ili eksplozije, tlaka eksplozije, brzine širenja plamena i drugih karakteristika. Kalorična vrijednost goriva određuje se eksperimentalno ili računski. Pri eksperimentalnom određivanju kalorične vrijednosti zadana masa krutog ili tekućeg goriva spaljuje se u kalorimetrijskoj bombi, a kod plinovitog goriva u plinskom kalorimetru. Ovi instrumenti mjere ukupnu toplinu Q 0 koji se oslobađa tijekom izgaranja uzorka goriva vaganja m. Kalorijska vrijednost Q g nalazi se formulom
Odnos između topline izgaranja i
kalorična vrijednost goriva
Za uspostavljanje veze između topline izgaranja i kalorične vrijednosti tvari potrebno je napisati jednadžbu kemijske reakcije izgaranja.
Produkt potpunog izgaranja ugljika je ugljični dioksid:
C+O2 → CO2.
Produkt potpunog izgaranja vodika je voda:
2H 2 +O 2 → 2H 2 O.
Produkt potpunog izgaranja sumpora je sumporni dioksid:
S +O 2 → SO 2.
U ovom slučaju, dušik, halogeni i drugi nezapaljivi elementi oslobađaju se u slobodnom obliku.
Zapaljiva tvar – plin
Kao primjer, izračunajmo ogrjevnu vrijednost metana CH 4, za koji je toplina izgaranja jednaka Q g=882.6 .
· Odredimo molekulsku težinu metana prema njegovoj kemijskoj formuli (CH 4):
M=1∙12+4∙1=16 g/mol.
· Odredimo ogrjevnu vrijednost 1 kg metana:
· Nađimo volumen 1 kg metana, znajući njegovu gustoću ρ=0,717 kg/m3 u normalnim uvjetima:
 .
.
· Odredimo ogrjevnu vrijednost 1 m 3 metana:
Kalorična vrijednost svih zapaljivih plinova određuje se na sličan način. Za mnoge uobičajene tvari, toplina izgaranja i kalorijske vrijednosti izmjerene su s visokom točnošću i navedene su u relevantnoj referentnoj literaturi. Evo tablice kalorijskih vrijednosti nekih plinovitih tvari (tablica 5.1). Veličina Q u ovoj tablici dano je u MJ/m 3 iu kcal/m 3, budući da se 1 kcal = 4,1868 kJ često koristi kao jedinica za toplinu.
Tablica 5.1
Kalorična vrijednost plinovitih goriva
|
Supstanca |
Acetilen |
|||||
|
Q |
||||||
Zapaljiva tvar – tekuća ili kruta
Kao primjer, izračunajmo ogrjevnu vrijednost etilnog alkohola C 2 H 5 OH, za koji je toplina izgaranja Q g= 1373,3 kJ/mol.
· Odredimo molekulsku težinu etilnog alkohola prema njegovoj kemijskoj formuli (C 2 H 5 OH):
M = 2∙12 + 5∙1 + 1∙16 + 1∙1 = 46 g/mol.
Odredimo kaloričnu vrijednost 1 kg etilnog alkohola:
Kalorijska vrijednost svih tekućih i krutih zapaljivih tvari određuje se na sličan način. U tablici 5.2 i 5.3 prikazuju kalorične vrijednosti Q(MJ/kg i kcal/kg) za neke tekućine i čvrste tvari.
Tablica 5.2
Kalorična vrijednost tekućih goriva
|
Supstanca |
Metilni alkohol |
Etanol |
Lož ulje, ulje |
||||
|
Q |
|||||||
Tablica 5.3
Kalorijska vrijednost krutih goriva
|
Supstanca |
Stablo je svježe |
Suha drva |
Mrki ugljen |
Suhi treset |
Antracit, koks |
||
|
Q |
|||||||
Mendeljejeva formula
Ako je kalorična vrijednost goriva nepoznata, tada se može izračunati pomoću empirijske formule koju je predložio D.I. Mendeljejev. Da biste to učinili, morate znati elementarni sastav goriva (ekvivalentna formula goriva), odnosno postotni sadržaj sljedećih elemenata u njemu:
kisik (O);
vodik (H);
Ugljik (C);
Sumpor (S);
Pepeo (A);
Voda (W).
Produkti izgaranja goriva uvijek sadrže vodenu paru, koja nastaje kako zbog prisutnosti vlage u gorivu, tako i tijekom izgaranja vodika. Produkti izgaranja otpada napuštaju industrijsko postrojenje na temperaturi iznad točke rosišta. Stoga se toplina koja se oslobađa pri kondenzaciji vodene pare ne može korisno iskoristiti i ne treba je uzimati u obzir u toplinskim proračunima.
Za izračun se obično koristi donja ogrjevna vrijednost Q n gorivo, koje uzima u obzir gubitke topline s vodenom parom. Za kruta i tekuća goriva vrijednost Q n(MJ/kg) približno se određuje Mendeljejevom formulom:
Q n=0.339+1.025+0.1085 – 0.1085 – 0.025, (5.1)
gdje je u zagradama naveden postotak (tež.%) sadržaja odgovarajućih elemenata u sastavu goriva.
Ova formula uzima u obzir toplinu egzotermnih reakcija izgaranja ugljika, vodika i sumpora (s predznakom plus). Kisik sadržan u gorivu djelomično zamjenjuje kisik u zraku, pa se odgovarajući član u formuli (5.1) uzima s predznakom minus. Kada vlaga isparava, troši se toplina, pa se i odgovarajući član koji sadrži W uzima s predznakom minus.
Usporedba izračunatih i eksperimentalnih podataka o kaloričnoj vrijednosti različitih goriva (drvo, treset, ugljen, nafta) pokazala je da izračun pomoću formule Mendelejeva (5.1) daje pogrešku ne veću od 10%.
Donja ogrjevna vrijednost Q n(MJ/m3) suhih zapaljivih plinova može se s dovoljnom točnošću izračunati kao zbroj umnožaka ogrjevne vrijednosti pojedinih komponenti i njihova postotnog sadržaja u 1 m3 plinovitog goriva.
Q n= 0,108[N 2 ] + 0,126 [SO] + 0,358 [SN 4 ] + 0,5 [S 2 N 2 ] + 0,234 [N 2 S ]…, (5.2)
gdje je u zagradama naveden postotak (volumni %) udjela odgovarajućih plinova u smjesi.
U prosjeku je ogrjevna vrijednost prirodnog plina približno 53,6 MJ/m 3 . U umjetno proizvedenim zapaljivim plinovima sadržaj metana CH4 je neznatan. Glavne zapaljive komponente su vodik H2 i ugljikov monoksid CO. U koksnom plinu, primjerice, sadržaj H2 doseže (55 ÷ 60)%, a donja ogrjevna vrijednost takvog plina doseže 17,6 MJ/m3. Generatorski plin sadrži CO ~ 30% i H 2 ~ 15%, dok je niža kalorična vrijednost generatorskog plina Q n= (5,2÷6,5) MJ/m3. Sadržaj CO i H 2 u plinu visoke peći je manji; veličina Q n= (4,0÷4,2) MJ/m3.
Pogledajmo primjere izračuna kalorijske vrijednosti tvari pomoću formule Mendelejeva.
Odredimo ogrjevnu vrijednost ugljena čiji je elementarni sastav dan u tablici. 5.4.
Tablica 5.4
Elementarni sastav ugljena
· Zamijenimo one dane u tablici. Podaci 5.4 u Mendelejevovoj formuli (5.1) (dušik N i pepeo A nisu uključeni u ovu formulu, jer su inertne tvari i ne sudjeluju u reakciji izgaranja):
Q n=0,339∙37,2+1,025∙2,6+0,1085∙0,6–0,1085∙12–0,025∙40=13,04 MJ/kg.
Odredimo količinu drva za ogrjev potrebnu za zagrijavanje 50 litara vode od 10°C do 100°C, ako se 5% topline oslobođene izgaranjem troši za grijanje, te toplinski kapacitet vode. S=1 kcal/(kg∙deg) ili 4,1868 kJ/(kg∙deg). Elementni sastav ogrjevnog drveta dat je u tablici. 5.5:
Tablica 5.5
Elementarni sastav ogrjevnog drveta
|
· Nađimo ogrjevnu vrijednost drva za ogrjev pomoću formule Mendelejeva (5.1): Q n=0,339∙43+1,025∙7–0,1085∙41–0,025∙7= 17,12 MJ/kg. · Odredimo količinu topline utrošenu na zagrijavanje vode pri izgaranju 1 kg drva za ogrjev (uzimajući u obzir činjenicu da se 5% topline (a = 0,05) oslobođene tijekom izgaranja troši na zagrijavanje): Q 2 =a Q n=0,05·17,12=0,86 MJ/kg. · Odredimo količinu drva za ogrjev potrebnu za zagrijavanje 50 litara vode od 10°C do 100°C:
Dakle, za zagrijavanje vode potrebno je oko 22 kg drva za ogrjev. |

 kg.
kg.