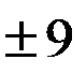Об'ємна частка газів у суміші
1. Ознайомтеся, запишіть визначення та формулу для знаходження об'ємної частки газу:
До складу повітря входить кілька різних газів: кисень, азот, вуглекислий газ, благородні гази, водяні пари та деякі інші речовини. Зміст кожного з цих газів у чистому повітрі чітко визначено.
Для того щоб виразити склад суміші газів у цифрах, тобто кількісно, використовують особливу величину, яку називають об'ємною часткою газів у суміші.
Об'ємну частку газу в суміші позначають грецькою літерою- "Фі".
Об'ємною часткою газу в суміші називають відношення обсягу даного газу до загального обсягу суміші:
![]()
Що ж показує об'ємна частка газу в суміші або, як то кажуть, який фізичний зміст цієї величини? Об'ємна частка газу показує, яку частину загального обсягу суміші займає цей газ.
Якби нам вдалося розділити 100 л повітря на окремі газоподібні компоненти, ми отримали б близько 78 л азоту, 21 л кисню, 30 мл вуглекислого газу, в обсязі, що залишився, містилися б так звані благородні гази (головним чином аргон) і деякі інші (мал. 62).
|
Мал. 62. |
Розрахуємо об'ємні частки цих газів у повітрі:

Неважко помітити, що сума об'ємних часток усіх газів у суміші завжди дорівнює 1, або 100%:
(Азоту) + (Кис.) + (Кут. газу) + (Дер. газів) = 78% + 21% + 0,03% + 0,97% = 100%.
Те повітря, яке ми видихаємо, набагато бідніше киснем (його об'ємна частка знижується до 16%), проте вміст вуглекислого газу зростає до 4%. Таке повітря для дихання вже непридатне. Ось чому приміщення, де знаходиться багато людей, треба регулярно провітрювати.
У хімії з виробництва частіше доводиться зіштовхуватися зі зворотним завданням: визначати обсяг газу суміші за відомої об'ємної частці.
2. Розгляньте приклади завдань
приклад. Обчисліть об'єм кисню, що міститься у 500 л повітря.
З визначення об'ємної частки газу суміші виразимо обсяг кисню:
V(Кис.) = V(пов.) (кисл.).
Підставимо в рівняння числа та розрахуємо обсяг кисню:
V(Кис.) = 500 (л) 0,21 = 105 л.
До речі, для наближених розрахунків об'ємну частку кисню повітря можна прийняти рівної 0,2, чи 20%.
При розрахунку об'ємних часток газів у суміші можна скористатися невеликою хитрістю. Знаючи, що сума об'ємних часток дорівнює 100%, для «останнього» газу суміші цю величину можна розрахувати інакше.
Завдання. Аналіз атмосфери Венери показав, що у 50 мл венеріанського «повітря» міститься 48,5 мл вуглекислого газу та 1,5 мл азоту. Розрахуйте об'ємні частки газів у атмосфері планети.
Дано:
V(суміші) = 50 мл,
V(Кут. газу) = 48,5 мл,
V(Азоту) = 1,5 мл.
Знайти:
(Кут. газу),
Рішення
Розрахуємо об'ємну частку вуглекислого газу суміші. За визначенням:
Обчислимо об'ємну частку азоту в суміші, знаючи, що сума об'ємних часток газів у суміші дорівнює 100%:
(Кут. газу) + (Азоту) = 100%,
(Азоту) = 100% - (Кут. газу) = 100% - 97% = 3%.
Відповідь.(Кут. газу) = 97%, (Азоту) = 3%.
За допомогою якої величини вимірюють вміст компонентів у сумішах іншого типу, наприклад, у розчинах? Зрозуміло, що в цьому випадку користуватися об'ємною часткою незручно. На допомогу приходить нова величина, про яку ви дізнаєтесь на наступному уроці.
3. Виконайте домашнє завдання:
1. Що таке об'ємна частка компонента газової суміші?
2. Об'ємна частка аргону повітря 0,9%. Який об'єм повітря потрібний для отримання 5 л аргону?
3. При розподілі повітря було отримано 224 л азоту. Які обсяги кисню та вуглекислого газу було отримано при цьому?
4. Об'ємна частка метану у природному газі становить 92%. Який обсяг цієї газової суміші міститиме 4,6 мл метану?
5. Змішали 6 л кисню та 2 л вуглекислого газу. Знайдіть об'ємну частку кожного газу отриманої суміші.
У статті розглядається таке поняття як масова частка. Наводяться засоби її обчислення. Також описано визначення подібних за звучанням, але відмінних за фізичним змістом величин. Це масові частки для елемента та виходу.
Колиска життя - розчин
Вода – джерело життя на нашій прекрасній блакитній планеті. Цей вираз можна зустріти досить часто. Проте мало хто, окрім фахівців, замислюється: насправді субстратом для розвитку перших біологічних системстав розчин речовин, а чи не хімічно чиста вода. Напевно, у популярній літературі чи передачі читач зустрічав вираз «первинний бульйон».
Про джерела, що дали поштовх розвитку життя у вигляді складних органічних молекул, досі сперечаються. Деякі навіть припускають не просто природний і дуже вдалий збіг обставин, а космічне втручання. Причому йдеться зовсім не про міфічні прибульці, а про специфічні умови для створення цих молекул, які можуть існувати тільки на поверхні малих космічних тіл, позбавлених атмосфери, - комети та астероїди. Таким чином, було б правильніше говорити, що розчин органічних молекул - колиска всього живого.
Вода як хімічно чиста речовина
Незважаючи на величезні солоні океани та моря, прісні озера та річки, у хімічно чистому вигляді вода зустрічається вкрай рідко, в основному у спеціальних лабораторіях. Нагадаємо, у вітчизняній науковій традиції хімічно чиста речовина - це субстанція, яка містить не більше десяти мінус шостої міри масової частки домішок.

Отримання абсолютно вільної від сторонніх компонентів маси потребує неймовірних витрат і рідко виправдовує себе. Застосовується лише окремих виробництвах, де навіть один сторонній атом може зіпсувати експеримент. Зазначимо, що напівпровідникові елементи, які становлять основу сьогоднішньої мініатюрної техніки (у тому числі смартфони та планшети), до домішок дуже чутливі. У їх створенні потрібні зовсім незабруднені розчинники. Однак у порівнянні з усією рідиною планети це дуже мало. Як же так виходить, що поширена, що пронизує нашу планету, наскрізь вода так рідко зустрічається в чистому вигляді? Пояснимо трохи нижче.
Ідеальний розчинник
Відповідь на поставлене у попередньому розділі питання неймовірно проста. Вода має полярні молекули. Це означає, що в кожній дрібній частинці цієї рідини позитивний і негативний полюси не набагато, але рознесені. При цьому структури, що виникають навіть у рідкій воді, утворюють додаткові (так звані водневі) зв'язки. І загалом це дає наступний результат. Речовина, що потрапляє у воду (не важливо, який заряд вона має) розтягується молекулами рідини. Кожна частка розчиненої домішки обволікається або негативними, або позитивними сторонами молекул води. Таким чином, ця унікальна рідина здатна розчиняти дуже велика кількістьнайрізноманітніших речовин.

Поняття масової частки у розчині
Розчин, що виходить, містить деяку частину домішки, що має назву "масова частка". Хоча такий вираз зустрічається не часто. Зазвичай використовується інший термін – "концентрація". Масова частка визначається конкретним співвідношенням. Формульний вираз наводити не будемо, він досить простий, пояснимо краще фізичний зміст. Це співвідношення двох мас – домішки до розчину. Масова частка – величина безрозмірна. Виражається по-різному в залежності від конкретних завдань. Тобто у частках одиниці, якщо у формулі є лише співвідношення мас, та у відсотках – якщо результат множиться на 100%.
Розчинність
Крім Н 2 Про застосовуються інші розчинники. Крім того, є речовини, які не віддають свої молекули воді. Зате легко розчиняються в бензині або гарячій сірчаній кислоті.

Існують спеціальні таблиці, які показують, скільки того чи іншого матеріалу залишиться у рідині. Цей показник називається розчинністю, і залежить від температури. Чим вона вища, тим активніше рухаються атоми або молекули розчинника, і тим більше домішок він здатний поглинути.
Варіанти визначення частки розчиненої речовини у розчині
Так як завдання у хіміків та технологів, а також інженерів та фізиків можуть бути різними, частина розчиненої речовини у воді визначається по-різному. Об'ємна частка обчислюється як обсяг домішки загального обсягу розчину. Використовується інший параметр, проте принцип залишається тим самим.
Об'ємна частка зберігає безрозмірність, виражаючи або у частках одиниці, або у відсотках. Молярність (інше ще називається "молярна об'ємна концентрація") - це число молей розчиненої речовини в заданому об'ємі розчину. У цьому вся визначенні беруть участь два різних параметри однієї системи, і розмірність у цієї величини інша. Вона виявляється у молях на літр. Про всяк випадок нагадаємо, що моль - це кількість речовини, що містить приблизно десять у двадцять третьому ступені молекул або атомів.
Концепція масової частки елемента
Ця величина має лише опосередковане відношення до розчинів. Масова частка елемента відрізняється від розглянутого вище поняття. Будь-яке складне хімічне з'єднанняскладається із двох або більше елементів. Кожен має свою відносною масою. Цю величину можна знайти в хімічної системиМенделєєва. Там вона вказана у нецілих числах, але для приблизних завдань значення можна округлити. В склад складної речовинивходить певна кількість атомів кожного виду. Наприклад, у воді (Н2О) два атоми водню та один кисню. Співвідношення між відносною масою всієї речовини та даного елемента у відсотках і становитиме масову частку елемента.

Для недосвідченого читача ці два поняття можуть здатися близькими. І досить часто їх плутають між собою. Масова частка виходу відноситься не до розчинів, а до реакцій. Будь-який хімічний процес завжди протікає із отриманням конкретних продуктів. Їх вихід розраховується за формулами в залежності від реагуючих речовин та умов процесу. На відміну від просто масової частки, цю величину не так просто визначити. Теоретичні розрахункипропонують максимально можливу кількість речовини продукту реакції. Однак практика завжди дає трохи менше значення. Причини такої розбіжності криються у розподілі енергій серед навіть сильно нагрітих молекул.

Таким чином, завжди знайдуться найхолодніші частки, які не зможуть вступити в реакцію і залишаться в початковому стані. Фізичний зміст масової частки виходу у тому, який відсоток становить реально отримане речовина від теоретично розрахованого. Формула неймовірно проста. Маса фактично отриманого товару ділиться на масу фактично розрахованого, весь вираз множиться повністю. Масова частка виходу визначається за кількістю молей речовини, що реагує. Не варто забувати про це. Справа в тому, що одна моль речовини - певна кількість його атомів або молекул. За законом збереження речовини із двадцяти молекул води не може вийти тридцять молекул сірчаної кислоти, тому завдання обчислюються саме так. З кількості молей вихідного компонента виводять масу, яка теоретично можлива результату. Потім, знаючи, скільки продукту реакції насправді було отримано, за описаною вище формулою визначають масову частку виходу.
Масова частка- Відношення маси розчиненої речовини до маси розчину. Масова частка вимірюється у частках одиниці.
m 1 - маса розчиненої речовини, г;
m – загальна маса розчину, г.
Масовий процентний вміст компонента, m%
m % =(m i /Σm i)*100
У бінарних розчинах часто існує однозначна (функціональна) залежність між щільністю розчину та його концентрацією (при цій температурі). Це дає можливість визначати практично концентрації важливих розчинів з допомогою денсиметра (спиртометра, сахариметра, лактометра). Деякі ареометри проградуйовані над значеннях щільності, а безпосередньо концентрації розчину (спирту, жиру в молоці, цукру). Слід враховувати, що для деяких речовин крива густини розчину має максимум, у цьому випадку проводять 2 вимірювання: безпосереднє, і при невеликому розведенні розчину.
Часто для вираження концентрації (наприклад, сірчаної кислоти в електроліті акумуляторних батарей) користуються їх щільністю. Поширені ареометри (денсиметри, густоміри), призначені для визначення концентрації розчинів речовин.
Об'ємна частка
Об'ємна частка- Відношення об'єму розчиненої речовини до об'єму розчину. Об'ємна частка вимірюється у частках одиниці чи у відсотках.
V 1 - Об'єм розчиненої речовини, л;
V – загальний обсяг розчину, л.
Як було зазначено вище, існують ареометри, призначені визначення концентрації розчинів певних речовин. Такі ареометри проградуйовані над значеннях щільності, а безпосередньо концентрації розчину. Для поширених розчинів етилового спирту, концентрація яких зазвичай виражається в об'ємних відсотках, такі ареометри отримали назву спиртомірів або андрометрів.
Молярність (молярна об'ємна концентрація)
Молярна концентрація - кількість розчиненої речовини (кількість молей) в одиниці об'єму розчину. Молярна концентрація у системі СІ вимірюється в моль/м³, проте практично її набагато частіше виражають в моль/л чи ммоль/л. Також поширене вираження у «молярності». Можливе інше позначення молярної концентрації C M, Яке прийнято позначати М. Так, розчин з концентрацією 0,5 моль/л називають 0,5-молярним. Примітка: одиниця «моль» не схиляється відмінками. Після цифри пишуть «моль», подібно до того, як після цифри пишуть «см», «кг» тощо.
V – загальний обсяг розчину, л.
Нормальна концентрація (мольна концентрація еквівалента)
Нормальна концентрація- Кількість еквівалентів даної речовини в 1 літрі розчину. Нормальну концентрацію виражають у моль-екв/л або г-екв/л (мається на увазі міль еквівалентів). Для запису концентрації таких розчинів використовують скорочення н» або « N». Наприклад, розчин, що містить 0,1 моль-екв/л, називають децинормальним і записують як 0,1 н.
ν - кількість розчиненої речовини, моль;
V – загальний обсяг розчину, л;
z – число еквівалентності.
Нормальна концентрація може відрізнятися залежно від реакції, у якій бере участь речовина. Наприклад, одномолярний розчин H 2 SO 4 буде однонормальним, якщо він призначається для реакції з лугом з утворенням гідросульфату KHSO 4 і двонормальним реакції з утворенням K 2 SO 4 .
Сенс величини
Об'ємна частка обчислюється за такою формулою:
,- V 1 - Об'єм розчиненої речовини в одиницях об'єму;
- V - загальний обсяг розчину тих самих одиницях.
Об'ємна частка в хімії
У хімії величина використовується переважно для газів, тому що об'ємна частка газової суміші при н.у. дорівнює його молярної концентрації.
Прийнято виражати об'ємну частку у відсотках.
Див. також
Посилання
Wikimedia Foundation. 2010 .
Дивитись що таке "Об'ємна частка" в інших словниках:
об'ємна частка- - [А.С.Гольдберг. Англо-російський енергетичний словник. 2006 р.] Тематики енергетика загалом EN volume fraction …
Безрозмірна фіз. величина, що характеризує склад суміші та дорівнює відношенню обсягу компонента суміші, приведеного до фіз. умов суміші, до обсягу суміші. О. д. виражається в частках одиниці, наприклад у сотих (відсотки), тисячних (проміле), ...
об'ємна частка нафти в продукції свердловини в даний момент часу- - Тематики нафтогазова промисловість EN oil holdup ... Довідник технічного перекладача
пористість об'ємна- Частка порожнин в обсязі мембрани. [РХТУ ім. Д.І. Менделєєва, кафедра мембранної технології] Тематики мембранні технології … Довідник технічного перекладача
1) русявий. од. маси, що застосовувалась до введення метричної системи заходів. 1 Д. дорівнює 1/96 золотника, або 44434 9 мг. Д. застосовувалася і як од. ваги (1 Д. = 44,4349 мг = = 0,435 758 мН). 2) Частина цілого, наприклад масова частка, молярна частка, … Великий енциклопедичний політехнічний словник
Мільярдна частка одиниця вимірювання концентрації та інших відносних величин, мільярдна частка аналогічна за змістом відсотку або проміле. Позначається скороченням млрд-1 або ppb (англ. Parts per billion, читається «пі пі бі», …
Цей термін має й інші значення, див. Ppm. Мільйонна частка, пропроміле, (ppm) абревіатура позначає мільйонну частку будь-яких відносних величин (1 10-6 від базового показника). Аналогічна за змістом відсотка чи проміле… Вікіпедія
Концентрація - величина, що характеризує кількісний склад розчину. Згідно з правилами ІЮПАК, концентрацією розчиненої речовини (не розчину) називають відношення кількості розчиненої речовини або її маси до об'єму розчину (моль/л … Вікіпедія
Концентрація - величина, що характеризує кількісний склад розчину. Згідно з правилами ІЮПАК, концентрацією розчиненої речовини (не розчину) називають відношення кількості розчиненої речовини або її маси до об'єму розчину (моль/л, г/л).
Визначення масової або об'ємної частки виходу продукту реакції від теоретично можливого
Кількісну оцінку виходу продукту реакції від теоретично можливого виражають у частках одиниці або у відсотках та розраховують за формулами:
M практ / m теорет;
M практ / m теорет * 100%,
де (етта) - масова частка виходу продукту реакції від теоретично можливого;
V практ / V теорет;
V практ / V теорет * 100%,
де (фі) – об'ємна частка виходу продукту реакції від теоретично можливого.
приклад 1. При відновленні воднем оксиду міді(II) масою 96 отримано мідь масою 56,4 г. Скільки це становитиме відтеоретично можливого виходу?
Рішення:
1.Записуємо рівняння хімічної реакції:
CuO + H 2 = Cu + Н 2
1 моль1 моль
2. Обчислюємо хімічну кількість оксиду міді ( II):
М(З u Про) = 80г/моль,
n (CuO) = 96/80 = 1,2 (моль).
3. Обчислюємо теоретичний вихід міді: виходячи з рівняння реакції, n (Cu) = n (CuO) = 1,2 моль,
m (З u) = 1,2 · 64 = 76,8 (г),
т. до. М(С u ) = 64 г/моль
4. Обчислюємо масову частку виходу міді порівняно з теоретично можливим: = 56.4/76.8 = 0,73 чи 73 %
Відповідь: 73 %
приклад 2. Скільки йоду може бути одержано при дії хлору найодид калію масою 132,8 кг, якщо втрати виробництва становлять 4 %?
Рішення:
1.Записуємо рівняння реакції:
2KI + Cl 2 = 2KCl + I 2
2 кмоль 1 кмоль
2. Обчислюємо хімічну кількість йодиду калію:
М(К I ) = 166 кг/кмоль,
n (До I ) = 132.8/166 = 0,8 (кмоль).
2. Визначаємо теоретичний вихід йоду: виходячи з рівняння реакції,
n(I 2)= 1/2n(KI) = 0,4 моль
М (I 2) = 254 кг/кмоль.
Звідки, m (I 2 ) = 0,4 * 254 = 101,6 (кг).
3. Визначаємо масову частку практичного виходу йоду:
= (100 - 4) = 96% або 0,96
4. Визначаємо масу йоду, практично одержаного:
m (I 2 ) = 101,6 * 0,96 = 97,54 (кг).
Відповідь:97,54 кг йоду
приклад 3. При спалюванні 33,6 дм 3 аміаку отримано азот обсягом 15 дм 3 . Обчисліть об'ємну частку виходу азоту % від теоретично можливого.
Рішення:
1. Записуємо рівняння реакції:
4 NH 3 + 3 O 2 = 2 N 2 + 6 H 2 O
4 моль2 моль
2. Обчислюємо теоретичний вихід азоту: відповідно до закону Гей-Люссака
при спалюванні 4 дм 3 аміаку виходить 2 дм 3 азоту, а
при спалюванні 33,6 дм 3 виходить дм 3 азоту
х = 33. 6 * 2/4 = 16,8 (дм 3).
3. Обчислюємо об'ємну частку виходу азоту від теоретично можливого:
15/16.8 = 0,89 або 89%
Відповідь:89 %
приклад 4. Яка маса аміаку необхідна для отримання 5 т азотної кислотиіз масовою часткою кислоти 60 %, вважаючи, що втрати аміаку у виробництві становлять 2,8 %?
Рішення:1. Записуємо рівняння реакцій, що лежать в основі виробництва азотної кислоти:
4NH 3 + 5 O 2 = 4NO + 6H 2 O
2NO + O 2 = 2NO 2
4NO 2 + O 2 + 2H 2 O = 4HNO 3
2. Виходячи з рівнянь реакцій бачимо, що з 4 моль аміаку виходить
4 моль азотної кислоти. Отримуємо схему:
NH 3 HNO 3
1 тмоль1тмоль
3. Обчислюємо масу та хімічну кількість азотної кислоти, яка необхідна для отримання 5 траствору з масовою часткою кислоти 60 %:
m (в-ва) = m (р-ра) * w (в-ва),
m (HNO 3 )= 5 * 0,6 = 3 (т),
4. Обчислюємо хімічну кількість кислоти:
n (HNO 3 ) = 3/63 = 0,048 (тмоль),
т. до. М(HNO 3 ) = 63 г/моль.
5. Виходячи із складеної схеми:
n (NH 3 ) = 0,048 тмоль,
а m (NH 3 ) = 0,048 · 17 = 0,82 (т),
т. до. М(NH 3 ) = 17 г/моль.
Але така кількість аміаку має вступити в реакцію, якщо не враховувати втрати аміаку у виробництві.
6. Обчислюємо масу аміаку з урахуванням втрат: приймемо масу аміаку, що бере участь у реакції - 0,82 т - за 97,2%,