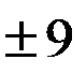Обов'язковий мінімум знань
Схема 1. Символіка Періодичної системи Д. І. Менделєєва
Закономірності зміни властивостей елементів та їх сполук
Зміна властивостей елементів та утворених ними речовин у межах одного періоду зі збільшенням порядкового номера елемента.1. Зростають:
- заряд атомного ядра;
- число електронів у зовнішньому шарі атома;
- ступінь окислення елементів у вищих оксидах та гідроксидах (як правило, дорівнює номеру групи);
- електронегативність;
- окисні властивості;
- не
- кислотні властивості вищих оксидів та гідроксидів.
2. Зменшуються:
- радіус атома;
- металеві властивості простих речовин;
- відновлювальні властивості;
- основні властивості вищих оксидів та гідроксидів.
3. Не змінюєтьсячисло електронних прошарків (енергетичних рівнів) в атомі. Зміна властивостей елементів та утворених ними речовин у межах однієї групи зі збільшенням порядкового номера елемента.
1. Зростають:
- заряд атомного ядра;
- кількість електронних шарів (енергетичних рівнів) в атомі;
- радіус атома;
- відновлювальні властивості;
- металеві властивості простих речовин;
- основні властивості вищих оксидів та гідроксидів;
- кислотні властивості (ступінь електролітичної дисоціації) безкисневих кислот неметалів.
2. Зменшуються:
- електронегативність;
- окисні властивості;
- міцність (стійкість) летких водневих сполук.
3. Не змінюються:
- число електронів у зовнішньому електронному шарі атома;
- ступінь окислення елементів у вищих оксидах та гідроксидах (як правило, дорівнює номеру групи).
1. Найменший радіус має атом
- фтору
- берилія
- барію
- кремнію
Найменший радіус атома має елемент, розташований якомога правіше і якомога вище в Періодичній таблиці хімічних елементів. Цій умові відповідає фтор. Відповідь: 1
2. Однакове число електронів на зовнішньому енергетичному рівні мають атоми хлору та атоми
- марганцю
- аргону
- брома
Так як однакове число електронів на зовнішньому енергетичному рівні мають атоми елементів однієї групи, то відправною точкою для вибору правильної відповіді є визначення групи, в якій знаходиться хлор - VIIA. Із запропонованих варіантів цій умові відповідає бром. Відповідь: 4.
3. Однакову електронну конфігурацію мають атом неону та іон
- Mg 2+
- Аl 3+
Ключем до знаходження правильної відповіді є визначення періоду, в якому знаходиться неон - 2-й. Отже, умові завдання відповідатиме катіон магнію. Відповідь: 1.
4. Часткою, що має таку ж будову електронної оболонки, як у атома аргону, є
- Сl +3
- Сl +1
- С1 -l
Для визначення правильної відповіді потрібно порівняти порядкові номери аргону та хлору, як елементів одного й того ж 3-го періоду: № 17 та № 18. Щоб мати таку ж будову електронної оболонки, як у атома аргону, атому хлору необхідно прийняти один електрон. Цій умові відповідає Cl - . Відповідь: 4.
5. Число електронів в іоні А1 3+ дорівнює
Це завдання вирішується просто: іон алюмінію порівняно з його атомом «втратив» три електрони, отже, 13 – 3 = 10. Відповідь: 4.
6. Вищі оксид та відповідний йому гідроксид з найбільш вираженими основними властивостями утворює
- калій
- кальцій
- індій
- алюміній
Найбільш сильні основні властивості виявляють оксиди і гідрооксиди лужних металів, тобто елементів IA групи. Відповідь: 1.
7. У порядку посилення металевих властивостей елементи розташовані у ряді
- Аl, Са, К
- Ва, Са, Mg
- К, Са, Ga
- Na, Mg, Аl
Так як металеві властивості найбільш виражені у лужних металів, то, очевидно, саме лужний метал повинен завершувати трійку елементів, що шукається. Відповідь: 1.
8. Найлегше приєднують електрони атоми
- хлору
- селену
- брома
Приєднання електронів характеризує окисні властивості елементів. Найбільш виражені ці властивості у елементів, що мають більше значення номера групи та менше значення номера періоду. Відповідь: 1.
9. Вищі оксид та відповідний йому гідроксид з найбільш вираженими кислотними властивостями утворює
- фосфор
- кремній
Аналіз положення запропонованих у завданні елементів у Періодичній системі Д. І. Менделєєва дозволяє дійти висновку, що вони перебувають у 3-му періоді. Знання закономірностей зміни кислотно-основних властивостей оксидів і гідроксидів, утворених елементами одного періоду, дасть можливість визначити правильну відповідь. Відповідь: 3.
10. У порядку посилення неметалічних властивостейпростих речовин, що утворюють їх елементи, розташовані в ряду
- З, Si, Ge
- Se, S, Про
- F, О, N
- Se, As, Ge
Це завдання вимагає знання закономірностей зміни металевих та неметалічних властивостей простих речовин, утворених хімічними елементами, у періодах та групах. Аналіз положення запропонованих трійок елементів у Періодичній системі Д. І. Менделєєва дозволяє дійти висновку, що варіанти 1 і 2 містять три елементи, відповідно IV і VI груп. Однак якщо в першій трійці елементи розташовані в порядку зростання зарядів атомних ядер, то в другій, навпаки, в порядку їх зменшення. Відповідь: 2.
Інші варіанти відповідей з метою економії часу можна навіть аналізувати, оскільки правильну відповідь знайдено.
Завдання для самостійної роботи
Атом складається з виключно щільного ядра, оточеного електронною «хмарою». Ядро шкода трохи в порівнянні з зовнішніми розмірами хмари, і складається з протонів та нейтронів. Атом у звичайному стані нейтральний, а електрони несуть негативний заряд. Але атом може перетягнути чужі електрони, або віддати свої. У разі він вже буде негативно зарядженим чи позитивно зарядженим іоном. Як визначити, скільки електронівміститься в атомі ?
Інструкція
1. Раніше кожного, вам на підтримку прийде Таблиця Менделєєва. Зазирнувши в неї, ви побачите, що весь хімічний елемент має не лише своє суворо певне місце, а й особистий порядковий номер. Скажімо, у водню він дорівнює одиниці, у вуглецю – 6, у золота – 79 тощо.
2. Саме порядковий номер характеризує кількість протонів у ядрі, тобто правильний заряд атома ядра. Від того, що атом у звичайному стані нейтральний, позитивний заряд повинен бути врівноважений негативним зарядом. Отже, у водню – один електрон, вуглецю – шість електронів, у золота – сімдесят дев'ять електронів .
3. Ну а як визначити число електронівв атомі, якщо атом, своєю чергою, входить до складу якоїсь більш важкої молекули? Скажімо, яке число електронівв атомах натрію і хлору, якщо вони утворюють молекулу кожним вам якісно знаменитої звичайної кухонної солі?
4. І тут немає нічого складного. Почніть з того, що напишіть формулу цієї речовини, вона матиме подальший вигляд: NaCl. З формули ви побачите, що молекула кухонної солі складається з 2-х елементів, а саме: лужного металунатрію та газу-галогену хлору. Але це вже не нейтральні атоми натрію та хлору, а їх іони. Хлор, утворюючи іонну зв'язок із натрієм, цим «перетягнув» себе один із його електронів, а натрій, відповідно, його віддав.
5. Знову подивіться в Таблицю Менделєєва. Ви побачите, що натрій має порядковий номер 11, хлор – 17. Отже, зараз у іона натрію буде 10 електронів, Іон хлору – 18.
6. Діючи за таким же алгоритмом, легко можна визначити число електроніву будь-якого хімічного елемента, чи то як нейтрального атома чи іона.
Атом хімічного елемента складається з ядерного ядра та електронів. До складу ядерного ядра входять два типи частинок – протони та нейтрони. Приблизно кожна маса атома сфокусована в ядрі, тому що протони та нейтрони набагато важчі за електрони.

Вам знадобиться
- атомний номер елемента, ізотопи
Інструкція
1. На відміну від протонів, нейтрони немає електричного заряду, тобто їх електричний заряд дорівнює нулю. Отже, знаючи ядерний номер елемента, неможливо однозначно сказати, скільки нейтронівміститься у його ядрі. Наприклад в ядрі атома вуглецю постійно міститься 6 протонів, проте протонів в ньому може бути 6 і 7. Різновиди ядер хімічного елемента з різним числом нейтроніву ядрі називаються ізотопами цього елемента. Ізотопи можуть бути як природними, так і неприродно отриманими.
2. Ядерні ядра позначаються буквеним символом хімічного елемента таблиці Менделєєва. Праворуч від символу вгорі та внизу стоять два числа. Верхнє число A – це масове числоатома, A = Z+N, де Z – заряд ядра ( числопротонів), а N - число нейтронів. Нижнє число– це Z – заряд ядра. Такий запис дає інформацію про кількість нейтроніву ядрі. Очевидно, воно дорівнює N = A-Z.
3. У різних ізотопів одного хімічного елемента число A змінюється, що відображено у записі цього ізотопу. Певні ізотопи мають справжні назви. Скажімо, звичайне ядро водню немає нейтронівта має один протон. Ізотоп водню дейтерій має один нейтрон (A = 2), а ізотоп тритій – два нейтрони (A = 3).
4. Пов'язаність числа нейтроніввід числа протонів відбито на N-Z діаграмі ядерних ядер. Стабільність ядер залежить від відношення числа нейтронівта числа протонів. Ядра легких нуклідів особливо стійкі за N/Z = 1, тобто за рівності числа нейтронівта протонів. Зі зростанням масового числа область стабільності зсувається до величин N/Z>1, досягаючи величини N/Z ~ 1,5 для особливо важких ядер.
Відео на тему
Атом складається з ядра і оточуючих його електронів, що обертаються навколо нього ядерними орбіталями і утворюють електронні шари (енергетичні яруси). Число негативно заряджених частинок на зовнішніх та внутрішніх ярусах визначає властивості елементів. Число електронів, що містяться в атомі, можна виявити, знаючи деякі ключові моменти.

Вам знадобиться
- - Папір;
- - Ручка;
- - Періодична система Менделєєва.
Інструкція
1. Щоб визначити число електронів, скористайтесь періодичною системою Д.І. Менделєєва. У цій таблиці елементи розташовані у певній послідовності, яка вузько пов'язана з їхньою ядерною будовою. Знаючи, що позитивний заряд атома незмінно дорівнює порядковому номеру елемента, ви легко виявите кількість негативних частинок. Чай вестимо - атом у сукупності нейтральний, а значить, число електронівдорівнюватиме числу протонів і номеру елемента в таблиці. Скажімо, порядковий номер алюмінію дорівнює 13. Отже, число електроніву нього буде 13, натрій – 11, залізо – 26 тощо.
2. Якщо вам потрібно знайти число електронівна енергетичних ярусах спочатку повторіть правило Пауля і правило Хунда. Потім розподіліть негативні частинки по ярусах і підрівнях за допомогою все тієї ж періодичної системи, а вірніше її періодів та груп. Так номер горизонтального ряду (періоду) вказує на кількість енергетичних шарів, а вертикального (групи) – на число електронівна зовнішньому ярусі.
3. Не забувайте про те, що кількість зовнішніх електронівдорівнює номеру групи тільки в елементів, що знаходяться в основних підгрупах. У елементів побічних підгруп число негативно заряджених частинок на останньому енергетичному ярусі не може бути більшим за дві. Скажімо, у скандія (Sc), що у 4 періоді, в 3 групі, побічної підгрупі, їх 2. У той час як у галію (Ga), той, що знаходиться в тому ж періоді і тій же групі, але в основній підгрупі , зовнішніх електронів 3.
4. При підрахунку електронівв атомі врахуйте, що останні утворюють молекули. У цьому атоми можуть приймати, віддавати негативно заряджені частки чи утворювати загальну пару. Скажімо, у молекулі водню (H2) загальна пара електронів. Інший випадок: у молекулі фториду натрію (NaF) загальна сума електронівдорівнюватиме 20. Але в ході хімічної реакціїатом натрію віддає свій електрон і він залишається 10, а фтор приймає – виходить теж 10.
Корисна порада
Пам'ятайте, що на зовнішньому енергетичному ярусі може бути лише 8 електронів. І це залежить від розташування елемента в таблиці Менделєєва.
Атом – це найдрібніша стабільна (найчастіше) частка речовини. Молекулою називають кілька атомів, пов'язаних між собою. Саме молекули зберігають у собі інформацію про всі властивості певної речовини.

Атоми утворюють молекулу за допомогою різних типівзв'язку. Вони відрізняються між собою спрямованістю та енергією, за допомогою яких можна цей зв'язок утворити.
Квантовомеханічна модель ковалентного зв'язку
Ковалентна зв'язок утворюється з допомогою валентних електронів. При зближенні 2 атомів відстежується перекриття електронних хмар. У цьому електрони будь-якого атома починають рухатися області, що належить іншому атому. У просторі, що оточує їх, виникає зайвий негативний потенціал, який стягує позитивно заряджені ядра. Це припустимо лише за умови, що спини загальних електронів антипаралельні (спрямовані у різні боки).Ковалентная зв'язок характеризується досить великим значенням енергії зв'язку весь атом (близько 5 эВ). Це означає, що необхідно 10 еВ, щоб молекула з двох атомів, утворена ковалентним зв'язком, розпалася. Атоми можуть наблизитись один до одного на суворо певний стан. За такого зближення відстежується перекриття електронних хмар. Теза Паулі говорить, що навколо одного і того ж атома не може обертатися два електрони в ідентичному стані. Чим більше відстежується перекриття, тим більше відштовхуються атоми.
Водневий зв'язок
Це окремий випадок ковалентного зв'язку. Її утворюють два атоми водню. Саме на прикладі цього хімічного елемента у двадцятих роках минулого століття було показано механізм утворення ковалентного зв'язку. Атом водню дуже примітивний у своїй будові, що дозволило вченим щодо правильно вирішити рівняння Шредінгера.
Іонний зв'язок
Кристал кожному вестимой кухонної солі утворюється з допомогою іонного зв'язку. Вона виникає, коли атоми, що утворюють молекулу, мають велику відмінність в електронегативності. Менш електронегативний атом (у разі кристала кухонної солі це натрій) віддає всі свої валентні електрони хлору, перетворюючись на правильно заряджений іон. Хлор, своєю чергою, стає негативно зарядженим іоном. Ці іони пов'язані у структурі електростатичною взаємодією, що характеризується досить великою силою. Ось чому іонна зв'язок має максимальною міцністю (10 еВ на атом, що вдвічі більше, ніж енергія ковалентного зв'язку). В іонних кристалах дуже рідко відстежуються недоліки різного роду. Електростатична взаємодія міцно утримує позитивні та негативні іони у певних місцях, не даючи виникнути вакансії, міжвузеллю та іншим недолікам кристалічної решітки.
Відео на тему
Корисна порада
Протони - це схвально заряджені частинки, нейтрони ж не несуть якогось заряду.
Від Гість >>
А1. Число електронів у зовнішньому електронному шарі атома із зарядом ядра +9 дорівнює 1)1 2) 5 3)3 4) 7 А2. Металеві властивості у магнію виражені сильніше, ніж у 1) берилію 2) калію 3) кальцію 4) натрію A3. Речовиною з іонним зв'язком є 1) оксид cepи(VI) 2) водень 3) магній 4) фторид натрію., А4. Ступені окислення заліза в сполуках Fe2O3 і FeCl2 відповідно дорівнюють 1) +3 і -2 2) +3 і +3 3) +3 і +2 4) -3 і +2 А5. Кислотним оксидом є 1) SO2 2) 3) ZnO 4) Na2O А6. До фізичним явищамвідносять 1) скисання молока 2) зацукровування варення 3) горіння свічки 4) пригоряння пиши А7. Яке рівняння відповідає реакції сполуки? 1) NH3 + HNO3 = NH4NO3 2) H2S + MgO = MgS + H2O 3) SO3 + 2NaOH = Na2SO4 + H2O 4) CuO + H2 = Cu + H2O A8. До добре розчинних у воді електролітів відноситься 1) сульфат барію 2) сульфат цинку 3) сульфід міді(II) 4) оксид заліза(III) А9. Найбільша кількістьіонів амонію утворюється при повній дисоціації 1 моль 1) сульфату амонію 2) сульфіду амонію 3) нітрату амонію 4) фосфату амонію А10. Виділення газу відбувається в результаті взаємодії іонів 1) Н+ і С1- 2) Н+ і SO32- 3) NH4+ і РО43- 4) NH4+ і S2-
Довгий час для дослідників залишалися секретом багато властивостей матерії. Чому одні речовини добре проводять електрику, а інші – ні? Чому залізо поступово руйнується під впливом атмосфери, а благородні метали добре зберігаються протягом тисяч років? Багато з цих питань знайшли відповідь після того, як людині став відомий пристрій атома: його будова, кількість електронів на кожному електронному шарі. Понад те, освоєння навіть самих основ будови атомних ядер відкрило світу нову епоху.
З яких елементів побудована елементарна цегла речовини, як вони взаємодіють між собою, чим з цього ми навчися користуватися?
у виставі сучасної науки
В даний час більшість вчених схильні дотримуватися планетарної моделі будови матерії. Відповідно до цієї моделі в центрі кожного атома знаходиться ядро, крихітне навіть у порівнянні з атомом (він у десятки тисяч разів дрібніший за цілий атом). Зате про масу такого ядра не скажеш. Практично вся маса атома зосереджена саме у ядрі. Ядро заряджено позитивно.
Навколо ядра обертаються електрони по різних орбітах, не кругових, як у випадку з планетами Сонячна система, а об'ємним (сфери та об'ємні вісімки). Число електронів в атомі чисельно дорівнює заряду ядра. Але розглядати електрон як частинку, яка рухається якоюсь траєкторією, дуже складно.

Його орбіта крихітна, а швидкість майже як у світлового променятому правильніше розглядати електрон разом з його орбітою як якусь негативно заряджену сферу.
Члени атомної сім'ї
Усі атоми складаються з трьох складових елементів: протонів, електронів і нейтронів.
Протон – головний будівельний матеріал ядра. Його вага дорівнює атомній одиниці (маса атома водню) або 1,67 ∙ 10 -27 кг у системі СІ. Заряджена частка позитивно, причому її заряд прийнятий за одиницю в системі елементарних електричних зарядів.
Нейтрон - близнюк протона по масі, але не заряджений.
Дві перераховані вище частинки називають нуклідами.
Електрон - протилежність протону за зарядом ( елементарний заряддорівнює -1). Але ось за вагою електрон підкачав, маса його всього-то 9,12 ∙ 10 -31 кг, що майже в 2 тисячі разів легше за протон або нейтрон.
Як це «розглянули»
Як можна було розглянути будову атома, якщо навіть найсучасніші технічні засоби не дозволяють і в найближчій перспективі не дозволять отримати зображення частинок, що його складають. Як же вчені дізналися протонів, нейтронів і електронів в ядрі та їх розташування?
Припущення планетарному пристрої атомів було зроблено з урахуванням результатів бомбардування тонкої металевої фольги різними частинками. На малюнку добре видно, як взаємодіють із речовиною різні елементарні частки.

Число електронів, що пройшли крізь метал, у дослідах дорівнювало нулю. Це пояснюється просто: негативно заряджені електрони відштовхуються від електронних оболонокметалу, що також мають негативний заряд.
Пучок протонів (заряд +) проходив через фольгу, але із «втратами». Частина відштовхувалася від ядер, що попалися на шляху (ймовірність таких попадань дуже незначна), частина відхилялася від початкової траєкторії, пролетівши надто близько до одного з ядер.
Найрезультативнішими в частині подолання металу стали нейтрони. Нейтрально заряджена частка втрачалася тільки у разі прямого зіткнення з ядром речовини, 99,99% нейтронів благополучно проходили крізь товщу металу. До речі, розмір ядер тих чи інших хімічних елементів вдалося розрахувати саме виходячи із кількості нейтронів на вході та не виході.
На основі отриманих даних і було побудовано домінуючу нині теорію будови речовини, яка успішно пояснює більшість питань.
Чого та скільки
Число електронів у атомі залежить від порядкового номера. Так, в атомі звичайного водню є лише один протон. Навколо по орбіті паморочиться єдиний електрон. Наступний елемент періодичної таблиці - гелій влаштований трохи складніше. Його ядро складається з двох протонів і двох нейтронів і, таким чином, має атомну масу 4.
Зі зростанням порядкового номера зростають розміри та маса атома. Порядковий номер хімічного елемента таблиці Менделєєва відповідає заряду ядра (кількості у ньому протонів). Число електронів в атомі дорівнює числу протонів. Так, атом свинцю (порядковий номер 82) має у своєму ядрі 82 протони. На орбітах навколо ядра знаходяться 82 електрони. Щоб розрахувати кількість нейтронів в ядрі, достатньо від атомної маси відібрати кількість протонів:
Чому їх завжди порівну
Будь-яка система в нашому Всесвіті прагне стабільності. Стосовно атома це виявляється у його нейтральності. Якщо на секунду уявити, що всі без винятку атоми у Всесвіті мають той чи інший заряд різної величини з різними знаками, можна собі уявити, який би у світі настав хаос.

Але оскільки число протонів і електронів в атомі дорівнює, підсумковий заряд кожної цеглини дорівнює нулю.
Число ж нейтронів в атомі – величина самостійна. Більше того, атоми одного й того ж хімічного елемента можуть мати різне число цих частинок із нульовим зарядом. Приклад:
- 1 протон + 1 електрон + 0 нейтронів = водень ( атомна маса 1);
- 1 протон + 1 електрон + 1 нейтрон = дейтерій (атомна маса 2);
- 1 протон + 1 електрон + 2 нейтрони = тритій (атомна маса 3).
У разі число електронів в атомі не змінюється, атом залишається нейтральним, змінюється його маса. Такі варіації хімічних елементів називають ізотопами.
Чи завжди атом нейтральний
Ні, не завжди число електронів в атомі дорівнює числу протонів. Якби в атома на якийсь час не можна було «відібрати» електрон чи два, не існувало б такого поняття, як гальваніка. На атом, як і будь-яку матерію, можна впливати.
Під впливом досить сильного електричного поляіз зовнішнього шару атома один або кілька електронів можуть "полетіти". У цьому випадку частка речовини перестає бути нейтральною і називається іоном. Вона може пересуватися в середовищі газу або рідини, переносячи електричний заряд від одного електрода до іншого. Таким чином, запасають електричний заряд в акумуляторних батареях, а також наносять найтонші плівки з одних металів на поверхні інших (золочення, сріблення, хромування, нікелювання тощо).

Нестабільна кількість електронів і в металах - провідниках електричного струму. Електрони зовнішніх шарів гуляють з атома на атом, переносячи по провіднику електричну енергію.