Якщо з усього ряду стандартних електродних потенціалів виділити ті електродні процеси, які відповідають загальному рівнянню.
то отримаємо низку напруг металів. У цей ряд завжди перешкодять, крім металів, водень, що дозволяє бачити, які метали здатні витісняти водень з водних розчинів кислот.
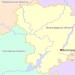
Таблиця 19. Ряд напруг металів

Ряд напруг для найважливіших металів наведено у табл. 19. Положення того чи іншого металу у ряді напруг характеризує його здатність до окислювально-відновних взаємодій у водних розчинах за стандартних умов. Іони металів є окислювачами, а метали як простих речовин - відновниками. При цьому чим далі розташований метал у ряді напруг, тим сильнішим окислювачем у водному розчині є його іони, і навпаки, чим ближче метал до початку ряду, тим сильніші відновлювальні властивості виявляє просту речовину - метал.
Потенціал електродного процесу
![]()
у нейтральному середовищі дорівнює В (див. стор. 273). Активні метали початку ряду, що мають потенціал, значно негативніший, ніж -0,41 В, витісняють водень з води. Магній витісняє водень лише з гарячої води. Метали, розташовані між магнієм та кадмієм, зазвичай не витісняють водень із води. На поверхні цих металів утворюються оксидні плівки, що мають захисну дію.
Метали, розташовані між магнієм та воднем, витісняють водень із розчинів кислот. При цьому на поверхні деяких металів утворюються також захисні плівки, що гальмують реакцію. Так, оксидна плівка на алюмінії робить цей метал стійким у воді, а й у розчинах деяких кислот. Свинець не розчиняється в сірчаній кислоті при її концентрації нижче, так як сіль, що утворюється при взаємодії свинцю з сірчаною кислотою, нерозчинна і створює на поверхні металу захисну плівку. Явище глибокого гальмування окислення металу, обумовлене наявністю на його поверхні захисних оксидних або сольових плівок, називається пасивністю, а стан металу при цьому пасивним станом.
Метали здатні витісняти один одного із розчинів солей. Напрямок реакції визначається у своїй їх взаємним становищем у низці напруг. Розглядаючи конкретні випадки таких реакцій, слід пам'ятати, що активні метали витісняють водень не лише з води, а й будь-якого водного розчину. Тому взаємне витіснення металів із розчинів їх солей практично відбувається лише у разі металів, розташованих у ряду після магнію.
Витиснення металів з їх сполук іншими металами вперше докладно вивчав Бекетов. В результаті своїх робіт він розташував метали за їхньою хімічною активністю у витіснювальний ряд», що є прототипом ряду напруг металів.
Взаємне становище деяких металів у низці напруг і періодичної системі здавалося б відповідає друг, другу. Наприклад, відповідно до положення в періодичній системі хімічна активність калію повинна бути більшою, ніж натрію, а натрію - більше, ніж літію. У ряді напруг найбільш активним виявляється літій, а калій займає середнє положення між літієм і натрієм. Цинк і мідь за їх положенням у періодичній системі повинні мати приблизно рівну хімічну активність, але в ряді напруг цинк розташований значно раніше за мідь. Причина таких невідповідностей полягає в наступному.
При порівнянні металів, що займають те чи інше положення в періодичній системі, за міру їхньої хімічної активності - відновлювальної здатності - приймається величина енергії іонізації вільних атомів. Дійсно, при переході, наприклад, зверху вниз головною підгрупою I групи періодичної системи енергія іонізації атомів зменшується, що пов'язано зі збільшенням їх радіусів (тобто з великим видаленням зовнішніх електронів від ядра) і зі зростаючим екрануванням позитивного заряду ядра проміжними електронними шарами (Див. § 31). Тому атоми калію виявляють більшу хімічну активність - мають сильніші відновлювальні властивості, - ніж атоми натрію, а атоми натрію - більшу активність, ніж атоми літію.
При порівнянні металів у ряді напруг за міру хімічної активності приймається робота перетворення металу, що знаходиться в твердому стані, гідратовані іони у водному розчині. Цю роботу можна представити як суму трьох доданків: енергії атомізації - перетворення кристала металу в ізольовані атоми, енергії іонізації вільних атомів металу та енергії гідратації іонів, що утворюються. Енергія атомізації характеризує міцність кристалічної ґрати даного металу. Енергія іонізації атомів – відриву від них валентних електронів – безпосередньо визначається положенням металу в періодичній системі. Енергія, що виділяється при гідратації, залежить від електронної структури іона, його заряду та радіусу.
Іони літію і калію, що мають однаковий заряд, але різні радіуси, будуть створювати біля себе різні електричні поля. Поле, що виникає поблизу маленьких іонів літію, буде сильнішим, ніж поле у великих іонах калію. Звідси ясно, що іони літію гідратуватимуться з виділенням більшої енергії, ніж нони калію.
Таким чином, у ході аналізованого перетворення витрачається енергія на атомізацію та іонізацію та виділяється енергія при гідратації. Чим менше буде сумарна витрата енергії, тим легше буде здійснюватися весь процес і тим ближче до початку ряду напруг розташовуватиметься даний метал. Але з трьох доданків загального балансу енергії лише одне - енергія іонізації-безпосередньо визначається положенням металу в періодичній системі. Отже, немає підстав очікувати, що взаємне становище тих чи інших металів у ряді напруг завжди відповідатиме їх положенню в періодичній системі. Так, для літію сумарна витрата енергії виявляється меншою, ніж для калію, відповідно до чим літій стоїть у ряді напруг раніше калію.
Для міді та цинку витрати енергії на іонізацію вільних атомів та виграш її при гідратації іонів близькі. Але металева мідь утворює міцнішу кристалічну решітку, ніж цинк, що видно зі зіставлення температур плавлення цих металів: цинк плавиться при , а мідь тільки при . Тому енергія, що витрачається на атомізацію цих металів, суттєво різна, внаслідок чого сумарні енергетичні витрати на весь процес у разі міді набагато більші, ніж у випадку цинку, що і пояснює взаємне становище цих металів у ряді напруг.
При переході від води до неводних розчинників взаємне становище металів у ряді напруг може змінюватися. Причина цього в тому, що енергія сольватації іонів різних металів по-різному змінюється під час переходу від одного розчинника до іншого.
Зокрема, іон міді енергійно сольватується в деяких органічних розчинниках; це призводить до того, що в таких розчинниках мідь розташовується в ряду напруги до водню і витісняє його з розчинів кислот.
Таким чином, на відміну від періодичної системи елементів, низка напруг металів не є відображенням загальної Закономірності, на основі якої можна давати різнобічну характеристику хімічних властивостей металів. Ряд напруг Характеризує лише окислювально-відновну здатність Електрохімічної системи «метал - іон металу» в строго певних умовах: наведені в ньому величини відносяться до водного розчину, температури та одиничної концентрації (активності) іонів металу.

Гроссе Е., Вайсмантель X.
Хімія для допитливих. Основи хімії та цікаві досліди.
Глава 3 (продовження)НЕВЕЛИКИЙ КУРС ЕЛЕКТРОХІМІЇ МЕТАЛІВ
Ми вже познайомилися з електролізом розчинів хлоридів лужних металів та отриманням металів за допомогою розплавів. Зараз спробуємо на кількох нескладних дослідах вивчити деякі закономірності електрохімії водних розчинів, гальванічних елементів, а також познайомитись із отриманням захисних гальванічних покриттів.Електрохімічні методи застосовуються у сучасній аналітичній хімії, служать визначення найважливіших величин теоретичної хімії.
Нарешті, корозія металевих предметів, яка завдає великої шкоди народному господарству, здебільшого є електрохімічним процесом.
РЯД НАПРУГИ МЕТАЛІВ
Основною ланкою для розуміння електрохімічних процесів є низка напруги металів. Метали можна розташувати в ряд, який починається з хімічно активних і закінчується найменш активними шляхетними металами:Li, Rb, K, Sr, Са, Mg, Al, Be, Mn, Zn, Cr, Ga, Fe, Cd, Tl, Co, Ni, Sn, Pb, H, Sb, Bi, As, Cu, Hg, Ag, Pd, Pt, Au.
Так виглядає, за найновішими уявленнями, ряд напруг для найважливіших металів та водню. Якщо з двох будь-яких металів ряду виготовити електроди гальванічного елемента, то на попередньому матеріалі з'явиться негативна напруга.
Величина напруги ( електрохімічний потенціал) залежить від положення елемента у ряді напрузі та від властивостей електроліту.
Сутність ряду напруги встановимо з кількох простих дослідів, для яких нам знадобляться джерело струму та електричні вимірювальні прилади. Розчинний близько 10 г кристалічного сульфату міді в 100 мл води і зануримо в розчин сталеву голку або шматочок залізної жерсті. (Рекомендуємо попередньо до блиску зачистити залізо тонкою наждачною шкіркою.) Через короткий час залізо покриється червонуватим шаром міді, що виділилася. Більш активне залізо витісняє мідь із розчину, причому залізо розчиняється як іонів, а мідь виділяється як металу. Процес триває до того часу, поки розчин перебуває у контакті із залізом. Як тільки мідь покриє всю поверхню заліза, він практично припиниться. У цьому випадку утворюється пористий шар міді, так що захисні покриття без застосування струму отримувати не можна.
У наступних дослідах опустимо в розчин сульфату міді невеликі смужки цинкової та свинцевої жерсті. Через 15 хвилин витягнемо їх, промиємо і досліджуємо під мікроскопом. Ми помітимо красиві, схожі на крижані, візерунки, які у відбитому світлі мають червоне забарвлення і складаються з міді, що виділилася. Тут також активніші метали перевели мідь з іонного в металевий стан.
У свою чергу, мідь може витісняти метали, що стоять нижче у ряді напруг, тобто менш активні. На тонку смужку листової міді або на розплющену мідну дріт (попередньо зачистивши поверхню до блиску) нанесемо кілька крапель розчину нітрату срібла. Неозброєним поглядом можна буде помітити чорнуватий наліт, що утворився, який під мікроскопом у відбитому світлі має вигляд тонких голок і рослинних візерунків (так званих дендритів).
Щоб виділити цинк без струму, необхідно застосувати активніший метал. Виключаючи метали, які бурхливо взаємодіють з водою, знаходимо у ряді напруг вище цинку магній. Декілька крапель розчину цинку сульфату помістимо на шматок магнієвої стрічки або на тонку стружку електрона. Розчин сульфату цинку отримаємо, розчинивши шматочок цинку в розведеній сірчаній кислоті. Одночасно із сульфатом цинку додамо кілька крапель денатурату. На магнії через короткий проміжок часу помітимо, особливо під мікроскопом, що виділився як тонких кристаликів цинк.
Загалом будь-який член ряду напруги може бути витіснений з розчину, де він знаходиться у вигляді іона, і переведений у металевий стан. Однак при випробуванні всіляких комбінацій нас може спіткати розчарування. Здавалося б, якщо смужку алюмінію занурити у розчини солей міді, заліза, свинцю та цинку, на ній мають виділятися ці метали. Але цього, проте, немає. Причина невдачі криється над помилці у ряді напруг, а полягає в особливому гальмуванні реакції, що у разі обумовлено тонкої оксидної плівкою лежить на поверхні алюмінію. У таких розчинах алюміній називають пасивним.
ПОГЛЯНЕМО ЗА КУЛИСИ
Щоб сформулювати закономірності процесів, що протікають, ми можемо обмежитися розглядом катіонів, а аніони виключити, оскільки вони самі в реакції не беруть участь. (Щоправда, на швидкість осадження впливає вигляд аніонів.) Якщо для простоти припустити, що і розчинений метали, що виділяється і дають двозарядні катіони, то можна записати:Me 1 + Me 2 2+ = Ме 1 2+ + Ме 2
Причому першого досвіду Ме 1 = Fe, Me 2 = Сu.
Отже, процес полягає в обміні зарядами (електронами) між атомами та іонами обох металів. Якщо окремо розглядати (як проміжні реакції) розчинення заліза або осадження міді, то отримаємо:
Fe = Fe 2+ + 2 е --
Сu 2+ + 2 е-- = Сu
Тепер розглянемо випадок, коли метал занурений у воду або розчин солі, з катіоном якої обмін неможливий через його положення в ряду напруг. Незважаючи на це метал прагне перейти в розчин у вигляді іона. При цьому атом металу віддає два електрони (якщо метал двовалентний), поверхня зануреного в розчин металу заряджається по відношенню до розчину негативно, а на межі розділу утворюється подвійний електричний шар. Ця різниця потенціалів перешкоджає подальшому розчиненню металу, тому процес незабаром припиняється.
Якщо в розчин завантажити два різних метали, то вони обидва зарядяться, але менш активний - дещо слабший, тому що його атоми менш схильні до відщеплення електронів.
З'єднаємо обидва метали провідником. Внаслідок різниці потенціалів потік електронів потече від активнішого металу до менш активного, який утворює позитивний полюс елемента. Протікає процес, у якому активніший метал перетворюється на розчин, а катіони з розчину виділяються більш благородному металі. Проілюструємо тепер кількома дослідами наведені вище кілька абстрактні міркування (які до того ж є грубим спрощенням).
Спочатку наповнимо хімічну склянку місткістю 250 мл до середини 10%-ним розчином сірчаної кислоти і зануримо в неї не дуже маленькі шматки цинку та міді. До обох електродів припаяємо або приклепуємо мідний дріт, кінці якого не повинні торкатися розчину.
Поки кінці дроту не з'єднані один з одним, ми спостерігатимемо розчинення цинку, яке супроводжується виділенням водню. Цинк, як випливає з ряду напруги, активніший за водень, тому метал може витісняти водень з іонного стану. На обох металах утворюється подвійний електричний шар. Різницю потенціалів між електродами найпростіше виявити за допомогою вольтметра. Безпосередньо після включення приладу в ланцюг стрілка вкаже приблизно 1, але потім напруга швидко впаде. Якщо під'єднати до елемента маленьку лампочку, що споживає напругу 1, то вона загориться - спочатку досить сильно, а потім напруження стане слабким.
По полярності клем приладу можна дійти невтішного висновку, що мідний електрод є позитивним полюсом. Це можна довести і без пристрою, розглянувши електрохімію процесу. Приготуємо в маленькій хімічній склянці або в пробірці насичений розчин кухонної солі, додамо приблизно 0,5 мл спиртового розчину індикатора фенолфталеїну і завантажимо обидва замкнутих дротом електрода в розчин. У негативного полюса буде спостерігатися слабке червоне фарбування, яке викликане утворенням на катоді гідроксиду натрію.
В інших дослідах можна поміщати в комірку різні пари металів і визначати напругу, що виникає. Наприклад, магній і срібло дадуть особливо велику різницю потенціалів завдяки значній відстані між ними ряду напруги, а цинк і залізо, навпаки, дуже маленьку, менш ніж десяту частку вольту. Застосовуючи алюміній, ми не отримаємо через пасивацію ніякого струму.
Всі ці елементи, або, як кажуть електрохіміки, ланцюги, мають той недолік, що при зйомці струму на них дуже швидко знижується напруга. Тому електрохіміки завжди вимірюють справжню величину напруги в знеструмленому стані за допомогою методу компенсації напруги, тобто порівнюючи його з напругою іншого джерела струму.
Розглянемо процеси у мідно-цинковому елементі дещо докладніше. На катоді цинк перетворюється на розчин за наступним рівнянням:
Zn = Zn 2+ + 2 е --
На мідному аноді розряджаються іони водню сірчаної кислоти. Вони приєднують електрони, що надходять дротом від цинкового катода і в результаті утворюються бульбашки водню:
2Н + + 2 е-- = Н 2
Через короткий проміжок часу мідь покриється найтоншим шаром пухирців водню. При цьому мідний електрод перетвориться на водневий, а різниця потенціалів зменшиться. Цей процес називають поляризацією електрода. Поляризацію мідного електрода можна усунути, додавши в комірку після падіння напруги трохи розчину калію дихромату. Після цього напруга знову збільшиться, оскільки дихромат калію окислить водень до води. Біхромат калію діє у разі як деполяризатор.
На практиці застосовують гальванічні ланцюги, електроди яких не поляризуються, або ланцюги, поляризацію яких можна усунути, додавши деполяризатори.
Як приклад неполяризуемого елемента розглянемо елемент Даніеля, який часто використовували як джерело струму. Це теж мідно-цинковий елемент, але обидва метали занурені в різні розчини. Цинковий електрод міститься в пористому глиняному осередку, наповненому розведеною (приблизно 20%-ною) сірчаною кислотою. Глиняну комірку підвішують у великій склянці, де знаходиться концентрований розчин сульфату міді, але в дні - шар кристалів сульфату міді. Другим електродом у цій посудині служить циліндр із мідного листа.
Цей елемент можна виготовити зі скляної банки, що є у продажу глиняного осередку (у крайньому випадку використовуємо горщик для квітів, закривши отвір у дні) і двох відповідних за розміром електродів.
У процесі роботи елемента цинк розчиняється з утворенням сульфату цинку, але в мідному електроді виділяються іони міді. Але при цьому мідний електрод не поляризується і елемент дає напругу близько 1 В. Власне, теоретично напруга на клемах становить 1,10, але при зніманні струму ми вимірюваємо трохи меншу величину, внаслідок електричного опору осередку.
Якщо ми не знімемо струм з елемента, потрібно витягнути цинковий електрод із розчину сірчаної кислоти, бо інакше він розчинятиметься з утворенням водню.
Схема простий осередку, на яку не потрібно пористої перегородки, показано малюнку. Цинковий електрод розташований у скляній банці нагорі, а мідний - поблизу дна. Весь осередок наповнений насиченим розчином кухонної солі. На дно банки насипаємо жменю кристалів сульфату міді. Концентрований розчин сульфату міді, що утворюється, змішуватиметься з розчином кухонної солі дуже повільно. Тому при роботі елемента на мідному електроді виділятиметься мідь, а у верхній частині осередку розчинятиметься цинк у вигляді сульфату або хлориду.
Зараз для батарей використовують майже виключно сухі елементи, які зручніші у використанні. Їхнім родоначальником є елемент Лекланше. Електродами є цинковий циліндр і вугільний стрижень. Електроліт є пастою, яка в основному складається з хлориду амонію. Цинк розчиняється у пасті, але в куті виділяється водень. Щоб уникнути поляризації, вугільний стрижень опускають у полотняний мішечок із сумішшю з вугільного порошку та піролюзиту. Вугільний порошок підвищує поверхню електрода, а піролюзит діє як деполяризатор, повільно окислюючи водень.
Щоправда, деполяризуюча здатність піролюзиту слабша, ніж у згадуваного раніше дихромату калію. Тому при отриманні струму в сухих елементах напруга швидко знижується, вони " стомлюються"внаслідок поляризації. Тільки через деякий час відбувається окислення водню піролюзитом. Таким чином, елементи" відпочиваютьЯкщо деякий час не пропускати струм. Перевіримо це на батарейці для кишенькового ліхтарика, до якої приєднаємо лампочку. Паралельно лампі, тобто безпосередньо на клеми, підключимо вольтметр.
Спочатку напруга складе близько 4,5 В. (Найчастіше в таких батарейках послідовно включені три осередки, кожна з теоретичною напругою 1,48 В.) Через деякий час напруга впаде, напруження лампочки послабшає. За показаннями вольтметра ми зможемо судити, як довго батарейці потрібно відпочивати.
Особливе місце займають регенеруючі елементи, відомі під назвою акумулятори. Вони протікають оборотні реакції, і можна перезаряджати після розрядки елемента, підключивши до зовнішнього джерела постійного струму.
В даний час найбільш поширені свинцеві акумулятори; у них електролітом служить розведена сірчана кислота, куди занурені дві свинцеві пластини. Позитивний електрод покритий діоксидом свинцю PbO 2 негативний являє собою металевий свинець. Напруга на клемах становить приблизно 2,1 В. При розрядці на обох пластинах утворюється сульфат свинцю, який знову перетворюється при зарядці в металевий свинець і пероксид свинцю.
НАНЕСЕННЯ ГАЛЬВАНІЧНИХ ПОКРИТТІВ
Осадження металів з водних розчинів з допомогою електричного струму є процесом, зворотним електролітичному розчиненню, з яким ми познайомилися під час розгляду гальванічних елементів. Насамперед досліджуємо осадження міді, яке використовують у мідному кулонометрі для вимірювання кількості електрики.Метал осідає струмом
Відігнувши кінці двох пластин із тонкої листової міді, підвісимо їх на протилежних стінках хімічної склянки або, краще, маленького скляного акваріума. Клемами прикріпимо до пластин дроту.
Електролітприготуємо за наступним рецептом: 125 г кристалічного сульфату міді, 50 г концентрованої сірчаної кислоти та 50 г спирту (денатурату), решта - вода до 1 літра. Для цього спочатку розчинний сульфат міді в 500 мл води, потім обережно, маленькими порціями додамо сірчану кислоту ( Нагрівання! Рідина може розбризкуватися!), після цього увіллємо спирт і доведемо водою до об'єму 1 л.
Готовим розчином наповнимо кулонометр і включимо в ланцюг змінний опір, амперметр і свинцевий акумулятор. За допомогою опору відрегулюємо струм таким чином, щоб його густина склала 0,02-0,01 А/см 2 поверхні електродів. Якщо мідна пластина має площу 50 см 2 то сила струму повинна знаходитися в межах 0,5-1 А.
Через деякий час на катоді (негативний електрод) почне виділятися світло-червона металева мідь, а на аноді (позитивний електрод) мідь переходитиме в розчин. Щоб очистити мідні пластини, пропускатимемо струм у кулонометрі близько півгодини. Потім витягнемо катод, обережно висушимо його за допомогою фільтрувального паперу і точно зважимо. Встановимо в комірці електрод, замкнемо ланцюг за допомогою реостата і підтримуватимемо постійну силу струму, наприклад 1 А. Через годину розімкнемо ланцюг і знову зважимо висушений катод. При струмі 1 А за годину його маса збільшиться на 1,18 г.
Отже, кількість електрики, що дорівнює 1 ампер-годині, при проходженні через розчин може виділити 1,18 г міді. Або загалом: кількість речовини, що виділилася, прямо пропорційно кількості що пройшла через розчин електрики.
Щоб виділити 1 еквівалент іона, необхідно пропустити через розчин кількість електрики, що дорівнює добутку заряду електрода е на число Авогадро N A:
е*N A = 1,6021 * 10 -19 * 6,0225 * 10 23 = 9,65 * 10 4 А * з * моль -1 Ця величина позначається символом Fі називається на честь першовідкривача кількісних законів електролізу числом Фарадея(точне значення F- 96498 А * з * моль -1). Отже, виділення з розчину цього числа еквівалентів nе. через розчин слід пропустити кількість електрики, що дорівнює F*nе А * з * моль -1 . Інакше кажучи,
I*t =F*nе Тут I- струм, t- Час проходження струму через розчин. В розділі " Основи титруваннявже було показано, що кількість еквівалентів речовини nе. дорівнює добутку числа молей на еквівалентне число:
nе = n*ZОтже:
I*t = F*n*Z
В даному випадку Z- Заряд іонів (для Ag + Z= 1 для Cu 2+ Z= 2, для Al 3+ Z= 3 і т. д.). Якщо висловити число молей у вигляді відношення маси до мольної маси ( n = m/М), то ми отримаємо формулу, яка дозволяє розрахувати всі процеси, що відбуваються при електролізі:
I*t =F*m*Z/M
За цією формулою можна обчислити струм:
I = F*m*Z/(t*M)= 9,65 * 10 4 * 1,18 * 2 / (3600 * 63,54) А * с * г * моль / (с * моль * г) = 0,996 А
Якщо ввести співвідношення для електричної роботи Wел
Wел = U*I*tі Wел / U = I*t
Те, знаючи напругу U, Можна обчислити:
Wел = F*m*Z*U/M
Можна також розрахувати скільки часу необхідно для електролітичного виділення певної кількості речовини або скільки речовини виділиться за певний час. Під час досвіду щільність струму слід підтримувати в заданих межах. Якщо вона буде менше 0,01 А/см 2 то виділиться занадто мало металу, так як будуть частково утворюватися іони міді(I). При занадто високій щільності струму зчеплення покриття з електродом буде слабким і при вилучення електрода з розчину воно може обсипатися.
На практиці гальванічні покриття на металах застосовують насамперед для захисту від корозії та для отримання дзеркального блиску.
Крім того, метали, особливо мідь і свинець, очищають за допомогою анодного розчинення та подальшого виділення на катоді (електролітичне рафінування).
Щоб покрити залізо міддю або нікелем, необхідно ретельно очистити поверхню предмета. Для цього відполіруємо її відмученою крейдою та послідовно знежиримо розведеним розчином їдкого натру, водою та спиртом. Якщо предмет покритий іржею, треба протруїти його заздалегідь у 10-15% розчині сірчаної кислоти.
Очищений виріб підвісимо в електролітичній ванні (маленький акваріум або хімічна склянка), де він служитиме як катод.
Розчин для нанесення мідного покриття містить в 1 л води 250 г сульфату міді та 80-100 г концентрованої сірчаної кислоти (Обережно!). В даному випадку анодом буде мідна пластинка. Поверхня анода приблизно повинна дорівнювати поверхні покривається предмета. Тому треба завжди стежити, щоб мідний анод висів у ванній на такій же глибині, як і катод.
Процес проводитимемо при напрузі 3-4 В (дві акумуляторні батареї) та щільності струму 0,02-0,4 А/см 2 . Температура розчину у ванні має становити 18-25 °С.
Звернемо увагу на те, щоб площина анода і поверхня, що покривається, були паралельні один одному. Предмети складної форми краще не використовувати. Варіюючи тривалість електролізу, можна отримувати мідне покриття різної товщини.
Часто вдаються до попереднього міднення для того, щоб цей шар нанести міцне покриття з іншого металу. Особливо часто це застосовується при хромуванні заліза, нікелюванні цинкового лиття та інших випадках. Щоправда, для цієї мети використовують дуже отруйні ціанідні електроліти.
Для приготування електроліту для нікелювання 450 мл води розчинний 25 г кристалічного сульфату нікелю, 10 г борної кислоти або 10 г цитрату натрію. Цитрат натрію можна приготувати самим, нейтралізувавши розчин 10 г лимонної кислоти розведеним розчином їдкого натру або розчином соди. Анодом нехай буде пластина нікелю можливо більшої площі, а як джерело напруги візьмемо акумулятор.
Величину щільності струму за допомогою змінного опору підтримуватимемо рівною 0,005 А/см 2 . Наприклад, при поверхні предмета 20 см 2 треба працювати за силою струму 0,1 А. Після півгодини роботи предмет буде вже віднікельований. Витягнемо його з ванни і протріть тканиною. Втім, процес нікелювання краще не переривати, тому що тоді шар нікелю може запассівуватися і наступне покриття погано буде триматися.
Щоб досягти дзеркального блиску без механічного полірування, введемо в гальванічну ванну так звану блискучую добавку. Такими добавками є, наприклад, клей, желатину, цукор. Можна ввести в нікелеву ванну, наприклад, кілька грамів цукру та вивчити його дію.
Щоб приготувати електроліт для хромування заліза (після попереднього міднення), в 100 мл води розчинний 40 г ангідриду хромової кислоти СrО 3 (Обережно! Отрута!) і точно 0,5 г сірчаної кислоти (ні в якому разі не більше!). Процес протікає при щільності струму близько 0,1 А/см 2 а в якості анода використовується свинцева пластина, площа якої повинна бути трохи менше площі хромованої поверхні.
Нікелеві та хромові ванни найкраще злегка підігріти (приблизно до 35 ° С). Звернемо увагу на те, що електроліти для хромування, особливо при тривалому процесі і високій силі струму, виділяють пари, що містять хромову кислоту, які дуже шкідливі для здоров'я. Тому хромування слід проводити під тягою або на свіжому повітрі, наприклад на балконі.
При хромуванні (а меншою мірою і при нікелюванні) не весь струм використовується на осадження металу. Одночасно виділяється водень. На підставі низки напруг слід було б очікувати, що метали, що стоять перед воднем, взагалі не повинні виділятися з водних розчинів, а навпаки повинен був виділятися менш активний водень. Однак тут, як і при анодному розчиненні металів, катодне виділення водню часто гальмується і спостерігається лише за високої напруги. Це явище називають перенапруженням водню, і воно особливо велике, наприклад, на свинці. Завдяки цьому може функціонувати свинцевий акумулятор. При зарядці акумулятора замість РbО 2 на катоді повинен виникати водень, але, завдяки перенапрузі, виділення водню починається тоді, коли акумулятор майже повністю заряджений.
Електрохімічний ряд активності металів (ряд напруг, ряд стандартних електродних потенціалів) - послідовність, в якій метали розташовані в порядку збільшення їх стандартних електрохімічних потенціалів φ 0 відповідають напівреакції відновлення катіону металу Me n+ : Me n+ + nē → Me
Ряд напруг характеризує порівняльну активність металів в окисно-відновних реакціях у водних розчинах.
Історія
Послідовність розташування металів у порядку зміни їхньої хімічної активності в загальних рисах була відома вже алхімікам. Процеси взаємного витіснення металів із розчинів та їх поверхневе осадження (наприклад, витіснення срібла та міді із розчинів їх солей залізом) розглядалися як прояв трансмутації елементів.
Пізні алхіміки впритул підійшли до розуміння хімічної сторони взаємного осадження металів їх розчинів. Так, Ангелус Сала у роботі «Anatomia Vitrioli» (1613) дійшов висновку, що продукти хімічних реакцій складаються з тих самих «компонентів», які у вихідних речовинах. Згодом Роберт Бойль запропонував гіпотезу про причини, через які один метал витісняє інший із розчину на основі корпускулярних уявлень.
В епоху становлення класичної хімії здатність елементів витісняти один одного із сполук стала важливим аспектом розуміння реакційної здатності. Й. Берцеліус на основі електрохімічної теорії спорідненості побудував класифікацію елементів, розділивши їх на «металоїди» (зараз застосовується термін «неметали») та «метали» та поставивши між ними водень.
Послідовність металів за їхньою здатністю витісняти один одного, давно відома хімікам, була в 1860-ті і наступні роки особливо ґрунтовно та всебічно вивчена та доповнена Н. Н. Бекетовим. Вже 1859 року він зробив у Парижі повідомлення тему «Дослідження над явищами витіснення одних елементів іншими». У цю роботу Бекетов включив цілу низку узагальнень про залежність між взаємним витісненням елементів та його атомною вагою, пов'язуючи ці процеси з « первісними хімічними властивостями елементів - тим, що називається хімічною спорідненістю». Відкриття Бекетовим витіснення металів з розчинів їх солей воднем під тиском і вивчення відновлювальної активності алюмінію, магнію і цинку при високих температурах (металотермія) дозволило йому висунути гіпотезу про зв'язок здатності одних елементів витісняти інші з сполук з їх щільністю: більш легкі прості важкі (тому цей ряд часто називають витіснювальний ряд Бекетова, або просто ряд Бекетова).
Не заперечуючи значних заслуг Бекетова у становленні сучасних уявлень про низку активності металів, слід вважати помилковим уявлення про нього як єдиного творця цього ряду, що існує у вітчизняній популярній і навчальній літературі. Численні експериментальні дані, отримані наприкінці ХІХ століття, спростовували гіпотезу Бекетова. Так, Вільям Одлінг описав безліч випадків «навернення активності». Наприклад, мідь витісняє олово з концентрованого підкисленого розчину SnCl 2 і свинець з кислого розчину PbCl 2 ; вона ж здатна до розчинення в концентрованій соляній кислоті з виділенням водню. Мідь, олово і свинець знаходяться в ряду правіше за кадмій, проте можуть витісняти його з киплячого слабо підкисленого розчину CdCl 2 .
Бурхливий розвиток теоретичної та експериментальної фізичної хімії вказував на іншу причину відмінностей хімічної активності металів. З розвитком сучасних уявлень електрохімії (головним чином роботах Вальтера Нернста) стало ясно, що ця послідовність відповідає «низці напруг» - розташування металів за значенням стандартних електродних потенціалів. Таким чином, замість якісної характеристики – «схильності» металу та його іона до тих чи інших реакцій – Нерст ввів точну кількісну величину, що характеризує здатність кожного металу переходити в розчин у вигляді іонів, а також відновлюватись з іонів до металу на електроді, а відповідний ряд отримав назву ряду стандартних електродних потенціалів.
Теоретичні основи
Значення електрохімічних потенціалів є функцією багатьох змінних і тому виявляють складну залежність від становища металів у періодичній системі. Так, окисний потенціал катіонів зростає зі збільшенням енергії атомізації металу, зі збільшенням сумарного потенціалу іонізації його атомів та зі зменшенням енергії гідратації його катіонів.
У загальному вигляді ясно, що метали, що знаходяться на початку періодів, характеризуються низькими значеннями електрохімічних потенціалів і займають місця в лівій частині ряду напруг. У цьому чергування лужних і лужноземельних металів відбиває явище діагональної подібності. Метали, розташовані ближче до середин періодів, характеризуються великими значеннями потенціалів і займають місця у правій половині низки. Послідовне збільшення електрохімічного потенціалу (від −3,395 У пари Eu 2+ /Eu [ ] до +1,691 У пари Au + / Au) відображає зменшення відновлювальної активності металів (властивість віддавати електрони) і посилення окислювальної здатності їх катіонів (властивість приєднувати електрони). Таким чином, найсильнішим відновником є металевий європій, а найсильнішим окислювачем – катіони золота Au+.
У ряд напруг зазвичай включається водень, оскільки практичний вимір електрохімічних потенціалів металів проводиться з використанням стандартного водню.
Практичне використання ряду напруг
Ряд напруг використовується на практиці для порівняльної [відносної] оцінки хімічної активності металів у реакціях з водними розчинами солей і кислот та для оцінки катодних та анодних процесів при електролізі:
- Метали, що стоять лівіше водню, є сильнішими відновниками, ніж метали, розташовані правіше: вони витісняють останні розчини солей. Наприклад, взаємодія Zn + Cu 2+ → Zn 2+ + Cu можлива лише у прямому напрямку.
- Метали, що стоять у ряду лівіше водню, витісняють водень при взаємодії з водними розчинами кислот-неокислювачів; найбільш активні метали (до алюмінію включно) - і за взаємодії з водою.
- Метали, що стоять у ряду правіше водню, з водними розчинами кислот-неокислювачів за звичайних умов не взаємодіють.
- При електролізі метали, що стоять правіше водню, виділяються на катоді; відновлення металів помірної активності супроводжується виділенням водню; найбільш активні метали (до алюмінію) неможливо за звичайних умов виділити з водних розчинів солей.
Таблиця електрохімічних потенціалів металів
| Метал | Катіон | φ 0 , | Реакційна здатність | Електроліз (на катоді): |
|---|---|---|---|---|
| Li + | -3,0401 | реагує з водою | виділяється водень | |
| Cs + | -3,026 | |||
| Rb + | -2,98 | |||
| K + | -2,931 | |||
| Fr+ | -2,92 | |||
| Ra 2+ | -2,912 | |||
| Ba 2+ | -2,905 | |||
| Sr 2+ | -2,899 | |||
| Ca 2+ | -2,868 | |||
| Eu 2+ | -2,812 | |||
| Na + | -2,71 | |||
| Sm 2+ | -2,68 | |||
| Md 2+ | -2,40 | реагує з водними розчинами кислот | ||
| La 3+ | -2,379 | |||
| Y 3+ | -2,372 | |||
| Mg 2+ | -2,372 | |||
| Ce 3+ | -2,336 | |||
| Pr 3+ | -2,353 | |||
| Nd 3+ | -2,323 | |||
| Er 3+ | -2,331 | |||
| Ho 3+ | -2,33 | |||
| Tm 3+ | -2,319 | |||
| Sm 3+ | -2,304 | |||
| Pm 3+ | -2,30 | |||
| FM 2+ | -2,30 | |||
| Dy 3+ | -2,295 | |||
| Lu 3+ | -2,28 | |||
| Tb 3+ | -2,28 | |||
| Gd 3+ | -2,279 | |||
| Es 2+ | -2,23 | |||
| Ac 3+ | -2,20 | |||
| Dy 2+ | -2,2 | |||
| Pm 2+ | -2,2 | |||
| Cf 2+ | -2,12 | |||
| Sc 3+ | -2,077 | |||
| Am 3+ | -2,048 | |||
| Cm 3+ | -2,04 | |||
| Pu 3+ | -2,031 | |||
| Er 2+ | -2,0 | |||
| Pr 2+ | -2,0 | |||
| Eu 3+ | -1,991 | |||
| Lr 3+ | -1,96 | |||
| Cf 3+ | -1,94 | |||
| Es 3+ | -1,91 | |||
| Th 4+ | -1,899 | |||
| FM 3+ | -1,89 | |||
| Np 3+ | -1,856 | |||
| Be 2+ | -1,847 | |||
| U 3+ | -1,798 | |||
| Al 3+ | -1,700 | |||
| Md 3+ | -1,65 | |||
| Ti 2+ | -1,63 | конкуруючі реакції: і виділення водню, і виділення металу в чистому вигляді | ||
| Hf 4+ | -1,55 | |||
| Zr 4+ | -1,53 | |||
| Pa 3+ | -1,34 | |||
| Ti 3+ | -1,208 | |||
| Yb 3+ | -1,205 | |||
| No 3+ | -1,20 | |||
| Ti 4+ | -1,19 | |||
| Mn 2+ | -1,185 | |||
| V 2+ | -1,175 | |||
| Nb 3+ | -1,1 | |||
| Nb 5+ | -0,96 | |||
| V 3+ | -0,87 | |||
| Cr 2+ | -0,852 | |||
| Zn 2+ | -0,763 | |||
| Cr 3+ | -0,74 | |||
| Ga 3+ | -0,560 | |||
Розділи: Хімія, Конкурс «Презентація до уроку»
Клас: 11
Презентація до уроку
Назад вперед
Увага! Попередній перегляд слайдів використовується виключно для ознайомлення та може не давати уявлення про всі можливості презентації. Якщо вас зацікавила ця робота, будь ласка, завантажте повну версію.
Цілі і завдання:
- Навчальна:Розгляд хімічної активності металів з положення в періодичної таблиці Д.І. Менделєєва та в електрохімічному ряді напруги металів.
- Розвиваюча:Сприяти розвитку слухової пам'яті, вмінню зіставляти інформацію, логічно мислити і пояснювати хімічні реакції, що відбуваються.
- Виховна:Формуємо навичку самостійної роботи, уміння аргументовано висловлювати свою думку та вислуховувати однокласників, виховуємо у хлопцях почуття патріотизму та гордість за співвітчизників.
Обладнання:ПК з медіапроектором, індивідуальні лабораторії із набором хімічних реактивів, моделі кристалічних ґрат металів.
Тип уроку: із застосуванням технології розвитку критичного мислення.
Хід уроку
I. Стадія виклику.
Актуалізація знань на тему, пробудження пізнавальної активності.
Блеф-гра: «Чи вірите Ви, що…». (Слайд 3)
- Метали займають верхній лівий кут ПСХЕ.
- У кристалах атоми металу пов'язані металевим зв'язком.
- Валентні електрони металів міцно пов'язані з ядром.
- У металів, які у основних підгрупах (А), зовнішньому рівні зазвичай 2 електрона.
- У групі зверху донизу відбувається збільшення відновлювальних властивостей металів.
- Щоб оцінити реакційну здатність металу в розчинах кислот та солей, достатньо подивитися в електрохімічний ряд напруги металів.
- Щоб оцінити реакційну здатність металу в розчинах кислот та солей, достатньо подивитися у періодичну таблицю Д.І. Менделєєва
Запитання класу?Що означає запис? Ме 0 - ne -> Me + n(Слайд 4)
Відповідь:Ме0 – є відновником, отже вступає у взаємодію Космосу з окислювачами. Як окислювачі можуть виступати:
- Прості речовини (+О 2 , Сl 2 , S…)
- Складні речовини (Н2О, кислоти, розчини солей…)
ІІ. Осмислення нової інформації.
Як методичний прийом пропонується складання опорної схеми.
Запитання класу?Від яких чинників залежить відновлювальні властивості металів? (Слайд 5)
Відповідь:Від положення в періодичній таблиці Д.І.Менделєєва або від положення електрохімічному ряду напруги металів.
Вчитель вводить поняття: хімічна активність та електрохімічна активність.
Перед початком пояснення хлопцям пропонується порівняти активність атомів Доі Liположення у періодичній таблиці Д.І. Менделєєва та активність простих речовин, утвореними даними елементами за становищем в електрохімічному ряді напруги металів. (Слайд 6)
Виникає протиріччя:Відповідно до положення лужних металів у ПСХЕ та згідно із закономірностями зміни властивостей елементів у підгрупі активність калію більша, ніж літію. За становищем у ряді напруги найактивнішим є літій.
Новий матеріалВчитель пояснює у чому відмінність хімічної від електрохімічної активності і пояснює, що електрохімічний ряд напруг відображає здатність металу переходити в гідратований іон, де мірою активності металу є енергія, що складається з трьох доданків (енергії атомізації, енергії іонізації та енергії гідротації). Матеріал записуємо у зошит. (Слайди 7-10)
Разом записуємо у зошит висновок:Чим менше радіус іона, тим більше електричне поле навколо нього створюється, тим більше енергії виділяється при гідротації, отже сильніші відновлювальні властивості цього металу в реакціях.
Історична довідка:виступ учня про створення Бекетовим витіснювального ряду металів. (Слайд 11)
Дія електрохімічного ряду напруги металів обмежується лише реакціями металів із розчинами електролітів (кислот, солей).
Пам'ятка:
- Зменшуються відновлювальні властивості металів при реакціях у водних розчинах у стандартних умовах (250°С, 1 атм.);
- Метал, що стоїть ліворуч, витісняє метал, що стоїть правіше з їх солей у розчині;
- Метали, що стоять до водню, витісняють його з кислот у розчині (викл. HNO3);
- Ме (до Al) + Н 2 О -> луг + Н 2
ІншіМе (до Н 2) + Н 2 О -> оксид + Н 2 (жорсткі умови)
Ме (після Н 2) + Н 2 Про -> не реагують
(Слайд 12)
Хлопцям лунають пам'ятки.
Практична робота:«Взаємодія металів із розчинами солей» (Слайд 13)
Здійсніть перехід:
- CuSO 4 -> FeSO 4
- CuSO 4 -> ZnSO 4
Демонстрація досвіду взаємодії міді та розчину нітрату ртуті (II).
ІІІ. Рефлексія, роздум.
Повторюємо: у якому разі користуємося таблицею Менделєєва, а якому разі необхідний ряд напруга металів. (Слайди 14-15).
Повертаємось до початкових питань уроку. На екрані висвітлюємо питання 6 та 7. Аналізуємо яке висловлювання не вірне. На екрані – ключ (перевірка завдання 1). (Слайд 16).
Підбиваємо підсумки уроку:
- Що нового впізнали?
- У якому випадку можна скористатися електрохімічним рядом напруги металів?
Домашнє завдання: (Слайд 17)
- Повторити з курсу фізики поняття «ПОТЕНЦІАЛ»;
- Закінчити рівняння реакції, написати рівняння електронного балансу: Су + Hg(NO 3) 2 →
- Дані метали ( Fe, Mg, Pb, Cu)– запропонуйте досліди, що підтверджують розташування цих металів у електрохімічному ряді напруги.
Оцінюємо результати за блеф-гру, роботу біля дошки, усні відповіді, повідомлення, практичну роботу.
Використовувана література:
- О.С. Габріелян, Г.Г. Лисова, А.Г. Введенська «Настільна книга для вчителя. Хімія 11 клас, частина ІІ» Видавництво Дрофа.
- Н.Л. Глінка "Загальна хімія".
Метали у хімічних реакціях завжди відновники. Відновлювальну активність металу відображає його положення електрохімічному ряду напруг.
З низки можна зробити такі выводы:
1. Чим лівіше стоїть метал у цьому ряду, тим сильнішим відновником він є.
2. Кожен метал здатний витісняти із солей у розчині ті метали, які стоять правіше
2Fe + 3CuSO 4 → 3Cu + Fe 2 (SO 4) 3
3. Метали, що знаходяться в ряді напруг лівіше водню здатні витісняти його з кислот.
Zn + 2HCl → ZnCl 2 + H 2
4. Метали, що є найсильнішими відновниками (лужні та лужноземельні) у будь-яких водних розчинах насамперед реагують з водою.
Відновлювальна здатність металу, визначена по електрохімічному ряду який завжди відповідає його становищу в періодичної системі т.к у ряду напруг враховується як радіус атома, а й енергія відриву електронів.
Альдегіди, їх будова та властивості. Отримання, застосування мурашиного та оцтового альдегідів.
Альдегіди – це органічні сполуки, до складу молекули яких входить карбонільна група, сполучена з воднем та вуглеводневим радикалом.
Метаналь (мурашиний альдегід)
Фізичні властивості
Метаналь – газоподібна речовина, водний розчин – формалін
Хімічні властивості
Реактивом на альдегіди є Cu(OH) 2
Застосування
Найбільше застосування мають метаналь та етаналь. Велика кількість метаналю використовується для одержання фенолформальдегідної смоли, яку одержують при взаємодії метаналю з фенолом. Ця смола необхідна для різних пластмас. Пластмаси виготовлені для фенолформальдегідної смоли в поєднанні з різними наповнювачами, називаються фенопластами. При розчиненні фенолформальдегідної смоли в ацетоні або спирті одержують різні лаки. При взаємодії метаналю з карбамідом CO(NH 2) 2 одержують карбідну смолу, а з неї – амінопласти. З цих пластмас виготовляють мікропористі матеріали для потреб електротехніки. Метаналь йде також на виробництво деяких лікарських речовин і барвників. Широко застосовується водний розчин, що містить у масових частках 40% метаналю. Він називається формаліном. Його використання ґрунтується на властивості згортати білок.
Отримання
Альдегіди отримують окисленням алканів та спиртів. Етаналь отримують гідротацією етину та окисленням етену.
Білет №12
Найвищі оксиди хімічних елементів третього періоду. Закономірності у вимірі їх властивостей у зв'язку зі становищем хімічних елементів у періодичній системі. Характерні хімічні властивості оксидів: основних, амфотерних, кислотних.
Оксиди- Це складні речовини, що складаються з двох хімічних елементів, один з яких є кисень зі ступенем окислення «-2»
До оксидів третього періоду відносяться:
Na 2 O, MgO, Al 2 O 3 , SiO 2 , P 2 O 5 , SO 3 , Cl 2 O 7 .
Зі збільшенням ступеня окислення елементів збільшуються кислотні властивості оксидів.
Na 2 O, MgO – основні оксиди
Al 2 O 3 – амфотерний оксид
SiO2, P2O5, SO3, Cl2O7 - кислотні оксиди.
Основні оксиди реагують з кислотами з утворенням солі та води.
MgO + 2CH 3 COOH → (CH 3 COO) 2 Hg + H 2 O
Оксиди лужних та лужноземельних металів реагують з водою з утворенням лугу.
Na 2 O + HOH → 2NaOH
Основні оксиди реагують із кислотними оксидами з утворенням солі.
Na 2 O + SO 2 → Na 2 SO 3
Кислотні оксиди реагують із лугами з утворенням солі та води
2NaOH + SO 3 → Na 2 SO 4 + H 2 O
Реагує з водою, з утворенням кислоти
SO 3 + H 2 O → H 2 SO 4
Амфотерні оксиди реагують з кислотами та лугами
Al 2 O 3 + 6HCl → 2AlCl 3 + 3H 2 O
З лугом
Al 2 O 3 + 2NaOH → 2NaAlO 2 + H 2 O
Жири, їх властивості та склад. Жири у природі, перетворення жирів в організмі. Продукти технічної переробки жирів, поняття про синтетичні миючі засоби. Захист природи від забруднення СМС.
Жири– це складні ефіри гліцерину та карбонових кислот.
Загальна формула жирів:

Тверді жири утворені переважно вищими граничними карбоновими кислотами – стеаринової C 17 H 35 COOH, пальмітинової C 15 H 31 COOH та деякими іншими. Рідкі жири утворені головним чином вищими ненасиченими карбоновими кислотами – олеїновою C 17 H 33 COOH, лінолевій C 17 H 31 COOH
Жири поряд з вуглеводнями та білками входять до складу організмів тварин та рослин. Вони є важливою складовою їжі людини і тварин. При окисненні жирів в організмі виділяється енергія. Коли до органів травлення надходять жири, то під впливом ферментів вони гідролізуються на гліцерин та відповідні кислоти.
Продукти гідролізу всмоктуються ворсинками кишківника, а потім синтезується жир, але вже властивий організм. Потоком крові жири переносяться в інші органи та тканини організму, де накопичуються або знову гідролізуються та поступово окислюються до оксиду вуглецю (IV) та води.
Фізичні властивості.
Тварини жири здебільшого тверді речовини, але трапляються і рідкі (риб'ячий жир). Рослинні жири найчастіше рідкі речовини - олії; відомі і тверді рослинні жири - кокосове масло.
Хімічні властивості.
Жири у тваринних організмах у присутності ферментів гідролізуються. Крім реакцій із водою, жири взаємодіють із лугами.
До складу рослинних олій входять складні ефіри ненасичених карбонових кислот, їх можна піддати гидрированию. Вони перетворюються на граничні з'єднання
Приклад: З олії в промисловості отримують маргарин.
Застосування.
Жири в основному застосовують як харчовий продукт. Раніше жири використовували для отримання мила
Синтетичні миючі засоби.
Синтетичні миючі засоби шкідливо впливають на довкілля, т.к. вони стійкі і важко піддаються руйнації.