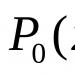Чарлз Б. Карпентер (Charles В. Carpenter)
Антигени, що забезпечують внутрішньовидові відмінності особин, позначаються як алоантигени, а коли вони включаються в процес відторгнення алогенних тканинних трансплантатів, набувають назву антигенів тканинної сумісності (гістосумісності). Еволюція закріпила одиничний ділянку тісно зчеплених генів гістосумісності, продукти яких на поверхні клітин забезпечують сильний бар'єр при алотрансплантації. Терміни «major histocompatibility antigens» (головні антигени гістосумісності) та «major histocompatibility gene complex» (MHC) (головний генний комплекс гістосумісності) відносяться відповідно до продуктів генів та генів цієї хромосомної ділянки. Численні мінорні антигени гістосумісності, навпаки, кодуються численними ділянками геному. Їм відповідають слабші аллоантигенні відмінності молекул, що виконують різноманітні функції. Структури, що несуть детермінанти MHC, відіграють значну роль в імунітет і саморозпізнавання в процесі диференціювання клітин та тканин. Інформація про МНС контроль імунної відповіді отримана в дослідах на тваринах, коли гени імунної відповіді були картовані всередині MHC-у мишей (Н-2), щурів (RT1), морських свинок (GPLA). Людина MHC названий HLA. Окремим буквам абревіатури HLA надається різне значення, і за міжнародною згодою HLA служить для позначення людського МНС-комплексу.
Щодо MHC можна зробити кілька узагальнень. По-перше, у малій ділянці (менше 2 сантиморгани) MHC кодується три класи генних продуктів. Молекули класу I, що експресуються практично всіма клітинами, містять один важкий і один легкий поліпептидний ланцюг і є продуктами трьох редуплікованих локусів-HLA-A, HLA-B і HLA-C. Молекули класу II, експресія яких обмежується В-лімфоцитами, моноцитами та активованими Т-лімфоцитами, містять два поліпептидні ланцюги (? і ?) нерівної величини і є продуктами кількох тісно зчеплених генів, що в сумі позначаються як зона HLA-D. Молекули класу III є компонентами комплементу С4, С2 і Bf. По-друге, молекули класів I і II утворюють комплекс із псевдоантигеном, або антиген гістосумісності та псевдоантиген разом розпізнаються Т-лімфоцитами, що мають відповідний рецептор для антигену. Розпізнавання свого і несвоєго при запуску та в ефекторній фазі імунної відповіді безпосередньо спрямовується молекулами І та ІІ класів. По-третє, чітких обмежень міжклітинних взаємодій, у яких беруть участь супресорні Т-лімфоцити, у людини не виявлено, але роль генів HLA досить важлива деяких проявів супресорної Т-клітинної активності. По-четверте, у МНС-регіоні локалізуються гени ферментних систем, які мають безпосереднього відношення до імунітету, але важливих зростання і розвитку скелета. Відомі локуси HLA на короткому плечі 6 хромосоми представлені на рис. 63-1.
Локуси системи HLA. Антигени класу I. HLA-антигени I класу визначаються серологічно за допомогою людських сироваток, головним чином від жінок, що багато народжували, і в меншій мірі за допомогою моноклональних антитіл. Антигени І класу присутні з різною щільністю у багатьох тканинах організму, включаючи В-клітини, Т-клітини, тромбоцити, але не на зрілих еритроцитах. Кількість специфічностей серологічно велике, і система HLA є найбільш поліморфною з відомих генетичних систем людини. Усередині HLA-комплексу для серологічно виявлених антигенів HLA I класу чітко визначаються три локуси. Кожен антиген 1 класу містить 2-мікроглобулінову субодиницю (мол. маса 11500) і важкий ланцюг (мол. маса 44000), що несе антигенну специфічність (рис. 63-2). Існує 70 чітко визначених А- і В-специфічностей та вісім специфічностей локусу С. Позначення HLA зазвичай присутнє в найменуванні антигенів головного комплексу гістосумісності, але може не вживатися, коли дозволяє контекст. Антигени, остаточно класифіковані ВООЗ, мають у позначенні букву w після назви локусу. Номер, наступний за позначенням локусу, є власною назвою антигену. HLA-антигени населення Африки, Азії та Океанії нині недостатньо чітко визначені, хоча вони включають частину загальних антигенів, властивих особам західноєвропейського походження. Розподіл HLA-антигенів по-різному в різних расових групах, і вони можуть бути використані як антропологічні маркери у вивченні захворювань та міграційних процесів.
Мал. 63-1. Схематичне зображення хромосоми 6.
Показано локалізація зони HLA в регіоні 21 короткого плеча. Локуси HLA-A, HLA-B і HLA-C кодують важкі ланцюги класу I (44000), тоді як?2-мікроглобулінова легка ланцюг (11500) молекул класу I кодується геном хромосоми 15. Зона HLA-D (клас II) розташована центромірно стосовно локусів А, В і С з тісно зчепленими генами компонентів комплементу С4А, С4В, Bf та С2 на ділянці B-D. Порядок розташування генів комплементу встановлено. Кожна молекула класу II D-регіону утворена α- і β-ланцюгами. Вони присутні на клітинній поверхні різних ділянках (DP, DQ і DR). Цифра, що передує знакам? і?, означає, що існують різні гени для ланцюгів даного типу, наприклад, для DR існує три гени?-ланцюгів, так що експресовані молекули можуть бути 1??, 2?? або 3??. Антигени DRw52(MT2) і DRw53(MT3) знаходяться на 2?-ланцюга, тоді як DR - на l?-ланцюга. DR неполіморфний, а молекули DQ-антигенів поліморфні як по?-, і по?-ланцюгам (2?2?). Інші типи DQ (1?1?) мають обмежений поліморфізм. Поліморфізм DP пов'язаний з ?-ланцюгами. Загальна протяжність HLA-регіону - близько 3 см.
Оскільки хромосоми парні, кожен індивід має до шести серологічно визначених антигенів HLA-A, HLA-B та HLA-C, по три від кожного з батьків. Кожен із цих наборів позначається як гаплотип, і відповідно до простого менделівського наслідування четверта частина потомства має ідентичні гаплотипи, половина - частина загальних гаплотипів і чверть, що залишилася, - повністю несумісна (рис. 63-3). Значення ролі цього генного комплексу у трансплантаційній відповіді підтверджується тим, що підбір за гаплотипом пар донор – реципієнт серед потомства одного покоління забезпечує найкращі результати при трансплантації нирок – близько 85-90% тривалого виживання (див. гл. 221).
Антигени класу ІІ. Зона HLA-D примикає до локусів класу I на короткому плечі 6-ї хромосоми (див. рис. 63-1). Цей регіон кодує серію молекул класу II. Несумісність по цьому регіону, особливо антигенам DR, визначає проліферативну реакцію лімфоцитів in vitro. Змішана лімфоцитарна реакція (MLR) оцінюється за рівнем проліферації в змішаній культурі лімфоцитів (MLC) і може бути позитивною навіть за ідентичності антигенів HLA-A, HLA-B і HLA-C (див. рис. 63-3). Антигени HLA-D визначаються за допомогою стандартних стимулюючих лімфоцитів, гомозиготних HLA-D та інактивованих рентгенівськими променями або мітоміцином С з метою надання реакції односпрямованості. Існує 19 таких антигенів (HLA-Dwl-19), виявлених з використанням гомозиготних типових клітин.
Спроби визначення HLA-D серологічними методами спочатку дозволили виявити серію D-пов'язаних (DR) антигенів, експресованих на молекулах класу II В-лімфоцнтів, моноцитів та активованих Т-лімфоцитів. Потім були описані інші тісно зчеплені антигенні системи, які отримали різні найменування (MB, MT, DC, SB). Ідентичність окремих груп молекул класу II зараз встановлена, і гени відповідних α- і β-ланцюгів виділені та секвеновані. Генна карта класу II представлена на рис. 63-1, відображає мінімальну кількість генів та молекулярних ділянок. Хоча молекула маса II може містити DR? з гаплотипу одного з батьків, a DR? - іншого (транскомплементація), комбінаторика поза кожною з ділянок DP, DQ, DR рідка, якщо взагалі можлива. Молекули DR і певною мірою DQ можуть бути стимулами для первинної MLR. Вторинна MLR визначається як тест з прімірованими лімфоцитами (PLT) і дає можливість отримати результат через 24-36 годин замість 6-7 днів для первинної реакції. Аллоантигени DP були відкриті завдяки їхній здатності викликати стимуляцію PLT, хоча вони не дають первинної MLR. Хоча В-лімфоцити та активовані Т-лімфоцити експресують усі три набори молекул класу II, антигени DQ не експресуються на 60-90% DP- та DR-позитивних моноцитів.

Мал. 63-2. Схематичне зображення молекул клітинної поверхні класів І та ІІ.
Молекули класу I складаються з двох поліпептидних ланцюгів. Тяжкий ланцюг з мол. масою 44000 проходить крізь плазматичну мембрану; її зовнішня ділянка складається з трьох доменів (?1,? 2 і?3), що формуються дисульфідними зв'язками. Легкий ланцюг з мол. масою 11500 (?2-мікроглобулін,? 2мю) кодується хромосомою 15 і нековалентно пов'язана з важким ланцюгом. Амінокислотна гомологія між молекулами I класу становить 80-85%, знижуючись до 50% у ділянках α1 та β2, які, ймовірно, відповідають ділянкам алоантигенного поліморфізму. Молекули класу II утворені двома нековалентно пов'язаними поліпсптидними ланцюгами, ?-ланцюг з мол. масою 34000 і?-ланцюг з мол масою 29000. Кожен ланцюг містить два домени, сформованих дисульфідними зв'язками (з С. Б. Carpenter, E. L. Milford, Renal Transplantation: Immunobiology in the Kidnev/Eds. York: Samiders, 1985).

Мал. 63-3. HLA-зона хромосоми 6: успадкування HLA-гаплотипів. Кожен хромосомний сегмент зчеплених генів позначається як гаплотип, і кожен індивід успадковує по одному гаплотипу кожного батька. На діаграмі представлені антигени А, В і С гаплотипів а та b для даного гіпотетичного індивіда; нижче розкрито позначення гаплотипів відповідно до тексту. Якщо чоловік з гаплотипом ab одружується з жінкою з гаплотипом cd, нащадки можуть лише чотирьох типів (з погляду HLA). Якщо в мейозі в одного з батьків відбувається рекомбінація (відзначена переривчастими лініями), це призводить до формування зміненого гап-лотна. Частота змінених гаплотипів у дітей служить мірою відстаней на генетичній карзі (1% частота рекомбінацій = 1 сМ; див. рис. 63-1) (з Г. В. Carpenter. Kidney International, Г)78. 14. 283).
Молекулярна генетика Кожен поліпептидний ланцюг молекул класів І та ІІ містить кілька поліморфних ділянок на додаток до «приватної» антигенної детермінанти, що визначається за допомогою антисироваток. У тесті клітинно-опосередкованого лімфолізу (CML) визначається специфічність кілерних Т-клітин (Тк), які виникають у процесі проліферації при MLR, шляхом тестування на клітинах-мішенях від донорів, які не служили джерелом стимулюючих клітин для MLR. Антигенні системи, що визначаються цим методом, виявляють тісну, але неповну кореляцію з «приватними» антигенами класу 1. Клонування циготоксичних клітин дозволило виявити набір поліморфних детермінант-мішеней на молекулах HLA, деякі з яких неможливо виявити за допомогою алоантисироваток і моноклональних антитіл, людські клітини. Деякі з цих реагентів можуть бути використані для ідентифікації «приватних» детермінантів HLA, тоді як інші спрямовані до більш «загальних» (іноді званих супертипованих) детермінантів. Одна така система «загальних» антигенів HLA-B має два алелі, Bw4 і Bw6. Більшість "приватних" HLA-B пов'язані або з Bw4, або з Bw6. Інші системи пов'язані з підгрупами антигенів HLA. Наприклад, HLA-B-позитивні важкі ланцюги містять додаткові ділянки, загальні для B7, B27, Bw22 і B40 або для B5, B15, B18 і Bw35. Існують і інші типи антигенних детермінант, що перекриваються, про що свідчить реакція моноклональних антитіл з ділянкою, загальним для важких ланцюгів HLA-A і HLA-B. Вивчення амінокислотної послідовності і псптидних карт деяких молекул HLA показало, що гіперваріабельні ділянки антигенів класу I зосереджені в зовнішньому домені 1-1 (див. рис. 63-2) і прилеглій ділянці 2 домену. Варіабельні послідовності молекул класу II різні для різних локусів. Чудово, що ?3-домен класу I, ?2-домен класу II та ?2-домен, а також частина мембранної молекули Т8 (Leu 2), що бере участь у міжклітинних взаємодіях (див. гл. 62), виявляють значну гомологію послідовності амінокислот із константними зонами імуноглобулінів. Це підтверджує гіпотезу про еволюційне формування сімейства генних продуктів, які несуть функції імунологічного розпізнавання. При дослідженні геномної ДНК HLA для молекул класів I та II були виявлені типові екзон-інтронні послідовності, причому екзони були ідентифіковані для сигнальних пептидів (5") кожного домену, трансмембранного гідрофобного сегмента і цитоплазматичного сегмента (З"). Є проби кДНК більшості ланцюгів HLA, а застосування ферментативних гідролізатів для оцінки стану поліморфізму рестрикційних фрагментів за довжиною (ПДРФ), дозволило отримати дані, які корелюють з результатами вивчення молекул класу 11 серологічними методами в MLR. Однак чисельність (20-30) генів класу 1 робить оцінку поліморфізму з ПДРФ скрутною. Багато цих генів не експресуються (псевдогени), хоча деякі можуть відповідати додатковим локусам класу I, які експресуються тільки на активованих Т-клітинах; функції їх невідомі. Розробка специфічних проб на локус HLA-A і HLA-B допоможе розібратися в цій досить складній проблемі.
Комплемент (клас ІІІ). Структурні гени трьох компонентів комплементу-С4, С2 і Bf присутні в зоні HLA-B-D (див. рис. 63-1). Це два локуси С4, що кодують С4А і С4В, спочатку описані як еритроцитарні антигени Rodgers і Chido відповідно. Ці антигени виявилися дійсно абсорбованими з плазми молекулами С4. Інші компоненти комплементу немає тісного зчеплення з HLA. Між генами С2, Bf та С4 кросинговера не описано. Всі вони кодуються ділянкою між HLA-B та HLA-DR довжиною близько 100кг. Існують два алелі С2, чотири Bf, сім С4А і три С4В, крім того, в кожному локусі є алеї QO, що мовчать. Виняткова поліморфність гістотипів комплементу (комплотипи) робить цю систему придатною для генетичних досліджень.
Таблиця 63-1. Найбільш поширені гаплотини HLA

У табл. 63-1 представлені чотири найбільш поширені гаплотипи, виявлені в осіб західноєвропейського походження. Результати MLR у людей, які не перебувають у спорідненості, відібраних за ознакою сумісності за цими гаплотипами, негативні, водночас реакція зазвичай має місце, якщо неспоріднені індивіди підібрані лише сумісність по HLA-DR і DQ. Такі ідентичні поширені гаплотипи, можливо, у незмінному вигляді походять від єдиного предка.
Інші гени 6-ї хромосоми. Недостатність стероїд 21-гідроксилази, аутосомно-рецесивна ознака, викликає синдром вродженої гіперплазії надниркових залоз (гл. 325 та 333). Ген цього ферменту локалізується дільниці HLA-B-D. Ген 21-гідроксилази, прилеглий до гена С4А, делетований в осіб, які страждають на згаданий синдром, разом з С4А (C4AQO), і ген HLA-B може трансформуватися з конверсією В 13 в рідкісний Bw47, що виявляється тільки в змінених гаплотипах. На відміну від дефіциту 21-гідроксилази, що пізно проявляється, зчепленого з HLA, вроджена гіперплазія надниркових залоз, пов'язана з дефіцитом 21-гідроксилази, не зчеплена з HLA. У кількох сімейних дослідженнях показано, що ідіопатичний гемохроматоз, аутосомно-рецесивне захворювання, зчеплене з HLA (див. гл. 310). Хоча патогенез розладів всмоктування заліза у шлунково-кишковому тракті невідомий, встановлено, що гени, що модулюють цей процес, знаходяться поблизу ділянки HLA-A.


Мал. 63-4. Схема відносної ролі HLA-A, HLA-B, HLA-C та HLA-D антигенів в ініціації алоімунної відповіді та у освіті ефекторних клітин та антитіл.
Два головні класи Т-лімфоцитів розпізнають антигени: Тк – попередники цитотоксичних «кілерних» клітин та Тх-хелперні клітини, що сприяють розвитку цитотоксичної відповіді. Тх також забезпечують допомогу В-лімфоцитів при розвитку зрілого IgG-відповіді. Важливо відзначити, що Тк зазвичай розпізнають антигени класу I, тоді як сигнал Тх створює переважно HLA-D, який тісно пов'язаний з антигенами класу II (з С. В. Carpenter. - Kidney International, 1978, 14, 283).
Гени імунної відповіді. При вивченні in vitro відповіді на синтетичні поліпептидні антигени, гемоціанін, колаген, правцевий токсоїд виявлено, що зона HLA-D аналогічна регіону Н-2. I у миші. Презентація антигенних фрагментів на поверхні макрофагів або інших клітин, що несуть молекули II класу, потребує пов'язаного розпізнавання комплексу «молекула II класу + антиген» Т-лімфоцитами, що несуть відповідний рецептор (и) (див. гл. 62). Стрижнем цієї гіпотези "своє-)-Х" або "змінене своє" полягає в тому, що Т-залежна імунна відповідь, дія Т-хелперів/індукторів (Тх) здійснюється тільки в тому випадку, якщо будуть синтезовані відповідні детермінанти класу II. Гени останніх і є Ir-гени. Оскільки алогенні детермінанти класу І розпізнаються як вже змінені, алогенна MLP є модель імунної системи, в якій присутність псевдоантигена необов'язкова (рис. 63-4). Ефективні фази імунітету вимагають розпізнавання псевдоантигену в комплексі з власними структурами. Останні в людини, як і в миші, є молекули антигенів гістосумісності I класу. Людські клітинні лінії, інфіковані вірусом грипу, лізуються імунними цитотоксичними Т-лімфоцитами (Тк) тільки в тому випадку, якщо клітини, що реагують, і клітини-мішені ідентичні за локусами HLA-A і HLA-B. Алогенна MLR служить моделлю і формування цитотоксичних Т-лімфоцитів, рестриктированных за класом I (див. рис. 63-4). Деталі рестрикції за різними молекулами класів І і ІІ та епітопів можуть бути вичленовані при використанні примованих клітин, що зазнали розмноження та клонування. Наприклад, на рівні антиген-презентуючих клітин даний Тх-клон розпізнає антигенний фрагмент, комплексований зі специфічною ділянкою молекули класу II, за допомогою рецептора Ti. Рестриктуючими елементами. Для деяких мікробних антигенів є алелі DR та Dw.
Супресія імунної відповіді (або низький рівень відповідальності) до пилку кедра, антигенів стрептококів та шистосом домінантна та зчеплена з HLA, що свідчить про існування генів імунної супресії (Is). Показано також наявність специфічних алельних асоціацій HLA з рівнем імунної відповіді, наприклад, для антигену рицини Ra5 - з DR2 і для колагену - з DR4.
Асоціації із хворобами. Якщо головний комплекс гістосумісності виконує важливу біологічну функцію, то яка ця функція? Одна з гіпотез полягає в тому, що він відіграє роль в імунному нагляді за неопластичними клітинами, що з'являються протягом життя індивіда. Велике значення цієї системи при вагітності, оскільки між матір'ю та плодом завжди існує тканинна несумісність. Високий ступінь поліморфізму може також сприяти виживанню видів у протистоянні величезній кількості мікробних агентів присутніх у навколишньому середовищі. Толерантність до «свого» (аутотолерантність) може перехрестя поширюватися на мікробні антигени, наслідком якої буде висока сприйнятливість, що призводить до виникнення смертельних інфекцій, в той час як поліморфізм за системою HLA сприяє тому, що частина популяції розпізнає небезпечні агенти як чуже. . Ці гіпотези пов'язують роль HLA з перевагами, завдяки яким система виживає в умовах тиску відбору. Кожна з цих гіпотез має певні підтвердження.
Важливим свідченням ролі комплексу HLA в імунобіології стало виявлення позитивної асоціації деяких патологічних процесів з антигенами HLA. Вивчення цих асоціацій стимулювало відкриття генів імунної відповіді, зчеплених з Н-2-комплексом, у мишеї. У табл. 63-3 сумовані найбільш значущі асоціації HLA та хвороб.
Встановлено, що частота народження HLA-B27 підвищується при деяких ревматичних захворюваннях, особливо при анкілозуючому спондиліті, захворюванні явно сімейного характеру. Антиген В27 є лише у 7% осіб західноєвропейського походження, але його виявляють у 80-90% хворих на анкілозуючий спондиліт. У перерахунку на відносний ризик це означає, що цей антиген відповідальний за сприйнятливість до розвитку анкілозуючого спондиліту, яка у 87 разів вища у його носіїв, ніж у загальній популяції. Аналогічно показаний високий ступінь асоціації з антигеном В27 гострого переднього увеїту, синдрому Рейтера та реактивних артритів принаймні при трьох бактеріальних інфекціях (ієрсиніозі, сальмонельозі та гонореї). Хоча звичайна форма ювенільного ревматоїдного артриту також асоційована з В27, тип захворювання із слабко вираженим суглобовим синдромом та іритом пов'язаний із В27. При псоріатичному артриті центрального типу найчастіше зустрічається В27, тоді як Bw38 асоційований як із центральним, так і з периферичним типами. Псоріаз асоційований із Cw6. У хворих з дегенеративним артритом або подагрою не виявляється будь-яких змін у частоті антигенів.
Більшість інших асоціацій з хворобами властиво антигенам HLA-D-зони Наприклад, глютенчутлива ентеропатія у дітей і дорослих асоційована з антигеном DR3 (відносний ризик 21) Дійсний відсоток хворих з цим антигеном варіює від 63 до 96% порівняно з 22-27% . Той самий антиген найчастіше виявляється у хворих з активним хронічним гепатитом і герпетиформним дерматитом, що страждають у той же час і на глютенчутливу ентеропатію. Ювенільний інсулінзалежний цукровий діабет (тип I) асоційований з DR3 і DR4 і негативно асоційований з DR2 У 17-25% хворих на діабет I типу виявлено рідкісний аллель Bf (М). Діабет із початком у дорослому періоді життя (типу II) не має асоціації з HLA. Гіпертиреоїдизм США асоційований з В8 і Dw3, тоді як у японської популяції - з Bw35. Більш широке обстеження здорових та хворих представників різних рас допоможе прояснити питання про універсальні HLA-маркери. Наприклад, антиген В27, рідкісний у здорових осіб японської національності, звичайний у хворих з анкілозуючим спондилітом. Так само DR4 - маркер для діабету I типу у представників усіх рас. Іноді HLA-маркер явно асоціюється лише з частиною симптомів усередині синдрому. Наприклад, міастенія значно сильніше асоційована з антигенами В8 та DR3 у хворих без тимоми, а розсіяний склероз - з антигеном DR2 у осіб з швидко прогресуючим перебігом хвороби. Синдром Гудпасчера, пов'язаний з аутоімунним ураженням клубочкових базальних мембран, ідіопатичний мембранозний гломерулонефрит, що відображає аутоімунні процеси з утворенням антитіл до антигенів клубочків, а також мембранозний нефрит, індукований золотом, значною мірою асоційовані з HLADR.
Таблиця 63-3. Захворювання, асоційовані з HLA-антигенами

Нерівноважне зчеплення. Хоча розподіл алелів HLA варіює в расових та етнічних популяціях, найбільш характерну особливість популяційної генетики антигенів HLA є наявність нерівноважного зчеплення для деяких антигенів А і В, В і С, В, D і локусів комплементу. Нерівноважність зчеплення означає, що антигени тісно зчеплених локусів виявляються разом частіше, ніж випливає з припущення випадкової асоціації. Класичним прикладом нерівноважного зчеплення є зв'язок антигену локусу AHLA-A1 з антигеном локусу У HLA-B8 в осіб західноєвропейського походження. Одночасне наявність А1 і В8, розраховане з урахуванням частот їх генів, має спостерігатися з частотою 0,17. 0,11, тобто приблизно 0,02. Тоді як частота їх співіснування, що спостерігається, становить 0,08, тобто в 4 рази більше, ніж очікувана, і різниця між цими величинами становить 0,06. Остання величина позначається дельта (?) і є мірою нерівноважності. Виявлено нерівноважне зчеплення та інших гаплотипів А- та В-локусів: A3 та В7, А2 та В 12, А29 та В 12, A11 та Bw35, Для деяких детермінант D-зони описано нерівноважне зчеплення з антигенами В-локусу (наприклад, DR3 та В 8); а також для антигенів В- та С-локусів. Антигени HLA, що серологічно виявляються, служать маркерами для генів цілого гаплотипу всередині сімейства і маркерами специфічних генів у популяції, але тільки за наявності нерівноважного зчеплення.
Значення нерівноважного зчеплення велике, оскільки такі генні асоціації можуть породжувати певні функції. Тиск відбору у процесі еволюції може бути основним фактором у збереженні деяких генних комбінацій у генотипах. Так, наприклад, існує теорія, згідно з якою А1 і В8, а також деякі детермінанти D та інших регіонів забезпечують селективну перевагу перед епідеміями таких хвороб, як чума або віспа. Однак можливо також, що нащадки людей, які вижили під час подібних епідемій, зберігають сприйнятливість до інших хвороб, оскільки їхній унікальний генний комплекс не забезпечує адекватної відповіді на інші фактори навколишнього середовища. Головна труднощі цієї гіпотези полягає в припущенні, що відбір діє на кілька генів одночасно і забезпечує тим самим виникнення спостерігаються значень Л, проте потреба в складних взаємодіях між продуктами різних локусів МНС-комплексу - лише початкова ланка для явищ, що спостерігаються, і селекція може посилити множинне нерівноважне зчеплення . Збереження деяких найпоширеніших гаплотипів, названих вище, підтримує цей погляд.
З іншого боку, гіпотеза відбору необов'язково має пояснювати нерівноважне зчеплення. Коли популяція, позбавлена деяких антигенів, схрещується з іншого, на яку характерна висока частота цих антигенів, що у рівновазі, ? може виявитися через кілька поколінь. Наприклад, наростання? для А1 і В8, виявлене в популяціях у напрямку зі сходу на захід, від Індії до Західної Європи, можна пояснити на основі міграції та асиміляції населення. У малих групах нерівноважність може бути зумовлена сумісністю, ефектом засновників та дрейфом генів. Нарешті, деякі випадки нерівноважного зчеплення є результатом невипадкового кросинговеру під час мейозу, оскільки хромосомні сегменти можуть бути більшою чи меншою мірою ламкими. Чи то тиск відбору чи обмеження кросинговера, нерівноважність зчеплення може зникати протягом кількох поколінь. Величезна кількість невипадкових асоціацій є в HLA-генному комплексі і визначення їх причин може забезпечити проникнення в механізми, що лежать в основі чутливості до хвороб.
Зчеплення та асоціації. У табл. 63-2 перераховані хвороби, які є прикладом зчеплення з HLA, коли спадкові ознаки маркуються в межах сім'ї відповідними гаплотипами. Наприклад, дефіцит С2, 21-гідроксилази, ідіопатичний гемохроматоз успадковуються за рецесивним типом з наявністю часового дефіциту у гетерозигот. Ці генетичні порушення також є HLA-асоційованими та обумовлюються надлишком деяких HLA-алелей у хворих людей, які не перебувають у спорідненості. Дефіцит С2 зазвичай зчеплений з гаплотипами HLA-Aw 25, 18, В55, D/DR2, а при ідіопатичному гемохроматозі проявляється як зчеплення, так і сильна асоціація між HLA-A3 і 14. Висока ступінь нерівноважного зчеплення в цьому випадку викликана особи, яка послужила його джерелом; крім того, недостатній був період часу, необхідний повернення пулу генів у стан рівноваги. З цього погляду HLA-гени – прості маркери зчеплених генів. З іншого боку, для прояву конкретного порушення може бути потрібна взаємодія зі специфічними HLA-алелями. Остання гіпотеза зажадала б визнання вищого темпу мутацій з експресією дефектних генів, що відбувається лише за умови зчеплення з деякими HLA-генами.
Хвороба Педжета та спинно-мозочкова атаксія є HLA-зчепленими аутосомно-домінантними спадковими захворюваннями; вони виявляються відразу в кількох членів сім'ї. Хвороба Ходжкіна є проявом HLA-зчепленого рецесивного спадкового дефекту. Жодних HLA-асоціацій не було виявлено при цих захворюваннях, що свідчить на користь вихідної множини «основоположників» цих хвороб із мутаціями, пов'язаними з різними алелями HLA.
Зчеплення з HLA легко визначається, коли домінантність і рецесивність ознак легко розмежувати, тобто коли висока експресивність і процес детермінується дефектом одиничних генів. При більшості асоціацій HLA-маркери відображають фактори ризику, що залучаються до реалізації та модуляції імунної відповіді під впливом багатьох генів. Прикладом полігенного імунного захворювання є атонічна алергія, при якій асоціація з HLA може бути очевидною лише у осіб з низьким генетично контрольованим (не у зв'язку з HLA) рівнем продукції IgE. Інший приклад такого роду – дефіцит IgA (див. табл. 63-3), асоційований з HLA-DR3.
Клінічне значення системи HLA. Клінічне значення типування HLA для діагностики обмежується визначенням В27 при діагностиці анкілозуючого спондиліту; проте і в цьому випадку спостерігається 10% хибнопозитивних та хибнонегативних результатів. Вивчення HLA має цінність також у практиці генетичних консультацій для раннього визначення хвороб у сім'ях з ідіопатичним гемохроматозом, уродженою гіперплазією надниркових залоз, пов'язаною з дефіцитом стероїдгідроксилази, особливо якщо HLA-типування здійснюється на клітинах, отриманих амніоцентезом. Високий рівень поліморфізму в системі HLA робить її цінним інструментом для тестування різних клітинних препаратів, особливо в судово-медичній практиці. Деякі хвороби, такі як цукровий діабет І типу та інші, для яких показані HLA-асоціації, вимагають додаткового вивчення ролі компонентів системи HLA у патогенезі цих захворювань
2661 0
Згідно з умовами формування імунологічної відповіді на антигени різної природи його розвиток, як зазначено вище, супроводжується обов'язковою експресією молекул головного комплексу гістосумісності (ГКГ).
Система ГКГ забезпечує регуляцію всіх форм імунологічної відповіді, починаючи від розпізнавання, і зрештою - загальний контроль за імунологічним гомеостазом.
Такий практично універсальний контроль стану системи імунітету обгрунтовується особливостями структурної організації системи ГКГ.
Успішний розвиток молекулярної біології та генетики сприяв отриманню нових даних та розумінню структури ГКГ, вивчення якої почалося майже 50 років тому. Результати дослідження системи головного комплексу гістосумісності відображені у великій кількості монографій, оглядів, статей. Тому далі розглядаються ті основні уявлення про систему ГКГ, які необхідні розуміння сутності процесу розпізнавання пухлинних антигенів .
Відомі дві основні групи антигенів ГКГ - І та ІІ класів, переважна більшість молекул яких можуть брати участь у презентації антигену. При виражених відмінностях у структурі, особливостях, функціях, генетичної організації, локалізації у клітині, перерозподілі тканин різних молекул I і II класів головного комплексу гістосумісності вони розглядаються як своєрідний рецептор для пептидів антигенів різної природи, включаючи пухлинні.
Антигени першого класу головного комплексу гістосумісності
Антигени I класу ГКГ в нормі експресуються практично всіма клітинами, що містять ядро (виняток становлять клітини ранніх стадій ембріонального розвитку). Антигени ГКГ є універсальними структурами, кількість яких коливається в залежності від виду тканини і досягає максимуму на мембрані лімфоцитів усіх лімфоїдних тканин (лімфатичних вузлів, селезінки), а також у периферичній крові.Значно нижчий рівень експресії антигенів І класу головного комплексу гістосумісності у клітинах печінки, нирок та ендокринних органів. Особливості тканин та їх функціональний стан, можливість розвитку тієї чи іншої патології також впливають на рівень експресії антигенів І класу ГКГ. Клітини, позбавлені антигенів ГКГ, вважаються мутантними. Безпрецедентний поліморфізм антигенів головного комплексу гістосумісності всередині виду забезпечує унікальність та неповторність антигенної структури окремих індивідуумів одного і того ж виду; Контроль за цим поліморфізмом здійснюють гени ГКГ.
Необхідно також враховувати, що в нормальних тканинах рівень експресії антигенів ГКГ I класу різний і залежить від локалізації та особливостей тих чи інших клітин. Наприклад, на клітинах епітелію кишечника, гортані, молочної залози, легких рівень експресії антигенів І класу головного комплексу гістосумісності зазвичай високий, на клітинах скелетних м'язів та слизової оболонки шлунка - невисокий, а на клітинах центральної нервової системи ці антигени практично не виявляються.
Гетерогенність клітинного складу тих чи інших органів чи тканин, своєю чергою, визначає можливі відмінності в експресії антигенів I класу ГКГ різними клітинами. Важливу роль цьому грають особливості мікрооточення, зокрема продукція цитокінів, які по-різному впливають експресію антигенів I класу ГКГ.
Молекули антигенів I класу ГКГ представлені різними локусами: А, В, С – класичні молекули з вираженим поліморфізмом, а також локуси G, Е та F, відомі як некласичні молекули антигенів I класу головного комплексу гістосумісності; до некласичних молекул відносяться і CDId. І класичні молекули антигенів ГКГ I класу, і некласичні антигени локусу G можуть бути в розчинній формі - sHLA-A, sHLA-B, sHLA-C, а також sHLA-G.
Основні структурні особливості антигенів І класу ГКГ такі. Молекула антигенів цього класу є інтегральним мембранним глікопротеїном (гетеродимер з молекулярною масою 45 кД) і складається з важкої ос-ланцюга, до складу якої входять а1-, а2- і аЗ-домени. Домени а1 і а2 можуть безпосередньо зв'язуватися з пухлинними пептидами, у той час як а3-домен містить неполіморфний регіон - ліганд для цитотоксичних Т-клітин, який взаємодіє з рецептором CD8+-лімфоцитів і гомологічним контактній ділянці Ig.
Функціонування молекул I класу ГКГ багато в чому пов'язане з в2-мікроглобуліном (в2m), який відіграє важливу роль в особливостях а-ланцюга і є розчинним легким ланцюгом. У літературі дедалі частіше з'являються повідомлення, автори яких намагаються знайти зв'язок між експресією антигенів І класу ГКГ та геном в2m.
Отримані дані суперечливі. Проте, постановка цього питання має серйозне обґрунтування, що базується на таких двох переконливих фактах. Перший - незалежно від того, чи можна в даний час стверджувати наявність зв'язку між зниженням експресії головного комплексу гістосумісності та в2m, показано, що пухлинні пептиди можуть безпосередньо зв'язуватися з в2m, утворюючи комплекс з важким ланцюгом молекули антигену ГКГ I класу.
Зокрема, таку здатність має HLA-A2-peстриктований епітоп, що зв'язується з N-кінцями в2m, який потім розпізнається цитотоксичними лімфоцитами (ЦТЛ). Другий – аномалії в експресії в2m часто поєднуються з резистентністю до дії ЦТЛ.
Що ж до виявлення будь-яких кореляцій між експресією антигенів I класу ГКГ і в2m, то, як зазначалося, ці дані неоднорідні. Дослідження великої кількості різних пухлин (меланома, рак кишечника, носоглотки та інших.) показало, що у переважній кількості спостережень експресія антигенів I класу ГКГ зменшувалася.
У одних випадках це поєднувалося з мутацією гена в2m, а інших - немає. З цього випливає, що автори наведених даних не розглядають соматичні мутації гена в2m як головний механізм зниження рівня антигенів І класу головного комплексу гістосумісності.
На противагу такій точці зору при вивченні експресії антигенів I класу ГКГ (А, В, С) паралельно з геном в2m інші автори показали, що зменшення експресії зазначених антигенів при первинних карциномах раку молочної залози в 40% випадків поєднувалося і зі зниженням експресії гена в2m порівняно з цим показником для нормальних тканин.
Лише 12 % поява в2m було порівняно з нормою; зниження експресії в2m не супроводжувалося дефектами гена в2m. Дослідження молекулярних механізмів зменшення експресії антигенів I класу ГКГ дало підставу для висновку, що таке зниження є феноменом, який відбувається головним чином на посттранскрипційному рівні і може впливати на експресію гена в2m.
Більше однозначне трактування наявності в2m висловлюють інші автори. Так, показано, що у значній кількості клітин різних ліній злоякісних пухлин, включаючи меланому, рак нирки та інші, різко знижений рівень експресії антигенів I класу ГКГ і паралельно експресія в2m або ослаблена, або цей мікроглобулін взагалі не експресується.
Нарешті, не можна не відзначити і дані, згідно з якими відсутність експресії або невисокий рівень в2m у мишей деяких ліній поєднується з дефектом дозрівання CD4-CD8+Т-лімфоцитів, що експресують TCR і дефектом цитотоксичності Т-лімфоцитів. З цих даних випливає, що експресія молекул I класу головного комплексу гістосумісності відіграє ключову роль у позитивній селекції Т-клітин, зокрема тих, які в період тимічного дозрівання експресують а-і в-ланцюзі TCR.
Незважаючи на зазначену суперечливість даних, вивчення в2m, його дослідження при карциномі носоглотки показало достовірне підвищення рівня цього білка з відмінностями на окремих етапах процесу, поширення пухлини і метастазах. Підвищення рівня в2m найчастіше спостерігалося за низькодиференційованих форм цієї пухлини, проте, на думку авторів досліджень, діагностична значимість цього маркера низька.
Наведені дані, незважаючи на їх деяку суперечність, свідчать про те, що експресія в2m у злоякісно трансформованих клітинах у значній кількості випадків асоціюється з дефектами розпізнавання та зниженням цитотоксичності, що пояснює заслужений інтерес до вивчення ролі в2m у процесі розпізнавання пухлинних антигенів.
Цілком ймовірно, що подальші дослідження в цьому напрямку можуть послужити базою не тільки для прогнозування перебігу пухлинного процесу, але і для підходів до регулювання індукції імунологічної відповіді. Схематично структуру класичних антигенів I класу ГКГ представлено на рис. 4.
Мал. 4. Схематична структура антигенів гістосумісності І класу
Прагнення з'ясування механізмів зниження експресії антигенів I класу ГКГ не обмежується пошуками зв'язку з мутаціями гена в2m. Зокрема, показано, що це може бути обумовлено втратою гетерозиготності (loss of heterozigosity - LOH) на 6p21 хромосомі.
Цей механізм призводить до незворотного зниження рівня HLA-гаплотипу в різних пухлинах і, незважаючи на недостатню вивченість, може бути серйозною перешкодою для терапевтичного ефекту імунізації пухлинними антигенами. Зменшення гетерозиготності було виявлено у зразках, отриманих з пухлин носоглотки, кишечника, меланоми, що дозволило авторам на підставі великого дослідженого матеріалу розділити пухлини на LOH-негативні та LOH-позитивні для виявлення хворих, яких можна розглядати як перспективні для імунотерапії.
Білки-транспортери
Для реалізації процесу розпізнавання антигени І класу ГКГ у комплексі з пухлинними пептидами мають бути доставлені на поверхню пухлинної клітини. Транспорт цього комплексу, як правило, може бути здійснений лише за наявності білків-транспортерів – ТАР (transporter antigene proteines).ТАР є гетеродимером, що відноситься до субсімейства трансмембранних транспортерів, синтезується в цитозолі, де пов'язаний з комплексом, що включає і а-ланцюги головного комплексу гістосумісності, пухлинного пептиду, в2m і транспортує цей комплекс в ендоплазматичний ретикулум, де і відбувається процесинг. В даний час відомі дві субодиниці цього білка - ТАР-1 та ТАР-2.
Значення ТАР-1 і ТАР-2 у процесі розпізнавання не обмежується транспортом зазначеного комплексу, оскільки вони забезпечують і організацію молекул ГКГ. Регуляція активності білків-транспортерів здійснюється факторами PSF1 та PSF2 (peptide suppy factors).
Молекула ГКГ I класу взаємодіє з білком-транспортером завдяки молекулі, відомій як тапазин, що кодується геном, пов'язаним із ГКГ. Експресія тапазину в ряді випадків може коригувати дефекти розпізнавання ЦТЛ, що свідчить про важливу роль цього білка в HLA-l-рестриктованому розпізнаванні.
Тример, що утворився в подальшому, з цитозолю через апарат Гольджі транспортується на поверхню пухлинної клітини і презентує відповідні епітопи рецепторам СD8+Т-лімфоцитів. Мал. 5 ілюструє участь транспортних білків у переміщенні комплексу антигени головного комплексу гістосумісності – антигени пухлини.

Мал. 5. Участь транспортних білків у переміщенні комплексу антигени ГКГ-антигени пухлини:
ТАР – білки-транспортери пухлинних пептидів, TCR – рецептор Т-лімфоцитів
У плані загальних уявлень про функціонування ТАР мають значення дані, отримані останнім часом при дослідженні клітин меланоми. З них випливає, що поява точкових мутацій у генах, що кодують антигени І класу ГКГ, порушує транспортну здатність ТАР, що може перешкоджати розпізнаванню цитотоксичних лімфоцитів і розглядається як ще одна причина вислизання пухлини з-під імунологічного контролю.
Ефективність презентації антигенів у комплексі з молекулами І класу ГКГ ЦТЛ залежить не тільки від наявності експресії ТАР, а й від їхньої функціональної активності. Молекулярні механізми порушення функціональної активності ТАР вивчені недостатньо. Однак нині вже є відомості про деякі механізми порушення експресії та функціональної активності ТАР.
Передбачається, що такі порушення можуть бути обумовлені транслокацією та точковими мутаціями в генах, що кодують ці білки, що веде до втрати здатності клітин презентувати антигени I класу головного комплексу гістосумісності. Тому є підстави вважати, що дефект цієї системи вважатимуться однією з центральних у зміні експресії антигенів I класу ГКГ.
Підтвердженням цьому є результати дослідження клітин лінії недрібноклітинної карциноми легені, коли точкові мутації, що поєднуються з порушеннями функції ТАР, були виявлені в аденозинтрифосфатзв'язуючому ділянці цього білка. Не виключається можливість наявності інгібіторів активності ТАР.
Останнє припущення ґрунтується на тому, що білок простого вірусу герпесу ICP47 блокує транспорт ТАР. У цьому не можна виключити існування інших інгібіторів активності ТАР як вірусного, і іншого походження.
Слід звернути увагу також на неоднаковий ступінь значущості експресії ТАР у клітинах високо- та низькоімуногенних пухлин. Так, вивчення презентації пептидів вірусиндукованих пухлин мишей лінії С57В1/6 показало, що ефективність презентації пептиду слабоімуногенними пухлинами чітко залежить від експресії ТАР, тоді як вираженої залежності від презентації пептидів високоімуногенними пухлинами не простежується.
Факт ТАР-незалежного розпізнавання потребував пояснення, можливість якого з'явилася лише останнім часом завдяки роботам Т. Fiedler та співробітників.
Їм вдалося отримати дані, згідно з якими у випадках дефекту ТАР презентація пухлинних антигенів за участю молекул CDld залишається незмінною. У зв'язку з цими даними автори вважають за можливе розглядати презентацію за участю CDld як додатковий механізм розпізнавання.
Стали відомі й молекулярні механізми зниження функціональної активності ТАР людини та мишей, виявлено також структури, що забезпечують активність цих білків-транспортерів. Зокрема, щодо амінокислотної послідовності ТАР було встановлено, що наявність глютамінової кислоти в позиції 263 (Glu-263) забезпечує їх транспортну функцію.
Зниження функціональної активності може бути пов'язане з порушенням стабільності гена мРНК, відповідального за презентацію антигену, що нерідко поєднується і зі зменшенням експресії антигенів I класу ГКГ.
Зміна функціональної активності транспортних білків може спричинити порушення процесингу антигенів. Про це свідчить нещодавно встановлений факт, отриманий для дослідження карциноми нирки; ступінь виразності таких дефектів у клітинах окремих ліній карциноми нирки відрізнялася великою варіабельністю.
Важливо, що частота виявлення дефектів ТАР у різних пухлинах неоднакова. Якщо вони досить часто виявляються при меланомах, карциномі нирки, то при раку легені та карциномах кишечника зниження активності ТАР або не спостерігалося, або було слабко вираженим.
Дані про неоднаковий рівень пошкоджень функціональної активності ТАР у різних пухлинах є важливими не тільки тому, що ще раз ілюструють біологічні особливості пухлинних клітин, але й орієнтують на пошук механізмів, пошкодження яких також може сприяти порушенню уявлення антигенів пухлин.
Важлива роль експресії ТАР та належний рівень їх функціональної активності для процесу розпізнавання пухлинних антигенів робить зрозумілим, чому недостатність цих білків дуже істотно впливає на індукцію імунологічної відповіді на дані антигени.
Вже з'явилися відомості про те, що зниження рівня експресії ТАР може бути використане і для оцінки клінічних особливостей перебігу пухлинного процесу, зокрема його прогнозу. Такі дані, наприклад, були отримані при вивченні клітин меланоми, коли було зазначено, що прогресуючий перебіг меланоми та вислизання її від розпізнавання ЦТЛ поєднувалося зі зниженням рівня експресії ТАР.
Паралельні дослідження ТАР-1, ТАР-2, LMP-2, LMP-7, антигенів I класу ГКГ та в2m показали, що не тільки зміни ТАР-1, а, можливо, і ТАР-2 можуть бути незалежними прогностичними маркерами при зростанні первинних меланом.
Білки вірусу Епштейна-Барр
Поряд із білками-транспортерами – важливими компонентами розпізнавання велике значення має ще одна група білків вірусного походження. Йдеться про білки вірусу Епштейна-Барр - LMP (large multifunctional protease), які належать до нового класу регуляторів і є субодиницею 20S протеосоми. В даний час відомі кілька субодиниць цього білка - LMP-1, LMP-2A, LMP-2B, LMP-7, LMP-10 з різною молекулярною масою; ідентифіковано 9 генів, що кодують ці білки.Експресія білків LMP виявлена в різних пухлинах: назофарингальній карциномі, раку шлунка та інших злоякісних пухлинах епітеліального походження, лімфогранулематозі, лімфомі Беркітта та ін. Є спостереження, що LMP-2 частіше за інших білків цього сімейства, наприклад LMP-7, , і метастазів.
Розуміння ролі LMP випливає з особливостей тих процесів, у яких беруть участь. У цьому плані досить вивчені субодиниці LMP-2A та LMP-2B, які мають схожу молекулярну організацію. Білок LMP-2A пов'язаний з тирозиновими кіназами сімейства src і є для них субстратом, а тирозинфосфорилування LMP-2A індукує процес адгезії до екстрацелюлярного білка матриксу - ЕСМ (extra cellular matrix).
Поряд з переліченими білками, участь яких обов'язково практично у всіх випадках розпізнавання, в цьому процесі можуть брати участь і інші білки - MECL-1, РА28-а, РА28-в, тапазин та ін, які регулюються генами, зчепленими з генами, що контролюють презентацію антигену.
Виходячи з цього постулюється, що HLA-I-дефіцитний фенотип пухлини, наприклад меланоми, пов'язаний із зменшенням кількості безлічі компонентів, серед яких насамперед слід відзначити ТАР, LMP, РА28-а або РА28-в, в той час як експресія інших компонентів, таких, як калретикулін, ER60, білок дисульфідізомераза, калнексин або взагалі не змінена, або знижена.
Дефекти ТАР та LMP частіше спостерігаються у клітинах метастазів, ніж первинних пухлин, що може бути обумовлено більшою генетичною нестабільністю цих клітин. В результаті створюються умови для селекції клону пухлинних клітин, здатних вислизати від розпізнавання, рестриктованого молекулами І класу головного комплексу гістосумісності.
Вивчення молекулярних механізмів процесу розпізнавання не обмежується розумінням його сутності. Так, при вивченні меланоми отримані дані, згідно з якими визначення ТАР та LMP може мати клінічне значення.
Результати паралельного дослідження LMP-2, LMP-7, ТАР-1, ТАР-2, антигенів I класу ГКГ та в2m у клітинах меланоми різної щільності свідчать про те, що:
1) експресія зазначених маркерів не корелювала із щільністю пухлини;
2) зменшення кількості LMP та ТАР у багатьох випадках поєднувалося з ослабленням експресії молекул ГКГ;
3) зниження рівня експресії ТАР-1 та ТАР-2 корелювало з наявністю метастазів.
Ще одним прикладом несприятливого поєднання зниження рівня експресії молекул ГКГ, білків-транспортерів та пухлинних антигенів є такі дані. Виявилося, що зменшення експресії антигену меланоми MART-1/Melan-A, ТАР та молекул головного комплексу гістосумісності I класу в клітинах хворих на меланому приводило в подальшому до летального результату; імунотерапія була неефективною. Це пояснює, чому в даний час робляться спроби використання результатів визначення експресії білків ТАР та LMP у клініці.
Однак, незважаючи на безперечну значущість білків ТАР і LM Р у процесі розпізнавання, є спостереження, які ілюструють можливість винятків. Як неодноразово зазначалося, зниження експресії ТАР зазвичай пов'язане зі зменшенням експресії антигенів I класу ГКГ.
Поруч із відомі випадки, коли такий паралелізм відсутня, що підтверджують результати вивчення клітин двох ліній карциноми носоглотки людини. У клітинах обох ліній зменшувалась експресія LMP-2, ТАР-1, ТАР-2, LMP-7, молекул алелей HLA-B.
У клітинах однієї з ліній - HSC5, незважаючи на виражене зниження рівня ТАР, відзначено експресію молекул HLA-A2, що свідчить про можливість транспортування антигенів ГКГ без участі ТАР.
Цілком ймовірно, що така можливість залежить від низки ще не відомих особливостей внутрішньоклітинних процесів, що відбуваються в тій чи іншій пухлинній клітині. Тому існування поодиноких випадків транспортування комплексів пухлинних пептидів і молекул ГКГ за відсутності ТАР ставить перед дослідниками завдання з'ясування, за яких умов здійснюється розпізнавання.
Таким чином, можна констатувати, що ТАР та LMP – необхідні компоненти ефективного процесу розпізнавання пухлинних антигенів. Зниження рівня експресії цих білків та його функціональної активності - одне з основних причин догляду пухлини з-під імунологічного контролю. Зменшення їхньої експресії нерідко асоціюється зі зниженням чутливості не тільки до лізису цитотоксичними лімфоцитами, а й до природних кілерів.
Ключова роль ТАР і LMP у розпізнаванні обґрунтовує доцільність ще одного безперечно перспективного підходу у загальній стратегії імунотерапії - підвищення рівня експресії зазначених білків різними шляхами: трансфекцією відповідних генів, дією цитокінів, що посилюють їхню експресію, зокрема IFNy та ін.
Антигени, рестриктовані молекулами І класу головного комплексу гістосумісності, можуть бути різними шляхами. Пряма презентація – деградація цитолітичних білків за участю протеосом, транспортом пептидів через мембрану ендоплазматичного ретикулуму та подальшою експресією комплексу молекула ГКГ – епітопи антигену пухлини на поверхню пухлинної клітини.
Перехресна презентація включає внутрішньоклітинний процесинг пухлинних антигенів антиген-презентуючими клітинами. Як відомо, пряма презентація, як правило, спрямована на подання антигену CD8+Т-лімфоцитів, а перехресна - CD4+Т-лімфоцитів. При цьому показано, що перехресна презентація необхідна і для індукції клітин пам'яті CD8+, проте залишається незрозумілим, чи така презентація здатна впливати на цитотоксичність останніх.
Для відповіді на це питання були проведені досліди з індукцією прямої та перехресної презентації при використанні мутантних антигенів І класу ГКГ, які не здатні здійснювати презентацію навіть нормальних антигенів цього класу.
Результати досліджень показали, що перші індукують дуже слабку цитотоксичність ЦТЛ, а оптимальна індукція цитотоксичності, але не клітин пам'яті ЦТЛ здійснюється при прямій презентації антигену пухлинними клітинами.
Антигени локусу G
Як зазначалося, у структуру антигенів I класу ГКГ поруч із локусами А, У, З входять інші локуси, зокрема G, Е і F, які, на відміну антигенів локусів А, У, З, характеризуються обмеженим поліморфізмом і тому називаються некласичними молекулами. Вони відрізняються від класичних не лише обмеженим поліморфізмом, а й особливостями транскрипції, експресії та імунологічними функціями.Антигени локусу G (що не беруть участь у класичному розпізнаванні) експресуються трофобластами, на поверхні яких зазвичай відсутні антигени інших локусів головного комплексу гістосумісності. Фізіологічна роль HLA-G у цих випадках полягає в обмеженні росту клітин, включаючи трофобласти, завдяки чому ці антигени відіграють важливу роль у встановленні толерантності плода до імунологічної системи матері.
Інтерес до виявлення антигенів локусу G на пухлинних клітинах виник порівняно недавно і великий внесок у розуміння значення експресії HLA-G внесли P. Paul та співробітники. Стало відомо, що HLA-G може перебувати в мембраннозв'язаній та розчинній формах, що визначає наявність його різних ізоформ: HLA-G1, HLA-G2, HLA-G3, HLA-G4 - ізоформи, пов'язані з мембраною, HLA-G5, HLA- G6, HLA-G7 – розчинні ізоформи; деякі з них виявляються як у супернатантах клітин, що культивуються, так і в різних рідинах організму.
Природно, що порівняльна новизна цього питання залишає неясними багато деталей, що стосуються оцінки значення експресії антигенів локусу G. Тим не менш, незважаючи на деяку неоднозначність такої оцінки, отримані результати дозволяють досить точно встановити важливість експресії молекул HLA-G пухлинними клітинами і можуть бути використані для розуміння процесів лізису цитотоксичними клітинами
Останнє пояснюється, в основному, тим, що взаємодія з HLA-G призводить до інгібіції лізису пухлинних клітин, формуванню толерантності, що можна розглядати як сприятливі умови для виходу пухлини з-під імунологічного контролю. Можливий уникнення лізису пухлинних клітин, які експресують HLA-G, очевидно, пов'язаний з інгібіцією рецепторів, відповідальних за цитотоксичність.
Останнім часом стали відомі кілька типів таких інгібіторних рецепторів, вперше один із них був описаний на початку 90-х років. Докладніші відомості про інгібіторні рецептори будуть викладені нижче.
Стало відомо, що інгібіторні рецептори взаємодіють з молекулами HLA-G і таким чином сприяють догляду пухлини з-під імунологічного контролю. Можливість цього посилюється і тим, що інгібіторні рецептори експресуються на різних цитотоксичних лімфоцитах: Т-лімфоцитах, природних кілерах і природних кілерних Т-лімфоцитах.
Про неоднозначність трактувань значення експресії антигенів HLA-G для процесу розпізнавання свідчать також результати вивчення значної кількості зразків різних пухлинних тканин та клітин багатьох пухлинних ліній з метою виявлення експресії антигенів А, В, С, а також G та його ізоформи - G1.
Результати цих досліджень показали, що в невеликій кількості випадків спостерігається транскрипція мРНК антигенів локусу G за відсутності експресії його ізоформи - G1. Підсумком цих досліджень було висновок, що антигени HLA-G, і зокрема його ізоформа G1, або не відіграють ролі у здійсненні інгібіторного сигналу кілерних клітин, або ця роль дуже мала.
До аналогічних висновків щодо експресії HLA-G клітинами меланоми дійшли й інші дослідники. Було встановлено, що клітини меланоми експресували цей антиген тільки de novo, що дало підставу розглядати експресію локусу HLA-G на клітинах меланоми не закономірну. Ці ж дослідники показали, що IFNy не впливає на експресію антигенів HLA-G і тому терапія даним цитокіном не сприяє відходу пухлини від лізису.
Незважаючи на те, що автори зазначених досліджень не дають остаточної оцінки значення експресії HLA-G, вони не виключають, що експресія цих антигенів може перешкоджати розвитку тих проявів протипухлинного імунітету, які сприяють прогресу пухлин.
Такий висновок було зроблено при дослідженні клітин меланоми, на яких було встановлено високий рівень сплайсингу HLA-G-транскрипції, що поєднується з прогресуванням пухлинного росту.
Молекули HLA-G можуть експресуватися на активованих макрофагах і дендритних клітинах, що інфільтрують карциному легені, а також легеневу тканину при інших патологічних процесах.
Передбачається, що експресія HLA-G цими клітинами може перешкоджати презентації антигену та сприятлива для прогресії як злоякісного росту, так і запальних процесів.
Деякі автори схильні розглядати експресію HLA-G як фактор вислизання пухлини з-під імунологічного контролю навіть у випадках, коли проведені дослідження не дають прямих доказів для такого висновку. Наприклад, при дослідженні клітин (свіжовиділених та клітин різних ліній) гепатоми, меланоми, карцином не виявлено експресії антигенів HLA-G.
Відзначено також, що пухлини не були інфільтровані природними кілерами і лізис пухлинних клітин не спостерігався. Проте автори не виключають можливу роль антигенів ГКГ локусу HLA-G у процесі вислизання пухлини від імунологічного контролю. Встановлено, що HLA-G-молекули у більшій кількості випадків експресуються макрофагами та ДК, що інфільтрують карциному легені, ніж при незлоякісних захворюваннях.
У міру вивчення ролі експресії HLA-G сумніви щодо її значення зменшувалися, і в даний час є підстави вважати, що експресія HLA-G може:
1) бути додатковим механізмом вислизання пухлин від імунологічного контролю;
2) викликати імунологічну толерантність;
3) інгібувати цитотоксичність кілерних клітин.
Якщо ж врахувати, що HLA-G може інгібувати лізис різними кілерними клітинами, спектр можливих негативних впливів експресії цих молекул значно розширюється.
До некласичних антигенів системи ГКГ належать і молекули локусу Е – HLA-E. Ці молекули характеризуються обмеженим поліморфізмом і з високою специфічністю пов'язують пептид 1а, який походить з класичних поліморфних молекул А, В, С і стабілізує білки ГКГ, сприяючи їх просуванню до клітинної мембрани.
Дослідження кристалічної структури HLA-E показало, що він має здатність зв'язуватися з пептидами la HLA-1 за участю білків-транспортерів (ТАР-залежним шляхом), може взаємодіяти з рецепторами природних кілерів, інгібуючи їх лізис. Специфічність зв'язування молекул локусу Е з 1а визначається внутрішніми властивостями молекули HLA-E.
Подібно до молекул антигену HLA-G, молекули антигенів HLA-E також виявляються на трофобластах, гальмують активність природних кілерів і розглядаються як компонент захисту від розпізнавання материнськими цитотоксичними лімфоцитами; за певних умов антигени HLA-E можуть активувати природні кілери.
Якщо в ендоплазматичному ретикулумі немає основного пептиду, молекули локусу Е втрачають стабільність і деградують ще до досягнення поверхні клітини. Якщо в клітинах відбуваються зміни (внаслідок влучення інфекції, злоякісної трансформації), знижується експресія А, В, С або інгібується активність ТАР, молекули локусу Е також можуть не досягати поверхні.
Молекулярні механізми визначення функції антигенів локусу Е підлягають подальшому вивченню. Однак за наявності низки нез'ясованих питань є дані про сувору залежність між експресією антигенів локусу Е та ко-експресією в2m.
Як зазначалося, описаний ще один локус молекул антигенів I класу головного комплексу гістосумісності - локус F. Інформація про цей локус дуже обмежена, а порівняльне дослідження експресії антигенів локусу F у мавп та людини показало, що він виявляється тільки у людини. Даних про роль молекул локусу F у розпізнаванні пухлинних антигенів немає.
Закінчуючи виклад даних про класичні та некласичні молекули, не можна залишити без уваги і нещодавно отримані факти, що розчинні форми як класичних, так і некласичних молекул, зокрема HLA-G, можуть індукувати апоптоз активованих СD8+Т-лімфоцитів.
Вивчення цієї апоптозиндукуючої здатності щодо активованих СD8+Т-лімфоцитів показало, що їх зв'язування з розчинними формами як класичних, так і некласичних антигенів призводить до посилення Fas/FasL-взаємодії, секреції розчинної форми FasL СD8+Т-лімфоцитами, цих клітин.
Автори припускають, що розчинні форми зазначених антигенів виконують імунорегуляторну роль у різних умовах, включаючи і ряд захворювань, що характеризується активацією клітин системи імунітету та підвищенням рівня sHLA-A, sHLA-B, sHLA-C, sHLA-G у сироватці крові.
Для розуміння значення експресії антигенів І класу ГКГ важливим є факт, згідно з яким рівень експресії антигенів ГКГ по-різному впливає на індукцію цитотоксичності різних кілерних клітин. Так, для оптимального лізису пухлинних клітин ЦТЛ необхідний високий рівень антигенів I класу ГКГ, у той час як ефективний лізис іншими кілерними клітинами, зокрема природними кілерами, може здійснюватися і при низькому рівні зазначених антигенів головного комплексу гістосумісності, що показано в дослідах з аденокарцином мишей.
Зміни експресії антигенів ГКГ
Зміни експресії антигенів ГКГ (переважно зниження) виявлено при багатьох передпухлинних станах, що особливо виразно проявляється у антигенів І класу ГКГ. Причини цього зниження можуть бути різні: мутації відповідних генів, що контролюють експресію антигенів I класу ГКГ, порушення регуляції презентації антигенів за участю антигенів I класу ГКГ, інгібіція гліколізування або транспорту молекул I класу головного комплексу гістосумісності, мутації в ТАР- в2m, зміна у структурі хроматину антигенів І класу ГКГ, експресія онкогенів та зниження рівня експресії молекул ГКГ під впливом вірусів та ін.Достатня кількість даних показує, що зниження рівня експресії антигенів І класу ГКГ часто спостерігається при таких передпухлинних патологіях, як дисплазії, кандиломи, папіломи. Однак це спостерігається не при всіх передпухлинних станах. Наприклад, при кондиломах, раку шийки матки, молочної залози, гортані та наявності відповідних генетичних та морфологічних змін експресія антигенів головного комплексу гістосумісності І класу не порушена.
Більше того, у деяких випадках, наприклад, при аденомах кишечника, які, як відомо, характеризуються акумуляцією таких онкогенів, як k-ras, експресія антигенів гістосумісності не змінена. Наявність експресії антигенів I класу ГКГ у багатьох випадках поєднується зі сприятливим прогнозом, наприклад, при раку молочної залози, гортані та ін.
Різні дисплазії, що супроводжуються зниженням експресії антигенів І класу ГКГ, зокрема з локалізацією в шийці матки, органах дихального та шлункового тракту, нерідко поєднуються із зменшенням експресії адгезивних молекул, важливих для міжклітинних взаємодій при формуванні протипухлинного імунітету.
Загальне уявлення про динаміку експресії антигенів I класу ГКГ на нормальних клітинах, при передпухлинних станах, а також злоякісно трансформованих клітин різних органів дає схема 1.

Схема 1. Експресія антигенів І класуголовного комплексу гістосумісностіу динаміці формування злоякісного фенотипу
Рівень експресії антигенів ГКГ I класу знижується значніше в міру розвитку пухлинного процесу, про що свідчать багато спостережень. Нерідко зменшення кількості цих антигенів асоціюється з вислизанням пухлини з-під імунологічного контролю, раннім метастазуванням, десимінацією процесу, що відмічено при меланомах, раку носоглотки, кишечнику.
Це пояснює, чому в багатьох випадках спостерігається паралелізм між порушеннями в генах, що кодують експресію антигенів ГКГ, особливостями перебігу пухлинного процесу та ефективністю імунотерапії, точкою застосування якої є Т-лімфоцити. Такий висновок підтверджують спостереження, згідно з якими збільшення частоти порушення експресії антигенів I класу ГКГ може поєднуватися або з відсутністю ефекту імунотерапії, або швидким рецидивуванням захворювання.
Ці спостереження свідчать про можливість того, що в основі посилення та поширення пухлини лежить селекція пухлинних клітин, які набувають здатності уникати імунологічного розпізнавання у зв'язку з порушеннями експресії антигенів головного комплексу гістосумісності.
Різний характер зменшення експресії антигенів окремих локусів ГКГ І класу демонструють дослідження, проведені із клітинами інвазивного раку прямої кишки. Дослідження показали, по-перше, загальну високу частоту зниження експресії цих антигенів (до 40 %) та високу частоту їх ушкодження (до 73 %), по-друге, виявлено локус-специфічні відмінності у пошкодженні: HLA-А та HLA-B - відповідно у 9 та 8 %, паралельне пошкодження HLA-A та HLA-B – у 2 % та не відзначено змін в експресії HLA-C-локусу.
Високу частоту порушення експресії антигенів I класу ГКГ при інвазивному раку прямої кишки автори розглядають як сприятливу умову вислизання пухлини з-під імунологічного контролю.
Зниження рівня антигенів I класу ГКГ може бути різним - повним, локусспецифічним або алелеспецифічним. Виявлено, що у багатьох випадках зменшення експресії антигенів І класу пов'язане з формуванням резистентності пухлинних клітин до лізису кілерними клітинами.
Незважаючи на те, що зниження рівня експресії антигенів I класу головного комплексу гістосумісності пухлинними клітинами різного гістогенезу та локалізації спостерігається в переважній більшості випадків, можливі й винятки - експресія не зменшується, а в окремих випадках рівень експресії підвищується.
Проте привертає увагу такий важливий факт: у ряді випадків за відсутності змін в експресії молекул антигенів ГКГ або навіть при її посиленні протипухлинний імунологічний захист не формується.
Така нестандартна ситуація викликає природне питання: чому при незначному зниженні рівня експресії антигенів ГКГ, відсутності змін і навіть посиленні експресії протипухлинна імунологічна відповідь таки не розвивається?
Причини цього можуть бути різні та будуть розглянуті у наступних розділах. Однак дуже важливо мати на увазі, що відсутність формування протипухлинного імунітету ще не означає, що процес розпізнавання не відбувся. На жаль, є переконливі докази того, що в деяких випадках процес розпізнавання призводить до індукції іншої форми імунологічної відповіді – толерантності.
При тому, як правило, для представлення антигенів пухлини необхідні експресія антигенів ГКГ і процесинг пухлинних антигенів є спостереження, згідно з якими ослаблення процесингу та експресії антигенів I класу головного комплексу гістосумісності не завжди є перешкодою для лізису пухлинних клітин відповідними лімфоцитами.
Такі дані отримано при дослідженні клітин нейробластоми з дуже незначним рівнем експресії антигенів І класу ГКГ. Однак навіть цього рівня виявилося достатньо для розпізнавання за умови, що клітини пухлини були інфіковані вірусом грипу.
Така чутливість клітин нейробластоми до дії кілерних лімфоцитів дозволяє характеризувати її як пухлину, чутливу до імунотерапії. При всьому інтересі до цих даних виникають питання, на які сьогодні немає відповідей.
Наприклад, чи можна проводити паралель між такими умовами лізису пухлинних клітин та можливістю лізису неінфікованих пухлинних клітин зі зниженою експресією антигенів І класу ГКГ? Чи можна визначити мінімальний поріг експресії антигенів ГКГ, що спричиняє індукцію імунологічної відповіді?
При дослідженні частоти зміни експресії антигенів різних локусів головного комплексу гістосумісності I класу показано, що найбільше часто спостерігається зменшення кількості молекул HLA-A, а потім HLA-B; рідше має місце паралельне зниження експресії антигенів двох чи трьох локусів.
Узагальнюючи результати вивчення експресії антигенів I класу ГКГ з урахуванням їхнього клінічного значення можна зазначити таке:
1. Існує достовірна негативна кореляція між зниженням експресії антигенів І класу ГКГ та пухлинною прогресією при багатьох пухлинах – первинній карциномі молочної залози, раку кишечника, шийки матки, ротової порожнини та гортані, сечового міхура, меланомі.
При цій вираженій загальній закономірності відомі поодинокі винятки, які виявляються не тільки у посиленні експресії антигенів I класу ГКГ, але навіть у появі цих антигенів на тих клітинах, які до цього їх не експресували, що спостерігалося при деяких пухлинах м'язової тканини, зокрема при рабдоміосаркомі .
2. Різке зниження рівня експресії антигенів І класу часто збігається з раннім метастазуванням, що особливо характерно для клітин меланоми, у яких зазвичай спостерігається виражений дефіцит експресії антигенів I класу головного комплексу гістосумісності.
3. Існує кореляція між ступенем диференціювання пухлинних клітин та рівнем експресії антигенів І класу ГКГ – ступінь диференціювання зменшується у міру зниження рівня експресії.
Ці дані підтверджені при паралельному вивченні експресії різних локусів ГКГ і даних гістологічних досліджень, які показали, що найбільш слабка експресія антигенів I класу ГКГ поєднувалася з низькою диференціюванням пухлинних клітин, їх вираженою інвазивністю і великою метастатичною активністю, що особливо виразно проявилося при вивченні клітин. .
4. Інтенсивність зниження експресії антигенів I класу головного комплексу гістосумісності варіює залежно від локалізації пухлини та вихідного рівня експресії цих антигенів: клітини скелетних м'язів і слизової оболонки шлунка можуть бути віднесені до клітин, що слабко експресують антигени I класу ГКГ, а їх не експресують.
5. Нерідко зниження рівня експресії антигенів ГКГ асоціюється зі слабкою імуногенністю пухлинних клітин.
6. При багатьох пухлинах людини, особливо при меланомі, рівень експресії ТАР-1 та ТАР-2 зменшувався також LMP, що обумовлено або їх структурними ушкодженнями, або дисрегуляцією та асоціюється зі швидким метастазуванням.
7. Зниження рівня експресії антигенів головного комплексу гістосумісності з повною основою вважають однією з найважливіших причин вислизання пухлини з-під імунологічного контролю.
8. Принципово важливою є необхідність урахування особливостей експресії антигенів І класу ГКГ до початку імунотерапії, що, на думку багатьох авторів, може суттєво зумовити її ефективність, зокрема вакцинації пухлинними пептидами.
Бережна Н.М., Чехун В.Ф.
ГЕНЕТИКА ГОЛОВНОГО КОМПЛЕКСУ ГІСТОСУМІСНОСТІ
МНС (Major Histocompatibility Complex) – головний комплекс гістосумісності – система генів, що кодують антигени, що визначають функціонування імунної системи
HLA (Human Leucocyte Antigen) – головний комплекс гістосумісності людини
Історія відкриття
Відкриття МНС.
Нобелівська премія 1980
Жан Доссе
Відкрив перший антиген гістосумісності людини (HLA)

Джордж Снелл
Відкрив антигени гістосумісності у миші (комплекс Н-2)

Барух Бенацерраф
Відкрив гени імунної відповіді (Ir-гени)
Функції МНС
- · Розпізнавання «свій – чужий» – реакція відторгнення трансплантата, РТПХ (реакція трансплантат проти господаря)
- · Регуляція взаємодій клітин імунної системи – рестрикція залучення до імунної відповіді лімфоцитів, через презентацію АГ
- · Регуляція сили імунної відповіді на антиген - гени імунної відповіді (Ir) - від англ. immune response
ХАРАКТЕРИСТИКИ МНС
Гени комплексу MHC (на відміну генів TCR і Ig) не піддаються рекомбінації.
Механізм їх пристосування до варіабельності (необмеженої множини потенційних АГ) полягає в їх генетичному поліморфізмі, полігенності та кодомінантному типі спадкування

ПОЛІМОРФІЗМ
Існування великої кількості різних специфічностей HLA-генів у межах кожного локусу. Гени відрізняються між собою за нуклеотидними послідовностями, що входять до варіабельної ділянки ДНК.
ПОЛІГЕННІСТЬ
Наявність кількох неалельних близькозчеплених генів, білкові продукти яких подібні у структурному відношенні та виконують ідентичні функції
ПОЛІГЕННІСТЬ і ПОЛІМОРФІЗМ
Система HLA включає гени
1 класу: А, В, З; 2 класи: DR, DP, DG

ГЕНЕТИЧНА КАРТА МНС
Номер хромосоми людина – 6р 21.1-21.3
Гени MHC поділяються на три групи.
Кожна група включає гени, що контролюють синтез поліпептидів одного з трьох класів MHC


· MHC-I клас
Гени груп HLA-A, HLA-B та HLA-C кодують молекули MHC класу I.
· MHC-II клас
Гени груп HLA-DP, HLA-DQ та HLA-DR кодують молекули MHC класу II. гістосумісність генетичний поліморфізм вірусний
- · MHC-III позначає область між MHC-I і MHC-II, тут картовані гени, що кодують деякі компоненти системи комплементу (C4a і C4b, С2, фактора В), цитокінів - (TNF-б та лімфотоксину), 21-гідроксилази (ферменту , що бере участь у біосинтезі стероїдних гормонів) та ін.
- · Некласичні гени не належать до жодного з класів MHC. Описано 6 таких генів в області розташування генів MHC-I (Е, F, G, Н, J, X), і 6 - в області MHC-II (DM, DO, CLIP, TAP, LMP, LNA)
СПАДЧИНА МНС
Гени MHC кодомінантні, тобто. одночасно експресуються гени материнської та батьківської хромосом. Генів MHC-I по 3 (А, В, С) у кожній з гомологічних хромосом, генів MHC-II - також по 3 (DP, DQ, DR); отже, якщо в матері та батька немає однакових алелів, то кожна людина має як мінімум 12 різних основних алелей кожного гена MHC класів I та II, разом узятих.
Кодомінантність

Відомо близько 2000 алельних генів.
Алелі HLA I класу – понад 900
Алелі HLA II класу – понад 600

Продукти генів МНС відіграють центральну роль у розпізнаванні «свій-чужий» при імунному реагуванні
БУДОВА
класичних МНС
Клас I
Клас II
ЛОКУСИ ЛОКУСИ
А, В, DP, DQ, DR
МНС І класу

Молекула І класу складається з 2-х ланцюгів. Тяжкої б-ланцюга та легкої в2-мікроглобуліну
б-ланцюг, що включає три фрагменти: позаклітинний, трансмембранний і цитоплазматичний.
Позаклітинний містить 3 домени - б1, б2 та б3. Зв'язування антигенного пептиду відбувається в щілини, утвореній б1-і б2-доменами.
Екзонна організація генів, що кодують б-ланцюг молекул І класу
- 1 екзон, що кодує сигнальний пептид,
- 4 екзони, що кодують 3 зовнішніх і трансмембранні домени,
- 2 екзони, що кодують невеликий цитоплазматичний домен
Експресія та функції МНС 1 класу
Експресія антигени представлені на всіх клітинах, тканинах та органах, тому вони є головними трансплантаційними антигенами.
- · Реакція відторгнення трансплантата;
- · Рестрикція активності цитотоксичних реакцій Т-кілерів.
Презентація АГ
MHC-I «обслуговують» зону цитозолю, що повідомляється через ядерні пори з вмістом ядра. Тут відбувається фолдинг синтезованих білкових молекул.
У разі виникнення помилок (зокрема і за синтезі вірусних білків) білкові продукти розщеплюються в мультипротеазних комплексах (протеосоми). Пептиди, що утворюються, зв'язуються з молекулами MHC-I, які представляють T-лімфоцитам внутрішньоклітинно утворюються пептидні АГ. Тому CD8+ T-лімфоцити, які розпізнають комплекси АГ з MHC-I, беруть участь у першу чергу у захисті від вірусних, а також внутрішньоклітинних бактеріальних інфекцій.
Етапи підготовки вірусних білків до взаємодії з молекулами І класу головного комплексу гістосумісності

І етап – руйнування вірусних білків, що знаходяться в цитозолі, за допомогою протеазного комплексу – протеосоми.
II етап - транспорт пептидів, що утворилися, у внутрішній простір ендоплазматичного ретикулуму за допомогою ТАР-1 і ТАР-2, що утворюють гетеродимер на ендоплазматичній мембрані.
III етап - зустріч пептидів, що транспортуються, з молекулами I класу МНС. Взаємодія пептиду з молекулою І класу призводить до від'єднання калнексину. Комплекс пептид, що утворився: молекула I класу готовий до подальшого транспорту до плазматичної мембрани.
IV етап - комплекс через апарат Гольджі транспортується до клітинної поверхні, вірусний пептид у комплексі з молекулою І класу МНС стає доступним (імуногенним) для його розпізнавання TCR
МНС II класу
Молекула II класу гетеродимер із двох нековалентно зв'язаних ланцюгів б і в, кожна з яких включає два домени: б1, б2 та в1, в2 (відповідно). Антигензв'язуючу область утворюють б1-і в1-домени.
Екзонна організація генів, що кодують б і в-ланцюги молекул II класу
- 1 екзон кодує лідерну послідовність.
- 2 і 3 екзони - перші (б-1 або в-1) та другі (б-2 або в-2) зовнішні домени відповідно.
- 4 екзон кодує трансмембранну ділянку та частину цитоплазматичного фрагмента.
- 5 і 6 екзон – цитоплазматичний «хвіст»
Експресія та функції МНС II класу
Експресія антигени представлені на макрофагах, В-лімфоцитах та активованих Т-лімфоцитах.
Реакція трансплантат проти господаря
Рестрикція взаємодій:
- · Т-h1
- · Т-h2
MHC-ІІ. Зона «обслуговування» пов'язана з позаклітинним середовищем та з клітинними органоїдами (апарат Гольджі, ЕПС, лізосоми, ендосоми та фагосоми).
Пептиди, що утворюються в цій зоні, мають позаклітинне походження – це продукти протеолізу білків, захоплених клітиною у вигляді ендоцитозу або фагоцитозу. Молекули MHC-II за допомогою кальнексину експонуються всередину везикул (ендосом або фаголізосом) і тільки тут, зв'язавшись з пептидною артеріальною гіпертензією, приймають необхідну конформацію для подальшої експресії на мембрані клітини.
Таким чином, молекули MHC-II здійснюють подання артеріальної гіпертензії при розвитку імунних реакцій на позаклітинні інфекції. Головну роль цих реакціях грають CD4+ T-лімфоцити, що розпізнають АГ в комплексі з MHC-II. Етапи підготовки вірусних білків до взаємодії з молекулами ІІ класу головного комплексу гістосумісності.
І етап – поглинання бактерій або їх токсинів фагоцитуючої, здатної до презентації антигену клітиною та руйнування захопленого матеріалу до окремих пептидів у фаголізосомах.
II етап - у внутрішньому просторі ЕПР відбувається складання молекул II класу, які до зустрічі з пептидом комплексовані з інваріантним ланцюгом (Ii). Цей білок захищає молекулу ІІ класу від випадкової зустрічі з бактеріальними пептидами в ендоплазматичному ретикулумі. Комплекс молекули ІІ класу з ІІ залишає ендоплазматичний ретикулум у складі вакуолі.
III етап - вакуоль, що містить комплекс молекули ІІ класу з ІІ, зливається з фаголізосомою. Протеази руйнують білок Ii і знімають заборону на взаємодію МНС II з бактеріальними пептидами. Комплекс пептид + МНС II у складі секреторної вакуолі переміщається до мембрани. Результат - експресія АГ пептиду в комплексі з МНС класу II на клітинній поверхні.
Це забезпечує доступність АГ пептиду для TCR Т-клітин.
ПОРІВНЯННЯ МНС І та ІІ класу
Будова молекул HLA класу II важливо схоже з будовою молекул I класу, попри відмінність у складі їх субъединиц.
ТМ – трансмембранний домен, ЦИТ – цитоплазматичний домен, ВК – позаклітинний домен
Експресія на клітинній мембрані
Зміст теми "Фактори неспецифічної резистентності організму. Інтерферон (іфн). Імунна система. Клітини імунної системи.":Імунна система. Індуцибельні фактори захисту організму (імунна система). Головний комплекс гістосумісності (МНС першого та другого класу). Гени MHC I та MHC II.
Імунна система- сукупність органів, тканин та клітин, що забезпечують структурну та генетичну сталість клітин організму; утворює другу лінію захисту організму. Функції першого бар'єру на шляху чужорідних агентів виконують шкіра та слизові оболонки, жирні кислоти (що входять до складу секрету сальних залоз шкіри) та висока кислотність шлункового соку, нормальна мікрофлора організму, а також клітини, що виконують функції неспецифічного захисту від інфекційних агентів.
Імунна системаздатна розпізнавати мільйони різноманітних речовин, виявляти тонкі відмінності між близькими за структурою молекулами. Оптимальне функціонування системи забезпечують тонкі механізми взаємодії лімфоїдних клітин та макрофагів, що здійснюються при прямих контактах та за участю розчинних посередників (медіаторів імунної системи). Система має імунною пам'яттю, зберігаючи інформацію про попередні антигенні дії. Принципи підтримки структурної сталості організму («антигенної чистоти») ґрунтуються на розпізнаванні «свого-чужого».
Для цього на поверхні клітин організму є глікопротеїнові рецептори (Аг), що становлять головний комплекс гістосумісності - МНС[Від англ. major histocompatibility complex]. При порушенні структури цих Аг, тобто зміні «свого», імунна система розцінює їх як «чуже».
Спектр молекул МНСунікальний для кожного організму та визначає його біологічну індивідуальність; це і дозволяє відрізняти «своє» ( гістосумісне) від «чужого» (несумісного). Виділяють гени та Аг двох основних класів МНС.
Головний комплекс гістосумісності (МНС першого та другого класу). Гени MHC I та MHC II.
Молекули І та ІІ класівконтролюють імунну відповідь. Вони поєднано розпізнаються поверхневими диференціювальними CD-Ar клітин-мішеней і беруть участь у реакціях клітинної цитотоксичності, що здійснюється цитотоксичними Т-лімфоцитами (ЦТЛ).
Гени MHC I класувизначають тканинні Аг; Аг класу МНС Iпредставлені на поверхні всіх клітин, що містять ядро.
Гени MHC II класуконтролюють відповідь до тимузалежних Аг; Аг класу II експресуються переважно на мембранах імунокомпетентних клітин, включаючи макрофаги, моноцити, В-лімфоцити та активовані Т-клітини.
ГОЛОВНИЙ КОМПЛЕКС ГІСТОСУМІСНОСТІ (ГКГ), комплекс генів, що кодують білки, відповідальні за подання (презентацію) антигенів (дивися Антигенпредставляючі клітини) Т-лімфоцитам при імунній відповіді. Спочатку продукти цих генів були ідентифіковані як антигени, що зумовлюють сумісність тканин, що визначило назву комплексу (від англійської major histocompatibility complex). У людини антигени ГКГ (і сам комплекс) називаються HLA (від англійського human leukocyte antigens), оскільки вони були виявлені на лейкоцитах. Комплекс HLA локалізується у 6-й хромосомі та включає понад 200 генів, розділених на 3 класи. Розподіл на класи обумовлено особливостями структури кодованих ними білків і характером імунних процесів, що викликаються. Серед генів перших двох класів є звані класичні гени, котрим характерний надзвичайно високий поліморфізм: кожен ген представлений сотнями алельних форм. До класичних генів ГКГ людини відносяться HLA-гени А, В, С (клас I), гени DR, DP та DQ (клас II). Гени ГКГ класу III кодують білки, що не мають відношення до гістосумісності та презентації антигену. Вони контролюють освіту факторів системи комплементу, деяких цитокінів, білків теплового шоку.
Кінцеві продукти генів ГКГ представлені глікопротеїни, які вбудовуються в мембрану клітин. Глікопротеїни ГКГ класу I присутні в клітинних мембранах практично всіх клітин, що містять ядро, а глікопротеїни класу II - тільки в антигенпрезентуючих клітинах (дендритні клітини, макрофаги, В-лімфоцити, деякі активовані клітини). У процесі утворення глікопротеїнів ГКГ класу I до їх складу вбудовуються фрагменти внутрішньоклітинних білків, що утворюються в ході протеолізу, а у разі класу II - білків міжклітинного простору, що поглинаються клітиною. Серед них можуть бути компоненти патогенних мікроорганізмів. У складі глікопротеїнів ГКГ вони виносяться на поверхню клітини та розпізнаються Т-лімфоцитами. Цей процес називається презентацією антигену: чужорідні антигенні пептиди представляються цитотоксичними Т-клітинами у складі глікопротеїнів ГКГ класу I, Т-хелперам – у складі глікопротеїнів ГКГ класу II.
Продукти різних алельних форм генів ГКГ відрізняються спорідненістю до різних пептидів. Від того, які алелі генів ГКГ є в даному організмі, залежить ефективність захисту від того чи іншого патогену. Вона визначається зв'язуванням чужорідних пептидів з глікопротеїнами ГКГ класу II, оскільки їх презентація Т-хелперам є основою всіх форм імунної відповіді. У зв'язку з цим гени ГКГ класу II розглядаються як гени імунної відповіді (генів Ir).
У певних ситуаціях імунна відповідь може бути викликана в результаті презентації фрагментів пептидних власних білків організму в складі молекул ГКГ класу II. Наслідком цього може бути розвиток аутоімунних процесів, який також знаходиться під контролем генів ГКГ класу II.
Визначення класичних генів ГКГ (ДНК-типування) здійснюється за допомогою полімеразної ланцюгової реакції при пересадці органів і тканин (для підбору сумісних пар донор – реципієнт), у судово-медичній практиці (для заперечення батьківства, ідентифікації злочинців та жертв), а також у геногеографічних дослідженнях (для вивчення родинних зв'язків та міграції народів та етносів). Дивись також імунітет.
Ярилін А. А. Основи імунології. М., 1999; Devitt Н. О. Розкриваючи роль великої histocompatibility complex in the immune response // Annual Review of Immunology. 2000. Vol. 18; Хаїтов Р. М., Алексєєв Л. П. Фізіологічна роль головного комплексу гістосумісності людини // Імунологія. 2001. №3.