Горчичен газима изразено локално и резорбтивно свойство. Характеризира се със следните характеристики:
няма дразнещ ефект по време на контакт;
свикване с миризмата му, когато човек престане да мирише на горчица (чесън) след няколко минути;
наличието на скрит период;
възпалително-некротични процеси в тъканите, в които прониква иприт;
бавни възстановителни процеси и често присъединяване на вторични инфекции;
свръхчувствителност към многократно излагане на иприт.
В случай на контакт с течен иприт върху кожатабързо се разтваря в липидната смазка на кожата. Ако дегазирането не се извърши в рамките на 5 минути, ипритът прониква в дълбоките слоеве на епидермиса, като се натрупва главно в мастните жлези и космените фоликули на кожата. В зони с по-тънка и деликатна кожа и голям брой мастни и потни жлези (кожа на шията, гърдите, подмишниците и др.) лезиите са по-изразени. Доза от 0,05 mg/cm2 причинява еритема за 5 минути, доза от 0,1-0,25 mg/cm2 при същите условия причинява образуване на мехури.
скрит период- 2-6 ч. След това се появяват признаци на кожни лезии (зачервяване, сърбеж, подуване). Първоначално се появяват малки мехурчета, пълни с бистра течност. Увеличавайки обема си, мехурчетата се сливат и образуват по-големи. Максималното развитие на мехурчетата е в края на 1-2 дни (в зависимост от дозата иприт). Тогава черупката на мехурите се счупва и се появяват язви, които често се инфектират и заздравяват бавно (седмици, месеци). На мястото на язви, като правило, се образуват белези, които в областта на ставите могат да ограничат подвижността и да нарушат тяхната функция.
двойки ипритпри токсични дози от 0,1-0,3 mg-min / l причиняват еритема; 0,2-1,0 mg-min / l - мехури и 0,75-1,5 ml * min / l - тежки кожни лезии с образуване на множество мехури. Симптомите обикновено се развиват след няколко часа. Първо се появява зачервяване, последвано от пигментация, напомняща слънчево изгаряне; след това - мехури, на чието място се образуват язви след 2-3 дни. Под действието на пари и аерозоли от иприт са възможни лезии на голяма площ, което обикновено е придружено от изразен резорбтивен ефект.
Очите са най-чувствителни към действие иприт. Токсичните дози иприт, равни на 0,07 mg-min / l, причиняват леко увреждане на очите (конюнктивит); 0,1 mg-min / l - увреждане на очите със зрително увреждане и 0,2 mg-min / l - тежко зрително увреждане с увреждане. Симптомите на лезията се развиват след 1-2 ч. Първоначално има неприятно усещане за наличие на чужд предмет в очите („усещане на пясък в очите“), след това сълзене, фотофобия, зачервяване и подуване на клепачите, което обикновено са залепени заедно с обилно гноен секрет. По правило зрението се влошава. При умерени до тежки лезии настъпва възпаление на роговицата (кератит) с възможна болка и последващо замъгляване и дори некроза на роговицата. В тежки случаи може да има възпаление на цялата очна ябълка. Процесът достига най-високото си развитие на 2-5-ия ден. Възстановяването отнема седмици и месеци.
При вдишване на пари и аерозоли ипритхарактерна миризма на чесън (или миризма на горчица) обикновено се усеща при 0,0015 mg/l, но миризмата бързо се притъпява. Това е характерна особеност на действието на иприта: постепенно човек престава да мирише парите на иприта и при концентрация от около 1-10-3 mg / l, които са с 2 порядъка по-ниски от Cmax, възникват сериозни лезии . Симптомите на лезията, като правило, се отбелязват след 2-6 часа.В назофаринкса има усещане за "болка", кашлица и хрема. Кашлицата се влошава. Гласът става дрезгав, а понякога напълно изчезва - афонията се развива поради увреждане на гласните струни. Гласовите нарушения могат да продължат дълго време (понякога години).
При излагане на по-високи концентрации ипритзасегнати са по-дълбоките части на дихателните органи. Кашлицата произвежда обилна гнойна храчка. Температурата се повишава до 38 ° C и повече. Развива се задух. Най-често смъртните случаи настъпват на 2-4-ия и 7-9-ия ден след поражението. При благоприятен ход на заболяването възстановяването започва след 2-3 седмици. Най-честите усложнения са бронхит (хроничен), бронхиектазии, пневмосклероза, които са трудни за лечение.
Към храносмилателните органи ипритпогълнат чрез замърсена вода и храна. Латентен период - 1-3 часа в зависимост от дозата. След това има болки в епигастралната област, гадене, повръщане, диария (често с кръв). При тежки случаи е възможна перфорация на стените на стомаха и червата, последвана от развитие на перитонит.
Обикновено при повреда ипритима резорбтивен ефект.Промените в централната нервна система се проявяват в обща летаргия, депресия и сънливост. Те отбелязват понижаване на кръвното налягане и нарушение на сърдечната дейност, метаболизма (загуба на тегло - кахексия). Съставът на кръвта се променя: през първите дни се отбелязва левкоцитоза, в следващите дни - левкопения (до 2-3 хиляди левкоцити на 1 mm3).
През 1943г в италианското пристанище Бариизбухна експлозия на USS John Harvey, който носеше химически снаряди от горчица. Моряците бяха принудени да плуват в замърсена с горчица вода. При много, наред с поражението на кожата, резорбтивният ефект на иприта е силно изразен. Спасените моряци починаха през първите три дни със симптоми на тежка обща депресия и остра хипотония, подобна на състояние на шок. Вторият пик на смъртността се наблюдава на 8-9-ия ден, когато при засегнатите се развива тежка левкопения. Това е основната причина за смъртта - "вторични" инфекции и левкопения. По правило почти всички ветерани от Първата световна война, засегнати от иприт, умират през следващите десетилетия с диагнози хронична бронхопневмония, пневмосклероза и белодробни тумори. При поражение от иприт най-честите дългосрочни последици са загуба или загуба на тегло, белези по кожата, които могат да ограничат функциите на крайниците, пневмосклероза, бронхиектазии, левкопения, намален имунитет, повишена чувствителност към настинки и инфекциозни заболявания, онкологични заболявания.
Нямаше нито един баща на иприта, на когото би принадлежала съмнителната чест на подобно откритие. Този газ е открит дълго време - в продължение на почти сто години различни химици успешно го синтезират, но това не предизвика никакъв интерес, тъй като токсичните свойства на това вещество не бяха разкрити.
Ситуацията се променя през 1913 г. В лабораторията на немския химик Херман Фишер се разби колба с синтезиран газ. Инцидентът имаше две последствия. Първо, колегата на Фишър, англичанинът Ханс Кларк, отиде в болницата за два месеца. Второ, Фишер докладва за инцидента на Германското химическо дружество, което работи в тясно сътрудничество с германската отбранителна индустрия. Остава година до голямата война и генералите се интересуват от вредните свойства на този газ.
Също така отбелязваме, че този газ не получи веднага обичайното си име днес. Първоначално се нарича ЗАГУБЕН - по първите букви от имената на немските химици Ломел и Щайнкопф, които през 1916 г. са инструктирани да напомнят за формулата на новия газ и да постигнат възможността за бойното му използване на фронтовете. Химически чистият газ бил без цвят и мирис, но когато се произвеждал за военни цели, към него се добавяли примеси с мирис на горчица или чесън, така че впоследствие LOST бил наречен иприт.
... и иприт дойде
Зад думата „иприт“ стои цялата история на Западния фронт от Първата световна война. Първата световна война, също благодарение на класиците на европейската литература (ние, по очевидни причини, писахме много по-малко за нея), се свързва с безкрайни окопи, редици телени огради и мащабни битки, в които загиват стотици хиляди хора без видими промени на фронтовата линия.
Една от тези битки е битката при белгийския град Ипр на река Иперл. Прави впечатление, че именно тук за първи път са използвани химически оръжия - в самото начало на войната.
Битките край Ипр се водят от 1914 г., а за битките от различни години са използвани различни имена. Битките през лятото и есента са известни като битката при Passchendaele, на името на най-близкото село. Пасхендейл беше запомнен от участниците с непроходимата кал, в която засядаха хора и инструменти: местността беше мочурлива, а годината беше дъждовна. В местоположението на германските войски на разстояние няколко километра един от друг двама германци в войнишки униформи, непознати един с друг, чакаха заповедта за атака. Скоро те влязоха в световната история: те бяха Ерих Мария Ремарк и Адолф Хитлер.
По това време Русия се оттегли от войната и германците успяха да прехвърлят сили на Западния фронт. Те не пестиха усилия и пари, разчитайки на дългоочаквания пробив. И в нощта на 12 срещу 13 юли германската артилерия започва да обстрелва британски позиции с необичайни снаряди. Те избухнаха безшумно, изпускайки газ с аромат на горчица върху вражеските позиции. На мястото на първото приложение новият газ получи името си.
- лейтенант JW Brooke/IWM чрез Getty Images
От очите до ДНК
Тази нощ ипритът отрови около 2500 души, от които загинаха 87. Горчичният газ не винаги убива, само 5% от отровените умират. Но този газ причинява непоправими вреди на здравето на хората, правейки ги инвалиди.
Горчичният газ засяга предимно очите и кожата. Ако очите на жертвата не са защитени, те могат да ослепят, временно или завинаги. При контакт с иприт се образуват абсцеси по кожата, а ако попадне в белите дробове, води до тежки увреждания на дихателните пътища. В допълнение, съвременните изследвания показват, че ипритът е способен да предизвика промени в ДНК. Ето как хората, запознати с производството на иприт, описват ефектите на газа:
„Последствията се проявяват след няколко часа или ден: зачервяване на очите, увреждане на гласните струни, кашлица. След няколко дни почивка и лечение всички тези симптоми изчезнаха и след това всичко се повтаряше отново и отново. Въздействието на иприта се кумулира и като правило след няколко месеца се появява хроничен бронхит, последван от белодробен емфизем, бронхиални етази, склонност към чести пневмонии, нелечимо професионално заболяване и инвалидност.
Горчичният газ е в състояние тихо да се натрупва в тялото, той се усеща няколко часа след отравяне. През лятото ипритът запазва смъртоносните си свойства дори няколко дни след пръскането, а през есента и зимата може да чака жертвата със седмици.
страшен урок
По време на Първата световна война стана ясно: по-добре е да не се забърквате с газови оръжия, тъй като порив на вятъра може да превърне близката победа в ужасно поражение. Бойното използване на иприт обаче не приключи дотук. Горчичният газ е отровен от етиопци от италианските фашисти през втората половина на 30-те години, използван е от Саддам Хюсеин във войната срещу Иран, известни са и случаи на използване на този газ от бойци на ИД* в Сирия.
Най-известният инцидент, свързан с използването на иприт след Първата световна война, е бомбардировката от германците на италианското пристанище Бари през 1943 г., при която са разтоварени съюзнически кораби. Американците в тайна се опитаха да донесат значителен товар иприт на фронта. Германските бомбардировачи успяха да потопят транспорта за газ и в резултат на това значителен брой от цивилното население на Бари пострада от иприт.
Използването на иприт беше окончателно забранено след влизането в сила на Конвенцията за химическите оръжия през 1997 г. Към момента на подписването му в света са останали 17 440 тона иприт. Малко след подписването му 86% от световните запаси от иприт са унищожени и унищожаването му продължава и до днес.
*Ислямска държава (ИД) е терористична групировка, забранена в Русия.
Тази група съчетава предимно устойчиви, висококипящи течни вещества, един от характерните признаци на увреждане е възпаление на кожата на тялото в различна степен - от зачервяване до образуване на гнойни инфилтрати, които се превръщат в язви. Естествено, подобни токсични вещества засягат други системи на тялото в още по-голяма степен - по-чувствителни и по-деликатни от кожата: очите, вътрешните органи. Средствата с образуване на мехури имат и общ токсичен ефект поради абсорбцията им през кожата в кръвта. Някои представители на групата имат и известен дразнещ ефект върху лигавиците на очите и дихателните пътища.
Отровните вещества с образуване на мехури могат да причинят фатално отравяне на хора и животни. Като се има предвид осигуряването на съвременните армии с надеждни средства за индивидуална и колективна защита, чуждестранните военни експерти не си поставят за цел унищожаване на живата сила на противника с помощта на агенти за кожно блистер. Предназначени са предимно за временно, макар и продължително, извеждане от работа на работната сила. В същото време се решават задачите за сковаване на бойните действия на войските и изтощаване на живата сила. Първият от тях се дължи на способността на блистерните агенти да заразяват дълго време терен и местни обекти, оръжия и военна техника, тилни съоръжения и населени места. Второто се постига чрез високата кожно-резорбтивна пропускливост на ОМ, което налага необходимостта от пълна защита на тялото. Всички предмети, замърсени с блистери, изискват дегазиране.
За използване на блистерни агенти в чуждестранни армии са разработени химически артилерийски снаряди, експлозивни химически въздушни бомби и химически противопехотни мини.
Мехуриращият ефект се притежава от представители на различни класове органични съединения, сред които най-известни са халогенирани тиоетери, третични амини, първични арсини, оксими, кетони и естери на силни киселини. Въпреки такъв хетерогенен състав, веществата от тази група имат едно общо свойство - всички те са алкилиращи или ацилиращи агенти по отношение на съединения с атоми със свободни електронни двойки.
По този начин халогенираните тиоетери и третичните амини са способни да алкилират нуклеофилни кислородни, азотни и серни атоми в различни съединения с образуването на нови връзки елемент-въглерод - съответно етер C-O, амин C-N. сулфид C-S. Средствата за кожни мехури с алкилиращо действие са стабилни, запазват увреждащите си свойства за дълго време, признаци на увреждане от тях обикновено се появяват след определен период на латентно действие.
Ацилхалогенидите на някои двуосновни киселини, като фосгеноксим, и особено халогенидите на арсеновата киселина, имат ацилиращи свойства по отношение на нуклеофилните реагенти. Те ацилират съединения при кислородни, азотни или серни атоми, образувайки естерни, амидни или тиоетерни връзки с тях. Кожно-абсцесните агенти с ацилиращо действие са по-малко устойчиви от алкилаторите, техният токсичен ефект се проявява по-бързо, тъй като имат и каутеризиращ ефект.
Веществото HD (иприт) е от най-голям интерес сред агентите с блистерно действие. Вещество L (люизит), което може да се използва като компонент на тактически смеси, може да бъде от известно значение. Не можем напълно да изключим възможността за използване на някои представители на т. нар. азотни иприти (агенти HN1, HN2, HN3) за замърсяване на водоизточници.

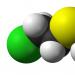
IPRIT - 2,2'-дихлороетил тиоетер
 Горчичен газ |
 Азотна горчица (агент HN3) |
 Люисит |
История.От така наречените ОВ с жълт кръст, бис-2-хлороетил тиоетер, наречен „изгубен“, е използван за първи път от германските войски през нощта на 12 срещу 13 юли 1917 г. в ожесточена битка за Ипр. Особеното значение на тази ОБ беше не само да направи засегнатите дълготрайно неработоспособни. С този нов ОВ беше прието средство за унищожаване, от което средствата за защита на дихателните пътища не защитаваха от вече известни ОВ. Поради специалните свойства на иприта да прониква в униформите и обувките и да причинява кожни лезии, вече в малки количества, атакуваните бяха принудени да предпазват цялото тяло от неговото въздействие.
Химическата стабилност и изключителните физически свойства, които осигуряват високата устойчивост на иприта, издигат това съединение до ранга на мощно отбранително средство, на което ограничената германска армия може ефективно да се противопоставя за дълго време на настъпателните планове на съюзниците.
През март 1918 г. германските войски изстрелват около 250 000 горчични мини по части от 3-та британска армия. Съюзниците успяват да използват иприт, овладян от индустрията, по линията на германската отбрана едва през юни 1918 г.
Загубите, понесени от иприт, са по-големи, отколкото от други ОВ. Според британски данни загубите им от иприт възлизат на 80% от общия брой на отровените ОВ; останалите 20% включват тези, засегнати от задушаващ OB и OB, дразнещ назофаринкса.
Полученият в чист вид бис-2-хлороетил тиоетер от Майер през 1886 г. е синтезиран още по-рано от други химици: през 1822 г. във Франция от Дюпре, през 1860 г. в Англия от Гътри и в Германия от Ниман. Те са получили това съединение чрез действието на етилена върху серен моно- или дихлорид. Вече Guthrie и Niemann установиха физиологичната активност на това вещество, въпреки че го получиха само в непречистена форма. И двамата химици отбелязват, че действието на тази течност и нейните пари върху кожата причиняват образуването на мехури. През 1891 г. немският офталмолог Лебер докладва за своите експерименти за изследване на ефекта на иприта върху очите и възпаленията, произтичащи от това.
 Алберт Ниман (20 май 1834 г., Госляр - 19 януари 1861 г., Госляр) Немски фармацевтичен химик, създател на иприт. През 1849 г. Ниман става чирак на аптекар в Гьотинген. През 1852 г., на 18-годишна възраст, той постъпва в Гьотингенския университет в катедрата по технология на фармацевтичните форми на Философския факултет. През 1858 г. той успешно издържа изпита за фармацевт и започва работа в лабораторията на Гьотингенския университет при професор Ф. Вьолер, който поставя две задачи на младия изследовател: да проведе химична реакция на серен хлорид с етилен и да определя химичния състав на листата от кока. И с двете задачи Ниман се справи блестящо. В първия случай той получава иприт (иприт), който е използван като химическо оръжие по време на Първата световна война. В резултат на първата газова атака на река Ипр загинаха 5000 души, а 15 000 останаха инвалиди. Докато провеждаше експерименти, самият Ниман се отрови, тъй като не знаеше нищо за токсичните свойства на иприта и не взе никакви защитни мерки. Страдащ от отравяне, той въпреки това успешно провежда изследване на листата на кока и през 1860 г. изолира алкалоид в чиста форма, който дава името "кока-ин" (вещество вътре в кока). Ниман описва специфичното изтръпване на езика след контакт с кокаин в дисертацията си „Върху нова органична основа, съдържаща се в листата на кока“. Той е представен за степен доктор по химия, но на 19 януари 1861 г. умира у дома в Гослар от пневмония на 26-годишна възраст, без да завърши обещаващата си научна работа. |
 Виктор Майер (Виктор Майер) (8 септември 1848 г., Берлин - 18 август 1897 г., Хайделберг) Учи химия в Хайделберг и Берлин. През 1871 г. е поканен да оглави катедрата по органична химия в Щутгартския университет. От 1872 до 1885 г. работи в Цюрихския политехнически институт. През 1885 г. Виктор Майер работи като професор в Гьотинген и накрая през 1889 г. в университета в Хайделберг. Виктор Майер разработи през 1878 г. метод за определяне на моларната маса на течни съединения с помощта на апарат, наречен на негово име, апаратът на Виктор Майер. Той също така открива органични нитросъединения, открива през 1882 г. ново вещество, което нарича тиофен, и за първи път го изолира в чист вид и описва физиологичното действие на иприта (горчичния газ, S-Lost). Измисли термина "стереохимия". Откритата от него реакция за синтеза на нитросъединения е кръстена на него. |
 Фредерик Гътри (Фредерик Гътри) (1833 - 1886) Британски научен писател и професор. През 1874 г. той става съосновател на Лондонското физическо дружество (сега Институт по физика) и е негов президент от 1884 до 1886 г. Гътри беше убеден, че науката трябва да се основава не на теория, а на експерименти. Гътри е първият, който описва ефектите на "горчичния газ" върху хората. Независимо от Алберт Ниман, той синтезира иприт през 1860 г., използвайки реакцията на етилен и серен дихлорид. Фредерик Гутри също е лингвист, драматург и поет. Пише под псевдонима Фредерик Черни. Синът му Фредерик Бикел Гътри беше земеделски химик. |
Малко преди Първата световна война англичанинът Кларк, ученик на Емил Фишер, изучава някои реакции на синтезиран от него бис-2-хлороетил тиоетер в Химическия институт на Берлинския университет.
Откакто ипритът е известен като агент, той е обект на научни изследвания. В допълнение към технологичните промени, методите за получаването му по принцип са се променили незначително. Методите, описани от Meyer, Guthrie и други, са доразвити и модифицирани за използване в промишлен мащаб.
Оттогава италианските фашисти са използвали иприт по време на окупацията на Етиопия, а по време на Втората световна война големи запаси от този ОМ са подготвени от много воюващи сили. Тя в никакъв случай не е загубила военното си значение, въпреки наличието на по-ефективни бойни глави. Възможностите за използването му в бой за осигуряване или възпрепятстване на бойни действия, както и за поставяне на бариери, са разнообразни, особено с помощта на съвременни средства за приложение.
Горчичният газ се счита за един от важните агенти и принадлежи към стандартните агенти на много армии.
Методи за получаване.Бис-2-хлороетил тиоетер може да се получи по различни начини: чрез хлориране на бис-2-хидроксиетил тиоетер (тиодигликол) с подходящи хлориращи агенти; директен синтез от етилен и серни хлориди; фотохимичен синтез от етиленхлорид и сероводород или 2-хлороетил меркаптан.
Методът за получаване от тиодигликол е използван и от Майер, който използва фосфорен трихлорид като хлориращ агент:
3S(CH 2 CH 2 OH) 2 + 2PCl 3 → 3S(CH 2 CH 2 CI) 2 + 2H 3 PO 3
По-късно Кларк заменя фосфорния трихлорид с хлороводород.
S (CH 2 CH 2 OH) 2 + 2HCl → S (CH 2 CH 2 CI) 2 + H 2 O
и Steinkopf et al. се препоръчва да се използва сулфурил хлорид или тионил хлорид:
S(CH 2 CH 2 OH) 2 + SOCI 2 → S(CH 2 CH 2 Cl) 2 + SO 2 + H 2 O
Тиодигликолът се получава по аналогия с общия метод за синтез на тиоетери чрез реакцията на алкилхалогениди, в този случай етилен хлорхидрин, със сулфид на алкален метал
2ClCH 2 CH 2 OH + Na 2 S → S(CH 2 CH 2 OH) 2 + 2NaCl
Или от етиленов оксид и сероводород:

Етилен хлорхидрин се получава чрез действието на хипохлорна киселина върху етилен или със същия успех от етиленов оксид и хлороводород:
CH 2 \u003d CH 2 + HOCl → CH 2 OH-CH 2 Cl

Директният синтез на иприт от етилен и серни хлориди (разработка на експериментални изследвания от Guthrie и Niemann) е избран по време на Първата световна война от съюзниците като най-удобен и бърз. Те използвали различни смеси от моно- и дихлоридна сяра и при това получили голям брой продукти, чиято смес приемали за чисто съединение.
Поуп извърши синтеза на иприт - от серен монохлорид и етилен при 70 ° C и равномерно енергично разбъркване, използвайки активен въглен като катализатор:
S 2 Cl 2 + 2CH 2 \u003d CH 2 → S (CH 2 CH 2 Cl) 2 + S
Индустриални методи за получаване.В голям индустриален мащаб производството на иприт се извършва по методите на Майер и Гътри. Възможен е промишлен фотохимичен синтез, който беше въведен във водещите страни за производство на органична материя във връзка с реорганизацията на такива предприятия.
Докато в Германия и по време на Първата и Втората световна война се използва предимно т. нар. тиодигликолов (оксолов) процес (модифицираният метод на Майер), производството на иприт във Франция, Англия и САЩ се основава на директен синтез от етилен и серни хлориди.
В процеса на оксол, бавен поток от сух хлороводород се прекарва в тиодигликола, за да замести хидроксилните групи. Реакторите и цялата комуникационна система на инсталацията са изработени от олово или оловно покритие. Това предотвратява образуването на железни соли. Процесът на хлориране се извършва при 50°C, като температурата се поддържа с помощта на отоплителни и охладителни системи. След пълно абсорбиране на хлороводород, полученият иприт, който има висока плътност, се отстранява от реактора и се изпраща за вакуумна дестилация, където водата се отдестилира при понижено налягане. Горчичният газ се пречиства чрез вакуумна дестилация или обработка с органични разтворители.
В сравнение с директния синтез, производството на иприт чрез тиодигликоловия процес е по-трудоемко, но води до по-високи добиви (95%) от продукта с по-добро качество.
Директният синтез на иприт, използван от съюзниците, е подложен на постоянни подобрения след Първата световна война. Процесът се състои от четири етапа: I) получаване на серен дихлорид от елементи; 2) приготвяне на разтвор на серен дихлорид във въглероден тетрахлорид; 3) добавяне на серен дихлорид към етилен чрез преминаване на етилен в разтвора, като по този начин се получава разреден разтвор на иприт; 4) отделяне на иприта от разтворителя за повторното му използване в процеса.
Всички тези четири производствени стъпки могат да се извършват непрекъснато в една стъпка. Реакторите, използвани от французите, са с височина 18 м. Те са направени изцяло от олово и са оборудвани със сложна система от охлаждащи намотки. Всяка такава гигантска колона имаше свой собствен масивен змиевиден кондензатор, изработен от сребро.
При преминаване на етилен в разтвора на въглероден тетрахлорид, реакционната температура се поддържа при 60-70°С. Етиленът трябва да бъде предварително изсушен и пречистен от алкохол. Добивът беше около 80%.
физични свойства.Чистият бис-2-хлороетил тиоетер е безцветна маслена течност без мирис. Техническите продукти са оцветени от примеси в цветове от жълто до тъмно кафяво и имат характерна сладка миризма. Под точката на изливане (13,5°С) тиоетерът кристализира като дълги безцветни ромбични кристали. С помощта на прецизни измервания точката на топене се настройва на 14,44-14,45°C; обикновено данните варират от 14,1-14,5°C. Техническата горчица се втвърдява при температура от 5 до 10°C.
Когато се нагрява до точка на кипене (около 217 ° C), ипритът се разлага с образуването на зловонни продукти, които миришат на горчица или чесън.
Произведеният в Америка иприт, така нареченият HD, има така наречената бала. 228°С, т.т. 14°C.
Горчичният газ е по-тежък от водата (d 20 1,2741). Поради известна повърхностна активност намалява повърхностното напрежение на водата и в малка степен се разстила върху нея на тънък слой, като маслен филм. Чрез добавяне на повече повърхностноактивни вещества, които се разтварят в иприт, ефективното разпръскване може да се увеличи. Налягането на парите на бис-2-хлороетил тиоетер е доста ниско (0,1 mmHg при 20°C).
Въпреки че с повишаване на температурата на въздуха съпротивлението на иприта намалява, но поради неговото изпарение въздухът се обогатява с пари иприт. В горещите безветрени дни се създава концентрация, която е почти 50 пъти по-висока от обичайно необходимата токсична концентрация. Дори при скорост на вятъра от 2 m/s и плътност на инфекцията около 5 g/m2, на открити площи парите на иприта са все още ефективни в продължение на 3-4 часа.
При температури под 15°C, особено в зараснали или силно залесени райони, заразата продължава повече от седмица. Под 4°C, при скорост на вятъра над 8 m/s, изпаренията на иприта във въздуха вече не са ефективни.
За да се повиши стабилността на иприта и по този начин неговата ефективност се добавят добавки, които повишават вискозитета му (т.нар. вискозни формулировки). Тези добавки гарантират не само дълготрайност на действие, но и затрудняват дегазирането, което в този случай е трудно осъществимо с водни дегазиращи разтвори. Увеличаването на вискозитета едновременно потиска образуването на аерозол и насърчава образуването на по-големи капчици (вместо дим) при пръскане от самолет.
Разтворимостта на бис-2-хлороетил тиоетер във вода е ниска, около 0,8 g/l. В органични разтворители - халоалкани, бензол, хлоробензен - се разтваря, както и в растителни или животински мазнини. Докато разтворимостта на ОВ в абсолютен етанол над 16°C е почти 100%, в 92% етанол достига едва 25%. Той има ограничена смесимост с разтворители като петрол и дизелово гориво и има области на несмесимост. При ниска температура само нискокипящи фракции, като лек бензин и петролев етер, могат да се използват за разтваряне на иприта, които са отлично средство за извличане на иприт.
Поради високата си дифузия ипритът бързо прониква през редица вещества и материали. Така течният иприт бързо прониква през тъкани, кожа, картон, хартия и тънка гума. Той бързо попива в порести нехомогенни материали като тухли, бетон, гола дървесина и стари напукани маслени покрития.
Химични свойства.При обикновена температура бис-2-хлороетил тиоетерът е стабилно съединение. При нагряване над 170 ° C се разлага с образуването на неприятно миришещи токсични продукти с различен състав. Над 500°C настъпва пълно термично разлагане. Краткотрайното нагряване дори над 300°C почти не води до образуване на продукти на разлагане, така че ипритът се счита за относително устойчив на детонация.
По отношение на металите при обикновена температура ипритът е инертен. Замърсеният продукт, обикновено съдържащ вода и хлороводород, ще корозира стоманата. Получените железни соли допринасят за корозия. Поради отделяните газове - водород, сероводород, етилен и други продукти на разлагането - трябва да се има предвид повишаването на налягането в затворени контейнери, мини, бомби и корабни контейнери.
Хидролиза.Във водни разтвори бис-2-хлороетил тиоетерът се хидролизира със заместване на хлорните атоми с хидроксилни групи. При наличие на излишък от солна киселина реакцията е обратима. Обикновено протича с образуването на нетоксичен тиодигликол:
Водата, съдържаща малки количества (~ I%) иприт, може да се дегазира чрез кипене в продължение на 15 минути. При температури под 0°C хидролизата продължава няколко дни. По-силно замърсената вода трябва да бъде подложена на обичайните методи за дегазиране и пречистване.
Поради хидролизата, концентрацията на иприт във въздуха след ден намалява с почти порядък.
Поради ниската разтворимост на бис-2-хлороетил тиоетер, в зависимост от наличното количество, водата се замърсява за дълго време, тъй като нови порции иприт постепенно дифундират във водата вместо хидролизиран иприт. Експериментите показват, че RH под вода остава ефективна в продължение на години, ако има малко или никакво смесване.
Тъй като OM е практически неразтворим във вода, хидролизата може да се случи само на самата граница. Бързата хидролиза задължително изисква енергично разбъркване. Ако смесването не е достатъчно, тогава, особено при използване на технически класове иприт, поради съдържащите се в него примеси и примеси, в резултат на странични реакции се образува трета фаза, в която ипритът е слабо разтворим и който предпазва и го „запазва“ от по-нататъшна хидролиза.
От казаното по-горе става ясно, че за постигане на пълна хидролиза е необходим голям излишък от вода и енергично разбъркване или нагряване, а още по-добре, ако и трите фактора са активни.
За да се пренесе хидролизата извън границата на фазите на хетерогенна система, е необходимо смесите да се хомогенизират, да речем, чрез добавяне на разтворители, които могат да се смесват както с вода, така и с иприт (метанол и др.). Такива добавки се използват по-специално при използване на водни дегазиращи разтвори.
Скоростта на хидролиза на бис-2-хлороетил тиоетер зависи от концентрацията на водородните йони - алкална среда допринася за това, докато киселинната предотвратява и забавя хидролизата.
Реакцията на бис-2-хлороетил тиоетер с амоняк, дори при температури над 150°C, е много бавна. Въпреки това, под налягане вече при 60 ° C, се образува 1,4-тиазан - безцветна течност, димяща във въздуха:

При първични амини в алкохолни разтвори при нормални условия се получава подобна циклизация на тиоетера.
Окисление.Като типичен представител на тиоетерите, ипритът може лесно да се окисли до сулфоксид или сулфон съгласно уравнението:
Като окислители са подходящи водороден пероксид, азотна киселина, калиев перманганат, хромова киселина, белина, хипохлорити и др.
Въпреки че продуктите на окисление на иприта - сулфоксид и бис-(2-хлороетил)-сулфон - са силно токсични съединения, а сулфоксидът има дори образуване на мехури, окисляването на иприта е една от важните реакции на дегазиране. Продуктите на окисление са твърди кристални вещества и следователно нямат кожно-резорбтивни свойства.
Под действието на силни окислители или при по-тежки условия реакцията излиза извън образуването на сулфоксид и сулфон и завършва с пълно разлагане на тиоетера.
Бис-2-хлороетил тиоетерът се окислява при 150°С с излишък от концентрирана HNO3 до сулфоксид. Реакцията е бърза и екзотермична. Може да отиде по-далеч - с отделянето на азотен диоксид и образуването на сулфон в крайна сметка:

Под действието на димяща азотна киселина и нагряване се образува например 2-хлороетансулфонова киселина ClCH 2 CH 2 SO 2 OH.
За да се получи бис-(2-хлороетил)-сулфоксид, бис-2-хлороетил тиоетер се добавя на капки при 20°С към концентрирана HNO3. Ако сместа се разреди с вода, сулфоксидът се утаява като бяла утайка, която се прекристализира от 60% етанол (безцветни люспи, т.т. 110°С).
Когато горчичният газ се третира с хромен анхидрид в оцетна киселина при 100°С (20 минути нагряване), се образува чист бис-(2-хлороетил)-сулфон, т.т. 55-56°С.
Сухата белина окислява главно иприта, но едновременно с това настъпва и хлориране. При определени условия тази бърза екзотермична реакция е придружена от запалване на нереагиралия тиоетер. Като продукти на реакцията бяха идентифицирани хлороводород, въглероден диоксид, серен диоксид, халоалкани (например дихлороетан, хлороформ), хлорал, серни хлориди и др. При използване на суспензия от белина реакцията протича по-спокойно с образуването на основно сулфоксид и сулфон .
Хипохлоритите във водни разтвори частично окисляват, частично хлорират бис-2-хлороетил тиоетер.
Хлориране.Под действието на хлор и до известна степен на други хлориращи агенти, като дихлорамин и сулфурил хлорид, се получават различни хлорирани тиоетери и сулфоксиди. По-долу са формулите на съединенията, получени чрез хлориране на иприт:

Всички с изключение на първото съединение, което е твърдо вещество (бели нестабилни игли), са течности. В зависимост от броя на хлорните атоми и тяхната позиция в молекулата, тези продукти на хлориране имат само слаба или никаква физиологична активност.
Реакции с хлорамини.Моно- и дихлорамините лесно реагират с бис-2-хлороетил тиоетер. Дихлораминът има предимството пред монохлорамина, че реакцията протича в хомогенна среда, тъй като дихлораминът е относително лесно разтворим в органични разтворители. Продуктите на реакцията са нетоксични.
Реакция с хексаметилентетрамин.Една от реакциите, важни за дегазирането на кожата, е ефектът на хексаметилентетрамин върху хидролизата на иприта, предложен от Brewer и Bouchereau. Освободеният по време на хидролизата хлороводород реагира с хексаметилентетрамин, за да образува формалдехид, който поради дъбилния си ефект спомага за локализирането и по-доброто заздравяване на горчични лезии по кожата. Използването на хексаметилентетрамин като стабилизатор на този ОМ се обяснява с подобна реакция.
Реакцията се изразява със следното уравнение:
2S (CH 2 CH 2 Cl) 2 + 10H 2 O + (CH 2) 6 N 4 → 2S (CH 2 CH 2 OH) 2 + 4NH 4 Cl + 6HCHO
Реакции с метални соли.Подобно на незаместените тиоетери, горчичният газ има способността да образува адукти с метални соли, така наречените сулфониеви соли. Получените комплекси понякога са трудно разтворими във вода и имат характерен цвят, в резултат на което са намерили приложение в качествен и количествен анализ.
Най-често се използват халогениди на тежки метали - йодид и живачен хлорид, хлориди на мед, цинк, титан, платина, паладий и злато.
Бис-2-хлороетил тиоетер образува сложно съединение със златен хлорид:
S (CH 2 CH 2 Cl) 2 + AuCl 3 → [Cl 2 AuS + (CH 2 CH 2 Cl) 2] Cl -
токсични свойства.Горчицата действа като контактна и инхалационна отрова; пари и капки иприт влияят на очите. Както вече беше споменато, поради високата разтворимост на иприта в липидите или резорбцията му във всички органи се появяват общи интоксикации, които са причина за общото му токсично действие.
Способността на иприта да прониква през кожата зависи от температурата. Скоростта на резорбция е пропорционална на повишаването на температурата: при 21-23°C е около 1,4·10 -3 mg/cm 2 ·min, при по-висока температура - около 2,7·10 -3 mg/cm 2 ·min. По време на този експеримент, проведен върху предмишницата, относителната влажност на въздуха, наситен с пари от иприт, беше около 46%. Количества RH от порядъка на 6·10 -3 mg, прониквайки през кожата, в 50% от случаите предизвикват образуването на мехури.
В 100% от случаите образуването на еритема се появява при доза иприт 0,01 mg/cm 2 от повърхността на кожата, малки мехури се образуват при 0,1-0,15 mg/cm 2, големи - при 0,5 mg/cm 2 .
Очите са засегнати от малки количества RH. И така, концентрацията от 1,2·10 -3 mg/l след 45 минути експозиция причинява фотофобия, спазъм на клепачите и възпаление на конюнктивата, продължаващи до 4 седмици. Възстановяването настъпва след 3 месеца. По-високите концентрации при по-ниска експозиция водят до опасно увреждане на очите.
При време на експозиция от 2-5 минути концентрация от 0,03 mg/l е смъртоносна, концентрации до 0,01 mg/l след излагане до 15 минути са много опасни, водят до кожни лезии и тежко възпаление на лигавицата на очите.
При подкожно инжектиране смъртоносната доза е 40-60 mg/kg телесно тегло.
Препратки
Иприт, бис (2-хлороетил) сулфид- органосярно съединение от състава (ClCH 2 CH 2) 2 S. Горчичният газ е получен за първи път от немския химик Виктор Меер през 1886г. Това е предшествано от работата на химиците Деспре (1822), Неман (1859), Гутман (1860), които изследват този клас съединения, но не го изолират в чиста форма.
Чистият иприт е безцветно маслено вещество без мирис (техническият иприт има мирис на чесън и горчица и жълто-кафяв цвят). Той е слабо разтворим във вода и неограничено в много органични разтворители.
По време на Първата световна война ипритът е използван като блистер. Международно обозначение на иприта като химическо оръжие — HD. Боеприпасите с иприт в Германия бяха маркирани с жълт кръст (той е част от бойната смес жълт кръст,Немски Гелбкройц,в САЩ те са кодирани с два зелени пръстена.
През 1993 г., в резултат на подписването на Конвенцията за химическите оръжия, използването на иприт като химическо оръжие беше забранено. Той беше включен в списък 1, който регулира производството и оборота на опасни вещества.
Срок ипритидва от името на белгийския град Ипр, близо до който през нощта на 13 юли 1917 г. това вещество е използвано за първи път от германските войски като химическо оръжие.
Токсичният ефект на иприта е да увреди очите, кожата и дихателните пътища. Симптомите на отравяне се появяват с латентен период от 2:00 часа, но при горещо време и мокра кожа се появяват веднага. Последицата от контакта с веществото е появата на везикули с жълтеникава течност, които се лекуват дълго време и оставят белези. При концентрация на иприт във въздуха от 0,03 mg/l смъртта настъпва в рамките на 2-5 минути.
Веществото бързо прониква в строителните материали, абсорбира се от текстил, гума, хартия, така че е възможно и отравяне при контакт със замърсени предмети.
Физически свойства
Чистият иприт е безцветна мазна течност с лек мирис на рициново масло, техническият продукт има жълт до тъмнокафяв цвят и остра миризма (чесън или горчица). Плътността на парите във въздуха е 3,5. Налягане на парите при 20 ° C - 0,072 mm Hg. Изкуство.
Точката на топене на чистото вещество е 14,5 ° C, а за технически иприт, поради наличието на примеси, е малко по-ниска. За да се предотврати замръзване по време на Първата световна война, към него са добавени хлоропикрин, хлоробензен, тетрахлорометан.
Слабо разтворим във вода (по-малко от 1%), безкрайно разтворим в масла, мазнини, бензин, керосин, ацетон, въглероден тетрахлорид, алкохоли, хлоропикрин. Смесва се с други токсични вещества: етилдихлорарзин, фенилдихлорарзин, люизит.
Летливост на иприта: 75 mg/m³ при 0°C (твърдо вещество), 610 mg/m³ при 20°C (течно), 2,860 mg/m³ при 40°C (течно).
Не предизвиква корозия при съхранение в алуминиеви съдове; месингът бързо корозира при температура от 65 ° C. Във влажен въздух индустриалният иприт с примеси, които се образуват в резултат на неговото разлагане (сероводород, хлороводород, етилен) причинява корозия на стоманата.
Касова бележка
Има три основни начина за синтезиране на иприт: с оксиран (етиленов оксид), етилен и винилхлорид.
Синтез с оксиранизвършва се при температура 80 ° C на два етапа: сулфониране със сероводород или хидросулфиди за получаване на тиодигликол и впоследствие - хлориране на съединението:
След вакуумна дестилация се получава иприт с чистота 95%. Добивът от синтеза е 90%. Този метод е осъществен за първи път от немския химик В. Меер през 1886г.
Синтез на иприт от етилени серни хлориди е разработен по време на Първата световна война и след нейния край. Преобладаващият метод на получаване е реакцията с SCl 2:
Серният хлорид (II) обикновено има примеси от дихлорополисулфид (S 2 Cl 2, S 3 Cl 2, S 5 Cl 2), така че крайният продукт може да бъде замърсен с хлоретилполисулфидам (ClCH 2 CH 2) 2 S x. Свободният хлор, присъстващ в реакционната смес, може да образува полихлорирани примеси.
Получаване на иприт с винилхлориде най-подходящият, като се има предвид лекотата на реакцията - протича вече при стайна температура (15-25 ° C):
Като инициатори на реакцията се използват органични пероксиди и ултравиолетово лъчение. Реакция в рамките на 10 минути с добив на продукт от около 75%. Когато се използва 1-меркапто-2-хлороетан HSCH 2 CH 2 Cl вместо сероводород, добивът от реакцията се приближава до 100%.
Химични свойства
Горчичният газ бавно се хидролизира до образуване на солна киселина и тиодигликол:
Той е слабо разтворим във вода, така че може да не изпитва хидролиза за дълго време. Процесът на хидролиза се ускорява от повишаване на температурата и наличието на алкали.
Една от най-важните реакции е действието на уротропина по време на хидролиза: продуктът от взаимодействието на създадената солна киселина с уротропин е формалдехид, който насърчава заздравяването на рани:
Под действието на силни окислители (калиев перманганат, хроматна киселина, азотна киселина, хипохлорити) сулфидът се окислява до сулфоксид, а след това до сулфон:
Въпреки че продуктите на окисление също са токсични вещества, този метод се използва за дегазиране, тъй като те са кристални вещества и не засягат кожата.
Подобно на други тиоетери, горчичният газ е способен да образува сулфониеви съединения с метални соли. Образуваните комплекси имат характерен цвят и понякога ниска разтворимост, поради което понякога се използват в аналитичната химия. По-често реакцията се извършва с халогениди на тежки метали: йодиди и хлориди на мед, цинк, титан, платина, аура:
токсичност
Горчичният газ действа върху човешкото тяло или е отрова за вдишване и контакт: капки и аерозоли от иприт засягат дихателните пътища, кожата и очите.
Веществото е в състояние да проникне в тялото през кожата. Тази способност зависи от температурата на околната среда: при 21-23 ° C проникването е 1,4 10 -3 mg / (cm² min), при високи температури - около 2,7 10 -3 mg / (cm² min). Проникването на иприт в количество 6 · 10 -3 в половината от случаите причинява появата на мехури. Образуването на малка еритема настъпва при доза 0,01 mg/cm от кожата, голяма – при доза от 0,5 mg/cm предизвиква възпаление на очите, спазми на клепачите, фотофобия, които продължават до 4 седмици.
Действието на иприта при концентрация 0,03 mg / l за 2-5 минути е смъртоносно. Концентрация от 0,01 mg / l е опасна в рамките на 15 минути и води до тежко увреждане на очите и кожата.
Контактът на иприта върху кожата първоначално не причинява дискомфорт. През първите 2-5 минути прониква в кожата, след това се разтваря в подкожната мазнина и впоследствие, след 20-30 минути, се абсорбира напълно и навлиза в кръвния поток. След абсорбиране настъпва латентен период с продължителност от 2 часа до ден, в зависимост от дозата, температурата и влажността на въздуха, структурата и влажността на кожата. При горещо време, с гореща, влажна кожа или нейните деликатни зони, периодът на латентно действие е значително намален и може да отсъства почти.
Първите признаци на увреждане след края на периода на латентно действие се проявяват под формата на сърбеж, парене и зачервяване на кожата (еритема) в точките на контакт с течен или газообразен иприт. Кожата се опъва, става суха и топла. При малки дози тези явления изчезват след няколко дни. При по-високи дози се развива подуване, по краищата на което 16-30 часа след контакт с отровата се появяват много малки мехурчета. В бъдеще те се сливат в голям или един голям мехур с безцветна или жълтеникава течност. Мехурите се чупят и по кожата се образуват болезнени синапени язви, чието зарастване може да продължи повече от 2 месеца. Вторичната инфекция може да доведе до гнойно възпаление на засегнатите участъци от кожата. Белезите остават на мястото си.
Защита
Основната защита срещу иприт, по-специално очите, лицето и дихателните пътища, е противогаз. След контакт с памучно облекло, ипритът напълно го импрегнира за 3:00 часа, което допълнително може да доведе до допълнителни щети. За да се предотврати попадането на съединението върху и под дрехите, се използват специални защитни костюми.
Окислители и хлориращи агенти (хипохлорити, белина, хлорамиди) се използват за третиране на кожата (отстраняване на малки капки иприт), дрехи или предмети, които са влезли в контакт с иприт.
История
Той е синтезиран в Германия от Ниман (през 1859 г.) и (независимо) от британския учен Фредерик Гутри през 1860 г. Горчичният газ е използван за първи път от Германия на 12 юли 1916 г. срещу англо-френски войски, които са обстреляни от мини, съдържащи маслена течност, близо до белгийския град Ипр (оттук и името на това вещество).
По време на Втората световна война ипритът е използван само веднъж от Полша, като двама германски войници са убити и дванадесет са с различна степен на нараняване. Освен това ипритът е използван по време на потушаването на въстанието в Синцзян през 1934 г., в итало-етиопската война от 1935-1936 г. В град Дзержинск по време на Втората световна война е имало тайна фабрика, където бомбите са били пълнени с иприт. Работниците на този завод, получили белодробни лезии с иприт, в следвоенния период до 90-те години на XX век. ежегодно се подлага на лечение в специалния санаториум "Карасан" на 15 километра югозападно от Алушта (между Алушта и Ялта).
Касова бележка
Горчицата се получава по два начина:
От етилен CH2=CH2 и серни хлориди като S2Cl2 или SCl2:
SCl2 + 2 C2H4 → (ClCH2CH2)2S
От тиодигликол S(CH2CH2OH)2 и фосфорен трихлорид PCl3:
3(HO-CH2CH2)2S + 2PCl3 → 3(Cl-CH2CH2)2S + 2P(OH)3
или тиодигликол и солна киселина:
(HO-CH2CH2)2S + 2HCl → (Cl-CH2CH2)2S + 2H2O
Физически свойства
Горчичният газ е безцветна течност с мирис на чесън или горчица. Техническият иприт е тъмнокафява, почти черна течност с неприятна миризма. Точката на топене е 14,5 °C, точката на кипене е 217 °C (с частично разлагане), плътността е 1,280 g/cm³ (при 15 °C).
Горчичният газ е лесно разтворим в органични разтворители - халоалкани, бензол, хлоробензен - както и в растителни или животински мазнини; разтворимостта във вода е 0,05%. Докато разтворимостта в абсолютен етанол над 16°C е почти 100%, в 92% етанол едва достига 25%.
Поради известна повърхностна активност намалява повърхностното напрежение на водата и в малка степен се разстила върху нея на тънък слой, като маслен филм. В резултат на добавяне на 1% високомолекулен амин C22H38O2NH2, разпространението на иприта във водата се увеличава с 39%.
Горчицата хидролизира много бавно с вода, скоростта на хидролиза се увеличава рязко в присъствието на каустични основи, когато се нагрява и разбърква.
Горчичният газ реагира енергично с хлориращи и окислителни агенти. Тъй като това произвежда нетоксични продукти, горните реакции се използват за дегазирането му. Със соли на тежки метали ипритът образува сложни оцветени съединения; откриването на иприт се основава на това свойство.
Химични свойства
Горчичният газ е органично съединение, което има следната формула: (ClCH2CH2)2S.
При обикновени температури ипритът е стабилно съединение. При нагряване над 170 °C се разлага, за да образува миришещи отровни продукти с различен състав. При температури над 500 °C настъпва пълно термично разлагане. Краткотрайното нагряване дори над 300 °C почти не води до образуване на продукти на разлагане, така че ипритът се счита за относително устойчив на детонация.
По отношение на металите при обикновена температура ипритът е инертен, почти не влияе върху олово, месинг, цинк, стомана, алуминий; Когато температурата се повиши, стоманата се разпада. Замърсеният иприт, обикновено съдържащ вода и хлороводород, корозира стоманата. Получените железни соли допринасят за корозия. Поради отделяните газове (водород, сероводород, етилен и други продукти на разлагането), трябва да се има предвид повишаването на налягането в затворени контейнери, мини, бомби и контейнери за транспортиране.
Инхибиторите на корозия и антиоксидантите предотвратяват разграждането по време на съхранение. Такива вещества могат да бъдат, например, тетраалкиламониев халогениди, хексаметилентетрамин, пиридин, пиколин, хинолин и други производни на органични амини.
В човешкото тяло ипритът реагира с NH групите нуклеотиди, които са част от ДНК. Това допринася за образуването на кръстосани връзки между ДНК вериги, поради което този участък от ДНК става неработоспособен.
Щета
Горчичният газ влияе върху човешкото тяло по няколко начина:
Мъж след отравяне с иприт.
Разрушаване на клетъчните мембрани;
Нарушаване на въглехидратния метаболизъм;
- „извличане” на азотни бази от ДНК и РНК.
Горчичният газ има увреждащо действие при всякакъв начин на проникване в тялото. Лезиите на лигавиците на очите, назофаринкса и горните дихателни пътища се появяват дори при ниски концентрации на иприт. При по-високи концентрации, наред с локалните лезии, настъпва общо отравяне на организма. Горчицата има латентен период на действие (2-8 часа) и има кумулативен ефект.
По време на контакт с иприт липсват кожно дразнене и болкови ефекти. Зоните, засегнати от иприт, са предразположени към инфекция. Кожните лезии започват със зачервяване, което се проявява 2-6 часа след излагане на иприт. Ден по-късно на мястото на зачервяване се образуват малки мехури, пълни с жълта прозрачна течност, които впоследствие се сливат. След 2-3 дни мехурите се спукват и язвата заздравява само след 20-30 дни. Ако инфекцията попадне в язвата, лечението може да отнеме до 2-3 месеца.
При вдишване на пари или аерозолен иприт, първите признаци на увреждане се появяват след няколко часа под формата на сухота и парене в назофаринкса, след това има силно подуване на лигавицата на назофаринкса, придружено от гнойно течение. При тежки случаи се развива пневмония, смъртта настъпва на 3-4-ия ден от задушаване.