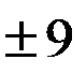Поняття про кислотно-основний гомеостаз, його основні параметри. Роль стабілізації рН внутрішнього середовища організму. Функціональна система підтримки сталості параметрів кислотно-основного гомеостазу. Значення підтримки сталості рН у життєдіяльності. Роль зовнішнього дихання, нирок та буферних систем крові у стабілізації рН.
Поняття рН, роль сталості рН внутрішнього середовища реалізації внутрішньоклітинного метаболізму.
Кислотно-лужна рівновага є одним із найважливіших фізико-хімічних параметрів внутрішнього середовища організму. Від співвідношення водневих і гідроксильних іонів у внутрішньому середовищі організму значною мірою залежать активність ферментів, спрямованість та інтенсивність окислювально-відновних реакцій, процеси розщеплення та синтезу білка, гліколіз та окислення вуглеводів і жирів, функції ряду органів, чутливість рецепторів до медіаторів, т. д. Активність реакції середовища визначає здатність гемоглобіну зв'язувати кисень і віддавати його тканинам. При зміні реакції середовища змінюються фізико-хімічні характеристики колоїдів клітин та міжклітинних структур – ступінь їхньої дисперсності, гідрофілії, здатність до адсорбції та інші важливі властивості.
Співвідношення активних мас водневих та гідроксильних іонів у біологічних середовищах залежить від вмісту в рідинах організму кислот (донаторів протонів) та буферних основ (акцептори протонів). Прийнято активну реакцію середовища оцінювати по одному з іонів (Н+) або (ОН-), частіше за іоном Н+. Зміст в організмі Н + визначається, з одного боку, прямим або опосередкованим через вуглекислоту утворенням їх у ході обміну білків, жирів та вуглеводів, а з іншого - надходженням їх до організму або виведенням із нього у вигляді нелетких кислот чи вуглекислого газу. Навіть відносно невеликі зміни СН+ неминуче ведуть до порушення фізіологічних процесів, а при зрушеннях за відомі межі – і до загибелі організму. У зв'язку з цим величина pH, що характеризує стан кислотно-лужної рівноваги, є одним з "жорстких" параметрів крові і коливається у людини у вузьких межах - від 7,32 до 7,45. Зсув pH на 0,1 за зазначені межі обумовлює виражені порушення з боку дихання, серцево-судинної системи та ін; зниження pH на 0,3 викликає ацидотичну ком, а зсув pH на 0,4 часто несумісний з життям.
Обмін кислот та основ в організмі найтіснішим чином пов'язаний з обміном води та електролітів. Всі ці види обміну об'єднані законами електронейтральності, ізоосмолярності та гоместатичними фізіологічними механізмами. Для плазми закон електронейтральності можна проілюструвати даними табл. 20.
Загальна кількість катіонів плазми становить 155 ммоль/л, їх 142 ммоль/л припадають частку натрію. Загальна кількість аніонів також становить 155 ммоль/л, з них 103 ммоль/л припадають на слабку основу С1 - і 27 ммоль/л - на частку HCO - 3 (сильна основа). Г. Рут (1978) вважає, що HCO - 3 та аніони білка (приблизно 42 ммоль/л) становлять головні буферні основи плазми. Зважаючи на те, що концентрація іонів водню в плазмі становить всього 40·10 -6 ммоль/л, кров є добре буферованим розчином і має слаболужну реакцію. Аніони білка, особливо іон НСО - 3 тісно пов'язані, з одного боку, з обміном електролітів, з іншого - з кислотно-лужною рівновагою, тому правильне трактування змін їх концентрації має важливе значення для розуміння процесів, що відбуваються у сфері обміну електролітів, води та Н +.
Кислотно-основний стан (КОС)- Відносне сталість реакції внутрішнього середовища організму, що кількісно характеризується концентрацією Н + .
Концентрацію Н+ виражають за допомогою величини рН. Концентрація Н + і відповідно величина рН, залежать від співвідношення в організмі кислот і основ.
Кислоти Бренстеда -молекули чи іони, здатні віддавати Н + .
Підстави Бренстеда -з'єднання, здатні приймати Н+.
Найпоширенішою кислотою організму є вугільна кислота, за добу її утворюється близько 20 моль. Також у організмі утворюються інші неорганічні (соляна, сірчана, фосфорна) та органічні (аміно-, кето-, окси-, нуклеїнові, жирні) кислоти у кількості 80 ммоль/сут.
найсильнішим із них є аміак. Основні властивості також мають амінокислоти аргінін і лізин, біогенні аміни, наприклад, катехоламіни, гістамін, серотонін і т.д.
Біологічне значеннярегуляції рН, наслідки порушень
Н + - позитивно заряджені частинки, вони приєднуються до негативно заряджених груп молекул та аніонів, внаслідок чого ті змінюють свій склад та властивості. Таким чином, кількість Н + у рідині визначає будову та властивості всіх основних груп. органічних сполук- білків, нуклеїнових кислот, вуглеводів та ліпідів (амфіфільних). Найважливіший вплив концентрація Н+ надає активність ферментів. Кожен фермент має свій оптимум рН, у якому фермент має максимальну активність. Наприклад, ферменти гліколізу, ЦТК, ПФШ активні у нейтральному середовищі, а лізосомальні ферменти, ферменти шлунка активні у кислому середовищі (рН=2). В результаті зміни величини рН викликає зміну активності окремих ферментів і призводить до порушення метаболізму в цілому.
Основні принципи регулювання КОС
В основі регуляції КОС лежать 3 основні принципи:
1. сталість рН . Механізми регуляції КОС підтримують сталість рН.
2. ізоосмолярність . При регуляції КОС, концентрація частинок міжклітинної і позаклітинної рідини не змінюється.
3. електронейтральність . При регуляції КОС, кількість позитивних та негативних частиноку міжклітинній та позаклітинній рідині не змінюється.
МЕХАНІЗМИ РЕГУЛЯЦІЇ КІС
- Фізико-хімічний механізм , це буферні системикрові та тканин;
- Фізіологічний механізм , Це органи: легені, нирки, кісткова тканина, печінка, шкіра, ШКТ.
- Метаболічний (На клітинному рівні).
Порушення КОС – класифікація за механізмами? Біохімічні шляхи компенсації.
ПОРУШЕННЯ КІС
Компенсація КІС- пристосувальна реакція з боку органу, не винного порушуючи КОС.
Корекція КОС- Пристосувальна реакція з боку органу, що спричинив порушення КОС.
Виділяють два основні види порушень КОС – ацидоз та алкалоз.
Ацидоз- Абсолютний або відносний надлишок кислот або дефіцит основ.
Алкалоз- Абсолютний або відносний надлишок основ або дефіцит кислот.
Ацидоз чи алкалоз який завжди супроводжуються помітним зміною концентрації Н + , оскільки сталість рН підтримують буферні системи. Такі ацидози та алкалози називаються компенсованими (У них рН у нормі). АН ↔ А - + Н + , Н + + B - ↔ BH
Якщо при ацидозах або алкалозах буферна ємність витрачена, рН змінюється і спостерігається: ацидемія - Зниження величини рН нижче норми, або алкалемія - підвищення величини рН вище за норму. Такі ацидози та алкалози називаються декомпенсованими .
Гомеостаз – одна з основних властивостей живого зберігати відносне динамічне
сталість внутрішнього середовища тобто. хімічного складу, осмотичного
тиску, стійкості основних фізіологічних функцій
Це здатність організму підтримувати відносну сталість внутрішнього середовища (крові, лімфи, міжклітинної рідини).
Організм людини пристосовується до умов навколишнього середовища, що постійно змінюються, проте при цьому внутрішнє середовище залишається постійним і його показники коливаються в дуже вузьких межах. Тому людина може жити у різних умовах навколишнього середовища. Деякі фізіологічні параметри регулюються особливо ретельно і тонко, наприклад, температура тіла, артеріальний тиск, вміст глюкози, газів, солей, іонів кальцію в крові, кислотно-лужна рівновага, об'єм крові, її осмотичний тиск, апетит багато інших. Регуляція здійснюється за принципом негативного зворотного зв'язку між рецепторами, що уловлюють зміни зазначених показників та керуючих системами. Так, зменшення одного з параметрів уловлюється відповідним рецептором, від якого імпульси направляються в ту чи іншу структуру мозку, за командою якого вегетативна нервова система включає складні механізми вирівнювання змін, що настали. Мозок використовує для підтримки гомеостазу дві основні системи: вегетативну та ендокринну.
Одним із найважливіших фізико-хімічних параметрів внутрішнього середовища є кислотно-лужна рівновага .
Кількісна реакція крові, що характеризує водневий показник(рН) – негативний десятковий логарифм концентрації водень та іонів.
Більшість розчинів в організмі буферні розчини,у яких рН не змінюється від додавання до них невеликої кількості сильної кислоти або луги.
Тканинна рідина, кров, сеча та інші рідини – буферні розчини.
рН показник рідин організму добре демонструє на скільки засвоюється Na, Mg, Ca, K. Ці 4 компоненти регулюють кислотність організму. Якщо кислотність висока починається запозичення речовин з інших органів та порожнин. Для всіх функцій живих структур всіх рівнях від молекулярних систем до органів необхідна слаболужна середовище (рН 7,4).
Навіть незначне відхилення від нормального значення може стати причиною патології.
рН змінюється: у кислу – ацидоз
в лужну – алкалоз
Зрушення на 0,1 може призвести до порушення діяльності середовище, а на 0,3 – небезпечне для життя.
Норми рН крові та інших внутрішніх рідин. Метаболізм та метаболіти.
Норми для внутрішніх рідин:
Артеріальна кров 7,35 – 7,45
Венозна кров 7,26 – 7,36
Лімфа 7,35 - 7,40
Міжклітинна рідина 7,26 – 7,38
рН сечі 5-7 (кислотність змінюється від їжі і фізичних навантажень.Лужність сечі - рослинна їжа; кислотність сечі - м'ясо, фізичні навантаження).
Відхилення та норми:
- Кисла реакція рідини
Голодування, підвищення температури тіла, цукровий діабет, порушення нирок, важка фізична робота.
- Лужна реакція
Запалення сечового міхура, бідна дієта м'ясними продуктами, надлишок мінеральної води, попадання крові у сечу.
Будь-який організм характеризується сукупністю показників, за допомогою яких оцінюється фізико-хімічні властивості внутрішнього середовища, крім рН, що оцінюється зворотним десятковим логарифмом р і р, а також ударний об'єм серця, частота серцевих скорочень, артеріальний тиск, швидкість кровотоку, опірність периферичних судин, хвилинний та ін. Сукупність цих показників характеризує функціональний рівень організму.
Метаболізм – сукупність хімічних реакційпротікають у живих клітинах та
що забезпечують організм речовинами та енергією для основного обміну.
Метаболіти – продукти внутрішньоклітинного обміну, які підлягають остаточному виведенню з організму.
2.Буферні системи крові. Роль буферних систем у підтримці гомеостазу pH. Кислотно-основний стан. Поняття про ацидоз та алкалоз.
В організмі кислотоутворення преобл.над освітою соед-й основного характеру.
Джерела Н+ в організмі:
1.летюча кислота Н2СО3, на добу образ.10-20тыс.ммоль СО2 при окисленні білків, Ж, У.
2.нелеткі кислоти в сут.образ. 70 ммоль:
Фосфорна при розщепл.орг.фосфатів(нуклеотидів, ФО, фосфопротеїдів)
Сірчана, соляна при окисненні Б
3.орг.к-ти: молочна, кетонові тіла, ПВК та ін.
рН утримується на слаболужному рівні завдяки участі буф.с-м та фізіологічному контролю (виділить.
Рівняння Гендерсона-Хесельбаха: pH = pKa + lg [акц.протонів]/[донор протонів].
(Сіль) (кислота)
Будь-яка буф.с-ма складається із сполученої кислотно-основної пари: донор+акцептор протонів.
Буферна ємність залежить від абсолютних концентрацій компонентів буфера.
Бікарбонатна.
10% буф.ємності крові.
При нормальному значенні рН крові (7,4) концентрація іонів бікарбонату НСО 3 у плазмі крові перевищує концентрацію 2 приблизно в 20 разів. Бікарбонатна буферна система функціонує як ефективний регулятор області рН 7,4.
Механізм дії даної системи полягає в тому, що при виділенні в кров щодо великих кількостей кислих продуктів водневі іони Н + взаємодіють з іонами бікарбонату НСО 3 -, що призводить до утворення вугільної кислоти, що слабодисоціює, Н 2 СО 3 . Подальше зниження концентрації Н 2 3 досягається в результаті прискореного виділення 2 через легені в результаті їх гіпервентиляції (нагадаємо, що концентрація Н 2 3 в плазмі крові визначається тиском 2 в альвеолярної газової суміші).
Якщо в крові збільшується кількість основ, то вони, взаємодіючи зі слабкою вугільною кислотою, утворюють іони бікарбонату і воду. При цьому не відбувається скільки помітних зрушень у величині рН. Крім того, для збереження нормального співвідношення між компонентами буферної системи в цьому випадку підключаються фізіологічні механізми регуляції кислотно-основної рівноваги: відбувається затримка в плазмі крові деякої кількості 2 в результаті гіповентиляції легень.
NaHCO3 + H+ → Na+ + H2CO3
Реабс.в нирках ↓карбоангідразу
↓збільшення вентиляції легень
Фосфатна є сполученою кислотно-основною парою, що складається з іону Н 2 РО 4 – (донорпротонів) та іону НРО 4 2– (акцептор протонів):
 Фосфатна буферна система становить лише 1% від буферної ємності крові. У позаклітинній рідині, у тому числі в крові, співвідношення [НРО 4 2-]: [Н 2 РО 4 -] становить 4:1. Буферна дія фосфатної системи заснована на можливості зв'язування водневих іонів іонами НРО 4 2 - з утворенням Н 2 РО 4 - (Н + + + НРО 4 2 - -> Н 2 РО 4 -), а також іонів ВІН - з іонами Н 2 РО 4 – (ВІН – + + Н 2 Р О 4 – -> HPO 4 2– + H 2 O). Буферна пара (Н 2 РО 4 -НРО 4 2-) здатна впливати при змінах рН в інтервалі від 6,1 до 7,7 і може забезпечувати певну буферну ємність внутрішньоклітинної рідини, величина рН якої в межах 6,9-7, 4. У крові максимальна ємність фосфатного буфера проявляється поблизу значення pH 7,2.
Фосфатна буферна система становить лише 1% від буферної ємності крові. У позаклітинній рідині, у тому числі в крові, співвідношення [НРО 4 2-]: [Н 2 РО 4 -] становить 4:1. Буферна дія фосфатної системи заснована на можливості зв'язування водневих іонів іонами НРО 4 2 - з утворенням Н 2 РО 4 - (Н + + + НРО 4 2 - -> Н 2 РО 4 -), а також іонів ВІН - з іонами Н 2 РО 4 – (ВІН – + + Н 2 Р О 4 – -> HPO 4 2– + H 2 O). Буферна пара (Н 2 РО 4 -НРО 4 2-) здатна впливати при змінах рН в інтервалі від 6,1 до 7,7 і може забезпечувати певну буферну ємність внутрішньоклітинної рідини, величина рН якої в межах 6,9-7, 4. У крові максимальна ємність фосфатного буфера проявляється поблизу значення pH 7,2.
1 та 2 – вивідні.
Білкова має менше значення для підтримки КОР у плазмі крові, ніж інші буферні системи. Білки утворюють буферну систему завдяки наявності кислотно-основних груп у молекулі білків: білок-Н+ (кислота, донорпротонів) та білок (сполучена основа, акцептор протонів). Білкова буферна система плазми ефективною в області значень рН 7,2-7,4.
Гемоглобінова буферна система – найпотужніша буферна система крові. Вона в 9 разів потужніша за бікарбонатний буфер; на її частку припадає 75% від усієї буферної ємності крові. складається з неіонізованого гемоглобіну ННb (слабка органічна кислота, донорпротонів) та калієвої солі гемоглобіну КНb (сполучена основа, акцептор протонів). Так само може бути розглянута оксигемоглобінова буферна система. Система гемоглобіну і система оксигемоглобіну є взаємоперетворюваними системами і існують як єдине ціле.
Механізм дії:
У тканинах: Н2О + СО2(карбоангідраза) ->Н2СО3->Н+ + НСО3-(дифундує в плазму крові)
КНвО2 ->КНв + 4О2
КНв + 2Н+ -> ННв + 2К+ (К-гемоглобін неітралізує іони Н+)
У легенях: ННв + 4О2 -> 2Н + + НвО2
2Н+ + НвО2 + 2К+ + 2НСО3- ->КНвО2 + 2Н2СО3(карбоангідраза) ->Н2О + 2СО2
рН та концентрація СО2 впливають на звільнення та зв'язування О2 немоглобіном – ефф.Бора.
Підвищення концентрації протонів, СО2 сприяє звільненню О2, а підвищення концентрації О2 стимулює вивільнення СО2 і протонів.
| У широкому значенніпоняття "фізико-хімічні властивості" організму включає всю сукупність складових частинвнутрішнього середовища, їх зв'язків один з одним, з клітинним вмістом та із зовнішнім середовищем. Стосовно завдань даної монографії доцільно вибрати фізико-хімічні параметри внутрішнього середовища, що мають життєво важливе значення, добре "гомеостазовані" і разом з цим відносно повно вивчені з точки зору конкретних фізіологічних механізмів, що забезпечують збереження їх гомеостатичних кордонів. Як такі параметри обрані газовий склад, кислотно-лужний стан та осмотичні властивості крові. По суті, в організмі немає окремих ізольованих систем гомеостазування зазначених параметрів внутрішнього середовища. |
Кислотно-лужний гомеостаз
Кислотно-лужна рівновага є одним із найважливіших фізико-хімічних параметрів внутрішнього середовища організму. Від співвідношення водневих та гідроксильних іонів у внутрішньому середовищі організму значною мірою залежать активність ферментів, спрямованість та інтенсивність окисно-відновних реакцій, процеси розщеплення та синтезу білка, гліколіз та окислення вуглеводів та жирів, функції ряду органів, чутливість рецепторів до медіаторів т. д. Активність реакції середовища визначає здатність гемоглобіну зв'язувати кисень і віддавати його тканинам. При зміні реакції середовища змінюються фізико-хімічні характеристики колоїдів клітин та міжклітинних структур – ступінь їхньої дисперсності, гідрофілії, здатність до адсорбції та інші важливі властивості.
Співвідношення активних мас водневих та гідроксильних іонів у біологічних середовищах залежить від вмісту в рідинах організму кислот (донаторів протонів) та буферних основ (акцептори протонів). Прийнято активну реакцію середовища оцінювати по одному з іонів (Н+) або (ОН-), частіше за іоном Н+. Зміст в організмі Н + визначається, з одного боку, прямим або опосередкованим через вуглекислоту утворенням їх у ході обміну білків, жирів та вуглеводів, а з іншого - надходженням їх до організму або виведенням із нього у вигляді нелетких кислот чи вуглекислого газу. Навіть щодо невеликі зміни сН+ неминуче ведуть до порушення фізіологічних процесів, а при зрушеннях за відомі межі – і до загибелі організму. У зв'язку з цим величина pH, що характеризує стан кислотно-лужної рівноваги, є одним з "жорстких" параметрів крові і коливається у людини у вузьких межах - від 7,32 до 7,45. Зсув pH на 0,1 за вказані межі обумовлює виражені порушення з боку дихання, серцево-судинної системи та ін; зниження pH на 0,3 викликає ацидотичну ком, а зсув pH на 0,4 часто несумісний з життям.
Обмін кислот та основ в організмі найтіснішим чином пов'язаний з обміном води та електролітів. Всі ці види обміну об'єднані законами електронейтральності, ізоосмолярності та гоместатичними фізіологічними механізмами. Для плазми закон електронейтральності можна проілюструвати даними табл. 20.
| Таблиця 20. Концентрація іонів плазми (Hermann Н., Cier J., 1969) | |||||
| Катіони | Концентрація | Аніони | Концентрація | ||
| мг/л | ммоль/л | мг/л | ммоль/л | ||
| Na + | 3 300 | 142 | З 1 - | 3650 | 103 |
| До + | 180-190 | 5 | НСО - 3 | 1650 | 27 |
| Са 2+ | 100 | 2,5 | Білки | 70000 | 7,5-9 |
| Mg 2+ | 18-20 | 0,5 | РO 2-4 | 95-106 | 1,5 |
| SO 2-4 | 45 | 0,5 | |||
| Інші елементи | Приблизно 1,5 | Органічні кислоти | Приблизно 5 | ||
| Усього. . . | 155 ммоль/л | Усього. . . | 155 ммоль/л | ||
Загальна кількість катіонів плазми становить 155 ммоль/л, їх 142 ммоль/л припадають частку натрію. Загальна кількість аніонів також становить 155 ммоль/л, з них 103 ммоль/л припадають на слабку основу С1 - і 27 ммоль/л - на частку HCO - 3 (сильна основа). Г. Рут (1978) вважає, що HCO - 3 та аніони білка (приблизно 42 ммоль/л) становлять головні буферні основи плазми. Зважаючи на те, що концентрація іонів водню в плазмі становить всього 40·10 -6 ммоль/л, кров є добре буферованим розчином і має слаболужну реакцію. Аніони білка, особливо іон НСО - 3 тісно пов'язані, з одного боку, з обміном електролітів, з іншого - з кислотно-лужною рівновагою, тому правильне трактування змін їх концентрації має важливе значення для розуміння процесів, що відбуваються у сфері обміну електролітів, води та Н +.
Кислотно-лужна рівновага підтримується потужними гомеостатичними механізмами. В основі цих механізмів лежать особливості фізико-хімічних властивостей крові та фізіологічні процеси, в яких беруть участь системи зовнішнього дихання, нирки, печінка, шлунково-кишковий тракт та ін.
Фізико-хімічні гомеостатичні механізми
Буферні системи крові та тканин. Як за умов нормальної життєдіяльності, і при вплив на організм надзвичайних чинників, підтримання кислотно-лужного гомеостазу забезпечується насамперед фізико-хімічними регуляторними механізмами.
- Особливе місце серед цих механізмів займає карбонатна буферна система. [показати]
Згідно Закону електролітичної дисоціації, відношення добутку концентрації іонів до концентрації недисоційованих молекул - величина постійна:
(H+) (HCO - 3) (H 2 CO 3) (Na+) (HCO - 3) (NaHCO 3) Іон HCO - 3 є загальним для кожного компонента системи, і тому цей іон, що утворюється з сильно дисоціюючої солі NaHCO 3 буде пригнічувати утворення аналогічного іона зі слабкою Н 2 3 , тобто практично вся кількість HCO - 3 в бікарбонатному буфері відбувається від дисоціації NaHCO 3 . Тому рівняння (1) можна наступним чином:
(H+) (NaHCO 3) (H 2 CO 3) а на пропозицію Sörensen, символом для позначення активної реакції прийнятий рН = -lg (Н +). У остаточному вигляді рівняння Хендерсона - Гассельбальха для карбонатного буфера зазвичай представляють так:
H 2 CO 3 NaHCO 3 де рК = -lgK. Отже, карбонатний буфер складається із слабкої Н 2 СО 3 і натрієвої солі її аніону (сильної основи НСО - 3 -NaHCO 3 . У нормальних умовах у плазмі бікарбонату в 20 разів більше, ніж вугільної кислоти. При контакті цього буфера з кислотами останні нейтралізуються лужним компонентом буфера з утворенням слабкої Н 2 3. Утворений потім вуглекислий газ збуджує дихальний центр, і весь надлишок вуглекислого газу видаляється з крові з повітрям, що видихається Карбонатний буфер здатний нейтралізувати і надлишок основ, які будуть пов'язані вуглекислотою з утворенням NaH нирками.
Буферна ємність карбонатної системи становить 7-9% від загальної буферної ємності крові, але важливість її дуже велика внаслідок того, що вона тісно пов'язана з іншими буферними системами та її стан залежить також від функцій, що беруть участь у підтримці кислотно-лужного гомеостазу органів виділення. Таким чином вона є чутливим індикатором кислотно-лужної рівноваги і визначення її компонентів широко використовується для діагностики його розладів.
- Іншою буферною системою плазми є фосфатний буфер, утворений одно- та двоосновними фосфатними солями [показати]
:
Фосфатний буфер, утворений одно- та двоосновними фосфатними солями:
NaH 2 PO 4 1 Na 2 PO 4 4 Одноосновні фосфорні солі є слабкими кислотами, а двоосновні солі мають чітко виражену лужну реакцію. Принцип дії фосфатного буфера аналогічний до карбонатного. Безпосередня роль фосфатного буфера у крові незначна; цей буфер має набагато більше значення у нирковій регуляції кислотно-лужного гомеостазу. Йому належить також значна роль регуляції активної реакції деяких тканин. У крові його дія головним чином зводиться до підтримки сталості та відтворення бікарбонатного буфера. Справді, "агресія" кислот викликає в системі, що містить карбонатний і фосфатний буфери, збільшення вмісту Н 2 3 і зменшення вмісту NaНCО 3 . Завдяки одночасному присутності у розчині фосфатного буфера відбувається обмінна реакція:
т. е. надлишок Н 2 3 усувається, а концентрація NaHCО 3 збільшується, підтримуючи сталість виразу:
H 2 CO 3 1 NaHCO 3 20 - Третьою буферною системою крові є білки [показати]

Буферні властивості білків визначаються їхньою амфотерністю. Білки можуть дисоціювати з утворенням як Н+, так і ОН-іонів. Характер дисоціації залежить від хімічної природибілка та від реакції середовища. Буферна ємність білків плазми порівняно з бікарбонатами невелика. Найбільша буферна ємність крові (до 75%) посідає гемоглобін. У гемоглобіні людини міститься 8,1% гістидину - амінокислоти, що включає як кислі (СООН), так і основні (NH2) групи. Буферні властивості гемоглобіну обумовлені можливістю взаємодії кислот з калієвою сіллю гемоглобіну з утворенням еквівалентної кількості відповідної калієвої солі та вільного гемоглобіну, що має властивості дуже слабкої органічної кислоти. Таким чином можуть зв'язуватися дуже значні кількості іонів Н+. Здатність зв'язувати Н + іони виражена у солей гемоглобіну сильніше, ніж у солей оксигемоглобіну (НbО 2), тобто Нb є слабкішою органічною кислотою, ніж НbO 2 . Тому при дисоціації НbO 2 у тканинних капілярах на Про 2 і Нb з'являється додаткова кількість основ (лужно-реагуючих солей гемоглобіну), здатних зв'язувати вуглекислоту, протидіючи зниженню pH. Навпаки, оксигенація гемоглобіну призводить до витіснення Н 2 2 з гідрокарбонату (рис. 38).
Ці механізми, очевидно, можуть вступити в дію не тільки при перетворенні артеріальної крові на венозну і назад, але й у всіх випадках, коли змінюється Рсо 2 . Гемоглобін здатний також зв'язувати вуглекислий газ за допомогою вільних аміногруп, утворюючи карбгемоглобін:
Таким чином, витрата гідрокарбонату NaHCO 3 у системі карбонатного буфера при "агресії" кислот компенсується за рахунок лужних протеїнатів, фосфатів та солей гемоглобіну.
Надзвичайно важливе значення має також обмін іонів Сl- та НСО-3 між еритроцитами та плазмою. Коли концентрація вуглекислоти у плазмі збільшується, концентрація С1 - у ній зменшується, оскільки Сl - перетворюється на еритроцити. Основним джерелом Сl - у плазмі є хлорид натрію; отже, підвищення концентрації вугільної кислоти викликає розрив зв'язку між Na + та Сl - та їх поділ, причому Сl - входять до еритроцитів, a Na + залишаються у плазмі, оскільки мембрана еритроцитів для них практично непроникна. Надлишок Na +, що створюється, з'єднується з надлишком НСО - 3 , утворюючи бікарбонат натрію, заповнюючи його спад, що виникла в результаті закислення крові, і підтримуючи тим самим сталість pH крові.
Зниження Рсо 2 викликає зворотний процес: Сl - виходять з еритроцитів, з'єднуючись з надлишком Na +, що звільнився з бікарбонату, і попереджаючи цим залужування крові. Зазначені переміщення іонів через напівпроникну мембрану еритроцитів пояснюються одним із правил Доннана, що свідчить, що відносини концентрацій іонів, здатних проходити через мембрану, повинні дорівнювати по обидва боки мембрани. Цей процес має виняткову важливість для підтримки pH крові, Cl - ер /Cl - пл = 0,48-0,52 може бути одним із показників стану кислотно-лужного гомеостазу.
Велика роль у підтримці кислотно-лужного гомеостазу належить буферним системам тканин, які підтримують сталість внутрішньотканинного pH та беруть участь у регуляції pH крові. У тканинах є карбонатна та фосфатна буферні системи. Однак особливу роль відіграють білки тканини, які здатні пов'язувати дуже великі кількості кислот і лугів. Найбільш виражена буферна ємність у колагенової субстанції сполучної тканини, здатної також зв'язувати кислоти шляхом їхньої адсорбції.
Гомеостатичні обмінні процеси. Дуже істотну роль регуляції кислотно-лужного балансу грають обмінні процеси, які у тканинах, особливо у печінці, нирках, м'язах. Органічні кислоти можуть піддаватися окисленню з утворенням або летких, що легко виділяються з організму кислот (головним чином вуглекислоти), або перетворюючись на некислі речовини. Вони можуть з'єднуватися з продуктами білкового обміну, повністю або частково втрачаючи свої кислі властивості(наприклад, з'єднання бензойної кислоти з гліцином); молочна кислота, що у великих кількостях утворюється при посиленій м'язовій роботі, ресинтезується в глікоген, кетонові тіла - у вищі жирні кислоти і потім у жири і т. д. Неорганічні кислоти можуть бути нейтралізовані солями калію, натрію, що звільняються при дезамінуванні амінокислот солей тощо. буд. Кислотно-лужний гомеостаз підтримує і ряд фізико-хімічних процесів: розчинення сильних кислот та лугів у середовищах з низькою діелектричною постійною (наприклад, у ліпідах), зв'язування кислот та лугів різними органічними речовинами у недисоційованих та нерозчинних солях, обмін іонів між клітинами кров'ю та ін.
Відзначаючи важливість розглянутих вище механізмів підтримки кислотно-лужного гомеостазу, слід визнати, що в кінцевому підсумку вузловою ланкою в гомеостатичній системі, що розглядається, є клітинний обмін, так як пересування аніонів і катіонів між поза- і внутрішньоклітинними секторами їх розподіл у цих секторах є перш за все результатом діяльності клітин та підпорядковані потребам цієї діяльності.
Механізми, які забезпечують цей обмін, дуже різноманітні. Пересування іонів залежить від градієнта осмотичного тиску, проникності мембран, що визначається динамічним. електричним потенціаломмембран тощо.
Фізіологічні гомеостатичні механізми
Другий ешелон підтримки кислотно-лужного гомеостазу представлений фізіологічними регуляторними механізмами, серед яких головна роль належить легені та ниркам.
Завдяки буферам крові органічні кислоти, що утворюються в процесі обміну, або кислоти, введені в організм ззовні, не змінюють реакції крові, а лише витісняють вуглекислоту з її сполуки з основами; надлишок вуглекислого газу виводиться легкими. Висока дифузійна здатність вуглекислого газу забезпечує швидке проходження газу через мембрани та виведення його з організму. Швидкість дифузії будь-якого газу обернено пропорційна квадратному кореню з його молекулярної маси, а кількість дифузного газу пропорційно його розчинності в рідині.
Об'єднання цих двох законів дифузії дозволяє зробити висновок, що вуглекислий газ дифундує приблизно в 20 разів інтенсивніше кисню:
де 0,545 і 0,023 - коефіцієнти розчинності відповідно 2 і 2 у воді при t=38°C. Перехід вуглекислого газу з крові в альвеолярне повітря пояснюється градієнтом Рсо 2 . Полегшується цей процес двома механізмами: переходом Нb в НbО 2 , що витісняє як сильніша кислота вуглекислий газ з крові, і дією вугільної ангідрази, якій належить велика роль у звільненні вільної вуглекислоти в легенях. Кількість вуглекислого газу, що виводиться з легень, залежить насамперед від амплітуди та частоти дихальних рухів. Параметри дихання регулюються залежно від вмісту вуглекислоти в організмі. У цілому ж відношення між Рсо 2 у крові та легеневою вентиляцією виражається наступним чином (Рут Г., 1978):
де Рсо 2 та Р (барометричний тиск) виражаються в міліметрах ртутного стовпа, продукція СО 2 – у молях, а альвеолярна вентиляція – у літрах.
Роль нирок у підтримці кислотно-лужного гомеостазу визначається переважно їх кислото-выделительной функцією. У фізіологічних умовах нирки виділяють кислу сечу, рН якої коливається від 5,0 до 7,0. Величина pH сечі може досягати 4,5, і, отже, концентрація вільних іонів Н+ може у 800 разів перевищувати їх вміст у плазмі крові. Підкислення сечі в проксимальних і дистальних канальцях є результатом секреції іонів Н + , в освіті та секреції яких (ацидогенезі) важлива роль належить ферменту карбоангідраз (КА), що міститься в клітинах канальців. Фермент прискорює досягнення рівноваги між повільною реакцією гідратації та дегідратації вугільної кислоти (Н 2 3):
![]()
Швидкість цієї реакції, що не каталізується, зростає при зниженні pH. Ацидогенез забезпечує виведення кислих компонентів фосфатного буфера (у процесі утворення кислої сечі відбувається перетворення: НРО 2- 4 + H + ---> H 2 PO 4), а також слабких органічних кислот: молочної, лимонної, β-оксимасляної та ін. виділення епітелієм ниркових канальців Н+ відбувається проти електрохімічного градієнта із витратою великої кількостіенергії і потребує одночасної реабсорбції еквівалентної кількості іонів Na+. Зменшення реабсорбції натрію, як правило, супроводжується зниженням ацидогенезу. Реабсорбований в результаті ацидогенезу Na + утворює в крові разом з НСО - 3 ниркових канальців, що виділяються з епітелію, бікарбонат натрію. Іони Н+, секретовані клітинами ниркових канальців, вступають у взаємодію Космосу з аніонами буферних сполук. Ацидогенез забезпечує виділення переважно аніонів карбонатного та фосфатного буферів, а також аніонів слабких органічних кислот.

При фільтрації сполук, що містять аніони сильних органічних і неорганічних кислот (Cl - , SO 2- 4), в нирках включається інший механізм - амоніогенез, що забезпечує виведення кислот і запобігає зниженню pH сечі нижче критичного рівня (рис. 39). Амоніогенез відбувається на рівні дистальних канальців та збиральних трубок. NH 3 , що утворюється в епітелії ниркових канальців, надходить у просвіт канальців, де взаємодіє з Н + , що походять від ацидогенезу. Таким чином, NH3 забезпечує, з одного боку, зв'язування Н + , а з іншого - виведення аніонів сильних кислот у вигляді амонійних солей, у складі яких іони Н + не надають шкідливого впливу на епітелій канальців. Джерелом амонію є переважно глутамін крові. Близько 60% NH 3 утворюється з глутаміну шляхом його дезамінування йод впливом ферменту глутамінази I. Інші 40% аміаку, утворюються з інших амінокислот (Pitts R. F., 1964)
Оскільки амоніогенез тісно пов'язані з ацидогенезом, очевидно, що концентрація амонію у сечі перебуває у прямої залежності від концентрації у ній Н + . Закислення крові, що призводить до зниження pH канальцевої рідини, сприяє дифузії аміаку з клітин. Інтенсивність екскреції амонію визначається також швидкістю його продукції і швидкістю потоку сечі, від якої залежить час контакту між канальцевою рідиною і епітелієм ниркового канальця, і, отже, своєчасне видалення іону, що утворюється з клітини.
У регуляції екскреції нирками кислот важливу роль виконують хлориди. Зокрема, збільшення реабсорбції НСО - 3 зазвичай супроводжується збільшенням реабсорбції хлоридів. Іон С1 - загалом пасивно слідує за катіоном Na +. Підвищення концентрації гідрокарбонатів НСО - 3 у сечі зазвичай супроводжується зменшенням вмісту в них хлоридів таким чином, що сума цих аніонів виявляється еквівалентною кількості Na + (Matthews D. L., O'Connor W. J., 1968). Зміна транспорту хлоридів є наслідком первинної зміни секреції іонів Н+ та реабсорбції бікарбонату та обумовлено необхідністю підтримки електронейтральності канальцевої сечі. Згідно з іншою точкою зору, первинно змінюється транспорт хлоридів.
Крім механізмів ацидо- та амоніогенезу, у збереженні іона Na+ при закисленні крові істотна рольналежить секреції іонів К+. Калій, що звільняється із клітин при зниженні pH крові, екскретується нирковими канальцями у підвищеній кількості; одночасно при цьому відбувається збільшена реабсорбція Na +. Цей обмін регулюється мінералокортикоїдами (альдостерон, дезоксикортикостерон). У нормальних умовах нирки виділяють переважно кислі продукти обміну. При збільшенні надходження в організм основ реакція сечі стає більш лужною внаслідок посиленого виділення бікарбонату та основного фосфату.
Певне місце у регуляції виділення кислотно-лужного гомеостазу займає шлунково-кишковий тракт. Клітини слизової оболонки шлунка секретують НСl, що утворює з іонів Сl - , що надходять із крові, та іонів Н + , що походять із шлункового епітелію. В обмін на хлориди в кров у процесі шлункової секреції надходить бікарбонат. Залужування крові, однак, при цьому не відбувається, тому що іони Сl - шлункового соку знову всмоктуються в кров у кишечнику. Епітелій слизової оболонки кишечника секретує лужний сік, багатий бікарбонатами. При цьому іони Н+ переходять у кров у вигляді НС1. Короткочасне зрушення реакції відразу ж урівноважується зворотним всмоктуванням бікарбонату в кишечнику. У той час як нирки концентрують і виділяють з організму головним чином Н+ та одновалентні катіони, кишечник концентрує та виділяє двовалентні лужні іони. При кислій дієті збільшується виділення переважно двовалентних Са 2+ і Mg 2+ , при лужній - виділення всіх катіонів.
Порушення кислотно-лужної рівноваги
Гомеостатична система кислотно-лужної рівноваги за своєю природою нездатна тривалий час безперервно перебувати у стані напруги за наявності впливів, що обурюють. Розлади кислотно-лужного гомеостазу можуть виникнути в результаті тривалої безперервної дії навіть помірних за інтенсивністю факторів, що обурюють, або в тому випадку, якщо вплив факторів, що обурюють, короткочасно, але за своєю інтенсивністю вони виходять за межі можливостей екстрено мобілізованих гомеостатичних механізмів. Абсолютна або відносна недостатність гомеостатичних механізмів (або їх резервних можливостей) може стати основою порушень кислотно-лужної рівноваги внутрішнього середовища організму та призвести до виникнення ацидозу або алкалозу.В даний час ацидоз називається таке порушення кислотно-лужної рівноваги, при якому в крові з'являється відносний або абсолютний надлишок кислот. Алкалоз характеризується абсолютним чи відносним збільшенням кількості основ у крові. За ступенем компенсації всі ацидози та алкалози поділяють на компенсовані та некомпенсовані. Компенсовані ацидоз і алкалоз - це також стани, коли змінюються абсолютні кількості Н 2 3 і NaHCO 3 але відношення NаНСО 3 /Н 2 3 залишається в нормальних межах (близько 20:1). За збереження зазначеного відношення pH крові істотно не змінюється. Відповідно некомпенсованими ацидозами та алкалозами називають такі стани, коли змінюється не тільки загальна кількість Н 2 3 і NaHCO 3 , але і їх співвідношення, результатом чого є зсув pH крові в той чи інший бік (Weisberg Н. F., 1977).
Поняття "негазовий ацидоз" та "метаболічний ацидоз" (або алкалоз) вживаються як синоніми. Однак таке ототожнення термінів не може вважатися виправданим. Негазовий ацидоз (алкалоз) - поняття збірне, що включає всі можливі форми порушень кислотно-лужного гомеостазу, що ведуть до первинної зміни вмісту бікарбонату крові, тобто знаменника дробу в рівнянні:
| H 2 CO 3 | |||
| NaHCO 3 |
Розвиток негазового ацидозу може бути обумовлено:
- збільшенням надходження кислот ззовні;
- порушенням обміну речовин, що супроводжується накопиченням органічних кислот, нездатністю нирок виводити кислоти, або, навпаки, надмірним виведенням буферних основ через нирки та шлунково-кишковий тракт.
Отже, метаболічними ацидозами в точному значенні цього слова можна називати лише такі ацидози, що розвиваються внаслідок порушень обміну речовин, що призводять до надмірного накопичення кислот. Ацидози, обумовлені утрудненням виведення кислот з організму або надмірною втратою буферних аніонів, слід зарахувати до категорії виділених ацидозів.
Виходячи з наведених міркувань, класифікацію порушень кислотно-лужної рівноваги можна подати у вигляді наступної схеми.
- Газово-дихальний (накопичення вуглекислоти):
- утруднення виведення вуглекислого газу при порушення дихання;
- висока концентрація вуглекислого газу в навколишньому середовищі(замкнуті приміщення, шахти, підводні човни та ін.);
- несправності наркозно-дихальної апаратури (рідко!).
- Негазовий (накопичення нелетких кислот):
- Метаболічний:
- кетоацидоз внаслідок збільшення продукції або порушення окислення та ресинтезу кетонових тіл (цукровий діабет, голодування, порушення функції печінки, лихоманка, гіпоксія та ін.)
- лактат-ацидоз внаслідок збільшення продукції, зниження окислення та ресинтезу молочної кислоти (гіпоксія, порушення функцій печінки, інфекції та ін.);
- ацидоз при накопиченні інших органічних та неорганічних кислот (великі запальні процеси, опіки, травми тощо).
- Видільний:
- затримка кислот при нирковій недостатності (дифузний нефрит, уремія);
- втрата лугів, ниркова (нирковий канальцевий ацидоз, знесолюючий нефрит, гіпоксія, інтоксикація сульфаніламідами); втрата лугів, гастроентеральна (діарея, гіперсалівація)
- Екзогенний:
- тривале вживання кислої їжі;
- прийом ліків (NH 4 Cl);
- прийом кислот усередину (рідко!)
- Комбіновані форми:
- кетоацидоз + лактатацидоз;
- метаболічний + видільний;
- різні інші поєднання.
- Метаболічний:
- Змішаний (газовий + негазовий) при асфіксії, серцево-судинній недостатності, тяжких станах з порушенням серцево-судинної та дихальної систем тощо).
- Газово-дихальний:
- посилене виведення вуглекислого газу при порушеннях зовнішнього дихання гіпервентиляційного характеру;
- гіпервентиляційне кероване дихання
- Негазовий:
- Видільний:
- затримка лугів (посилення реабсорбцип лужних аніонів (підстав) нирками);
- втрата кислот (блювання при пілоростенозі, кишкова непрохідність, токсикоз вагітності; гіперсекреція шлункового соку);
- гіпохлоремічний-"метаболічний"
- Екзогенний:
- тривалий прийом лужної їжі;
- введення ліків (бікарбонат та інші лужні речовини)
- Видільний:
ЗМІШАНІ ФОРМИ АЦИДОЗІВ І АЛКАЛОЗІВ (ПРИКЛАДИ)
- Газовий алкалоз + метаболічний ацидоз (висотна хвороба, крововтрата);
- Газовий алкалоз + нирковий канальцевий ацидоз (серцева недостатність та лікування карбоангід-різними інгібіторами);
- Артеріальний газовий алкалоз + венозний газовий ацидоз (дихання чистим киснем під підвищеним тиском) та ін.
Гомеостатичні процеси при ацидозах та алкалозах та їх порушення.При розвитку ацидозу в буферних системах та регуляторних механізмах відбуваються такі зміни. Якщо ацидоз викликаний надлишком якоїсь сильної кислоти, наприклад, НС1, то відбудуться наступні реакції:
- НС1 + NaHCO 3 Н 2 СО 3 + NaCl.
Отже,
т. е. виникають деякий надлишок Н 2 3 і деякий дефіцит NaHCO 3 .
- Надлишок Н 2 ЗО 3 (Н + та СО 2) викликає посилення діяльності дихального центру, що призводить до гіпервентиляції та вимивання СО 2 з крові.
- Надлишок Н 2 3 3 NaHCO 3 + NaH 2 PO 4 . Ця реакція забезпечує певною мірою ліквідацію дефіциту NaHCO 3 .
- NaHCO 3 поповнюється значною мірою за рахунок обміну іонів між еритроцитами і плазмою за правилом Доннана, тобто іони С1 - входять до еритроцитів, створюючи в плазмі надлишок іонів Na + , які, з'єднуючись з надлишком НСО - 3 утворюють бікарбонат.
- HCl + Na 2 HPO 4 = NaH 2 PO 4 + NaCl, тобто відбувається часткова нейтралізація кислоти основними фосфатами.
- Кислота виділяється нирками у вигляді солей Na+ та К+ або у вигляді амонійних солей. Включення зазначених механізмів забезпечує компенсацію ацидозу, що виник, який може перейти в некомпенсовану форму, якщо відбудеться виснаження буферних систем або настане недостатність видільних процесів.
Найчастіше зустрічаються такі форми ацидозу.
Метаболічний ацидоз, що виникає внаслідок накопичення проміжних кислих продуктів обміну, наприклад, кетонових тіл (ацетооцтова, β-оксимасляна кислоти), молочної кислоти та інших органічних кислот. Гіперкетонемія може розвинутися в результаті посиленої продукції кетонових тіл, наприклад, при зменшенні вмісту глікогену в печінці, а також при інтенсивному розпаді жирів; при порушеннях циклу трикарбонових кислот, що призводять до гальмування окиснення кетонових тіл; при кисневому голодуванні, зменшенні продукції НАДФ та гальмуванні їх ресинтезу. Нерідко має місце поєднана дія кількох факторів, що зумовлюють гіперкетонемію (наприклад, при панкреатичному діабеті). Концентрація кетонових тіл при патологічних станах може зростати у десятки та сотні разів. Значні кількості кетонових тіл виділяються нирками у вигляді солей натрію та калію, що може призвести до великих втрат лужних іонів та розвитку некомпенсованого ацидозу. Такий стан буває при цукровому діабеті, голодуванні (особливо вуглеводному), високій лихоманці, тяжкій інсуліновій гіпоглікемії, при деяких видах наркозу.
Ацидоз внаслідок накопичення молочної кислоти трапляється досить часто, навіть у здорових людей. Короткочасний ацидоз виникає при посиленій м'язовій роботі, особливо у нетренованих людей, коли збільшується концентрація молочної кислоти внаслідок відносного нестачі кисню. Тривалий ацидоз подібного роду зустрічається при тяжких ураженнях печінки (цироз, токсичні дистрофії), при декомпенсації серцевої діяльності, а також при зменшенні надходження в організм кисню, пов'язаному з недостатністю зовнішнього дихання, та інших форм кисневого голодування.
Негазовий видільний ацидоз внаслідок зменшення виділення нелетких кислот спостерігається при захворюваннях нирок, коли виділення кислих фосфатів, сульфатів, органічних кислот утруднено, загальмований амоніогенез, тоді як буферні основи виділяються більш-менш нормально. В результаті може виникнути ацидоз на ґрунті відносного або абсолютного надлишку Н+. Такий ацидоз зустрічається при хронічному дифузному гломерулонефриті, нефросклерозі н деяких інших тяжких ураженнях нирок. Декомпенсована форма зазвичай відзначається при уремії. Посилене виділення бікарбонату із сечею відбувається при деяких інтоксикаціях, наприклад, при тривалому застосуванні сульфаніламідів, які гальмують активність карбоангідрази та призводять до послаблення ацидогенезу. Ацидоз при нефритах розвивається як наслідок первинної недостатності виведення органічних кислот із сечею у вільному вигляді та у вигляді амонійних солей. Водночас показано, що реабсорбція бікарбонату у нирках при їх ураженні зменшена. Реакція сечі при нирковому ацидозі зазвичай є нейтральною або лужною. Компенсація ацидозу на фоні ураження нирок може здійснюватися тільки за рахунок мобілізації великої кількості катіонів і насамперед натрію з усіх його сполук. Істотним резервом натрію у своїй є кісткова система. Негазовий ацидоз може розвинутись також при збільшеному виділенні лугів через шлунково-кишковий тракт, наприклад, при проносах у дітей або при блюванні лужним кишковим соком.
Газовий ацидоз характеризується накопиченням вугільної кислоти в крові внаслідок недостатності функції зовнішнього дихання або внаслідок присутності більш-менш значних кількостей вуглекислого газу у повітрі, що вдихається.
Можливість розвитку змішаних форм ацидозу базується, зокрема, на тому факті, що обмін вуглекислого газу в легенях здійснюється приблизно в 25 разів інтенсивніше, ніж обмін кисню. Тому завжди, коли виділення вуглекислого газу утруднено у зв'язку з ураженням легень або серця, розвивається кисневе голодування з подальшим накопиченням недоокислених продуктів проміжного обміну. Помірні компенсовані ацидози протікають без виражених клінічних симптомів та розпізнаються шляхом дослідження буферних систем крові, а також складу сечі. При поглибленні ацидозу одним із перших клінічних симптомів є посилене дихання, яке при некомпенсованому ацидозі переходить у різку задишку. Некомпенсований ацидоз характеризується також розладами з боку серцево-судинної системи та шлунково-кишкового тракту, значною мірою обумовленими тим, що ацидоз одночасно зменшує активність α- та β-адренорецепторів серця, судин та кишечника, знижуючи функціональну та метаболічну дію катехоламінів.
Ацидоз призводить до збільшення вмісту катехоламінів у крові, тому в його розвитку спочатку відзначаються посилення серцевої діяльності, почастішання пульсу, підвищення хвилинного об'єму крові, підйом АТ. Але в міру поглиблення ацидозу знижується активність адренорецепторів і, незважаючи на підвищений вміст катехоламінів у крові, серцева діяльність пригнічується, артеріальний тиск падає. При цьому з'являються екстрасистоли та інші порушення ритму аж до шлуночкової фібриляції. Встановлено також, що ацидоз різко посилює парасимпатичні ефекти, викликаючи бронхоспазм та посилену секрецію бронхіальних залоз. З боку шлунково-кишкового тракту відзначаються блювання, пронос.
При надлишку H+ у плазмі частина їх переміщається всередину клітин в обмін на K+, які відщеплюються від білків у кислому середовищі. У діагностичному відношенні показник концентрації K + плазми може бути ознакою вираженості "біохімічної травми" тканин організму. Крім того, частина іонів НСОз переходить у клітини та нейтралізує іони H + . На місце НСОз із клітин виходять С1 - , осмотичний тиск позаклітинної рідини підвищується, розвивається позаклітинна гіпергідрія. При некомпенсованому ацидозі виникають різкі розлади центральної функції нервової системи, З'являються спочатку запаморочення, сонливість, а потім при розвитку ацидотичної коми настає повна втрата свідомості. Природно, що ацидотичні симптоми поєднуються із симптомами основного захворювання, що спричинило ацидоз.
Алкалоз. При накопиченні лужних сполук в організмі відбуваються наступні принципові зміни в гомеостатичній системі кислотно-лужної рівноваги (у наведеному прикладі як лужна сполука умовно взята NaOH).
- NaOH + Н 2 СО 3 NaHCO 3 + Н 2 0
Отже,
H 2 CO 3 - H 2 CO 3 витрачена NaHCO 3 + NaHCO 3 утворюється т. е. створюється деякий надлишок NaHCO 3 і дефіцит Н 2 3 .
- Дефіцит Н 2 3 компенсується, по-перше, за рахунок виходу іонів Cl - з еритроцитів і звільненням іонів НСО - 3 з бікарбонату натрію: Cl - + NaHCO 3 NaCl + НСО 3 . (Іон НСО - 3 разом з H + , що виходять з клітин в обмін на іони K + , утворює Н 2 3 ; по-друге, при нестачі Н 2 3 знижується активність дихального центру, що призводить до зменшення вентиляції та затримки виділення вуглекислоти з організму.
- NaOH + NaH 2 PO 4 Na 2 HPO 4 + H 2 O, тобто деяка частина лугу зв'язується кислими фосфатами.
- Надлишок NaHCO 3 і Na 2 HPO 4 виділяється із сечею, що сприяє підтримці pH у межах норми.
Доки буферні системи не вичерпалися і нирки функціонують нормально, алкалоз залишається компенсованим, а потім при неспроможності підтримують pH механізмів може перейти в некомпенсовану форму.
Найбільше клінічне значення має негазовий алкалоз, зокрема його гастроентеральна форма, що виникає під час блювання кислим шлунковим вмістом (пілоростеноз, кишкова непрохідність). При захворюваннях нирок, що супроводжуються втратою здатності виділяти катіони Na+, K+ та ін, розвивається ниркова форма негазового алкалозу.
p align="justify"> Газовий алкалоз є наслідком гіпервентиляції, що виникає при висотній хворобі, істерії, епілепсії та інших станах, коли посилена діяльність дихального центру не пов'язана з впливом вуглекислоти, а також при надмірному штучному диханні. Симптоматика алкалозу проявляється у послабленні дихальної функції, підвищенні нервово-м'язової збудливості, що може призвести до тетанії. Це пов'язано зі зниженням вмісту Са 2+ у плазмі. Одночасно збільшується вміст Сl - у плазмі, зменшується кількість аміаку в сечі (гальмування амоніогенезу) та відзначається зсув її реакції у лужний бік (результат посиленого виведення бікарбонатів). Алкалоз підвищує збудливість β-адренорецепторів у серці, судинах, кишечнику та бронхах, зменшуючи одночасно парасимпатичні ефекти. Це виявляється у почастішанні серцебиття, що супроводжується падінням системного АТ. З боку шлунково-кишкового тракту відзначаються запори, зумовлені уповільненням перистальтики. Впливу алкалозу на α-адренорецептори не виявлено.
Змішані форми алкалозу можуть спостерігатися, наприклад, при травмах головного мозку, що супроводжуються задишкою (газовий алкалоз) та блюванням кислим шлунковим соком (негазовий алкалоз).
Комбіновані форми розладів кислотно-лужної рівноваги можуть виникати при штучній гіпервентиляції, що приводить, з одного боку, до газового алкалозу (посилене вимивання вуглекислоти), а з іншого – і до метаболічного ацидозу (порушення дисоціації оксигемоглобіну в тканинах при алкалозі). Подібні порушення виникають і при висотній хворобі. Не завжди розлади кислотно-лужної рівноваги супроводжуються вираженими клінічними симптомами, а ніби поступово підточують захисні можливості організму, призводячи згодом до незворотних порушень.