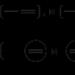Іпрітмає виражену місцеву та резорбтивну властивість. Для нього характерні такі особливості:
відсутність дратівливої дії на момент контакту;
звикання до його запаху, коли людина перестає відчувати запах гірчиці (часника) за кілька хвилин;
наявність прихованого періоду;
запально-некротичні процеси у тканинах, у які іприт проникає;
повільний перебіг процесів відновлення та вторинні інфекції, що часто приєднуються;
підвищена чутливість до повторних дій іприту.
При попаданні на шкіру краплинно-рідкого іпритувін швидко розчиняється в ліпідному мастилі шкіри. Якщо дегазація не проведена протягом 5 хв, то іприт проникає у глибокі шари епідермісу, накопичуючись переважно у сальних залозах та волосяних фолікулах шкіри. На ділянках з більш тонкою та ніжною шкірою та великою кількістю сальних та потових залоз (шкіра шиї, грудей, пахвових западин та ін.) ураження більш виражені. Доза 0,05 мг/см2 при дії протягом 5 хв викликає еритему, доза 0,1-0,25 мг/см2 за цих самих умов - утворення пухирів.
Прихований період- 2-6 год. Потім з'являються ознаки ураження шкіри (почервоніння, свербіж, набряклість). Спочатку виникають дрібні міхури, наповнені прозорою рідиною. Збільшуючись обсягом, бульбашки зливаються утворюючи більші. Максимальний розвиток бульбашок – наприкінці 1-2-ї доби (залежно від дози іприту). Потім оболонка бульбашок проривається і виникають виразки, які часто інфікуються і повільно гояться (тижні, місяці). На місці виразок, як правило, утворюються рубці, які в ділянці суглобів можуть обмежувати рухливість і порушувати їхню функцію.
Пари іпритупри токсичних дозах 0,1-0,3 мг-хв/л викликають еритему; 0,2-1,0 мг-хв/л - бульбашки і 0,75-1,5 мл * хв/л - серйозні ураження шкіри з утворенням множинних пухирів. Симптоми поразки розвиваються, зазвичай, через кілька годин. Спочатку виникають почервоніння з подальшою пігментацією, що нагадує сонячну засмагу; потім - бульбашки, дома яких через 2-3 сут утворюються виразки. При дії парів та аерозолів іприту можливі ураження на великій площі, що зазвичай супроводжується вираженою резорбтивною дією.
Очі найбільш чутливі до дії іприту. Токсичні дози іприту, рівні 0,07 мг-хв/л, викликають ураження очей легкого ступеня (кон'юнктивіти); 0,1 мг-хв/л - ураження очей з порушенням зору та 0,2 мг-хв/л - серйозні порушення зору з втратою працездатності. Симптоми ураження розвиваються через 1-2 год. Спочатку виникає неприємне відчуття наявності стороннього предмета в очах ("відчуття попадання в очі піску"), потім сльозотеча, світлобоязнь, почервоніння та набряк повік, які зазвичай склеєні рясними гнійними виділеннями. Як правило, зір погіршується. При ураженнях середнього та тяжкого ступеня має місце запалення рогівки (кератит) з можливим больовим ефектом та подальшим помутнінням і навіть некрозом рогівки. У важких випадках можливо запалення всього очного яблука. Найвищого розвитку процес досягає на 2-5 добу. Одужання затягується на тижні та місяці.
При інгаляції пар та аерозолів іпритузазвичай відчувається характерний часниковий запах (або запах гірчиці) при концентрації 0,0015 мг/л, проте сприйняття запаху швидко притуплюється. Це характерна особливість дії іприту: поступово людина перестає відчувати запах парів іприту, а при концентрації порядку 1-Ю-3 мг/л, які на 2 порядки нижче Сmах, виникають серйозні поразки. Симптоми ураження, як правило, відзначають через 2-6 год. З'являються почуття "садіння" у носоглотці, кашель і нежить. Кашель посилюється. Голос стає хрипким, інколи ж зовсім пропадає - розвивається афонія через поразки голосових зв'язок. Порушення голосу може зберігатися тривалий час (іноді роки).
При дії більш високих концентрацій іпритууражаються глибші відділи органів дихання. При кашлі виділяється рясне гнійне мокротиння. Температура підвищується до 38 ° С і від. Розвивається задишка. Найчастіше смертельні наслідки бувають на 2-4-й та 7-9-й день після поразки. При сприятливому перебігу хвороби одужання починається через 2-3 тижні. Найчастіші ускладнення – бронхіти (хронічні), бронхоектатична хвороба, пневмосклероз, які важко піддаються лікуванню.
В органи травлення іпритпотрапляє із зараженою водою та їжею. Прихований період – 1-3 години залежно від дози. Потім з'являються біль у надчеревній ділянці, нудота, блювання, пронос (часто з кров'ю). У важких випадках можливе прорив стінок шлунка і кишечника з подальшим розвитком перитоніту.
Як правило, при ураженні іпритоммає місце резорбтивна дія. Зміни з боку ЦНС виявляються у загальній млявості, пригніченні та сонливості. Відзначають зниження кров'яного тиску та порушення серцевої діяльності, обміну речовин (зниження маси тіла – кахексія). Змінюється склад крові: у перші дні відзначається лейкоцитоз, у наступні – лейкопенія (лейкоцитів до 2-3 тис. в 1 мм3).
У 1943 р. в італійському порту Барістався вибух американського корабля "Джон Харві", на борту якого були хімічні снаряди з іпритом. Моряки були змушені рятуватися водою у воді, зараженій іпритом. У багатьох поряд із поразкою шкірних покровів було сильно виражено резорбтивну дію іприту. Врятовані моряки загинули у перші три доби при явищах тяжкої загальної депресії та гострої гіпотонії, на кшталт шокового стану. Другий пік смертності спостерігали на 8-9-й день, коли у уражених розвивалася сильна лейкопенія. Це була основна причина загибелі - "вторинні" інфекції та лейкопенія. Як правило, практично всі ветерани першої світової війни, уражені іпритом, загинули в наступні десятиліття з діагнозами "хронічні бронхопневмонії", "пневмосклероз" та "пухлини легень". При ураженні іпритами найчастішими віддаленими наслідками є зниження або втрата маси тіла, рубці на шкірі, які можуть обмежувати функції кінцівок, пневмосклероз, бронхоектатична хвороба, лейкопенія, зниження імунітету, підвищена чутливість до застудних та інфекційних захворювань, онкологічні захворювання.
Іприт не мав одного батька, якому повністю належала б сумнівна честь такого відкриття. Цей газ відкривали довго — майже сто років різні хіміки успішно його синтезували, але це не викликало жодного інтересу, оскільки не було виявлено отруйних властивостей цієї речовини.
Ситуація змінилася 1913 року. У лабораторії німецького хіміка Германа Фішера розбилася колба із синтезованим газом. Пригода мала два наслідки. По-перше, колега Фішера, англієць Ганс Кларк, вирушив на два місяці до лікарні. По-друге, Фішер повідомив про те, що сталося Німецькому хімічному суспільству, яке тісно співпрацювало з німецькою оборонкою. До Великої війни залишався рік, і вражаючими властивостями цього газу зацікавилися генерали.
Зазначимо також, що звичну сьогодні назву цей газ отримав не одразу. Спочатку його називали LOST — за першими літерами прізвищ німецьких хіміків Ломмеля та Стейнкопфа, яким у 1916 році доручили довести формулу нового газу до ладу та домогтися можливості його бойового застосування на фронтах. Хімічно чистий газ не мав кольору та запаху, але при виробництві для бойових цілей до нього додали домішки із запахом гірчиці або часнику, тому згодом LOST стали називати гірчичним газом.
…і прийшов іприт
За словом "іприт" стоїть вся історія Західного фронту Першої світової війни. Перша світова, у тому числі завдяки класикам європейської літератури (у нас про неї, зі зрозумілих причин, писали значно менше), асоціюється з нескінченними окопами, рядами дротяних загороджень та масштабними битвами, в яких без видимих змін на лінії фронту загинули сотні тисяч людей.
Однією з таких битв стала битва біля бельгійського міста Іпр на річці Іперлі. Примітно, що саме тут уперше було застосовано хімічну зброю ще на самому початку війни.
Бої під Іпром йшли з 1914 року і для битв різних років використовувалися різні назви. Бої літа-осені відомі як Битва при Пашендейлі - за назвою найближчого села. Пашендейл запам'ятався учасникам непролазним брудом, у якому загрузли люди та знаряддя: місцевість була болотистою, а рік дощовим. У розташуванні німецьких військ на відстані кількох кілометрів один від одного чекали наказу про настання двох незнайомих один з одним німців у солдатській формі. Незабаром вони увійшли до світової історії: це були Еріх Марія Ремарк та Адольф Гітлер.
Росія на той час вийшла з війни, і німці отримали можливість перекинути сили на Західний фронт. Вони не шкодували сил та коштів, розраховуючи на довгоочікуваний прорив. І в ніч із 12 на 13 липня німецька артилерія розпочала обстріл британських позицій незвичайними снарядами. Розривалися вони тихо, випускаючи на позиції противника газ із гірчичним запахом. За місцем першого застосування новий газ і отримав свою назву.
- Lt. J W Brooke/ IWM via Getty Images
Від очей до ДНК
Тієї ночі іпритом отруїлися близько 2500 людей, з яких померло 87. Іприт вбиває далеко не завжди, гинуть лише 5% тих, хто отруївся. Але цей газ завдає непоправної шкоди здоров'ю людей, роблячи їх інвалідами.
Вражає гірчичний газ насамперед очі та шкіру. Якщо очі постраждалого не захищені, може засліпнути — тимчасово чи назавжди. При контакті з іпритом на шкірі утворюються нариви, а попадання в легені призводить до важких поразок дихальних шляхів. Крім того, сучасні дослідження показали, що іприт здатний провокувати зміни ДНК. Ось як описували вплив газу люди, знайомі з виробництвом іприту:
«Наслідки давались взнаки через кілька годин або через добу: почервоніння очей, поразка голосових зв'язок, кашель. Після кількох днів відпочинку та лікування всі ці симптоми зникали, а потім все повторювалося знову і знову. Вплив іприту кумулювався, і, як правило, через кілька місяців вже з'являвся хронічний бронхіт, далі емфізема легень, бронхоетази, схильність до частих запалень легень, невиліковне профзахворювання та інвалідність».
Іприт здатний непомітно накопичуватися в організмі, він дається взнаки через кілька годин після отруєння. Влітку іприт зберігає свої вбивчі властивості навіть через кілька днів після розпилення, а восени та взимку може чекати жертву тижнями.
Страшний урок
У роки Першої світової війни стало зрозуміло: з газовою зброєю краще не зв'язуватися, оскільки порив вітру може обернути близьку перемогу у страшну поразку. Однак бойове застосування іприту не закінчилося. Іпритом труїли ефіопів італійські фашисти у другій половині тридцятих років, його застосовував Саддам Хусейн у війні проти Ірану, відомі також випадки застосування цього газу бойовиками ІГ* у Сирії.
Найбільш гучною подією, пов'язаною із застосуванням іприту після Першої світової війни, стало бомбардування німцями італійського порту Барі в 1943 році, в якому розвантажувалися кораблі союзників. Американці в таємниці намагалися ввезти на фронт значний вантаж іприту. Транспорт із газом змогли потопити німецькі бомбардувальники, і в результаті від іприту постраждала значна кількість громадянського населення Барі.
Застосування іприту було остаточно заборонено після набуття чинності Конвенцією про заборону хімічної зброї у 1997 році. На момент її підписання у світі зберігалося 17440 тонн гірчичного газу. Незабаром після її підписання було знищено 86% світових запасів іприту, його знищення продовжується досі.
*«Ісламська держава» (ІГ) - терористична угруповання, заборонена в Росії.
Ця група поєднує переважно стійкі, висококиплячі рідкі речовини, одна з характерних ознак ураження якими полягає у запаленні шкірних покривів тіла різного ступеня - від почервоніння до утворення гнійних інфільтратів, що переходять у виразки. Природно, що такі отруйні речовини ще більшою мірою вражають інші системи організму - більш чутливі і ніжніші, ніж шкіра: очі, внутрішні органи. ОВ шкірно-наривної дії мають також загальноотруйну дію за рахунок всмоктування їх через шкіру в кров. Окремим представникам групи властива і деяка дратівлива дія слизових оболонок очей та дихальних шляхів.
Отруйні речовини шкірно-наривної дії здатні викликати смертельні отруєння людей та тварин. Враховуючи забезпеченість сучасних армій надійними засобами індивідуального та колективного захисту, закордонні військові фахівці не ставлять за мету знищення живої сили противника за допомогою шкірно-наривних ОВ. Вони призначаються головним чином для тимчасового, хоч і на тривалий термін, виведення живої сили з ладу. Одночасно вирішуються завдання зі сковування бойових дій військ та виснаження живої сили. Перша з них обумовлена здатністю шкірно-наривних ОВ заражати на тривалий час місцевість та місцеві об'єкти, озброєння та військову техніку, об'єкти тилу та населені пункти. Друга досягається високою шкірно-резорбтивною проникністю ОВ, що зумовлює необхідність повного захисту тіла. Усі об'єкти, заражені ОВ шкірно-наривної дії, потребують дегазації.
Для застосування шкірно-наривних ОВ у іноземних арміях розроблено артилерійські хімічні снаряди, хімічні авіаційні бомби вибухової дії та хімічні фугаси.
Шкірно-наривну дію мають представники найрізноманітніших класів органічних сполук, серед яких найбільш відомими є галоїдзаміщені тіоефіри, третинні аміни, первинні арсини, оксими, кетони, складні ефіри сильних кислот. Незважаючи на такий різнорідний склад, для речовин цієї групи характерна одна загальна властивість - всі вони є алкилирующими або ацилирующими засобами стосовно сполук, що мають атоми з вільними парами електронів.
Так, галоїдзаміщені тіоефіри та третинні аміни здатні алкілювати нуклеофільні атоми кисню, азоту, сірки в різних сполуках з утворенням нових елемент вуглецевих зв'язків - відповідно ефірних С-О, амінних С-N. сульфідних С-S. Шкірно-наривні ОВ алкілуючої дії стійкі, тривалий час зберігають свої вражаючі властивості, ознаки ураження ними зазвичай виявляються після певного періоду прихованої дії.
Ацилюючими властивостями по відношенню до нуклеофільних реагентів мають галоїдангідриди деяких двоосновних кислот, наприклад фосгеноксим і особливо галоїдангідриди миш'яковистих кислот. Вони ацилируют сполуки атомів кисню, азоту чи сірки, утворюючи із нею сложноэфирные, амідні чи тиоэфирные зв'язку. Шкірно-наривні ОВ ациліруюшої дії менш стійкі, ніж алкілатори, їх токсичний ефект проявляється швидше, оскільки їм властиво ще й припікаючу дію.
Найбільший інтерес серед ОР шкірно-наривної дії становить речовина НD (іприт). Певне значення може мати речовину L (люїзит), здатне знайти застосування як компонент тактичних сумішей. Не можна повністю виключати можливість використання для зараження джерел води деяких представників про азотистих іпритів (агентів НN1, НN2, НNЗ).

ІПРИТ - 2,2′-дихлоретиловий тіоефір
 Іпріт |
 Азотистий іприт (Агент HN3) |
 Люїзіт |
Історія.З так званих OB з жовтим хрестом біс-2-хлоретіловий тіоефір під назвою «лост» був вперше застосований німецькими військами в ніч з 12 на 13 липня 1917 в запеклій битві за Іпр. Особливе значення цього OB полягало у тому, щоб на тривалий час зробити уражених небоєздатними. З цим новим ОВ було використано засіб поразки, якого не оберігали засоби захисту органів дихання від вже відомих OB. Через особливі властивості іприту проникати через обмундирування та взуття і викликати ураження шкіри вже в невеликих кількостях атаковані були змушені захищати від його впливу все тіло.
Хімічна стабільність і виняткові фізичні властивості, які забезпечували високу стійкість іприту, зводили це з'єднання в ранг потужного оборонного засобу, яке обмежена німецька армія могла тривалий час ефективно протиставляти наступальним задумам союзників.
У березні 1918 р. німецькі війська випустили частинами 3-ї англійської армії близько 250000 іпрітних мін. Союзникам вдалося застосувати освоєний промисловістю іприт у межах німецької оборони лише у червні 1918 р.
Втрати, понесені від іприту, були більшими, ніж від інших OB. За англійськими даними, втрати від іприту склали 80% від загальної кількості отруєних OB; решта 20% включали уражених задушливими OB та OB, що дражнюють носоглотку.
Отриманий у чистому вигляді Мейєром у 1886 р. біс-2-хлоретиловий тіоефір ще раніше був синтезований іншими хіміками: у 1822 р. у Франції – Дюпре, у 1860 р. в Англії – Гутрі та у Німеччині – Німаном. Вони отримували це з'єднання при дії етилену на моно або дволористу сірку. Вже Гутрі та Німан встановили фізіологічну активність цієї речовини, хоча вони отримали її лише у неочищеному вигляді. Обидва хіміки зазначали, що дія цієї рідини та її пари на шкіру викликає утворення пухирів. У 1891 р. німецький окуліст Лебер повідомив про проведені ним досліди з дослідження дії іприту на очі і про запалення, що виникають при цьому.
 Альберт Німанн (Albert Niemann) (20 травня 1834 р., Госляр - 19 січня 1861 р., Госляр) Німецький хімік-фармацевт, творець іприту. У 1849 Німанн став учнем аптекаря в Геттінгені. У 1852 році у віці 18 років він вступив до університету Геттінгена на відділення технології лікарських форм філософського факультету. У 1858 році він успішно склав іспит на фармацевта і став працювати в лабораторії Геттінгенського університету у професора Ф. Велера, який поставив перед молодим дослідником два завдання: провести хімічну реакцію хлориду сірки з етиленом і визначити хімічний склад листя коки. З обома завданнями Німан блискуче впорався. У першому випадку він отримав гірчичний газ (іприт), який використовувався як хімічна зброя під час Першої світової війни. Внаслідок першої газової атаки на річці Іпр було вбито 5 тисяч людей, а 15 тисяч залишилися інвалідами. Проводячи експерименти, Німан і сам отруївся, оскільки він нічого не знав про токсичні властивості гірчичного газу і не вжив жодних заходів захисту. Страждаючи від отруєння, він все ж таки успішно провів дослідження листя коки і в 1860 виділив у чистому вигляді алкалоїд, якому дав назву "кока-ін" (речовина всередині коки). Специфічне оніміння мови після контакту з кокаїном Німан описав у своїй дисертації "Про нову органічну основу, що міститься в листі коки". Він був представлений до ступеня доктора хімії, але 19 січня 1861 помер вдома в Госларі від пневмонії у віці 26 років, так і не завершивши перспективну наукову роботу. |
 Віктор Мейєр (Victor Meyer) (8 вересня 1848, Берлін - 18 серпня 1897, Гейдельберг) Вивчав хімію в Гейдельберзі та Берліні. У 1871 він був запрошений завідувати кафедрою органічної хімії в університет Штутгарта. З 1872 по 1885 він працював у Цюріхському політехнічному інституті. В 1885 Віктор Мейєр працював професором в Геттінгені і, нарешті, в 1889 - в університеті Гейдельберга. Віктор Мейєр розробив у 1878 році метод визначення молярної маси рідких сполук за допомогою апарату, названого на його честь апаратом Віктора Мейєра. Він також виявив органічні нітросполуки, відкрив у 1882 році нову речовину, яку назвав тіофен і вперше виділив у чистому вигляді та описав фізіологічну дію іприту (гірчичний газ, S-Lost). Ввів у звернення термін "стереохімія". Відкрита ним реакція синтезу нітросполук отримала назву на його честь. |
 Фредерік Гутрі (Frederick Guthrie) (1833 - 1886) Британський науковий письменник та професор. У 1874 став співзасновником Лондонського Фізичного Співтовариства (зараз Інститут Фізики) і був його президентом з 1884 по 1886 рік. Гутрі був переконаний, що наука повинна ґрунтуватися не на теорії, а на експериментах. Гутрі був першим, хто описав вплив "гірчичного газу" на людину. Незалежно від Альберта Німана, він у 1860 синтезував іприт, використовуючи реакцію етилену і дихлориду сірки. Фредерік Гутрі був також лінгвістом, драматургом та поетом. Писав під псевдонімом Frederick Cerny. Його син Фредерік Бікель Гутрі був агрохіміком. |
Незадовго до першої світової війни англієць Кларк, учень Еміля Фішера, у хімічному інституті Берлінського університету вивчав деякі реакції синтезованого ним самим біс-2-хлоретилового тіоефіру.
Відколи іприт став відомий як ВВ, він став предметом наукових досліджень про. Крім технологічних змін, методи його отримання в принципі змінилися несуттєво. Описані Мейером, Гутрі та інших. методи отримали розвиток і видозміна використання у промисловому масштабі.
З того часу італійські фашисти застосували іприт під час окупації Ефіопії, а під час Другої світової війни багатьма воюючими державами були заготовлені великі запаси цього ВВ. Він жодною мірою не втратив свого військового значення, незважаючи на існування більш ефективних ОВ. Можливості його застосування в бою для забезпечення або утруднення бойових дій, а також для встановлення загороджень різноманітні, особливо за допомогою сучасних засобів застосування.
Іприт вважається одним з найважливіших ОВ і належить до табельних ОВ багатьох армій.
Методи одержання.Отримати біс-2-хлоретиловий тіоефір можна різними способами: хлоруванням біс-2-оксиэтилового тіоефіру (тіодигліколю) відповідними хлоруючими агентами; прямим синтезом з етилену та хлоридів сірки; фотохімічним синтезом із хлористого етилену та сірководню або 2-хлоретил меркаптану.
Методом одержання з тіодигліколю користувався ще Мейєр, який як хлоруючий агент застосовував трихлористий фосфор:
3S(CH 2 CH 2 OH) 2 + 2PCl 3 → 3S(CH 2 CH 2 CI) 2 + 2H 3 PО 3
Пізніше Кларк замінив трихлористий фосфор хлористим воднем
S(CH 2 CH 2 OH) 2 + 2HCl → S(CH 2 CH 2 CI) 2 + Н 2 O
а Штейнкопф та співр. запропонували користуватися сульфурилхлоридом або тіонілхлоридом:
S(CH 2 CH 2 OH) 2 + SOCI 2 → S(CH 2 CH 2 Cl) 2 + SO 2 + H 2 O
Тіодигліколь отримують за аналогією із загальним методом синтезу тіоефірів взаємодією алкілгалогенідів, в даному випадку етиленхлоргідрину, з сульфідом лужного металу
2СlСН 2 СН 2 ВІН + Na 2 S → S(CH 2 CH 2 OH) 2 + 2NaCl
Або з окису етилену та сірководню:

Етиленхлоргідрин отримують дією хлорноватистої кислоти на етилен або, з таким же успіхом, з окису етилену та хлористого водню:
СН 2 =СН 2 + НОСl → СH 2 OН-СН 2 Cl

Прямий синтез іприту з етилену та хлоридів сірки (розвиток експериментальних досліджень Гутрі та Німана) був обраний під час першої світової війни союзниками як найзручніший та найшвидший. Вони застосовували різні суміші як моно-, так і дволористої сірки та отримували при цьому велику кількість продуктів, суміш яких вони брали за чисту сполуку.
Поуп здійснив синтез іприту - з однохлористої сірки та етилену при 70°С та рівномірному енергійному перемішуванні із застосуванням активованого вугілля як каталізатор:
S 2 Сl 2 + 2СН 2 =СН 2 → S(СН 2 СН 2 Сl) 2 + S
Промислові способи одержання.У великому промисловому масштабі виробництво іприту здійснюється за методами Мейєра та Гутрі. Можливий промисловий фотохімічний синтез, який і було впроваджено у провідних країнах з виробництва ОВ у зв'язку з реорганізацією таких підприємств.
У той час як у Німеччині та в першу і в другу світову війну застосовували переважно так званий тіодіглікольний (оксольний) процес (модицифований метод Мейєра), виробництво іприту у Франції, Англії, США базувалося на прямому синтезі з етилену та хлоридів сірки.
В оксольному процесі для заміщення оксигруп пропускають в тіодігліколь повільний струм сухого водню хлористого. Реактори та вся система комунікацій установки виготовлені зі свинцю чи освинцювані. Тим самим унеможливлюється утворення солей заліза. Процес хлорування ведуть при 50°З підтримуючи температуру за допомогою систем нагрівання та охолодження. Після повного поглинання хлористого водню отриманий іприт, що має велику щільність, виводять з реактора і направляють на вакуумну перегонку, де при зниженому тиску відганяється вода. Іприт очищають перегонкою у вакуумі або обробкою органічними розчинниками.
У порівнянні з прямим синтезом виробництво іприту тіодіглікольним процесом більш трудомістко, але призводить до більш високих виходів (95%) продукту за кращої якості.
Прямий синтез іприту, що застосовувався союзниками, піддавався після першої Першої світової постійним удосконаленням. Процес складається із чотирьох стадій: I) отримання дволористої сірки з елементів; 2) приготування розчину дволористої сірки у чотирихлористому вуглеці; 3) приєднання дволористої сірки до етилену шляхом пропускання етилену в розчин, при цьому виходить розведений розчин іприту; 4) відділення іприту від розчинника для повторного його використання у процесі.
Всі ці чотири виробничі операції можна проводити безперервно в один прийом. Ректори, що застосовувалися французами, мали висоту 18 м. Виготовлялися вони цілком із свинцю і були забезпечені складною системою змійовиків охолодження. Кожна така гігантська колона мала свій масивний змійниковий конденсатор зі срібла.
Під час пропускання етилену розчин чотирихлористого вуглецю температуру реакції підтримували 60-70°С. Етилен повинен бути попередньо ретельно висушений та очищений від спирту. Вихід становив близько 80%.
Фізичні властивості.Чистий біс-2-хлоретиловий тіоефір - безбарвна масляниста рідина, що не має запаху. Технічні продукти пофарбовані домішками в кольори від жовтого до темно-коричневого і мають характерний солодкуватий запах. Нижче температури застигання (13,5°С) тіоефір кристалізується як довгих безбарвних ромбічних кристалів. За допомогою прецизійних вимірювань встановлена його температура плавлення 1444-1445°С; зазвичай дані коливаються не більше 14,1-14,5°С. Технічний іприт застигає за температури від 5 до 10°С.
При нагріванні до температури кипіння (близько 217 ° С) іприт розкладається з утворенням смердючих продуктів, що нагадують за запахом чи гірчицю, чи часник.
Іприт американського виробництва, так званий НD, має т. кіп. 228 ° С, т. пл. 14°С.
Іприт важчий за воду (d 20 1,2741). Внаслідок деякої поверхневої активності він зменшує поверхневе натяг води і в невеликій мірі розтікається по ній тонким шаром, як плівка олії. Додаванням більш поверхнево-активних речовин, що розчиняються в іприті, ефективне розтікання можна збільшити. Тиск пари біс-2-хлоретилового тіоефіру досить мало (0,1 мм. рт. ст. При 20 ° С).
Хоча зі зростанням температури повітря стійкість іприту зменшується, але з його випаровування повітря збагачується парами іприту. У спекотні безвітряні дні створюється концентрація, що майже в 50 разів перевищує зазвичай необхідну токсичну концентрацію. Навіть за швидкості вітру 2 м/сек і щільності зараження близько 5 г/м 2 на відкритій місцевості пари іприту ще ефективні протягом 3-4 год.
При температурі нижче 15 ° С, особливо на покритій рослинністю або дуже лісистої місцевості, зараженість тримається більше тижня. Нижче 4°С при швидкості вітру понад 8 м/сек пари іприту повітря не ефективні.
Щоб підвищити стійкість іприту і, тим самим його ефективність, вносять добавки, які підвищують його в'язкість (так звані в'язкі рецептури). Ці добавки гарантують не тільки велику тривалість дії, але й ускладнюють дегазацію, яка в цьому випадку навряд чи здійсненна водними розчинами, що дегазують. Підвищення в'язкості одночасно пригнічує утворення аерозолю та сприяє утворенню крапель більшого розміру (а не диму) при поливанні з літаків.
Розчинність біс-2-хлоретилового тіоефіру у воді мала, приблизно 0,8 г/л. В органічних розчинниках - галогеналканах, бензолі, хлорбензолі - він розчиняється так само добре, як і в рослинних або тваринних жирах. У той час як розчинність ОВ в абсолютному етанолі вище 16°С становить майже 100%, 92%-ном етанолі вона досягає ледве 25%. З такими розчинниками, як нафта та дизельне паливо, він змішується обмежено, є області незмішуваності. При низькій температурі для розчинення іприту можна використовувати лише низькокиплячі фракції, наприклад, легкий бензин і петролейний ефір, які є чудовими засобами для екстракції іприту.
Внаслідок своєї високої дифузійної здатності іприт швидко проникає через низку речовин та матеріалів. Так, рідкий іприт швидко просочується через тканини, шкіру, картон, папір та тонку гуму. Він швидко вбирається в пористі неоднорідні матеріали, такі як цегла, бетон, необроблена деревина і старі потріскані масляні покриття.
Хімічні властивості.При звичайній температурі біс-2-хлоретиловий тіоефір є стійкою сполукою. При нагріванні вище 170°С він розкладається з утворенням отруйних продуктів, що неприємно пахнуть, різного складу. Вище 500 ° С відбувається повне термічне розкладання. Короткочасне нагрівання навіть вище 300°С майже призводить до утворення продуктів розкладання, тому іприт вважається щодо стійким до детонації.
По відношенню до металів при звичайній температурі іприт інертний. Забруднений продукт, що зазвичай містить воду і хлористий водень, викликає корозію сталі. Солі заліза, що утворюються, сприяють корозії. Через гази, що виділяються - водню, сірководню, етилену н інших продуктів розкладання - слід зважати на підвищення тиску в закритих ємностях, мінах, бомбах і контейнерах для перевезення.
Гідроліз.У водних розчинах біс-2-хлоретиловий тіоефір гідролізується із заміщенням атомів хлору на гідроксильні групи. У присутності надлишку соляної кислоти реакція оборотна. Зазвичай вона йде з утворенням неотруйного тіодигліколю:
Воду, що містить невеликі кількості (I%) іприту, можна дегазувати кип'ятінням протягом 15 хв. При температурі нижче 0°З гідроліз триває кілька діб. Більш сильно заражену воду доводиться піддавати звичайним прийомам дегазації та очищення.
Внаслідок гідролізу концентрація іприту у повітрі через добу зменшується майже на порядок.
Через малу розчинність біс-2-хлоретилового тіоефіру, залежно від присутньої його кількості, вода заражається на тривалий термін, оскільки замість гідролізованого іприту у воду постійно поступово дифундують нові порції іприту. Досліди показують, що ОВ, що знаходиться під водою, залишається ефективним роками, якщо зовсім або майже відсутнє перемішування.
Так як ОВ практично нерозчинно у воді, гідроліз може протікати тільки на межі розділу фаз. Для швидкого гідролізу обов'язково потрібне енергійне перемішування. Якщо ж перемішування недостатньо, то, особливо при застосуванні технічних сортів іприту, через забруднень і домішок, що містяться в ньому, в результаті побічних реакцій утворюється третя фаза, в якій іприт мало розчинний і яка захищає і «консервує» його від подальшого гідролізу.
З усього сказаного вище ясно, що для досягнення повноти гідролізу потрібні великий надлишок води та енергійне перемішування або нагрівання, а ще краще, якщо діють усі три фактори.
Для того, щоб вивести гідроліз за поверхню розділу фаз гетерогенної системи, потрібно гомогенізувати суміші, скажімо, добавкою розчинників, які можуть змішуватися і з водою, і з іпритом (метанол та ін.). Такими добавками користуються, зокрема, при вживанні водних розчинів, що дегазують.
Швидкість гідролізу біс-2-хлоретилового тіоефіру залежить від концентрації іонів водню – сприяє йому лужне середовище, а кисла – перешкоджає та уповільнює гідроліз.
Реакція біс-2-хлоретилового тіоефіру з аміаком навіть при температурі вище 150 ° С йде дуже повільно. Однак під тиском вже при 60°С утворюється 1,4-тіазан - безбарвна рідина, що димиться на повітрі:

З первинними амінами в спиртових розчинах за звичайних умов відбувається аналогічна циклізація тіоефіру.
Окислення.Як типовий представник тіоефірів, іприт можна легко окислити в сульфоксид або сульфон відповідно до рівняння:
Як окислювачів придатні перекис водню, азотна кислота, перманганат калію, хромова кислота, хлорне вапно, гіпохлорити та ін.
Хоча продукти окиснення іприту - сульфоксид і біс-(2-хлоретил)-сульфон - сильно отруйні сполуки, а сульфоксид має навіть шкірно-наривну дію, окиснення іприту є однією з важливих реакцій дегазації. Продукти окислення являють собою тверді кристалічні речовини, і тому вони не мають шкірно-резорбтивних властивостей.
При дії сильних окислювачів або при окисленні в жорсткіших умовах реакція йде далі утворення сульфоксиду і сульфону і завершується повним розкладанням тіоефіру.
Біс-2-хлоретиловий тіоефір окислюється при 150°З надлишком концентрованої НNO 3 сульфоксид. Реакція швидка та екзотермічна. Вона може йти і далі - з виділенням двоокису азоту та утворенням зрештою сульфону:

При дії димлячої азотної кислоти і нагріванні утворюється, наприклад, 2-хлоретансульфокислота СlСН 2 СН 2 SO 2 ОН.
Для отримання біс-(2-хлоретил)-сульфоксиду біс-2-хлорэтиловий тіоефір додають по краплях при 20°З концентрованої НNО 3 . Якщо суміш розбавити водою, то сульфоксид випадає у вигляді білого осаду, який перекристалізовують з 60% етанолу (безбарвні лусочки, т. пл. 110°С).
При дії на іприт хромовим ангідридом в оцтовій кислоті при 100°С (20 хв нагрівання) утворюється чистий біс-(2-хлоретил)сульфон, т. пл. 55-56°С.
Сухе хлорне вапно переважно окислює іприт, але одночасно відбувається і хлорування. За певних умов ця швидка екзотермічна реакція супроводжується запаленням непрореагував тіоефіру. Як продукт реакції були ідентифіковані - хлористий водень, двоокис вуглецю, двоокис сірки, галогеналкани (наприклад, дихлоретан, хлороформ), хлораль, хлориди сірки та ін. При використанні кашки хлорного вапна реакція йде спокійніше з утворенням в основному сульфоксиду і сульфону.
Гіпохлорити у водних розчинах частково окислюють, частково хлорують біс-2-хлоретіловий тіоефір.
Хлорування.При дії хлору та, частково, інших хлоруючих агентів, наприклад дихлораміну та сульфурилхлориду, отримують різні хлоровані тіоефіри та сульфоксиди. Нижче наведені формули сполук, що виходять при хлоруванні іприту:

Всі вони, крім першої сполуки, що є твердою речовиною (білі нестійкі голки), є рідиною. Залежно від числа атомів хлору і від їх положення в молекулі ці продукти хлорування мають лише слабку, або зовсім не мають фізіологічної активності.
Реакції із хлорамінами.Моно- та дихлораміни легко реагують з біс-2-хлоретиловим тіоефіром. Дихлорамін має ту перевагу перед монохлораміном, що реакція йде в гомогенному середовищі, так як дихлорамін порівняно легко розчинний в органічних розчинниках. Продукти реакції неотруйні.
Реакція з гексаметилентетраміном.Однією з реакцій, важливих для дегазації шкіри, є запропонований Брюером і Бушеро вплив гексаметилентетрамін на гідроліз іприту. Хлористий водень, що виділяється при гідролізі, реагує з гексаметилентетраміном з утворенням формальдегіду, який, завдяки своїй дублячій дії, сприяє локалізації і кращому загоєнню іпритних уражень на шкірі. Застосування гексаметилентетраміну як стабілізатор цього ОВ пояснюється аналогічною реакцією.
Реакція виражається наступним рівнянням:
2S(СН 2 СН 2 Сl) 2 + 10Н 2 Про + (СН 2) 6 N 4 → 2S(СН 2 СН 2 ВІН) 2 + 4NН 4 Сl + 6НСНО
Реакції із солями металів.Подібно до незаміщених тіоефірів, іприт має здатність утворювати аддукти з солями металів, так звані солі сульфонія. Комплекси, що утворюються, іноді важко розчиняються у воді і мають характерне забарвлення, внаслідок чого вони знайшли застосування в якісному і кількісному аналізі.
Найчастіше використовують галогеніди важких металів - іодид та хлорид ртуті, хлориди міді, цинку, титану, платини, паладію та золота.
З хлорним золотом біс-2-хлоретиловий тіоефір утворює комплексне з'єднання:
S(СН 2 СН 2 Сl) 2 + АuСl 3 → [Сl 2 АuS + (СН 2 СН 2 Сl) 2 ]Сl -
Токсичні властивості.Іприт діє як контактна та інгаляційна отрута; пари та краплі іприту вражають очі. Як уже згадувалося, внаслідок високої розчинності іприту в ліпідах або його резорбції у всі органи настають інтоксикації загального характеру, які є причиною його загальної дії.
Здатність іприту проникати через шкіру залежить від температури. Швидкість резорбції пропорційна підвищенню температури: при 21-23°С вона становить близько 1,4·10 -3 мг/см 2 ·хв, за більш високої температури - близько 2,7·10 -3 мг/см 2 ·хв. Під час цього досвіду, що проводився на передпліччі, відносна вологість насиченого парами іприту повітря становила близько 46%. Кількості ОВ порядку 6 · 10 -3 мг, що проникали через шкіру, у 50% випадків викликали утворення пухирів.
У 100% випадків утворення еритем настає при дозі іприту 0,01 мг/см 2 поверхні шкіри, маленькі пухирі утворюються при 0,1-0,15 мг/см 2 великі - при 0,5 мг/см 2 .
Очі уражаються малою кількістю ОВ. Так, концентрація 1,2 · 10 -3 мг/л після 45 хв експозиції викликає світлобоязнь, спазм повік та запалення кон'юнктиви, що триває до 4 тижнів. Одужання настає через 3 місяці. Вищі концентрації при меншій експозиції призводять до небезпечних уражень очей.
При часі експозиції 2-5 хв концентрація 0,03 мг/л смертельна, концентрації вже в 0,01 мг/л при дії 15 хв дуже небезпечні, вони ведуть до уражень шкіри та сильних запалень слизової оболонки очей.
При підшкірній ін'єкції летальною дозою 40-60 мг/кг маси.
Використана література
Іприт, біс (2-хлороетил) сульфід- сульфуроорганічна сполука складу (ClCH 2 CH 2) 2 S. Іприт вперше був отриманий німецьким хіміком Віктором Меєром у 1886 році. Цьому передували роботи хіміків Деспре (1822), Немана (1859), Гутмана (1860), які досліджували цей клас сполук, проте не виділили її у чистому вигляді.
Чистий іприт є безбарвною маслянистою речовиною без запаху (технічний іприт має часниково-гірчичний запах і жовто-коричневий колір). Погано розчиняється у воді та необмежено – у багатьох органічних розчинниках.
За часів Першої світової війни іприт застосовувався як бойова отруйна речовина шкірно-наривної дії. Міжнародне позначення іприту як хімічної зброї — HD. Боєприпаси з іпритом у Німеччині давались взнаки жовтим хрестом (він входить до складу бойової суміші жовтий хрест,ньому. Gelbkreuz),США кодуються двома зеленими кільцями.
У 1993 році, в результаті підписання Конвенції про хімічну зброю, використання іприту як хімічної зброї було заборонено. Його включили до списку 1, який регламентує виробництво та обіг небезпечних речовин.
Термін іпритпоходить від назви бельгійського міста Іпр, поблизу якого в ніч на 13 липня 1917 року німецькими військами вперше застосовано дану речовину як хімічну зброю.
Токсична дія іприту полягає у пошкодженні очей, шкіри, дихальних шляхів. Симптоми отруєння виявляються із прихованим періодом о 2 годині, але при спекотній погоді та вологій шкірі вони з'являються відразу. Наслідком контакту з речовиною поява бульбашки з жовтуватою рідиною, які довго гояться і залишають рубці. При концентрації іприту у повітрі 0,03 мг/л смерть настає протягом 2-5 хвилин.
Речовина швидко проникає в будівельні матеріали, поглинається текстилем, гумою, папером, тому отруєння можливе і при контакті із зараженими предметами.
Фізичні властивості
Чистий іприт є безбарвною маслянистою рідиною зі слабким запахом касторки, технічний продукт має колір від жовтого до темно-коричневого і різкий запах (часника або гірчиці). Щільність парів повітрям становить 3,5. Тиск пари при 20°С - 0,072 мм рт. ст.
Температура плавлення чистої речовини становить 14,5 °C, а у технічного іприту, внаслідок наявності домішок, вона дещо нижча. Для запобігання замерзанню під час Першої світової війни до нього додавали хлоропікрин, хлоробензен, тетрахлорметан.
Погано розчиняється у воді (менше 1%), необмежено розчиняється в оліях, жирах, бензині, гасі, ацетоні, тетрахлорметані, спиртах, хлоропікрині. Змішується з іншими отруйними речовинами: етілдіхлороарсіном, фенілдіхлороарсіном, люїзитом.
Летучість іприту: 75 мг/м³ при 0°C (твердий), 610 мг/м³ при 20°C (рідкий), 2860 мг/м³ при 40°C (рідкий).
Не викликає корозії при зберіганні в алюмінієвих контейнерах; латунь швидко корродує при температурі 65°C. У вологому повітрі технічний іприт із домішками, що утворюються в результаті його розкладання (сірководень, хлороводень, етилен), викликає корозію сталі.
Отримання
Існує три основні способи синтезу іприту: з оксиран (оксиду етилену), етилену та вінілхлориду.
Синтез з оксиранпроводиться при температурі 80 ° C у дві стадії: сульфуванням за допомогою сірководню або гідросульфідів для одержання тіодігліколю, а згодом - хлоруванням сполуки:
Після вакуумної дистиляції отримують іприт із чистотою 95%. Вихід синтезу становить 90%. Цей спосіб вперше було проведено німецьким хіміком В. Меєром у 1886 році.
Синтез іприту з етиленуі хлоридів сірки розроблявся за часів Першої світової війни, а після її закінчення. Переважним способом отримання є реакція з SCl 2:
Хлорид сірки (II) зазвичай має домішки дихлорополісульфідів (S 2 Cl 2, S 3 Cl 2, S 5 Cl 2), тому кінцевий продукт може бути забруднений хлоретілполісульфідами (ClCH 2 CH 2) 2 S x. Наявний у реакційній суміші вільний хлор може утворювати поліхлоровані домішки.
Отримання іприту з вінілхлоридує найбільш доцільним, враховуючи легкість протікання реакції – вона відбувається вже за кімнатної температури (15-25°C):
Як ініціатори реакції використовують органічні перекису та ультрафіолетове випромінювання. Реакція протягом 10 хвилин із виходом продукту близько 75%. При використанні замість сірководню 1-меркапто-2-хлороетану HSCH 2 CH 2 Cl вихід реакції наближається до 100%.
Хімічні властивості
Іприт повільно гідролізується з утворенням соляної кислоти та тіодигліколю:
Він слабо розчиняється у воді, тому може не відчувати гідролізу тривалий час. Процес гідролізу прискорюють підвищення температури та присутність лугів.
Однією з найважливіших реакції є дія уротропіну при гідролізі: продуктом взаємодії соляної кислоти, що створюється, з уротропіном є формальдегід, який сприяє загоєнню ран:
При дії сильних окислювачів (перманганату калію, хроматної кислоти, азотної кислоти, гіпохлоритів), сульфід окислюється до сульфоксиду, а потім - у сульфону:
Незважаючи на те, що продукти окислення також є отруйними речовинами, цей спосіб застосовується для дегазації, тому що вони є кристалічними речовинами і не впливають на шкіру.
Подібно до інших тіотерів, іприт здатний утворювати з солями металів сульфонієві сполуки. Утворювані комплекси мають характерне забарвлення, інколи ж і низьку розчинність, тому іноді застосовуються в аналітичній хімії. Найчастіше реакція проводиться з галогенідами важких металів: йодидами та хлоридами міді, цинку, титану, платини, ауру:
Токсичність
Іприт діє на організм людини або інгаляційна та контактна отрута: краплі та аерозолі іприту вражають дихальні шляхи, шкіру, очі.
Речовина може проникати в організм через шкіру. Ця здатність залежить від температури навколишнього середовища: при 21-23°C проникнення становить 1,4 · 10 -3 мг/(см² · хв), при високих – близько 2,7 · 10 -3 мг/(см² · хв). Проникнення в організм іприту в кількості 6 · 10 -3 у половині випадків викликає появу пухирів. Утворення невеликих еритем відбувається при дозі 0,01 мг/см шкіри, великих – при дозі 0,5 мг/см. Очі уражаються навіть іпритом невеликої концентрації: його дія при концентрації 1,2 · 10 -3 мг/л протягом 45 хвилин викликає запалення очей, спазми повік, світлобоязнь, які продовжуються до 4 тижнів.
Дія іприту концентрацією 0,03 мг/л протягом 2-5 хвилин є летальною. Концентрація 0,01 мг/л небезпечна протягом 15 хвилин і веде до сильних ушкоджень очей, шкіри.
Контакт іприту за шкірою спочатку не викликає жодних неприємних відчуттів. Протягом перших 2-5 хвилин він проникає крізь шкіру, далі розчиняється у підшкірному жирі та згодом, через 20-30 хвилин, повністю всмоктується та потрапляє у кров. Після всмоктування настає прихований період тривалістю від 2 годин до доби залежно від дози, температури та вологості повітря, структури та вологості шкіри. У жарку погоду, при гарячій, вологій шкірі або ніжних її дільницях період прихованої дії значно скорочується і може бути майже відсутнім.
Перші ознаки ураження після закінчення періоду прихованої дії виявляються у вигляді сверблячки, печіння та почервоніння шкіри (еритеми) у місцях контакту з рідким або газоподібним іпритом. Шкіра натягується, стає сухою та теплою. При невеликих дозах ці явища за кілька діб проходять. При більш високих дозах розвивається набряклість, по краях якої через 16-30 годин після контакту з отрутою утворюється безліч дрібних пухирців. Надалі вони зливаються у великі або один великий міхур з безбарвною або жовтуватою рідиною. Пухирці прориваються і на шкірі утворюються хворобливі іпритні виразки, загоєння яких може тривати більше 2 місяців. Вторинна інфекція може призвести до гнійного запалення уражених ділянок шкіри. На місці залишаються рубці.
Захист
Основним захистом від іприту, зокрема, очей, обличчя та дихальних шляхів, є протигаз. Після попадання на бавовняний одяг іприт за три години повністю просочує його, що може в подальшому спричинити додаткові поразки. Для запобігання попаданню з'єднання на одяг та під нього користуються спеціальними захисними костюмами.
Для обробки шкіри (усунення незначних крапель іприту), одягу або предметів, що контактували з іпритом, застосовують окислювачі та агенти хлорування (гіпохлорити, хлорне вапно, хлороаміди).
Історія
Був синтезований у Німеччині - Німаном (у 1859 році) та (незалежно) британським ученим Фредеріком Гутрі (Frederick Guthrie) у 1860 році. Вперше іприт був застосований Німеччиною 12 липня 1916 проти англо-французьких військ, які були обстріляні мінами, що містили маслянисту рідину, у бельгійського міста Іпр (звідки і походить назва цієї речовини).
Під час Другої світової війни іприт застосовувався лише один раз Польщею, при цьому загинули два німецькі солдати, а дванадцять отримали поразки різного ступеня тяжкості. Крім того, іприт застосовувався під час придушення Синьцзянського повстання у 1934 році, у італо-ефіопську війну 1935-1936 років. У Дзержинську під час Другої світової війни був секретний завод, на якому начиняли іпритом авіабомби. Працівники цього заводу, що зазнали легеневих поразок парами іприту, у повоєнний час аж до 90-х рр. ХХ ст. щорічно проходили лікування у спецсанаторії "Карасан" за 15 кілометрів на південний захід від Алушти (між Алуштою та Ялтою).
Отримання
Іприт отримують двома способами:
З етилену CH2=CH2 і хлоридів сірки, наприклад, S2Cl2 або SCl2:
SCl2 + 2 C2H4 → (ClCH2CH2)2S
З тіодигліколю S(CH2CH2OH)2 та трихлориду фосфору PCl3:
3(HO-CH2CH2)2S + 2PCl3 → 3(Cl-CH2CH2)2S + 2P(OH)3
або тіодигліколю та соляної кислоти:
(HO-CH2CH2)2S + 2HCl → (Cl-CH2CH2)2S + 2H2O
Фізичні властивості
Іприт – безбарвна рідина із запахом часнику або гірчиці. Технічний іприт – темно-коричнева, майже чорна рідина з неприємним запахом. Температура плавлення становить 14,5 °C, температура кипіння - 217 °C (з частковим розкладанням), щільність 1,280 г/см3 (при 15 °C).
Іприт легко розчиняється в органічних розчинниках - галогеналканах, бензолі, хлорбензолі - так само добре, як і в рослинних або тваринних жирах; розчинність у воді становить 0,05%. У той час, як розчинність в абсолютному етанолі вище 16°С становить майже 100%, у 92%-му етанолі вона ледь досягає 25%.
Внаслідок деякої поверхневої активності він зменшує поверхневе натяг води і в невеликій мірі розтікається по ній тонким шаром, як плівка олії. Внаслідок додавання 1% високомолекулярного аміну C22H38O2NH2 розтікання іприту по воді збільшується на 39%.
Іприт дуже повільно гідролізується водою, швидкість гідролізу різко зростає у присутності їдких лугів, при нагріванні та перемішуванні.
Іприт енергійно реагує з хлоруючими та окислюючими агентами. Оскільки утворюються нетоксичні продукти, зазначені вище реакції використовують із його дегазації. Із солями важких металів іприт утворює комплексні пофарбовані з'єднання; на цій властивості засновано виявлення іприту.
Хімічні властивості
Іприт - це органічна сполука, яка має таку формулу: (ClCH2CH2)2S.
При звичайній температурі іприт є стійким з'єднанням. При нагріванні вище 170 ° C він розкладається з утворенням отруйних продуктів різного складу, що неприємно пахнуть. При температурі вище за 500 °C відбувається повне термічне розкладання. Короткочасне нагрівання навіть вище 300 ° C майже призводить до утворення продуктів розкладання, тому іприт вважається щодо стійким до детонації.
По відношенню до металів при звичайній температурі іприт інертний, він майже не впливає на свинець, латунь, цинк, сталь, алюміній; у разі підвищення температури сталь руйнується. Забруднений іприт, що зазвичай містить воду і хлористий водень, викликає корозію сталі. Солі заліза, що утворюються, сприяють корозії. Через гази, що виділяються (водню, сірководню, етилену та інших продуктів розкладання) слід зважати на підвищення тиску в закритих ємностях, мінах, бомбах і контейнерах для перевезення.
Інгібітори корозії та антиоксиданти перешкоджають розкладанню при зберіганні. Такими речовинами можуть бути, наприклад, галогеніди тетраалкіламонію, гексаметилентетрамін, піридин, піколін, хінолін та інші органічні амінопохідні.
В організмі людини іприт вступає у реакцію з NH групами нуклеотидів, що входять до складу ДНК. Це сприяє утворенню зшивок між ланцюгами ДНК, через що ця ділянка ДНК стає непрацездатною.
Вражаюча дія
Іприт впливає на організм людини декількома способами:
Людина після отруєння іпритом.
Руйнування клітинних мембран;
порушення обміну вуглеводів;
-«виривання» азотистих основ із ДНК та РНК.
Іприт має вражаючу дію за будь-яких шляхів проникнення в організм. Поразки слизових оболонок очей, носоглотки і верхніх дихальних шляхів виявляються навіть за незначних концентраціях іприту. При вищих концентраціях поруч із місцевими поразками відбувається загальне отруєння організму. Іприт має прихований період дії (2-8 год) і має кумулятивність.
У момент контакту з іпритом подразнення шкіри та болючі ефекти відсутні. Уражені іпритом місця схильні до інфекції. Поразка шкіри починається з почервоніння, яке проявляється через 2-6 годин після дії іприту. Через добу дома почервоніння утворюються дрібні бульбашки, наповнені жовтої прозорої рідиною, надалі зливаються. Через 2-3 дні бульбашки лопаються і утворюється виразка, що гоиться тільки через 20-30 діб. Якщо виразку потрапляє інфекція, то загоєння може затягтися до 2-3 місяців.
При вдиханні пари або аерозолю іприту перші ознаки ураження проявляються через кілька годин у вигляді сухості та печіння в носоглотці, потім настає сильний набряк слизової оболонки носоглотки, що супроводжується гнійними виділеннями. У важких випадках розвивається запалення легенів, смерть настає на 3-4-й день від ядухи.