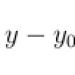природні або штучні перетворення ядер одних атомів на ядра інших атомів.
Нова алхімія? У 1903 році П'єр Кюрі виявив, що солі урану безперервно і без видимого зменшення згодом виділяють теплову енергію, яка в розрахунку на одиницю маси представлялася величезною в порівнянні з енергією найенергійніших хімічних реакцій. Ще більше теплоти виділяє радій близько 107 Дж на годину в розрахунку на 1 г чистої речовини. Виходило, що радіоактивних елементів, що є в глибинах земної кулі, достатньо (в умовах обмеженого тепловідведення) щоб розплавити магму
Де ж джерело цієї, здавалося б, невичерпної енергії? Марія Кюрі висунула наприкінці 19 ст. дві гіпотези. Одна з них (її поділяв лорд Кельвін ) полягала в тому, що радіоактивні речовини вловлюють якесь космічне випромінювання, запасаючи необхідну енергію. Відповідно до другої гіпотези випромінювання супроводжується якимись змінами в самих атомах, які при цьому втрачають енергію, яка і випромінюється. Обидві гіпотези здавалися однаково неймовірними, але поступово накопичувалося все більше даних на користь другої.
Великий внесок у розуміння того, що ж відбувається з радіоактивними речовинами, зробив Ернест Резерфорд. Ще в 1895 р. англійський хімік Вільям Рамзай, який прославився відкриттям у повітрі аргону, виявив у мінералі наклеп і інший благородний газ гелій. Згодом значні кількості гелію були виявлені і в інших мінералах, але тільки тих, які містили уран і торій. Це здавалося дивним і дивним: звідки в мінералах міг узятися рідкісний газ? Коли Резерфорд почав досліджувати природу альфа-частинок, які випускають радіоактивні мінерали, зрозуміли, що гелій є продуктом радіоактивного розпаду ( див.РАДІОАКТИВНІСТЬ). Отже, одні хімічно елементи здатні «породжувати» інші – це суперечило всьому досвіду, накопиченому кількома поколіннями хіміків.
Однак «перетворенням» урану та торію на гелій не обмежилося. У 1899 в лабораторії Резерфорда (тоді він працював у Монреалі) спостерігали ще одне дивне явище: препарати елемента торію в закритій ампулі зберігали постійну активність, а на відкритому повітрі їхня активність залежала від. Протягів. Резерфорд швидко зрозумів, що торій випускає радіоактивний газ (його назвали еманацією торію від лат. emanatio закінчення, або тороном), активність цього газу дуже швидко зменшувалася: вдвічі приблизно за одну хвилину (за сучасними даними за 55,6 с). Подібна газоподібна «еманація» була відкрита також у радію (її активність зменшувалася значно повільніше), її назвали еманацією радію, або радоном. Своя "еманація", що зникає всього за кілька секунд, виявилася і в актинія, її назвали еманацією актинія, або актиноном. Згодом з'ясувалося, що всі ці «еманації» є ізотопами одного і того ж хімічного елемента радону ( див.ЕЛЕМЕНТИ ХІМІЧНІ).
У 1900 році Резерфорд розповів про таємничу торону англійському радіохіміку Фредеріку Содді. Содді довів, що торон - інертний газ, подібний до аргону, відкритого за кілька років до цього в повітрі; це був один із ізотопів радону, 220 Rn. Еманація радію, як з'ясувалося згодом, виявилася іншим ізотопом радону 222 Rn (період напіврозпаду) Т 1/2 = 3,825 діб), а еманація актинія ? короткоживучим ізотопом того ж елемента: 219 Rn ( Т 1/2 = 4 с). Більше того, Резерфорд та Содді виділили з продуктів перетворення торію новий нелетючий елемент, відмінний за властивостями від торію. Його назвали торієм Х (згодом встановили, що це був ізотоп радію 224 Ra c Т 1/2 = 3,66 діб). Як з'ясувалося, «еманація торію» виділяється саме з торію Х, а не з вихідного торію. Подібні приклади множилися: спочатку хімічно ретельно очищених урані або торії з часом виявлялася домішка радіоактивних елементів, з яких, у свою чергу, виходили нові радіоактивні елементи, в тому числі і газоподібні. Так, що виділяються з багатьох радіоактивних препаратів a-частинки перетворювалися на газ, ідентичний гелію, який був відкритий наприкінці 1860-х на Сонці (спектральним методом), а в 1882 виявлений у деяких гірських породах.
Результати спільної роботи Резерфорд і Содді опублікували в 19021903 в ряді статей в «Philosophical Magazine» «Філософському журналі». У цих статтях, проаналізувавши отримані результати, автори дійшли висновку про можливість перетворення одних хімічних елементів на інші. Вони писали: «Радіоактивність - це атомне явище, що супроводжується хімічними змінами, в яких народжуються нові види речовини... Радіоактивність потрібно розглядати як прояв внутрішньоатомного хімічного процесу... Радіація супроводжує перетворення атомів... У результаті атомного перетворення утворюється речовина абсолютно нового виду , повністю відмінне за своїми фізичними та хімічними властивостями від первісної речовини».
У ті часи ці висновки були дуже сміливими; інші видатні вчені, серед яких були і подружжя Кюрі, хоча й спостерігали аналогічні явища, пояснювали їх присутністю «нових» елементів у вихідній речовині від самого початку (наприклад, з уранової руди Кюрі виділила полоній і радій, що міститься в ній). Проте, мають рацію Резерфорд і Содді: радіоактивність супроводжується перетворенням одних елементів на інші
Здавалося, що руйнується непорушне: незмінність і неподільність атомів, адже ще з часів Бойля і Лавуазьє хіміки дійшли висновку про нерозкладність хімічних елементів (як тоді казали, «простих тіл», цегли світобудови), про неможливість їхнього перетворення один на одного. Про те, що діялося в умах тогочасних вчених, яскраво свідчать висловлювання Д.І.Менделєєва, якому, ймовірно, здавалося, що можливість «трансмутації» елементів, про яку століттями тлумачили алхіміки, зруйнує створену ним і визнану в усьому світі струнку систему хімічних. елементів. У виданому у 1906 підручнику Основи хіміївін писав: «...я зовсім не схильний (на підставі суворої, але плідної дисципліни індуктивних знань) визнавати навіть гіпотетичну перетворюваність одних елементів один в одного і не бачу жодної можливості походження аргонових чи радіоактивних речовин із урану чи назад.»
Час показав помилковість поглядів Менделєєва щодо неможливості перетворення одних хімічних елементів на інші; одночасно воно підтвердило непорушність його головного відкриття періодичного закону. Наступні роботи фізиків і хіміків показали, у яких одні елементи можуть перетворюватися на інші і які закони природи керують цими перетвореннями.
Содді Ф. Історія атомної енергії. М., Атоміздат, 1979
Чоппін Г. та ін. Ядерна хімія. М., Вища школа, 1984
Гофман До. Чи можна зробити золото? Л., Хімія, 1984
Кадменський С.Г. Радіоактивність атомних ядер: історія, результати, новітні досягнення. «Соросівський освітній журнал», 1999 № 11
Знайти " РАДІОАКТИВНІ ПЕРЕТВОРЕННЯ"на
Було одним із найважливіших етапів у розвитку сучасного фізичного знання. Вчені дійшли правильних висновків щодо структури найдрібніших частинок не відразу. І набагато пізніше були відкриті інші закономірності - наприклад, закони руху мікрочастинок, і навіть особливості перетворення атомних ядер, які відбуваються при радіоактивному розпаді.
Досліди Резерфорда
Вперше радіоактивні перетворення атомних ядер вивчали англійський дослідник Резерфорд. Вже тоді було зрозуміло, що переважна більшість атома посідає його ядро, оскільки електрони у багато сотень разів легше, ніж нуклоны. Для того щоб дослідити позитивний заряд усередині ядра, в 1906 Резерфорд запропонував дослідити атом за допомогою зондування альфа-частинками. Такі частки виникали при розпаді радію, а також деяких інших речовин. У ході своїх дослідів Резерфорд отримав уявлення про будову атома, якому було надано назву «планетарної моделі».
Перші спостереження радіоактивності
Ще 1985 року англійський дослідник У. Рамзай, відомий своїм відкриттям газу аргону, зробив цікаве відкриття. У мінералі під назвою наклеп він виявив газ гелій. Згодом велику кількість гелію було знайдено також і в інших мінералах, але лише в тих, до складу яких входять торій та уран.
Досліднику це здавалося дуже дивним: звідки міг взятися в мінералах газ? Але коли Резерфорд почав вивчати природу радіоактивності, то виявилося, що гелій є продуктом радіоактивного розпаду. Одні хімічні елементи породжують інші, з абсолютно новими властивостями. І цей факт суперечив усьому попередньому досвіду хіміків того часу.

Спостереження Фредеріка Соді
Разом із Резерфордом у дослідженнях брав безпосередню участь вчений Фредерік Содді. Він був хіміком, і тому вся його робота проводилася щодо ототожнення хімічних елементів відповідно до їх властивостей. Насправді радіоактивні перетворення атомних ядер вперше помітили Содді. Він зумів з'ясувати, що є альфа-частинки, якими користувався у своїх дослідах Резерфорд. Зробивши вимірювання, вчені з'ясували, що маса однієї альфа-частинки становить 4 атомні одиниці маси. Нагромадивши певну кількість таких альфа-часток, дослідники виявили, що вони перетворилися на нову речовину – гелій. Властивості цього газу були добре відомі Соді. Тому він стверджував, що альфа-частинки зуміли захопити електрони ззовні та перетворитися на нейтральні атоми гелію.
Зміни усередині ядра атома
Наступні дослідження було спрямовано виявлення особливостей атомного ядра. Вчені зрозуміли, що це перетворення відбуваються не з електронами або електронною оболонкою, а безпосередньо з самими ядрами. Саме радіоактивні перетворення атомних ядер сприяли перетворенню одних речовин на інші. Тоді ще особливості цих перетворень вченим були невідомі. Але зрозуміло було одне: у результаті якимось чином з'являються нові хімічні елементи.
Вперше такий ланцюжок метаморфоз вченим вдалося простежити у процесі перетворення радію на радон. Реакції, у яких відбувалися такі перетворення, що супроводжувалися особливим випромінюванням, дослідники назвали ядерними. Переконавшись, що ці процеси протікають саме всередині ядра атома, вчені почали досліджувати й інші речовини, як радій.

Відкриті види випромінювань
Основна дисципліна, яка може вимагати відповіді на такі питання - це фізика (9 клас). Радіоактивні перетворення атомних ядер входять до її курсу. Проводячи досліди над проникаючою здатністю уранового випромінювання, Резерфорд відкрив два види випромінювань або радіоактивних перетворень. Менш проникаючий тип був названий альфа-випромінюванням. Пізніше було досліджено і бета-випромінювання. Гамма-випромінювання вперше було вивчено Полем Віллардом у 1900 році. Вчені показали, що радіоактивності пов'язані з розпадом атомних ядер. Таким чином, за панівними до того часу уявленнями про атом як про неподільну частинку було завдано нищівного удару.

Радіоактивні перетворення атомних ядер: основні типи
Зараз вважається, що під час радіоактивного розпаду відбувається три види перетворень: альфа-розпад, бета-розпад, електронне захоплення, інакше зване К-захопленням. При альфа-розпаді відбувається випромінювання з ядра альфа-частинки, яка є ядром атома гелію. Саме радіоактивне ядро при цьому перетворюється на таке, що має менший електричний заряд. Альфа-розпад властивий речовинам, які займають останні місця у таблиці Менделєєва. Бета-розпад також входить у радіоактивні перетворення атомних ядер. Склад атомного ядра у своїй типі також змінюється: воно втрачає нейтрино чи антинейтрино, і навіть електрони і позитрони.
Цей тип розпаду супроводжується короткохвильовим електромагнітним випромінюванням. При електронному захопленні ядро атома поглинає одне із найближчих електронів. При цьому ядро берилію може перетворитися на ядро літію. Цей тип було виявлено у 1938 році фізиком з Америки на прізвище Альварес, який також вивчав радіоактивні перетворення атомних ядер. Фото, на яких дослідники намагалися сфотографувати такі процеси, містять зображення, схожі на розмиту хмару, внаслідок малих величин досліджуваних частинок.
1. РАДІОАКТИВНІ ПЕРЕТВОРЕННЯ
Ернест Резерфорд народився у Новій Зеландії в англійській родині. У Новій Зеландії він здобув вищу освіту, а потім у 1895 р. приїхав до Кембриджу і зайнявся науковою роботою як асистент Томсона. У 1898 р. Резерфорда запросили на кафедру фізики Монреальського університету Мак-Гілла (Канада), де продовжував дослідження радіоактивності, розпочате ще в Кембриджі.
У 1899 р. у Монреалі колега Резерфорда Оунз повідомив йому, що радіоактивність торію чутлива до потоків повітря. Це спостереження здалося цікавим, Резерфорд зацікавився і виявив, що радіоактивність з'єднань торію, якщо торій знаходиться в закритій ампулі, зберігає постійну інтенсивність, якщо ж досвід проводиться на відкритому повітрі, вона швидко зменшується, причому на результатах позначаються навіть слабкі потоки повітря. Крім того, тіла, розташовані по сусідству із сполуками торію, через деякий час самі починають випускати випромінювання, якби вони теж були радіоактивними. Цю властивість Резерфорд назвав «збудженою активністю».
Резерфорд досить швидко зрозумів, що всі ці явища можна легко пояснити, якщо припустити, що з'єднання торію випускають, крім α-часток, ще інші частинки, які радіоактивні. Речовина, що складається з цих частинок, він назвав «еманацією» і вважав його подібним до радіоактивного газу, який, розташовуючись найтоншим невидимим шаром на тілах, що знаходяться поряд з торієм, що виділяє цю еманацію, повідомляє цим тілам здається радіоактивність. Керуючись цим припущенням, Резерфорд зумів відокремити цей радіоактивний газ за допомогою простої витяжки повітря, що мав зіткнення з препаратом торію, а потім, ввівши його в іонізаційну камеру, таким чином визначив його активність і основні фізичні властивості. Зокрема, Резерфорд показав, що ступінь радіоактивності еманації (охрещеної пізніше тороном, подібно до того, як були названі радоном і актиноном радіоактивні гази, що випромінюються радієм і актинієм) дуже швидко зменшується в геометричній прогресії залежно від часу: кожну хвилину активність зменшується вдвічі, через десять хвилин вона вже стає зовсім непомітною.
Тим часом подружжя Кюрі показало, що радій теж має властивість збуджувати активність прилеглих тіл. Для пояснення радіоактивності опадів радіоактивних розчинів вони прийняли висунуту Беккерелем теорію та назвали це нове явище «індукованою радіоактивністю». Подружжя Кюрі вважало, що індукована радіоактивність викликається якимось особливим збудженням тіл променями, що випромінюються радієм: щось схоже на фосфоресценцію, якою вони прямо уподібнювали це явище. Втім, Резерфорд, говорячи про «збуджену активність», спочатку теж, мабуть, мав на увазі явище індукції, яке фізика XIX століття цілком готова була прийняти. Але Резерфорду вже було відомо більше, ніж подружжю Кюрі: він знав, що збудження, чи індукція, було не прямим наслідком впливу торію, а результатом дії еманації. Тоді Кюрі ще не відкрили еманації радію, вона була отримана Латером і Дорном в 1900 р., після того як вони повторили такі ж дослідження радію, які Резерфорд провів раніше з торієм.
Навесні 1900 р., опублікувавши своє відкриття, Резерфорд перервав дослідження і повернувся до Нової Зеландії, де мало відбутися його весілля. Після повернення в Монреаль того ж року він зустрівся з Фредеріком Содді (1877-1956), який закінчив хімічний факультет в Оксфорді в 1898 р. і також недавно приїхав до Монреалю. Зустріч цих двох молодих людей була щасливою подією історії фізики. Резерфорд розповів Содді про своє відкриття, про те, що йому вдалося виділити торон, наголосив на широкому полі досліджень, яке тут відкривалося, і запропонував йому об'єднатися для спільного хіміко-фізичного вивчення сполуки торію. Соді погодився.
Це дослідження зайняло у молодих вчених два роки. Соді, зокрема, вивчив хімічну природу еманації торію. В результаті своїх досліджень він показав, що новий газ зовсім не вступає в жодні відомі хімічні реакції. Тому залишалося припустити, що він належить до інертних газів, а саме (як Содді виразно показав на початку 1901 р.) новий газ за своїми хімічними властивостями подібний до аргону (зараз відомо, що це один з його ізотопів), який Релей і Рамсей виявили у повітрі 1894 р.
Наполеглива робота двох молодих учених увінчалася новим значним відкриттям: разом з торієм у їх препаратах було виявлено інший елемент, який відрізнявся за хімічними властивостями від торію, а за активністю перевершував торій принаймні кілька тисяч разів. Цей елемент був хімічно відокремлений від торію осадженням за допомогою аміаку. За прикладом Вільяма Крукса, який 1900 р. назвав радіоактивний елемент, отриманий ним з урану, ураном X, молоді вчені назвали новий радіоактивний елемент торієм X. Активність цього нового елемента протягом чотирьох днів зменшується наполовину; цього часу було достатньо, щоб докладно вивчити його. Дослідження дозволили зробити висновок, що не підлягає сумніву: еманація торію виходить зовсім не з торію, як це здавалося, а з торію X. Якщо в деякому зразку торій торій X відокремлювався від торію, то інтенсивність радіації торію була спочатку набагато менше, ніж до поділу, але поступово вона збільшувалася з часом за експоненційним законом завдяки постійному утворенню нової радіоактивної речовини.
У першій роботі 1902 р. вчені, пояснюючи всі ці явища, дійшли висновку, що
«...радіоактивність - це атомне явище, що супроводжується хімічними змінами, у якому породжуються нові види речовини. Ці зміни мають відбуватися всередині атома, а радіоактивні елементи є, мабуть, спонтанними перетвореннями атомів... Тому радіоактивність потрібно розглядати як прояв внутрішньоатомного хімічного процесу» (Philosophical Magazine, (6), 4, 395 (1902)).
А наступного року вони писали вже більш точно:
«Радіоактивні елементи мають серед усіх інших елементів найбільшу атомну вагу. Це, власне, і є їх єдина загальна хімічна властивість. В результаті атомного розпаду та викидання важких заряджених частинок з масою того ж порядку, що і маса атома водню, залишається нова система, легша, ніж первісна, з фізичними та хімічними властивостями, зовсім відмінними від властивостей вихідного елемента. Процес розпаду, розпочавшись одного разу, потім вже переходить з одного ступеня в інший з певними швидкостями, цілком вимірними. На кожному ступені випускається одна або кілька α-часток, поки не досягаються останні ступені, коли α-частки або електрони вже випущені. Очевидно, доцільно було б дати спеціальні назви цим новим уламкам атомів і новим атомам, які виходять з початкового атома після випромінювання частки і існують лише обмежений відрізок часу, постійно зазнаючи подальших змін. Їхньою відмінністю є нестійкість. Кількості, в яких вони можуть скупчуватися, дуже невеликі, тому малоймовірно, щоб їх можна було вивчати звичайними способами. Нестійкість і пов'язане з нею випромінювання променів і дають нам спосіб вивчення. Тому ми пропонуємо називати ці уламки атомів "метаболонами"» (Philosophical Magazine, (6), 5, 536 (1903)).
Запропонований термін не втримався, тому що ця перша обережна спроба сформулювати теорію була незабаром виправлена самими авторами та уточнена у низці неясних пунктів, які, напевно, наголосив і сам читач. У виправленому вигляді теорія вже не потребувала нового терміну і через десять років одним з цих молодих учених, які стали на той час вже вченими зі світовим ім'ям і лауреатом Нобелівської премії з фізики, була виражена так:
«Атоми радіоактивної речовини схильні до спонтанних видозмін. У кожний момент невелика частина загальної кількості атомів стає нестійкою і вибухоподібно розпадається. У переважній більшості випадків з величезною швидкістю викидається уламок атома - α-частка, в деяких інших випадках вибух супроводжується викиданням швидкого електрона і появою рентгенівських променів, що мають велику проникаючу здатність і відомі під назвою γ-випромінювання. Радіація супроводжує перетворення атомів і є мірою, що визначає ступінь їх розпаду. Було виявлено, що в результаті атомного перетворення утворюється речовина абсолютно нового виду, повністю відмінна за своїми фізичними та хімічними властивостями від початкової речовини. Ця нова речовина, однак, сама теж нестійка і зазнає перетворення з випромінюванням характерного радіоактивного випромінювання.
Таким чином, точно встановлено, що атоми деяких елементів схильні до спонтанного розпаду, що супроводжується випромінюванням енергії в кількостях, величезних порівняно з енергією, що звільняється при звичайних молекулярних видозмінах» ( E. Rutherford, structure of the atom, Scientia, 16, 339 (1914)).
У статті 1903 р., що вже цитувалася, Резерфорд і Содді склали таблицю «метаболонів», які, згідно з їхньою теорією, утворюються відповідно до їх власних дослідів та дослідів інших учених як продукти розпаду:

Такими є перші «генеалогічні дерева» радіоактивних речовин. Поступово інші речовини зайняли своє місце в цих сімействах природних радіоактивних елементів, і було встановлено, що таких сімейств всього три, з яких два мають уран, а третє - торій. Перше сімейство налічує 14 «нащадків», тобто 14 елементів, що виходять один з одного в результаті послідовного розпаду, друге – 10, третє – 11; у будь-якому сучасному підручнику фізики можна знайти докладний опис цих «генеалогічних дерев».
Дозволимо собі одне зауваження. Зараз може здаватися цілком природним, більше того, що само собою зрозуміло той висновок, до якого дійшли в результаті своїх досвідів Резерфорд і Содді. По суті, про що йшлося? Про те, що через деякий час у спочатку чистому торії виявлялася домішка нового елемента, з якого у свою чергу утворювався газ, що також має радіоактивність. Утворення нових елементів можна побачити наочно. Наочно, але не дуже. Потрібно мати на увазі, що кількості, в яких утворювалися нові елементи, були дуже далекі від тих мінімальних доз, які були необхідні для найточнішого хімічного аналізу. Йшлося про ледь помітні сліди, які можна виявити лише радіоактивними методами, з фотографії та іонізації. Але всі ці ефекти можна було пояснити й іншим способом (індукцією, присутністю нових елементів у вихідних препаратах із самого початку, як це було при відкритті радію, тощо). Те, що розпад зовсім не був такий очевидний, ясно хоча б з того, що ні Крукс, ні Кюрі не побачили ні найменшого натяку на це, хоча й спостерігали аналогічні явища. Не можна замовчати і про те, що потрібна була велика мужність, щоб у 1903 р., у розпал тріумфу атомістики, говорити про перетворення елементів. Ця гіпотеза аж ніяк не була захищена від всілякої критики і, можливо, не встояла б, якби Резерфорд і Содді з дивовижною завзятістю не відстоювали її протягом цілих десятиліть, вдаючись до нових доказів, про які ми ще говоритимемо.
Нам здається доречним додати тут, що теорія радіоактивної індукції також надала велику послугу науці, запобігши розпорошенню сил у пошуках нових радіоактивних елементів при кожному прояві радіоактивності у нерадіоактивних елементів.
2. ПРИРОДА α-ЧАСТИНИ
Дуже важливим пунктом теорії радіоактивного розпаду, який ми досі обходили, проте, мовчанням з метою простоти викладу, є природа α-частинок, що випускаються радіоактивними речовинами, оскільки гіпотеза, приписує їм корпускулярні властивості, має значення для теорії Резерфорда і Содди.
Спочатку α-частинки - повільна, легко поглинається речовиною компонента випромінювання - після їх відкриття Резерфордом не привертали особливої уваги фізиків, які цікавилися переважно швидкими β-променями, що мають у сто разів більшу проникаючу здатність, ніж α-частинки.
Той факт, що Резерфорд передбачив важливість α-частинок для пояснення радіоактивних процесів і багато років присвятив їх вивченню, є одним із найяскравіших проявів геніальності Резерфорда та одним із головних факторів, що визначили успіх його діяльності.

У 1900 р. Роберт Релей (Роберт Стретт, син Джона Вільяма Релея) і незалежно від нього Крукс висунули гіпотезу, не підтверджену жодним досвідченим доказом, згідно з якою α-частинки несуть позитивний заряд. Сьогодні дуже добре можна зрозуміти ті труднощі, які стояли на шляху експериментального дослідження α-часток. Цих труднощів дві: по-перше, α-частки набагато важчі β-часток, тому вони незначно відхиляються під впливом електричних та магнітних полів, і, звичайно, простого магніту було недостатньо, щоб отримати помітне відхилення; по-друге, α-частки швидко поглинаються повітрям, від чого спостерігати їх стає ще важче.
Протягом двох років Резерфорд намагався домогтися відхилення α-часток у магнітному полі, але весь час отримував невизначені результати. Нарешті, наприкінці 1902 р., коли йому вдалося завдяки люб'язному посередництву П'єра Кюрі отримати достатню кількість радію, він зміг надійно встановити відхилення α-часток у магнітному та електричному полях за допомогою показаного на стор. 364 пристрою.
Відхилення, що спостерігалося ним, дозволило визначити, що α-частка несе позитивний заряд; за характером відхилення Резерфорд визначив також, що швидкість -частки приблизно дорівнює половині швидкості світла (пізніші уточнення зменшили швидкість приблизно до однієї десятої швидкості світла); відношення e/m вийшло рівним приблизно 6000 електромагнітних одиниць. З цього випливало, що якщо α-частка несе елементарний заряд, то її маса має бути вдвічі більшою за масу атома водню. Резерфорд усвідомлював, що всі ці дані найвищою мірою наближені, але один якісний висновок вони все ж таки дозволяли зробити: α-частинки мають масу того ж порядку, що й атомні маси, і тому подібні до каналових променів, які спостерігав Гольдштейн, але мають значно більшу швидкість. Отримані результати, каже Резерфорд, «проливають світло на радіоактивні процеси», і відображення цього світла ми вже бачили в уривках із статей Резерфорда і Содді, що цитувалися.

У 1903 р. Марія Кюрі підтвердила відкриття Резерфорда за допомогою описуваної тепер у всіх підручниках фізики установки, в якій завдяки сцинтиляції, що викликається всіма променями, що випромінює радій, можна було одночасно спостерігати протилежні відхилення α-часток і β-променів та несприйнятливість γ-і до електричного та магнітного полів.
Теорія радіоактивного розпаду навела Резерфорда і Содді на думку, що всі стійкі речовини, що виходять при радіоактивних перетвореннях елементів, повинні бути присутніми на радіоактивних рудах, в яких ці перетворення відбуваються вже протягом багатьох тисяч років. Чи не слід вважати гелій, знайдений Рамсеєм і Траверсом в уранових рудах, продуктом радіоактивного розпаду?
З початку 1903 р. вивчення радіоактивності отримало несподівано новий поштовх завдяки тому, що Гізель (фірма «Хінінфабрик», Брауншвейг) випустив у продаж за порівняно помірними цінами такі чисті сполуки радію, як гідрат бромистого радію, що містить 50% чистого елемента. До цього доводилося працювати зі сполуками, що містили якнайбільше 0,1% чистого елемента!
На той час Содді повернувся до Лондона, щоб продовжувати там вивчення властивостей еманації в хімічній лабораторії Рамсея – єдиної тоді у світі лабораторії, де можна було проводити дослідження такого роду. Він купив 30 мг препарату, що надійшов у продаж, і цієї кількості виявилося йому достатньо, щоб разом з Рамсеєм у тому ж 1903 р. довести, що гелій присутній у радії, що має вік кілька місяців, і що при розпаді еманації утворюється гелій.
Але яке місце посідав гелій у таблиці радіоактивних перетворень? Чи був він кінцевим продуктом перетворень радію чи продуктом якоїсь із стадій його еволюції? Резерфорд дуже скоро здогадався, що гелій утворимося α-частинками, що випускаються радієм, що кожна α-частинка є атомом гелію з двома позитивними зарядами. Але, щоб довести це, знадобилися роки роботи. Доказ було отримано лише тоді, коли Резерфорд та Гейгер винайшли лічильник α-часток, про який ми говорили в гол. 13. Вимірювання заряду окремої α-частинки та визначення відношення e/m відразу ж дало для її маси m значення, що дорівнює масі атома гелію.
І все ж таки всі ці дослідження та підрахунки ще не доводили рішуче, що α-частинки тотожні з іонами гелію. Справді, якби, скажімо, одночасно з викиданням α-частинки звільнявся атом гелію, то всі досліди та розрахунки залишалися б чинними, але α-частинка могла б бути і атомом водню або якоїсь іншої невідомої речовини. Резерфорд добре розумів можливість такої критики і, щоб відхилити її, в 1908 р. разом з Ройдсом дав рішучий доказ своєї гіпотези за допомогою установки, схематично зображеної на наведеному малюнку: -частки, що випускаються радоном, збираються і накопичуються в трубці для спектроскопічного аналізу; у своїй спостерігається характерний спектр гелію.
Таким чином, починаючи з 1908 р. вже не було жодних сумнівів у тому, що α-частинки є іонами гелію і що гелій є складовою природних радіоактивних речовин.
Перш ніж перейти до іншого питання, додамо ще, що через кілька років після виявлення гелію в уранових рудах американський хімік Болтвуд, досліджуючи руди, що містять уран і торій, дійшов висновку, що останнім нерадіоактивним продуктом послідовного ряду перетворень урану є свинець і що того, радій та актиній – самі продукти розпаду урану. Таблиця «метаболонів» Резерфорда і Содді мала, таким чином, зазнати суттєвої зміни.
Теорія атомного розпаду призводила до ще одного нового цікавого слідства. Оскільки радіоактивні перетворення відбуваються з незмінною швидкістю, яку міг змінити ніякої фізичний чинник, відомий у той час (1930 р.), то за співвідношенням кількостей урану, свинцю і геліяг присутніх в уранової руді, можна визначити вік самої руди, тобто. вік Землі. Перший підрахунок дав цифру в один мільярд вісімсот мільйонів років, але Джон Джолі (1857-1933) та Роберт Релей (1875-1947), які провели важливі дослідження в цій галузі, вважали цю оцінку дуже неточною. Зараз вік уранових руд вважають приблизно рівним півтора мільярда років, що не дуже відрізняється від початкової оцінки.
3. ОСНОВНИЙ ЗАКОН РАДІОАКТИВНОСТІ
Ми вже говорили, що Резерфорд встановив на досвіді експоненційний закон зменшення активності еманації торію з часом: активність зменшується вдвічі приблизно за одну хвилину. Усі радіоактивні речовини, досліджені Резерфордом та інші, підпорядковувалися якісно такому закону, але кожному їх відповідав свій період напіврозпаду. Цей експериментальний факт виражається простою формулою ( Ця формула має вигляд
де постійна напіврозпаду, а зворотна їй величина є середній час життя елемента. Час, необхідний у тому, щоб кількість атомів зменшилося вдвічі, називається періодом, чи часом, напіврозпаду. Як ми вже сказали, А сильно змінюється від елемента до елемента і, отже, змінюються і всі інші залежні від неї величини. Наприклад, середній час життя урану I дорівнює 6 мільярдам 600 мільйонам років, а актинія А - трьом тисячним часткам секунди), що встановлює співвідношення між числом N 0 радіоактивних атомів у початковий момент і числом атомів, що ще не розпалися, в момент t. Цей закон можна висловити інакше: частка атомів, що розпадаються за певний проміжок часу, є постійною, що характеризує елемент, і називається постійною радіоактивним розпадом, а величина, обернена їй, називається середнім часом життя.
До 1930 р. був відомо якогось чинника, який впливав би хоч у найменшою мірою на природну швидкість цього явища. Починаючи з 1902 р., Резерфорд і Содді, а потім і багато інших фізиків поміщали радіоактивні тіла в різні фізичні умови, але жодного разу не отримали жодної зміни постійної радіоактивного розпаду.
«Радіоактивність, - писали Резерфорд і Содді, - згідно з нашими сьогоднішніми знаннями про неї, слід розглядати як результат процесу, що залишається зовсім поза сферою дії відомих нам і контрольованих сил; вона не може бути ні створена, ні змінена, ні зупинена» (Philosophical Magazine, (6), 5, 582 (1903).).
Середній час життя елемента - це точно певна константа, незмінна кожному за елемента, проте індивідуальне час життя окремого атома даного елемента зовсім невизначено. Середній час життя не зменшується з часом: воно те саме як для групи атомів, що тільки що утворилися, так і для групи атомів, що утворилися в ранні геологічні епохи. Коротше кажучи, вдаючись до антропоморфного порівняння, можна сказати, що атоми радіоактивних елементів вмирають, але не старіють. Загалом із самого початку основний закон радіоактивності видався абсолютно незбагненним, яким залишається й донині.
Зі всього сказаного ясно, і це було зрозуміло відразу ж, що закон радіоактивності - закон імовірнісний. Він стверджує, що можливість розпаду атома зараз однакова всім наявних радіоактивних атомів. Йдеться, таким чином, про статистичний закон, який тим ясніше виявляється, чим більша кількість аналізованих атомів. Якби явище радіоактивності впливали зовнішні причини, то пояснення цього закону було б досить простим: в такому разі атомами, що розпадаються в даний момент, були б саме ті атоми, які знаходяться по відношенню до впливової зовнішньої причини в особливо сприятливих умовах. Ці особливі умови, що призводять до розпаду атома, можна було б, наприклад, пояснити тепловим збудженням атомів. Іншими словами, статистичний закон радіоактивності мав би тоді такий самий зміст, як і статистичні закони класичної фізики, що розглядаються як синтез приватних динамічних законів, які через велику кількість просто зручно розглядати статистично.
Але дані досвіду не давали жодної можливості звести цей статистичний закон до суми приватних законів, що визначаються зовнішніми причинами. Виключивши зовнішні причини, почали шукати причини перетворення атома у самому атомі.
«Оскільки, - писала Марія Кюрі, - у сукупності великої кількості атомів деякі з них негайно руйнуються, тоді як інші продовжують існувати протягом дуже довгого часу, то не можна вже розглядати всі атоми однієї і тієї ж простої речовини як абсолютно однакові, а слід визнати, що різницю у тому долі визначається індивідуальними відмінностями. Але тоді виникає нова проблема. Відмінності, які ми хочемо враховувати, повинні бути такими, що вони не повинні визначати, так би мовити, «старіння» речовини. Вони повинні бути такими, щоб ймовірність того, що атом проживе ще деякий час, не залежала від того часу, протягом якого він уже існує. Будь-яка теорія будови атомів повинна задовольняти цю вимогу, якщо вона заснована на висловлених вище міркуваннях» (Rapports et discussions du Conseil Solvay tenu Bruxelles du 27 au 30 avril 1913, Paris, 1921, p. 68-69).
Точку зору Марії Кюрі поділяв і її учень Деб'єрн, який висунув припущення, що кожен радіоактивний атом безперервно швидко проходить через численні різні стани, зберігаючи незмінним і незалежним від зовнішніх умов середній стан. Звідси випливає, що в середньому всі атоми одного і того ж виду мають однакові властивості і однакову ймовірність розпаду, що обумовлюється нестійким станом, через який атом час від часу проходить. Але наявність постійної ймовірності розпаду атома передбачає надзвичайну його складність, оскільки він повинен складатися з великої кількості елементів, схильних до безладних рухів. Це внутрішньоатомне збудження, обмежене центральною частиною атома, може призвести до необхідності введення внутрішньої температури атома, яка значно вища за зовнішню.
Ці міркування Марії Кюрі та Деб'єрна, не підтверджені, однак, жодними досвідченими даними і які не призвели до жодних реальних наслідків, не знайшли відгуку серед фізиків. Ми згадали їх тому, що спроба класичного тлумачення закону радіоактивного розпаду, що виявилася безрезультатною, була першим, або принаймні найбільш переконливим, прикладом статистичного закону, який не можна отримати з законів індивідуальної поведінки окремих об'єктів. Виникає нова концепція статистичного закону, даного безпосередньо, безвідносно до поведінки індивідуальних об'єктів, що становлять сукупність. Така концепція стане ясною лише через десять років після невдалих зусиль Кюрі та Деб'єрна.
4. РАДІОАКТИВНІ ІЗОТОПИ
У першій половині минулого століття деякі хіміки, зокрема Жан Батист Дюма (1800-1884), помітили певний зв'язок між атомною вагою елементів та їх хімічними та фізичними властивостями. Ці спостереження було завершено Дмитром Івановичем Менделєєвим (1834-1907), який у 1868 р. опублікував свою геніальну теорію періодичної системи елементів, одне з найглибших узагальнень у хімії. Менделєєв розташував відомі на той час елементи у порядку зростання атомної ваги. Ось перші з них, із зазначенням їхньої атомної ваги за даними того часу:
7Li; 9,4Ве; 11В; 12С; 14N; 160; 19F;
23Na; 24Mg; 27,3Al; 28Si; 31P; 32S; 35,50Сl.
Менделєєв зауважив, що хімічні та фізичні властивості елементів є періодичними функціями від атомної ваги. Наприклад, у першому ряду виписаних елементів густина регулярно зростає зі збільшенням атомної ваги, досягає максимуму в середині ряду, а потім зменшується; таку ж періодичність, хоч і не настільки чітку, можна бачити і щодо інших хімічних та фізичних властивостей (точка плавлення, коефіцієнт розширення, провідність, окислюваність тощо) для елементів як першого, так і другого ряду. Ці зміни відбуваються за однаковим законом в обох рядах, так що елементи, які знаходяться в одній і тій же колонці (Li і Na, Be і Mg і т. д.), мають аналогічні хімічні властивості. Ці два ряди називаються періодами. Таким чином, всі елементи можна розподілити за періодами відповідно до їх властивостей. З цього і випливає закон Менделєєва: властивості елементів перебувають у періодичній залежності від їхньої атомної ваги.

Тут не місце розповідати про жваву дискусію, яку викликала періодична класифікація, та її поступове затвердження завдяки безцінним послугам, які вона надала розвитку науки. Достатньо лише вказати, що до кінця минулого століття її було прийнято майже всіма хіміками, які приймали її як досвідчений факт, переконавшись у марності всіх спроб теоретично її інтерпретувати.
На самому початку XX століття при обробці дорогоцінного каміння на Цейлоні було відкрито новий мінерал, торіаніт, який, як відомо зараз, є торієво-урановим мінералом. Деяка кількість торіаніту була надіслана до Англії для аналізу. Однак при першому аналізі через помилку, яку Содді приписує відомої німецької роботи з аналітичної хімії, був поплутаний торій з цирконієм, через що досліджуване речовина, що вважалося уранової рудою, було оброблено методом Кюрі для відокремлення радію від уранової руди. У 1905 р., застосувавши зазначений спосіб, Вільгельм Рамсей і Отто Хан (останній обезсмертив своє ім'я через тридцять років, відкривши реакцію поділу урану) отримали речовину, яку хімічний аналіз визначав як торій, але яка відрізнялася від нього набагато інтенсивнішою радіоактивністю. Як і у випадку торію, в результаті його розпаду утворилися торій X; торон та інші радіоактивні елементи. Інтенсивна радіоактивність свідчила про наявність у отриманій речовині нового радіоактивного елемента, хімічно ще визначеного. Його назвали радіоторієм. Незабаром з'ясувалося, що він є елементом з ряду розпаду торію, що він вислизнув від попереднього аналізу Резерфорда і Содді і повинен бути вставлений між торієм і торієм X. Середній час життя радіоторію дорівнював приблизно двом рокам. Це досить довгий термін, щоб радіоторій міг замінити в лабораторіях дорогий радій. Крім суто наукового інтересу, ця економічна причина спонукала багатьох хіміків спробувати виділити його, але всі спроби виявилися безрезультатними. Ніяким хімічним процесом відокремити його від торію не вдавалося, більше того, в 1907 р. проблема, здавалося, ще більше ускладнилася, тому що Хан відкрив мезоторій - елемент, що породжує радіоторій, який теж виявився невіддільним від торію. Американські хіміки Мак-Кой і Росс, зазнавши невдачі, мали сміливість пояснювати її та невдачі інших експериментаторів принциповою неможливістю відділення, але їх сучасникам таке пояснення здалося лише зручною відмовкою. Тим часом у період 1907-1910 р.р. були помічені інші випадки, коли одні радіоактивні елементи не вдавалося відокремити від інших. Найбільш типовими прикладами були торій та іоній, мезоторій I і радій, радій D та свинець.
Деякі хіміки уподібнювали невіддільність нових радіоелементів випадку з рідкісноземельними елементами, з яким хімія зіткнулася в XIX столітті. Спочатку подібні хімічні властивості рідкісних земель змусили вважати властивості цих елементів однаковими, і лише пізніше в міру вдосконалення хімічних методів поступово вдалося відокремити їх. Однак Содді вважав, що ця аналогія надумана: у випадку з рідкісними землями труднощі полягали не в тому, щоб розділити елементи а в тому, щоб встановити факт їхнього поділу. Навпаки, у разі радіоактивних елементів від початку ясно відмінність двох елементів, а ось відокремити їх не вдається.
У 1911 р. Содді провів систематичне дослідження комерційного препарату мезоторію, що містить радій, і виявив, що відносний вміст одного з цих двох елементів збільшити неможливо, навіть вдаючись до багаторазової фракційної кристалізації. Содді дійшов висновку, що два елементи можуть мати різні радіоактивні властивості і тим не менш мати настільки подібні інші хімічні та фізичні властивості, що вони виявляються нероздільними за допомогою звичайних хімічних процесів. Якщо два таких елементи мають однакові хімічні властивості, їх слід поміщати на те саме місце в періодичній таблиці елементів; тому він назвав їх ізотопами.

Виходячи з цієї основної ідеї, Содді спробував дати теоретичне пояснення, сформулювавши «правило зсуву при радіоактивних перетвореннях»: випромінювання однієї α-частинки призводить до зміщення елемента на два місця вліво в періодичній системі. Але перетворений елемент може згодом повернутися в ту ж клітину періодичної системи при подальшому випусканні двох β-частинок, в результаті чого два елементи будуть мати однакові хімічні властивості, незважаючи на різні атомні ваги. У 1911 р. хімічні властивості радіоактивних елементів, що випускають β-промені і мають, як правило, дуже малу тривалість життя, були ще мало відомі, тому, перш ніж прийняти таке пояснення, потрібно було краще дізнатися властивості елементів, що випускають β-промені. Содді доручив цю роботу своєму помічникові Флекку. Робота зажадала багато часу, і в ній взяли участь обидва помічники Резерфорда - Рессел і Хевеші; Пізніше цим зайнявся також Фаянс.
Весною 1913 р. робота була завершена і правило Содді було підтверджено без жодних винятків. Його можна було сформулювати дуже просто: випромінювання α-частки зменшує атомну вагу даного елемента на 4 одиниці і зміщує елемент на два місця вліво в періодичній системі; випромінювання ж β-частинки істотно не змінює атомної ваги елемента, але зміщує його на одне місце вправо в періодичній системі. Тому якщо за перетворенням, викликаним випромінюванням α-частинки, слідує два перетворення з випромінюванням β-частинок, то після трьох перетворень елемент повертається на початкове місце в таблиці і набуває ті ж хімічні властивості, що і вихідний елемент, володіючи, однак, атомною вагою, меншим на 4 одиниці. З цього ясно випливає також, що ізотопи двох різних елементів можуть мати однакову атомну вагу, але різні хімічні властивості. Стюарт назвав їх ізобарами. На стор. 371 відтворено схему, що ілюструє правило усунення при радіоактивних перетвореннях у формі, даної Содді в 1913 р. Зараз ми знаємо, звичайно, значно більше радіоактивних ізотопів, ніж знав Содді в 1913 р. Але нам не варто, мабуть, простежувати всі ці наступні технічні завоювання. Важливіше зайвий раз наголосити на головному: α-частинки несуть два позитивні заряди, а β-частинки - один негативний заряд; Випуск будь-якої з цих частинок змінює хімічні властивості елемента. Глибокий зміст правила Соді полягає, таким чином, у тому, що хімічні властивості елементів, або принаймні радіоактивних елементів, поки це правило не поширене далі, пов'язані не з атомною вагою, як це стверджувала класична хімія, а з внутрішньоатомним електричним зарядом.
Радіоактивністю називається здатність атомних ядер перетворюватися на інші ядра з випромінюванням спектру частинок. Якщо перетворення ядер відбувається спонтанно (самовільно), то радіоактивність називають природною.
Якщо розпад здійснюється штучно, то радіоактивність штучна.
Радіоактивність була відкрита французьким фізиком Беккерелем у 1896 р., який уперше спостерігав випромінювання ураном проникаючих випромінювань.
В1890 Резерфорд та Содді використовували природну радіоактивність  (Торія), а також радіоактивність легких елементів, вивели ряд закономірностей.
(Торія), а також радіоактивність легких елементів, вивели ряд закономірностей.
I. Природна радіоактивність супроводжується трьома видами випромінювання.
1.
-випромінювання представляє потік позитивно заряджених -часток. Потік ядер  .
.

3.
 -випромінювання - електромагнітне випромінювання з короткою довжиною хвилі ~ рент. променів
-випромінювання - електромагнітне випромінювання з короткою довжиною хвилі ~ рент. променів  Å.
Å.
ІІ. Радіоактивність зумовлена внутрішньою будовою ядер і не залежить від зовнішніх умов
Більше того, розпад кожного ядра не впливає на розпад інших ядер.
ІІІ. Різні радіоактивні речовини сильно різняться між собою за кількістю радіоактивних випромінювань, що використовуються.
Радіоактивні речовини прийнято характеризувати кількістю розпадів за одиницю часу.
Активність радіоактивної речовини
Виявилося, що кількість розпадів на секунду ~ загальній кількості атомів радіоактивної речовини, тобто
 - Вказує, що число рад.ат. зменшується
- Вказує, що число рад.ат. зменшується
 - постійна радіоактивність та характеризує активність розпаду елемента
- постійна радіоактивність та характеризує активність розпаду елемента
Після інтегрування
 - Закон радіоактивного розпаду (Резерфорд)
- Закон радіоактивного розпаду (Резерфорд)
 - Початкова кількість радіоактивних ядер
- Початкова кількість радіоактивних ядер
 - число ядер, що не розпалися, до м.в. t
- число ядер, що не розпалися, до м.в. t
Тривалість життя радіоактивних ядер прийнято характеризувати періодом напіврозпаду, тобто проміжком часу, протягом якого кількість радіоактивних ядер зменшиться вдвічі.
Виходячи з цього визначення легко знайти зв'язок між періодом напіврозпаду та постійною розпаду



середній час життя радіоактивних ядер визначається виразом

після інтегрування легко отримає
 , тобто період напіврозпаду ядер
, тобто період напіврозпаду ядер 
В експериментах зазвичай вимірюють активність речовини, тобто кількість розпаду ядер на 1 сек.


Однак найчастіше використовується позасистемна одиниця
Існують ядра з дуже великим періодом напіврозпаду (Уран 9500 років) та існують ядра та періодом напіврозпаду кілька секунд (  - 5730 років)
- 5730 років)
- розпад – розпад атомних ядер зі випромінюванням - Частинок. Цей вид радіоактивності уражає елементів, розташованих у кінці таблиці Менделєєва. В даний час налічується близько 40 природних та понад 100 штучно викликаних - випромінювачів. Однак усі елементи -Розпаду за Рв
тобто в результаті -Розпаду заряд ядра зменшується на 2 од., а А - на 4
Отримуємо 
-розпад має 2 особливості
1. Постійна розпаду та енергія вилетіла -частки виявилися взаємозалежними і підпорядковується закону Гейгера Неттола
У 1 і У 2 – емпіричні постійні
Закон показує, що чим менша тривалість життя, тим більша енергія -частки, що вилетіла.
2. Енергія
-часток при розпаді укладена у вузьких межах від  , Що значно менше енергії, яку
-частка мала б отримати після
-Розпаду при прискоренні в електричному полі ядра.
, Що значно менше енергії, яку
-частка мала б отримати після
-Розпаду при прискоренні в електричному полі ядра.
Енергія -Частки виявилася малою в порівнянні з потенційним бар'єром ядра.
3. Спостерігається тонка структура випромінюваних -Частинок, тобто спостерігається деякий розподіл за енергією поблизу деякого середнього значення. Причому цей розподіл є дискретним.




Електронне захоплення



Займає енергію в інших нуклонів.
 -Розпад був пояснений тільки після завершення побудови квантової механіки і пояснюється з її позиції. Класичному трактуванню він не піддається.
-Розпад був пояснений тільки після завершення побудови квантової механіки і пояснюється з її позиції. Класичному трактуванню він не піддається.
 - глибина потенційної ями, висота потенційного бар'єру 30 М ев
- глибина потенційної ями, висота потенційного бар'єру 30 М ев
Відповідно до класичної механіки  -частки ( Е
) не можуть подолати потенційний бар'єр.
-частки ( Е
) не можуть подолати потенційний бар'єр.
У ядрах вже існують по одній  -частинки, що рухаються всередині ядра з енергією
-частинки, що рухаються всередині ядра з енергією  .
.
Якби не було потенційного бар'єру, то  -частка покинула б ядро з енергією
-частка покинула б ядро з енергією

 - Енергія, яку вона витратила б на подолання сил тяжіння в ядрі.
- Енергія, яку вона витратила б на подолання сил тяжіння в ядрі.
Однак через те, що ядро має оболонку, яка призводить до збільшення потенційного бар'єру приблизно на 30 М ев (див. рис.), то  -Частина може залишити ядро. Тільки проникши через потенційний об'єкт. Відповідно до квантової механіки частка, що має хвильові властивості, може просочуватися через потенційний бар'єр без витрат енергії. Явище називається тунельним ефектом
.
-Частина може залишити ядро. Тільки проникши через потенційний об'єкт. Відповідно до квантової механіки частка, що має хвильові властивості, може просочуватися через потенційний бар'єр без витрат енергії. Явище називається тунельним ефектом
.
Застосування  -Розпаду обумовлено тим, що ймовірність просочування
-Розпаду обумовлено тим, що ймовірність просочування  -Частинок через бар'єр залежить від розмірів ядер. Можна оцінити розміри ядра, знаючи енергію
-Частинок через бар'єр залежить від розмірів ядер. Можна оцінити розміри ядра, знаючи енергію  -частки Е
.
-частки Е
.
Відповісти на це питання на початку XX ст. було дуже непросто. Вже на початку досліджень радіоактивності виявилося багато дивного і незвичайного.
По перше , дивною була постійність, з якою радіоактивні елементи уран, торій і радій випромінюють. Протягом доби, місяців та навіть років інтенсивність випромінювання помітно не змінювалася. На неї не впливали такі звичайні впливи, як нагрівання та збільшення тиску. Хімічні реакції, у які вступали радіоактивні речовини, також впливали інтенсивність випромінювання.
По-друге , Незабаром після відкриття радіоактивності з'ясувалося, що радіоактивність супроводжується виділенням енергії. П'єр Кюрі помістив ампулу з хлоридом радію в калориметр. У ньому поглиналися –, – і – промені, і за рахунок їх енергії калориметр нагрівався. Кюрі визначив, що радій масою 1 г виділяє за 1 год енергію, приблизно рівну 582 Дж. І така енергія виділяється безперервно протягом багатьох років!
Звідки ж береться енергія, на виділення якої не впливають всі відомі впливи? Мабуть, при радіоактивності речовина зазнає якихось глибоких змін, зовсім відмінних від звичайних хімічних перетворень. Було зроблено припущення, що перетворення зазнають самі атоми. Зараз ця думка не може викликати особливого подиву, тому що про неї дитина може почути ще раніше, ніж навчиться читати. Але на початку XX ст. вона здавалася фантастичною, і потрібна була велика сміливість, щоб наважитися висловити її. У той час щойно були отримані безперечні докази існування атомів. Ідея Демокріта про атомістичну будову речовини нарешті перемогла. І ось майже відразу ж після цього незмінність атомів зникне під сумнів.
Не будемо докладно розповідати про ті експерименти, які призвели зрештою до повної впевненості в тому, що при радіоактивному розпаді відбувається ланцюжок послідовних перетворень атомів. Зупинимося тільки на перших дослідах, започаткованих Резерфордом і продовжених ним спільно з англійським хіміком Ф. Содді.
Резерфорд виявив, що активність торію, що визначається як число -часток, що випускаються в одиницю часу, залишається незмінною в закритій ампулі. Якщо препарат обдувається навіть дуже слабкими потоками повітря, то активність торію сильно зменшується. Вчений припустив, що одночасно з частинками торій випускає якийсь радіоактивний газ.
Відсмоктуючи повітря з ампули, що містить торій, Резерфорд виділив радіоактивний газ і досліджував його іонізуючу здатність. Виявилося, що активність цього газу (на відміну від активності торію, урану та радію) дуже швидко зменшується з часом. Щохвилини активність зменшується вдвічі, і через десять хвилин вона стає практично рівною нулю. Соді досліджував хімічні властивості цього газу і встановив, що він не вступає в жодні реакції, тобто є інертним газом. Згодом цей газ був названий радоном та поміщений у періодичній системі Д. І. Менделєєва під порядковим номером 86.
Перетворення зазнавали й інші радіоактивні елементи: уран, актіній, радій. Загальний висновок, який зробили вчені, був точно сформульований Резерфордом: «Атоми радіоактивної речовини схильні до спонтанних перших змін. У кожний момент невелика частина загальної кількості атомів стає нестійкою і вибухоподібно розпадається. У переважній більшості випадків викидається з величезною швидкістю уламок атома - -частка. У деяких інших випадках вибух супроводжується викиданням швидкого електрона і появою променів, що володіють, подібно до рентгенівських променів, великою проникаючою здатністю і званих -випромінюванням.
Було виявлено, що в результаті атомного перетворення утворюється речовина совернгенно нового виду, повністю відмінна за своїми фізичними та хімічними властивостями від первісної речовини. Ця нова речовина, однак, також нестійка і відчуває перетворення з випромінюванням характерного радіоактивного випромінювання 2 .
Таким чином, точно встановлено, що атоми деяких елементів схильні до спонтанного розпаду, що супроводжується випромінюванням енергії в кількостях, величезних у порівнянні з енергією, що звільняється при звичайних молекулярних видозмінах».
1 Від латинського слова spontaneus самоїропольний.
2 Насправді можуть утворюватися й стабільні ядра.
Після того як було відкрито атомне ядро, відразу стало ясно, що саме воно зазнає змін при радіоактивних перетвореннях. Адже частинок взагалі немає в електронній оболонці, а зменшення числа електронів оболонки на одиницю перетворює атом на іон, а не на новий хімічний елемент. Викид електрона з ядра змінює заряд ядра (збільшує його) на одиницю.
Отже, радіоактивність є мимовільне перетворення одних ядер на інші, що супроводжується випромінюванням різних частинок.
Правило усунення.Перетворення ядер підкоряються так званому правилу зміщення, сформульованому вперше Содді: при -розпаді ядро втрачає позитивний заряд 2е і маса його зменшується приблизно на чотири атомні одиниці маси. В результаті елемент зміщується на дві клітини до початку періодичної системи. Символічно це можна записати так:
![]()
Тут елемент позначається, як і хімії, загальноприйнятими символами: заряд ядра записується як індексу зліва внизу у символу, а атомна маса - як індексу зліва вгорі символу. Наприклад, водень позначається символом . Для -частинки, що є ядром атома гелію, застосовується позначення і т. д. При -розпаді з ядра вилітає електрон. В результаті заряд ядра збільшується на одиницю, а маса залишається майже незмінною:
![]()
Тут позначає електрон: індекс 0 вгорі означає, що маса його дуже мала порівняно з атомною одиницею маси, - електронне антинейтрино - нейтральна частка з дуже малою (можливо, нульовою) масою, що забирає при -розпаді частина енергії. Утворенням антинейтрино супроводжується розпад будь-якого ядра і в рівняннях відповідних реакцій цю частинку часто не вказують.
Після розпаду елемент зміщується на одну клітину ближче до кінця періодичної системи. Гамма-випромінювання не супроводжується зміною заряду; маса ж ядра змінюється дуже мало.
Згідно з правилом зміщення при радіоактивному розпаді зберігається сумарний електричний заряд і наближено зберігається відносна атомна маса ядер.
Нові ядра, що виникли при радіоактивному розпаді, можуть бути також радіоактивними і відчувати подальші перетворення.
При радіоактивному розпаді відбувається перетворення атомних ядер.
Які із відомих вам законів збереження виконуються при радіоактивному розпаді!