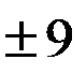Obavezan minimum znanja
Shema 1. Simbolika periodnog sustava D. I. Mendeljejeva
Obrasci promjena svojstava elemenata i njihovih spojeva
Promjene svojstava elemenata i tvari koje oni formiraju unutar jednog razdoblja s povećanjem atomskog broja elementa.1. Povećanje:
- naboj atomske jezgre;
- broj elektrona u vanjskom sloju atoma;
- stupanj oksidacije elemenata u višim oksidima i hidroksidima (obično jednak broju skupine);
- elektronegativnost;
- oksidacijska svojstva;
- Ne
- kiselinska svojstva viših oksida i hidroksida.
2. Smanjeno:
- atomski radijus;
- metalna svojstva jednostavne tvari;
- restorativna svojstva;
- osnovna svojstva viših oksida i hidroksida.
3. Ne mijenja se broj elektronskih slojeva (energetskih razina) u atomu. Promjene svojstava elemenata i tvari koje oni tvore unutar jedne skupine A s povećanjem atomskog broja elementa.
1. Povećanje:
- naboj atomske jezgre;
- broj elektronskih slojeva (energetskih razina) u atomu;
- atomski radijus;
- restorativna svojstva;
- metalna svojstva jednostavnih tvari;
- osnovna svojstva viših oksida i hidroksida;
- kiselinska svojstva (stepen elektrolitička disocijacija) kiseline bez kisika nemetala.
2. Smanjeno:
- elektronegativnost;
- oksidacijska svojstva;
- čvrstoća (stabilnost) hlapivih vodikovih spojeva.
3. Nemojte mijenjati:
- broj elektrona u vanjskom elektronskom sloju atoma;
- stupanj oksidacije elemenata u višim oksidima i hidroksidima (obično jednak broju skupine).
1. Atom ima najmanji radijus
- fluorid
- berilijum
- barij
- silicij
Element s najmanjim atomskim radijusom je onaj koji se nalazi što više udesno i što je moguće više u periodnom sustavu elemenata. kemijski elementi. Fluor ispunjava ovaj uvjet. Odgovor: 1
2. Atomi klora i atomi imaju isti broj elektrona na vanjskoj energetskoj razini
- mangan
- argon
- brom
Budući da atomi elemenata iste skupine imaju jednak broj elektrona na vanjskoj energetskoj razini, polazište za odabir točnog odgovora je određivanje skupine u kojoj se nalazi klor - VIIA. Od predloženih opcija, brom ispunjava ovaj uvjet. Odgovor: 4.
3. Atom i ion neona imaju istu elektroničku konfiguraciju
- Mg 2+
- Al 3+
Ključ za pronalaženje točnog odgovora je određivanje razdoblja u kojem se nalazi neon - 2. Posljedično, kation magnezija će odgovarati uvjetima zadatka. Odgovor: 1.
4. Čestica koja ima istu strukturu elektronske ljuske kao i atom argona
- Cl +3
- Cl +1
- C1 -l
Da biste odredili točan odgovor, potrebno je usporediti redne brojeve argona i klora, kao elemenata iste 3. periode: br. 17 i br. 18. Da biste imali istu strukturu elektronske ljuske kao atom argona, atom klora mora prihvatiti jedan elektron. Cl - odgovara ovom stanju. Odgovor: 4.
5. Broj elektrona u ionu A1 3+ je
Ovaj problem se može jednostavno riješiti: aluminijev ion je “izgubio” tri elektrona u odnosu na svoj atom, dakle, 13 - 3 = 10. Odgovor: 4.
6. Formiraju viši oksid i njemu odgovarajući hidroksid s najizraženijim bazičnim svojstvima
- kalij
- kalcij
- indij
- aluminij
Najjača bazična svojstva pokazuju oksidi i hidroksidi alkalijskih metala, odnosno elemenata IA skupine. Odgovor: 1.
7. Redoslijedom povećanja metalnih svojstava, elementi su poredani u nizu
- Al, Ca, K
- Va, Ca, Mg
- K, Ca, Ga
- Na, Mg, Al
Budući da su metalna svojstva najizraženija kod alkalnih metala, onda bi, očito, alkalijski metal trebao upotpuniti željeni trio elemenata. Odgovor: 1.
8. Atomi najlakše dobivaju elektrone.
- klor
- Selena
- brom
Adicija elektrona karakterizira oksidacijska svojstva elemenata. Ova svojstva su najizraženija kod elemenata koji imaju veći broj grupe i manji broj perioda. Odgovor: 1.
9. Nastaju viši oksid i njemu odgovarajući hidroksid s najizraženijim kiselim svojstvima
- fosfor
- silicij
Analiza položaja elemenata predloženih u zadatku u periodnom sustavu D. I. Mendeljejeva omogućuje nam da dođemo do zaključka da su svi oni u 3. razdoblju. Poznavanje obrazaca promjena kiselinsko-baznih svojstava oksida i hidroksida formiranih od elemenata istog razdoblja omogućit će određivanje točnog odgovora. Odgovor: 3.
10. Po redu dobitka nemetalna svojstva jednostavne tvari, elementi koji ih tvore poredani su u nizu
- C, Si, Ge
- Se, S, O
- F, O, N
- Se, As, Ge
Ovaj zadatak zahtijeva poznavanje obrazaca promjena metalnih i nemetalnih svojstava jednostavnih tvari koje tvore kemijski elementi u periodima i skupinama. Analiza položaja predloženih tripleta elemenata u periodnom sustavu D. I. Mendeljejeva omogućuje nam da dođemo do zaključka da opcije 1 i 2 sadrže po tri elementa, odnosno skupine IV i VI. Međutim, ako su u prva tri elementa raspoređeni u rastućem redoslijedu naboja njihovih atomskih jezgri, onda u drugom, naprotiv, u opadajućem redoslijedu. Odgovor: 2.
Kako biste uštedjeli vrijeme, ne morate čak ni analizirati preostale mogućnosti odgovora, budući da je točan odgovor pronađen.
Zadaci za samostalan rad
Atom se sastoji od izuzetno guste jezgre okružene elektronskim "oblakom". Jezgra je malo mala u usporedbi s vanjskim dimenzijama oblaka, a sastoji se od protona i neutrona. Atom u svom običnom stanju je neutralan, a elektroni nose negativan naboj. Ali atom također može povući tuđe elektrone ili odustati od svojih. U ovom slučaju, to će biti ili negativno nabijen ili pozitivno nabijen ion. Kako odrediti koliko elektroni sadržano u atom ?
upute
1. Prije svih ostalih, periodni sustav će vam doći u podršku. Gledajući u njega, vidjet ćete da cijeli kemijski element ima ne samo svoje strogo određeno mjesto, već i osobni serijski broj. Recimo da je za vodik jednak jedan, za ugljik je 6, za zlato je 79, i tako dalje.
2. Upravo atomski broj karakterizira broj protona u jezgri, odnosno točan naboj atomske jezgre. Budući da je atom normalno neutralan, pozitivni naboj mora biti uravnotežen negativnim nabojem. Prema tome, vodik ima jedan elektron, a ugljik šest elektroni, zlato ima sedamdeset i devet elektroni .
3. Pa, kako odrediti broj elektroni V atom, ako je atom, pak, dio neke složenije molekule? Recimo koji je broj elektroni u atomima natrija i klora, ako tvore molekulu svake vaše poznate obične kuhinjske soli?
4. I tu nema ništa teško. Započnite pisanjem formule ove tvari; izgledat će ovako: NaCl. Iz formule ćete vidjeti da se molekula kuhinjske soli sastoji od 2 elementa, i to: alkalni metal natrij i klor halogeni plin. Ali to više nisu neutralni atomi natrija i klora, već njihovi ioni. Klor je, stvarajući ionsku vezu s natrijem, "izvukao" jedan od svojih elektroni, a natrij ga je, sukladno tome, “odao”.
5. Ponovno pogledajte periodni sustav elemenata. Vidjet ćete da natrij ima redni broj 11, klor - 17. Prema tome, sada će natrijev ion imati 10 elektroni, za ion klora – 18.
6. Koristeći isti algoritam, lako je odrediti broj elektroni za bilo koji kemijski element, bilo u obliku neutralnog atoma ili iona.
Atom kemijskog elementa sastoji se od nuklearne jezgre i elektrona. Nuklearna jezgra sadrži dvije vrste čestica - protone i neutrone. Otprilike svaka masa atoma koncentrirana je u jezgri jer su protoni i neutroni mnogo teži od elektrona.

Trebat će vam
- atomski broj elementa, izotopi
upute
1. Za razliku od protona, neutroni nemaju električni naboj, tj električno punjenje jednaka nuli. Posljedično, znajući nuklearni broj elementa, nemoguće je nedvosmisleno reći koliko neutroni sadržanu u njegovoj jezgri. Na primjer, jezgra atoma ugljika uvijek sadrži 6 protona, iako protona u njoj može biti 6 ili 7. Varijante jezgri kemijskog elementa s različitim brojevima neutroni u jezgri nazivaju se izotopi ovog elementa. Izotopi mogu biti prirodni ili neprirodno dobiveni.
2. Nuklearne jezgre označavaju se slovnim simbolom kemijskog elementa iz periodnog sustava elemenata. Desno od simbola nalaze se dva broja na vrhu i dnu. Gornji broj A je za masu broj atom, A = Z+N, gdje je Z naboj jezgre ( broj protoni), i N – broj neutroni. Niži broj– ovo je Z – naboj jezgre. Ovaj zapis daje podatke o broju neutroni u jezgri. Prividno je jednako N = A-Z.
3. Različiti izotopi istog kemijskog elementa broj A promjene, koje se odražavaju u zapisu ovog izotopa. Neki izotopi imaju svoja vlastita imena. Recimo, obična jezgra vodika nema neutroni i ima jedan proton. Izotop vodika deuterij ima jedan neutron (A = 2), a izotop tricija dva neutrona (A = 3).
4. Brojna povezanost neutroni na broj protona odražava se u N-Z dijagramu nuklearnih jezgri. Stabilnost jezgri ovisi o omjeru broja neutroni i broj protona. Jezgre lakih nuklida posebno su stabilne pri N/Z = 1, odnosno kada je broj neutroni i protoni. S povećanjem masenog broja, područje stabilnosti se pomiče na vrijednosti N/Z>1, dosežući N/Z ~ 1,5 za posebno teške jezgre.
Video na temu
Atom se sastoji od jezgre i okoline elektroni, koji se oko njega okreću u nuklearnim orbitalama i tvore elektronske slojeve (energetske slojeve). Broj negativno nabijenih čestica na vanjskom i unutarnjem sloju određuje svojstva elemenata. Broj elektroni sadržane u atomu mogu se otkriti poznavanjem nekih ključnih točaka.

Trebat će vam
- - papir;
- - olovka;
- – Mendeljejevljev periodni sustav.
upute
1. Za određivanje broja elektroni, koristite periodni sustav D.I. Mendeljejev. U ovoj tablici elementi su raspoređeni u određenom slijedu, koji je usko povezan s njihovom nuklearnom strukturom. Znajući da je pozitivni naboj atoma uvijek jednak atomskom broju elementa, lako možete otkriti broj negativnih čestica. Čaj je očit – atom je kolektivno neutralan, što znači broj elektroni bit će jednak broju protona i broju elementa u tablici. Recimo da je serijski broj aluminija 13. Posljedično, broj elektroni imat će 13, natrij će imati 11, željezo će imati 26 itd.
2. Ako trebate otkriti broj elektroni na energetskim razinama, prvo ponovite Paulovo pravilo i Hundovo pravilo. Zatim uz pomoć istih rasporedite negativne čestice među razine i podrazine periodni sustav elemenata, odnosno njegovih razdoblja i skupina. Dakle, broj vodoravnog reda (točka) označava broj energetskih slojeva, a okomiti (skupina) – broj elektroni na vanjskoj razini.
3. Ne zaboravite da je broj vanjskih elektroni jednak broju grupe samo za elemente koji su u glavnim podskupinama. Za elemente sekundarnih podskupina, broj negativno nabijenih čestica u zadnjem energetskom sloju ne može biti veći od 2. Recimo, skandij (Sc), koji je u 4. periodi, u 3. skupini, sekundarnoj podskupini, ima ih 2. Dok galij (Ga), koji je u istoj periodi i istoj skupini, ali u glavnoj podskupini. , vanjski elektroni 3.
4. Prilikom brojanja elektroni u atomu, imajte na umu da potonji tvore molekule. U tom slučaju atomi mogu prihvatiti, odati negativno nabijene čestice ili formirati univerzalni par. Recimo, u molekuli vodika (H2) univerzalni par elektroni. Drugi slučaj: u molekuli natrijeva fluorida (NaF) ukupna količina elektroni bit će jednak 20. Ali tijekom kemijska reakcija Atom natrija predaje svoj elektron i ostaje mu 10, a atom fluora ga prihvaća i također dobiva 10.
Koristan savjet
Upamtite da u vanjskom energetskom sloju može biti samo 8 elektrona. I to ne ovisi o položaju elementa u periodnom sustavu.
Atom je najmanja stabilna (u većini slučajeva) čestica materije. Molekula se naziva nekoliko međusobno povezanih atoma. Molekule su te koje pohranjuju informacije o svim svojstvima određene tvari.

Atomi tvore molekulu pomoću različite vrste komunikacije. Međusobno se razlikuju po smjeru i energiji uz pomoć koje se ta veza može formirati.
Kvantno mehanički model kovalentne veze
Kovalentna veza nastaje pomoću valentnih elektrona. Kada se dva atoma približe jedan drugome, prati se preklapanje elektronskih oblaka. U tom slučaju, elektroni svakog atoma počinju se kretati u području koje pripada drugom atomu. U prostoru koji ih okružuje javlja se pretjerani negativni potencijal koji spaja pozitivno nabijene jezgre. To je dopušteno samo ako su spinovi univerzalnih elektrona antiparalelni (usmjereni u različitim smjerovima).Kovalentnu vezu karakterizira prilično velika energija veze za cijeli atom (oko 5 eV). To znači da je 10 eV potrebno da se molekula od 2 atoma formirana kovalentnom vezom raspadne. Atomi se mogu približavati jedan drugome do strogo definiranog stanja. Ovim pristupom prati se preklapanje elektronskih oblaka. Paulijeva teza tvrdi da dva elektrona u identičnom stanju ne mogu kružiti oko istog atoma. Što se više preklapanja prati, atomi se više odbijaju.
Vodikova veza
Ovo je poseban slučaj kovalentna veza. Tvore ga dva atoma vodika. Upravo na primjeru ovog kemijskog elementa dvadesetih godina prošlog stoljeća prikazan je mehanizam nastanka kovalentne veze. Atom vodika je vrlo primitivan u svojoj strukturi, što je omogućilo znanstvenicima da ispravno riješe Schrödingerovu jednadžbu.
Ionska veza
Kristal svake poznate kuhinjske soli nastaje ionskom vezom. Pojavljuje se kada atomi koji tvore molekulu imaju veliku razliku u elektronegativnosti. Manje elektronegativan atom (u slučaju kristala natrijeva klorida) predaje sve svoje valentne elektrone kloru, postajući ispravno nabijen ion. Klor, pak, postaje negativno nabijen ion. Ovi ioni su vezani u strukturi elektrostatskom interakcijom, koju karakterizira prilično ogromna sila. Zbog toga ionska veza ima najveću snagu (10 eV po atomu, što je dvostruko više od energije kovalentne veze). Defekti raznih vrsta rijetko se opažaju u ionskim kristalima. Elektrostatska interakcija čvrsto drži pozitivne i negativne ione na određenim mjestima, sprječavajući stvaranje praznina, međuprostora i drugih nedostataka u kristalnoj rešetki.
Video na temu
Koristan savjet
Protoni su pozitivno nabijene čestice, ali neutroni nemaju nikakav naboj.
Iz Gost >>
A1. Broj elektrona u vanjskom sloju elektrona atoma s jezgrinim nabojem +9 je 1)1 2) 5 3)3 4) 7 A2. Metalna svojstva magnezija izraženija su od 1) berilija 2) kalija 3) kalcija 4) natrija A3. Tvar s ionskom vezom je 1) sumporov(VI) oksid 2) vodik 3) magnezij 4) natrijev fluorid., A4. Oksidacijska stanja željeza u spojevima Fe2O3 i FeCl2 su redom 1) +3 i -2 2) +3 i +3 3) +3 i +2 4) -3 i +2 A5. Kiselinski oksid je 1) SO2 2) CO 3) ZnO 4) Na2O A6. DO fizičke pojave uključuju 1) kiseljenje mlijeka 2) ušećerenje pekmeza 3) gorenje svijeće 4) gorenje hrane A7. Koja je jednadžba za reakciju spoja? 1) NH3 + HNO3 = NH4NO3 2) H2S + MgO = MgS + H2O 3) SO3 + 2NaOH = Na2SO4 + H2O 4) CuO + H2 = Cu + H2O A8. Elektroliti koji su vrlo topljivi u vodi uključuju 1) barijev sulfat 2) cink sulfat 3) bakar(II) sulfid 4) željezov(III) oksid A9. Najveća količina Amonijevi ioni nastaju potpunom disocijacijom 1 mola 1) amonijevog sulfata 2) amonijevog sulfida 3) amonijevog nitrata 4) amonijevog fosfata A10. Do oslobađanja plina dolazi kao rezultat međudjelovanja iona 1) H+ i C1- 2) H+ i SO32- 3) NH4+ i PO43- 4) NH4+ i S2-
Dugo su vremena mnoga svojstva materije ostala tajna za istraživače. Zašto neke tvari dobro provode struju, a druge ne? Zašto željezo postupno propada pod utjecajem atmosfere, dok su plemeniti metali savršeno očuvani tisućama godina? Mnoga od ovih pitanja pronašla su odgovor nakon što je čovjek postao svjestan strukture atoma: njegove strukture, broja elektrona u svakom elektroničkom sloju. Štoviše, ovladavanje čak i samim osnovama strukture atomskih jezgri otvorilo je novu eru za svijet.
Od kojih elemenata se sastoje elementarni gradivni blokovi materije, kako oni međusobno djeluju, što iz toga možemo naučiti koristiti?
u pogledu moderne znanosti
Trenutno se većina znanstvenika pridržava planetarnog modela strukture materije. Prema tom modelu, u središtu svakog atoma nalazi se jezgra, sićušna čak iu usporedbi s atomom (desetke tisuća puta manja je od cijelog atoma). Ali isto se ne može reći za masu jezgre. Gotovo sva masa atoma koncentrirana je u jezgri. Jezgra je pozitivno nabijena.
Elektroni rotiraju oko jezgre u različitim orbitama, a ne kružnim, kao što je slučaj s planetima Sunčev sustav, ali volumetrijske (sfere i volumetrijske osmice). Broj elektrona u atomu brojčano je jednak naboju jezgre. Ali vrlo je teško smatrati elektron česticom koja se kreće duž neke putanje.

Njegova orbita je malena, a brzina mu je skoro jednaka svjetlosni snop, stoga je ispravnije smatrati elektron zajedno s njegovom orbitom nekom vrstom negativno nabijene kugle.
Članovi atomske obitelji
Svi atomi se sastoje od 3 sastavna elementa: protona, elektrona i neutrona.
Proton je glavni građevni materijal jezgre. Njegova težina jednaka je atomskoj jedinici (masi atoma vodika) ili 1,67 ∙ 10 -27 kg u SI sustavu. Čestica je pozitivno nabijena, a njezin se naboj uzima kao jedinica u sustavu elementarnih električnih naboja.
Neutron je po masi blizanac protona, ali ni na koji način nije nabijen.
Gornje dvije čestice nazivaju se nuklidi.
Elektron je suprotan protonu u naboju ( elementarni naboj jednaka je −1). Ali elektron nas je iznevjerio u pogledu težine, njegova masa je samo 9,12 ∙ 10 -31 kg, što je gotovo 2 tisuće puta lakše od protona ili neutrona.
Kako su to "uočili"?
Kako razabrati strukturu atoma ako čak ni najsuvremenija tehnička sredstva ne dopuštaju, a u bliskoj budućnosti neće dopuštati, dobivanje slika čestica koje ga sačinjavaju? Kako su znanstvenici znali broj protona, neutrona i elektrona u jezgri i njihov položaj?
Pretpostavka o planetarnoj strukturi atoma nastala je na temelju rezultata bombardiranja tanke metalne folije raznim česticama. Slika jasno pokazuje koliko je raznolik elementarne čestice.

Broj elektrona koji prolaze kroz metal u pokusima bio je nula. To se jednostavno objašnjava: negativno nabijeni elektroni se odbijaju od elektronske ljuske metali koji također imaju negativan naboj.
Snop protona (naboj +) prošao je kroz foliju, ali s “gubicima”. Neke su odbile jezgre koje su se našle na putu (vjerojatnost takvih pogodaka je vrlo beznačajna), neke su skrenule s izvorne putanje, leteći preblizu jednoj od jezgri.
Neutroni su postali "najučinkovitiji" u smislu probijanja metala. Neutralno nabijena čestica izgubljena je samo u slučaju izravnog sudara s jezgrom tvari, dok je 99,99% neutrona sigurno prošlo kroz debljinu metala. Inače, na temelju broja neutrona na ulazu i izlazu bilo je moguće izračunati veličinu jezgri pojedinih kemijskih elemenata.
Na temelju dobivenih podataka izgrađena je trenutno dominantna teorija o građi tvari koja uspješno objašnjava većinu pitanja.
Što i koliko
Broj elektrona u atomu ovisi o atomskom broju. Dakle, obični atom vodika ima samo jedan proton. Jedan elektron kruži u orbiti. Sljedeći element periodnog sustava, helij, malo je kompliciraniji. Njegova jezgra sastoji se od dva protona i dva neutrona i stoga ima atomsku masu 4.
Kako se atomski broj povećava, povećavaju se veličina i masa atoma. Redni broj kemijskog elementa u periodnom sustavu odgovara naboju jezgre (broju protona u njoj). Broj elektrona u atomu jednak je broju protona. Dakle, atom olova (redni broj 82) ima 82 protona u svojoj jezgri. Oko jezgre kruže 82 elektrona. Da bi se izračunao broj neutrona u jezgri, dovoljno je od atomske mase oduzeti broj protona:
Zašto ih je uvijek jednak broj?
Svaki sustav u našem svemiru teži stabilnosti. Kada se primijeni na atom, to se izražava u njegovoj neutralnosti. Ako na trenutak zamislite da svi atomi u Svemiru, bez iznimke, imaju jedan ili drugi naboj različitih veličina s različitim predznacima, možete zamisliti kakav bi kaos nastao u svijetu.

Ali budući da je broj protona i elektrona u atomu jednak, konačni naboj svake "cigle" je nula.
Broj neutrona u atomu je nezavisna veličina. Štoviše, atomi istog kemijskog elementa mogu imati različit broj ovih čestica s nultim nabojem. Primjer:
- 1 proton + 1 elektron + 0 neutrona = vodik ( atomska masa 1);
- 1 proton + 1 elektron + 1 neutron = deuterij (atomska masa 2);
- 1 proton + 1 elektron + 2 neutrona = tricij (atomska masa 3).
U tom se slučaju broj elektrona u atomu ne mijenja, atom ostaje neutralan, a mijenja se i njegova masa. Takve varijacije kemijskih elemenata obično se nazivaju izotopi.
Je li atom uvijek neutralan?
Ne, broj elektrona u atomu nije uvijek jednak broju protona. Da se elektron ili dva ne mogu privremeno "oduzeti" atomu, ne bi bilo takve stvari kao što je galvanizam. Na atom, kao i na svaku materiju, može se utjecati.
Pod utjecajem dovoljno jake električno polje Jedan ili više elektrona mogu "odletjeti" od vanjskog sloja atoma. U tom slučaju čestica tvari prestaje biti neutralna i naziva se ion. Može se kretati u plinovitom ili tekućem okruženju, prenoseći električni naboj s jedne elektrode na drugu. Na taj se način u baterijama pohranjuje električni naboj, a također se tanki slojevi nekih metala nanose na površine drugih (pozlata, posrebrenje, kromiranje, poniklavanje itd.).

Nestabilan je i broj elektrona u metalima – vodičima električna struja. Čini se da elektroni u vanjskim slojevima lutaju od atoma do atoma, prenoseći električnu energiju duž vodiča.