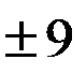Svojstva aminokiselina mogu se podijeliti u dvije skupine: kemijske i fizikalne.
Kemijska svojstva aminokiselina
Ovisno o spojevima, aminokiseline mogu pokazivati različita svojstva.
Interakcije aminokiselina:
Aminokiseline, kao amfoterni spojevi, tvore soli i s kiselinama i s lužinama.
Kao karboksilne kiseline, aminokiseline tvore funkcionalne derivate: soli, estere, amide.
Interakcija i svojstva aminokiselina sa razloga:
Nastaju soli:
NH 2 -CH 2 -COOH + NaOH NH 2 -CH 2 -COONa + H2O
Natrijeva sol + 2-aminooctena kiselina Natrijeva sol aminooctene kiseline (glicin) + voda
Interakcija sa alkoholi:
Aminokiseline mogu reagirati s alkoholima u prisutnosti plina klorovodika, pretvarajući se u ester. Esteri aminokiselina nemaju bipolarnu strukturu i hlapljivi su spojevi.
NH2-CH2-COOH + CH3OH NH2-CH2-COOCH3 + H2O.
Metil ester / 2-aminooctena kiselina /
Interakcija amonijak:
Nastaju amidi:
NH 2 -CH(R)-COOH + H-NH 2 = NH 2 -CH(R)-CONH 2 + H 2 O
Interakcija aminokiselina sa jake kiseline:
Dobivamo soli:
HOOC-CH 2 -NH 2 + HCl → Cl (ili HOOC-CH 2 -NH 2 *HCl)
Ovo su osnovna kemijska svojstva aminokiselina.
Fizička svojstva aminokiselina
Nabrojimo fizička svojstva aminokiseline:
- Bezbojan
- Imati kristalni oblik
- Većina aminokiselina ima sladak okus, ali ovisno o radikalu (R), mogu biti gorke ili bezukusne
- Lako topljiv u vodi, ali slabo topiv u mnogim organskim otapalima
- Aminokiseline imaju svojstvo optičke aktivnosti
- Topi se uz raspad na temperaturama iznad 200°C
- Neisparljiv
- Vodene otopine aminokiselina u kiselim i alkalna sredina provoditi električnu struju

Aminokiseline pokazuju svojstva i kiselina i amina. Dakle, oni tvore soli (zbog kiselih svojstava karboksilne skupine):
NH 2 CH 2 COOH + NaOH (NH 2 CH 2 COO)Na + H 2 O
glicin natrijev glicinat
i esteri (poput drugih organskih kiselina):
NH 2 CH 2 COOH + C 2 H 5 OHNH 2 CH 2 C(O)OC 2 H 5 + H 2 O
glicin etilglicinat
S jačim kiselinama aminokiseline pokazuju svojstva baza i tvore soli zbog bazičnih svojstava amino skupine:

glicin glicinija klorid
Najjednostavniji protein je polipeptid koji u svojoj strukturi sadrži najmanje 70 aminokiselinskih ostataka i ima molekulsku masu veću od 10 000 Da (daltona). Dalton - mjerna jedinica za masu proteina, 1 dalton je jednak 1,66054·10 -27 kg (jedinica mase ugljika). Slični spojevi koji se sastoje od manjeg broja aminokiselinskih ostataka klasificiraju se kao peptidi. Peptidi su po prirodi neki hormoni - inzulin, oksitocin, vazopresin. Neki peptidi su regulatori imuniteta. Neki antibiotici (ciklosporin A, gramicidini A, B, C i S), alkaloidi, toksini pčela i osa, zmija, otrovnih gljiva (falloidin i amanitin žabokrečine), toksini kolere i botulina itd. imaju peptidnu prirodu.
Razine strukturne organizacije proteinskih molekula.
Proteinska molekula ima složena struktura. Postoji nekoliko razina strukturne organizacije proteinske molekule – primarna, sekundarna, tercijarna i kvaternarna struktura.
Primarna struktura definira se kao linearni slijed proteinogenih aminokiselinskih ostataka povezanih peptidnim vezama (slika 5):

sl.5. Primarna struktura proteinske molekule
Primarna struktura proteinske molekule genetski je određena za svaki specifični protein u nukleotidnom slijedu glasničke RNA. Primarna struktura također određuje više razine organizacije proteinskih molekula.
Sekundarna struktura - konformacija (tj. položaj u prostoru) pojedinih dijelova proteinske molekule. Sekundarna struktura u proteinima može se prikazati -heliksom, -strukturom (struktura presavijenog lista) (slika 6).
sl.6. Sekundarna struktura proteina
Sekundarna struktura proteina održava se vodikovim vezama između peptidnih skupina.
Tercijarna struktura - konformacija cijele proteinske molekule, tj. prostorni raspored cijelog polipeptidnog lanca, uključujući raspored bočnih radikala. Za značajan broj proteina rendgenskom difrakcijom dobivene su koordinate svih atoma proteina, osim koordinata atoma vodika. U formiranju i stabilizaciji tercijarne strukture sudjeluju sve vrste interakcija: hidrofobne, elektrostatske (ionske), disulfidne kovalentne veze, vodikove veze. U tim interakcijama sudjeluju radikali aminokiselinskih ostataka. Među vezama koje drže tercijarnu strukturu treba istaknuti: a) disulfidni most (- S - S -); b) esterski most (između karboksilne skupine i hidroksilne skupine); c) slani most (između karboksilne skupine i amino skupine); d) vodikove veze.
Prema obliku proteinske molekule, određenom tercijarnom strukturom, razlikuju se sljedeće skupine proteina:
1) Globularni proteini , koji imaju oblik globule (sfere). Takvi proteini uključuju, na primjer, mioglobin, koji ima 5 α-spiralnih segmenata i nema β-nabora, imunoglobuline koji nemaju α-heliks; glavni elementi sekundarne strukture su β-nabori.
2) Fibrilarni proteini . Ovi proteini imaju duguljasti končasti oblik i obavljaju strukturnu funkciju u tijelu. U primarnoj strukturi imaju područja koja se ponavljaju i tvore sekundarnu strukturu koja je prilično ujednačena za cijeli polipeptidni lanac. Dakle, protein α - keratin (glavni proteinska komponenta nokti, kosa, koža) građena je od proširenih α - spirala. Postoje manje uobičajeni elementi sekundarne strukture, na primjer, polipeptidni lanci kolagena, koji tvore lijeve spirale s parametrima koji se oštro razlikuju od parametara α-spirala. U kolagenim vlaknima, tri spiralna polipeptidna lanca su upletena u jednu desnu superheliks (slika 7):
Slika 7. Tercijarna struktura kolagena
Kvartarna struktura proteina. Kvarternarna struktura proteina odnosi se na način na koji su pojedini polipeptidni lanci (identični ili različiti) s tercijarnom strukturom raspoređeni u prostoru, što dovodi do stvaranja strukturno i funkcionalno jedinstvene makromolekularne tvorevine (multimera). Nemaju svi proteini kvaternarnu strukturu. Primjer proteina s kvaternarnom strukturom je hemoglobin koji se sastoji od 4 podjedinice. Ovaj protein je uključen u transport plinova u tijelu.
Prilikom lomljenja disulfid i slabe vrste veza u molekulama, sve proteinske strukture, osim primarne, se uništavaju (potpuno ili djelomično), a protein gubi svoju zavičajna svojstva (svojstva proteinske molekule svojstvena njoj u prirodnom, prirodnom (nativnom) stanju). Ovaj proces se zove denaturacija proteina . Čimbenici koji uzrokuju denaturaciju proteina su visoke temperature, ultraljubičasto zračenje, koncentrirane kiseline i lužine, soli teških metala i drugi.
Proteini se dijele na jednostavan (proteini), koji se sastoje samo od aminokiselina, i kompleks (proteini), koji osim aminokiselina sadrže i druge neproteinske tvari, na primjer ugljikohidrate, lipide, nukleinske kiseline. Neproteinski dio složenog proteina naziva se prostetička skupina.
Jednostavni proteini, koji se sastoje samo od aminokiselinskih ostataka, rašireni su u životinjskom i biljnom svijetu. Trenutno ne postoji jasna klasifikacija ovih spojeva.
Histoni
Imaju relativno nisku molekulsku masu (12-13 tisuća), s prevladavanjem alkalnih svojstava. Lokaliziran uglavnom u staničnoj jezgri, topljiv u slabim kiselinama, taložen amonijakom i alkoholom. Imaju samo tercijarnu strukturu. U prirodnim uvjetima čvrsto su vezani za DNK i dio su nukleoproteina. Glavna funkcija je regulacija prijenosa genetskih informacija iz DNA i RNA (prijenos se može blokirati).
Protamini
Ovi proteini imaju najmanju molekulsku težinu (do 12 tisuća). Pokazuje izražena osnovna svojstva. Dobro topljiv u vodi i slabim kiselinama. Sadrži se u zametnim stanicama i čini glavninu proteina kromatina. Poput histona, oni tvore kompleks s DNA i daju joj kemijsku stabilnost, ali za razliku od histona, ne obavljaju regulatornu funkciju.
Glutelini
Biljni proteini sadržani u glutenu iz sjemena žitarica i nekih drugih usjeva, u zelenim dijelovima biljaka. Netopljiv u vodi, otopinama soli i etanolu, ali dobro topljiv u otopinama slabih alkalija. Sadrže sve esencijalne aminokiseline i potpuni su prehrambeni proizvodi.
Prolamini
Biljni proteini. Sadržano u glutenu žitarica. Topljivi su samo u 70% alkoholu (to se objašnjava visokim sadržajem prolina i nepolarnih aminokiselina u tim proteinima).
Proteinoidi.
Proteinoidi uključuju proteine potpornih tkiva (kosti, hrskavice, ligamenata, tetiva, noktiju, kose), karakterizira ih visok sadržaj sumpora. Ovi proteini su netopljivi ili teško topljivi u vodi, soli i vodeno-alkoholnim smjesama.Proteinoidi uključuju keratin, kolagen, fibroin.
Albumin
To su kiseli proteini niske molekularne težine (15-17 tisuća), topljivi u vodi i slabim slanim otopinama. Taloženo neutralnim solima pri 100% zasićenju. Sudjeluju u održavanju osmotskog tlaka krvi i prenose krvlju razne tvari. Sadržano u krvnom serumu, mlijeku, bjelanjku.
Globulini
Molekulska težina do 100 000. Netopljiv u vodi, ali topljiv u slabim otopinama soli i taloži se u manje koncentriranim otopinama (već kod 50% zasićenja). Sadržano u sjemenkama biljaka, posebno mahunarki i uljarica; u krvnoj plazmi i nekim drugim biološkim tekućinama. Oni obavljaju funkciju imunološke obrane i osiguravaju otpornost organizma na virusne zarazne bolesti.
Kemijsko ponašanje aminokiselina određuju dvije funkcionalne skupine -NH 2 i -COOH. Aminokiseline karakteriziraju reakcije na amino skupini, karboksilnoj skupini i na radikalnom dijelu, a ovisno o reagensu, međudjelovanje tvari može se odvijati preko jednog ili više reakcijskih centara.
Amfoterna priroda aminokiselina. Imajući i kiselinsku i bazičnu skupinu u molekuli, aminokiseline u vodene otopine ponašaju se kao tipični amfoterni spojevi. U kiselim otopinama pokazuju bazična svojstva, reagirajući kao baze, u alkalnim otopinama - kao kiseline, odnosno tvoreći dvije skupine soli:
Zbog svoje amfoternosti u živom organizmu aminokiseline imaju ulogu puferskih tvari koje održavaju određenu koncentraciju vodikovih iona. Puferske otopine dobivene interakcijom aminokiselina s jakim bazama imaju široku primjenu u bioorganskoj i kemijskoj praksi. Soli aminokiselina s mineralnim kiselinama bolje su topljive u vodi od slobodnih aminokiselina. Soli s organskim kiselinama slabo su topljive u vodi i koriste se za identifikaciju i odvajanje aminokiselina.
Reakcije uzrokovane amino skupinom. Uz sudjelovanje amino skupine, aminokiseline tvore amonijeve soli s kiselinama, aciliraju se, alkiliraju , reagiraju s dušikastom kiselinom i aldehidima prema sljedećoj shemi:
Alkilacija se provodi uz sudjelovanje R-Ha1 ili Ar-Hal:
U reakciji aciliranja koriste se kiselinski kloridi ili kiselinski anhidridi (acetil klorid, octeni anhidrid, benziloksikarbonil klorid):
Reakcije aciliranja i alkiliranja koriste se za zaštitu NH 2 skupine aminokiselina tijekom sinteze peptida.
Reakcije uzrokovane karboksilnom skupinom. Uz sudjelovanje karboksilne skupine, aminokiseline tvore soli, estere, amide i kiselinske kloride u skladu sa shemom prikazanom u nastavku:
Ako se na a-ugljikovom atomu u ugljikovodikovom radikalu postoji supstituent koji privlači elektron (-NO 2, -CC1 3, -COOH, -COR, itd.) koji polarizira C®COOH vezu, tada se karboksilne kiseline lako podvrgavaju reakcije dekarboksilacije. Dekarboksilacija a-aminokiselina koje sadrže +NH3 skupinu kao supstituent dovodi do stvaranja biogenih amina. U živom organizmu taj se proces odvija pod djelovanjem enzima dekarboksilaze i vitamina piridoksal fosfata.
U laboratorijskim uvjetima reakcija se provodi zagrijavanjem a-aminokiseline u prisutnosti CO2 apsorbera, na primjer Ba(OH)2.
Dekarboksilacijom b-fenil-a-alanina, lizina, serina i histidina nastaju fenamin, 1,5-diaminopentan (kadaverin), 2-aminoetanol-1 (kolamin) odnosno triptamin.
Reakcije aminokiselina koje uključuju bočnu skupinu. Kada se aminokiselina tirozin nitrira dušična kiselina nastaje spoj dinitro derivata, obojen narančasto (ksantoproteinski test):
Redoks prijelazi odvijaju se u cistein-cistin sustavu:
2HS CH 2 CH(NH 2)COOH ¾¾¾® HOOCCH(NH 2)CH 2 S-J CH2CH(NH2)COOH
HOOCCH(NH2)CH2 S-J CH 2 CH(NH 2)COOH ¾¾¾® 2 NS CH2CH(NH2)COOH
U nekim reakcijama aminokiseline reagiraju na obje funkcionalne skupine istovremeno.
Stvaranje kompleksa s metalima. Gotovo sve a-aminokiseline tvore komplekse s dvovalentnim metalnim ionima. Najstabilnije su složene unutarnje soli bakra (kelatni spojevi), nastale kao rezultat interakcije s bakrovim (II) hidroksidom i obojene u plavo:
Djelovanje nitratne kiseline na alifatske aminokiseline dovodi do stvaranja hidroksi kiselina, na aromatske aminokiseline - diazo spojevi.
Stvaranje hidroksi kiselina:
Reakcija diazotiranja:
(diazo spoj)
1. uz oslobađanje molekularnog dušika N2:
2. bez oslobađanja molekularnog dušika N2:
Kromoforna skupina azobenzena -N=N u azo spojevima uzrokuje žutu, žutu, narančastu ili druge boje tvari kada se apsorbiraju u vidljivom području svjetlosti (400-800 nm). Grupa auksokroma
COOH mijenja i pojačava boju zbog π, π - konjugacije s π - elektroničkim sustavom glavne skupine kromofora.
Odnos aminokiselina prema toplini. Kada se zagrijavaju, aminokiseline se razgrađuju na različite produkte ovisno o njihovoj vrsti. Kad se zagrije a-aminokiseline Kao rezultat intermolekularne dehidracije nastaju ciklički amidi - diketopiperazini:
valin (Val) diizopropil derivat
diketopiperazin
Kad se zagrije b-aminokiseline Od njih se odvaja amonijak i formiraju α, β-nezasićene kiseline s konjugiranim sustavom dvostrukih veza:
β-aminovalerijanska kiselina penten-2-oična kiselina
(3-aminopentanska kiselina)
Grijanje g- i d-aminokiseline praćen intramolekularnom dehidracijom i stvaranjem unutarnjih cikličkih amida - laktami:
γ-aminoizovalerijanska kiselina γ-aminoizovalerijanski laktam
(4-amino-3-metilbutanska kiselina) kiseline
Sve α-aminokiseline, osim glicina, sadrže kiralni α-ugljikov atom i mogu se pojaviti kao enantiomeri:
Pokazalo se da gotovo sve prirodne -aminokiseline imaju istu relativnu konfiguraciju na -ugljikovom atomu. -Ugljikov atom (-)-serina je konvencionalno dodijeljen L-konfiguracija i -ugljikov atom (+)-serina - D-konfiguracija. Štoviše, ako je Fischerova projekcija aminokiseline napisana tako da se karboksilna skupina nalazi na vrhu, a R na dnu, tada L-aminokiseline, amino skupina će biti s lijeve strane, i D- aminokiseline - desno. Fischerova shema za određivanje konfiguracije aminokiselina primjenjuje se na sve α-aminokiseline koje imaju kiralni α-ugljikov atom.
Iz slike je jasno da L-aminokiselina može biti desnorotatorna (+) ili lijevorotatorna (-) ovisno o prirodi radikala. Velika većina aminokiselina koje se nalaze u prirodi su L-red. Njihovo enantiomorfi, tj. D-aminokiseline sintetiziraju samo mikroorganizmi i nazivaju se "neprirodne" aminokiseline.
Prema (R,S) nomenklaturi, većina "prirodnih" ili L-aminokiselina ima S konfiguraciju.
L-izoleucin i L-treonin, od kojih svaki sadrži dva kiralna centra po molekuli, mogu biti bilo koji član para dijastereomera ovisno o konfiguraciji na -ugljikovom atomu. Ispravne apsolutne konfiguracije ovih aminokiselina dane su u nastavku.
KISELINSKO-BAZNA SVOJSTVA AMINOKISELINA
Aminokiseline su amfoterne tvari koje mogu postojati u obliku kationa ili aniona. Ovo svojstvo se objašnjava prisutnošću i kiselih ( -ZDRAVLJE), i glavni ( -NH 2 ) skupine u istoj molekuli. U vrlo kiselim otopinama N.H. 2 Kiselinska skupina se protonira i kiselina postaje kation. U jako alkalnim otopinama karboksilna skupina aminokiseline se deprotonira i kiselina se pretvara u anion.
U čvrstom stanju aminokiseline postoje u obliku zwitterions (bipolarni ioni, unutarnje soli). U zwitterionima, proton se prenosi s karboksilne skupine na amino skupinu:
Ako stavite aminokiselinu u vodljivi medij i tamo spustite par elektroda, tada će u kiselim otopinama aminokiselina migrirati na katodu, au alkalnim otopinama - na anodu. Pri određenoj pH vrijednosti karakterističnoj za određenu aminokiselinu, ona se neće pomaknuti niti prema anodi niti prema katodi, budući da je svaka molekula u obliku zwitteriona (nosi i pozitivan i negativan naboj). Ova pH vrijednost se naziva izoelektrična točka(pI) date aminokiseline.
REAKCIJE AMINOKISELINA
Većina reakcija kojima se aminokiseline podvrgavaju u laboratoriju ( in vitro), karakterističan za sve amine ili karboksilne kiseline.
1. stvaranje amida na karboksilnoj skupini. Kada karbonilna skupina aminokiseline reagira s amino skupinom amina, paralelno se odvija reakcija polikondenzacije aminokiseline, što dovodi do stvaranja amida. Kako bi se spriječila polimerizacija, amino skupina kiseline je blokirana tako da reagira samo amino skupina amina. U tu svrhu koristi se karbobenzoksiklorid (karbobenziloksiklorid, benzil kloroformat). trlja-butoksikarboksazid, itd. Za reakciju s aminom, karboksilna skupina se aktivira tretiranjem s etil kloroformatom. Zaštitna grupa zatim uklonjen katalitičkom hidrogenolizom ili djelovanjem hladne otopine bromovodika u octenoj kiselini.

2. stvaranje amida na amino skupini. Kada se amino skupina aminokiseline acilira, nastaje amid.

Reakcija se bolje odvija u bazičnom mediju, jer se time osigurava visoka koncentracija slobodnog amina.
3. obrazovanje esteri. Karboksilna skupina aminokiseline lako se esterificira uobičajenim metodama. Na primjer, metilni esteri se pripremaju propuštanjem suhog plinovitog klorovodika kroz otopinu aminokiseline u metanolu:

Aminokiseline su sposobne za polikondenzaciju, što rezultira stvaranjem poliamida. Poliamidi koji se sastoje od -aminokiselina nazivaju se peptidi ili polipeptidi . Amidna veza u takvim polimerima naziva se peptid komunikacija. Polipeptidi sa Molekularna težina poziva se najmanje 5000 bjelančevine . Proteini sadrže oko 25 različitih aminokiselina. Kada se određeni protein hidrolizira, sve ove aminokiseline ili neke od njih mogu nastati u određenim omjerima karakterističnim za pojedini protein.
Jedinstveni slijed aminokiselinskih ostataka u lancu koji je svojstven određenom proteinu naziva se primarna struktura vjeverica . Značajke uvijanja lanaca proteinskih molekula ( međusobni dogovor fragmenti u prostoru) nazivaju se sekundarna struktura proteina . Polipeptidni lanci proteina mogu se međusobno povezati tvoreći amidne, disulfidne, vodikove i druge veze zahvaljujući bočnim lancima aminokiselina. Kao rezultat, spirala se uvija u loptu. Ova strukturna značajka se zove tercijarna struktura proteina . Da bi pokazali biološku aktivnost, neki proteini prvo moraju formirati makrokompleks ( oligoprotein), koji se sastoji od nekoliko kompletnih proteinskih podjedinica. Kvartarna struktura određuje stupanj asocijacije takvih monomera u biološki aktivnom materijalu.
Proteini se dijele u dvije velike skupine – fibrilarni (omjer duljine molekule i širine je veći od 10) i kuglasti (omjer manji od 10). Fibrilarni proteini uključuju kolagena , najzastupljeniji protein kod kralješnjaka; čini gotovo 50% suhe težine hrskavice i oko 30% čvrsta kosti. U većini regulacijskih sustava biljaka i životinja katalizu provode globularni proteini, tzv enzima .
Aminokiseline.
Aminokiseline(aminokarboksilne kiseline) - organski spojevi, čija molekula istovremeno sadrži karboksil (-COOH) I aminske skupine (-NH 2).
Struktura aminokiselina može se izraziti kako slijedi opća formula,
(Gdje R– ugljikovodični radikal, koji može sadržavati različite funkcionalne skupine).
Aminokiseline mogu se smatrati izvedenicama karboksilne kiseline, u kojem je jedan ili više atoma vodika zamijenjeno s aminske skupine (-NH2).
Primjer su protozoe: aminooctena kiselina, odn glicin, i aminopropionska kiselina ili alanin:

Kemijska svojstva aminokiselina
Aminokiseline su amfoterni spojevi, tj. Ovisno o uvjetima, mogu pokazivati i bazična i kisela svojstva.
Zbog karboksilne skupine ( -COOH) s bazama tvore soli.
Zbog amino skupine ( -NH 2) tvore soli s kiselinama.
Vodikov ion koji se eliminira nakon disocijacije s karboksilne skupine ( -ON) aminokiselina, može prijeći na svoju amino skupinu uz stvaranje amonijeve skupine ( NH3+).

Dakle, aminokiseline također postoje i reagiraju u obliku bipolarnih iona (unutarnje soli).
To objašnjava da otopine aminokiselina koje sadrže jednu karboksilnu i jednu amino skupinu imaju neutralnu reakciju.
Alfa aminokiseline
Od molekula aminokiseline građene su molekule proteinskih tvari ili bjelančevine, koji se nakon potpune hidrolize pod utjecajem mineralnih kiselina, lužina ili enzima razgrađuju, tvoreći smjese aminokiselina.
Ukupan broj prirodnih aminokiselina doseže 300, ali neke od njih su prilično rijetke.
Među aminokiselinama postoji skupina od 20 najvažnijih. Nalaze se u svim bjelančevinama i nazivaju se alfa aminokiseline.
Alfa aminokiseline– kristalne tvari topljive u vodi. Mnogi od njih imaju sladak okus. Ovo se svojstvo odražava u nazivu prvog homologa u nizu alfa aminokiselina - glicin, koja je također bila prva alfa aminokiselina pronađena u prirodnom materijalu.
Ispod je tablica s popisom alfa aminokiselina:
Ime | Formula | Preostalo ime |
|---|---|---|
| Aminokiseline s alifatskim radikalima | ||
| OH skupina | ||
| Ser | ||
| Thr | ||
| Aminokiseline s radikalima koji sadrže COOH skupinu | ||
| Asp | ||
| Glu | ||
| Aminokiseline s radikalima koji sadrže NH2CO-skupina | ||
| Asn | ||
| Gln | ||
| Aminokiseline s radikalima koji sadrže NH 2-skupina | ||
| Lys | ||
| Arg | ||
| Aminokiseline s radikalima koji sadrže sumpor | ||
| Cys | ||
| Met | ||
| Aminokiseline s aromatskim radikalima | ||
| Phe | ||
| Tyr | ||
| Aminokiseline s heterocikličkim radikalima | ||
| Trp | ||
| Njegovo | ||
| profesionalac | ||
Esencijalne aminokiseline
Glavni izvor alfa aminokiseline proteini hrane služe životinjskom tijelu.
Mnoge alfa aminokiseline se sintetiziraju u tijelu, ali neke alfa aminokiseline neophodne za sintezu proteina se ne sintetiziraju u tijelu i mora doći izvana, s hranom. Te se aminokiseline nazivaju nezamjenjiva. Evo njihovog popisa:
Naziv aminokiseline | Naziv prehrambenih proizvoda |
|---|---|
žitarice, mahunarke, meso, gljive, mliječni proizvodi, kikiriki |
|
bademi, indijski oraščići, piletina, slanutak, jaja, riba, leća, jetra, meso, raž, većina sjemenki, soja |
|
meso, riba, leća, orasi, većina sjemenki, piletina, jaja, zob, smeđa riža |
|
riba, meso, mliječni proizvodi, pšenica, orasi, amarant |
|
mlijeko, meso, riba, jaja, grah, grah, leća i soja |
|
mliječni proizvodi, jaja, orasi, grah |
|
mahunarke, zob, banane, sušene datulje, kikiriki, sezam, pinjoli, mlijeko, jogurt, svježi sir, riba, piletina, puretina, meso |
|
mahunarke, orasi, govedina, piletina, riba, jaja, svježi sir, mlijeko |
|
sjemenke bundeve, svinjetina, junetina, kikiriki, susam, jogurt, švicarski sir |
|
tuna, losos, svinjski file, goveđi file, pileća prsa, soja, kikiriki, leća |
U nekim, često urođenim, bolestima, popis esencijalnih kiselina se proširuje. Na primjer, s fenilketonurijom, ljudsko tijelo ne sintetizira drugu alfa aminokiselinu - tirozin, koji je u tijelu zdravi ljudi dobiven hidroksilacijom fenilalanina.
Primjena aminokiselina u medicinskoj praksi
Alfa aminokiseline zauzimaju ključnu poziciju u metabolizam dušika. Mnogi od njih se koriste u medicinskoj praksi kao lijekovi , koji utječu na metabolizam tkiva.
Tako, glutaminska kiselina koristi se za liječenje bolesti središnjeg živčani sustav, metionin I histidin– liječenje i prevencija bolesti jetre, cistein– bolesti oka.