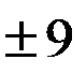Tijekom lekcije moći ćete provjeriti svoje znanje o temi „Jedinstveni državni ispit. Elektrolitička disocijacija soli, kiselina, lužina. Reakcije ionske izmjene. Hidroliza soli." Razmotrit ćete rješavanje zadataka iz Jedinstvenog državnog ispita Grupa A, B i C nadalje razne teme: “Otopine i njihove koncentracije”, “Elektrolitička disocijacija”, “Reakcije ionske izmjene i hidroliza”. Za rješavanje ovih problema, osim znanja o temama koje se razmatraju, potrebno je također znati koristiti tablicu topljivosti tvari, poznavati metodu ravnoteže elektrona te imati razumijevanje o reverzibilnosti i ireverzibilnosti reakcija.
Tema: Otopine i njihova koncentracija, disperzirani sustavi, elektrolitička disocijacija
Lekcija: Jedinstveni državni ispit. Elektrolitička disocijacija soli, kiselina, lužina. Reakcije ionske izmjene. Hidroliza soli
ja. Odaberite jednu točnu opciju od 4 ponuđene.
|
Pitanje |
Komentar |
|
A1. Jaki elektroliti su: |
Prema definiciji, jaki elektroliti su tvari koje se u vodenoj otopini potpuno raspadaju na ione. CO 2 i O 2 ne mogu biti jaki elektroliti. H 2 S je slab elektrolit. Točan odgovor je 4. |
|
A2. Tvari koje disociraju samo na metalne ione i hidroksidne ione su: 1. kiseline 2. lužine 4. amfoterni hidroksidi |
Po definiciji, spoj koji, kada se disocira u vodenoj otopini, proizvodi samo hidroksidne anione naziva se baza. Samo alkalijski i amfoterni hidroksid odgovaraju ovoj definiciji. Ali pitanje kaže da bi spoj trebao disocirati samo na metalne katione i hidroksidne anione. Amfoterni hidroksid postupno disocira, pa su hidroksometalni ioni u otopini. Točan odgovor 2. |
|
A3. Reakcija izmjene odvija se do kraja stvaranjem tvari netopljive u vodi između: 1. NaOH i MgCl 2 2. NaCl i CuSO 4 3. CaCO 3 i HCl (otopina) |
Da biste odgovorili, trebate napisati ove jednadžbe i pogledati u tablici topljivosti da vidite ima li među proizvodima netopljivih tvari. To je u prvoj reakciji magnezijev hidroksid Mg(OH) 2 Točan odgovor 1. |
|
A4. Zbroj svih koeficijenata u punom i smanjenom ionskom obliku u reakciji izmeđuFe(NE 3 ) 2 +2 NaOHjednako je: |
Fe(NO 3) 2 +2NaOH Fe(OH) 2 ↓ +2Na NO 3 molekularni Fe 2+ +2NO 3 - +2Na+2OH - Fe(OH) 2 ↓ +2Na + +2 NO 3 - kompletno ionska jednadžba, zbroj koeficijenata je 12 Fe 2+ + 2OH - Fe(OH) 2 ↓ skraćeno ionski, zbroj koeficijenata je 4 Točan odgovor je 4. |
|
A5. Skraćena ionska jednadžba za reakciju H + +OH - →H 2 O odgovara međudjelovanju: 2. NaOH (PP) +HNO 3 3. Cu(OH) 2 + HCl 4. CuO + H 2 SO 4 |
Ova skraćena jednadžba odražava interakciju između jake baze i jake kiseline. Baza je dostupna u verzijama 2 i 3, ali Cu(OH) 2 je netopljiva baza Točan odgovor 2. |
|
A6. Reakcija ionske izmjene nastavlja se do kraja kada se otopine ispuste: 1. natrijev nitrat i kalijev sulfat 2. kalijev sulfat i solna kiselina 3. kalcijev klorid i srebrov nitrat 4. natrijev sulfat i kalijev klorid |
Napišimo kako bi se trebale odvijati reakcije ionske izmjene između svakog para tvari. NaNO 3 +K 2 SO 4 → Na 2 SO 4 +KNO 3 K2SO4 +HCl→H2SO4 +KCl CaCl 2 +2AgNO 3 → 2AgCl↓ + Ca(NO 3) 2 Na 2 SO 4 + KCl → K 2 SO 4 + NaCl Iz tablice topljivosti vidimo da je AgCl↓ Točan odgovor 3. |
|
A7. U vodenoj otopini disocira postupno: |
Polibazične kiseline podliježu postupnoj disocijaciji u vodenoj otopini. Među tim tvarima samo je H2S kiselina. Točan odgovor 3. |
|
A8. Jednadžba reakcije CuCl 2 +2 KOH→ Cu(OH) 2 ↓+2 KClodgovara skraćenoj ionskoj jednadžbi: 1. CuCl 2 +2OH - →Cu 2+ +2OH - +2Cl - 2. Cu 2+ +KOH→Cu(OH) 2 ↓+K + 3. Cl - +K + →KCl 4. Cu 2+ +2OH - →Cu(OH) 2 ↓ |
Napišimo kompletnu ionsku jednadžbu: Cu 2+ +2Cl - +2K + +2OH - → Cu(OH) 2 ↓+2K + +2Cl - Eliminirajući nevezane ione, dobivamo skraćenu ionsku jednadžbu Su 2+ +2OH - →Cu(OH) 2 ↓ Točan odgovor je 4. |
|
A9. Reakcija je gotovo završena: 1. Na 2 SO 4 + KCl→ 2. H 2 SO 4 + BaCl 2 → 3. KNO 3 + NaOH → 4. Na 2 SO 4 + CuCl 2 → |
Napišimo hipotetske reakcije ionske izmjene: Na 2 SO 4 + KCl → K 2 SO 4 + Na Cl H 2 SO 4 + BaCl 2 → BaSO 4 ↓ + 2HCl KNO 3 + NaOH → NaNO 3 + KOH Na 2 SO 4 + CuCl 2 → CuSO 4 + 2NaCl Prema tablici topljivosti vidimo BaSO 4 ↓ Točan odgovor 2. |
|
A10. Otopina ima neutralnu okolinu: 2. (NH 4) 2 SO 4 |
Neutralan okoliš imaju samo vodene otopine soli koje čine jaka baza i jaka kiselina. NaNO3 je sol nastala od jake baze NaOH i jake kiseline HNO3. Točan odgovor 1. |
|
A11. Kiselost tla može se povećati uvođenjem otopine: |
Potrebno je odrediti koja sol će dati kiselu reakciju na medij. To mora biti sol koju čine jaka kiselina i slaba baza. Ovo je NH4NO3. Točan odgovor 1. |
|
A12. nastaje kada se otopi u vodi: |
Samo soli koje stvaraju jaka baza i jaka kiselina ne podliježu hidrolizi. Sve gore navedene soli sadrže anione jakih kiselina. Samo AlCl 3 sadrži slab bazni kation. Točan odgovor je 4. |
|
A 13. Ne podliježe hidrolizi: 1. octena kiselina 2. etil octene kiseline 3. škrob |
Imamo hidrolizu veliki značaj V organska kemija. Esteri, škrob i proteini podliježu hidrolizi. Točan odgovor 1. |
|
A14. Koji broj predstavlja fragment molekularne jednadžbe? kemijska reakcija, što odgovara višestrukoj ionskoj jednadžbi C u 2+ +2 OH - → Cu(OH) 2 ↓? 1. Cu(OH) 2 + HCl→ 2. CuCO 3 + H 2 SO 4 → 3. CuO + HNO 3 → 4. CuSO 4 +KOH→ |
Prema skraćenoj jednadžbi, slijedi da trebate uzeti bilo koji topljivi spoj koji sadrži bakreni ion i hidroksidni ion. Od svih navedenih bakrenih spojeva samo je CuSO 4 topljiv, a samo u vodenoj reakciji je OH - . Točan odgovor je 4. |
|
A15.Kada će koje tvari međudjelovati oslobodit će se sumporni oksid?: 1. Na2S03 i HCl 2. AgNO 3 i K 2 SO 4 3. BaCO 3 i HNO 3 4. Na2S i HCl |
Prvom reakcijom nastaje nestabilna kiselina H 2 SO 3 koja se raspada na vodu i sumporov oksid (IV) Točan odgovor1.
|
II. Kratak odgovor i odgovarajući zadaci.
|
U 1. Ukupni zbroj svih koeficijenata u punoj i smanjenoj ionskoj jednadžbi za reakciju između srebrnog nitrata i natrijevog hidroksida je... |
Napišimo jednadžbu reakcije: 2AgNO 3 +2NaOH→Ag 2 O↓+ 2NaNO 3 +H 2 O Puna ionska jednadžba: 2Ag + +2NO 3 - +2Na + +2OH - →Ag 2 O↓+ 2Na + +2NO 3 - +H 2 O Skraćena ionska jednadžba: 2Ag + +2OH - →Ag 2 O↓+H 2 O Točan odgovor: 20 |
|
U 2. Napišite potpunu ionsku jednadžbu za interakciju 1 mola kalijevog hidroksida s 1 molom aluminijevog hidroksida. Navedite broj iona u jednadžbi. |
KOH + Al(OH) 3 ↓→ K Puna ionska jednadžba: K + +OH - + Al(OH) 3 ↓ → K + + - Točan odgovor: 4 iona. |
|
U 3. Povežite naziv soli s njezinim odnosom prema hidrolizi: A) amonijev acetat 1. ne hidrolizira B) barijev sulfid 2. kationom B) amonijev sulfid 3. anionom D) natrijev karbonat 4. kationom i anionom |
Da biste odgovorili na pitanje, morate analizirati s kojom jačinom baze i kiseline nastaju te soli. Točan odgovor A4 B3 C4 D3 |
|
U 4. Otopina jednog mola natrijevog sulfata sadrži 6,02natrijevi ioni. Izračunajte stupanj disocijacije soli. |
Napišimo jednadžbu za elektrolitičku disocijaciju natrijeva sulfata: Na 2 SO 4 ↔ 2Na + +SO 4 2- 0,5 mol natrijevog sulfata raspalo se na ione. |
|
U 5. Povežite reagense sa skraćenim ionskim jednadžbama: 1. Ca(OH) 2 +HCl → A)NH 4 + +OH - →NH 3 +H 2 O 2. NH 4 Cl + NaOH → B) Al 3+ + OH - → Al(OH) 3 ↓ 3. AlCl 3 +KOH → B) H + +OH - →H 2 O 4. BaCl 2 +Na 2 SO 4 → D) Ba 2+ +SO 4 2- → BaSO 4 ↓ Točan odgovor: B1 A2 B3 D4 |
|
|
U 6. Napiši potpunu ionsku jednadžbu koja odgovara skraćenoj: SO 3 2- +2 H + → CO 2 + H 2 O. Navedite zbroj koeficijenata u molekularnoj i ukupnoj ionskoj jednadžbi. |
Morate uzeti bilo koji topljivi karbonat i bilo koju topljivu jaku kiselinu. Molekularno: Na2C03 +2HCl → CO2 +H20 +2NaCl; Puni ionski: 2Na + +CO 3 2- +2H + +2Cl - → CO 2 +H 2 O +2Na + +2Cl - ; |
III.Zadaci s detaljnim odgovorima
|
Pitanje |
Elektrolitička disocijacija NaCl.avi
Disocijacija se događa u otopinama i talinama.
Topljive kiseline disociraju na vodikove ione i kisele ione.
Topljive baze razlažu se na pozitivno nabijene metalne ione i negativno nabijene hidroksidne ione.
Srednje soli disociraju na metalne katione i anione kiselinskih ostataka.
Kisele soli razlažu se na metalne i vodikove katione i anione kiselinskih ostataka.
Kationi su metalni ioni i vodik H
+ .
Anioni su ioni kiselinskih ostataka i hidroksidni ioni OH – .
Ionski naboj je brojčano jednaka valenciji iona u danom spoju.
Koristite tablicu topljivosti za izradu jednadžbi disocijacije.
U kemijska formula zbroj naboja pozitivno nabijenih iona jednak je zbroju naboja negativno nabijenih iona.



















Sastavljanje jednadžbi disocijacije kiselina
(na primjeru dušične i sumporne kiseline)

Sastavljanje jednadžbi disocijacije za lužine
(topljive baze)
(na primjeru natrijeva i barijeva hidroksida)
Topljive baze su hidroksidi formirani od aktivnih metalnih iona:
jednovalentni: Li +, Na+, K+, Rb+, Cs+, Fr+;
dvovalentni: Ca 2+, Sr 2+, Ba 2+.
Sastavljanje jednadžbi disocijacije soli
(na primjeru aluminijevog sulfata, barijevog klorida i kalijevog bikarbonata)


Zadaci samokontrole
1. Napišite jednadžbe disocijacije za sljedeće elektrolite: cinkov nitrat, natrijev karbonat, kalcijev hidroksid, stroncijev klorid, litijev sulfat, sumporna kiselina, bakrov(II) klorid, željezo(III) sulfat, kalijev fosfat, hidrosulfid, kalcijev bromid, kalcijev hidroksiklorid, natrijev nitrat, litijev hidroksid.
2. Podijeli tvari na elektrolite i neelektrolite: K 3 PO 4 , HNO 3 , Zn(OH) 2 , BaCl 2 , Al 2 O 3 , Cr 2 (SO 4) 3 , NO 2 , FeBr 3 , H 3 PO 4 , BaSO 4 , Cu(NO 3) 2 , O 2, Sr(OH) 2, NaHSO 4, CO 2, AlCl 3, ZnSO 4, KNO 3, KHS.
Navedite tvari elektrolita.
3. Sastavite formule za tvari koje mogu tvoriti sljedeći ioni:

Imenuj tvari i sastavi jednadžbe njihove disocijacije.
Odgovori na zadatke za samokontrolu
2.
elektroliti
: K 3 PO 4 – kalijev fosfat, HNO 3 – Dušična kiselina, BaCl 2 – barijev klorid, Cr 2 (SO 4) 3 – krom(III) sulfat, FeBr 3 – željezo(III) bromid, H 3 PO 4 – fosforna kiselina, Su(NO 3) 2 – bakrov(II) nitrat, Sr(OH) 2 – stroncijev hidroksid, NaHSO 4 – natrijev hidrogensulfat, AlCl 3 – aluminijev klorid, ZnSO 4 – cink sulfat, KNO 3 – kalijev nitrat, KHS – hidrosulfid kalij, Zn(OH) 2 – cink hidroksid, BaSO 4 – barijev sulfat.
Neelektroliti
: Al 2 O 3, NO 2, O 2, CO 2.
3.
a) N 2 SO 4, CaSO 4, NaMnO 4, MgI 2, Na 2 CrO 4 itd.;
b) KClO3, Ba(OH)2, AlPO4, H2CO3, itd.;
c) H 2 S, CaCl 2, FeSO 4, Na 2 SO 4 itd.

Teme kodifikatora jedinstvenog državnog ispita:Elektrolitička disocijacija elektrolita u vodene otopine. Jaki i slabi elektroliti.
– To su tvari čije otopine i taline provode električnu struju.
Električna struja je uređeno kretanje nabijenih čestica pod utjecajem električno polje. Dakle, otopine ili taline elektrolita sadrže nabijene čestice. U otopinama elektrolita, u pravilu, električna provodljivost zbog prisustva iona.
Ioni– to su nabijene čestice (atomi ili skupine atoma). Odvojite pozitivno nabijene ione ( kationi) i negativno nabijenih iona ( anioni).
Elektrolitička disocijacija - To je proces razgradnje elektrolita na ione kada se on otopi ili tali.
Odvojene tvari - elektroliti I neelektroliti. DO neelektroliti uključuju tvari s jakim kovalentnim nepolarna veza (jednostavne tvari), svi oksidi (koji su kemijski Ne u interakciji s vodom), većina organska tvar(osim polarnih spojeva - karboksilne kiseline, njihove soli, fenoli) - aldehidi, ketoni, ugljikovodici, ugljikohidrati.
DO elektroliti uključuju neke tvari s kovalentnom polarnom vezom i tvari s ionskom kristalnom rešetkom.
Što je bit procesa elektrolitičke disocijacije?
Stavite nekoliko kristala natrijeva klorida u epruvetu i dodajte vodu. Nakon nekog vremena kristali će se otopiti. Što se dogodilo?
Natrijev klorid je tvar s ionskom kristalnom rešetkom. Kristal NaCl sastoji se od iona Na+ i Cl - . U vodi se taj kristal raspada na strukturne jedinice – ione. U ovom slučaju, ionski kemijske veze i neke vodikove veze između molekula vode. Ioni Na + i Cl - koji dospiju u vodu stupaju u interakciju s molekulama vode. U slučaju kloridnih iona može se govoriti o elektrostatskom privlačenju dipolnih (polarnih) molekula vode prema anionu klora, a u slučaju natrijevih kationa približava se donorno-akceptorskoj prirodi (kada elektronski par atoma kisika spoji elektrostatski spoj s atomom kisika). nalazi se u slobodnim orbitalama natrijeva iona). Okruženi molekulama vode, ioni postaju prekrivenihidratacijska školjka.
Disocijacija natrijeva klorida opisuje se jednadžbom:
Kada se spojevi s kovalentnom polarnom vezom otope u vodi, molekule vode, okružujući polarnu molekulu, najprije rastežu vezu u njoj, povećavajući njenu polarnost, zatim je razbijaju na ione, koji se hidratiziraju i ravnomjerno raspoređuju u otopini. Na primjer, klorovodična kiselina disocira na ione ovako: HCl = H + + Cl - .
Tijekom taljenja, kada se kristal zagrijava, ioni počinju podvrgavati intenzivnim vibracijama u čvorovima kristalne rešetke, uslijed čega se ona uništava i nastaje talina koja se sastoji od iona.
Proces elektrolitičke disocijacije karakterizira stupanj disocijacije molekula tvari:
Stupanj disocijacije je omjer broja disociranih (raspadnutih) molekula prema ukupnom broju molekula elektrolita. Odnosno, koji se dio molekula izvorne tvari raspada u ione u otopini ili talini.
α=N prodiss /N out, gdje je:
N prodiss je broj disociranih molekula,
N out je početni broj molekula.
Prema stupnju disocijacije elektrolite dijelimo na snažna I slab.
Jaki elektroliti (α≈1):
1. Sve topljive soli (uključujući soli organskih kiselina - kalijev acetat CH 3 COOK, natrijev format HCOONa itd.)
2. Jake kiseline: HCl, HI, HBr, HNO 3, H 2 SO 4 (u prvom stupnju), HClO 4 itd.;
3. Alkalije: NaOH, KOH, LiOH, RbOH, CsOH; Ca(OH)2, Sr(OH)2, Ba(OH)2.
Jaki elektroliti raspadaju se na ione gotovo potpuno u vodenim otopinama, ali samo u. U otopinama se čak i jaki elektroliti mogu samo djelomično raspasti. Oni. stupanj disocijacije jakih elektrolita α približno je jednak 1 samo za nezasićene otopine tvari. U zasićenim ili koncentriranim otopinama stupanj disocijacije jakih elektrolita može biti manji ili jednak 1: α≤1.
Slabi elektroliti (α<1):
1. Slabe kiseline, uklj. organski;
2. Netopljive baze i amonijev hidroksid NH 4 OH;
3. Netopljive i neke slabo topljive soli (ovisno o topljivosti).
Neelektroliti:
1. Oksidi koji ne stupaju u interakciju s vodom (oksidi koji stupaju u interakciju s vodom, kada se otope u vodi, stupaju u kemijsku reakciju stvarajući hidrokside);
2. Jednostavne tvari;
3. Većina organskih tvari sa slabo polarnim ili nepolarnim vezama (aldehidi, ketoni, ugljikovodici itd.).
Kako tvari disociraju? Prema stupnju disocijacije razlikuju se snažna I slab elektroliti.
Jaki elektroliti potpuno disociraju (u zasićenim otopinama), u jednom koraku, sve se molekule raspadaju na ione, gotovo nepovratno. Imajte na umu da tijekom disocijacije u otopini nastaju samo stabilni ioni. Najčešći ioni mogu se pronaći u tablici topljivosti - vašoj službenoj varalici za svaki ispit. Stupanj disocijacije jakih elektrolita približno je jednak 1. Na primjer, tijekom disocijacije natrijevog fosfata nastaju ioni Na + i PO 4 3–:
Na 3 PO 4 → 3Na + +PO 4 3-
NH 4 Cr(SO 4) 2 → NH 4 + + Cr 3+ + 2SO 4 2–
Disocijacija slabi elektroliti : polikisele kiseline i polikisele baze odvija se postupno i reverzibilno. Oni. Tijekom disocijacije slabih elektrolita samo se vrlo mali dio izvornih čestica raspada u ione. Na primjer, ugljična kiselina:
H 2 CO 3 ↔ H + + HCO 3 –
HCO 3 – ↔ H + + CO 3 2–
Magnezijev hidroksid također disocira u 2 koraka:
Mg(OH) 2 ⇄ Mg(OH) + OH –
Mg(OH) + ⇄ Mg 2+ + OH –
Kisele soli također disociraju stepenasto, prvo se prekidaju ionske veze, a zatim polarne kovalentne veze. Na primjer, kalijev hidrogenkarbonat i magnezijev hidroksiklorid:
KHCO 3 ⇄ K + + HCO 3 – (α=1)
HCO 3 – ⇄ H + + CO 3 2– (α< 1)
Mg(OH)Cl ⇄ MgOH + + Cl – (α=1)
MgOH + ⇄ Mg 2+ + OH – (α<< 1)
Stupanj disocijacije slabih elektrolita mnogo je manji od 1: α<<1.
Glavne odredbe teorije elektrolitičke disocijacije su dakle:
1. Kada se otope u vodi, elektroliti disociraju (razbijaju se) na ione.
2. Razlog disocijacije elektrolita u vodi je njezina hidratacija, tj. interakcija s molekulama vode i kidanje kemijskih veza u njoj.
3. Pod utjecajem vanjskog električnog polja pozitivno nabijeni ioni kreću se prema pozitivno nabijenoj elektrodi - katodi; nazivaju se kationi. Negativno nabijeni elektroni kreću se prema negativnoj elektrodi – anodi. Zovu se anioni.
4. Elektrolitička disocijacija događa se reverzibilno za slabe elektrolite, a praktički ireverzibilno za jake elektrolite.
5. Elektroliti mogu disocirati na ione u različitim stupnjevima, ovisno o vanjskim uvjetima, koncentraciji i prirodi elektrolita.
6. Kemijska svojstva iona razlikuju se od svojstava jednostavnih tvari. Kemijska svojstva otopina elektrolita određena su svojstvima iona koji iz nje nastaju tijekom disocijacije.
Primjeri.
1. Uz nepotpunu disocijaciju 1 mola soli, ukupan broj pozitivnih i negativnih iona u otopini bio je 3,4 mola. Formula soli – a) K 2 S b) Ba(ClO 3) 2 c) NH 4 NO 3 d) Fe(NO 3) 3
Riješenje: Prvo, odredimo jačinu elektrolita. To se lako može učiniti pomoću tablice topljivosti. Sve soli navedene u odgovorima su topljive, tj. jaki elektroliti. Zatim zapisujemo jednadžbe elektrolitičke disocijacije i upotrijebimo jednadžbu za određivanje maksimalnog broja iona u svakoj otopini:
A) K 2 S ⇄ 2K + + S 2– , potpunim raspadom 1 mola soli nastaju 3 mola iona, ne može se dobiti više od 3 mola iona;
b) Ba(ClO 3) 2 ⇄ Ba 2+ + 2ClO 3 –, opet, tijekom razgradnje 1 mola soli nastaju 3 mola iona, više od 3 mola iona ne nastaje;
V) NH 4 NO 3 ⇄ NH 4 + + NO 3 –, tijekom razgradnje 1 mola amonijevog nitrata nastaje najviše 2 mola iona; ne nastaje više od 2 mola iona;
G) Fe(NO 3) 3 ⇄ Fe 3+ + 3NO 3 –, potpunom razgradnjom 1 mola željezovog (III) nitrata nastaje 4 mola iona. Posljedično, kod nepotpune razgradnje 1 mola željeznog nitrata moguće je stvaranje manjeg broja iona (nepotpuna razgradnja moguća je u zasićenoj otopini soli). Dakle, opcija 4 nam odgovara.