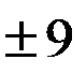Часто хімічні зв'язки утворюються рахунок електронів, розташованих різних атомних орбіталях (наприклад,s - І р- Орбіталі). Незважаючи на це, зв'язки виявляються рівноцінними та розташовані симетрично, що забезпечено гібридизацією атомних орбіталей.
Гібридизація орбіталей - це зміна форми деяких орбіталей при утворенні ковалентного зв'язку для досягнення ефективнішого перекривання орбіталей.
В результаті гібридизації з'являються нові гібридні орбіталі, які орієнтуються в просторі таким чином, щоб після їх перекривання з орбіталями інших атомів електронні пари, що утворюються, виявилися максимально віддаленими один від одного. Це зводить до мінімуму енергію відштовхування електронів у молекулі.
Гібридизація перестав бути реальним процесом. Це введено описи геометричної структури молекули. Форма частинок, що виникають при утворенні ковалентних зв'язків, В яких беруть участь гібридні атомні орбіталі, залежить від числа та типу цих орбіталей. У цьому σ – зв'язку створюють жорсткий «скелет» частки:
|
Орбіталі беруть участь у гібридизації |
Тип гібридизації |
Просторова форма молекули |
Приклади |
|
s, p |
sp – гібридизація |
Лінійна |
BeCl 2 CO 2 C 2 H 2 ZnCl 2 BeH 2 Двіsp - орбіталі можуть утворювати дві σ - зв'язки ( BeH 2 , ZnCl 2 ). Ще двіp- зв'язки можуть утворитися, якщо на двох p - орбіталях, що не беруть участь у гібридизації, знаходяться електрони (ацетилен C 2 H 2 ). |
|
s, p, p |
sp 2 – гібридизація |
Трикутна (плоска тригональна) |
BH 3 BF 3 C 2 H 4 AlCl 3 Якщо зв'язок утворюється при перекриванні орбіталей по лінії, що з'єднує ядра атомів, вона називається σ - зв'язком. Якщо орбіталі перекриваються поза лінією, що з'єднує ядра, то утворюється π - зв'язок. Три sp 2 - орбіталі можуть утворювати три σ - зв'язки ( BF 3 , AlCl 3 ). Ще один зв'язок (π - зв'язок) може утворитися, якщо на p- орбіталі, що не бере участі в гібридизації, знаходиться електрон (етилен C 2 H 4 ). |
|
s, p, p, p |
sp 3 – гібридизація |
Тетраедрична |
З H 4 NH 4+ PO 4 3- BF 4 - |
Насправді спочатку експериментально встановлюють геометричну структуру молекули, після чого описують тип і форму атомних орбіталей, що у її освіті. Наприклад, просторова структура молекул аміаку і води близька до тетраедричної, але кут між зв'язками в молекулі води дорівнює 104,5?, а в молекулі NH 3 – 107,3˚.
Чим це можна пояснити?
|
Аміак NH 3 |
Молекула аміаку має форму тригональної піраміди з атомом азоту у вершині . Атом азоту знаходиться у sp 3 - гібридному стані; з чотирьох гібридних орбіталей азоту три беруть участь в утворенні одинарних зв'язків N-H, а четверта sp 3 - гібридна орбіталь зайнята неподіленою електронною парою, вона може утворити донорно-акцепторний зв'язок з іоном водню, утворюючи іон амонію NH 4 + , а також є причиною відхилення від тетраедричного кута в будові |
|
Вода H 2 O |
Молекула води має кутова будова: є рівнобедреним трикутником з кутом на вершині 104,5°. Атом кисню знаходиться у sp 3 - гібридному стані; з чотирьох гібридних орбіталей кисню дві беруть участь в утворенні одинарних зв'язків О-H, а дві інші sp 3 - гібридні орбіталі зайняті неподіленими електронними парами, їх дія є причиною зменшення кута від 109,28 до 104,5 °. |
1. Графічне подання молекул та їх властивостей – теорія графів у хімії
Вивчення зв'язку властивостей речовин зі своїми будовою - одне з основних завдань хімії. Великий внесок у її вирішення внесла структурна теорія органічних сполук, До творців якої входить великий російський хімік Олександр Михайлович Бутлеров (1828-1886). Саме він першим встановив, що властивості речовини залежать не тільки від її складу (молекулярної формули), а й від того, у якому зв'язані між собою атоми в молекулі. Такий порядок назвали хімічною будовою». Бутлеров передбачив, що складу C 4 H 10 можуть відповідати дві речовини, що мають різну будову - бутан та ізобутан, і підтвердив це, синтезувавши останню речовину.
Ідея про те, що порядок сполуки атомів має ключове значення для властивостей речовини, виявилася дуже плідною. На ній засноване уявлення молекул за допомогою графів, у яких атоми грають роль вершин, а хімічні зв'язки між ними – ребер, що з'єднують вершини. У графічному поданні довжини зв'язків та кути між ними ігноруються. Описані вище молекули C4H10 зображуються такими графами:
Атоми водню у таких графах не вказуються, оскільки їх розташування можна однозначно встановити структурою вуглецевого скелета. Нагадаємо, що вуглець в органічних сполуках чотиривалентний, тому у відповідних графах від кожної вершини може відходити не більше чотирьох ребер.
Графи – це математичні об'єкти, тому їх можна характеризувати за допомогою чисел. Звідси з'явилася ідея виражати будову молекул числами, пов'язаними із структурою молекулярних графів. Ці числа у хімії називають «топологічними індексами». Розрахувавши якийсь топологічний індекс для великої кількостімолекул, можна встановити зв'язок між його значеннями та властивостями речовин, а потім використовувати цей зв'язок для передбачення властивостей нових, ще не синтезованих речовин. На даний момент хіміками та математиками запропоновані сотні різноманітних індексів, що характеризують ті чи інші властивості молекул.
Інфрачервоні спектри молекул
На відміну від видимого та ультрафіолетового діапазонів, які обумовлені головним чином переходами електронів з одного стаціонарного стану до іншого...
Дослідження будови органічних сполук за допомогою фізичних методів
Різні положення молекул у тривимірному просторі зводяться до поступального, обертального та коливального руху. Молекула, що складається з N атомів, має всього 3N ступенів свободи руху.
Квантовохімічне вивчення фотофізичних властивостей поліаніліну
Квантовохімічні розрахунки геометрії та розподілу електронної щільності для збуджених станів, виконані будь-яким методом, становлять інтерес, тому що тут навіть напівкількісні результати виявляються дуже корисними.
Макромолекулі лінійних аморфних полімерів
Молекула - найдрібніша частинка речовини, що володіє її основними хімічними властивостями і складається з атомів, з'єднаних між собою хімічними зв'язками. Молекулі можуть відрізнятися між собою природою чи кількістю атомів.
2.1 Опис вимірювання, складання його моделі та виявлення джерел невизначеності Будь-який процес вимірювання можна представити у вигляді послідовності виконуваних операцій.
Методика розрахунку невизначеностей вимірювань вмісту свинцю в цукерках, крупі, зерні та продуктах його переробки (хлібі та хлібобулочних виробах) методом інверсійної вольтамперометрії на аналізаторах типу ТА
Якщо мірою невизначеності є сумарна стандартна невизначеність, то результат може бути записаний так: у (одиниць) при стандартній невизначеності uc(y) (одиниць). Якщо мірою невизначеності є розширена невизначеність U...
Розвиток періодичного закону. Залежність якості елементів від ядра його атома
Визначення порядкових номерів елементів зарядів ядер їх атомів дозволило встановити загальну кількість місць у періодичній системіміж воднем (що має порядковий номер у таблиці - 1), та ураном (порядковий номер якого - 92).
Причому останні 12 років свого життя Ейлер тяжко хворів, осліп і, незважаючи на тяжку недугу, продовжував працювати і творити. Статистичні підрахунки показують, що Ейлер у середньому робив одне відкриття на тиждень. Важко знайти математичну проблему, яка була б порушена у творах Ейлера. Усі математики наступних поколінь однак навчалися в Ейлера, і недарма відомий французький учений П.С. Лаплас сказав: "Читайте Ейлера, він - учитель усіх нас". Лагранж каже: "Якщо ви дійсно любите математику, читайте Ейлера; виклад його творів відрізняється дивовижною ясністю та точністю". Справді, витонченість обчислень доведено в нього до вищого ступеня. Кондорсе уклав свою промову в академії на згадку про Ейлера наступними словами: "Отже, Ейлер перестав жити і обчислювати!" Жити, щоб обчислювати - яким це здається нудним! Математика прийнято уявляти собі сухим і глухим до всього життєвого, до того що займає звичайних людей. З ім'ям Ейлера, є завдання про три будиночки і три колодязі. |
ТЕОРІЯ ГРАФІВ
Одна із гілок топології. Графом називають геометричну схему, що є системою ліній, що зв'язують якісь задані точки. Крапки називаються вершинами, а лінії, що їх зв'язують, – ребрами (або дугами). Усі завдання теорії графів можуть вирішуватися як і графічної, і у матричної формі. У разі запису в матричній формі можливість передачі повідомлення з цієї вершини в іншу позначається одиницею, а її відсутність – банкрутом.
Зародження Теорії Графів у 18 ст. пов'язане з математичними головоломками, але особливо сильний поштовх її розвитку було дано в 19 ст. і переважно у 20 в., коли виявилися можливості її практичних додатків: до розрахунку радіоелектронних схем, рішення т.зв. транспортних завдань та ін. З 50-х років. Теорія графів все ширше використовується в соціальної психологіїта соціології.
В області Теорії Графів слід назвати роботи Ф. Харрі, Дж. Кемені, К. Фламенту, Дж. Снелла, Дж. Френча, Р. Норманна, О. Ойзера, А. Бейвеласа, Р. Вейса та ін. р. працюють Φ. Μ. Бородкін та ін.
Мова Теорії графів добре пристосований для аналізу різноманітних структур і передачі станів. Відповідно до цього можна назвати такі типи соціологічних і соціально-психологічних завдань, вирішуваних з допомогою Теорії графів.
1) Формалізація та побудова загальної структурної моделі соціального об'єкта на різних рівнях його складності. Наприклад, структурна схемаорганізації, соціограми, порівняння систем кревності у різних суспільствах, аналіз рольової структури груп тощо. Можна вважати, що рольова структура включає три компоненти: особи, позиції (у спрощеному варіанті - посади) та завдання, що виконуються в даній позиції. Кожна компонента може бути подана у вигляді графа:


Можна поєднати всі три графи всім позицій або лише однієї, й у результаті отримуємо ясне уявлення про конкретну структуру к.-л. цієї ролі. Так, для ролі позиції P5 маємо граф (рис.). Вплетення неформальних відносин у вказану формальну структуру значно ускладнить граф, але він буде більш точною копією дійсності.

2) Аналіз отриманої моделі, виділення у ній структурних одиниць (підсистем) та вивчення їх зв'язків. У такий спосіб можуть бути виділені, напр., підсистеми у великих організаціях.
3) Вивчення рівнів структури ієрархічних організацій: кількість рівнів, кількість зв'язків, що йдуть з одного рівня до іншого та від однієї особи до іншої. З цього вирішуються завдання:
а) кількостей. оцінки ваги (статусу) індивіда в ієрархічній організації Одним із можливих варіантів визначення статусу є формула:

де r(р) – статус деякої особи р, k – величина рівня субординації, яка визначається як найменша кількість кроків від даної особи до свого підлеглого, nk – кількість осіб на даному рівні k. Напр., у створенні, представленої слід. графом:

вага а = 1 · 2 +2 · 7 +3 · 4 = 28; 6 = 1 · 3 +2 · 3 = 9 і т.д.
б) визначення лідера групи. Лідер характеризується зазвичай більшою проти іншими пов'язаністю з іншими членами групи. Як і в попередній задачі, тут також можуть бути використані різні способи виділення лідера.
Найпростіший спосіб дається формулою: r=Σdxy/Σdqx, тобто. приватне від розподілу суми всіх дистанцій кожного до всіх інших у сумі дистанцій даного індивіда всім інших.
4) Аналіз ефективності діяльності цієї системи, куди входять такі завдання, як пошуки оптимальної структури організації, підвищення згуртованості групи, аналіз соціальної системи з погляду її устойчивости; дослідження потоків інформації (передачі повідомлень під час вирішення завдань, вплив членів групи друг на друга у процесі гуртування групи); за допомогою Т. р. вирішують проблему знаходження оптимальної комунікаційної мережі.
У застосуванні до Теорії графів, як і до будь-якого математичного апарату, вірно твердження, основні принципи розв'язання завдання задаються, змістовної теорією (у разі соціологією).
Завдання : Три сусіди мають три спільні колодязі Чи можна провести доріжки, що не перетинаються, від кожного будинку до кожної криниці. Доріжки не можуть проходити через колодязі та будиночки (рис.1).

Мал. 1. До завдання про будиночки та криниці.
Для вирішення цього завдання скористаємося теоремою, доведеною Ейлером в 1752, яка є однією з основних в теорії графів. Перша робота з теорії графів належить Леонарду Ейлеру (1736), хоча термін «граф» вперше ввів у 1936 угорський математик Денеш Кеніг. Графами були названі схеми, що складаються з точок і відрізків прямих або кривих, що з'єднують ці точки.
Теорема. Якщо багатокутник розбитий на кінцеве число багатокутників так, що будь-які два багатокутники розбиття або не мають спільних точок, або мають спільні вершини, або мають спільні ребра, то має місце рівність
В - Р + Г = 1, (*)
де В – загальна кількість вершин, Р – загальна кількість ребер, Г – число багатокутників (гранів).
Доведення. Доведемо, що рівність не зміниться, якщо у якомусь багатокутнику даного розбиття провести діагональ (рис. 2, а).
а)  б)
б) 
Справді, після проведення такої діагоналі в новому розбиття буде В вершин Р+1 ребер і кількість багатокутників збільшиться на одиницю. Отже, маємо
В - (Р + 1) + (Г +1) = В - Р + Г.
Користуючись цією властивістю, проведемо діагоналі, що розбивають вхідні багатокутники на трикутники, і для розбиття покажемо здійснимість співвідношення.
Для цього будемо послідовно прибирати зовнішні ребра, зменшуючи кількість трикутників. При цьому можливі два випадки:
для видалення трикутника ABC потрібно зняти два ребра, у разі AB і BC;
для видалення трикутника MKN потрібно зняти одне ребро, у разі MN.
В обох випадках рівність не зміниться. Наприклад, у першому випадку після видалення трикутника граф складатиметься з В-1 вершин, Р-2 ребер та Г-1 багатокутника:
(В - 1) - (Р + 2) + (Г -1) = В - Р + Г.
Таким чином, видалення одного трикутника не змінює рівності.
Продовжуючи цей процес видалення трикутників, зрештою ми прийдемо до розбиття, що складається з одного трикутника. Для такого розбиття В = 3, Р = 3, Г = 1 і, отже,
Отже, рівність має місце й у вихідного розбиття, звідки остаточно отримуємо, що з даного розбиття багатокутника справедливе співвідношення.
Зауважимо, що співвідношення Ейлера залежить від форми багатокутників. Багатокутники можна деформувати, збільшувати, зменшувати чи навіть викривляти їхні сторони, аби при цьому не відбувалося розривів сторін. Співвідношення Ейлера у своїй не зміниться.
Приступимо тепер до вирішення завдання про три будиночки і три колодязі.
Рішення. Припустимо, що це можна зробити. Зазначимо будиночки точками Д1, Д2, Д3, а колодязі – точками К1, К2, К3 (рис. 1). Кожну точку-будиночок з'єднаємо з кожною точкою-колодцем. Отримаємо дев'ять ребер, які попарно не перетинаються.
Ці ребра утворюють на площині багатокутник, розділений більш дрібні багатокутники. Тому для цього розбиття повинно виконуватися співвідношення Ейлера - Р + Г = 1.
Додамо до розглянутих граней ще одну - зовнішню частину площини по відношенню до багатокутника. Тоді співвідношення Ейлера набуде вигляду В - Р + Г = 2, причому В = 6 і Р = 9.
Отже, Г = 5. Кожна з п'яти граней має принаймні чотири ребра, оскільки, за умовою завдання, жодна з доріжок не повинна безпосередньо з'єднувати два будинки або два колодязі. Так як кожне ребро лежить рівно у двох гранях, то кількість ребер має бути не менше (5 4)/2 = 10, що суперечить умові, за якою їхнє число дорівнює 9.
Отримана суперечність показує, що відповідь у завданні негативна - не можна провести доріжки, що не перетинаються, від кожного будиночка до кожного коло.
Теорія Графів у хімії
Застосування теорії графів на побудові та аналізі різних класів хімічних та хіміко-технологічних графів, які називаються також топологією, моделями, тобто. моделями, які враховують лише характер зв'язку вершин. Дуги (ребра) і вершини цих графів відображають хімічний та хімічно-технологічний поняття, явища, процеси або об'єкти та відповідно якісного та кількісного взаємозв'язку або певні відносини між ними.
Теоретичні задачі. Хімічні графи дають можливість прогнозувати хімічні перетворення, пояснювати сутність і систематизувати деякі основні поняття хімії: структуру, конфігурацію, конфірмації, квантовомеханічну і статистико-механічну взаємодії молекул, ізомерію та ін. Молекулярні графи, що застосовуються в стереохімії та структурної топології, хімії кластерів, полімерів та ін., є неорієнтованими графами, що відображають будову молекул. Вершини та ребра цих графів відповідають відповідним атомам і хімічним зв'язкамміж ними.
У стереохімії орг. в-в найчастіше використовують молекулярні дерева - кістякові дерева молекулярних графів, які містять лише всі вершини, відповідні атомам Складання наборів молекулярних дерев і встановлення їх ізоморфізму дозволяють визначати молекулярні структури і знаходити повне число ізомерів алканів, алкенів та алкінів. Молекулярні графи дають можливість зводити завдання, пов'язані з кодуванням, номенклатурою та структурними особливостями (розгалуженість, циклічність тощо) молекул різних сполук, до аналізу та зіставлення суто математичних ознак та властивостей молекулярних графів та їх дерев, а також відповідних їм матриць. Для виявлення кількості кореляцій між будовою молекул та фізико-хімічними (в т.ч. фармакологічними) властивостями сполук розроблено понад 20 т. зв. Топологічних індексів молекул (Вінера, Балабана, Хосойї, Плата, Рандича та ін.), які визначають за допомогою матриць та числових характеристикмолекулярні дерева. Напр., індекс Вінера W = (m3 + m)/6, де т-число вершин, що відповідають атомам С, корелює з молекулярними обсягами та рефракціями, ентальпіями освіти, в'язкістю, поверхневим натягомхроматографічними константами сполук, октановими числами вуглеводнів і навіть фізіол. активністю лікарських засобів. Важливими параметрами молекулярних графів, що використовуються для визначення таутомерних форм даної речовини та їхньої реакційної здатності, а також при класифікації амінокислот, нуклеїнових кислот, вуглеводів та ін. складних природних сполук, є середня та повна (Н)інформаційна ємності. Аналіз молекулярних графів полімерів, вершини яких відповідають мономерним ланкам, а ребра-хімічним зв'язкам між ними, дозволяє пояснити, наприклад: ефекти виключеного обсягу, що призводять до якостей. змін прогнозованих властивостей полімерів. Із застосуванням Теорії графів та принципів штучного інтелектурозроблено програмне забезпечення інформаційно-пошукових систем у хімії, а також автоматизованих систем ідентифікації молекулярних структурта раціонального планування органічного синтезу. Для практичної реалізації на ЕОМ операцій вибору оптимальних шляхів хім. перетворень на основі ретросинтетичного та синтонного принципів використовують багаторівневі розгалужені графи пошуку варіантів рішень, вершини яких відповідають молекулярним графам реагентів та продуктів, а дуги зображують перетворення.
Для вирішення багатовимірних завдань аналізу та оптимізації хіміко-технологічних систем (ХТС) використовують такі хіміко-технологічні графи: потокові, інформаційно-потокові, сигнальні та графи надійності. Для вивчення у хім. фізики збурень у системах, що складаються з великої кількості частинок, використовують т. зв. діаграми Фейнмана-графи, вершини яких відповідають елементарним взаємодіям фізичних частинок, ребра їх шляхам після зіткнень. Зокрема, ці графи дозволяють досліджувати механізми коливальних реакцій та визначати стійкість реакційних систем. Матеріальні потокові графи відображають зміни витрат в-в ХТС. вершини графів відповідають апаратам, у яких змінюються витрати теплоти фізичних потоків, та, крім того, джерелам та стокам теплової енергії системи; дуги відповідають фізичним і фіктивним (фіз.-хім. перетворення енергії в апаратах) тепловим потокам, а ваги дуг дорівнюють ентальпіям потоків. Матеріальні та теплові графи використовують для складання програм автоматизованої розробки алгоритмів розв'язання систем рівнянь матеріальних та теплових балансів складних ГТС. Інформаційно-струмові графи відображають логіко-інформаційну структуру систем рівнянь мат. моделей ХТС; застосовуються упорядкування оптимальних алгоритмів розрахунку цих систем. Дводольний інформаційний граф неорієнтований чи орієнтований граф, вершини якого відповідають соотв. рівнянням fl -f6 та змінним q1 – V, а гілки відображають їх взаємозв'язок. Інформаційний граф - орграф, що зображує порядок розв'язання рівнянь; вершини графа відповідають цим рівнянням, джерелам та приймачам інформації ХТС, а гілки-інформації. змінним. Сигнальні графи відповідають лінійним системамрівнянь математичних моделей хіміко-технологічних процесів та систем. Графи надійності застосовують для розрахунку різних показниківнадійності Х.
Використана література :
1.Берж До., Т. р. та її застосування, переклад з французької, М., 1962;
2.Кемені Дж., Снелл Дж., Томпсон Дж., Введення в кінцеву математику, пров. з англ., 2 видавництва, М., 1963;
3.Ope О., Графи та їх застосування, пров. з англ., М., 1965;
4. Білих О. Ст, Бєляєв Е. Ст, Можливості застосування Т. р. в соціології, в сб.: Людина і суспільство, вип. 1, [Л.], 1966;
5. Кількісні методи у соціологічних дослідженнях, М., 1966; Бєляєв Е. Ст, Проблеми соціологічних вимірів, "ВФ", 1967, No 7; Bavelas. Communication patterns в task oriented groups, в кн. Lerner D., Lass well H., Policy sciences, Stanford, 1951;
6.Кеmeny J. G., Snell J., Mathematical models in the social sciences, N. Y., 1962; Filament C., Applications of graph theory to group structure, N. Y., 1963; Оeser Ο. Α., Hararu F., Role structures and description in terms of graph theory, кн.: Вiddle У., Thomas Е. J., Role theory: concepts and research, N. Y., 1966. Еге. Бєляєв. Ленінград.
Для створення комплексів програм автоматизування. синтезу оптим. високонадійних виробів (у т. ч. ресурсозберігаючих) поряд з принципами мистецтв. інтелекту застосовують орієнтовані семантичні, чи смислові, графи варіантів рішень ХТС. Ці графи, які в окремому випадку є деревами, зображують процедури генерації безлічі раціональних альтернативних схем ХТС (напр., 14 можливих при розділенні ректифікацією п'ятиком"понентної суміші цільових продуктів) і процедури впорядкованого вибору серед них схеми, оптимальної за деяким критерієм ефективності системи (див. Оптимізація).
Графів теорію використовують також розробки алгоритмів оптимізації тимчасових графіків функціонування устаткування багатоасортиментних гнучких произ-в, алгоритмів оптим. розміщення апаратури та трасування трубопровідних систем, алгоритмів оптим. управління хіміко-технол. процесами і произ-вами, при мережевому плануванні роботи і т.д.
Зыков А. А., Теорія кінцевих графів, [ст. 1], Новосиб., 1969; Яцимирський К. Би., Застосування теорії графів у хімії, Київ, 1973; Кафаров Ст Ст, Перов Ст Л., Мешалкін Ст П., Принципи математичного моделювання хіміко-технологічних систем, М., 1974; Крістофідес Н., Теорія графів. Алгоритмічний підхід, пров. з англ., М., 1978; Кафаров Ст Ст, Перов Ст Л., Мешал кін Ст П., Математичні основи автоматизованого проектування хімічних виробництв, М., 1979; Хімічні додатки топології та теорії графів, за ред. Р. Кінга, пров. з англ., М., 1987; Chemical Applications of Graph Theory, Balaban A.T. (Ed.), N.Y.-L., 1976. Ст Ст Кафаров, Ст П. Мешалкін.
===
Вик. література для статті «ГРАФІВ ТЕОРІЯ»: немає даних
Сторінка «ГРАФІВ ТЕОРІЯ»підготовлена за матеріалами
VARIABILITY БАГАТООБРАЗ БУДУВАННЯ OF STRUCTURES AND FORMS І ФОРМ МОЛЕКУЛ OF ORGANIC COMPOUND ОРГАНІЧНИХ СПОЛУКІВ MOLECULES L. P. OLEKHNOVICH р. в. йгЦпзйЗау КУТЪУ‚ТНЛИ „УТИС‡ ТЪ‚ВММ˚И ВИМЛ‚У ТЛЪВЪ, КУТЪУ‚-М‡-СУМИ виділяється різноманітністю будови та надзвичайної pounds are discussed with численністю індивідуальних сполук the application of some . Загальна кількість відомих органічних сполук - елементи графової теорії. ній (понад десять мільйонів) щорічно поповнюється десятками тисяч нових речовин, що синтезуються в лабораторіях. Органічна хімія дивує analysis of molecular різноманіттям класів молекул, у будові кото- forms (“figures”) on the рих на перший погляд не видно жодної логіки. Основною причиною появи не піддається basis of symmetry opera простому перерахуванню (> 107) безлічі організацій are enlightened. Dif-чеських сполук є унікальні властивості ferences of achiral and центрального елемента – вуглецю. chiral compounds are Світ сполук вуглецю – це невичерпна комбінаторика варіантів та способів побудови classified. молекул з n атомів З, m атомів O, k-N, l-S, h-P і т.д. к‡ТТПУЪ ВМ˚ ‚УФ УТ˚ щгЦеЦзнх нЦйкаа ЙкДойЗ Ф УЛТıУКВВМЛfl ПМУ„У- З абйЕкДЬЦзап ейгЦдмг У· ‡БЛfl ‚ЛЩУ‚ БВ Н‡О¸- ˆЛУМУМІЇ, але ємною мовою математичних формул і ЛБУПВ ЛЛ У „‡МЛ˜ВТНЛı викладок, хіміки використовують особливу мову записів будови сполук. Цю мову тим більше не обходимо в органічній хімії для упорядкування уявлень про численні підкласи „ ЩУ”. д ЗНУ УТВ- гігантського розмаїття молекул. Щоб витрачати менше часу і місця при зображенні структурних формул, хіміки-органіки часто не захищені П (ЩЛ„И) ПУОВНО ускладнюють себе позначеннями атомів. Цей прийом МЗУТМУ‚В Ф В‰ТЪ‡‚ОВ- особливо зручний, коли розглядаються не які-небудь властивості конкретного з'єднання, а загальні закономірності будови і форми рядів мо- ЛЛ, НО‡ТЛЩЛˆЛ ‚‡- лекул. Так, замість того щоб малювати літерні М·УТУ·ВММУТЪЛ ТЪ УВ- позначення вуглецевих і водневих атомів у всіх структурних ізомерах, наприклад гранично- © йОВıМУ‚Л˜ г.і. , 1997 МЛfl ТЛППВЪ ЛМХЛ Л вуглеводню гексану – С6Н14 , зображуються ТЛППВ ЛММ ТУВЛМВ- графи (схема 1) МЛІ, МОУ УФ ВВВМЛЛ ЛЛ. Схема 1 44 лйкйлйЗлдав йЕкДбйЗДнЦгъзхв ЬмкзДг, ‹2, 1997 Вершини графів (точки) – це атоми вуглецю, з'єднань, зображати також складні перетворювально – а з'єднуючі їх лінії ня молекул (реакції) і розуміти один одного. Оскільки вуглець чотиривалентний, а водень од- Взагалі хімічні графи мають пряме отно- новалентен, то ясно, що при кінцевих (вільних) шення до спеціальної галузі математики – теорії вершин графа має бути по три атоми Н, при графів. У цій теорії граф G порядку n опреде- середніх вершинах типу – по два, при третин- няється як непорожня безліч вершин V1 , V2 , …, Vn них вершинах – по одному і не повинно бути з безліччю (m) парних відносин – ребер, свя- водневих атомів при четвертинних вершинах, що зивають різні вершини. Початок теорії графів поклали знамениті міркування Л. Ейлера. Наведені вище графи, отже, не- (1736) про кенігсберські мости, де були сформулі-повні, проте вони достатні для представлення критерії обходу всіх ребер графа без повструктурних ізомерів вуглеводнів. Нижче приві- торень, а також інші його роботи, пов'язані з моде- ни графи молекул ненасичених вуглеводнів з тематичними головоломками та розвагами. подвійними (С=С) та потрійними (С≡С) зв'язками, а так- Важливі віхи на шляху розвитку цієї теорії складе- ж графи деяких циклічних та каркасних вугілля роботи Г. Кірхгофа (1847) та В. Гамільтона леводнів (табл. 1). (1859). А. Келі (1857, 1874–1875) був першим, хто Тригональний граф (схема 2) узагальнює застосовував графові уявлення (перерахунки про фігури дуже різних молекул. ня графових “дерев”) у зв'язку з підрахунком числа ізомерів перших членів ряду граничних вуглеводо- Таким чином, графічна (графова) форму-родів – алканів. Справді, лише з допомогою ла з'єднання – це економне уявлення важ- аппарата теорії графів (теорема Пойа, 1937) мож- них приватних і найбільш загальних закономірностей його вирішувати завдання перебору (перерахування) всіх будови і форми. Хімікам досить подібних структурних ізомерів молекул СnH2n +2, CnH2n, графів, щоб, не користуючись довгими назвами CnH2n-2, CnH2n-4 і т.д. (Див. графи ізомерів гексану), Таблиця 1 Z,E-ізомери бутену-2 Z E H3C CH CH CH3 .R . R,L-ізомери 1,3-диметил-3-кумулену L . Z. . E. Z,E-ізомери 1,4-диметил-4-кумулену. . . . . . Диметилацетилен 1,4-диметил-біацетилен Ксилоли Бензол Толуол орто- мета- пара- Циклічні граничні вуглеводні Циклопропан Циклобутан Циклопентан Циклогексан і так далі Каркасні вуглеводні Тетраедран Призман Кубан йгЦпзй. 45 O 2− O − CH2 + F B C N C = F F O O O H2C CH2 Трифторид Аніон кислотного залишку Катіон триметиленметану похідних (заміщених) вугле- лаєєЦнкаь а ДлаєєЦнкаь ейгЦдмг, водень, коли "вручну", при великих n, це дакДг'зДь лаєєЦнкаь вимагає багато часу. В даний час теорія Звернемося тепер до іншої особливості нашого графів природним чином входить до багатьох свідомості - уваги. Коли ми розглядаємо розділи сучасної математики, такі, як топокій-небудь з навколишніх об'єктів (у тому числі мологія і комбінаторика, лінійна алгебра і теорія лекулярні графи), то при цьому найчастіше реалізу- груп, теорія ймовірностей і чисельний аналіз. ються теж свідомо неконтрольовані операції Вона успішно застосовується у фізиці, хімії, гене-уваги, які відзначають, в якій відповідності тиці, антропології, електротехніці, проектування-один одному знаходяться частини об'єкта. Стародавні греки ні ЕОМ, архітектурі, соціології та лінгвістиці. терміном “сумірний” (σιёёετροσ) позначали Слід мати на увазі особливості “мови” хі- такі особливості взаєморозташування, відноше- мічних графів: ній частин об'єкта, які і зумовлюють його симетричний вигляд, форму – строгу симетрію молекулярні графи формалізують мінералів, двосторонню сімнію, що включають, як правило, кілька (два і метрію листя рослин, поворотну симетрію більше) сортів атомів-вершин; квітів і т.д. якщо загальна теоріяОб'єкти симетричні, якщо пропорційність і вільна кількість ребер, що виходять з однієї вер- взаєморозташування їх частин допускають такі шини (у тому числі ізольовані вершини при операції поворотів, внутрішніх відображень, ін- повній відсутності ребер), то вершини хімічно-версій (комбінування поворотів і відбитків), го графа повинні мати рівно стільки ребер (свя- дію яких залишає їх (об'єкти) незмін-зей), яка валентність ( координаційне число) ними, переводить їх самих у себе. Будова симмет- даного атома в хімічному з'єднанні ; річних об'єктів таке, що воно характеризується наявністю хоча б одного з наступних елементів вершини хімічного графа разом з напрямком симетрії: ними ребер повинні бути чітко орієнтовані, площини дзеркального відображення σ (S1) – бо вони являють собою взаєморозташування скості симетрії, що мають об'єкти, що складаються з атомів у молекулах, а також кути між зв'язками однакових, дзеркально-тотожних половин атомів: для тетраедричного атома вуглецю ці (див. графи на схемах 1, 2 та табл. 1); кути зазвичай дорівнюють 109,5°, для тригонально-плоського – 120°, для дигонального, ацетиленового – осі симетрії Сn, n = 2, 3, 4, …, – частини об'єктів – 180°, але можуть бути і винятки ( див. графи картки поєднуються, як і об'єкт загалом, за його пока- сних вуглеводнів у табл. 1), а тривимірні (об- воротах на кути 2π / n (див. табл. 1 і схему 2); ємні) проекції графів потрібні для предзеркально-поворотной осі Sn , S2 = i – центр ставлення конфігурацій молекул. інверсії – є комбінацією С2 + S1 , S4 = ком- Хіміки-експериментатори проектують, по-бінації C4 + S1 (див. E-ізомери бутену-2, парних подібно інженерам, графи нових, невідомих раніше кумуленів, тетраедран і кубан у табл. 1). сполук, продумують і реалізують способи їх об'єкта асиметричний, якщо його внутрішнє синтезу. Хіміки-теоретики піддають порівняння і зовнішню форму не можна охарактеризувати в квантовохімічних розрахунках жодним з перелічених елементів наразі дуже різні структури, щоб виявити метрії (див. 2-й і 4-й ізомери гексану на схемі 1, межі змін міжатомних відстаней та роз- аланін на схемі 3). Для таких об'єктів є єдність електронів в іонах і молекулах, передова тривіальна операція симетрії – С1 . що ставляться одним графом (див. схему 2). Графічний поворот С1 на 360° (2π) поєднує асиметричні формули стали повсякденними трохи більше об'єкт сам з собою. Зрозуміло, дією опера - 100 років тому, і графова мова спілкування хіміків ції С1 поєднуються самі з собою і все симетрично - безперервно вдосконалюється. ні об'єкти, оскільки цей поворот тривіальний. 46 лйкйлйЗлдав йЕкДбйЗДнЦгъзхв ЬмкзДг, ‹2, 1997 3 3 H H H H COOH H3C COOH HOOC CH3 C 2 C C 2 C 1 4 4 1 H H ін Схема 3 Сфери, кулі – приклади об'єктів, що мають асиметрична молекула (аланін) має дзеркаль- нескінченні множини всіх елементів симетрії – ного двійника – дубль (див. схему 3). S1(σ), Cn, Sn. Куля поєднується сама з собою при будь-яких поворотах, будь-яких дзеркальних орієнтаціях У 60–70-ті роки нашого століття вчені-стереоплощин і осей обертання, що проходять через його хіміки Р. Кан, К. Інгольд і В. Прелог виробили центр. Тому правильні опуклі багатогранні загальні правила для віднесення компонентів-дубленики (тетраедр, куб, октаедр, додекаедр, ікосаедр – тов подібного типу до лівих (l) і правих (r) форм: ідеальні Платонові тіла), в які вписують заступники (атоми), пов'язані з асиметрією сфери, мають хоч і кінцеві набори елементів вуглецевим або іншим атомним центром, симетрії, але їх кількість і різноманітність завжди на- сортуються за їх ієрархією, і найстаршим (найбільші в порівнянні з іншими багатогранниками.мером 1) є той, який має більшу Вже давно було відзначено, що якщо асиметричні атомну масу: в аланіні (схема 3) 14N старше 12С, а ну фігуру відобразити в дзеркальній площині, роз- серед атомів вуглецю метильної і карбоксильної груп старше останній: він пов'язаний з важкими 16О, кладеної поза цим об'єктом, то виходить фігура, в той час як перший – з легкими 1Н; точності подібна до вихідної, але несумісна з першою при будь-яких зрушеннях і поворотах. Слідчий спостерігач орієнтується (звичайно, мисленно, всім асиметричним об'єктам можна солоно) до молекули, або молекула орієнтується до поставити дзеркальноподібні двійники. Звичайним є спостерігачеві таким чином, щоб вуглецеві приклади цього – наше взуття та рукавички, ліві центр “затуляв” наймолодший заступник (Н), і праві пари фігур яких облягають відповід- і якщо при цьому траєкторія послідовного пе-венно ліві та праві дзеркально -дублетні кінцівки від найстаршого до молодших (незаслонених наших взагалі-то планарно-симетричних) заступників (тобто від першого номера до фігур. Кристалографи ще кілька століть тому наступним) аналогічна руху стрілок годинника, відзначили поширеність дзеркальноподібних то конфігурація абсолютно права (r), якщо наобо-енантіоморфних форм у неорганічному світі – рот, то абсолютно ліва (l). ліві та праві кристали кварцу, турмаліну, кальциту (ісландський шпат). Ввівши уявлення про абсолютно ліві та праві конфігурації, ми повинні попередити про Дзеркальну ізомерію, енантіомерію, в організованості цієї абсолютності. Операції зер- чеської хімії – дуже поширене явище. кального відображення відповідає Р – інверсія ко- Пріоритет її відкриття в середині минулого столу- ординат всіх атомних і субатомних частин об'єкта. тия належить видатному французу Луї Пас- Проте оскільки невідомо внутрішня будова теру, який звернув увагу на дзеркальну подобу атомних (електрони) і субатомних (кварки, глюоформ кристалів калій-амонійних солей винної ни) частинок, то операцію Р фізики доповнюють фор- кислоти. З ім'ям Пастера пов'язане становлення мальною операцією зарядового сполучення С – стереохімії, що ґрунтується на проблемах си- сменою на протилежні знаки зарядів і всіх метрії та асиметрії молекул, їх будови (форми) інших антиподних квантових характеристик атомів у тривимірному просторі. Важливою віхою розвинених (протонів, нейтронів, електронів) і субатомтія стереохімії стала запропонована в 1874 році них (кварків, глюонів) частинок, а також операцією Я. Вант Гоффом і Ж. Ле Белем тетраедричної інверсії напрямків руху (імпульс) - модель атома вуглецю Якщо в найпростішому вуглево- менті імпульсів) всіх складових об'єкта, на кшталт, фігура якого аналогічна високоси- торій відповідає обігу часу Т. Поеметричному тетраедру, – метани атоми водню дійсно граничною інверсією є послідовно замінювати (заміщати) ) іншими ато-комбінована СРТ-операція. Звідси випливає, мами та атомними угрупованнями, то симетрія абсолютним антиподом вихідної, наприклад, виходять молекул швидко знижується. Після r-молекули повинен бути її l-партнер, але складаються з трьох таких процедур з тетраедричним вуглецевим щій з антиречовини і центром, що рухається в часі, пов'язані вже чотири різних заступники, і назад. Ідеї комбінування Р-, С- та Т-операторів йгЦпзйЗау г.і. 47 симетрії належать Г. Людерсу і В. Паулі об'єднувати до нескінченно симетричної сфери, то все (1954–1955). елементи симетрії вихідного об'єкта деградують- Внаслідок гігантських можливостей варіюють- повністю, тобто асиметрична "добавка" ня атомів і атомних груп, здатних зв'язувати-переводить ідеально симетричний (синглетний) ся з вуглецем, в принципі реалізовані нескінченних- об'єкт. ні послідовності дзеркальних r, l-дублетів Однак не слід вважати, що енантіомерія молекул з асиметричними вуглецевими центрами неможлива серед симетричних фігур (молекул). ми. Зазначимо просту закономірність: чи дзеркальна асиметричний вуглецевий чи інший атом- конфігураційна ізомерія дійсно невоз- ний центр помістити як заступника на можна в рядах об'єктів (молекул), що мають в кожну з вершин високосиметричного об'єкта (на - Якість внутрішніх елементів симетрії плоско- приклад, на тетраедран, кубан; 1) і навіть присо- сті дзеркального відображення σ (S1) та/або дзеркально- Таблиця 2 C2 C2 R L . . (CH 2) n (CH 2) n R, L-транс-циклооктени R, L-транс-циклоетилени C2 C2 C2 C2 C2 C2 Твістан R L Z Z -біфеніли симетрії C2 Z Z R L -трифенілметани симетрії C3 L R C2 R шнеки, гвинти, гайки, болти 48 лйкйлйЗлдав йЕкДбйЗДнЦгъзхв ЬмкзДг, ‹2, 1997 поворотні осі i (S2, 3, 4, …). При відображенні таких д – топологічно-киральні молекули (кате-фігур зовнішньої дзеркальної площиною виходять нани, вузли на схемі 4). тотожні вихідним об'єкти-копії (див. гра- Все ж умовність розбиття очевидна у світлі фи на схемах 1, 2 і в табл. 1). Навпаки, якщо ладо- розроблених Р. Каном, К. Інгольдом і В. Застосування об'єктів (молекул) характеризується відсутністю, доповнених їх послідовниками внутрішніх дзеркальних елементів симетрії Sn правил віднесення конфігурацій енантіомерних (σ, i), але вони сим щодо поворотів молекул до R- або L-рядів – це циркулярні, спи- Cn (n = 2, 3, 4, …), то такі фігури завжди R, L-дубральні (киральні) рухи по (R) або проти льотні. Найпростіший приклад – 1,3-диметил-3-куму- (L) ходу стрілок годинника при послідовному рослін (табл. 1) і всі його гомологи з непарним числом перегляді “старшинства” (ваги) заступників, рас- атомів вуглецю в лінійного ланцюга. У табл. 2 показані (схема 3) навколо атомного центру – ни деякі R, L-дублети з великої множини а, виділеної площини – б (транс-циклоетилени, молекул, симетричних щодо поворотів. табл. 2), при обході контурів пропелерів – в , вин- Зазначимо, що вони взагалі не мають асиметричних - г, вузлів - д в табл. 2, на схемі 4. вуглецевих центрів. У техніці молекулам біфенілів та трифенілметилів аналогічні фігури лопатей вентиляторів, пропелерів, ротори турбін; фігур геліценових молекул аналогічні спіралі, пружини, шнеки, ліва і права нарізка гвинтів. Для короткої характеристикиобговорюваного яв-катенан лення на рубежі XIX і XX століть лорд Кельвін Трилистий вузол (CH2)m, з орієнтованими і не- мінімальне m = 66 запропонував термін “chirality” (від грец. χειρ – рука). тотожними кільцями У російській мові вживаються два варіанти вимови та написання цього терміна: кіральність і Схема 4 хіральність. Автор разом із фізиками віддає перевагу першому. Поєднані операцією дзеркального відображення (координатної інверсії P) мо- Отже, строго кажучи, не існують лекули – компоненти енантіомерних дублетів – якісно різні види кіральності молекул. відрізняються лише єдиною властивістю – наприклад, звана топологічною кіраль- тивоположними знаками +(R) і −(L) кута обертованість д на схемі 4 лише відображення тієї струк- вання площини поляризації світла. Аналогічні турні особливості зображених молекул, що антиподні (+, −) відносини характерні також окремі їх частини утримуються разом не хімі- для полюсів магнітів, зарядів та інших квантових зв'язками, а топологією будови ланцюгів (ка- характеристик атомних і субатомних частинок. Такі тенани ), замкнутих спіралей та вузлів; їх кіральні відносини називаються фізиками кіральної сім- (R, L) форма цілком аналогічна формі пропелеметрії. ров – в і спіралей – р. Тому всі перелічені вище види кіральності молекул кількісно Завдяки зусиллям хіміків-синтетиків, захоплюються одноманітно: знаком (+, −) та величених проблемами стереобудування, за останнім чином кута обертання площини поляризації за десятиліття сталі відомі і доступні досить багатостандартної довжині хвилі світла. Тим не менш відомо також і те, що при поліральних молекул (див. табл. 2 і схему 4). Прийнято конденсації центрально-киральних (r або l) амі- рахувати , що різноманітність киральних хімічно-кислот, рибонуклеотидів загальна киральність по- кіх сполук поділяється на п'ять видів відповідно до лімеру (білка, ДНК) не може бути оцінена з симетричними особливостями. : тривіальним підсумовуванням індивідуальних кі-а – молекули з киральним центром немає ральностей ланок: Σrn(ln) . Ця сума “об'єм- ніяких елементів симетрії, крім елемента літся” спіральною (гелікальною) кіральністю ідентичності C1 (приклади – амінокислоти (ала-макромолекули, що має свій знак (+R h, −Lh) і нін на схемі 3), цукру-вуглеводи ); абсолютну величину б – планарно-киральні молекули симетрії Nr (l) ∑ l (r) ⊂ R (L). h h C1 та/або C2 (виділений елемент будови – плоска n n (1) кістка, приклади – трансциклоетилени в табл. 2); Той факт, що регулярна орто-конденсація аків – аксіально-киральні молекули c симметричних бензольних кілець також призводить до спірії Cn (мають форму пропелерів або свастик, ральних геліценів (табл. 2), лише підтверджують приклади – твістан). , біфеніл, трифенілметан в дає загальне правило: і циркулярне об'єднання (табл. 2 і т.п.); акіральних мономерів відповідної будови, і г – гелікально-киральні молекули симетрії лінійна поліконденсація киральних (тільки r C2 (характерна форма – спіраль, приклади – гекса- або тільки l) ланок автоматично ведуть до спігеліцен у табл. 2, білки, ДНК) ; ральної формі полімеру. Можна вважати, що у йгЦпзйЗау г.і. 49 рядах таких макромолекул реалізується якась посмі- шають внутрішні дзеркальні елементи симмет-льодовність киральностей, відповідна ії рівнів стереобудування. Наприклад, оскільки їх внутрішня будова Р-парно. Об'єктивний, вторинний, третинний і четвертинний ти, що не мають внутрішньої Р-парності будови рівні будови гемоглобіну , очевидно, характерні (що не мають елементів симетрії Sn), завжди кон- теризуються також послідовностями “вкладено- фігураційно двозначні (дублетні, лівий + праній” типу (1) суми індивідуальних киральностей вий). Щоб з Р-парного об'єкта отримати його коамінокислот у спіральну киральність поліпеп-пію, достатньо однієї Рσ(i)-операції, але щоб тида, цих двох – у “глобулярну” кіральність скопіювати Р-непарний об'єкт, необхідні два третинні рівні, нарешті, цих трьох - в "надмо-послідовні Р-операції: лекулярну" кіральність квартету (тетраедра) об'єднаних глобул. Звідси, між іншим, слідує, що стереохімія полімерів, їх асоціатів повинна враховувати на додаток до перелічених. неживій природі Р-непарним ну” – ж види кіральності. Саме наступні за об'єктами можна легко знайти лівих або правих первинним (структурним) верхні конфігурації-партнерів-близнюків, наприклад обраному дерев'яному рівні організації макромолекул грають ву лісі або каменю з купи щебеню. Зазначимо далі, вирішальну роль при їхньому функціонуванні в орга- що киральна симетрія абсолютно (на 100%) не низмах. Так, біохімічні реакції за участю дотримується для Р-непарних молекул органічних ферментів ефективно здійснюються лише в сполуках, що входять до складу всіх живих органів, коли попередньо реалізована комнізмів на нашій планеті. Якщо це амінокислоти, плементація, тобто “впізнавання”, відбір тих моле-то лише ліві (l); якщо цукру-вуглеводи, то тільки кул реагентів і субстратів, особливості конфігу-праві (r); якщо це біополімери, то вони спіраль- рації яких (“фігури” яких) ідеально закручені тільки вправо (білки, ДНК). На цю погоджуються з контурами, формами відповідну закономірність, звану кіральною асимметною порожниною в глобулах ферментів. Побутовою анарією біосфери, також вперше звернув увагу логом такої комплементації Д. Кошланд запропонував Л. Пастер. жил вважати відповідність ключа та замку. 1. Загальна органічна хімія: Пер. з англ. М: Хімія, Узагальним викладене вище. Ця стаття 1981–1986. Т. 1-12. слід мета показати, що у неозорому на пер- 2. Жданов Ю.А. Вуглець та життя. Ростов н/Д: Вид-во вий погляд на матеріалі органічної хімії легше РГУ, 1968. 131 с. орієнтуватися, якщо засвоїти принципи графово-3. Татт У. Теорія графів. М: Світ, 1988. го зображення найбільш загальних характеристикбудови молекул, а також принципи їх оцінки 4. Соколов В.І. Введення в теоретичну стерео-конфігурації – форми у тривимірному просторі-хімію. М: Наука, 1982; Успіхи хімії. 1973. Т. 42. ве - на основі ідей симетрії та асиметрії. По-С. 1037-1051. слідні включають уявлення про основні опе- 5. Нограді М. Стереохімія. М.: Мир, 1984. раторах симетрії: площині, осях і дзеркально- 6. Харгіттаї І., Харгіттаї М. Симетрія очима поворотних осях, що використовуються при виявленні тих хіміка. М.: Світ, 1989. внутрішніх особливостей будови молекул, кото- 7. Пилипович І.В., Сорокіна Н.І. // Успіхи сучасні. рі визначають їх зовнішній вигляд, Форму і в кінці-біології. 1983. Т. 95. С. 163-178. ном рахунку найважливіші їх властивості. При “сортуванні” молекул на симетричні та * * * асиметричні особлива роль належить оператору дзеркального відображення – координатній інвер- Лев Петрович Олехнович, доктор хімічних насі Р. Оператор Рσ координатам усіх частин (аток, професор, зав. кафедрою хімії природних та мов) об'єкта, розташованого ліворуч від обраної високомолекулярних з'єднань Ростовської го- площини, ставить у однозначну відповідність коор- державного університету, зав. лабораторією динати інвертованого (відбитого) об'єкта внутрішньої динаміки молекул хімфаку та НДІ фі- праворуч від цієї площини. Оператор Pi здійснює зичну та органічну хімію РГУ, член-корес- аналогічну координатну інверсію щодо-пондент Російської академії природничих наук. але точки, обраної поза об'єктом (легко зрозуміти Область наукових інтересів: органічний синтез, і перевірити, що при дії Pi -оператора також кінетика і механізми молекулярних перегрупи- виходить дзеркальний двійник об'єкта, але перевірок, стереохімія і стереодинаміка. Співавтор нут, на 180 °). Об'єкти (молекули), двох монографій та автор понад 370 наукових статей. 50 лйкйлйЗлдав йЕкДбйЗДнЦгъзхв ЬмкзДг, ‹2, 1997