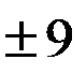с-ЕлементиНаричат се елементи, в чиито атоми последният електрон влиза в s-подниво. По подобен начин се определя стр- елементи,д- елементи иf- елементи.
Началото на всеки период съответства на отварянето на нов електронен слой. Номерът на периода е равен на броя на отворения електронен слой. Всеки период, с изключение на първия, завършва със запълване на р-поднивото на слоя, отворен в началото на този период. Първият период съдържа само s-елементи (два). В четвъртия и петия период между s-елементите (два) и p-елементите (шест) има d-елементи (десет). В шестия и седмия, зад чифт s-елементи има (в нарушение на правилата на Клечковски) един d-елемент, след това четиринадесет f-елемента (те са поставени в отделни редове в долната част на таблицата - лантаниди и актиниди) , след това девет d-елемента и, както винаги, периодите завършват с шест p-елемента.
Таблицата е разделена вертикално на 8 групи, всяка група на основна и второстепенна подгрупа. В главните подгрупи са s- и p-елементи, във вторичните - d-елементи. Основната подгрупа е лесна за определяне - съдържа елементи от 1-3 периода. Точно под тях са останалите елементи от основната подгрупа. Елементите на страничната подгрупа са разположени отстрани (отляво или отдясно).
Валентност на атомите
В класическата концепция валентността се определя от броя на несдвоените електрони в основното или възбудено състояние на атомите. Основно състояние- електронното състояние на атома, при което неговата енергия е минимална. Възбудено състояние- електронното състояние на атома, съответстващо на прехода на един или повече електрони от орбитала с по-ниска енергия към свободна орбитала с по-висока енергия. За s- и p-елементи преходът на електрони е възможен само във външния електронен слой. За d-елементите са възможни преходи в рамките на d-поднивото на пред-външния слой и s- и p-поднивата на външния слой. За f-елементите са възможни преходи в рамките на (n-2)f-, (n-1)d-, ns- и np-поднива, където n е номерът на външния електронен слой. Валентни електронисе наричат електрони, които определят валентността на атома в неговото основно или възбудено състояние. Валентен електронен слой- слой, върху който са разположени валентни електрони.
Опишете електроните на външния слой на серния атом и валентните електрони на желязото (основно състояние), като използвате квантови числа. Посочете възможните валентности и степени на окисление на атомите на тези елементи.
1). Серен атом.
Сярата има пореден номер 16. Тя е в трети период, шеста група, главна подгрупа. Следователно това е p-елемент, външният електронен слой е третият, той е валентният. Има шест електрона. Електронната структура на валентния слой има формата
За всички електрони n=3, тъй като те се намират на третия слой. Нека ги разгледаме по ред:
n=3, L=0 (електронът се намира в s-орбиталата), m l =0 (за s-орбиталата е възможна само тази стойност на магнитното квантово число), m s =+1/2 (въртене около собствената му ос се появява по посока на часовниковата стрелка);
n=3, L=0, m l =0 (тези три квантови числа са същите като тези на първия електрон, тъй като и двата електрона са в една и съща орбитала), m s = -1/2 (само тук се появява разликата, изисква се от принципа на Паули);
n=3, L=1 (това е p-електрон), m l =+1 (от три възможни стойности m l = 1, 0 за първата p-орбитала избираме максимума, това е p x орбитала ), m s = +1/2;
n=3, L=1, m l = +1, m s =-1/2;
n=3, L=1, m l = 0 (това е p y орбитала), m s = +1/2;
n=3, L=1, m l = -1 (това е p z орбитала), m s = +1/2.
Нека разгледаме валентността и степента на окисление на сярата. На валентния слой в основното състояние на атома има две електронни двойки, два несдвоени електрона и пет свободни орбитали. Следователно валентността на сярата в това състояние е II. Сярата е неметал. Липсват му два електрона, преди да завърши слоя, така че в съединения с атоми на по-малко електроотрицателни елементи, като метали, той може да покаже минимално ниво на окисление от -2. Сдвояването на електронни двойки е възможно, тъй като на този слой има свободни орбитали. Следователно в първото възбудено състояние (S *)
В съединения с атоми на по-електроотрицателни елементи, като кислород, всичките шест валентни електрона могат да бъдат изместени от серните атоми, така че максималното му състояние на окисление е +6.
2). Желязо.
Поредният номер на желязото е 26. Намира се в четвъртия период, в осма група, второстепенна подгрупа. Това е d-елемент, шестият в поредица d-елементи от четвъртия период. Валентните електрони на желязото (осем) са разположени на подниво 3d (шест, в съответствие с позицията им в серията от d елементи) и на подниво 4s (две):
Нека ги разгледаме по ред:
n=3, L=2, m l = +2, m s = +1/2;
n=3, L=2, m l = +2, m s = -1/2;
n=3, L=2, m l = +1, m s = +1/2;
n=3, L=2, m l = 0, m s = +1/2;
n=3, L=2, m l = -1, m s = +1/2;
n=3, L=2, m l = -2, m s = +1/2;
n=4, L=0, m l = 0, m s = +1/2;
n=4, L=0, m l = 0, m s = -1/2.
Валентност
Във външния слой няма несдвоени електрони, така че минималната валентност на желязото (II) се появява във възбудено състояние на атома:
След като се използват електроните на външния слой, 4 несдвоени електрона от 3d подниво могат да бъдат включени в образуването на химични връзки. Следователно максималната валентност на желязото е VI.
Степен на окисление
Желязото е метал, така че се характеризира с положителни степени на окисление от +2 (включени са електрони от подниво 4s) до +6 (включени са 4s и всички несдвоени 3d електрони).
Местоположението на електроните върху енергийните обвивки или нива се записва с помощта на електронни формули химически елементи. Електронните формули или конфигурации помагат да се представи атомната структура на даден елемент.
Атомна структура
Атомите на всички елементи се състоят от положително заредено ядро и отрицателно заредени електрони, които са разположени около ядрото.
Електроните са на различни енергийни нива. Колкото по-далеч е един електрон от ядрото, толкова повече енергия има той. Размерът на енергийното ниво се определя от размера на атомната орбитала или орбиталния облак. Това е пространството, в което се движи електронът.

Ориз. 1. Обща структураатом.
Орбиталите могат да имат различни геометрични конфигурации:
- s-орбитали- сферична;
- p-, d- и f-орбитали- дъмбеловидни, лежащи в различни равнини.
Първото енергийно ниво на всеки атом винаги съдържа s-орбитала с два електрона (изключение е водородът). Започвайки от второто ниво, s- и p-орбиталите са на едно ниво.

Ориз. 2. s-, p-, d и f-орбитали.
Орбиталите съществуват независимо от наличието на електрони в тях и могат да бъдат запълнени или празни.
Писане на формула
Електронните конфигурации на атомите на химичните елементи се записват съгласно следните принципи:
- всяко енергийно ниво има съответен сериен номер, обозначен с арабска цифра;
- числото е последвано от буква, обозначаваща орбиталата;
- Над буквата е изписан горен индекс, съответстващ на броя на електроните в орбиталата.
Примери за записване:
 Трябва да активирате JavaScript, за да стартирате това приложение.
Трябва да активирате JavaScript, за да стартирате това приложение. Електронна конфигурация на атоме формула, показваща разположението на електроните в атома по нива и поднива. След като изучите статията, ще научите къде и как се намират електроните, ще се запознаете с квантовите числа и ще можете да конструирате електронната конфигурация на атома по неговия номер; в края на статията има таблица с елементи.
Защо да изучаваме електронната конфигурация на елементите?
Атомите са като строителен комплект: има определен брой части, те се различават една от друга, но две части от един и същи вид са абсолютно еднакви. Но този конструктор е много по-интересен от пластмасовия и ето защо. Конфигурацията се променя в зависимост от това кой е наблизо. Например кислород до водород Може бисе превръща във вода, когато е близо до натрий, се превръща в газ, а когато е близо до желязо, напълно го превръща в ръжда. За да се отговори на въпроса защо това се случва и да се предвиди поведението на един атом до друг, е необходимо да се проучи електронната конфигурация, която ще бъде разгледана по-долу.
Колко електрона има в един атом?
Атомът се състои от ядро и електрони, въртящи се около него; ядрото се състои от протони и неутрони. В неутрално състояние всеки атом има брой електрони, равен на броя на протоните в ядрото му. Броят на протоните се обозначава с атомния номер на елемента, например сярата има 16 протона - 16-ият елемент от периодичната таблица. Златото има 79 протона - 79-ият елемент от периодичната система. Съответно сярата има 16 електрона в неутрално състояние, а златото има 79 електрона.
Къде да търся електрон?
Чрез наблюдение на поведението на електрона са изведени определени модели; те се описват с квантови числа, общо четири:
- Главно квантово число
- Орбитално квантово число
- Магнитно квантово число
- Спиново квантово число
Орбитален
Освен това, вместо думата орбита, ще използваме термина „орбитала“; орбитала е вълновата функция на електрона; грубо казано, това е областта, в която електронът прекарва 90% от времето си.
N - ниво
L - черупка
M l - орбитален номер
M s - първият или вторият електрон в орбиталата
Орбитално квантово число l
В резултат на изучаването на електронния облак те установиха, че в зависимост от енергийното ниво облакът приема четири основни форми: топка, дъмбели и две други, по-сложни. По ред на нарастване на енергията тези форми се наричат s-, p-, d- и f-обвивка. Всяка от тези черупки може да има 1 (на s), 3 (на p), 5 (на d) и 7 (на f) орбитали. Орбиталното квантово число е обвивката, в която се намират орбиталите. Орбиталното квантово число за s, p, d и f орбиталите приема стойности съответно 0, 1, 2 или 3.
На s-обвивката има една орбитала (L=0) - два електрона
На p-обвивката (L=1) има три орбитали - шест електрона
Има пет орбитали на d-обвивката (L=2) - десет електрона
На f-обвивката (L=3) има седем орбитали - четиринадесет електрона
Магнитно квантово число m l
Има три орбитали на p-черупката, те са обозначени с числа от -L до +L, тоест за p-черупката (L=1) има орбитали "-1", "0" и "1" . Магнитното квантово число се обозначава с буквата m l.
Вътре в обвивката е по-лесно електроните да бъдат разположени в различни орбитали, така че първите електрони запълват по един във всяка орбитала, а след това към всяка се добавя двойка електрони.
Помислете за d-обвивката:
D-обвивката съответства на стойността L=2, т.е. пет орбитали (-2,-1,0,1 и 2), първите пет електрона запълват обвивката, приемайки стойностите M l =-2, M l =-1, Ml =0, Ml =1, Ml =2.
Спиново квантово число m s
Спинът е посоката на въртене на електрона около неговата ос, има две посоки, така че квантовото число на спина има две стойности: +1/2 и -1/2. Едно енергийно подниво може да съдържа само два електрона с противоположни спинове. Спиновото квантово число се означава с m s
Главно квантово число n
Основното квантово число е енергийното ниво, в момента са известни седем енергийни нива, всеки е обозначен с арабска цифра: 1,2,3,...7. Броят на черупките на всяко ниво е равен на номера на нивото: има една черупка на първото ниво, две на второто и т.н.
Електронно число

И така, всеки електрон може да бъде описан с четири квантови числа, комбинацията от тези числа е уникална за всяка позиция на електрона, вземете първия електрон, най-ниското енергийно ниво е N = 1, на първото ниво има една обвивка, първата обвивка на всяко ниво има формата на топка (s -shell), т.е. L=0, магнитното квантово число може да приеме само една стойност, M l =0 и спинът ще бъде равен на +1/2. Ако вземем петия електрон (в какъвто и атом да е), то основните квантови числа за него ще бъдат: N=2, L=1, M=-1, спин 1/2.
Откога химична реакцияядрата на реагиращите атоми остават непроменени (с изключение на радиоактивни трансформации), тогава химичните свойства на атомите зависят от тяхната структура електронни обвивки. Теория електронна структура на атомаизградена на базата на апарата на квантовата механика. По този начин структурата на атомните енергийни нива може да бъде получена на базата на квантово-механични изчисления на вероятностите за намиране на електрони в пространството около атомното ядро ( ориз. 4.5).
Ориз. 4.5. Схема за разделяне на енергийните нива на поднива
Основите на теорията за електронната структура на атома се свеждат до следните разпоредби: състоянието на всеки електрон в атома се характеризира с четири квантови числа: основното квантово число n = 1, 2, 3,; орбитален (азимутален) l=0,1,2, n–1; магнитен м л = –l, –1,0,1, л; завъртане м с = -1/2, 1/2 .
Според принцип на Паули, в един и същи атом не може да има два електрона с еднакъв набор от четири квантови числа n, l, m л , м с; колекции от електрони с еднакви основни квантови числа n образуват електронни слоеве или енергийни нива на атома, номерирани от ядрото и означени като K, L, M, N, O, P, Q, и в енергийния слой с дадена стойност нможе да бъде не повече от 2n 2 електрони. Набори от електрони с еднакви квантови числа нИ л, образуват поднива, означени, докато се отдалечават от ядрото като s, p, d, f.
Вероятностното определяне на позицията на електрона в пространството около атомното ядро съответства на принципа на неопределеността на Хайзенберг. Според квантово-механичните концепции електронът в атома няма определена траектория на движение и може да се намира във всяка част от пространството около ядрото, а различните му позиции се разглеждат като електронен облак с определена отрицателна плътност на заряда. Пространството около ядрото, в което е най-вероятно да се намери електрон, се нарича орбитален. Той съдържа около 90% от електронния облак. Всяко подниво 1s, 2s, 2pи т.н. съответства на определен брой орбитали с определена форма. Например, 1s- И 2s-орбиталите са сферични и 2т-орбитали ( 2т х , 2стр г , 2стр z-орбитали) са ориентирани във взаимно перпендикулярни посоки и имат формата на дъмбел ( ориз. 4.6).

Ориз. 4.6. Форма и ориентация на електронните орбитали.
По време на химичните реакции атомното ядро не претърпява промени, променят се само електронните обвивки на атомите, чиято структура обяснява много от свойствата на химичните елементи. Въз основа на теорията за електронната структура на атома е установен дълбокият физически смисъл на периодичния закон на Менделеев за химичните елементи и е създадена теорията за химичната връзка.
Теоретичната обосновка на периодичната система от химични елементи включва данни за структурата на атома, потвърждаващи наличието на връзка между периодичността на промените в свойствата на химичните елементи и периодичното повторение на подобни видове електронни конфигурации на техните атоми.
В светлината на учението за структурата на атома, разделянето на Менделеев на всички елементи на седем периода става оправдано: номерът на периода съответства на броя на енергийните нива на атомите, пълни с електрони. В малки периоди, с увеличаване на положителния заряд на атомните ядра, броят на електроните на външното ниво се увеличава (от 1 на 2 през първия период и от 1 до 8 във втория и третия период), което обяснява промяна в свойствата на елементите: в началото на периода (с изключение на първия) има алкален метал, след това има постепенно отслабване метални свойстваи армиране на неметални. Този модел може да бъде проследен за елементи от втория период в таблица 4.2.
Таблица 4.2.

При големи периоди, с увеличаване на заряда на ядрата, запълването на нивата с електрони е по-трудно, което обяснява по-сложната промяна в свойствата на елементите в сравнение с елементите с малки периоди.
Идентичният характер на свойствата на химичните елементи в подгрупите се обяснява с подобната структура на външното енергийно ниво, както е показано в маса 4.3, илюстриращ последователността на запълване на енергийните нива с електрони за подгрупи алкални метали.
Таблица 4.3.

Номерът на групата обикновено показва броя на електроните в атома, които могат да участват в образуването на химични връзки. Това е физическото значение на номера на групата. На четири места периодичната таблицаЕлементите не са подредени в ред на увеличаване на атомните маси: АрИ К,CoИ Ni,TдИ аз,ThИ татко. Тези отклонения се считат за недостатъци на периодичната таблица на химичните елементи. Учението за структурата на атома обясни тези отклонения. Експерименталното определяне на ядрените заряди показа, че разположението на тези елементи съответства на увеличаване на зарядите на техните ядра. В допълнение, експерименталното определяне на зарядите на атомните ядра направи възможно определянето на броя на елементите между водорода и урана, както и броя на лантанидите. Сега всички места в периодичната система са попълнени в интервала от Z=1преди Z=114Въпреки това, периодичната система не е пълна, възможно е откриването на нови трансуранови елементи.
Електрони
Концепцията за атом произхожда от древния свят за обозначаване на частиците на материята. На гръцки атом означава „неделим“.

Ирландският физик Стоуни, въз основа на експерименти, стигна до извода, че електричеството се пренася от най-малките частици, съществуващи в атомите на всички химически елементи. През 1891 г. Стоуни предлага да наречем тези частици електрони, което на гръцки означава „кехлибар“. Няколко години след като електронът получи името си, английски физикДжоузеф Томсън и френският физик Жан Перин доказаха, че електроните носят отрицателен заряд. Това е най-малкият отрицателен заряд, който в химията се приема за единица (-1). Томсън дори успя да определи скоростта на електрона (скоростта на електрона в орбитата е обратно пропорционална на числото на орбитата n. Радиусите на орбитите нарастват пропорционално на квадрата на числото на орбитата. В първата орбита на водороден атом (n=1; Z=1) скоростта е ≈ 2,2·106 m/s, тоест около сто пъти по-малка от скоростта на светлината c = 3·108 m/s) и масата на електрона (тя е почти 2000 пъти по-малка от масата на водородния атом).

Състояние на електроните в атома
Състоянието на електрона в атома се разбира като набор от информация за енергията на определен електрон и пространството, в което се намира. Електронът в атома няма траектория на движение, т.е. можем само да говорим вероятността да го открием в пространството около ядрото.
 Той може да бъде разположен във всяка част от това пространство, заобикалящо ядрото, и съвкупността от различните му позиции се разглежда като електронен облак с определена отрицателна плътност на заряда. Образно това може да се представи по следния начин: ако беше възможно да се заснеме позицията на електрона в атома след стотни или милионни от секундата, както при фотофиниш, тогава електронът в такива снимки би бил представен като точки. Ако се наложат безброй такива снимки, картината ще бъде на електронен облак с най-голяма плътност, където ще има най-много от тези точки.
Той може да бъде разположен във всяка част от това пространство, заобикалящо ядрото, и съвкупността от различните му позиции се разглежда като електронен облак с определена отрицателна плътност на заряда. Образно това може да се представи по следния начин: ако беше възможно да се заснеме позицията на електрона в атома след стотни или милионни от секундата, както при фотофиниш, тогава електронът в такива снимки би бил представен като точки. Ако се наложат безброй такива снимки, картината ще бъде на електронен облак с най-голяма плътност, където ще има най-много от тези точки.
Пространството около атомното ядро, в което е най-вероятно да се намери електрон, се нарича орбитала. Съдържа приблизително 90% електронен облак, а това означава, че около 90% от времето електронът е в тази част от пространството. Те се отличават по форма 4 известни в момента типа орбитали, които се обозначават с лат букви s, p, d и f. Графично изображениеНякои форми на електронни орбитали са показани на фигурата.

Най-важната характеристика на движението на електрона по определена орбитала е енергия на връзката му с ядрото. Електроните с подобни енергийни стойности образуват единичен електронен слой или енергийно ниво. Енергийните нива са номерирани, като се започне от ядрото - 1, 2, 3, 4, 5, 6 и 7.
Цялото число n, което показва номера на енергийното ниво, се нарича главно квантово число. Той характеризира енергията на електроните, заемащи дадено енергийно ниво. Електроните от първото енергийно ниво, най-близо до ядрото, имат най-ниска енергия.В сравнение с електроните от първото ниво, електроните от следващите нива ще се характеризират с голям запас от енергия. Следователно, електроните на външното ниво са най-слабо свързани с атомното ядро.
Най-големият брой електрони на енергийно ниво се определя по формулата:
N = 2n 2,
където N е максималният брой електрони; n е номерът на нивото или основното квантово число. Следователно на първото енергийно ниво, най-близо до ядрото, не може да има повече от два електрона; на втория - не повече от 8; на третия - не повече от 18; на четвъртото - не повече от 32.
Започвайки от второто енергийно ниво (n = 2), всяко от нивата е разделено на поднива (подслоеве), малко по-различни един от друг в енергията на свързване с ядрото. Броят на поднивата е равен на стойността на основното квантово число: първото енергийно ниво има едно подниво; втората - две; трети - три; четвърто - четири поднива. Поднивата от своя страна са образувани от орбитали. Всяка стойностn съответства на броя орбитали, равен на n.
Поднивата обикновено се обозначават с латински букви, както и формата на орбиталите, от които се състоят: s, p, d, f.

Протони и неутрони

Атом на всеки химичен елемент е сравним с мъничък слънчева система. Следователно този модел на атома, предложен от Е. Ръдърфорд, се нарича планетарен.
Атомното ядро, в което е концентрирана цялата маса на атома, се състои от частици от два вида - протони и неутрони.
Протоните имат заряд, равен на заряда на електроните, но противоположен по знак (+1), и маса, равна на масата на водороден атом (в химията се приема за единица). Неутроните не носят заряд, те са неутрални и имат маса, равна на тази на протона.
Протоните и неутроните се наричат заедно нуклони (от лат. nucleus - ядро). Сумата от броя на протоните и неутроните в един атом се нарича масово число. Например масовото число на алуминиев атом:

13 + 14 = 27
брой протони 13, брой неутрони 14, масово число 27
Тъй като масата на електрона, която е пренебрежимо малка, може да бъде пренебрегната, очевидно е, че цялата маса на атома е концентрирана в ядрото. Електроните са означени с e - .
Тъй като атомът електрически неутрален, тогава също е очевидно, че броят на протоните и електроните в един атом е еднакъв. Той е равен на поредния номер на дадения му химичен елемент в периодичната система. Масата на атома се състои от масата на протоните и неутроните. Познавайки атомния номер на елемента (Z), т.е. броя на протоните и масовото число (A), равно на суматаброя на протоните и неутроните, можете да намерите броя на неутроните (N), като използвате формулата:

N = A - Z
Например броят на неутроните в един железен атом е:
56 — 26 = 30
Изотопи
Наричат се разновидности на атоми на един и същ елемент, които имат еднакъв ядрен заряд, но различни масови числа изотопи. Химическите елементи, открити в природата, са смес от изотопи. Така въглеродът има три изотопа с маси 12, 13, 14; кислород - три изотопа с маси 16, 17, 18 и т.н. Относителната атомна маса на химичен елемент, обикновено дадена в периодичната таблица, е средната стойност на атомните маси на естествена смес от изотопи на даден елемент, като се вземат предвид относителното им изобилие в природата. Химични свойстваИзотопите на повечето химични елементи са напълно еднакви. Водородните изотопи обаче се различават значително по свойства поради рязкото многократно увеличение на относителните им атомна маса; дори им се дават индивидуални имена и химически символи.

Елементи от първия период
Диаграма на електронната структура на водородния атом:

Диаграмите на електронната структура на атомите показват разпределението на електроните в електронните слоеве (енергийни нива).

Графична електронна формула на водородния атом (показва разпределението на електроните по енергийни нива и поднива):

Графичните електронни формули на атомите показват разпределението на електроните не само между нива и поднива, но и между орбитали.
В атома на хелия първият електронен слой е завършен - има 2 електрона. Водородът и хелият са s-елементи; S-орбиталата на тези атоми е изпълнена с електрони.

За всички елементи от втория период първият електронен слой е запълнен, а електроните запълват s- и p-орбиталите на втория електронен слой в съответствие с принципа на най-малката енергия (първо s и след това p) и правилата на Паули и Хунд.
В атома на неона вторият електронен слой е завършен - има 8 електрона.
За атомите на елементи от третия период първият и вторият електронен слой са завършени, така че третият електронен слой е запълнен, в който електроните могат да заемат 3s-, 3p- и 3d-поднива.
Магнезиевият атом завършва своята 3s електронна орбитала. Na и Mg са s-елементи.
В алуминия и следващите елементи поднивото 3p е запълнено с електрони.
Елементите от третия период имат незапълнени 3d орбитали.
Всички елементи от Al до Ar са p-елементи. S- и p-елементите формират основните подгрупи в периодичната система.

Елементи от четвърти - седми периоди
В калиеви и калциеви атоми се появява четвърти електронен слой и поднивото 4s се запълва, тъй като има по-ниска енергия от поднивото 3d.
K, Ca - s-елементи, включени в основните подгрупи. За атоми от Sc до Zn, 3d поднивото е запълнено с електрони. Това са 3d елементи. Те са включени във вторични подгрупи, най-външният им електронен слой е запълнен и се класифицират като преходни елементи.
Обърнете внимание на структурата на електронните обвивки на хром и медни атоми. При тях един електрон „се проваля“ от 4s до 3d подниво, което се обяснява с по-голямата енергийна стабилност на получените електронни конфигурации 3d 5 и 3d 10:

В атома на цинка третият електронен слой е завършен – в него са запълнени всички поднива 3s, 3p и 3d, с общо 18 електрона. В елементите след цинка, четвъртият електронен слой, поднивото 4p, продължава да бъде запълнен.
Елементите от Ga до Kr са p-елементи.
Атомът на криптон има външен слой (четвърти), който е пълен и има 8 електрона. Но може да има общо 32 електрона в четвъртия електронен слой; атомът криптон все още има незапълнени поднива 4d и 4f.За елементите от петия период поднивата се запълват в следния ред: 5s - 4d - 5p. Има и изключения, свързани с „ провал» електрони, y 41 Nb, 42 Mo, 44 Ru, 45 Rh, 46 Pd, 47 Ag.
В шестия и седмия период се появяват f-елементи, т.е. елементи, в които се запълват съответно 4f- и 5f-поднива на третия външен електронен слой.
4f елементите се наричат лантаниди.
5f елементите се наричат актиниди.
Редът на запълване на електронни поднива в атомите на елементите от шестия период: 55 Cs и 56 Ba - 6s елементи; 57 La … 6s 2 5d x - 5d елемент; 58 Ce - 71 Lu - 4f елементи; 72 Hf - 80 Hg - 5d елементи; 81 T1 - 86 Rn - 6d елементи. Но и тук има елементи, при които редът на запълване на електронните орбитали е „нарушен“, което например се свързва с по-голямата енергийна стабилност на полу- и напълно запълнените f-поднива, т.е. nf 7 и nf 14. В зависимост от това кое подниво на атома е последно запълнено с електрони, всички елементи се разделят на четири електронни семейства или блокове:
- s-елементи. S-поднивото на външното ниво на атома е запълнено с електрони; s-елементите включват водород, хелий и елементи от основните подгрупи на групи I и II.
- р-елементи. p-поднивото на външното ниво на атома е запълнено с електрони; p-елементите включват елементи от основните подгрупи на групи III-VIII.
- d-елементи. D-поднивото на пред-външното ниво на атома е запълнено с електрони; d-елементите включват елементи от вторични подгрупи от групи I-VIII, т.е. елементи от последователни десетилетия с големи периоди, разположени между s- и p-елементи. Те се наричат още преходни елементи.
- f-елементи. f-поднивото на третото външно ниво на атома е запълнено с електрони; те включват лантаниди и антиноиди.

Швейцарският физик В. Паули през 1925 г. установява, че в един атом в една орбитала не може да има повече от два електрона с противоположни (антипаралелни) спинове (преведено от английски като "вретено"), т.е. притежаващи такива свойства, които условно могат да се представят като въртене на електрон около неговата въображаема ос: по посока на часовниковата стрелка или обратно на часовниковата стрелка.

Този принцип се нарича принцип на Паули. Ако има един електрон в орбиталата, тогава той се нарича несдвоен; ако има два, тогава това са сдвоени електрони, т.е. електрони с противоположни спинове. Фигурата показва диаграма на разделянето на енергийните нива на поднива и реда на тяхното запълване.


Много често структурата на електронните обвивки на атомите се изобразява с помощта на енергийни или квантови клетки - записват се така наречените графични електронни формули. За тази нотация се използва следната нотация: всяка квантова клетка е обозначена с клетка, която съответства на една орбитала; Всеки електрон е обозначен със стрелка, съответстваща на посоката на въртене. Когато пишете графична електронна формула, трябва да запомните две правила: Принцип на Паули и правило на Ф. Хунд, според който електроните заемат свободните клетки първо един по един и едновременно имат същата стойностназад и едва след това чифт, но гърбовете, според принципа на Паули, вече ще бъдат в противоположни посоки.
Правилото на Хунд и принципът на Паули
Правилото на Хунд- правило на квантовата химия, което определя реда на запълване на орбиталите на определен подслой и се формулира по следния начин: общата стойност на спиновото квантово число на електроните на даден подслой трябва да бъде максимална. Формулиран от Фридрих Хунд през 1925 г.
Това означава, че във всяка от орбиталите на подслоя първо се запълва по един електрон и едва след изчерпване на незапълнените орбитали към тази орбитала се добавя втори електрон. В този случай в една орбитала има два електрона с полуцели спинове с противоположен знак, които се сдвояват (образуват двуелектронен облак) и в резултат на това общият спин на орбиталата става равен на нула.
Друга формулировка: С по-ниска енергия се намира атомният член, за който са изпълнени две условия.
- Множеството е максимално
- Когато кратностите съвпадат, общият орбитален момент L е максимален.
Нека анализираме това правило, като използваме примера за запълване на орбитали на p-подниво стр-елементи от втория период (т.е. от бор до неон (в диаграмата по-долу хоризонталните линии показват орбитали, вертикалните стрелки показват електрони, а посоката на стрелката показва ориентацията на спина).
Правилото на Клечковски
Правилото на Клечковски -тъй като общият брой на електроните в атомите се увеличава (с увеличаване на зарядите на техните ядра или поредните номера на химичните елементи), атомните орбитали се заселват по такъв начин, че появата на електрони в орбитала с по-висока енергия зависи само от главното квантово число n и не зависи от всички други квантови числа числа, включително от l. Физически това означава, че във водородоподобен атом (при липса на междуелектронно отблъскване) орбиталната енергия на електрона се определя само от пространственото разстояние на плътността на електронния заряд от ядрото и не зависи от характеристиките на неговото движение в полето на ядрото.
Емпиричното правило на Клечковски и схемата за подреждане, която следва от него, донякъде противоречат на реалната енергийна последователност на атомните орбитали само в два подобни случая: за атоми Cr, Cu, Nb, Mo, Ru, Rh, Pd, Ag, Pt, Au , има „отказ” на електрон с s -подниво на външния слой се заменя с d-подниво на предходния слой, което води до енергийно по-стабилно състояние на атома, а именно: след запълване на орбитала 6 с две електрони с