Nad slobodnom površinom tekućine uvijek postoje pare te tekućine. Ako posuda s tekućinom nije zatvorena, tada koncentracija čestica pare pri konstantnoj temperaturi može varirati u širokim granicama, gore i dolje.
Proces isparavanja u zatvorenom prostoru(zatvorena posuda s tekućinom) može se pojaviti na određenoj temperaturi samo do određene granice. To se objašnjava činjenicom da se kondenzacija pare događa istovremeno s isparavanjem tekućine. Prvo, broj molekula koje izlete iz tekućine u 1 s veći je od broja molekula koje se vrate natrag, pa se povećava gustoća, a time i tlak pare. To dovodi do povećanja stope kondenzacije. Nakon nekog vremena dolazi do dinamičke ravnoteže u kojoj gustoća pare iznad tekućine postaje konstantna. Para koja je u stanju dinamičke ravnoteže sa svojom tekućinom naziva se zasićena para. Para koja nije u stanju dinamičke ravnoteže sa svojom tekućinom naziva se nezasićen.
Iskustvo pokazuje da se nezasićene pare pokoravaju svim plinskim zakonima, i to točnije što su dalje od zasićenja.Zasićene pare karakteriziraju sljedeća svojstva:
Književnost
Aksenovich L. A. Fizika u Srednja škola: Teorija. Zadaci. Testovi: Udžbenik. dodatak za ustanove općeg obrazovanja. okoliš, obrazovanje / L. A. Aksenovich, N. N. Rakina, K. S. Farino; ur. K. S. Farino. - Mn.: Adukatsiya i vyakhavanne, 2004. - P. 198-199.
Tekućine imaju tendenciju isparavanja. Kad bismo kap vode, etera i žive ispustili na stol (samo to nemojte raditi kod kuće!), mogli bismo promatrati kako kapljice postupno nestaju - isparavaju. Neke tekućine isparavaju brže, druge sporije. Proces isparavanja tekućine naziva se i vaporizacija. A obrnuti proces od pretvaranja pare u tekućinu je kondenzacija.
Ova dva procesa ilustriraju fazni prijelaz– proces prijelaza tvari iz jednog agregatnog stanja u drugo:
- isparavanje (prijelaz iz tekućeg u plinovito stanje);
- kondenzacija (prijelaz iz plinovitog stanja u tekućinu);
- desublimacija (prijelaz iz plinovitog stanja u čvrsto stanje, zaobilazeći tekuću fazu);
- sublimacija, poznata i kao sublimacija (prijelaz iz krutog u plinovito stanje, zaobilazeći tekućinu).
Sada je, usput, pravo vrijeme za promatranje procesa desublimacije u prirodi: mraz i inje na drveću i predmetima, mrazne šare na prozorima - njegov rezultat.
Kako nastaje zasićena i nezasićena para
No, vratimo se vaporizaciji. Nastavit ćemo eksperimentirati i u otvorenu posudu uliti tekućinu - vodu, na primjer, te na nju spojiti manometar. Nevidljivo oku, isparavanje se događa u posudi. Sve molekule tekućine su u neprekidnom kretanju. Neki se kreću toliko brzo da je njihova kinetička energija jača od one koja povezuje molekule tekućine.
Napustivši tekućinu, te se molekule nastavljaju kaotično kretati u prostoru, velika većina ih je raspršena u njemu - ovako nezasićena para. Samo mali dio njih vraća se natrag u tekućinu.
Ako zatvorimo posudu, broj molekula pare će se postupno povećavati. I sve više njih će se vraćati u tekućinu. To će povećati pritisak pare. To će zabilježiti manometar spojen na posudu.
Nakon nekog vremena, broj molekula koje lete iz tekućine i vraćaju se u nju bit će jednak. Tlak pare će se prestati mijenjati. Kao rezultat zasićenje parom uspostavit će se termodinamička ravnoteža sustava tekućina-para. To znači da će isparavanje i kondenzacija biti jednaki.
Svojstva zasićene pare
Kako bismo ih jasno ilustrirali, koristimo se još jednim eksperimentom. Upotrijebite svu snagu svoje mašte da to zamislite. Dakle, uzmimo živin manometar, koji se sastoji od dva koljena - komunikacijske cijevi. Obje su ispunjene živom, jedan kraj je otvoren, drugi zapečaćen, a iznad žive još uvijek postoji određena količina etera i njegove zasićene pare. Ako spustite i podignete nezapečaćeno koljeno, razina žive u zapečaćenom će također padati i rasti.
U tom će se slučaju promijeniti i količina (volumen) zasićene pare etera. Razlika u razinama živinih stupaca na obje strane manometra pokazuje tlak zasićene pare etera. Ostat će nepromijenjen cijelo vrijeme.
To implicira svojstvo zasićene pare - njen tlak ne ovisi o volumenu koji zauzima. Tlak zasićene pare različitih tekućina (na primjer vode i etera) različit je pri istoj temperaturi.
Međutim, bitna je temperatura zasićene pare. Što je viša temperatura, to je veći i tlak. Tlak zasićene pare raste s porastom temperature brže nego kod nezasićene pare. Temperatura i tlak nezasićene pare linearno su povezani.
Može se napraviti još jedan zanimljiv eksperiment. Uzmite praznu tikvicu bez tekućinske pare, zatvorite je i spojite manometar. Postupno, kap po kap, dodavati tekućinu u tikvicu. Kako tekućina ulazi i isparava, uspostavlja se tlak zasićene pare, najviši za danu tekućinu pri danoj temperaturi.
Više o temperaturi i zasićenoj pari
Temperatura pare također utječe na brzinu kondenzacije. Baš kao što temperatura tekućine određuje brzinu isparavanja - drugim riječima, broj molekula koje izlete s površine tekućine u jedinici vremena.
Za zasićenu paru njezina je temperatura jednaka temperaturi tekućine. Što je viša temperatura zasićene pare, što je veći njezin tlak i gustoća, to je manja gustoća tekućine. Kada se postigne kritična temperatura za tvar, gustoća tekućine i pare je ista. Ako je temperatura pare viša od kritične temperature za tvar, fizičke razlike između tekućine i zasićene pare se brišu.
Određivanje tlaka zasićene pare u smjesi s drugim plinovima
Govorili smo o tome da je tlak zasićene pare konstantan pri konstantnoj temperaturi. Tlak smo odredili u “idealnim” uvjetima: kada se u posudi ili tikvici nalazi tekućina i para samo jedne tvari. Razmotrimo i pokus u kojem su molekule tvari raspršene u prostoru u smjesi s drugim plinovima.
Da biste to učinili, uzmite dva otvorena staklena cilindra i u oba stavite zatvorene posude s eterom. Kao i obično, spojimo mjerače tlaka. Otvorimo jednu posudu s eterom, nakon čega manometar bilježi porast tlaka. Razlika između ovog tlaka i tlaka u cilindru sa zatvorenom posudom etera omogućuje nam da saznamo tlak zasićene pare etera.
O pritisku i vrenju
Isparavanje je moguće ne samo s površine tekućine, već i u njezinom volumenu - tada se naziva vrenje. Kako se temperatura tekućine povećava, stvaraju se mjehurići pare. Kada je tlak zasićene pare veći ili jednak tlaku plina u mjehurićima, tekućina isparava u mjehuriće. I šire se i dižu na površinu.
Tekućine vriju na različitim temperaturama. U normalnim uvjetima voda vrije na 100 0 C. Ali s promjenom atmosferskog tlaka mijenja se i vrelište. Dakle, u planinama, gdje je zrak vrlo razrijeđen i atmosferski tlak niži, kako se penjete u planine, vrelište vode opada.
Usput, kuhanje u hermetički zatvorenoj posudi uopće je nemoguće.

Drugi primjer odnosa između tlaka pare i isparavanja pokazuje takva karakteristika sadržaja vodene pare u zraku kao što je relativna vlažnost zraka. Predstavlja stav parcijalni tlak vodene pare do tlaka zasićene pare i određuje se formulom: φ = r/r o * 100%.
Snižavanjem temperature zraka povećava se koncentracija vodene pare u njemu, tj. postaju zasićeniji. Ta se temperatura naziva točka rosišta.
Sažmimo to
Na jednostavnim primjerima analizirali smo bit procesa isparavanja i nastalu nezasićenu i zasićenu paru. Sve te pojave možete promatrati oko sebe svaki dan: na primjer, vidjeti lokve koje se suše na ulicama nakon kiše ili ogledalo zamagljeno od pare u kupaonici. U kupaonici čak možete promatrati kako se prvo stvara para, a zatim se vlaga nakupljena na ogledalu kondenzira natrag u vodu.
Ovo znanje također možete iskoristiti da svoj život učinite ugodnijim. Na primjer, zimi je zrak u mnogim stanovima vrlo suh, a to loše utječe na dobrobit. Možete koristiti moderan uređaj za ovlaživanje zraka kako biste povećali vlažnost. Ili, na starinski način, stavite posudu s vodom u sobu: postupno isparavajući, voda će zasititi zrak svojim parama.
web stranice, pri kopiranju materijala u cijelosti ili djelomično, poveznica na izvor je obavezna.
Kao što znate, tekućine isparavaju, odnosno pretvaraju se u paru. Na primjer, lokve se suše nakon kiše. Isparavanje tekućine nastaje zbog činjenice da neke od njezinih molekula, zahvaljujući udarima svojih "susjeda", stječu kinetičku energiju dovoljnu da pobjegnu iz tekućine.
Kao rezultat isparavanja iznad površine tekućine uvijek postoji para.To je plinovito stanje tvari. Vodena para je nevidljiva, baš kao i zrak. Ono što se često naziva para skup je sitnih kapljica vode nastalih kondenzacijom pare.
Kondenzacija je pretvorba pare u tekućinu, odnosno proces suprotan isparavanju. Uslijed kondenzacije vodene pare sadržane u zraku nastaju oblaci (sl. 44.1) i magla (sl. 44.2). Hladno se staklo magli u dodiru s toplim zrakom (slika 44.3). To je također rezultat kondenzacije vodene pare.
Dinamička ravnoteža
Ako je staklenka s vodom dobro zatvorena, razina vode u njoj ostaje nepromijenjena mnogo mjeseci.
Znači li to da u zatvorenoj posudi tekućina ne isparava?
Ne, naravno: uvijek sadrži prilično brze molekule koje neprestano lete iz tekućine. Međutim, kondenzacija se događa istovremeno s isparavanjem: molekule iz pare lete natrag u tekućinu.
Ako se razina tekućine ne mijenja tijekom vremena, to znači da se procesi isparavanja i kondenzacije odvijaju istim intenzitetom. U tom slučaju se kaže da su tekućina i para u dinamičkoj ravnoteži.
2. Zasićena i nezasićena para
Zasićena para
Slika 44.4 shematski prikazuje procese isparavanja i kondenzacije u dobro zatvorenoj posudi kada su tekućina i para u dinamičkoj ravnoteži. 
Para koja je u dinamičkoj ravnoteži sa svojom tekućinom naziva se zasićena.
Nezasićena para
Ako se posuda s tekućinom otvori, para će početi izlaziti iz posude prema van. Zbog toga će se koncentracija pare u posudi smanjiti, a molekule pare manje će se sudarati s površinom tekućine i uletjeti u nju. Stoga će se intenzitet kondenzacije smanjiti.
Ali intenzitet isparavanja ostaje isti. Stoga će se razina tekućine u posudi početi smanjivati. Ako je proces isparavanja brži od procesa kondenzacije, kaže se da se iznad tekućine nalazi nezasićena para (sl. 44.5). 
U zraku uvijek ima vodene pare, ali je ona obično nezasićena, pa isparavanje prevladava nad kondenzacijom. Zato se lokve suše.
Nad površinom mora i oceana para je također nezasićena, pa postupno isparavaju. Zašto se razina vode ne spušta?
Činjenica je da se para koja se diže hladi i kondenzira, stvarajući oblake i oblake. Pretvore se u kišne oblake i kiše. A rijeke nose vodu natrag u mora i oceane.
3. Ovisnost tlaka zasićene pare o temperaturi
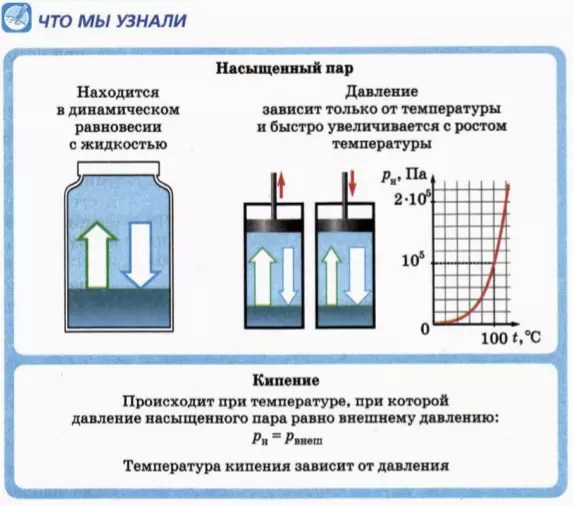
Glavno svojstvo zasićene pare je da
Tlak zasićene pare ne ovisi o volumenu, već ovisi samo o temperaturi.
Ovo svojstvo zasićene pare nije tako lako razumjeti jer se čini da proturječi jednadžbi stanja idealnog plina
pV = (m/M)RT, (1)
iz čega slijedi da je za donju masu plina pri konstantnoj temperaturi tlak obrnuto proporcionalan volumenu. Možda ova jednadžba nije primjenjiva za zasićenu paru?
Odgovor je: jednadžba stanja idealnog plina dobro opisuje paru, i zasićenu i nezasićenu. Ali masa zasićene pare m na desnoj strani jednadžbe (1) mijenja se tijekom izotermnog širenja ili kompresije - i to na takav način da tlak zasićene pare ostaje nepromijenjen. Zašto se ovo događa?
Činjenica je da kada se volumen posude promijeni, para može ostati zasićena samo ako je "njezina" tekućina u istoj posudi. Izotermno povećavajući volumen posude, čini se da "izvlačimo" molekule iz tekućine, koje postaju molekule pare (slika 44.6, a). 
Zato se ovo događa. Kako se volumen pare povećava, njezina koncentracija u početku opada - ali za vrlo kratko vrijeme. Čim para postane nezasićena, isparavanje tekućine u istoj posudi počinje "prestići" kondenzaciju. Kao rezultat toga, masa pare se brzo povećava dok ponovno ne postane zasićena. Tlak pare će se tada vratiti na istu razinu.
1. Koristeći sliku 44.6, b, objasnite zašto se sa smanjenjem volumena zasićene pare smanjuje njezina masa.
Dakle, kada se zasićena para širi ili skuplja, njezina se masa mijenja zbog promjene mase tekućine koja se nalazi u istoj posudi.
Eksperimentalno je izmjerena ovisnost tlaka zasićene vodene pare o temperaturi. Grafikon ovog odnosa prikazan je na slici 44.7. Vidimo da tlak zasićene pare raste vrlo brzo s povećanjem temperature. 
Glavni razlog povećanja tlaka zasićene pare s porastom temperature je porast mase pare. Kao što ćete se i sami uvjeriti rješavanjem sljedećeg zadatka, kada temperatura poraste od 0 ºS do 100 ºS, masa zasićene pare u istom volumenu povećava se više od 100 puta!
U tablici su prikazane vrijednosti tlaka zasićene vodene pare pri određenim temperaturama.
Ova tablica pomoći će vam u sljedećem zadatku. Također upotrijebite formulu (1).
2. U hermetički zatvorenoj posudi obujma 10 litara nalazi se voda i zasićena para. Temperatura sadržaja posude se povećava od 0 ºS do 100 ºS. Smatrajte da se volumen vode u usporedbi s volumenom pare može zanemariti.
a) Koliko se puta povećala apsolutna temperatura?
b) Koliko bi se puta povećao tlak pare da je ostala zasićena?
c) Koliko bi se puta povećala masa pare da je ostala zasićena?
d) Kolika bi bila konačna masa pare da je ostala zasićena?
e) Pri kojoj će najmanjoj masi vode u početnom stanju para ostati zasićena?
f) Koliki će biti tlak pare u konačnom stanju ako je početna masa vode 2 puta manja od one iz prethodnog odlomka?
3. Što se brže povećava s porastom temperature - tlak zasićene pare ili njezina gustoća?
Trag. Formula (1) može se napisati kao
4. Prazna hermetički zatvorena posuda obujma 20 litara napunjena je zasićenom vodenom parom temperature 100 ºC.
a) Koliki je tlak pare?
b) Kolika je masa pare?
c) Kolika je koncentracija pare?
d) Koliki će biti tlak pare kad se ohladi na 20 ºC?
e) Kolike su mase pare i vode pri 20 ºS?
Trag. Koristite gornju tablicu i formulu (1).
4. Vrenje
Na temelju gornjeg grafikona (Sl. 44 7) i tablice vjerojatno ste primijetili da je na vrelištu vode (100 ºS) tlak zasićene vodene pare točno jednak atmosferskom tlaku (točkasta linija u grafikonu 44.7). Je li ovo slučajnost?
Ne, ne slučajno. Razmotrimo proces vrenja.
Stavimo iskustvo
Vodu ćemo grijati u otvorenoj prozirnoj posudi. Uskoro će se na stijenkama posude pojaviti mjehurići. Time se oslobađa zrak otopljen u vodi.
Voda počinje isparavati unutar tih mjehurića, a mjehurići se pune zasićenom parom. Ali ti mjehurići ne mogu rasti sve dok je tlak zasićene pare manji od tlaka u tekućini. U otvorenoj plitkoj posudi tlak u tekućini gotovo je jednak atmosferskom tlaku.
Nastavimo zagrijavati vodu. Tlak zasićene pare u mjehurićima brzo raste s porastom temperature. A čim postane jednak atmosferskom tlaku, započet će intenzivno isparavanje tekućine u mjehuriće.
Brzo će narasti, podići se i rasprsnuti se na površini tekućine (Sl. 44.8). Ovo je ključanje. 
U plitkoj posudi tlak u tekućini gotovo je jednak vanjskom tlaku. Stoga možemo reći da
vrenje tekućine događa se na temperaturi pri kojoj je tlak p n zasićene pare jednak vanjskom tlaku p vanjski:
p n = p ekst. (2)
Iz toga slijedi da vrelište ovisi o tlaku. Stoga se može promijeniti promjenom tlaka tekućine. Kako se tlak povećava, vrelište tekućine raste. To se koristi, na primjer, za sterilizaciju medicinskih instrumenata: voda se kuha u posebnim uređajima - autoklavima, gdje je tlak 1,5-2 puta veći od normalnog atmosferskog tlaka.
Visoko u planinama, gdje je atmosferski tlak znatno niži od normalnog atmosferskog tlaka, nije lako kuhati meso: na primjer, na nadmorskoj visini od 5 km voda već ključa na temperaturi od 83 ºS.
5. Pomoću formule (2) i gornje tablice odredite vrelište vode:
a) pri tlaku jednakom jednoj petini normalnog atmosferskog tlaka;
b) pri tlaku 2 puta većem od atmosferskog tlaka.
Vrenje vode pri smanjenom tlaku može se promatrati u sljedećem pokusu.
Stavimo iskustvo
Zakuhajte vodu u tikvici i dobro zatvorite tikvicu. Kad se voda malo ohladi, tikvicu prevrnuti i zaliti dno hladna voda. Voda će proključati, iako je njena temperatura znatno niža od 100 ºS (Sl. 44.9). 
6. Objasnite ovo iskustvo.
7. Do koje visine bi se kipuća voda mogla podići klipom ako se ne bi ohladila?
Dodatna pitanja i zadaci
8. U cilindričnoj posudi ispod klipa dugo se nalazi voda i vodena para. Masa vode je 2 puta veća od mase pare. Polako pomičući klip, volumen ispod klipa se povećava sa 1 litre na 6 litara. Temperatura sadržaja posude cijelo vrijeme ostaje jednaka 20 ºS. Smatrajte da je volumen vode zanemariv u usporedbi s volumenom pare.
a) Kakva je para ispod klipa na početku?
b) Objasnite zašto se tlak u posudi neće promijeniti sve dok obujam ispod klipa ne postane jednak 3 litre.
c) Koliki je tlak u posudi kad je obujam ispod klipa 3 litre?
d) Kolika je masa pare u posudi kad je obujam ispod klipa 3 litre?
Trag. U tom slučaju, cijeli volumen posude ispunjen je zasićenom parom.
e) Koliko se puta povećala masa pare kad se volumen ispod klipa povećao s 1 litre na 3 litre?
f) Kolika je masa vode u početnom stanju?
Trag. Iskoristite činjenicu da je u početnom stanju masa vode 2 puta veća od mase pare.
g) Kako će se promijeniti tlak u posudi kad se volumen ispod klipa promijeni s 3 l na 6 l?
Trag. Za nezasićenu paru vrijedi jednadžba stanja idealnog plina konstantne mase.
h) Koliki je tlak u posudi kad je obujam ispod klipa 6 litara?
i) Nacrtajte približni graf ovisnosti tlaka pare ispod klipa o volumenu.
9. Dvije zatvorene U-cijevi bile su nagnute kao što je prikazano na slici 44.10. U kojoj je cijevi iznad vode samo zasićena para, a u kojoj zrak s parom? Obrazložite svoj odgovor. 
Procesi isparavanja i kondenzacije odvijaju se kontinuirano i paralelno jedan s drugim.
U otvorenoj posudi s vremenom se smanjuje količina tekućine jer isparavanje prevladava nad kondenzacijom.
Para koja postoji iznad površine tekućine kada isparavanje prevladava nad kondenzacijom ili para u odsutnosti tekućine naziva se nezasićen.
U hermetički zatvorenoj posudi razina tekućine se ne mijenja tijekom vremena, jer isparavanje i kondenzacija međusobno se kompenziraju: koliko molekula izleti iz tekućine, toliko ih se istodobno u nju vrati, te između pare i njezine tekućine nastaje dinamička (mobilna) ravnoteža.
Para koja je u dinamičkoj ravnoteži sa svojom tekućinom naziva se zasićena.
Na danoj temperaturi, zasićena para bilo koje tekućine ima najveću gustoću ( ) i stvara maksimalan pritisak ( ) koju para te tekućine može imati na ovoj temperaturi.
Tlak i gustoća zasićene pare pri istoj temperaturi ovisi o vrsti tvari: veći tlak stvara zasićenu paru tekućine koja brže isparava. Na primjer, i
Svojstva nezasićenih para: Nezasićene pare podliježu plinskim zakonima Boylea - Mariottea, Gay-Lussaca, Charlesa i na njih se može primijeniti jednadžba stanja idealnog plina.
Svojstva zasićenih para:1. Pri konstantnom volumenu, s porastom temperature, tlak zasićene pare raste, ali ne izravno proporcionalno (Charlesov zakon nije zadovoljen), tlak raste brže od tlaka idealnog plina. , s povećanjem temperature ( ) , masa pare se povećava, a time i koncentracija molekula pare raste () i tlak zasićene pare će se rastopiti iz dva razloga (
3 1 – nezasićena para (idealni plin);
2 2 - zasićena para; 3 – nezasićena para,
1 dobivenog iz zasićene pare u istoj
Volumen kada se zagrije.
2. Tlak zasićene pare pri konstantnoj temperaturi ne ovisi o volumenu koji zauzima.
Povećanjem volumena povećava se masa pare, a smanjuje masa tekućine (dio tekućine prelazi u paru); kada se volumen smanjuje, para se smanjuje, a tekućina se povećava (dio se pretvara u paru). tekućina), dok gustoća i koncentracija molekula zasićene pare ostaju konstantni, dakle, tlak ostaje konstantan ().
tekućina
(sjedio. para + tekućina)
Nezasićen pare
Zasićene pare se ne pokoravaju plinskim zakonima Boylea - Mariottea, Gay-Lussaca, Charlesa, jer masa pare u procesima ne ostaje konstantna, već sve plinski zakoni dobivena za konstantnu masu. Jednadžba stanja idealnog plina može se primijeniti na zasićenu paru.
Tako, zasićena para se može pretvoriti u nezasićenu paru zagrijavanjem pri konstantnom volumenu ili povećanjem volumena pri konstantnoj temperaturi. Nezasićena para se može pretvoriti u zasićenu paru bilo hlađenjem na konstantan volumen ili komprimiranjem na konstantnoj temperaturi.
Kritično stanje
Prisutnost slobodne površine tekućine omogućuje označavanje gdje se nalazi tekuća faza tvari, a gdje je plinovita faza. Oštra razlika između tekućine i njezine pare objašnjava se činjenicom da je gustoća tekućine mnogo puta veća od gustoće pare. Ako zagrijavate tekućinu u hermetički zatvorenoj posudi, tada će se zbog ekspanzije njezina gustoća smanjiti, a gustoća pare iznad nje će se povećati. To znači da se razlika između tekućine i njezine zasićene pare izglađuje i pri dovoljno visokoj temperaturi potpuno nestaje. Temperatura na kojoj se razlikuju u fizička svojstva između tekućine i njezine zasićene pare, a njihove gustoće postaju jednake, naziva sekritična temperatura.
Kritična točka
Da bi tekućina nastala iz plina, prosječna potencijalna energija privlačenja molekula mora biti veća od njihove prosječne kinetičke energije.
Kritična temperatura – maksimalna temperatura pri kojoj para prelazi u tekućinu. Kritična temperatura ovisi o potencijalnoj energiji međudjelovanja između molekula i stoga je različita za različite plinove. Zbog snažne interakcije molekula vode, vodena para se može pretvoriti u vodu čak i na temperaturama od . Istodobno, ukapljivanje dušika događa se samo na temperaturi nižoj od = -147˚, jer molekule dušika međusobno slabo djeluju.
Još jedan makroskopski parametar koji utječe na prijelaz para-tekućina je tlak. S povećanjem vanjskog tlaka tijekom kompresije plina, prosječna udaljenost između čestica se smanjuje, sila privlačenja među njima raste i, sukladno tome, povećava se prosječna potencijalna energija njihove interakcije.
Pritisaknaziva se zasićena para na kritičnoj temperaturi kritično. To je najveći mogući tlak zasićene pare određene tvari.
Agregatno stanje s kritičnim parametrima naziva se kritično(kritična točka) . Svaka tvar ima svoju kritičnu temperaturu i tlak.
U kritičnom stanju specifična toplina isparavanja i koeficijent površinska napetost tekućine. Pri temperaturama iznad kritičnih, čak i pri vrlo visokim tlakovima, nemoguća je transformacija plina u tekućinu, tj. Tekućina ne može postojati iznad kritične temperature. Na superkritičnim temperaturama moguće je samo parno stanje tvari.
Ukapljivanje plinova moguće je samo na temperaturama ispod kritične temperature. Da bi se ukapili, plinovi se hlade na kritičnu temperaturu, kao što je adijabatsko širenje, a zatim se izotermno komprimiraju.
Ključanje
Izvana fenomen izgleda ovako: Brzo rastući mjehurići dižu se iz cijelog volumena tekućine na površinu, pucaju na površini, a para se oslobađa u okolinu.
MKT objašnjava vrenje na sljedeći način: U tekućini uvijek postoje mjehurići zraka, u njima dolazi do isparavanja. Ispostavilo se da je zatvoreni volumen mjehurića ispunjen ne samo zrakom, već i zasićenom parom. Kad se tekućina zagrijava, tlak zasićene pare u njima raste brže od tlaka zraka. Kada u dovoljno zagrijanoj tekućini tlak zasićene pare u mjehurićima postane veći od vanjskog tlaka, oni se povećavaju u volumenu, a uzgonska sila koja premašuje njihovu gravitaciju podiže mjehuriće na površinu. Plutajući mjehurići počinju pucati kada na određenoj temperaturi tlak zasićene pare u njima premaši tlak iznad tekućine. Temperatura tekućine pri kojoj je tlak njezine zasićene pare u mjehurićima jednak ili veći od vanjskog tlaka na tekućinu naziva se vrelište.
Vrelište različitih tekućina je različito, jer tlak zasićene pare u njihovim mjehurićima uspoređuje se s istim vanjskim tlakom pri različitim temperaturama. Na primjer, tlak zasićene pare u mjehurićima jednak je normalnom atmosferskom tlaku za vodu na 100˚C, za živu na 357˚C, za alkohol na 78˚C, za eter na 35˚C.
Vrelište ostaje konstantno tijekom procesa vrenja, jer sva toplina koja se dovodi zagrijanoj tekućini troši se na isparavanje.
Vrelište ovisi o vanjskom tlaku na tekućinu: s povećanjem tlaka temperatura raste; Kako se tlak smanjuje, temperatura se smanjuje. Na primjer, na nadmorskoj visini od 5 km, gdje je tlak 2 puta niži od atmosferskog tlaka, vrelište vode je 83˚C, u kotlovima parnih strojeva, gdje je tlak pare 15 atm. (), temperatura vode je oko 200˚S.
Vlažnost zraka
U zraku uvijek ima vodene pare, pa se može govoriti o vlažnosti zraka koju karakteriziraju sljedeće vrijednosti:
1.Apsolutna vlažnost je gustoća vodene pare u zraku (ili tlak koji ta para stvara (.
Apsolutna vlažnost ne daje ideju o stupnju zasićenosti zraka vodenom parom. Ista količina vodene pare pri različitim temperaturama stvara različit osjećaj vlažnosti.
2.Relativna vlažnost- je omjer gustoće (tlaka) vodene pare sadržane u zraku pri određenoj temperaturi prema gustoći (tlaku) zasićene pare pri istoj temperaturi :
![]() ili
ili
– apsolutna vlažnost pri određenoj temperaturi; - gustoća, tlak zasićene pare pri istoj temperaturi. Gustoća i tlak zasićene vodene pare na bilo kojoj temperaturi mogu se pronaći u tablici. Iz tablice je vidljivo da što je viša temperatura zraka, veća mora biti gustoća i tlak vodene pare u zraku da bi bio zasićen.
Poznavajući relativnu vlažnost, možete razumjeti u kojem postotku je vodena para u zraku na određenoj temperaturi daleko od zasićenja. Ako je para u zraku zasićena, tada . Ako , tada u zraku nema dovoljno pare da bi se postiglo stanje zasićenja.
O tome da para u zraku postaje zasićena prosuđuje se po pojavi vlage u obliku magle ili rose. Temperatura pri kojoj vodena para u zraku postaje zasićena naziva se temperatura kondenzacije.
Para u zraku može se učiniti zasićenom dodavanjem pare kroz dodatno isparavanje tekućine bez promjene temperature zraka ili, ako postoji količina pare u zraku, smanjiti njenu temperaturu.
Normalna relativna vlažnost zraka, najpovoljnija za čovjeka, iznosi 40 - 60%. Velika važnost ima znanja o vlažnosti zraka u meteorologiji za predviđanje vremena. U tkalačkoj i konditorskoj proizvodnji za normalno odvijanje procesa potrebna je određena vlažnost zraka. Čuvanje umjetnina i knjiga zahtijeva održavanje vlažnosti zraka na potrebnoj razini.
Instrumenti za određivanje vlažnosti:
1. Kondenzacijski higrometar (omogućuje određivanje točke rosišta).
2. Higrometar za kosu (princip rada temelji se na ovisnosti duljine nemasne kose o vlažnosti) mjeri relativnu vlažnost u postocima.
3. Psihrometar se sastoji od dva termometra, suhog i ovlaženog. Spremnik navlaženog toplomjera umota se u krpu umočenu u vodu. Zbog isparavanja iz tkanine temperatura navlaženog je niža od suhe. Razlika u očitanjima termometra ovisi o vlažnosti okolnog zraka: što je zrak suši, to je intenzivnije isparavanje iz tkanine, veća je razlika u očitanjima termometra i obrnuto. Ako je vlažnost zraka 100%, očitanja termometra su ista, tj. razlika u očitanjima je 0. Za određivanje vlažnosti pomoću psihrometra koristi se psihrometrijska tablica.
Taljenje i kristalizacija
Prilikom topljenja čvrsta Udaljenost između čestica koje tvore kristalnu rešetku se povećava, a sama rešetka se uništava. Proces taljenja zahtijeva energiju. Zagrijavanjem čvrstog tijela povećava se kinetička energija titrajućih molekula, a time i amplituda njihovih vibracija. Na određenoj temperaturi tzv talište, narušava se red u rasporedu čestica u kristalima, kristali gube oblik. Tvar se topi, prelazeći iz krutog stanja u tekuće stanje.
Nakon kristalizacije Molekule se spajaju i tvore kristalnu rešetku. Kristalizacija se može dogoditi samo kada tekućina oslobodi energiju. Kako se rastaljena tvar hladi, prosječna kinetička energija i brzina molekula se smanjuju. Privlačne sile mogu držati čestice blizu njihovog ravnotežnog položaja. Na određenoj temperaturi tzv temperatura skrućivanja (kristalizacije), sve se molekule nađu u položaju stabilne ravnoteže, njihov raspored postaje uređen – nastaje kristal.
Taljenje krutine događa se na istoj temperaturi na kojoj se tvar skrućuje
Svaka tvar ima svoje talište. Na primjer, točka topljenja helija je -269,6˚C, žive je -38,9˚C, a bakra je 1083˚C.
Tijekom procesa taljenja temperatura ostaje konstantna. Količina topline dovedena izvana koristi se za uništavanje kristalne rešetke.
Tijekom procesa stvrdnjavanja, iako se toplina uklanja, temperatura se ne mijenja. Energija koja se oslobađa tijekom kristalizacije troši se na održavanje stalne temperature.
Dok se cijela tvar ne otopi ili cijela tvar ne očvrsne, t.j. Sve dok čvrsta i tekuća faza tvari postoje zajedno, temperatura se ne mijenja.
TV+tekućina tekućina+tv
,
gdje je količina topline, ![]() - količina topline potrebna za taljenje tvari koja se oslobađa tijekom kristalizacije tvari po masi
- količina topline potrebna za taljenje tvari koja se oslobađa tijekom kristalizacije tvari po masi
- specifična toplina taljenja– količina topline potrebna za taljenje tvari mase 1 kg na talištu.
Koliko se topline potroši tijekom taljenja određene mase tvari, ista se količina topline oslobađa tijekom kristalizacije te mase.
Također se zove specifična toplina kristalizacije.
Na talištu je unutarnja energija tvari u tekućem stanju veća od unutarnje energije iste mase tvari u krutom stanju.
U veliki broj Kada se tvari tale, njihov volumen se povećava, a gustoća smanjuje. Kod stvrdnjavanja, naprotiv, volumen se smanjuje, a gustoća povećava. Na primjer, kristali čvrstog naftalena tonu u tekući naftalin.
Neke tvari, na primjer, bizmut, led, galij, lijevano željezo itd., sabijaju se pri taljenju, a šire pri skrućivanju. Ova odstupanja od općeg pravila objašnjavaju se strukturnim značajkama kristalnih rešetki. Stoga se voda ispostavlja gušći od leda, led pluta u vodi. Širenje vode kada se smrzne dovodi do razaranja stijena.
Promjena volumena metala tijekom taljenja i skrućivanja od velike je važnosti u ljevanju.
Iskustvo to pokazuje promjena vanjskog tlaka po čvrsta ogleda se u talištu ove tvari. Za one tvari koje se šire tijekom taljenja, povećanje vanjskog tlaka dovodi do povećanja temperature taljenja, jer komplicira proces taljenja. Ako se tvari komprimiraju tijekom taljenja, tada za njih povećanje vanjskog tlaka dovodi do smanjenja temperature taljenja, jer pomaže proces topljenja. Tek vrlo veliki porast tlaka primjetno mijenja talište. Na primjer, da bi se temperatura topljenja leda snizila za 1˚C, tlak treba povećati za 130 atm. Talište tvari pri normalnom atmosferskom tlaku naziva se talište tvari.










