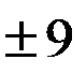Uz masu i obujam u kemijski proračuniČesto se koristi količina tvari koja je proporcionalna broju strukturnih jedinica sadržanih u tvari. U svakom slučaju mora biti naznačeno na koje se strukturne jedinice (molekule, atome, ione itd.) misli. Jedinica količine tvari je mol.
Mol je količina tvari koja sadrži onoliko molekula, atoma, iona, elektrona ili drugih strukturnih jedinica koliko ima atoma u 12 g izotopa ugljika 12C.
Broj strukturnih jedinica sadržanih u 1 molu tvari (Avogadrova konstanta) određuje se s velikom točnošću; u praktičnim proračunima uzima se jednakim 6,02 1024 mol -1.
Nije teško pokazati da je masa 1 mola tvari (molarna masa), izražena u gramima, brojčano jednaka relativnoj molekulskoj masi te tvari.
Da, rodbina molekularna masa(ili, skraćeno molekularna težina) slobodnog klora C1g je 70,90. Stoga je molarna masa molekulskog klora 70,90 g/mol. Međutim, molarna masa atoma klora je upola manja (45,45 g/mol), budući da 1 mol molekule klora Cl sadrži 2 mola atoma klora.
Prema Avogadrovom zakonu, jednaki volumeni svih plinova uzetih na istoj temperaturi i istom tlaku sadrže isti broj molekula. Drugim riječima, isti broj molekula bilo kojeg plina zauzima isti volumen pod istim uvjetima. U isto vrijeme, 1 mol bilo kojeg plina sadrži isti broj molekula. Prema tome, pod istim uvjetima, 1 mol bilo kojeg plina zauzima isti volumen. Taj se volumen naziva molarni volumen plina i pod normalnim uvjetima (0°C, tlak 101, 425 kPa) jednak je 22,4 litre.
Na primjer, izjava "sadržaj ugljičnog dioksida u zraku je 0,04% (vol.)" znači da kada parcijalni tlak CO 2 jednak tlaku zraka i pri istoj temperaturi, ugljični dioksid sadržan u zraku će zauzimati 0,04% ukupnog volumena koji zauzima zrak.
1. Usporedite broj molekula sadržanih u 1 g NH 4 i 1 g N 2. U kojem slučaju i koliko puta je broj molekula veći?
2. Izrazi masu jedne molekule sumporovog dioksida u gramima.
4. Koliko se molekula nalazi u 5,00 ml klora u normalnim uvjetima?
4. Koliki volumen u normalnim uvjetima zauzima 27 10 21 molekula plina?
5. Masu jedne molekule NO 2 izrazite u gramima -
6. Koliki je omjer volumena koji zauzimaju 1 mol O2 i 1 mol Oz (uvjeti su isti)?
7. Uzete su jednake mase kisika, vodika i metana pod istim uvjetima. Odredite omjer uzetih volumena plinova.
8. Na pitanje koliki će volumen zauzimati 1 mol vode u normalnim uvjetima, odgovor je bio: 22,4 litre. Je li ovo točan odgovor?
9. Masu jedne molekule HCl izrazite u gramima.
Koliko se molekula ugljičnog dioksida nalazi u 1 litri zraka ako je volumni udio CO 2 0,04% (normalni uvjeti)?
10. Koliko molova sadrži 1 m 4 bilo kojeg plina u normalnim uvjetima?
11. Izrazite u gramima masu jedne molekule H 2 O-
12. Koliko molova kisika ima u 1 litri zraka, ako je volumen
14. Koliko molova dušika ima 1 litra zraka ako je njegov volumni sadržaj 78% (normalni uvjeti)?
14. Uzete su jednake mase kisika, vodika i dušika pod istim uvjetima. Odredite omjer uzetih volumena plinova.
15. Usporedite broj molekula sadržanih u 1 g NO 2 i 1 g N 2. U kojem slučaju i koliko puta je broj molekula veći?
16. Koliko se molekula nalazi u 2,00 ml vodika pri standardnim uvjetima?
17. Izrazite u gramima masu jedne molekule H 2 O-
18. Koliki volumen zauzima 17 10 21 molekula plina u normalnim uvjetima?
BRZINA KEMIJSKIH REAKCIJA
Prilikom definiranja pojma ubrzati kemijska reakcija potrebno je razlikovati homogene i heterogene reakcije. Ako se reakcija odvija u homogenom sustavu, na primjer, u otopini ili u smjesi plinova, tada se ona odvija u cijelom volumenu sustava. Brzina homogene reakcije je količina tvari koja reagira ili nastaje kao rezultat reakcije u jedinici vremena po jedinici volumena sustava. Budući da je omjer broja molova tvari i volumena u kojem je raspoređena molarna koncentracija tvari, brzina homogene reakcije također se može definirati kao promjena koncentracije po jedinici vremena bilo koje od tvari: početnog reagensa ili produkta reakcije. Kako bi se osiguralo da je rezultat izračuna uvijek pozitivan, bez obzira temelji li se na reagensu ili proizvodu, u formuli se koristi znak "±":
Ovisno o prirodi reakcije, vrijeme se može izraziti ne samo u sekundama, kako to zahtijeva SI sustav, već iu minutama ili satima. Tijekom reakcije veličina njezine brzine nije konstantna, već se kontinuirano mijenja: smanjuje se kako se smanjuju koncentracije polaznih tvari. Gornji izračun daje prosječnu vrijednost brzine reakcije u određenom vremenskom intervalu Δτ = τ 2 – τ 1. Prava (trenutna) brzina definirana je kao granica kojoj teži omjer Δ S/ Δτ pri Δτ → 0, tj. prava brzina jednaka je derivaciji koncentracije u odnosu na vrijeme.
Za reakciju čija jednadžba sadrži stehiometrijske koeficijente koji se razlikuju od jedinice, vrijednosti brzine izražene za različite tvari nisu iste. Na primjer, za reakciju A + 4B = D + 2E, potrošnja tvari A je jedan mol, potrošnja tvari B je tri mola, a opskrba tvari E je dva mola. Zato υ (A) = ⅓ υ (B) = υ (D) =½ υ (E) ili υ (E) . = ⅔ υ (IN) .
Ako se reakcija dogodi između tvari koje se nalaze u različitim fazama heterogenog sustava, tada se može dogoditi samo na granici između tih faza. Na primjer, interakcija između otopine kiseline i komada metala događa se samo na površini metala. Brzina heterogene reakcije je količina tvari koja reagira ili nastaje kao rezultat reakcije po jedinici vremena po jedinici površine sučelja:
 .
.
Ovisnost brzine kemijske reakcije o koncentraciji reaktanata izražava se zakonom djelovanja mase: pri konstantnoj temperaturi, brzina kemijske reakcije izravno je proporcionalna umnošku molarnih koncentracija reaktanata podignutih na potenciju, jednaki koeficijentima s formulama tih tvari u jednadžbi reakcije. Zatim za reakciju
2A + B → proizvodi
omjer vrijedi υ ~ · S A 2 · S B, a za prijelaz na jednakost uvodi se koeficijent razmjernosti k, nazvao konstanta brzine reakcije:
υ = k· S A 2 · S B = k· [A] 2 · [B]
(molarne koncentracije u formulama mogu se označiti slovom S s odgovarajućim indeksom i formulom tvari u uglatim zagradama). Fizikalno značenje konstante brzine reakcije je brzina reakcije pri koncentracijama svih reaktanata jednakih 1 mol/l. Dimenzija konstante brzine reakcije ovisi o broju faktora na desnoj strani jednadžbe i može biti c –1 ; s –1 ·(l/mol); s –1 · (l 2 /mol 2) itd., odnosno tako da se u svakom slučaju u izračunima brzina reakcije izražava u mol · l –1 · s –1.
Za heterogene reakcije, jednadžba zakona djelovanja mase uključuje koncentracije samo onih tvari koje su u plinovita faza ili u otopini. Koncentracija tvari u čvrstoj fazi je konstantna vrijednost i uključena je u konstantu brzine, na primjer, za proces izgaranja ugljena C + O 2 = CO 2, zakon djelovanja mase je napisan:
υ = kI·const··= k·,
Gdje k= kI konst.
U sustavima u kojima su jedna ili više tvari plinovi, brzina reakcije također ovisi o tlaku. Na primjer, kada vodik stupa u interakciju s parama joda H 2 + I 2 = 2HI, brzina kemijske reakcije bit će određena izrazom:
υ = k··.
Ako tlak povećate, na primjer, 4 puta, tada će se volumen koji zauzima sustav smanjiti za isti iznos, a posljedično će se koncentracije svake od reagirajućih tvari povećati za isti iznos. Brzina reakcije u ovom će se slučaju povećati 9 puta
Ovisnost brzine reakcije o temperaturi opisano van't Hoffovim pravilom: sa svakim povećanjem temperature od 10 stupnjeva, brzina reakcije se povećava za 2-4 puta. To znači da kako se temperatura povećava u aritmetičkoj progresiji, brzina kemijske reakcije eksponencijalno raste. Baza u formuli progresije je temperaturni koeficijent brzine reakcijeγ, koji pokazuje koliko se puta povećava brzina dane reakcije (ili, što je isto, konstanta brzine) s porastom temperature za 10 stupnjeva. Matematički, Van't Hoffovo pravilo izraženo je formulama:
 ili
ili 
gdje su i brzine reakcije na početku t 1 i konačni t 2 temperature. Van't Hoffovo pravilo se također može izraziti sljedećim odnosima:
![]() ;
;  ;
; ![]() ;
;  ,
,
gdje su i brzina i konstanta brzine reakcije pri temperaturi t; i – iste vrijednosti na temperaturi t +10n; n– broj intervala od “deset stupnjeva” ( n =(t 2 –t 1)/10), za koliko se promijenila temperatura (može biti cijeli ili razlomački broj, pozitivan ili negativan).
Testni zadatak
1. Odredite vrijednost konstante brzine za reakciju A + B -> AB, ako je pri koncentracijama tvari A i B jednakih 0,05 odnosno 0,01 mol/l, brzina reakcije 5 10 -5 mol/(l -min).
2. Koliko će se puta promijeniti brzina reakcije 2A + B -> A2B ako se koncentracija tvari A poveća 2 puta, a koncentracija tvari B smanji 2 puta?
4. Koliko puta treba povećati koncentraciju tvari B 2 u sustavu 2A 2 (g) + B 2 (g) = 2A 2 B (g) da kada se koncentracija tvari A smanji za 4 puta , brzina izravne reakcije se ne mijenja ?
4. Neko vrijeme nakon početka reakcije 3A+B->2C+D koncentracije tvari bile su: [A] =0,04 mol/l; [B] = 0,01 mol/l; [C] = 0,008 mol/l. Kolike su početne koncentracije tvari A i B?
5. U sustavu CO + C1 2 = COC1 2 koncentracija je povećana s 0,04 na 0,12 mol/l, a koncentracija klora s 0,02 na 0,06 mol/l. Koliko se puta povećala brzina prednje reakcije?
6. Reakcija između tvari A i B izražena je jednadžbom: A + 2B → C. Početne koncentracije su: [A] 0 = 0,04 mol/l, [B] o = 0,05 mol/l. Konstanta brzine reakcije je 0,4. Pronaći početna brzina reakcije i brzina reakcije nakon nekog vremena, kada se koncentracija tvari A smanji za 0,01 mol/l.
7. Kako će se promijeniti brzina reakcije 2CO + O2 = 2CO2 koja se odvija u zatvorenoj posudi ako se tlak udvostruči?
8. Izračunajte koliko će se puta povećati brzina reakcije ako se temperatura sustava poveća s 20 °C na 100 °C, uzimajući vrijednost temperaturni koeficijent brzina reakcije jednaka 4.
9. Kako će se promijeniti brzina reakcije 2NO(r.) + 0 2 (g.) → 2N02(r.) ako se tlak u sustavu poveća 4 puta;
10. Kako će se promijeniti brzina reakcije 2NO(r.) + 0 2 (g.) → 2N02(r.) ako se volumen sustava smanji 4 puta?
11. Kako će se promijeniti brzina reakcije 2NO(r.) + 0 2 (g.) → 2N02(r.) ako se koncentracija NO poveća 4 puta?
12. Koliki je temperaturni koeficijent brzine reakcije ako se s povećanjem temperature za 40 stupnjeva brzina reakcije
povećava za 15,6 puta?
14. . Nađite vrijednost konstante brzine za reakciju A + B -> AB, ako je pri koncentracijama tvari A i B jednakih 0,07 odnosno 0,09 mol/l, brzina reakcije 2,7 10 -5 mol/(l-min). ).
14. Reakcija između tvari A i B izražena je jednadžbom: A + 2B → C. Početne koncentracije su: [A] 0 = 0,01 mol/l, [B] o = 0,04 mol/l. Konstanta brzine reakcije je 0,5. Odredite početnu brzinu reakcije i brzinu reakcije nakon nekog vremena, kada se koncentracija tvari A smanji za 0,01 mol/l.
15. Kako će se promijeniti brzina reakcije 2NO(r.) + 0 2 (g.) → 2N02(r.) ako se tlak u sustavu udvostruči;
16. U sustavu CO + C1 2 = COC1 2 koncentracija je povećana s 0,05 na 0,1 mol/l, a koncentracija klora s 0,04 na 0,06 mol/l. Koliko se puta povećala brzina prednje reakcije?
17. Izračunajte koliko će se puta povećati brzina reakcije ako se temperatura sustava poveća s 20 °C na 80 °C, uzimajući vrijednost temperaturnog koeficijenta brzine reakcije jednakom 2.
18. Izračunajte koliko će se puta povećati brzina reakcije ako se temperatura sustava poveća s 40 °C na 90 °C, uzimajući vrijednost temperaturnog koeficijenta brzine reakcije jednakom 4.
KEMIJSKA VEZA. NASTANAK I GRAĐA MOLEKULA
1.Koje vrste kemijskih veza poznajete? Navedite primjer nastanka ionske veze metodom valentne veze.
2. Koja se kemijska veza naziva kovalentnom? Ono što je karakteristično za kovalentni tip veze?
4. Koja svojstva karakterizira kovalentna veza? Pokažite to konkretnim primjerima.
4. Koja je vrsta kemijske veze u molekulama H2; Cl 2 HC1?
5.Kakva je priroda veza u molekulama? NCI 4 CS 2, CO 2? Za svaki od njih označite smjer pomaka zajedničkog elektronskog para.
6. Koja se kemijska veza naziva ionskom? Što je karakteristično za ionski tip veze?
7. Koja je vrsta veze u molekulama NaCl, N 2, Cl 2?
8. Nacrtajte sve moguće načine preklapanja s-orbitale s p-orbitalom;. Naznačite smjer komunikacije u ovom slučaju.
9. Objasnite donor-akceptorski mehanizam kovalentna veza na primjeru nastanka fosfonijevog iona [PH 4 ]+.
10. U molekulama CO, C0 2, je li veza polarna ili nepolarna? Objasniti. Opišite vodikovu vezu.
11. Zašto su neke molekule koje imaju polarne veze općenito nepolarne?
12.Kovalentni ili ionski tip veze karakterističan je za spojeve: Nal, S0 2, KF? Zašto je ionska veza ekstremni slučaj kovalentne veze?
14. Što je metalni spoj? Po čemu se razlikuje od kovalentne veze? Koja svojstva metala određuje?
14. Kakva je priroda veza među atomima u molekulama; KHF 2, H 2 0, HNO ?
15. Kako možemo objasniti veliku čvrstoću veze između atoma u molekuli dušika N2 i znatno nižu čvrstoću u molekuli fosfora P4?
16 . Kakva se veza naziva vodikovom vezom? Zašto stvaranje vodikovih veza nije tipično za molekule H2S i HC1, za razliku od H2O i HF?
17. Koja se veza naziva ionskom? Ima li ionska veza svojstva zasićenosti i usmjerenosti? Zašto je to ekstremni slučaj kovalentne veze?
18. Koja je vrsta veze u molekulama NaCl, N 2, Cl 2?
Prije rješavanja problema trebali biste znati formule i pravila kako pronaći volumen plina. Trebamo se sjetiti Avogadrova zakona. A sam volumen plina može se izračunati pomoću nekoliko formula, odabirom odgovarajuće od njih. Prilikom odabira potrebne formule, veliki značaj imati uvjete okoline, posebice temperaturu i tlak.
Avogadrov zakon
Kaže da će pri istom tlaku i istoj temperaturi isti volumeni različitih plinova sadržavati isti broj molekula. Broj molekula plina sadržanih u jednom molu je Avogadrov broj. Iz ovog zakona proizlazi da: 1 Kmol (kilomol) idealnog plina, bilo koji plin, pri istom tlaku i temperaturi (760 mm Hg i t = 0*C) uvijek zauzima jedan volumen = 22,4136 m3.
Kako odrediti volumen plina
- U zadacima se najčešće može naći formula V=n*Vm. Ovdje je volumen plina u litrama V, Vm je molarni volumen plina (l/mol), koji je u normalnim uvjetima = 22,4 l/mol, a n je količina tvari u molovima. Kada uvjeti nemaju količinu tvari, ali postoji masa tvari, tada idemo ovako: n=m/M. Ovdje je M g/mol (molarna masa tvari), a masa tvari u gramima je m. U periodnom sustavu zapisano je ispod svakog elementa, kao njegova atomska masa. Zbrojimo sve mase i dobijemo ono što tražimo.
- Dakle, kako izračunati volumen plina. Evo zadatka: klorovodična kiselina otopiti 10 g aluminija. Pitanje: koliko se vodika može osloboditi u.? Jednadžba reakcije izgleda ovako: 2Al+6HCl(g)=2AlCl3+3H2. Na samom početku nalazimo aluminij (količinu) koji je reagirao prema formuli: n(Al)=m(Al)/M(Al). Masu aluminija (molarnu) uzimamo iz periodnog sustava M(Al) = 27 g/mol. Zamijenimo: n(Al)=10/27=0,37 mol. Iz kemijska jednadžba Očigledno je da su 3 mola vodika nastala kada su 2 mola aluminija bila otopljena. Potrebno je izračunati koliko će se vodika osloboditi iz 0,4 mola aluminija: n(H2)=3*0,37/2=0,56mola. Zamijenimo podatke u formulu i pronađimo volumen ovog plina. V=n*Vm=0,56*22,4=12,54l.
Svrha lekcije: formirati pojam molarnog, milimolarnog i kilomolarnog volumena plinova i njihovih mjernih jedinica.
Ciljevi lekcije:
- Edukativni– učvrstiti prethodno proučene formule i pronaći vezu između volumena i mase, količine tvari i broja molekula, učvrstiti i usustaviti znanja učenika.
- Razvojni– razvijaju vještine i sposobnosti rješavanja problema, sposobnosti za logično mišljenje, proširiti vidike učenika, njihov Kreativne vještine, sposobnost rada s dodatnom literaturom, dugoročno pamćenje, interes za materiju.
- Edukativni– educirati pojedince sa visoka razina kulture, formirati potrebu za kognitivnom aktivnošću.
Vrsta lekcije: Kombinirana lekcija.
Oprema i reagensi: Tablica "Molarni volumen plinova", portret Avogadra, čaša, voda, mjerne posude sa sumporom, kalcijev oksid, glukoza s količinom tvari od 1 mola.
Plan učenja:
- Organizacijski trenutak (1 min.)
- Provjera znanja u obliku frontalne ankete (10 min.)
- Popunjavanje tablice (5 min.)
- Objašnjenje novog gradiva (10 min.)
- Konsolidacija (10 min.)
- Sažetak (3 min.)
- Domaća zadaća(1 minuta.)
Tijekom nastave
1. Organizacijski trenutak.
2. Frontalni razgovor o problemima.
Kako se zove masa 1 mola tvari?
Kako povezati molarnu masu i količinu tvari?
Koji je Avogadrov broj?
Kako je Avogadrov broj povezan s količinom materije?
Kako možemo povezati masu i broj molekula tvari?
3. Sada popunite tablicu rješavanjem zadataka – radi se o grupnom radu.
| Formula, tvari | Težina, g | Molekulska masa, g/mol | Količina tvari, mol | Broj molekula | Avogadrov broj, molekule/mol |
| ZnO | ? | 81 g/mol | ? madež | 18 10 23 molekule | 6 10 23 |
| MgS | 5,6 g | 56 g/mol | ? madež | ? | 6 10 23 |
| BaCl2 | ? | ? g/mol | 0,5 mol | 3 10 23 molekule | 6 10 23 |
4. Učenje novog gradiva.
“...Želimo ne samo znati kako priroda funkcionira (i kako prirodni fenomen), ali i, ako je moguće, postići cilj, možda utopijski i naizgled smion, - otkriti zašto je priroda upravo takva kakva jest, a ne drugačija. Znanstvenici u tome nalaze najveće zadovoljstvo.”
Albert Einstein
Dakle, naš cilj je pronaći najveće zadovoljstvo poput pravih znanstvenika.
Kako se zove volumen 1 mola tvari?
O čemu ovisi molarni volumen?
Koliki će biti molarni volumen vode ako je M r = 18 i ρ = 1 g/ml?
(naravno 18 ml).
Za određivanje volumena koristili ste formulu poznatu iz fizike ρ = m / V (g/ml, g/cm3, kg/m3)
Izmjerimo taj volumen pomoću mjernog posuđa. Izmjerimo molarne volumene alkohola, sumpora, željeza, šećera. Različiti su jer... različite gustoće (tablica različitih gustoća).
Što je s plinovima? Ispada da 1 mol bilo kojeg plina u uvjetima okoline. (0°C i 760 mmHg) zauzima isti molarni volumen od 22,4 l/mol (prikazano na tablici). Kako će se zvati volumen od 1 kilomola? Kilomolar. Jednako je 22,4 m 3 / kmol. Milimolarni volumen 22,4 ml/mol.
Odakle ovaj broj?
To proizlazi iz Avogadrova zakona. Posljedica Avogadrova zakona: 1 mol bilo kojeg plina u uvjetima okoline. zauzima volumen od 22,4 l/mol.
Sada ćemo čuti nešto o životu talijanskog znanstvenika. (reportaža o životu Avogadra)
Sada pogledajmo ovisnost vrijednosti o različitim pokazateljima:
| Formula tvari | Fizičko stanje (na br.) | Težina, g | Gustoća, g/ml | Volumen dijelova od 1 mola, l | Količina tvari, mol | Odnos između volumena i količine tvari |
| NaCl | Čvrsto | 58,5 | 2160 | 0,027 | 1 | 0,027 |
| H2O | Tekućina | 18 | 1000 | 0,018 | 1 | 0,18 |
| O2 | Plin | 32 | 1,43 | 22,4 | 1 | 22,4 |
| H 2 | Plin | 2 | 0,09 | 22,4 | 1 | 22,4 |
| CO2 | Plin | 44 | 1,96 | 22,4 | 1 | 22,4 |
| SO 2 | plin | 64 | 2,86 | 22,4 | 1 | 22,4 |
Usporedbom dobivenih podataka izvucite zaključak (odnos između volumena i količine tvari za sve plinovite tvari(u standardnim uvjetima) izražava se istom količinom, koja se naziva molarni volumen.)
Označava se Vm i mjeri u l/mol, itd. Izvedimo formulu za određivanje molskog volumena
Vm = V/v , odavde možete pronaći količinu tvari i volumen plina. Sada se prisjetimo prethodno proučenih formula, je li ih moguće kombinirati? Možete dobiti univerzalne formule za izračune.
m/M = V/V m;
V/V m = N/Na
5. Učvrstimo sada stečeno znanje uz pomoć mentalnog računanja, kako bi se znanje kroz vještine automatski primijenilo, odnosno pretvorilo u vještine.
Za točan odgovor dobit ćete bod, a prema broju bodova dobit ćete ocjenu.
- Koja je formula za vodik?
- Kolika je njegova relativna molekularna težina?
- Kolika je njegova molarna masa?
- Koliko će u svakom slučaju biti molekula vodika?
- Koliki će volumen zauzeti u normalnim uvjetima? 3 g H2?
- Koliko će težiti 12 10 23 molekula vodika?
- Koliki će volumen zauzimati te molekule u svakom slučaju?
Sada rješavajmo probleme u grupama.
Zadatak br. 1
Uzorak: Koliki volumen zauzima 0,2 mol N 2 na nultoj razini?
- Koliki volumen zauzima 5 mol O 2 na razini tla?
- Koliki volumen zauzima 2,5 mol H 2 na razini tla?
Zadatak br. 2
Uzorak: Kolika količina tvari sadrži vodik obujma 33,6 litara na tlu?
Problemi koje treba samostalno riješiti
Riješite zadatke prema navedenom primjeru:
- Kolika količina tvari sadrži kisik obujma 0,224 litre pri sobnim uvjetima?
- Koju količinu tvari sadrži ugljikov dioksid obujma 4,48 litara na tlu?
Zadatak br. 3
Uzorak: Koliki će volumen zauzeti 56 g plina CO pri standardnim uvjetima?
Problemi koje treba samostalno riješiti
Riješite zadatke prema navedenom primjeru:
- Koliki će volumen zauzimati 8 g plina O 2 pri sobnim uvjetima?
- Koliki će volumen zauzimati 64 g plina SO 2 na nultoj razini?
Zadatak br. 4
Uzorak: Koji volumen sadrži 3·10 23 molekula vodika H 2 na nultoj razini?
Problemi koje treba samostalno riješiti
Riješite zadatke prema navedenom primjeru:
- Koliki volumen sadrži 12,04 · 10 23 molekula vodika CO 2 pri standardnim uvjetima?
- Koliki volumen sadrži 3,01·10 23 molekula vodika O 2 pri standardnim uvjetima?
Pojam relativne gustoće plinova treba dati na temelju njihovog poznavanja gustoće tijela: D = ρ 1 /ρ 2, gdje je ρ 1 gustoća prvog plina, ρ 2 je gustoća plina. drugi plin. Znate formulu ρ = m/V. Zamjenom m u ovoj formuli s M, a V s V m, dobivamo ρ = M/V m. Zatim relativna gustoća može se izraziti pomoću desne strane posljednje formule:
D = ρ 1 /ρ 2 = M 1 / M 2.
Zaključak: relativna gustoća plinova je broj koji pokazuje koliko je puta molarna masa jednog plina veća od molarne mase drugog plina.
Na primjer, odredite relativnu gustoću kisika u usporedbi sa zrakom i vodikom.
6. Sažimanje.
Riješite probleme za konsolidaciju:
Odredite masu (un.s.): a) 6 litara. O 3; b) 14 l. plin H 2 S?
Koliki je volumen vodika pri sobnim uvjetima? nastaje međudjelovanjem 0,23 g natrija s vodom?
Kolika je molarna masa plina ako je 1 litra. ima li masu 3,17 g? (Savjet! m = ρ V)
Odnos između tlaka i volumena idealnog plina pri konstantnoj temperaturi prikazan je na sl. 1.
Tlak i volumen uzorka plina obrnuto su proporcionalni, tj. njihovi umnošci su konstantna vrijednost: pV = const. Ovaj odnos se može napisati u obliku koji je prikladniji za rješavanje problema:
str 1 V 1 = str 2 V 2(Boyle-Mariotteov zakon).
Zamislimo tih 50 litara plina (V 1 ), pod tlakom od 2 atm (p 1), komprimiran na volumen od 25 l (V 2), tada će njegov novi tlak biti jednak:

Ovisnost svojstava idealnih plinova o temperaturi određena je Gay-Lussacovim zakonom: volumen plina izravno je proporcionalan njegovoj apsolutnoj temperaturi (pri konstantnoj masi: V = kT, Gdje k- faktor proporcionalnosti). Ovaj odnos se obično piše u prikladnijem obliku za rješavanje problema:

Na primjer, ako se 100 litara plina na temperaturi od 300 K zagrije na 400 K bez promjene tlaka, tada će na višoj temperaturi novi volumen plina biti jednak

Zapisnik zakona o ujedinjenom plinu pV/T= = const se može pretvoriti u Mendeleev-Clapeyronovu jednadžbu:
![]()
Gdje R- univerzalna plinska konstanta, a je broj molova plina.
Mendeleev-Clapeyron jednadžba dopušta široku paletu izračuna. Na primjer, možete odrediti broj molova plina pri tlaku od 3 atm i temperaturi od 400 K, zauzimajući volumen od 70 l:
Jedna od posljedica jedinstvenog plinskog zakona: jednaki volumeni različitih plinova pri istoj temperaturi i tlaku sadrže isti broj molekula. Ovo je Avogadrov zakon.
Iz Avogadrova zakona također proizlazi važan korolar: mase dva identična volumena različitih plinova (naravno, pri istom tlaku i temperaturi) odnose se kao njihove molekulske mase:
m 1 /m 2 = M 1 /M 2 (m 1 i m 2 - mase dvaju plinova);
M 1 I.M. 2 predstavlja relativnu gustoću.
Avogadrov zakon vrijedi samo za idealne plinove. U normalnim uvjetima plinovi koji se teško komprimiraju (vodik, helij, dušik, neon, argon) mogu se smatrati idealnima. Za ugljični monoksid (IV), amonijak, sumporov oksid (IV) odstupanja od idealnosti opažaju se već u normalnim uvjetima i povećavaju se s povećanjem tlaka i snižavanjem temperature.
Primjer 1. Ugljični dioksid volumena 1 litre pri normalnim uvjetima ima masu 1,977 g. Koliki je stvarni volumen molova tog plina (pri normalnim uvjetima)? Objasni svoj odgovor.
Riješenje. Molarna masa M (CO 2) = 44 g/mol, tada je volumen mola 44/1,977 = 22,12 (l). Ova vrijednost je manja od one prihvaćene za idealne plinove (22,4 l). Smanjenje volumena povezano je s povećanjem interakcije između molekula CO 2, tj. odstupanjem od idealnosti.
Primjer 2. Plinoviti klor mase 0,01 g, koji se nalazi u zatvorenoj ampuli volumena 10 cm 3, zagrijava se od 0 do 273 o C. Koliki je početni tlak klora pri 0 o C i pri 273 o C?
Riješenje. M r (Cl 2)=70,9; stoga 0,01 g klora odgovara 1,4 10 -4 mol. Volumen ampule je 0,01 l. Korištenje Mendeleev-Clapeyronove jednadžbe pV=vRT, nađi početni tlak klora (str 1 ) na 0 o C:
slično nalazimo tlak klora (p 2) pri 273 o C: p 2 = 0,62 atm.
Primjer 3. Koliki volumen zauzima 10 g ugljikovog monoksida (II) pri temperaturi od 15 o C i tlaku od 790 mm Hg? Umjetnost.?
Riješenje.

Zadaci
1
. Koliki volumen (pri normalnim uvjetima) zauzima 0,5 mola kisika?
2
. Koliki volumen zauzima vodik koji sadrži 18-10 23 molekula (pri standardnim uvjetima)?
3
. Kolika je molarna masa sumpor(IV) oksida ako je gustoća vodika tog plina 32?
4
. Koliki volumen zauzima 68 g amonijaka pri tlaku od 2 atm i temperaturi od 100 o C?
5
. U zatvorenoj posudi zapremine 1,5 litara nalazi se smjesa sumporovodika s viškom kisika pri temperaturi od 27 o C i tlaku od 623,2 mm Hg. Umjetnost. Odredi ukupnu količinu tvari u posudi.
6
. U velikoj prostoriji temperatura se može mjeriti pomoću "plinskog" termometra. U tu svrhu staklena epruveta unutarnjeg volumena 80 ml napunjena je dušikom pri temperaturi od 20 o C i tlaku od 101,325 kPa. Nakon toga je cijev polako i oprezno iznesena iz prostorije u topliju prostoriju. Zbog toplinskog širenja, plin je napustio cijev i skupio se iznad tekućine, čiji je tlak pare zanemariv. Ukupni volumen plina koji izlazi iz cijevi (mjereno na 20 o C i 101,325 kPa) je 3,5 ml. Koliko je molova dušika bilo potrebno da se ispuni staklena cijev i koja je bila temperatura toplije prostorije?
7
. Kemičar koji je odredio atomsku masu novog elementa X sredinom 19. stoljeća upotrijebio je sljedeću metodu: pripremio je četiri spoja koji sadrže element X (A, B, C i D), te odredio maseni udio elementa ( %) u svakom od njih. U posudu iz koje je prethodno bio ispušten zrak stavio je svaki spoj preveden u plinovito stanje na 250 o C i postavio tlak pare tvari na 1,013 10 5 Pa. Masa plinovite tvari određena je iz razlike u masama prazne i pune posude. Sličan postupak je proveden s dušikom. Kao rezultat, mogla bi se sastaviti sljedeća tablica:
| Plin | Ukupna težina, g | Maseni udio () elementa x u tvari, % |
| N 2 | 0,652 | - |
| A | 0,849 | 97,3 |
| B | 2,398 | 68,9 |
| U | 4,851 | 85,1 |
| G | 3,583 | 92,2 |
Odredite vjerojatnu atomsku masu elementa X.
8 . Godine 1826. francuski kemičar Dumas predložio je metodu za određivanje gustoće pare, primjenjivu na mnoge tvari. Pomoću ove metode bilo je moguće pronaći molekularne mase spojeva koristeći Avogadrovu hipotezu da jednaki volumeni plinova i para pri jednakom tlaku i temperaturi sadrže jednak broj molekula. Međutim, eksperimenti s nekim tvarima, provedeni Dumasovom metodom, proturječili su Avogadrovoj hipotezi i doveli u sumnju samu mogućnost određivanja molekularne mase ovom metodom. Ovdje je opis jednog takvog eksperimenta (slika 2).

A. U vratu posude A poznatog volumena, stavi uzorak amonijaka i zagrije ga u pećnici V do ove temperature t o , u kojoj je sav amonijak ispario. Nastale pare istisnule su zrak iz posude, a neke od njih su ispuštene van u obliku magle. Zagrijano na t o posuda, u kojoj je tlak bio jednak atmosferskom tlaku, zatvorena je na struku r, zatim ohlađena i izvagana.
Zatim je posuda otvorena, isprana od kondenziranog amonijaka, osušena i ponovno izvagana. Iz razlike je određena masa m amonijaka.
Ova masa, kada se zagrije na t o imao pritisak R, jednak atmosferskom, u posudi volumena V. Za posudu a unaprijed su određeni tlak i volumen poznate mase vodika pri sobnoj temperaturi. Omjer molekulske mase amonijaka i molekulske mase vodika određen je formulom
Dobili smo vrijednost M/M(N 2) = 13.4. Omjer izračunat pomoću formule NH4Cl bio je 26,8.
b. Pokus je ponovljen, ali je grlo posude zatvoreno poroznim azbestnim čepom. d, propusna za plinove i pare. Istovremeno smo dobili stav M/M(H2) = 14,2.
V. Ponovili smo pokus b, ali smo početnu količinu amonijaka povećali za 3 puta. Omjer je postao jednak M/M (H 2) = 16,5.
Objasnite rezultate opisanog pokusa i dokažite da je u ovom slučaju poštovan Avogadrov zakon.
1.
Mol bilo kojeg plina zauzima volumen (pri standardnim uvjetima) od 22,4 litre; 0,5 mol O 2 zauzima volumen od 22,40,5 = 11,2 (l).
2.
Broj molekula vodika jednak 6,02-10 23 (Avogadrov broj), na n. u. zauzima volumen od 22,4 l (1 mol); Zatim
![]()
3.
Molarna masa sumpor(IV) oksida: M(SO 2) = 322 = 64 (g/mol).
4.
Kada je n. u. 1 mol NH3, jednak 17 g, zauzima volumen od 22,4 l, 68 g zauzima volumen x l ,

Iz jednadžbe stanja plina p o V o /T o = p 1 V 1 /T 1 nalazimo
smjese H2S i O2.
6 . Prilikom punjenja cijevi dušikom
Ostaci u epruveti (pod početnim uvjetima) V 1: 80-3,5 = 76,5 (ml). S porastom temperature dušik koji je pri 20 o C zauzimao volumen od 76,5 ml (V 1) počeo je zauzimati volumen V 2 = 80 ml. Tada prema T 1 /T 2 = = V 1 /V 2 imamo

Uzmimo da su pri temperaturi od 250 o C tvari A, B, C, D idealni plinovi. Zatim prema Avogadrovom zakonu

Masa elementa X u 1 molu tvari A, B, C i D (g/mol):
M(A) . 0,973 = 35,45; M(B) . 0,689 = 70,91; M(V). 0,851 = 177,17; M(G) . 0,922 = 141,78
Budući da molekula tvari mora sadržavati cijeli broj atoma elementa X, potrebno je pronaći najveći zajednički djelitelj dobivenih veličina. Iznosi 35,44 g/mol i taj se broj može smatrati vjerojatnim atomska masa element X.
8. Svaki moderni kemičar može lako objasniti rezultate eksperimenta. Dobro je poznato da je sublimacija amonijaka - amonijevog klorida - reverzibilan proces toplinske razgradnje ove soli:
| NH4Cl | NH 3 | + HCl. | |
| 53,5 | 17 | 36,5 |
Amonijak i klorovodik prisutni su u plinovitoj fazi, njihova prosječna relativna molekularna težina je M t
![]()
Promjena rezultata u prisutnosti azbestnog čepa manje je jasna. Međutim, sredinom prošlog stoljeća upravo su pokusi s poroznim („dobro oblikovanim“) pregradama pokazali da para amonijaka sadrži dva plina. Svjetliji amonijak brže prolazi kroz pore i lako se detektira mirisom ili korištenjem mokrog indikator papira.
Molekularno kinetička teorija plinova daje strogi izraz za procjenu relativne propusnosti plinova kroz porozne pregrade. Prosječna brzina molekula plina  , gdje je R plinska konstanta; T - apsolutna temperatura; M - molekulska masa. Prema ovoj formuli, amonijak bi trebao difundirati brže od klorovodika:
, gdje je R plinska konstanta; T - apsolutna temperatura; M - molekulska masa. Prema ovoj formuli, amonijak bi trebao difundirati brže od klorovodika:
Posljedično, kada se azbestni čep uvede u grlo tikvice, plin u tikvici imat će vremena da postane donekle obogaćen teškim HC1 tijekom vremena kada se tlak izjednači s atmosferskim tlakom. Povećava se relativna gustoća plina. S povećanjem mase NH 4 C1, kasnije će se uspostaviti tlak jednak atmosferskom tlaku (azbestni čep sprječava brzo istjecanje pare iz tikvice), plin u tikvici sadržavat će više klorovodika nego u prethodnoj slučaj; gustoća plina će se povećati.