Чудили ли сте се някога какви са мистериозните аморфни вещества? По структура те се различават както от твърди, така и от течни. Факт е, че такива тела са в специално кондензирано състояние, което има само близък ред. Примери за аморфни вещества са смола, стъкло, кехлибар, гума, полиетилен, поливинилхлорид (любимите ни пластмасови прозорци), различни полимери и др. Това са твърди тела, които нямат кристална решетка. Те включват също уплътнителен восък, различни лепила, ебонит и пластмаси.
Необичайни свойства на аморфните вещества
Фасетите не се образуват в аморфни тела по време на разделяне. Частиците са напълно произволни и са на близко разстояние една до друга. Те могат да бъдат както много дебели, така и вискозни. Как се влияят от външни влияния? Под въздействието на различни температури телата стават течни, като течности, и в същото време доста еластични. В случай, че външното действие не трае дълго, веществата с аморфна структура могат мощен ударразбийте на парчета. Продължителното влияние отвън води до факта, че те просто текат.
Опитайте малък експеримент със смола у дома. Поставете го върху твърда повърхност и ще забележите, че започва да тече плавно. Точно така, защото веществото! Скоростта зависи от температурните показатели. Ако е много високо, тогава смолата ще започне да се разпространява значително по-бързо.
Какво друго е характерно за такива тела? Те могат да приемат всякаква форма. Ако аморфни вещества под формата на малки частици се поставят в съд, например в кана, тогава те също ще приемат формата на съд. Те също са изотропни, тоест проявяват едни и същи физически свойства във всички посоки.
Топене и преминаване в други състояния. Метал и стъкло
Аморфното състояние на веществото не предполага поддържане на определена температура. При ниски скорости телата замръзват, при високи се топят. Между другото, степента на вискозитет на такива вещества също зависи от това. Ниската температура допринася за намаляване на вискозитета, високата, напротив, го увеличава.

За вещества от аморфен тип може да се разграничи още една особеност - преходът в кристално състояние, освен това спонтанен. Защо се случва това? Вътрешната енергия в кристалното тяло е много по-малка, отколкото в аморфното. Можем да видим това на примера със стъклени изделия – с течение на времето чашите стават мътни.
Метално стъкло - какво е това? Металът може да се отърве от кристалната решетка по време на топенето, тоест веществото на аморфната структура може да се направи стъклено. При втвърдяване при изкуствено охлаждане кристалната решетка се образува отново. Аморфният метал има просто невероятна устойчивост на корозия. Например, каросерията на автомобил, направена от него, няма да се нуждае от различни покрития, тъй като няма да бъде подложена на спонтанно унищожаване. Аморфното вещество е такова тяло, чиято атомна структура има безпрецедентна здравина, което означава, че аморфният метал може да се използва в абсолютно всеки индустриален сектор.
Кристалната структура на веществата
За да сте добре запознати с характеристиките на металите и да можете да работите с тях, трябва да имате познания за кристалната структура на определени вещества. Производството на метални изделия и областта на металургията не биха могли да получат такова развитие, ако хората нямаха определени познания за промените в структурата на сплавите, технологичните методи и експлоатационните характеристики.

Четири състояния на материята
Добре известно е, че има четири агрегатни състояния: твърдо, течно, газообразно, плазмено. Твърдите аморфни вещества също могат да бъдат кристални. При такава структура може да се наблюдава пространствена периодичност в подреждането на частиците. Тези частици в кристалите могат да извършват периодично движение. Във всички тела, които наблюдаваме в газообразно или течно състояние, може да се забележи движението на частиците под формата на хаотично разстройство. Аморфните твърди вещества (например метали в кондензирано състояние: ебонит, стъклени продукти, смоли) могат да се нарекат течности от замразен тип, тъй като когато променят формата си, можете да забележите такива отличителен белегкато вискозитет.
Разликата между аморфни тела от газове и течности
Проявите на пластичност, еластичност, втвърдяване по време на деформация са характерни за много тела. Кристалните и аморфните вещества имат тези характеристики в по-голяма степен, докато течностите и газовете не. Но от друга страна, може да се види, че те допринасят за еластична промяна в обема.
Кристални и аморфни вещества. Механични и физични свойства
Какво представляват кристалните и аморфните вещества? Както бе споменато по-горе, тези тела могат да се нарекат аморфни, които имат огромен коефициент на вискозитет и при обикновена температура тяхната течливост е невъзможна. Но високата температура, напротив, им позволява да бъдат течни, като течност.

Веществата от кристален тип изглеждат напълно различни. Тези твърди вещества могат да имат своя собствена точка на топене в зависимост от външното налягане. Получаването на кристали е възможно, ако течността се охлади. Ако не вземете определени мерки, тогава можете да забележите, че различни центрове на кристализация започват да се появяват в течно състояние. В областта около тези центрове се образува твърдо вещество. Много малки кристали започват да се комбинират един с друг в произволен ред и се получава така нареченият поликристал. Такова тяло е изотропно.
Характеристики на веществата
Какво определя физико-механичните характеристики на телата? Атомните връзки са важни, както и видът на кристалната структура. Йонните кристали се характеризират с йонни връзки, което означава плавен преход от един атом към друг. В този случай, образуването на положително и отрицателно заредени частици. Можем да наблюдаваме йонната връзка в прост пример - такива характеристики са характерни за различни оксиди и соли. Друга особеност на йонните кристали е ниската топлопроводимост, но производителността му може да се увеличи значително при нагряване. В възлите на кристалната решетка можете да видите различни молекули, които се отличават със силна атомна връзка.
Много минерали, които намираме навсякъде в природата, имат кристална структура. А аморфното състояние на материята също е природата в нейния най-чист вид. Само в този случай тялото е нещо безформено, но кристалите могат да приемат формата на най-красивите полиедри с наличието на плоски лица, както и да образуват нови твърди тела с удивителна красота и чистота.
Какво представляват кристалите? Аморфно-кристална структура
Формата на такива тела е постоянна за конкретна връзка. Например, берилът винаги изглежда като шестоъгълна призма. Направете малък експеримент. Вземете малък кристал кубична сол (топка) и го поставете в специален разтвор, възможно най-наситен със същата сол. С течение на времето ще забележите, че това тяло е останало непроменено - то отново е придобило формата на куб или топка, която е присъща на кристалите на солта.

3. - поливинилхлорид, или добре познатата пластмасова PVC дограма. Той е устойчив на пожари, тъй като се счита за бавно горящ, има повишена механична якост и електроизолационни свойства.
4. Полиамидът е вещество с много висока якост и устойчивост на износване. Има високи диелектрични характеристики.
5. Плексиглас, или полиметилметакрилат. Можем да го използваме в областта на електротехниката или да го използваме като материал за конструкции.
6. Флуоропластът или политетрафлуоретиленът е добре познат диелектрик, който не показва свойствата на разтваряне в разтворители органичен произход. Широк температурен диапазон и добър диелектрични свойствапозволяват да се използва като хидрофобен или антифрикционен материал.
7. Полистирол. Този материал не се влияе от киселини. Той, подобно на флуоропласта и полиамида, може да се счита за диелектрик. Много издръжлив по отношение на механично въздействие. Полистиролът се използва навсякъде. Например, той се е доказал добре като структурен и електроизолационен материал. Използва се в електротехниката и радиотехниката.
8. Вероятно най-известният полимер за нас е полиетиленът. Материалът проявява устойчивост, когато е изложен на агресивна среда, абсолютно не пропуска влагата. Ако опаковката е направена от полиетилен, не можете да се страхувате, че съдържанието ще се влоши под въздействието на силен дъжд. Полиетиленът също е диелектрик. Приложението му е обширно. От него се изработват тръбни конструкции, различни електрически продукти, изолационно фолио, обвивки за кабели на телефонни и електропроводи, части за радио и друго оборудване.
9. PVC е високополимерно вещество. Той е синтетичен и термопластичен. Той има структура от молекули, които са асиметрични. Почти не пропуска вода и се изработва чрез пресоване с щамповане и чрез формоване. Поливинилхлоридът се използва най-често в електрическата индустрия. На негова основа се създават различни топлоизолационни маркучи и маркучи за химическа защита, батерии, изолационни втулки и уплътнения, проводници и кабели. PVC също е отличен заместител на вредното олово. Не може да се използва като високочестотна верига под формата на диелектрик. И всичко това поради факта, че в този случай диелектричните загуби ще бъдат високи. Има висока проводимост.
ФИЗИКА 8 КЛАС
Доклад по темата:
„Аморфни тела. Топене на аморфни тела.”
ученик от 8 "б" клас:
2009
аморфни тела.
Да направим експеримент. Ще ни трябва парче пластилин, стеаринова свещ и електрическа камина. Поставете пластилин и свещ на равни разстояния от камината. След известно време част от стеарина ще се разтопи (стане течност), а част ще остане под формата на твърдо парче. Пластилинът за същото време само ще омекне малко. След известно време целият стеарин ще се разтопи и пластилинът постепенно ще се „коригира“ по повърхността на масата, омекотявайки все повече и повече.
И така, има тела, които не омекват при разтопяване, а от в твърдо състояниеведнага се превръщат в течност. При топенето на такива тела винаги е възможно да се отдели течността от все още неразтопената (твърда) част на тялото. Тези тела са кристална.Има и твърди вещества, които при нагряване постепенно омекват, стават все по-течни. За такива тела е невъзможно да се определи температурата, при която те се превръщат в течност (стопя се). Тези тела се наричат аморфен.
Нека направим следния експеримент. Нека хвърлим парче смола или восък в стъклена фуния и да го оставим в топло помещение. След около месец ще се окаже, че восъкът е приел формата на фуния и дори е започнал да изтича от нея под формата на „струя“ (фиг. 1). За разлика от кристалите, които запазват формата си почти завинаги, аморфните тела са течни дори при ниски температури. Следователно те могат да се считат за много гъсти и вискозни течности.

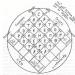
Структурата на аморфните тела.Изследвания с електронен микроскоп, както и с помощта на рентгенови лъчи, показват, че в аморфните тела няма строг ред в подреждането на техните частици. Погледнете, Фигура 2 показва подреждането на частиците в кристалния кварц, а вдясно - в аморфния кварц. Тези вещества се състоят от едни и същи частици - молекули на силициевия оксид SiO 2.
Кристалното състояние на кварца се получава, ако разтопеният кварц се охлажда бавно. Ако охлаждането на стопилката е бързо, тогава молекулите няма да имат време да се "подредят" в подредени редове и ще се получи аморфен кварц.
Частиците на аморфните тела вибрират непрекъснато и произволно. Те са по-склонни от частици кристали да скачат от място на място. Това се улеснява от факта, че частиците на аморфните тела не са еднакво плътни: между тях има празнини.
Кристализация на аморфни тела.С течение на времето (няколко месеца, години) аморфните вещества спонтанно преминават в кристално състояние. Например захарни бонбони или пресен мед, оставени сами на топло място, стават непрозрачни след няколко месеца. Казват, че медът и бонбоните са "захаросани". Счупвайки близалка или загребвайки мед с лъжица, наистина виждаме получените захарни кристали.
Спонтанната кристализация на аморфните тела показва, че кристалното състояние на материята е по-стабилно от аморфното състояние. Междумолекулната теория го обяснява по този начин. Междумолекулните сили на привличане и отблъскване карат частиците на аморфното тяло да скачат предимно до мястото, където има празнини. В резултат на това се получава по-подредено подреждане на частиците от преди, тоест се образува поликристал.
Топене на аморфни тела.
С повишаване на температурата енергията на вибрационното движение на атомите в твърдо тялонараства и накрая идва момент, в който връзките между атомите започват да се разрушават. В този случай твърдото тяло преминава в течно състояние. Такъв преход се нарича топене.При фиксирано налягане топенето става при строго определена температура.
Количеството топлина, необходимо за превръщане на единица маса от вещество в течност при точката на топене, се нарича специфична топлина на топене λ .
За разтопяване на вещество м необходимото количество топлина е:
Q = λ m .
Процесът на топене на аморфни тела се различава от топенето кристални тела. С повишаване на температурата аморфните тела постепенно омекват, стават вискозни, докато се превърнат в течност. Аморфни телаза разлика от кристалите, те нямат определена точка на топене. Температурата на аморфните тела в този случай се променя непрекъснато. Това е така, защото в аморфните твърди вещества, както и в течностите, молекулите могат да се движат една спрямо друга. При нагряване скоростта им се увеличава, разстоянието между тях се увеличава. В резултат на това тялото става все по-меко и по-меко, докато се превърне в течност. По време на втвърдяването на аморфните тела тяхната температура също непрекъснато намалява.
Когато температурата се понижи, течността може да замръзне, без да подрежда структурата. В този случай веществото вече е в твърдо състояние, но структурата му се доближава до структурата на течност - такива вещества се наричат аморфен (от гръцки " аморфни"- безформен)
Свойства на аморфните тела:
§ Основната характеристика е отсъствието на атомна или молекулярна решетка, тоест триизмерната периодичност на структурата, характерна за кристалното състояние.
§ Аморфното състояние се характеризира с наличието само на къси разстояния. Структурите на аморфните вещества наподобяват течности, но имат много по-малко течливост.
§ Аморфното състояние обикновено е нестабилно. Аморфното състояние има някаква излишна вътрешна енергия, така че спонтанно преминава в кристално състояние като по-стабилно. Поради това повечето вещества при нормални условия са все още в кристално състояние.
§ Под влияние на механични натоварвания или при промяна на температурата, аморфните тела могат кристализират.
§ Течност(тъй като според някои теории аморфните тела се разглеждат като преохладени течности). Този имот може да бъде открит чрез внимателен преглед на стъклата на прозорците, много стари къщи. Прозорците в такива къщи са малко по-дебели отдолу, тъй като дълго време стъклото непрекъснато се стичаше надолу под въздействието на гравитацията. Сравнително наскоро се научи да получава в стъклено състояние на метали. За да направите това, металът се разтопява и след това се охлажда за много кратко време. Поради бързото охлаждане в метала не се появява правилната кристална структура, той става стъклен. Металните стъкла се характеризират с висока твърдост, устойчивост на износване и устойчивост на корозия.
§ Аморфни тела изотропен , тоест техните механични, оптични, електрически и други свойства не зависят от посоката.
§ В аморфни тела няма фиксирана температура на топене: топенето става в определен температурен диапазон. Преходът на аморфно вещество от твърдо в течно състояние не се придружава от рязка промяна в свойствата. Например: температурният диапазон на топене на силикатните стъкла е приблизително 200°C.
Все още не е създаден физически модел на аморфното състояние.
Реактивността на веществата в аморфно състояние е много по-висока, отколкото в кристално състояние.
Примери за аморфни вещества: естествено: мед, кехлибар, колофон, смола, битум;
изкуствен: стъкло, много оксиди, хидроксиди.
Има вещества, които в твърда форма могат да бъдат само в аморфно състояние. То се отнася до полимерис неправилна последователност от връзки.
В някои случаи едно и също вещество може да бъде в различни състояния, например: SiO 2 съществува в стъкловидно и в няколко кристални състояния; също S-сяра, има аморфна сяра и две кристални модификации (ромбична и моноклинна).
Повечето вещества в умерения климат на Земята са в твърдо състояние. Твърдите тела запазват не само формата си, но и обема си.
Според естеството на относителното подреждане на частиците твърдите вещества се разделят на три вида: кристални, аморфни и композитни.
аморфни тела.Като примери за аморфни тела могат да служат стъкло, различни втвърдени смоли (кехлибар), пластмаси и др. Ако аморфното тяло се нагрее, то постепенно омеква, а преминаването в течно състояние заема значителен температурен диапазон.
Приликата с течностите се обяснява с факта, че атомите и молекулите на аморфните тела, подобно на молекулите на течността, имат „уредено“ време на живот. Няма специфична точка на топене, така че аморфните тела могат да се разглеждат като преохлаждане на течност с много висок вискозитет. Отсъствието на далечен ред в подреждането на атомите на аморфните тела води до факта, че веществото в аморфно състояние има по-ниска плътност, отколкото в кристално състояние.
Нарушението в подреждането на атомите на аморфните тела води до факта, че средното разстояние между атомите в различни посоки е еднакво, следователно те са изотропни, тоест всички физически свойства (механични, оптични и др.) не зависят от посоката на външно влияние. Признак за аморфно тяло е неправилната форма на повърхността при счупване. След дълъг период от време телата, които са случайно аморфни, все още променят формата си под въздействието на гравитацията. По този начин те са като течности. С повишаване на температурата тази промяна във формата настъпва по-бързо. Аморфното състояние е нестабилно, настъпва преход от аморфно състояние към кристално състояние. (Стъклото се замъглява.)
кристални тела.При наличие на периодичност в подреждането на атомите (далечен ред), твърдото вещество е кристално.
Ако погледнете солните зърна с лупа или микроскоп, ще забележите, че те са ограничени от плоски лица. Наличието на такива лица е знак, че сте в кристално състояние.
Тяло, което е единичен кристал, се нарича единичен кристал. Повечето кристални тела се състоят от много произволно подредени малки кристали, които са нараснали заедно. Такива тела се наричат поликристали. Бучка захар е поликристално тяло. кристали различни веществаимат разнообразни форми. Размерите на кристалите също варират. Размерите на кристалите от поликристален тип могат да се променят с течение на времето. Малките железни кристали се превръщат в големи, този процес се ускорява от удари и сътресения, среща се в стоманени мостове, железопътни релси и др., от които здравината на конструкцията намалява с времето.
Толкова много тела са еднакви химичен съставв кристално състояние, в зависимост от условията, те могат да съществуват в две или повече разновидности. Това свойство се нарича полиморфизъм. Ледът има до десет модификации. Полиморфизъм на въглерода - графит и диамант.
Съществено свойство на единичен кристал е анизотропията – несходството на неговите свойства (електрически, механични и др.) в различни посоки.
Поликристалните тела са изотропни, тоест проявяват едни и същи свойства във всички посоки. Това се обяснява с факта, че кристалите, които изграждат едно поликристално тяло, са произволно ориентирани един спрямо друг. В резултат на това нито една от посоките не се различава от другите.
Създадени са композитни материали, чиито механични свойства превъзхождат естествените материали. Композитни материали (композити)се състоят от матрица и пълнители. Като матрица се използват полимерни, метални, въглеродни или керамични материали. Пълнителите могат да се състоят от мустаци, влакна или тел. По-специално, композитните материали включват стоманобетон и железен графит.
Стоманобетонът е един от основните видове строителни материали. Това е комбинация от бетон и стоманена армировка.
Железният графит е керамично-метален материал, състоящ се от желязо (95-98%) и графит (2-5%). От него се изработват лагери, втулки за различни възли на машини и механизми.
Фибростъклото също е композитен материал, който е смес от стъклени влакна и втвърдена смола.
Човешките и животинските кости са композитен материал, състоящ се от два напълно различни компонента: колаген и минерална материя.
Твърдото тяло е едно от четирите основни състояния на материята, с изключение на течност, газ и плазма. Характеризира се със структурна твърдост и устойчивост на промени във формата или обема. За разлика от течността, твърдият обект не тече и не приема формата на съда, в който е поставен. Твърдото вещество не се разширява, за да запълни наличния си обем, както газът.
Атомите в твърдото тяло са тясно свързани един с друг, намират се в подредено състояние във възлите на кристалната решетка (това са метали, обикновен лед, захар, сол, диамант) или са подредени неправилно, нямат стриктна повторяемост в структура на кристалната решетка (това са аморфни тела, като прозоречно стъкло, колофон, слюда или пластмаса).
Кристални тела
Кристалните твърди вещества или кристали имат отличителна вътрешна характеристика - структура под формата на кристална решетка, в която атоми, молекули или йони на дадено вещество заемат определена позиция.
Кристалната решетка води до съществуването на специални плоски лица в кристалите, които отличават едно вещество от друго. Когато е изложена на рентгенови лъчи, всяка кристална решетка излъчва характерен модел, който може да се използва за идентифициране на вещество. Повърхностите на кристалите се пресичат под определени ъгли, които отличават едно вещество от друго. Ако кристалът е разделен, тогава новите лица ще се пресичат под същите ъгли като оригиналното.

Например галенит - галенит, пирит - пирит, кварц - кварц. Кристалните лица се пресичат под прав ъгъл в галенита (PbS) и пирита (FeS 2), под други ъгли в кварца.
Свойства на кристали
- постоянен обем;
- правилна геометрична форма;
- анизотропия - разликата в механичните, светлинните, електрическите и топлинните свойства от посоката в кристала;
- добре дефинирана точка на топене, тъй като зависи от редовността на кристалната решетка. Междумолекулните сили, държащи едно твърдо вещество заедно, са еднакви и е необходимо същото количество топлинна енергия, за да се прекъсне всяко взаимодействие по едно и също време.
Аморфни тела
Примери за аморфни тела, които нямат строга структура и повторяемост на клетките на кристалната решетка са: стъкло, смола, тефлон, полиуретан, нафталин, поливинилхлорид.



Те имат две характерни свойства: изотропност и липса на специфична точка на топене.
Изотропията на аморфните тела се разбира като еднаквост физични свойствавещества във всички посоки.
В аморфно твърдо вещество разстоянието до съседните възли на кристалната решетка и броят на съседните възли варира в целия материал. Следователно, за да се разрушат междумолекулните взаимодействия, е необходимо различно количество топлинна енергия. Следователно аморфните вещества омекват бавно в широк температурен диапазон и нямат ясна точка на топене.
Характеристика на аморфните твърди веществае, че при ниски температури притежават свойствата на твърди вещества, а при повишаване на температурата - свойствата на течности.