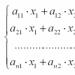Закон на Авогадро
В зората на развитието на атомната теория (), А. Авогадро изложи хипотеза, според която при една и съща температура и налягане равни обеми идеални газове съдържат еднакъв брой молекули. По-късно беше доказано, че тази хипотеза е необходимо следствие от кинетичната теория и сега е известна като закон на Авогадро. Може да се формулира по следния начин: един мол от всеки газ при същата температура и налягане заема същия обем, при нормални условия равен 22,41383 . Това количество е известно като моларен обем на газ.
Самият Авогадро не е оценил броя на молекулите в даден обем, но е разбрал, че това е много голяма стойност. Първият опит да се намери броят на молекулите, заемащи даден обем, е направен през годината J. Loschmidt. От изчисленията на Loschmidt следва, че за въздуха броят на молекулите на единица обем е 1,81·10 18 cm −3, което е приблизително 15 пъти по-малко от истинската стойност. Осем години по-късно Максуел дава много по-точна оценка от „около 19 милиона милиона милиона” молекули на кубичен сантиметър, или 1,9 10 19 cm −3. Всъщност 1 cm³ идеален газ при нормални условия съдържа 2,68675·10 19 молекули. Това количество се нарича число на Лошмид (или константа). Оттогава са разработени голям брой независими методи за определяне на числото на Авогадро. Отличното съответствие между получените стойности предоставя убедителни доказателства за действителния брой молекули.
Измерване на константа
| Данните в тази статия са към декември 2011 г. |
Официално приетата стойност за числото на Авогадро днес е измерена през 2010 г. За целта са използвани две сфери от силиций-28. Сферите са получени в Института за кристалография Лайбниц и полирани в Австралийския център за прецизна оптика толкова гладко, че височината на издатините на повърхността им не надвишава 98 nm. За тяхното производство е използван силиций-28 с висока чистота, изолиран в Института по химия на веществата с висока чистота в Нижни Новгород на Руската академия на науките от силициев тетрафлуорид, силно обогатен на силиций-28, получен в Централния дизайн на машиностроенето Бюро в Санкт Петербург.
Имайки такива практически идеални обекти, е възможно да се изчисли с висока точност броят на силициевите атоми в топката и по този начин да се определи числото на Авогадро. Според получените резултати е равно на 6,02214084(18)×10 23 mol −1 .
Връзка между константи
- Чрез произведението на константата на Болцман, универсалната газова константа, Р=kNА.
- Константата на Фарадей се изразява чрез произведението на елементарния електрически заряд и числото на Авогадро, Е=eNА.
Вижте също
Бележки
Литература
- Числото на Авогадро // Голяма съветска енциклопедия
Фондация Уикимедия. 2010 г.
Вижте какво е "номерът на Авогадро" в други речници:
- (Константа на Авогадро, символ L), константа, равна на 6.022231023, съответства на броя на атомите или молекулите, съдържащи се в един МОЛ от вещество ... Научно-технически енциклопедичен речник
Числото на Авогадро- Avogadro konstanta statusas T sritis chemija apibrėžtis Dalelių (atomų, molekulių, jonų) skaičius viename medziagos molyje, lygus (6.02204 ± 0.000031)·10²³ mol⁻¹. santrumpa(os) Santrumpą žr. Приеде. priedas(ai) Grafinis formatas atitikmenys:… … Chemijos terminų aiškinamasis žodynas
Числото на Авогадро- Avogadro konstanta statusas T sritis fizika atitikmenys: англ. константа на Авогадро; Числото на Авогадро вок. Avogadro Constante, f; Avogadrosche Konstante, е рус. Константа на Авогадро, f; Числото на Авогадро, n пранц. константа на Авогадро, f; nombre… … Fizikos terminų žodynas
Константа на Авогадро (число на Авогадро)- броят на частиците (атоми, молекули, йони) в 1 мол вещество (мол е количеството вещество, което съдържа същия брой частици, колкото има атоми в точно 12 грама от въглеродния изотоп 12), обозначен с символът N = 6.023 1023. Един от ... ... Началото на съвременното естествознание
- (числото на Авогадро), броят на структурните елементи (атоми, молекули, йони или други) в единици. брой va в va (в един кей). Наречен в чест на А. Авогадро, обозначен като NA. A.p. една от основните физически константи, съществена за определяне на множествеността ... Физическа енциклопедия
- (число на Авогадро; обозначено с NA), броят на молекулите или атомите в 1 мол вещество, NA = 6,022045(31) x 1023 mol 1; име на име А. Авогадро... Естествени науки. енциклопедичен речник
- (числото на Авогадро), броят на частиците (атоми, молекули, йони) в 1 мол във ва. Означава се NA и е равно на (6.022045 ... Химическа енциклопедия
Na = (6,022045±0,000031)*10 23 броят на молекулите в мол от всяко вещество или броят на атомите в мол от просто вещество. Една от основните константи, с помощта на която можете да определите величини като например масата на атом или молекула (вижте... ... Енциклопедия на Collier
Wikipedia има статии за други хора с това фамилно име, вижте Авогадро. Амедео Авогадро, граф на Куарегна и Черето Лоренцо Романо Амедео Карло Авогадро ди Куарегна и Черето ... Wikipedia
- (Авогадро, Амедео) АМЕДЕО АВОГАДРО (1776 1856), италиански физик и химик. Роден на 9 август 1776 г. в Торино в семейството на съдебен служител. Получава юридическо образование и през 1796 г. става доктор по право. Още в младостта си започнах да се интересувам от... Енциклопедия на Collier
Книги
- Числото на Авогадро. Как да видим атом, Евгений Залманович Мейлихов, италианският учен Амадео Авогадро (съвременник на А. С. Пушкин) е първият, който разбира, че броят на атомите (молекулите) в един грам-атом (мол) на веществото е еднакъв за всички вещества. Знания... Категория:
Законът на Авогадро е формулиран от италианския химик Амадео Авогадро през 1811 г. и е от голямо значение за развитието на химията по това време. Но дори и днес той не е загубил своята актуалност и значение. Нека се опитаме да формулираме закона на Авогадро, той ще звучи по следния начин.
Формулиране на закона на Авогадро
И така, законът на Авогадро гласи, че при еднакви температури и налягане равни обеми газове ще съдържат еднакъв брой молекули, независимо както от тяхната химична природа, така и от физичните им свойства. Това число е определена физическа константа, равна на броя на молекулите и йоните, съдържащи се в един мол.
Първоначално законът на Авогадро е само хипотеза на учения, но по-късно тази хипотеза е потвърдена от голям брой експерименти, след което навлиза в науката под името „закон на Авогадро“, който е предназначен да се превърне в основен закон за идеалните газове.
Формулата на закона на Авогадро
Самият откривател на закона смята, че физическата константа е голяма величина, но не знае коя. След смъртта му в хода на множество експерименти е установен точният брой атоми, съдържащи се в 12 g въглерод (точно 12 g е единицата за атомна маса на въглерода) или в моларен обем газ, равен на 22,41 литра. Тази константа е наречена "число на Авогадро" в чест на учения, обозначена е като NA, по-рядко L и е равна на 6,022 * 1023. С други думи, броят на молекулите на всеки газ в обем от 22,41 литра ще бъде еднакъв както за леките, така и за тежките газове.
Математическата формула на закона на Авогадро може да бъде записана по следния начин:
Където V е обемът на газа; n е количеството на веществото, което е отношението на масата на веществото към неговата моларна маса; VM е константата на пропорционалността или моларен обем.
Приложение на закона на Авогадро
По-нататъшното практическо приложение на закона на Авогадро значително помогна на химиците да определят химичните формули на много съединения.
Числото на Моле и Авогадро, видео
И накрая, образователно видео по темата на нашата статия.
италиански физик и химик Лоренцо Романо Амедео Карло Авогадророден през 1776 г. в Торино в благородническо семейство. Тъй като по това време е било обичайно професиите да се предават по наследство, Авогадро завършва университета в Торино на 16 години, а на 20 получава степента доктор по църковно право.
От 25-годишна възраст се занимава самостоятелно с физика и математика. И през 1803г годинаАмедео представи първата си научна работа за свойствата на електричеството в Торинската академия. През 1809гна учения е предложена професорска длъжност в колежа на Верчели и от 1820 гУченият успешно преподава в университета в Торино. Занимава се с преподавателска дейност до 1850 г.
Авогадро провежда различни изследвания върху изучаването на физични и химични свойства и явления. Научните му трудове са посветени на електрохимичната теория, електричеството, специфичния топлинен капацитет и номенклатурата на химичните съединения. Авогадро е първият, който определя атомните маси на въглерода, азота, кислорода, хлора и други елементи; установява количествения състав на молекулите на много вещества, включително водород, вода, амоняк, азот и др. Но химиците отхвърлиха теориите на Авогадро и работата на учения не беше призната.
Едва през 1860 г., благодарение на усилията на С. Канизаро, много от произведенията на Авогадро бяха преработени и оправдани. Постоянният брой молекули в 1 мол идеален газ е кръстен на фамилията на учения. – Числото на Авогадро (физическа константа, числено равна на броя на определени структурни единици (атоми, молекули, йони, електрони или всякакви други частици) в 1 мол вещество = 6,0222310 23. От този момент нататък законът на Авогадро започва да се използва широко по химия.
През 1811 г. Авогадро въвежда законкойто твърди, че равни обеми газове съдържат равен брой молекули при еднакви температури и налягания. И през 1814 г. се появява статия на учения„Есе за относителните маси на молекулите на простите тела или изчислените плътности на техните газове и за устройството на някои от техните съединения“, което ясно гласи закона на Авогадро.
Как ученият е стигнал до това заключение?
 Авогадро внимателно анализира резултатите от експериментите на Гей-Люсак и други учении разбра как работи една газова молекула. Известно е, че когато протича химическа реакция между газове, съотношението на обемите на тези газове е същото като тяхното молекулно съотношение. Оказва се, че чрез измерване на плътността на различни газове е възможно да се определят относителните маси на молекулите, от които са съставени тези газове, и на атомите. Тоест, ако 1 литър кислород съдържа толкова молекули, колкото 1 литър водород, тогава съотношението на плътностите на тези газове е равно на съотношението на масите на молекулите. Авогадро отбеляза, че молекулите на простите газове също могат да се състоят от няколко атома.
Авогадро внимателно анализира резултатите от експериментите на Гей-Люсак и други учении разбра как работи една газова молекула. Известно е, че когато протича химическа реакция между газове, съотношението на обемите на тези газове е същото като тяхното молекулно съотношение. Оказва се, че чрез измерване на плътността на различни газове е възможно да се определят относителните маси на молекулите, от които са съставени тези газове, и на атомите. Тоест, ако 1 литър кислород съдържа толкова молекули, колкото 1 литър водород, тогава съотношението на плътностите на тези газове е равно на съотношението на масите на молекулите. Авогадро отбеляза, че молекулите на простите газове също могат да се състоят от няколко атома.
Законът на Авогадро е широко използванпри изчисляване с помощта на химични формули и уравнения на химични реакции ви позволява да определите относителните молекулни маси на газовете и броя на молекулите в мол от всяко вещество.
Ако имате въпроси, искате да разгледате по-подробно този материал или се нуждаете от помощ при решаване на проблеми, онлайн преподавателите винаги са готови да помогнат. По всяко време и навсякъде ученикът може да се обърне към онлайн преподавател за помощ и да получи съвет по всеки предмет от училищната програма. Обучението се осъществява чрез специално разработен софтуер. Квалифицирани преподаватели оказват помощ при попълване на домашни и обясняване на неразбираем материал; помощ при подготовката за държавния изпит и единния държавен изпит. Ученикът сам избира дали да провежда часове с избрания преподавател дълго време или да използва помощта на учителя само в конкретни ситуации, когато възникнат трудности с определена задача.
уебсайт, при пълно или частично копиране на материал се изисква връзка към източника.
Еднакви обеми газове (V) при еднакви условия (температура T и налягане P) съдържат еднакъв брой молекули.
Нека температурата е постоянна (\(T=const \)), налягането не се променя (\(p=const \)), обемът е постоянен \((V=const) \) : \((N) \) - броят на частиците (молекулите) на всеки идеален газ е постоянна стойност. Това твърдение се нарича закон на Авогадро.
Законът на Авогадро звучи така:
Еднакви обеми газове (V) при еднакви условия (температура T и налягане P) съдържат еднакъв брой молекули.
Законът на Авогадро е открит през 1811 г. от Амедео Авогадро. Предпоставката за това беше правилото за множество съотношения: при едни и същи условия обемите на газовете, влизащи в реакцията, са в прости съотношения, като 1:1, 1:2, 1:3 и т.н.
Френският учен J.L. Гей-Лусак установи закона за обемните отношения:
Обемите на реагиращите газове при еднакви условия (температура и налягане) са свързани помежду си като прости цели числа.
Например, 1 литър хлор се комбинира с 1 литър водород, за да се образуват 2 литра хлороводород; 2 литра серен (IV) оксид се комбинират с 1 литър кислород, за да образуват 1 литър серен (VI) оксид.
Реалните газове, като правило, са смес от чисти газове - кислород, водород, азот, хелий и др. Например въздухът се състои от 77% азот, 21% кислород, 1% водород, останалите са инертни и други газове. Всеки от тях създава натиск върху стените на съда, в който се намира.
Парциално наляганеНалягането, което всеки газ създава отделно в смес от газове, сякаш сам заема целия обем, се нарича парциално налягане(от латински partialis - частичен)
Нормални условия: p = 760 mm Hg. Изкуство. или 101,325 Pa, t = 0 °C или 273 K.
Следствия от закона на Авогадро
Следствие 1 от закона на АвогадроЕдин мол от всеки газ при същите условия заема същия обем. По-специално, при нормални условия обемът на един мол идеален газ е 22,4 литра. Този обем се нарича моларен обем\(V_(\mu)\)
където \(V_(\mu)\) е моларният обем газ (размерност l/mol); \(V\) - обем на материята на системата; \(n\) - количеството вещество в системата. Примерен запис: \(V_(\mu)\) газ (n.s.) = 22,4 l/mol.
Следствие 2 от закона на АвогадроСъотношението на масите на равни обеми на два газа е постоянна стойност за тези газове. Това количество се нарича относителна плътност\(Д\)
където \(m_1\) и \(m_2\) са моларните маси на две газообразни вещества.
Стойността \(D\) се определя експериментално като съотношението на масите на равни обеми на изследвания газ \(m_1\) и референтен газ с известна молекулна маса (M2). От стойностите на \(D\) и \(m_2\) можете да намерите моларната маса на изследвания газ: \(m_1 = D\cdot m_2\)
Така при нормални условия (n.s.) моларният обем на всеки газ е \(V_(\mu) = 22,4\) l/mol.
Относителната плътност най-често се изчислява по отношение на въздуха или водорода, като се използват съответно известни и равни моларни маси на водорода и въздуха:
\[ (\mu )_(H_2)=2\cdot (10)^(-3)\frac(kg)(mol) \]
\[ (\mu )_(vozd)=29\cdot (10)^(-3)\frac(kg)(mol) \]
Много често при решаване на задачи се използва, че при нормални условия (n.s.) (налягане на една атмосфера или, което е същото \(p=(10)^5Pa=760\ mm\ Hg,\ t=0^o C \)) моларен обем на всеки идеален газ:
\[ \frac(RT)(p)=V_(\mu )=22,4\cdot (10)^(-3)\frac(m^3)(mol)=22,4\frac(l)( mol)\ . \]
Концентрация на идеални газови молекули при нормални условия:
\[ n_L=\frac(N_A)(V_(\mu ))=2,686754\cdot (10)^(25)m^(-3)\ , \]
наречен номер на Лошмид.
Javascript е деактивиран във вашия браузър.За да извършвате изчисления, трябва да активирате ActiveX контролите!
Законът на Авогадро в химията помага да се изчисли обемът, моларната маса, количеството на газообразното вещество и относителната плътност на газа. Хипотезата е формулирана от Амедео Авогадро през 1811 г. и по-късно е потвърдена експериментално.
закон
Джоузеф Гей-Лусак е първият, който изучава газовите реакции през 1808 г. Той формулира законите на топлинното разширение на газовете и обемните отношения, като получава кристално вещество - NH 4 Cl (амониев хлорид) от хлороводород и амоняк (два газа). Оказа се, че за създаването му е необходимо да се вземат същите обеми газове. Освен това, ако един газ е в излишък, тогава "допълнителната" част остава неизползвана след реакцията.
Малко по-късно Авогадро формулира заключението, че при еднакви температури и налягане равни обеми газове съдържат еднакъв брой молекули. Освен това газовете могат да имат различни химични и физични свойства.

Ориз. 1. Амедео Авогадро.
Законът на Авогадро има две последици:
- първи - един мол газ, при равни условия, заема същия обем;
- второ - съотношението на масите на равни обеми на два газа е равно на отношението на техните моларни маси и изразява относителната плътност на единия газ спрямо другия (обозначава се с D).
Нормални условия (n.s.) се считат за налягане P=101,3 kPa (1 atm) и температура T=273 K (0°C). При нормални условия моларният обем на газовете (обемът на веществото, разделен на неговото количество) е 22,4 l/mol, т.е. 1 мол газ (6,02 ∙ 10 23 молекули - постоянното число на Авогадро) заема обем от 22,4 литра. Моларен обем (V m) е постоянна стойност.

Ориз. 2. Нормални условия.
Разрешаване на проблем
Основното значение на закона е възможността за извършване на химически изчисления. Въз основа на първото следствие от закона можем да изчислим количеството на газообразно вещество чрез обем, като използваме формулата:
където V е обемът на газа, V m е моларният обем, n е количеството вещество, измерено в молове.
Второто заключение от закона на Авогадро се отнася до изчисляването на относителната плътност на газа (ρ). Плътността се изчислява по формулата m/V. Ако вземем предвид 1 мол газ, формулата за плътност ще изглежда така:
ρ (газ) = M/V m,
където М е масата на един мол, т.е. моларна маса.
За да се изчисли плътността на един газ от друг газ, е необходимо да се знаят плътностите на газовете. Общата формула за относителната плътност на газ е следната:
D (y) x = ρ(x) / ρ(y),
където ρ(x) е плътността на единия газ, ρ(y) е плътността на втория газ.
Ако заместите изчислението на плътността във формулата, получавате:
D (y) x = M(x) / V m / M(y) / V m.
Моларният обем се намалява и остава
D (y) x = M(x) / M(y).
Нека разгледаме практическото приложение на закона, като използваме примера на две задачи:
- Колко литра CO 2 ще бъдат получени от 6 mol MgCO 3 по време на разлагането на MgCO 3 в магнезиев оксид и въглероден диоксид (n.s.)?
- Каква е относителната плътност на CO 2 във водорода и във въздуха?
Нека първо решим първия проблем.
n(MgCO3) = 6 mol
MgCO 3 = MgO+CO 2
Количеството магнезиев карбонат и въглероден диоксид е еднакво (по една молекула), така че n(CO 2) = n(MgCO 3) = 6 mol. От формулата n = V/V m можете да изчислите обема:
V = nV m, т.е. V(CO 2) = n(CO 2) ∙ V m = 6 mol ∙ 22,4 l/mol = 134,4 l
Отговор: V(CO 2) = 134,4 l
Решение на втория проблем:
- D (H2) CO 2 = M(CO 2) / M(H 2) = 44 g/mol / 2 g/mol = 22;
- D (въздух) CO 2 = M(CO 2) / M (въздух) = 44 g/mol / 29 g/mol = 1,52.

Ориз. 3. Формули за количеството на веществото по обем и относителна плътност.
Формулите на закона на Авогадро работят само за газообразни вещества. Не са приложими за течности и твърди вещества.
Какво научихме?
Според формулировката на закона равни обеми газове при еднакви условия съдържат еднакъв брой молекули. При нормални условия (n.s.) стойността на моларния обем е постоянна, т.е. V m за газове винаги е равно на 22,4 l/mol. От закона следва, че един и същи брой молекули на различни газове при нормални условия заемат един и същ обем, както и относителната плътност на един газ спрямо друг - отношението на моларната маса на един газ към моларната маса на втори газ.
Тест по темата
Оценка на доклада
Среден рейтинг: 4 . Общо получени оценки: 62.