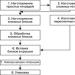
Vrste izomerije u organski spojevi
Izomerija je pojava postojanja izomera.Izomer je stvar koja ima isti sastav atoma, ali različitu strukturu.
A) Strukturni izomer 1) Izomerija ugljikovog skeleta.
Razlikovanje u relativni položaj atomi C.
2) Izomerija prema položaju višestruke veze
(dvostruko).
3) Iz položaja funkcionalne skupine Razlike u položaju funkcionalne skupine u odnosu na ugljikov kostur.
U) Prostorni izomer-I
Povezano s različitim položajem atoma ili skupina atoma u odnosu na dvostruku vezu. (cis-(kupka) i trans-izomeri (fotelja), zrcalna izoerija)
Ograničiti ugljikovodike, njihova kemijska svojstva.
Alkani (parafini) su zasićeni (limitirajući) ugljikovodici s otvorenim lancem. Oni imaju opća formula SnN2n+2, U alkanima su atomi ugljika međusobno povezani samo jednostavnim (jednostrukim) vezama, a preostale valencije ugljika zasićene su atomima vodika. Karakteristični sufiks za zasićene ugljikovodike je an.,
CH4 - metan; C2H6 - etan; S3N8 - propan
S4N10 - butan (2 izomera)
S5N12 - pentan (3 izomera)
S6N14 - heksan, S7N16 - heptan
Kemijska svojstva:
1) Zamjena: CH4+Cl2→CH3Cl+HCl (metil klorid)
CH3Cl+HCl→CH2Cl2+HCl (metilen klorid) CH2Cl2+Cl2→CHCl3+HCl (kloroform)
3) Nitriranje: karakteristika sekundarnog ili tercijarnog atoma ugljika.

Okrug KONOVALOV
4) Na temperaturi od 100-500ºS i pristupu kisika stvaraju se masne kiseline, a na temperaturi od 500-600ºS uočava se proces pucanja
R-I gori CH4+2O2 →CO2+H20(potpuno), 2CH4+O2à2CO+4H2(nepotpuno)
Katalitička oksidacija 2CH3-CH2-CH2-CH3 + 5O2 → 4CH3COOH (octena kiselina),
Reakcija štipanja: (pucketanje)
![]()
Izomerizacija ![]()
![]()
Dobivanje alkana.
Dobivanje metana
u industriji:
1. Frakcioniranje prirodnog plina i destilacija nafte.
2. Sinteza elemenata na visokoj temperaturi (naponski luk),
C + 2H2 →CH4
Kemijske metode dobivanja: 1) Iz soli organskih kiselina. Fuzija natrijevog acetata s alkalijom: CH3COONa + NaOH →CH4 + Na2CO3
2) Wurtz sinteza: CH3Cl+2Na+ClCH2-CH3→2NaCl+C3H8
3) Od organskih spojeva magnezija: CH3Br+Mg→CH3MgBr
CH3MgBr+H2O→CH4+Mg(OH)Br
4) Berthelotova sinteza: C2H5I+HI→C2H6+I2
5) Od alkena
6) Dobivanje halogeniranih alkana. CH3Cl+H2→(p,pt)→CH4+HCl
Pravila orijentacije
1. Supstituenti prisutni u benzenskoj jezgri usmjeravaju novounesenu skupinu na određene položaje, tj. imaju orijentirajući učinak.
2. Prema svom usmjeravajućem djelovanju svi supstituenti se dijele u dvije skupine: orijentatori prve vrste I orijentatori druge vrste.
Orijentanti 1. vrste (orto par-orientants) usmjeravaju naknadnu zamjenu uglavnom u orto- I par- odredbe.
To uključuje donor elektrona grupe (elektronički efekti grupa navedeni su u zagradama):
R( +ja); -Oh (+M,-I); -ILI (+M,-I); -NH2 (+M,-I); -NR 2 (+M,-I)
+M-efekt u ovim skupinama je jači od -Ja-efekta.
Orijentanti 1. vrste povećavaju gustoću elektrona u benzenskom prstenu, posebno na atomima ugljika u orto- I par-položaja, što pogoduje interakciji ovih atoma s elektrofilnim reagensima.  Primjer:
Primjer:

Orijentanti 1. vrste povećanjem gustoće elektrona u benzenskom prstenu povećavaju njegovu aktivnost u reakcijama elektrofilne supstitucije u odnosu na nesupstituirani benzen.
Posebno mjesto među orijentantima I. vrste zauzimaju halogeni koji pokazuju privlačeći elektrone Svojstva:- F (+M<–I
), -Cl (+M<–I
), -Br (+M<–I
).
Biće orto par-orijentanti, usporavaju elektrofilnu supstituciju. Razum je jak – ja-učinak elektronegativnih atoma halogena, što smanjuje gustoću elektrona u prstenu.
Orijentatori 2. vrste ( meta-orijentatori) izravna naknadna zamjena pretežno na meta-položaj.
To uključuje privlačeći elektrone grupe:
-NE 2 (-M, -ja); -COOH (-M, -ja); -CH=0 (-M, -ja); -SO3H (– ja); -NH3+ (– ja); -CCl 3 (– ja).
Orijentanti 2. vrste smanjuju gustoću elektrona u benzenskom prstenu, posebno u orto- I par- odredbe. Stoga elektrofil napada ugljikove atome ne u tim položajima, već u meta-položaj, gdje je gustoća elektrona nešto veća.
Primjer:
Svi orijentanti 2. vrste, smanjujući ukupnu gustoću elektrona u benzenskom prstenu, smanjuju njegovu aktivnost u reakcijama elektrofilne supstitucije.
Stoga se lakoća elektrofilne supstitucije za spojeve (dane kao primjere) smanjuje u nizu:
toluen C 6 H 5 CH 3 > benzen C 6 H 6 > nitrobenzen C 6 H 5 NO 2.
Chem. sveta.
ADICIJE REAKCIJE
1. Hidrogenacija karbonilnih spojeva, poput alkena, odvija se u prisutnosti kata-
liziri (Ni, Pt, Pd). Iz aldehida, tijekom redukcije, nastaju primarni alkoholi.
vi, H-COH + H2 → CH3OH;
2. Dodatak H2O
R-COH+H2O=R-CH(OH)2 (dihidrični alkohol) 3. Interakcija sa senilnom kiselinom R-COH+H-CN=R-CH(OH)(CN) (oksinitril)
4. Interakcija s alkoholima R-COH+R1-OH=R-CH(OR1)(OH)(hemacetal) R-COH+R1-OH=(t* HCl)=R-CH(OR1)(OR1) (acetal )
REAKCIJE SUPSTITUCIJE KARBONILNE SKUPINE
CH3-COH+PCl5→CH3-CHCl2+POCl3
REAKCIJE ZBOG SUPSTITUCIJE U RADIKALU
CH3-COH+Br2=Br-CH2-COH+HBr (bromoacetaldehid)
R.OKSIDACIJA
CH3-COH+Ag2O→CH3COOH+2Ag
R.ALDOL KONCENTRACIJA
CH3COH+ CH3COH→CH3-CH(CH3)-CH2-COH→CH3-CH=CH-COH+H2O
Dobivanje aldehida.
Aldehidi uključuju organske spojeve koji u svom sastavu imaju karbonilnu skupinu S=O, spojenu u aldehidima s jednim radikalom ugljikovodika
1 oksidacija metanola na bakrenom katalizatoru pri 300O
CH3OH + O2 → 2H-COH (formaldehid, mravlja aldehid) + 2H2O;
2. Dehidrogenacija metanola u plinovitoj fazi na katalizatoru (Cu, Ni).CH3OH→H-COH + H2
S2H2 + H2O CH2=CH-OH CH3-COH(octeni anhedron
3 ALKALNA HIDROLIZA DIHALOGENERIVATA
CH3-CHCl2+2NaOH→CH3-C(OH)3+2NaCl→CH3COH+H2O+2NaCl
4. R.KUCHEROVA CH≡CH+H2O→CH3COH
dikarboksilne kiseline.
Karboksilne kiseline su derivati ugljikovodika koji sadrže
jednu ili više karboksilnih skupina. Opća formula za karboksilne kiseline je R-COOH. Karboksilna skupina se pak sastoji od
karbonilne (> C \u003d O) i hidroksilne (-OH) skupine Ovisno o broju karboksilnih skupina, karboksilne kiseline dijelimo na
jednobazične (monokarboksilne), dibazične (dikarboksilne) i polibazične kiseline. To su organski spojevi koji sadrže dvije karboksilne skupine. Dvobazične kiseline
HOOS-COOH oksalni (etandij)
HOOS-CH2-COOH malonski propan
HOOS-CH2-CH2-COOH jantar (butan)
HOOC-CH2-CH2-CH2-COOHpentandioična, glutarna
HOOC-CH2-CH2-COOH jantarna kiselina \u003d (-H2O) \u003d jantarna kiselina
PRIMANJE:
1) oksidacija 2-atomskih alkohola CH2(OH)-CH2(OH)→[O],-H2O→COH-COH→[O]→COOH-COOH
2) iz dihalogenih derivata Cl-CH2-CH2-Cl→(2KCl)→N≡C-CH2-CH2-C≡N→(+6H2O,-2NH3)→HOOC-CH2-CH2-COOH+2H2O
KEMIJSKA ST-VA
1) reakcije supstitucije
COOH-COOH→(+NaOH,-H2O)→COONa-COOH→(+NaOH,-H2O)→COONa-COONa
2) oslobađanje CO2 pri zagrijavanju
COOH-COOH→CO2+HCOOH
COOH-CH2-COOH→CO2+CH3COOH
3) oslobađanje H2O zagrijavanjem
COOH-CH2-CH2-COOH→(t,-H2O)→ (-CH2-COOOC-CH2-)CIKLUS
4) COOH-COOH→[O]→CO2+CO+H2O
5) COOH-CH2-COOH+2C2H5O→CO(O-C2H5)-CH2-CO(O-C2H5)+H2O
6) COOH-CH2-CH2-COOH+2NH4OH→COOHNH4-CH2-CH2-COONH4→(-H2O)→CONH2-CH2-CH2-CONH2→(-NH3)→(-CH2-C(O)-NH-C (O)-CH2-)→(-CH=CH-NH-CH=CH-)
Njega sv-va
1) Har-ny sve reakcije na karboksilnu skupinu-oksidacija
Stvaranje etera
Stvaranje dviju vrsta estera
Raspadanje zagrijavanjem
Otpuštanje vode pri zagrijavanju (alfa kiseline)
Beta kiseline
Gama kiselina
Optička izomerija.
kolamin
Spokojan
Lecitin

![]()
Di- i tripeptidi.
– To su organske tvari čije su molekule građene od povezanih aminokiselina peptidna veza. Ovisno o broju aminokiselina uključenih u molekulu, razlikuju se dipeptidi, tripeptidi itd., Kao i polipeptidi. U pravilu, molekule peptida su linearne, s jednim krajem lanca koji završava karboksilnom skupinom ( -COOH), a drugi s amino skupinom ( -NH2). Ali lanac se također može zatvoriti u cikličku strukturu. Adicija se događa zbog oslobađanja vode iz karbonilne skupine jednog a/c i amino skupine drugog. Budući da se proteini sintetiziraju u obliku polipeptidnih lanaca, granica između polipeptida i jednostavnog proteina je proizvoljna. Peptidi su mnoge važne tvari za organizam - neki hormoni, antibiotici, toksini.
Nukleozidi i nukpeotidi.
Nukleinske kiseline sastoje se od mononukleotida. Nukleotid sastoji se od tri komponente: 1 .dušične baze (purin ili perimedin), 2 .šećer: riboza (C 5 H 10 O 5) ili deoksiriboza C 5 H 10 O 4 ., fosforna kiselina. Purinske baze. Predak je PUREEN:
pirimidinske baze. PIRIMIDIN:
dušične baze: AMFadenozin monofosfat (adenilna kiselina):
ATP adenozin trifosfat:
Nukleozidi su nukleotidi bez fosforna kiselina. Adenozin:
Priključak fosforne kiseline moguć je u tri položaja hidroksogrupe riboze: 2, 3, 5. Adenin, guanin i citozin uključeni su iu DNA i RNA. Timin - samo u DNK, uracil - samo u RNK.
Shema strukture RNA i DNA.
struktura DNK: Lanac DNA je ugljikohidratno-fosfatni niz na koji su vezane dušične baze. Molekule fosforne kiseline spajaju molekule oksiriboze, OH 3 i 5 ugljikove skupine. Molekula DNA ima 2 lanca nukleotida međusobno paralelna. Ova dva lanca drže zajedno vodikove veze. Komplementarnost osigurava isti razmak između dušičnih baza. Redoslijed dušičnih baza jednog lanca strogo odgovara nizu baza drugog lanca.
struktura RNA. lanac RNK to je niz ribonukleotida povezanih u jedan lanac. (linearna struktura) . Međusobna veza ribonukleotida ostvaruje se eterskom vezom između 3. -ON riboze od jednog nukleotida i 5 -ON riboza sljedećeg nukleotida. Dušične baze RNK su A i G (purin) te C i U (pirimidin). A i G su spojeni na pentozu preko N 9. pozicija. C i U - kroz atom N na 1. poziciji. Posebnost DNA od RNA je da nema stabilnu spiralnu strukturu. Ona je linearna. RNA)
Dijaliza. elektroforeza.
Dijaliza je metoda pročišćavanja otopina proteina od nečistoća niske molekulske mase. Za dijalizu je potreban cilindar u kojem se umjesto dana nalazi PPM, čije pore propuštaju male molekule, ali ne prolaze molekule proteina. Cilindar s otopinom proteina s nečistoćama uronjen je u posudu s destiliranom vodom. Male molekule nečistoća slobodno prolaze kroz pore membrane, ravnomjerno raspoređene između područja unutar i izvan cilindra. Za potpuno čišćenje, cilindar mora biti uronjen u tekuću vodu. Dijaliza se koristi za pročišćavanje proteinskih otopina u farmaceutskoj industriji. Ova metoda je u podlozi "umjetnog bubrega".
Elektroforeza je metoda razdvajanja proteina u zasebne frakcije. Rad eff aparata temelji se na sposobnosti nabijenih proteinskih molekula da se kreću u električnom polju prema suprotno nabijenoj elektrodi. Različite molekule - različite brzine, ovisno o molekularnoj težini, ukupnom naboju, obliku. Uređaj za ef sastoji se od horizontalnog nosača (helij) i elektroda koje stvaraju električno polje. Na nosač se nanosi otopina s elektrolitima. Ispitna otopina se nanosi na početnu zonu i primjenjuje se napon. Nakon određenog vremena, proteini s različitim Molekularna težina raspoređeni po zonama. Iz svake zone, proteini se mogu ekstrahirati i kvantificirati.
Kataliza. Vrste kataliza.
Kataliza je kemijski fenomen čija je bit promjena brzine kemijske reakcije pod djelovanjem određenih tvari (nazivaju se katalizatori).
Homogena kataliza – katalizator i reaktanti su u istoj fazi.
Heterogena kataliza - katalizator je obično čvrst, a reakcija se odvija na njegovoj površini.
Adsorpcija, suština, značenje.
Adsorpcija je taloženje čestica na površini adsorbensa. Aktivni ugljen u plinskim maskama štiti od djelovanja otrovnih plinova.
67) Kromatografija:
Kromatografija je metoda za odvajanje i analizu smjesa tvari i proučavanje fizikalnih kemijska svojstva tvari, temelji se na raspodjeli komponenata između dvije faze: pokretne i nepokretne. Nepokretan služi čvrsta(sorbent) ili film tekućine nataložen na krutinu. Mobilna faza je tekućina ili plin koji teče kroz stacionarnu fazu. Moguće je pročistiti tvar od nečistoća.
Fenomen difuzije.
Difuzija je jednostrani prijelaz otopljene tvari iz više koncentracije u nižu.
Vrste kemijske veze u organskim spojevima
Kovalentna veza je intramolekularna kemijska veza, koju provodi jedan ili više parova elektrona, koji su u snažnoj interakciji s jezgrama oba povezana atoma.
Sigma veza - veza nastala kao rezultat preklapanja elektronskih oblaka i smještena na ravnoj liniji koja povezuje središta jezgri atoma.
Pi - veza - veza nastala kao rezultat preklapanja elektronskih oblaka i smještena izvan ravne linije koja povezuje središta jezgri atoma.
1. Elektronska struktura ugljikovog atoma;
2. Hibridizacija atomskih orbitala;
3. Priroda kemijske veze;
4. Vrste kemijske veze.
Pri stvaranju kemijske veze dolazi do oslobađanja energije, pa pojava dviju novih valentnih mogućnosti dovodi do oslobađanja dodatne energije (1053,4 kJ/mol), koja premašuje energiju utrošenu na rasparivanje 2s elektrona (401 kJ/mol).
Orbitale različitih oblika (s, p) se tijekom stvaranja veze miješaju, dajući nove ekvivalentne hibridizirane orbitale (teorija hibridizacije, L. Pauling, D. Slater, 1928.-1931.). Koncept hibridizacije odnosi se samo na molekule, ne i na atome, au hibridizaciju ulaze samo orbitale, ne i elektroni na njima.
Za razliku od nehibridiziranih s- i p-orbitala, hibridna orbitala je polarna (elektronska gustoća je pomaknuta) i sposobna je stvarati jače veze.

Valentna stanja ugljikovog atoma
|
Vratilo. komp. |
međusobno djelujući orbitale |
Prostor stranica |
Vrsta komunikacije |
Vratilo. kutak |
|
|
tetraedarski | |||
|
| ||||
|
|
linearni |
Promjenom vrste hibridizacije ugljikovog atoma mijenjaju se i njegova svojstva. Pri prijelazu iz sp 3 u sp- povećava se udio s-orbitale u sastavu hibridiziranog oblaka, što povlači za sobom promjenu njegovog oblika. Granice elektronskog oblaka bliže su jezgri u slučaju sp 2 i sp-orbitala, u usporedbi s sp 3 oblakom. To se ogleda u povećanju elektronegativnosti ugljikovog atoma u nizu: sp 3< sp 2 < sp. В связи с этим, уменьшается ковалентный радиус, увеличивается полярность связи.
Vrste kemijske veze
Ionska veza
Javlja se u slučaju potpunog oslobađanja elektrona od strane nekih atoma i njihovog preuzimanja od strane drugih. U tom slučaju atomi se pretvaraju u ione.
kovalentna veza
Nastaje dijeljenjem elektrona. Vezanje atoma u molekulu provodi elektronski par koji pripada istovremeno dvama atomima. Socijalizacija elektrona moguća je na dva načina:
1) koligacija (mehanizam razmjene);
2) koordinacija (donor-akceptorski mehanizam).
Postoje dvije vrste kovalentnih veza: σ (sigma)- i π (pi)-veza.

σ-veza je jednostruka kovalentna veza koja nastaje kada se atomske orbitale preklapaju duž ravne linije (osi) koja povezuje jezgre dvaju vezanih atoma s maksimalnim preklapanjem na ovoj ravnoj liniji.
π-veza je veza nastala bočnim preklapanjem nehibridiziranih str z-atomske orbitale s maksimalnim preklapanjem s obje strane pravca koji povezuje jezgre atoma.
Kvantitativne karakteristike kovalentne veze
1. Energija veze je energija koja se oslobađa tijekom stvaranja veze ili je potrebna za njezin prekid.
2. Duljina veze je udaljenost između središta vezanih atoma.
3. Polaritet veze – neravnomjerna raspodjela gustoće elektrona.
4. Polarizabilnost veze - pomicanje elektrona veze pod vanjskim utjecajem električno polje, uključujući drugu česticu koja reagira.
Međumolekulske interakcije

| Naziv parametra | Značenje |
| Naslov članka: | Kemijske veze u organskim spojevima |
| Rubrika (tematska kategorija) | Obrazovanje |
Većina organskih spojeva sadrži samo nekoliko osnovnih elemenata: ugljik, vodik, dušik, kisik, sumpor, a znatno rjeđe druge elemente. Τᴀᴋᴎᴍ ᴏϬᴩᴀᴈᴏᴍ, cjelokupna raznolikost organskih spojeva određena je, s jedne strane, njihovim kvalitativnim i kvantitativnim sastavom, as druge strane, redoslijedom i prirodom veza između atoma.
1.1 Elektronegativnost elemenata
Elektronegativnost atoma - ϶ᴛᴏ njegova sposobnost da privlači elemente. Vrijednosti elektronegativnosti nemaju značaj konstanti, već samo pokazuju relativnu sposobnost atoma da privuku elektrone jače ili slabije kada se formiraju s drugim atomima.
Atomi koji se nalaze u nizu elektronegativnosti prije ugljika i imaju vrijednost elektronegativnosti manju od 2,5 povećavaju gustoću elektrona na atomu ugljika kada formiraju vezu s njim. Suprotno tome, atomi čija vrijednost elektronegativnosti prelazi 2,5 smanjuju gustoću elektrona na atomu ugljika kada se formira veza.
1.2 Ionska veza
Elektronska konfiguracija za bilo koji atom može se formirati na dva različita načina. Jedan od njih je prijenos elektrona: atomi jednog elementa doniraju elektrone, koji se prenose na atome drugog elementa. U ovom slučaju radi se o tzv ionska (elektrovalentna, heteropolarna) veza:
Atom koji predaje elektrone postaje pozitivan ion kation); atom koji je primio elektron u negativni ion ( anion).
Posebnosti ionskih spojeva su trenutne reakcije, disocijacija i otapanje iona u vodenim otopinama, visoka tališta i vrelišta, topljivost u polarnim otapalima, električna provodljivost otopine i taline.
Heteropolarna veza javlja se između atoma koji su vrlo različite u elektronegativnosti.
1.3 Kovalentna veza
U međudjelovanju atoma jednake ili bliske elektronegativnosti ne dolazi do prijenosa elektrona. Formiranje elektroničke konfiguracije za takve atome događa se kao rezultat generalizacije dva, četiri ili šest elektrona međudjelovanjem atoma. Svaki od generaliziranih parova elektrona čini jedan kovalentna (homeopolarna) veza:
Najvažniji fizički parametri kovalentne veze su one koje karakteriziraju njihovu simetriju, veličinu, električna i termokemijska svojstva.
Duljina veze- ϶ᴛᴏ je ravnotežna udaljenost između središta jezgri i ovisi o tome s kojim su drugim atomima povezani. Da, duljina C-C veze ovisno o okolini varira unutar 0,154 - 0,14 nm.
Valentni kutovi su kutovi između linija koje povezuju vezane atome. Poznavanje duljina veza i veznih kutova iznimno je važno za izgradnju ispravnog prostornog modela, razumijevanje distribucije gustoće elektrona i koristi se u kvantno-kemijskim proračunima.
Energija kidanja kemijske veze- ϶ᴛᴏ energija potrošena na kidanje ove veze ili oslobođena tijekom njezinog stvaranja po molu čestica. U slučaju molekula koje sadrže dvije ili više identičnih veza, razlikuje se energija prekida jedne od tih veza ili prosječna energija prekida tih veza. Što je veća energija kemijske veze, to jača veza. Veza se smatra snažnom ili jakom ako joj energija prelazi 500 kJ/mol, slabom ako joj je energija manja od 100 kJ/mol. Ako se međudjelovanjem atoma oslobađa energija manja od 15 kJ/mol, tada se smatra da ne nastaje kemijska veza, već se uočava međumolekulska interakcija. Snaga veze obično opada s povećanjem duljine veze.
Polaritet kemijskih veza- karakteristika kemijske veze, koja pokazuje promjenu u distribuciji gustoće elektrona u prostoru oko jezgri u usporedbi s distribucijom gustoće elektrona u neutralnim atomima koji tvore ovu vezu. Poznavanje polariteta veze iznimno je važno za prosuđivanje distribucije gustoće elektrona u molekuli, a time i prirode njezine reaktivnosti.
Polarizabilnost komunikacije izraženo u pomaku elektrona veze pod utjecajem vanjskog električnog polja, uklj. i druga čestica koja reagira. Polarizabilnost je određena pokretljivošću elektrona. Elektroni su pokretljiviji što su dalje od jezgre.
1.4 Prekidanje veza
Prekidanje kovalentne veze između dva atoma može se dogoditi na različite načine:
Kada A svaki atom je odvojen s jednim elektronom, što dovodi do stvaranja čestica koje se nazivaju radikali i vrlo su reaktivni zbog prisutnosti nesparenog elektrona; taj se razmak zove homolitičko cijepanje veze. U slučajevima b I V jedan atom može držati oba elektrona, ostavljajući drugi atom bez elektrona, što rezultira negativnim odnosno pozitivnim ionom. Ako atomi R i X nisu identični, cijepanje se može nastaviti duž jedne od ovih staza, ovisno o tome koji atom - R ili X - drži par elektrona. Takvi se prekidi nazivaju heterolitičko cijepanje te dovode do stvaranja ionskog para.
Kemijske veze u organskim spojevima - pojam i vrste. Klasifikacija i značajke kategorije "Kemijske veze u organskim spojevima" 2017., 2018.
Zadatak broj 1
Obrazloženje:
1) Dehidrohalogeniranje klorobutana pod djelovanjem alkoholne otopine lužine:
2) Oksidacija dvostruke veze butena-1 zakiseljenom otopinom kalijeva permanganata (prekid dvostruke veze):
3) Reakcija esterifikacije - nastajanje estera iz alkohola i karboksilne kiseline:
4) Alkalna hidroliza izopropil propionata uz stvaranje natrijevog propionata i izopropil alkohola:
5) Fuzija soli propionske kiseline s alkalijama da se dobije etan i natrijev karbonat:
Zadatak broj 2
Napišite jednadžbe reakcija koje se mogu koristiti za izvođenje sljedećih transformacija:
Obrazloženje:
1) Iz natrijevog acetata, metan se dobiva reakcijom dekarboksilacije koja se javlja kada se stopi s alkalijom, na primjer, natrijevim hidroksidom:
2) Kada metan stupa u interakciju s klorom u molarnom omjeru jedan prema jedan, nastaju pretežno monoklorometan (X 1) i klorovodik:
3) Kada se monoklorometan tretira s vodenom otopinom lužine, dolazi do nukleofilne supstitucije atoma klora hidroksilnom skupinom uz stvaranje metilnog alkohola (X 2):
4) Metanal (formaldehid) se može dobiti iz metilnog alkohola tako što se zagrijavanjem ponaša kao slabo oksidacijsko sredstvo - bakrov (II) oksid:
5) Kalijev permanganat, zakiseljen sumpornom kiselinom, oksidira metanal u ugljikov dioksid i vodu. U isto vrijeme, budući da je otopina kisela, permanganatni ion se reducira u dvovalentni mangan:
Zadatak broj 3
Napišite jednadžbe reakcija koje se mogu koristiti za izvođenje sljedećih transformacija:
Pri pisanju jednadžbi reakcija koristite strukturne formule organska tvar.
Obrazloženje:
1) Kada bromovodik djeluje na propanol-1, dolazi do reakcije supstitucije hidroksilne skupine u alkoholu za atom broma uz stvaranje 1-brompropana (X 1)
2) Možete dobiti propen iz 1-brompropana reakcijom dehidrobromiranja s alkoholnom otopinom lužine, na primjer, natrijevog hidroksida:
3) U kiseloj sredini propen može reagirati s vodom u skladu s Markovnikovljevim pravilom - vodik ide na najhidrogeniraniji atom, a hidroksilna skupina na najmanje hidrogeniran. Ovo proizvodi izopropil alkohol:
4) Izopropilni alkohol (X 2), kada se oksidira s kalijevim permanganatom u vodenoj otopini, prelazi u aceton, dok, budući da je medij otopine neutralan, permanganatni ion se reducira iz oksidacijskog stanja +7 u oksidacijsko stanje +4 - nastaje mangan dioksid:
5) Aceton se može pretvoriti u izopropanol (X 2) reakcijom hidrogenacije pri zagrijavanju, koristeći katalizator hidrogenacije kao što je nikal:
Zadatak broj 4
Napišite jednadžbe reakcija koje se mogu koristiti za izvođenje sljedećih transformacija:
Pri pisanju jednadžbi reakcija koristiti strukturne formule organskih tvari.
1) Kada se sol karboksilne kiseline kalcinira s viškom lužine, nastaje ugljikovodik, u ovom slučaju benzen (X 1):
2) Benzen ulazi u reakciju alkilacije s propenom u prisutnosti kiselih katalizatora i nastaje kumen (X 2):
3) Kumen reagira s klorom na svjetlu lančano radikalnim mehanizmom. S nedostatkom klora uglavnom se zamjenjuje atom vodika na tercijarnom atomu ugljika:
4) Kada se derivat klora izloži alkoholnoj otopini lužine, klorovodik se odvaja:
5) U posljednjoj reakciji, na prvi pogled, moglo bi se pomisliti da dolazi do pretvorbe ugljikovodika s dvostrukom vezom u odgovarajući diol, ali da bi nastao glikol potrebno je hlađenje (0-10 °C), a ne grijanje. Kada se zagrijava, doći će do duboke oksidacije u kalijev benzoat i kalijev karbonat.
Problem je u tome što je, očito, u ovom zadatku FIPI banke, koji je nekima usput naišao na ranom USE ispitu u travnju 2016., greška, a mislilo se na 0 o C, a ne na grijanje.
Zadatak broj 5
Napišite jednadžbe reakcija koje se mogu koristiti za izvođenje sljedećih transformacija:
Pri pisanju jednadžbi reakcija koristiti strukturne formule organskih tvari.
1) Pri djelovanju na bromoetan Vodena otopina lužine, dolazi do nukleofilne supstitucije atoma broma za hidroksidni ion, uz stvaranje etilnog alkohola (X 1):
2) Etilni alkohol (X 1) može se pretvoriti u octenu kiselinu oksidacijom s vodenom otopinom kalijevog permanganata u kiselom mediju kada se zagrijava:
3) Octena kiselina ulazi u reakciju neutralizacije s alkalijama, na primjer, s natrijevim hidroksidom, i nastaje natrijev acetat (X 2):
4) Nakon isparavanja vodene otopine natrijevog acetata (X 2) i fuzije dobivenog krutog natrijevog acetata s krutim natrijevim hidroksidom dolazi do reakcije dekarboksilacije uz stvaranje metana (X 3) i natrijevog karbonata:
5) Piroliza metana na 1500 o C dovodi do stvaranja acetilena (X 4) i vodika:
Zadatak broj 6
Napišite jednadžbe reakcija koje se mogu koristiti za izvođenje sljedećih transformacija:
Pri pisanju jednadžbi reakcija koristiti strukturne formule organskih tvari.
1) Propil acetat, budući da je ester, podvrgava se alkalnoj hidrolizi da nastane kalij acetat (X 1) i propanol:
2) Iz kalijevog acetata, reakcijom dekarboksilacije koja nastaje pri spajanju s alkalijom, dobiva se metan:
3) Na temperaturi od 1200 o C i brzom hlađenju (kako bi se spriječilo raspadanje acetilena na jednostavne tvari) metan se razlaže na acetilen (X 2) i vodik:
4) Dimerizacija acetilena događa se u prisutnosti katalizatora - otopine klorovodične kiseline bakra (I) i amonijevih klorida - uz stvaranje vinilacetilena:
5) Kada vinilacetilen prolazi kroz bromnu vodu, bromna voda postaje obezbojena zbog adicije broma na višestruke veze uz stvaranje zasićenog bromo derivata butana - 1,1,2,2,3,4-heksabromobutana (X 3 ):
Zadatak broj 7
Napišite jednadžbe reakcija koje se mogu koristiti za izvođenje sljedećih transformacija:
Pri pisanju jednadžbi reakcija koristiti strukturne formule organskih tvari.
1) U industriji se formaldehid proizvodi oksidacijom metana na aluminij fosfatnom katalizatoru pri temperaturi od 450 o C i tlaku od 1-2 MPa:
2) Tijekom hidrogenacije na katalizatorima (Pt, Pd, Ni) karbonilna skupina formaldehida reducira se u hidroksilnu, tj. aldehid prelazi u alkohol - metanol (X 1):
3) Metalni natrij reagira s metanolom pri čemu nastaje natrijev metoksid (X 2) i oslobađa vodik:
4) Reagiranje sa klorovodična kiselina, natrijev metoksid se pretvara natrag u metanol (X 1):
5) Kalijev permanganat u kiselom mediju, kada se zagrijava, oksidira metilni alkohol u ugljikov dioksid (X 3) (Mn +7 → Mn +2; C -2 → C +4):
Zadatak broj 8
Napišite jednadžbe reakcija koje se mogu koristiti za izvođenje sljedećih transformacija:
1) U prisutnosti aluminijevog oksida na temperaturi od 400 o C alkohol se dehidrira uz stvaranje etilena (X 1) i vode:
2) Kalijev permanganat u neutralnom mediju oksidira etilen u etilen glikol (X 2) (Mn +7 → Mn +4; 2C -2 → 2C -1):
3) Pod djelovanjem viška bromovodika na etilen glikol, hidroksilne skupine se zamjenjuju anionima broma, što rezultira stvaranjem 1,2-dibromoetana (X 3):
4) Etin (ili acetilen) može se dobiti djelovanjem alkoholne otopine lužine na 1,2-dibromoetan:
5) Prema reakciji M.G. Kucherov, u prisutnosti živinih soli u kiselom mediju (u vodenoj ili alkoholnoj otopini), acetilen se pretvara u etanal:
Zadatak broj 9
Napišite jednadžbe reakcija koje se mogu koristiti za izvođenje sljedećih transformacija:
1) Aceton (propanon) možete dobiti reakcijom M.G. Kucherov, djelujući na propin (X 1) s vodom u prisutnosti živinih soli u kiseloj sredini (u vodenoj ili alkoholnoj otopini):
2) Tijekom hidrogenacije na katalizatorima (Pt, Pd, Ni), karbonilna skupina ketona se reducira u hidroksilnu, tj. keton prelazi u sekundarni alkohol - izopropanol (X 2):
3) Pod djelovanjem bromovodika na izopropanol dolazi do nukleofilne supstitucije hidroksilne skupine za anion broma, što rezultira stvaranjem 2-brompropana:
4) Pod djelovanjem alkoholne otopine lužine, 2-brompropan prelazi u nezasićeni ugljikovodik - propilen (X 3):
5) Dehidrogenacijom propilena na katalizatoru (Pt, Pd, Ni) može se dobiti propin (X 1):
Zadatak broj 10
Napišite jednadžbe reakcija koje se mogu koristiti za izvođenje sljedećih transformacija:
1) Bromometan se može dobiti djelovanjem broma na metan (X 1) na svjetlu. Reakcija supstitucije odvija se prema mehanizmu slobodnih radikala:
2) Pri reakciji bromometana s amonijakom prvo nastaje aminska sol koja s viškom amonijaka prelazi u slobodni amin. U slučaju metilamina nastaju metilamin (X 2) i amonijev bromid:
3) Dušična kiselina nestabilan, pa se dobiva tijekom reakcije, djelujući na zakiseljenu otopinu amina s natrijevim nitritom. U slučaju primarnog amina, metilamina, oslobađa se dušik, a u otopini nastaje metanol (X 3):
4) Djelovanjem na metilni alkohol s bakrovim (II) oksidom, zagrijavanjem dobivamo formaldehid, dok će se Cu + 2 reducirati u Cu 0:
5) Kada se formaldehid oksidira kalijevim permanganatom u kiseloj sredini, oslobađa se ugljikov dioksid (X 4) (Mn +7 → Mn +2; C 0 → C +4):
Zadatak broj 11
Napišite jednadžbe reakcija koje se mogu koristiti za izvođenje sljedećih transformacija:
1) Alkani s glavnim lancem od 6 ili više ugljikovih atoma mogu ući u reakciju dehidrociklizacije, dok se rezultirajući šesteročlani prsten dalje dehidrogenira i pretvara u energetski stabilniji benzenski prsten aromatskog ugljikovodika. U ovom slučaju, dobiveni cikloheksan se dehidrogenira u benzen (X 1):
2) Alkilacija aromatskih ugljikovodika u alkil halogenide i u prisutnosti bezvodnog AlCl 3 je klasičan primjer Friedel-Craftsove reakcije. Reakcija je elektrofilna supstitucija na benzenskom prstenu. Alkilacija benzena metil kloridom dovodi do stvaranja toluena (X 2):
3) Kada se toluen izloži suvišku klora na svjetlu, svi atomi vodika u metilnom radikalu toluena zamijenjeni su klorom. Reakcija supstitucije odvija se prema mehanizmu slobodnih radikala:
4) Tijekom alkalne hidrolize trihalogenida s atomima klora na jednom atomu ugljika nastaju soli karboksilnih kiselina u visokim prinosima (u ovom slučaju kalijev benzoat (X 3)):
5) Iz kalijevog benzoata, reakcijom dekarboksilacije koja nastaje spajanjem s alkalijom, dobiva se benzen (X 1):
Zadatak broj 12
Napišite jednadžbe reakcija koje se mogu koristiti za izvođenje sljedećih transformacija:
1) 1,2-dikloroetan je geminalni dikloro derivat etana. U uvjetima vodene otopine lužine, 1,2-dikloroetan se pretvara u karbonilni spoj - acetaldehid:
2) Kada se karbonilni spojevi reduciraju vodikom, nastaju alkoholi. Dakle, prolazeći smjesu acetaldehida i vodikovih para preko nikalnog katalizatora, možete dobiti etanol (X 1):
3) Supstitucija hidroksilne skupine alkohola amino skupinom događa se u teškim uvjetima. Propuštanjem para etanola i amonijaka preko zagrijanog aluminijevog oksida dobiva se etilamin:
4) Kada ugljikov dioksid prolazi kroz vodenu otopinu etilamina, nastaje etilamonijev bikarbonat (X 2):
5) Zagrijavanjem se etilamonijev bikarbonat raspada na ugljikov dioksid, etilamin (X 3) i vodu:
Zadatak broj 13
Napišite jednadžbe reakcija koje se mogu koristiti za izvođenje sljedećih transformacija:
1) Acetilen (etin) ulazi u reakciju hidratacije u prisutnosti živinih soli u vodenoj otopini uz stvaranje acetaldehida (Kucherovljeva reakcija) (X 1):
2) Acetaldehid, kada je izložen zakiseljenoj vodenoj otopini kalijevog permanganata, pretvara se u octenu kiselinu:
3) Octena kiselina ulazi u reakciju neutralizacije s natrijevim hidroksidom, pri čemu nastaju natrijev acetat (X 2) i voda:
4) Natrijev acetat reagira s haloalkanima pri čemu nastaju esteri, u ovom slučaju nastaje metilni ester octene kiseline (metil acetat) (X 3):
5) Esteri u prisutnosti kiselina mogu stupiti u reakciju hidrolize. Hidrolizom metil acetata u kiselom mediju nastaje octena kiselina i metanol:
Zadatak broj 14
Napišite jednadžbe reakcija koje se mogu koristiti za izvođenje sljedećih transformacija:
1) Pod djelovanjem alkoholne otopine lužine na bilo koji od izomera dibromoetana nastaje acetilen (X 1):
2) Djelovanjem na acetilen (X 1) s vodom u prisutnosti živinih soli u kiseloj sredini (u vodenoj ili alkoholnoj otopini) dobiva se acetaldehid (X 2) (reakcija M.G. Kucherova):
3) Kada se acetaldehid oksidira s kalijevim permanganatom u kiselom mediju, nastaje octena kiselina (Mn +7 → Mn +2; C +1 → C +3):
4) Kloroctena kiselina može se dobiti djelovanjem klora na octenu kiselinu na svjetlu. Reakcija supstitucije odvija se prema mehanizmu slobodnih radikala, pri čemu se atom vodika na alkilnom radikalu zamjenjuje klorom (X 3):
5) Kada se klorooctena kiselina tretira amonijakom, nastaje aminokiselina - glicin:
Zadatak broj 15
Napišite jednadžbe reakcija koje se mogu koristiti za izvođenje sljedećih transformacija:
1) Na temperaturama iznad 140 0 C u prisutnosti koncentrirane sumporne kiseline alkoholi prolaze kroz intramolekularnu dehidraciju uz stvaranje alkena i vode. U ovom slučaju pri 180 0 C i djelovanju konc. H 2 SO 4 propanol-1 prelazi u propilen (X 1):
2) Kada propilen prolazi kroz bromnu vodu, uočava se promjena boje bromne vode zbog dodavanja broma na dvostruku vezu uz stvaranje 1,2-dibrompropana (X 2):
3) Pod djelovanjem alkoholne otopine lužine na 1,2-dibrompropan nastaje propin:
4) Djelovanjem na propin s vodom u prisutnosti živinih soli u kiselom mediju (u vodenoj ili alkoholnoj otopini) dobiva se aceton (X 3) (reakcija M.G. Kucherova):
5) Prolaskom smjese acetona i vodikovih para preko paladijevog katalizatora dobiva se propanol-2 (ili izopropanol) (X 4):
Zadatak broj 16
Napišite jednadžbe reakcija koje se mogu koristiti za izvođenje sljedećih transformacija:
1) Ciklopropan dodaje bromovodik s otvaranjem prstena, što rezultira stvaranjem 1-brompropana:
2) U laboratorijskim uvjetima alkani se dobivaju Wurtz-ovom reakcijom iz haloalkana. Djelomični pozitivni naboj na ugljikovom atomu na halogenu u halogenim derivatima omogućuje tim spojevima da reagiraju s aktivnim metalima. Monohaloalkani već na sobnoj temperaturi stupaju u interakciju s natrijem, pretvarajući se u alkane s dvostrukim ugljikovim skeletom. Tako se iz dvije molekule 1-bromopropana dobije n-heksan (X 1):
3) Alkani koji imaju šest ili više atoma ugljika u molekuli mogu stupiti u složenije reakcije dehidrogenacije, tijekom kojih je eliminacija vodika popraćena zatvaranjem lanca u ciklusu: reakcije dehidrogenacije - ciklizacije. U ovom slučaju heksan prelazi u benzen (X 2):
4) Toluen se dobiva alkilacijom benzena s metil halidom u prisutnosti AlCl 3 katalizatora (elektrofilna supstitucija, S E mehanizam):
5) Metilna skupina toluena oksidira se kalijevim permanganatom u kiselom mediju u karboksilnu skupinu, stoga se toluen pretvara u benzojevu kiselinu (X 3) (Mn + 7 → Mn + 2; C -3 → C + 3) :
Zadatak broj 17
Napišite jednadžbe reakcija koje se mogu koristiti za izvođenje sljedećih transformacija:
1) U laboratorijskim uvjetima, propan se može dobiti Wurtz-ovom reakcijom iz haloalkana - kloroetana i klorometana, međutim, ova reakcija je povezana s stvaranjem dva nusprodukta - butana i etana. Monohaloalkani na sobnoj temperaturi mogu djelovati s natrijem:
2) Dehidrogenacijom propana na katalizatoru (Pt, Pd, Ni) može se dobiti propilen (X 1):
3) Kada se alken oksidira permanganatom u neutralnom mediju na hladnom, nastaju dihidrični alkohol, alkalijski i manganov (IV) oksid. U ovom slučaju, propandiol-1,2 (X 2) nastaje iz propilena (Mn +7 → Mn +4; C -2 → C -1, C -1 → C 0):
4) Polihidrični alkoholi mogu ući u reakcije nukleofilne supstitucije s halogenovodicima. Djelovanjem suviška bromovodika na propandiol-1,2,1,2-dibrompropan (X 3) dobiva se:
5) Pod djelovanjem alkoholne otopine lužine na dihaloalkan - 1,2-dibrompropan - nastaje propin (X 4).