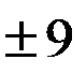По време на урока ще можете да проверите знанията си по темата „Единен държавен изпит. Електролитна дисоциация на соли, киселини, основи. Йонообменни реакции. Хидролиза на соли." Ще разгледате решаването на задачи от Единния държавен изпит А, Б и В група нататък различни теми: “Разтвори и техните концентрации”, “Електролитна дисоциация”, “Йонообменни реакции и хидролиза”. За да разрешите тези проблеми, в допълнение към познанията по разглежданите теми, вие също трябва да можете да използвате таблицата за разтворимост на веществата, да знаете метода на електронния баланс и да имате разбиране за обратимостта и необратимостта на реакциите.
Тема: Разтвори и тяхната концентрация, дисперсни системи, електролитна дисоциация
Урок: Единен държавен изпит. Електролитна дисоциация на соли, киселини, основи. Йонообменни реакции. Хидролиза на соли
аз. Изберете една правилна опция от 4 предложени.
|
Въпрос |
Коментар |
|
A1. Силни електролити са: |
По дефиниция силните електролити са вещества, които напълно се разпадат на йони във воден разтвор. CO 2 и O 2 не могат да бъдат силни електролити. H 2 S е слаб електролит. Верният отговор е 4. |
|
A2. Веществата, които се дисоциират само на метални йони и хидроксидни йони са: 1. киселини 2. алкали 4. амфотерни хидроксиди |
По дефиниция, съединение, което, когато се дисоциира във воден разтвор, произвежда само хидроксидни аниони, се нарича основа. Само алкалният и амфотерният хидроксид отговарят на това определение. Но въпросът казва, че съединението трябва да се дисоциира само на метални катиони и хидроксидни аниони. Амфотерният хидроксид се дисоциира стъпаловидно и следователно хидроксометалните йони са в разтвор. Верен отговор 2. |
|
A3. Обменната реакция протича докрай с образуването на неразтворимо във вода вещество между: 1. NaOH и MgCl 2 2. NaCl и CuSO 4 3. CaCO 3 и HCl (разтвор) |
За да отговорите, трябва да напишете тези уравнения и да погледнете в таблицата за разтворимост, за да видите дали сред продуктите има неразтворими вещества. Това е в първата реакция магнезиев хидроксид Mg(OH) 2 Верен отговор 1. |
|
A4. Сумата от всички коефициенти в пълна и намалена йонна форма в реакцията междуFe(НЕ 3 ) 2 +2 NaOHе равно на: |
Fe(NO 3) 2 +2NaOH Fe(OH) 2 ↓ +2Na NO 3 молекулно Fe 2+ +2NO 3 - +2Na+2OH - Fe(OH) 2 ↓ +2Na + +2 NO 3 - пълен йонно уравнение, сумата от коефициентите е 12 Fe 2+ + 2OH - Fe(OH) 2 ↓ съкратено йонен, сумата от коефициентите е 4 Верният отговор е 4. |
|
A5. Съкратеното йонно уравнение за реакцията H + +OH - →H 2 O съответства на взаимодействието: 2. NaOH (PP) + HNO 3 3. Cu(OH) 2 + HCl 4. CuO + H 2 SO 4 |
Това съкратено уравнение отразява взаимодействието между силна основа и силна киселина. Базата се предлага във версии 2 и 3, но Cu(OH) 2 е неразтворима основа Верен отговор 2. |
|
A6. Йонообменната реакция протича до завършване, когато разтворите се отцедят: 1. натриев нитрат и калиев сулфат 2. калиев сулфат и солна киселина 3. калциев хлорид и сребърен нитрат 4. натриев сулфат и калиев хлорид |
Нека напишем как трябва да протичат йонообменните реакции между всяка двойка вещества. NaNO 3 +K 2 SO 4 → Na 2 SO 4 +KNO 3 K2SO4 +HCl→H2SO4 +KCl CaCl 2 +2AgNO 3 → 2AgCl↓ + Ca(NO 3) 2 Na 2 SO 4 + KCl → K 2 SO 4 + NaCl От таблицата за разтворимост виждаме, че AgCl↓ Верен отговор 3. |
|
A7. Във воден разтвор се дисоциира стъпаловидно: |
Многоосновните киселини претърпяват поетапна дисоциация във воден разтвор. Сред тези вещества само H2S е киселина. Верен отговор 3. |
|
A8. Уравнение на реакцията CuCl 2 +2 KOH→ Cu(ОХ) 2 ↓+2 KClсъответства на съкратеното йонно уравнение: 1. CuCl 2 +2OH - →Cu 2+ +2OH - +2Cl - 2. Cu 2+ +KOH→Cu(OH) 2 ↓+K + 3. Cl - +K + →KCl 4. Cu 2+ +2OH - →Cu(OH) 2 ↓ |
Нека напишем пълното йонно уравнение: Cu 2+ +2Cl - +2K + +2OH - → Cu(OH) 2 ↓+2K + +2Cl - Елиминирайки несвързаните йони, получаваме съкратеното йонно уравнение Сu 2+ +2OH - →Cu(OH) 2 ↓ Верният отговор е 4. |
|
A9. Реакцията е почти завършена: 1. Na 2 SO 4 + KCl→ 2. H 2 SO 4 + BaCl 2 → 3. KNO 3 + NaOH → 4. Na 2 SO 4 + CuCl 2 → |
Нека напишем хипотетичните йонообменни реакции: Na 2 SO 4 + KCl → K 2 SO 4 + Na Cl H 2 SO 4 + BaCl 2 → BaSO 4 ↓ + 2HCl KNO 3 + NaOH → NaNO 3 + KOH Na 2 SO 4 + CuCl 2 → CuSO 4 + 2NaCl Според таблицата за разтворимост виждаме BaSO 4 ↓ Верен отговор 2. |
|
A10. Разтворът има неутрална среда: 2. (NH 4) 2 SO 4 |
Само водни разтвори на соли, образувани от силна основа и силна киселина, имат неутрална среда. NaNO3 е сол, образувана от силната основа NaOH и силната киселина HNO3. Верен отговор 1. |
|
A11. Киселинността на почвата може да се увеличи чрез въвеждане на разтвор: |
Необходимо е да се определи коя сол ще даде кисела реакция на средата. Трябва да е сол, образувана от силна киселина и слаба основа. Това е NH4NO3. Верен отговор 1. |
|
A12. възниква при разтваряне във вода: |
Само солите, образувани от силна основа и силна киселина, не се подлагат на хидролиза. Всички горепосочени соли съдържат силни киселинни аниони. Само AlCl3 съдържа слаб основен катион. Верният отговор е 4. |
|
A 13. Не се подлага на хидролиза: 1. оцетна киселина 2. етил оцетна киселина 3. нишесте |
Имаме хидролиза голямо значение V органична химия. Естерите, нишестето и протеините се подлагат на хидролиза. Верен отговор 1. |
|
A14. Какво число представлява фрагмент от молекулярно уравнение? химическа реакция, съответстващ на множественото йонно уравнение C u 2+ +2 ОХ - → Cu(ОХ) 2 ↓? 1. Cu(OH) 2 + HCl→ 2. CuCO 3 + H 2 SO 4 → 3. CuO + HNO 3 → 4. CuSO 4 +KOH→ |
Съгласно съкратеното уравнение следва, че трябва да вземете всяко разтворимо съединение, съдържащо меден йон и хидроксиден йон. От всички изброени медни съединения само CuSO 4 е разтворим и само във водната реакция е OH - . Верният отговор е 4. |
|
A15.Кога какви вещества взаимодействат ще се отдели серен оксид?: 1. Na 2 SO 3 и HCl 2. AgNO 3 и K 2 SO 4 3. BaCO 3 и HNO 3 4. Na2S и HCl |
Първата реакция произвежда нестабилна киселина H 2 SO 3, която се разлага на вода и серен оксид (IV) Верен отговор1.
|
II. Кратък отговор и задачи за свързване.
|
В 1. Общата сума на всички коефициенти в пълното и намаленото йонно уравнение за реакцията между сребърен нитрат и натриев хидроксид е... |
Нека напишем уравнението на реакцията: 2AgNO 3 +2NaOH→Ag 2 O↓+ 2NaNO 3 +H 2 O Пълно йонно уравнение: 2Ag + +2NO 3 - +2Na + +2OH - →Ag 2 O↓+ 2Na + +2NO 3 - +H 2 O Съкратено йонно уравнение: 2Ag + +2OH - →Ag 2 O↓+H 2 O Верен отговор: 20 |
|
НА 2. Напишете пълно йонно уравнение за взаимодействието на 1 mol калиев хидроксид с 1 mol алуминиев хидроксид. Посочете броя на йоните в уравнението. |
KOH + Al(OH) 3 ↓→ K Пълно йонно уравнение: K + +OH - + Al(OH) 3 ↓ → K + + - Правилен отговор: 4 йона. |
|
НА 3. Свържете името на солта с нейната връзка с хидролизата: А) амониев ацетат 1. не хидролизира Б) бариев сулфид 2. чрез катион Б) амониев сулфид 3. чрез анион Г) натриев карбонат 4. чрез катион и анион |
За да отговорите на въпроса, трябва да анализирате с каква сила на основа и киселина се образуват тези соли. Верен отговор A4 B3 C4 D3 |
|
НА 4. Разтвор на един мол натриев сулфат съдържа 6,02натриеви йони. Изчислете степента на дисоциация на солта. |
Нека напишем уравнението за електролитна дисоциация на натриев сулфат: Na 2 SO 4 ↔ 2Na + +SO 4 2- 0,5 mol натриев сулфат се разпада на йони. |
|
НА 5. Свържете реагентите със съкратените йонни уравнения: 1. Ca(OH) 2 +HCl → A)NH 4 + +OH - →NH 3 +H 2 O 2. NH 4 Cl + NaOH → B) Al 3+ + OH - → Al(OH) 3 ↓ 3. AlCl 3 +KOH → B) H + +OH - → H 2 O 4. BaCl 2 +Na 2 SO 4 → D) Ba 2+ +SO 4 2- → BaSO 4 ↓ Верен отговор: B1 A2 B3 D4 |
|
|
НА 6. Напишете пълното йонно уравнение, съответстващо на съкратеното: СЪСО 3 2- +2 з + → CO 2 + з 2 О. Посочете сумата от коефициентите в молекулярните и общите йонни уравнения. |
Трябва да вземете всеки разтворим карбонат и всяка разтворима силна киселина. Молекулярно: Na 2 CO 3 +2HCl → CO 2 +H 2 O +2NaCl; Пълна йонна: 2Na + +CO 3 2- +2H + +2Cl - → CO 2 +H 2 O +2Na + +2Cl - ; |
III.Задачи с подробен отговор
|
Въпрос |
Електролитна дисоциация на NaCl.avi
Дисоциацията възниква в разтвори и стопилки.
Разтворими киселинидисоциират на водородни йони и киселинни йони.
Разтворими основисе разграждат на положително заредени метални йони и отрицателно заредени хидроксидни йони.
Средни солидисоциират на метални катиони и аниони на киселинни остатъци.
Киселинни солисе разлагат на метални и водородни катиони и аниони на киселинни остатъци.
Катиониса метални йони и водород H
+ .
Аниониса йони на киселинни остатъци и хидроксидни йони OH – .
Йонен заряде числено равна на валентността на йона в дадено съединение.
Използвайте таблицата за разтворимост, за да създадете уравнения на дисоциация.
IN химична формуласумата от зарядите на положително заредените йони е равна на сумата от зарядите на отрицателно заредените йони.



















Съставяне на уравнения за киселинна дисоциация
(използвайки примера на азотна и сярна киселини)

Съставяне на уравнения на дисоциация за алкали
(разтворими основи)
(използвайки примера на натриев и бариев хидроксид)
Разтворимите основи са хидроксиди, образувани от активни метални йони:
едновалентен: Li + , Na + , K + , Rb + , Cs + , Fr + ;
двувалентен: Ca 2+, Sr 2+, Ba 2+.
Съставяне на уравнения за дисоциация на соли
(използвайки примера на алуминиев сулфат, бариев хлорид и калиев бикарбонат)


Задачи за самоконтрол
1. Напишете уравненията на дисоциация за следните електролити: цинков нитрат, натриев карбонат, калциев хидроксид, стронциев хлорид, литиев сулфат, сярна киселина, меден (II) хлорид, железен (III) сулфат, калиев фосфат, хидросулфид, калциев бромид, калций хидроксихлорид, натриев нитрат, литиев хидроксид.
2. Разделете веществата на електролити и неелектролити: K 3 PO 4, HNO 3, Zn(OH) 2, BaCl 2, Al 2 O 3, Cr 2 (SO 4) 3, NO 2, FeBr 3, H 3 PO 4, BaSO 4, Cu(NO 3) 2, O 2, Sr(OH) 2, NaHSO 4, CO 2, AlCl 3, ZnSO 4, KNO 3, KHS.
Назовете електролитните вещества.
3. Съставете формули за вещества, които могат да се образуват от следните йони:

Наименувайте веществата и съставете уравнения за тяхната дисоциация.
Отговори на задачи за самоконтрол
2.
Електролити
: К 3 PO 4 – калиев фосфат, HNO 3 – Азотна киселина, BaCl 2 – бариев хлорид, Cr 2 (SO 4) 3 – хром(III) сулфат, FeBr 3 – железен (III) бромид, H 3 PO 4 – фосфорна киселина, Сu(NO 3) 2 – меден(II) нитрат, Sr(OH) 2 – стронциев хидроксид, NaHSO 4 – натриев хидроген сулфат, AlCl 3 – алуминиев хлорид, ZnSO 4 – цинков сулфат, KNO 3 – калиев нитрат, KHS – калиев хидросулфид, Zn(OH) 2 – цинков хидроксид, BaSO 4 – бариев сулфат.
Неелектролити
: Al 2 O 3, NO 2, O 2, CO 2.
3.
а) Н 2 SO 4, CaSO 4, NaMnO 4, MgI 2, Na 2 CrO 4 и др.;
b) KClO 3, Ba(OH) 2, AlPO 4, H 2 CO 3 и др.;
в) H 2 S, CaCl 2, FeSO 4, Na 2 SO 4 и др.

Теми на кодификатора на Единния държавен изпит:Електролитна дисоциация на електролити в водни разтвори. Силни и слаби електролити.
– Това са вещества, чиито разтвори и стопилки провеждат електрически ток.
Електрическият ток е подредено движение на заредени частици под въздействието на електрическо поле. Така разтворите или стопилките на електролитите съдържат заредени частици. В електролитни разтвори, като правило, електропроводимостпоради наличието на йони.
йони– това са заредени частици (атоми или групи от атоми). Отделете положително заредените йони ( катиони) и отрицателно заредени йони ( аниони).
Електролитна дисоциация - Това е процесът на разграждане на електролит на йони, когато се разтваря или стопява.
Отделни вещества - електролитиИ неелектролити. ДА СЕ неелектролитивключват вещества със силна ковалентна неполярна връзка (прости вещества), всички оксиди (които са химически Невзаимодействат с водата), повечето органична материя(с изключение на полярните съединения - карбоксилни киселини, техните соли, феноли) - алдехиди, кетони, въглеводороди, въглехидрати.
ДА СЕ електролити включват някои вещества с ковалентна полярна връзка и вещества с йонна кристална решетка.
Каква е същността на процеса на електролитна дисоциация?
Поставете малко кристали натриев хлорид в епруветка и добавете вода. След известно време кристалите ще се разтворят. Какво стана?
Натриевият хлорид е вещество с йонна кристална решетка. Кристалът NaCl се състои от Na+ йонии Cl - . Във водата този кристал се разпада на структурни единици - йони. В този случай йонен химически връзкии някои водородни връзки между водните молекули. Йоните Na + и Cl -, които попадат във водата, взаимодействат с водните молекули. В случай на хлоридни йони можем да говорим за електростатично привличане на диполни (полярни) водни молекули към хлорния анион, а в случай на натриеви катиони се доближава до донорно-акцепторна природа (когато електронната двойка на кислородния атом се поставя в свободните орбитали на натриевия йон). Заобиколени от водни молекули, йоните се покриватхидратираща обвивка.
Дисоциацията на натриев хлорид се описва с уравнението:
Когато съединения с ковалентна полярна връзка се разтварят във вода, водните молекули, обграждащи полярната молекула, първо разтягат връзката в нея, увеличавайки нейната полярност, след което я разкъсват на йони, които се хидратират и равномерно разпределят в разтвора. Например солната киселина се дисоциира на йони по следния начин: HCl = H + + Cl - .
По време на топенето, когато кристалът се нагрява, йоните започват да претърпяват интензивни вибрации във възлите на кристалната решетка, в резултат на което тя се разрушава и се образува стопилка, която се състои от йони.
Процесът на електролитна дисоциация се характеризира със степента на дисоциация на молекулите на веществото:
Степен на дисоциация е отношението на броя на дисоциираните (дезинтегрирани) молекули към общия брой на електролитните молекули. Тоест каква част от молекулите на първоначалното вещество се разпада на йони в разтвор или стопилка.
α=N prodiss /N out, където:
N prodiss е броят на дисоциираните молекули,
N out е първоначалният брой молекули.
Според степента на дисоциация електролитите се делят на силенИ слаб.
Силни електролити (α≈1):
1. Всички разтворими соли (включително соли на органични киселини - калиев ацетат CH 3 COOK, натриев формиат HCOONa и др.)
2. Силни киселини: HCl, HI, HBr, HNO 3, H 2 SO 4 (в първия етап), HClO 4 и др.;
3. Алкали: NaOH, KOH, LiOH, RbOH, CsOH; Ca(OH)2, Sr(OH)2, Ba(OH)2.
Силни електролитисе разпадат на йони почти напълно във водни разтвори, но само в. В разтвори дори силните електролити могат само частично да се разпаднат. Тези. степента на дисоциация на силните електролити α е приблизително равна на 1 само за ненаситени разтвори на вещества. В наситени или концентрирани разтвори степента на дисоциация на силни електролити може да бъде по-малка или равна на 1: α≤1.
Слаби електролити (α<1):
1. Слаби киселини, вкл. органични;
2. Неразтворими основи и амониев хидроксид NH 4 OH;
3. Неразтворими и някои слабо разтворими соли (в зависимост от разтворимостта).
Неелектролити:
1. Оксиди, които не взаимодействат с вода (оксиди, които взаимодействат с вода, когато се разтварят във вода, влизат в химична реакция за образуване на хидроксиди);
2. Прости вещества;
3. Повечето органични вещества със слабо полярни или неполярни връзки (алдехиди, кетони, въглеводороди и др.).
Как се дисоциират веществата? Според степента на дисоциация се различават силенИ слабелектролити.
Силни електролити дисоциират напълно (в наситени разтвори), в един етап, всички молекули се разпадат на йони, почти необратимо. Моля, имайте предвид, че по време на дисоциация в разтвора се образуват само стабилни йони. Най-често срещаните йони могат да бъдат намерени в таблицата за разтворимост - вашият официален измамник за всеки изпит. Степента на дисоциация на силни електролити е приблизително равна на 1. Например, по време на дисоциацията на натриев фосфат се образуват йони Na + и PO 4 3–:
Na 3 PO 4 → 3Na + +PO 4 3-
NH 4 Cr(SO 4) 2 → NH 4 + + Cr 3+ + 2SO 4 2–
Дисоциация слаби електролити : поликиселинни киселини и поликиселинни основи протича стъпаловидно и обратимо. Тези. По време на дисоциацията на слабите електролити само много малка част от първоначалните частици се разпада на йони. Например въглеродна киселина:
H 2 CO 3 ↔ H + + HCO 3 –
HCO 3 – ↔ H + + CO 3 2–
Магнезиевият хидроксид също се дисоциира в 2 стъпки:
Mg(OH) 2 ⇄ Mg(OH) + OH –
Mg(OH) + ⇄ Mg 2+ + OH –
Киселинните соли също се дисоциират стъпаловидно, първо се разкъсват йонните връзки, а след това полярните ковалентни връзки. Например калиев хидроген карбонат и магнезиев хидроксихлорид:
KHCO 3 ⇄ K + + HCO 3 – (α=1)
HCO 3 – ⇄ H + + CO 3 2– (α< 1)
Mg(OH)Cl ⇄ MgOH + + Cl – (α=1)
MgOH + ⇄ Mg 2+ + OH – (α<< 1)
Степента на дисоциация на слабите електролити е много по-малка от 1: α<<1.
По този начин основните положения на теорията за електролитната дисоциация са:
1. Когато се разтворят във вода, електролитите се дисоциират (разпадат) на йони.
2. Причината за дисоциацията на електролитите във водата е нейната хидратация, т.е. взаимодействие с водните молекули и разкъсване на химичните връзки в нея.
3. Под въздействието на външно електрическо поле положително заредените йони се придвижват към положително зареден електрод - катод; те се наричат катиони. Отрицателно заредените електрони се движат към отрицателния електрод - анода. Те се наричат аниони.
4. Електролитната дисоциация настъпва обратимо за слабите електролити и практически необратимо за силните електролити.
5. Електролитите могат да се дисоциират на йони в различна степен, в зависимост от външните условия, концентрацията и природата на електролита.
6. Химичните свойства на йоните се различават от свойствата на простите вещества. Химичните свойства на електролитните разтвори се определят от свойствата на йоните, които се образуват от него по време на дисоциацията.
Примери.
1. При непълна дисоциация на 1 mol сол общият брой на положителните и отрицателните йони в разтвора е 3,4 mol. Солна формула – a) K 2 S b) Ba(ClO 3) 2 c) NH 4 NO 3 d) Fe(NO 3) 3
Решение: Първо, нека определим силата на електролитите. Това може лесно да се направи с помощта на таблицата за разтворимост. Всички соли, посочени в отговорите, са разтворими, т.е. силни електролити. След това записваме уравненията на електролитна дисоциация и използваме уравнението, за да определим максималния брой йони във всеки разтвор:
а) K 2 S ⇄ 2K + + S 2– ,при пълното разлагане на 1 мол сол се образуват 3 мола йони, не могат да се получат повече от 3 мола йони;
б) Ba(ClO 3) 2 ⇄ Ba 2+ + 2ClO 3 –, отново при разлагането на 1 мол сол се образуват 3 мола йони, повече от 3 мола йони не се образуват;
V) NH 4 NO 3 ⇄ NH 4 + + NO 3 –, по време на разлагането на 1 мол амониев нитрат се образуват максимум 2 мола йони; образуват се не повече от 2 мола йони;
G) Fe(NO 3) 3 ⇄ Fe 3+ + 3NO 3 –, при пълното разлагане на 1 мол железен (III) нитрат се образуват 4 мола йони. Следователно, при непълно разлагане на 1 мол железен нитрат е възможно образуването на по-малък брой йони (възможно е непълно разлагане в наситен разтвор на сол). Следователно вариант 4 ни подхожда.