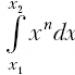··· Орловський випуск ···
Г.А.БІЛУХА,
школа № 4, м. Лівни, Орловська обл.
Робота газу в термодинаміці
При вивченні роботи газу в термодинаміці учні неминуче стикаються з труднощами, які зумовлені слабкими навичками обчислення роботи змінної сили. Тому до сприйняття цієї теми необхідно готуватися, починаючи вже з вивчення роботи в механіці і вирішуючи з цією метою завдання працювати змінної сили шляхом підсумовування елементарних робіт на всьому шляху за допомогою інтегрування.
Наприклад, під час обчислення роботи сили Архімеда, сили пружності, сили всесвітнього тяжіння тощо. треба вчитися підсумовувати елементарні величини за допомогою найпростіших диференціальних співвідношень типу dA = Fds. Досвід показує, що старшокласники легко справляються з цим завданням - дугу траєкторії, на якій сила збільшується або зменшується, потрібно розбити на такі проміжки. ds, на яких силу Fможна вважати постійною величиною, а потім, знаючи залежність F = F(s), підставити під знак інтеграла. Наприклад,
Робота цих сил обчислюється за допомогою найпростішого табличного інтегралу 
Така методика полегшує адаптацію майбутніх студентів до сприйняття курсу фізики у вузі та усуває методичні складності, пов'язані з умінням знаходити роботу змінної сили у термодинаміці та ін.
Після того, як учні засвоїли, що таке внутрішня енергія і як знайти її зміну, доцільно дати узагальнюючу схему:


Засвоївши, що робота – це один із способів зміни внутрішньої енергії, десятикласники легко розраховують роботу газу в ізобарному процесі. На даному етапі необхідно підкреслити, що сила тиску газу по всьому шляху не змінюється, і за третім законом Ньютона | F 2 | = |F 1 | знак роботи знаходимо з формули A = Fs cos. Якщо = 0 °, то A> 0 якщо = 180°, то A < 0. На графике зависимости р(V) робота чисельно дорівнює площі під графіком.
Нехай газ розширюється чи стискається ізотермічно. Наприклад, газ стискається під поршнем, тиск змінюється, і будь-якої миті часу
При нескінченно малому переміщенні поршня на dlми отримаємо нескінченно малу зміну обсягу dV, а тиск рможна вважати постійним. За аналогією зі знаходженням механічної роботи змінної сили складемо найпростіше диференціальне співвідношення dA = pdVтоді і, знаючи залежність р (V), запишемо  Це табличний інтеграл типу
Це табличний інтеграл типу  Робота газу цьому випадку негативна, т.к. = 180 °:
Робота газу цьому випадку негативна, т.к. = 180 °:
![]()
т.к. V 2 < V 1 .
Отриману формулу можна переписати, використовуючи співвідношення 
Для закріплення розв'яжемо задачі.
1. Газ переходить із стану 1 (Об `єм V 1 , тиск р 1) у стан 2 (Об `єм V 2 , тиск р 2) у процесі, у якому його тиск залежить від обсягу лінійно. Знайдіть роботу газу.
Рішення.Побудуємо зразковий графік залежності pвід V. Робота дорівнює площі під графіком, тобто. площі трапеції:
![]()

2. Один моль повітря, що знаходиться за нормальних умов, розширюється від обсягу V 0 до 2 V 0 двома способами – ізотермічно та ізобарно. Порівняйте роботу, здійснену повітрям у цих процесах.
Рішення
При ізобарному процесі A p = р 0 V, але р 0 = RT 0 /V 0 , V = V 0 , отже, A p = RT 0 .
При ізотермічному процесі:
![]()
Порівняємо: ![]()
Вивчивши перший закон термодинаміки та його застосування до ізопроцесів та закріпивши вирішенням завдань тему про роботу в термодинаміці, учні підготувалися до сприйняття найбільш складної частини термодинаміки «Робота циклів та ККД теплових машин». Цей матеріал викладаю в наступній послідовності: робота циклів - цикл Карно - ККД теплових машин - кругові процеси.
 Круговим процесом (або циклом) називається термодинамічний процес, в результаті якого тіло, пройшовши ряд станів, повертається у вихідний стан. Якщо всі процеси в циклі рівноважні, цикл вважається рівноважним. Його можна зобразити графічно як замкнутої кривої.
Круговим процесом (або циклом) називається термодинамічний процес, в результаті якого тіло, пройшовши ряд станів, повертається у вихідний стан. Якщо всі процеси в циклі рівноважні, цикл вважається рівноважним. Його можна зобразити графічно як замкнутої кривої.
На малюнку показано графік залежності тиску pвід обсягу V(діаграма p, V) для деякого циклу 1–2–3–4–1. На дільницях 1–2 і 4–1 газ розширюється та здійснює позитивну роботу А 1 , чисельно рівну площі фігури V 1 412V 2 . На ділянці 2–3–4 газ стискається та здійснює роботу А 2 модуль якої дорівнює площі фігури V 2 234V 1 . Повна робота газ за цикл А = А 1 + А 2, тобто. позитивна і дорівнює площі фігури 12341 .
Якщо рівноважний цикл зображується замкнутою кривою на р, V-діаграмі, яка обходиться за годинниковою стрілкою, то робота тіла позитивна, а цикл називається прямим. Якщо замкнута крива на р, V-Діаграма обходиться проти годинникової стрілки, то газ здійснює негативну роботу за цикл, а цикл називається зворотним. У будь-якому випадку модуль роботи газу за цикл дорівнює площі фігури, обмеженої графіком циклу р, V-діаграмі.
У круговому процесі робоче тіло повертається у вихідне стан, тобто. у стан із початковою внутрішньою енергією. Це означає, що зміна внутрішньої енергії за цикл дорівнює нулю: U= 0. Оскільки, за першим законом термодинаміки, всього циклу Q = U + A, то Q = A. Отже, сума алгебри всіх кількостей теплоти, отриманих за цикл, дорівнює роботі тіла за цикл: Aц = Qн+ Qх = Qн - | Qх |. 
Розглянемо одне із кругових процесів – цикл Карно. Він складається з двох ізотермічних та двох адіабатичних процесів. Нехай робочим тілом є бездоганний газ. Тоді на ділянці 1–2 ізотермічного розширення, згідно з першим законом термодинаміки, тепло, що все одержується газом, йде на здійснення позитивної роботи: Q 12 = A 12 . Тобто немає жодних втрат тепла в навколишній простір і жодної зміни внутрішньої енергії: U= 0, т.к. T 12 = const (бо газ – ідеальний).
На ділянці 2–3 адіабатного розширення газ здійснює позитивну роботу рахунок зміни внутрішньої енергії, т.к. Qпекло = 0 = U 23 + Aг23 Aг23 = - U 23 . Тут також немає втрат тепла щодо визначення адіабатного процесу.
На ділянці 3–4 над газом відбувається позитивна робота зовнішньої силою, але він нагрівається (ізотермічний процес). Завдяки досить повільно протікає процесу і гарному контакту з холодильником газ встигає віддавати енергію, що отримується за рахунок роботи, у вигляді тепла холодильнику. Сам же газ здійснює при цьому негативну роботу: Q 34 = Aг34< 0.
На ділянці 4–1 газ адіабатний (без теплообміну) стискається до вихідного стану. У цьому він здійснює негативну роботу, а зовнішні сили – позитивну: 0 = U 41 + Aг41 Aг41 = - U 41 .
Таким чином, за цикл газ отримує тепло лише на ділянці 1–2 , ізотермічно розширюючись:
![]()
Холодильник тепло віддається тільки при ізотермічному стисканні газу на ділянці 3–4 :
![]()
Відповідно до першого закону термодинаміки
Aц = Qн - | Q x |;
![]()
ККД машини, що працює за циклом Карно, знайдемо за формулою 
Відповідно до закону Бойля-Маріотта для процесів 1–2 і 3–4 , а також рівняння Пуассона для процесів 2–3 і 4–1 легко довести, що
Після скорочень отримаємо формулу ККД теплової машини, що працює за циклом Карно:
 p align="justify"> Роботу теплових машин, що працюють за зворотним циклом, методично правильно, як показує досвід, вивчати на прикладі роботи зворотного циклу Карно, т.к. він звернемо і його можна провести у зворотному напрямку: розширювати газ при зниженні температури від Tн до T x (процес 1–4
) і при низькій температурі T x (процес 4–3
), а потім стискати (процеси 3–2
і 2–1
). Тепер двигун робить роботу, щоб привести в дію холодильну машину. Робоче тіло забирає кількість теплоти Q x у продуктів усередині при низькій температурі Tх, а віддає кількість теплоти Qн оточуючим тілам, за межами холодильника, при вищій температурі Tн. Таким чином, машина, що працює за зворотним циклом Карно, вже не теплова, а ідеальна холодильна. Роль нагрівача (що віддає тепло) виконує тіло з нижчою температурою. Але, зберігши назви елементів, як у тепловій машині, що працює за прямим циклом, ми можемо уявити блок-схему холодильника в наступному вигляді:
p align="justify"> Роботу теплових машин, що працюють за зворотним циклом, методично правильно, як показує досвід, вивчати на прикладі роботи зворотного циклу Карно, т.к. він звернемо і його можна провести у зворотному напрямку: розширювати газ при зниженні температури від Tн до T x (процес 1–4
) і при низькій температурі T x (процес 4–3
), а потім стискати (процеси 3–2
і 2–1
). Тепер двигун робить роботу, щоб привести в дію холодильну машину. Робоче тіло забирає кількість теплоти Q x у продуктів усередині при низькій температурі Tх, а віддає кількість теплоти Qн оточуючим тілам, за межами холодильника, при вищій температурі Tн. Таким чином, машина, що працює за зворотним циклом Карно, вже не теплова, а ідеальна холодильна. Роль нагрівача (що віддає тепло) виконує тіло з нижчою температурою. Але, зберігши назви елементів, як у тепловій машині, що працює за прямим циклом, ми можемо уявити блок-схему холодильника в наступному вигляді:

Звернемо увагу, що тепло від холодного тіла переходить у холодильній машині до тіла з вищою температурою не спонтанно, а за рахунок роботи зовнішньої сили.
Найважливішою характеристикою холодильника є холодильний коефіцієнт, що визначає ефективність роботи холодильника і дорівнює кількості теплоти, відібраного від холодильної камери Qх до витраченої енергії зовнішнього джерела
За один зворотний цикл робоче тіло отримує від холодильника кількість теплоти. Qх і віддає в навколишній простір кількість теплоти Qн, що більше Qх на роботу Aдв, що здійснюється електродвигуном над газом за цикл: | Qн | = | Qх | + Адв.
Енергія, витрачена двигуном (електроенергія у разі компресорних електричних холодильників), йде на корисну роботу над газом, а також на втрати при нагріванні обмоток двигуна електричним струмом Q Rі на тертя у схемі Атр.
Якщо знехтувати втратами на тертя та джоулеве тепло в обмотках двигуна, то холодильний коефіцієнт
![]()
Враховуючи, що у прямому циклі
після нескладних перетворень отримаємо:
Останнє співвідношення між холодильним коефіцієнтом і ККД теплової машини, яка може працювати і за зворотним циклом, показує, що холодильний коефіцієнт може бути більшим за одинку. У цьому випадку тепла віднімається від холодильної камери і повертається до кімнати більше, ніж для цього використовується енергії двигуном.
У разі ідеальної теплової машини, що працює за зворотним циклом Карно (ідеального холодильника), холодильний коефіцієнт має максимальне значення:
У справжніх холодильниках т.к. не вся енергія, що отримується двигуном, йде на роботу над робочим тілом, про що написано вище.
Вирішимо завдання:
Оцініть вартість виготовлення 1 кг льоду у домашньому холодильнику, якщо температура випаровування фреону – tх °С, температура радіатора tн °С. Вартість однієї кіловат-години електроенергії дорівнює Ц. Температура в кімнаті t.
Дано:
m, c, t, tн, tх, , Ц.
____________
Д -?
Рішення
Вартість Д виготовлення льоду дорівнює добутку роботи електродвигуна за тарифом Ц: Д = ЦА.
Для перетворення води на лід з температурою 0 °С необхідно відвести від неї кількість теплоти Q = m(ct+). Вважаємо приблизно, що над фреоном відбувається зворотний цикл Карно з ізотермами при температурах Tн і Tх. Використовуємо формули для холодильного коефіцієнта: за визначенням = Q/Aі для ідеального холодильника ід = Tх/( Tн – Tх). З умови випливає, що ід.
Вирішуємо спільно три останні рівняння:
Розбираючи з учнями це завдання, необхідно звернути увагу, що основна робота холодильного пристрою йде не на охолодження продуктів, а на підтримання температури всередині холодильної шафи шляхом періодичної відкачування тепла, що проникає крізь стінки холодильника. 
Для закріплення теми можна вирішити задачу:
ККД теплової машини, що працює за циклом, що складається з ізотермічного процесу 1–2 , ізохоричного 2–3 та адіабатичного 3–1 , дорівнює , а різниця максимальної та мінімальної температур газу в циклі дорівнює T. Знайдіть роботу, виконану моль одноатомного ідеального газу в ізотермічному процесі.
Рішення
При вирішенні завдань, у яких фігурує ККД циклу, корисно попередньо проаналізувати всі ділянки циклу, використовуючи перший закон термодинаміки, та виявити ділянки, де тіло отримує та віддає тепло. Проведемо подумки ряд ізотерм на р, V-діаграмі. Тоді стане зрозумілим, що максимальна температура в циклі на ізотермі, а мінімальна – в т.ч. 3 . Позначимо їх через T 1 та T 3 відповідно.
На ділянці 1–2 зміна внутрішньої енергії ідеального газу U 2 – U 1 = 0. За першим законом термодинаміки, Q 12 = (U 2 – U 1) + А 12 . Бо на ділянці 1–2 газ розширювався, то робота газу А 12 > 0. Отже, і підведена до газу кількість теплоти на цій ділянці Q 12 > 0, причому Q 12 = А 12 .
На ділянці 2–3 робота газу дорівнює нулю. Тому Q 23 = U 3 – U 2 .
Скориставшись виразами U 2 = c V T 1 і тим, що T 1 – T 3 = T, отримаємо Q 23 = –c V T < 0. Это означает, что на участке 2–3 газ одержує негативну кількість теплоти, тобто. віддає тепло.
На ділянці 3–1
теплообміну немає, тобто. Q 31 = 0 і, за першим законом термодинаміки, 0 = ( U 1 – U 3) + A 31 . Тоді робота газу
A 31 = U 3 – U 1 = c V(T 3 –T 1) = –c V T.
Отже, за цикл газ здійснив роботу A 12 + А 31 = А 12 – c V Tі отримав тепло лише на ділянці 1–2 . ККД циклу
![]()
Оскільки робота газу на ізотермі дорівнює
Геннадій Антонович Бєлуха- Заслужений вчитель РФ, педагогічний стаж 20 років, щорічно його учні займають призові місця на різних етапах всеросійської олімпіади з фізики. Хобі – комп'ютерна техніка.
При деформації конструкцій відбувається переміщення точок застосування зовнішніх сил, при цьому зовнішні сили на заданих переміщеннях виконують роботу.
Обчислимо роботу деякої узагальненої сили (рис. 2.2.4), яка зростає від нуля до заданої величини досить повільно, щоб можна було знехтувати силами інерції мас. Таке навантаження прийнято називати статичним.

Рис.2.2.4
Нехай у довільний момент деформації силі  відповідає узагальнене переміщення
відповідає узагальнене переміщення  . Нескінченно мале збільшення сили на величину
. Нескінченно мале збільшення сили на величину  викличе нескінченно мале збільшення переміщення
викличе нескінченно мале збільшення переміщення  . Очевидно, що елементарна робота зовнішньої сили, якщо знехтувати нескінченно малими величинами другого порядку,
. Очевидно, що елементарна робота зовнішньої сили, якщо знехтувати нескінченно малими величинами другого порядку,
Повна робота, здійснена статично доданою узагальненою силою  , що викликала узагальнене переміщення
, що викликала узагальнене переміщення  ,
,
 . (2.2.5)
. (2.2.5)
Отриманий інтеграл є площею діаграми  , яка для лінійно деформованих систем є площею трикутника з основою остаточного значення переміщення
, яка для лінійно деформованих систем є площею трикутника з основою остаточного значення переміщення  та висотою остаточного значення сили
та висотою остаточного значення сили 
 (2.2.6)
(2.2.6)

Мал. 2.2.5
Таким чином, дійсна робота при статичній дії узагальненої сили на пружну систему дорівнює половині добутку остаточного значення сили на остаточне значення відповідного узагальненого переміщення (теорема Клапейрона).
У разі статичного впливу на пружну систему кількох узагальнених сил робота деформацій дорівнює напівсумі творів остаточного значення кожної сили на остаточне значення відповідного сумарного переміщення
 (2.2.7)
(2.2.7)
і залежить від порядку навантаження системи.
Робота внутрішніх сил.
Внутрішні сили, що виникають при деформуванні пружних систем, також виконують роботу.
Розглянемо елемент стрижня завдовжки  (Рис. 2.2.6). У загальному випадку для плоского вигину дія віддалених частин стрижня на залишений елемент виражається рівнодіючими осьовими силами
(Рис. 2.2.6). У загальному випадку для плоского вигину дія віддалених частин стрижня на залишений елемент виражається рівнодіючими осьовими силами  , поперечними силами
, поперечними силами  та згинальними моментами
та згинальними моментами  . Ці зусилля, показані на рис 2.2.6 суцільними лініями, щодо виділеного елемента є зовнішніми.
. Ці зусилля, показані на рис 2.2.6 суцільними лініями, щодо виділеного елемента є зовнішніми.

Рис.2.2.6
Внутрішні сили, показані штриховими лініями, перешкоджають деформації, що викликається зовнішніми силами, дорівнюють їм за величиною і зворотні у напрямку.
Обчислимо роботу, здійснену окремо кожним внутрішнім силовим фактором.
Нехай елемент відчуває лише дію осьових зусиль, рівномірно розподілених за перерізом (рис. 2.2.6).

Мал. 2.2.7
Подовження елемента внаслідок цього
 ,
,
Робота, що поступово зростає від нуля до величини  внутрішніх сил у цьому переміщенні.
внутрішніх сил у цьому переміщенні.
 . (2.2.8)
. (2.2.8)
Робота внутрішніх сил є негативною, тому в отриманій формулі стоїть знак «мінус».
Розглянемо тепер елемент, що під дією згинальних моментів (рис. 2.2.8).
Взаємний кут повороту перерізів елемента
 .
.
Робота згинальних моментів
 . (2.2.9)
. (2.2.9)

Мал. 2.2.8
Роботу поступово зростаючих внутрішніх поперечних сил з урахуванням розподілу дотичних напруг за поперечним перерізом та на підставі закону Гука можна записати в наступному вигляді
 , (2.2.10)
, (2.2.10)
де  - Коефіцієнт, що залежить від форми поперечного перерізу.
- Коефіцієнт, що залежить від форми поперечного перерізу.
Якщо стрижень піддається крученню, елементарна робота поступово зростаючих моментів, що крутять
 (2.2.11)
(2.2.11)
Нарешті, у загальному випадку дії на брус у перерізах маємо шість внутрішніх силових факторів, роботу яких можна визначити за формулою.
Під час розгляду термодинамічних процесів механічне переміщення макротіл загалом розглядається. Поняття роботи пов'язується зі зміною обсягу тіла, тобто. переміщенням частин макротіла один щодо одного. Цей процес призводить до зміни відстані між частинками, а також часто до зміни швидкостей їх руху, отже, до зміни внутрішньої енергії тіла.
Нехай у циліндрі з рухомим поршнем знаходиться газ за температури T 1 (рис. 1). Повільно нагріватимемо газ до температури T 2 . Газ ізобарично розширюватиметься, і поршень переміститься зі становища 1 у становище 2 на відстань Δ l. Сила тиску газу при цьому здійснить роботу над зовнішніми тілами. Так як p= const, то й сила тиску F = pSтеж постійна. Тому роботу цієї сили можна розрахувати за формулою
\(~A = F \Delta l = pS \Delta l = p \Delta V, \qquad (1)\)
де Δ V- Зміна обсягу газу. Якщо обсяг газу не змінюється (ізохорний процес), то робота газу дорівнює нулю.
Сила тиску газу виконує роботу лише у процесі зміни обсягу газу.
При розширенні (Δ V> 0) газу відбувається позитивна робота ( А> 0); при стисканні (Δ V < 0) газа совершается отрицательная работа (А < 0), положительную работу совершают внешние силы А’ = -А > 0.
Запишемо рівняння Клапейрона-Менделєєва для двох станів газу:
\(~pV_1 = \frac mM RT_1 ; pV_2 = \frac mM RT_2 \Rightarrow\) \(~p(V_2 - V_1) = \frac mM R(T_2 - T_1) .\)
Отже, при ізобарному процесі
\(~A = \frac mM R \Delta T .\)
Якщо m = М(1 моль ідеального газу), то при Δ Τ = 1 До отримаємо R = A. Звідси випливає фізичний зміст універсальної газової постійної: вона чисельно дорівнює роботі, яка здійснюється 1 моль ідеального газу при його ізобарному нагріванні на 1 К.
На графіку p = f(V) при ізобарному процесі робота дорівнює площі заштрихованого малюнку 2, а прямокутника.

Якщо процес не ізобарний (рис. 2, б), то криву p = f(V) можна уявити як ламану, що складається з великої кількості ізохор та ізобар. Робота на ізохорних ділянках дорівнює нулю, а сумарна робота на всіх ізобарних ділянках буде
\(~A = \lim_(\Delta V \to 0) \sum^n_(i=1) p_i \Delta V_i\), або \(~A = \int p(V) dV,\)
тобто. дорівнюватиме площі заштрихованої фігури. При ізотермічному процесі ( Т= const) робота дорівнює площі заштрихованої фігури, зображеної на малюнку 2, ст.
Визначити роботу, використовуючи останню формулу, можна лише тому випадку, якщо відомо, як змінюється тиск газу за зміни його обсягу, тобто. відомий вид функції p(V).
Таким чином, газ при розширенні виконує роботу. Прилади та агрегати, дії яких засновані на властивості газу в процесі розширення виконувати роботу, називаються пневматичними. На цьому принципі діють пневматичні молотки, механізми для закривання та відчинення дверей на транспорті та ін.
Література
Аксенович Л. А. Фізика у середній школі: Теорія. Завдання. Тести: Навч. посібник для установ, які забезпечують отримання заг. середовищ, освіти / Л. А. Аксенович, Н. Н. Ракіна, К. С. Фаріно; За ред. К. С. Фаріно. – Мн.: Адукація i виховування, 2004. – C. 155-156.
Основні формули термодинаміки та молекулярної фізики, які вам знадобляться. Ще один чудовий день для практичних занять із фізики. Сьогодні ми зберемо разом формули, які найчастіше використовуються при вирішенні задач у термодинаміці та молекулярній фізиці.
Тож поїхали. Спробуємо викласти закони та формули термодинаміки коротко.
Ідеальний газ
Ідеальний газ - Це ідеалізація, як і матеріальна точка. Молекули такого газу є матеріальними точками, а зіткнення молекул – абсолютно пружні. Взаємодією молекул на відстані нехтуємо. У завданнях термодинаміки реальні гази часто приймаються за ідеальні. Так набагато легше жити, і не потрібно мати стосунків з масою нових членів у рівняннях.
Отже, що відбувається із молекулами ідеального газу? Так, вони рухаються! І резонно запитати, з якою швидкістю? Звісно, окрім швидкості молекул нас цікавить ще й загальний стан нашого газу. Який тиск P він надає на стінки судини, який об'єм V займає, яка температура T.
Для того, щоб дізнатися про все це, є рівняння стану ідеального газу, або рівняння Клапейрона-Менделєєва
Тут m - Маса газу, M - Його молекулярна маса (знаходимо за таблицею Менделєєва), R - Універсальна газова постійна, рівна 8,3144598 (48) Дж / (моль * кг).
Універсальна газова стала може бути виражена через інші константи ( постійна Больцмана та число Авогадро )

Масу , своєю чергою, можна вирахувати, як твір щільності і обсягу .

Основне рівняння молекулярно-кінетичної теорії (МКТ)
Як ми вже говорили, молекули газу рухаються, причому чим вище температура – тим швидше. Існує зв'язок між тиском газу та середньою кінетичною енергією E його частинок. Цей зв'язок називається основним рівнянням молекулярно-кінетичної теорії і має вигляд:

Тут n - Концентрація молекул (відношення їх кількості до обсягу), E - Середня кінетична енергія. Знайти їх, а також середню квадратичну швидкість молекул можна відповідно за формулами:

Підставимо енергію в перше рівняння і отримаємо ще один вид основного рівняння МКТ

Перший початок термодинаміки. Формули для ізопроцесів
Нагадаємо, що перший закон термодинаміки говорить: кількість теплоти, передана газу, йде на зміну внутрішньої енергії газу U і на здійснення газом роботи A. Формула першого закону термодинаміки записується так:

Як відомо, із газом щось відбувається, ми можемо стиснути його, можемо нагріти. У разі нас цікавлять такі процеси, які протікають при одному постійному параметрі. Розглянемо, як виглядає перший початок термодинаміки у кожному їх.
До речі! Для всіх наших читачів зараз діє знижка 10% на будь-який вид роботи.
Ізотермічний процес протікає за постійної температури. Тут працює закон Бойля-Маріотта: в ізотермічному процесі тиск газу обернено пропорційно його обсягу. В ізотермічному процесі:

протікає за постійного обсягу. Для цього процесу характерний закон Шарля: При постійному обсязі тиск прямо пропорційний температурі. У ізохорному процесі все тепло, підведене до газу, йде зміну його внутрішньої енергії.

йде за постійного тиску. Закон Гей-Люссака говорить, що при постійному тиску газу його обсяг прямо пропорційний температурі. При ізобарному процесі тепло йде як у зміну внутрішньої енергії, і на здійснення газом роботи.

. Адіабатний процес – це процес, який відбувається без теплообміну з довкіллям. Це означає, що формула першого закону термодинаміки для адіабатного процесу має такий вигляд:

Внутрішня енергія одноатомного та двоатомного ідеального газу

Теплоємність
Питома теплоємність дорівнює кількості теплоти, яка потрібна для нагрівання одного кілограма речовини на один градус Цельсія.

Крім питомої теплоємності, є молярна теплоємність (кількість теплоти, необхідна для нагрівання одного молячи речовини на один градус) при постійному обсязі, та молярна теплоємність при постійному тиску. У формулах нижче i – число ступенів свободи молекул газу. Для одноатомного газу i=3 для двоатомного – 5.

Теплові машини Формула ККД у термодинаміці
Теплова машина , у найпростішому випадку, складається з нагрівача, холодильника та робочого тіла. Нагрівач повідомляє тепло робочому тілу, воно здійснює роботу, потім охолоджується холодильником, і все повторюється ов. Типовим прикладом теплової машини є двигун внутрішнього згоряння.
Коефіцієнт корисної дії теплової машини обчислюється за формулою

Ось ми і зібрали основні формули термодинаміки, які стануть у нагоді у вирішенні завдань. Звичайно, це не всі формули з теми термодинаміка, але їхнє знання справді може послужити хорошу службу. А якщо виникнуть питання – пам'ятайте про студентському сервісі, фахівці якого готові будь-якої миті прийти на виручку.
І історична довідка.
1) М.В. Ломоносов, провівши стрункі міркування та прості досліди, дійшов висновку, що «причина теплоти полягає у внутрішньому русі частинок зв'язаної матерії… Відомо, що тепло збуджується рухом: руки від взаємного тертя зігріваються, дерево загоряється, іскри вилітають при ударі кремнієм об сталь, залізо розжарюється при куванні його частинок сильними ударами»
2) Б. Румфорд, працюючи на заводі з виготовлення гармат, зауважив, що при свердлінні гарматного ствола він сильно нагрівається. Наприклад, він поміщав металевий циліндр масою близько 50 кг у ящик з водою і, свердливши циліндр свердлом, доводив воду в ящику до кипіння за 2.5 години.
3) Деві у 1799 році здійснив цікавий досвід. Два шматки льоду при терті одного про інше почали танути і перетворюватися на воду.
4) Корабельний лікар Роберт Майєр у 1840 році під час плавання на острів Яву помітив, що після шторму вода в морі завжди тепліша, ніж до нього.
Обчислення роботи.
У механіці робота визначається як добуток модулів сили та переміщення: A = FS. Під час розгляду термодинамічних процесів механічне переміщення макротіл загалом розглядається. Поняття роботи пов'язується зі зміною обсягу тіла, тобто. переміщенням частин макротіла один щодо одного. Цей процес призводить до зміни відстані між частинками, а також часто до зміни швидкостей їх руху, отже, до зміни внутрішньої енергії тіла.
Нехай у циліндрі з рухомим поршнем знаходиться газ за температури T 1 (рис.). Повільно нагріватимемо газ до температури T 2 . Газ ізобарно розширюватиметься, і поршень переміститься зі становища 1 у становище 2 на відстань Δ l. Сила тиску газу при цьому здійснить роботу над зовнішніми тілами. Так як p= const, то й сила тиску F = pSтеж постійна. Тому роботу цієї сили можна розрахувати за формулою A=F Δ l=pS Δ l=p Δ V, A = p Δ V
де Δ V- Зміна обсягу газу. Якщо обсяг газу не змінюється (ізохорний процес), то робота газу дорівнює нулю.
Чому при стисканні чи розширенні змінюється внутрішня енергія тіла? Чому при стисканні газ нагрівається, а при розширенні охолоджується?
Причиною зміни температури газу при стисканні та розширенні є наступне: при пружних зіткненнях молекул з поршнем, що рухається, їх кінетична енергія змінюється.
- Якщо газ стискається, то при зіткненні поршень, що рухається назустріч, передає молекулам частину своєї механічної енергії, внаслідок чого газ нагрівається;
- Якщо газ розширюється, то після зіткнення з поршнем, що віддаляється, швидкості молекул зменшуються. внаслідок чого газ охолоджується.
При стисканні та розширенні змінюється і середня потенційна енергія взаємодії молекул, тому що при цьому змінюється середня відстань між молекулами.
Робота зовнішніх сил, що діють на газ
- При стисканні газу, колиΔ V = V 2 – V 1 < 0 , A>0, напрями сили та переміщення збігаються;
- При розширенні, колиΔ V = V 2 – V 1 > 0 , A<0, направления силы и перемещения противоположны.
Запишемо рівняння Клапейрона-Менделєєва для двох станів газу:
pV 1 = m/M*RT 1 ; pV 2 =m/M* RT 2 ⇒
p(V 2 − V 1 )= m/M*R(T 2 − T 1 ).
Отже, при ізобарному процесі
A= m/M*RΔ T.
Якщо m = М(1 моль ідеального газу), то при Δ Τ = 1 До отримаємо R = A. Звідси випливає фізичний зміст універсальної газової постійної: вона чисельно дорівнює роботі, яка здійснюється 1 моль ідеального газу при його ізобарному нагріванні на 1 К.
Геометричне тлумачення роботи:
На графіку p = f(V) при ізобарному процесі робота дорівнює площі заштрихованого малюнку а) прямокутника.
Якщо процес не ізобарний (рис. б), то криву p = f(V) можна уявити як ламану, що складається з великої кількості ізохор та ізобар. Робота на ізохорних ділянках дорівнює нулю, а сумарна робота на всіх ізобарних ділянках дорівнюватиме площі заштрихованої фігури. При ізотермічному процесі ( Т= const) робота дорівнює площі заштрихованої фігури, зображеної на малюнку ст.