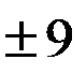Нека поговорим за това какво е количеството на веществото, как този термин се използва в предметите по природни науки. Тъй като на количествените връзки в химията и физиката се обръща сериозно внимание, е важно да се знае физическото значение на всички величини, техните мерни единици и области на приложение.
Обозначение, определение, мерни единици
В химията количествените зависимости са от особено значение. За извършване на изчисления с помощта на уравнения се използват специални количества. За да разберем какво е количеството вещество в химията, нека дадем определение на термина. Това физическо количество, който характеризира броя на подобни структурни единици (атоми, йони, молекули, електрони), присъстващи в дадено вещество. За да разберем какво е количеството вещество, отбелязваме, че това количество има свое собствено обозначение. Когато извършвате изчисления, които включват използването на тази стойност, използвайте буквата n. Мерни единици - мол, кмол, ммол.
Стойност стойност
Осмокласници, които още не могат да пишат химични уравнения, не знаят какво е количеството на дадено вещество или как да използват тази стойност в изчисленията. След запознаване със закона за постоянството на масата на веществата значението на тази величина става ясно. Например при реакцията на изгаряне на водород в кислород съотношението на реагентите е две към едно. Ако е известна масата на водорода, който е влязъл в процеса, е възможно да се определи количеството кислород, който е участвал в химическата реакция.
Използването на формули за количеството вещество ви позволява да намалите съотношението между първоначалните реагенти и да опростите изчисленията. Какво е количеството на веществото в химията? В математически термини това са стереохимичните коефициенти, включени в уравнението. Те се използват за извършване на определени изчисления. Тъй като е неудобно да се брои броят на молекулите, те използват Mole. Използвайки числото на Авогадро, можем да изчислим, че 1 mol от всеки реагент съдържа 6 1023 mol−1.


Изчисления
Искате ли да разберете какво е количеството на дадено вещество? Това количество се използва и във физиката. Тя е необходима в молекулярна физика, където налягането и обемът на газообразните вещества се изчисляват с помощта на уравнението на Менделеев-Клапейрон. За извършване на каквито и да било количествени изчисления се използва понятието моларна маса.


Под него имаме предвид масата, която съответства на един мол от специфичен химическо вещество. Моларната маса може да се определи чрез относителните атомни маси (тяхната сума, като се вземе предвид броят на атомите в молекулата) или да се определи чрез известната маса на веществото, неговото количество (mol).
Нито един проблем в училищен курс по химия, свързан с изчисления с помощта на уравнение, не е завършен без използването на такъв термин като „количество вещество“. След като усвоите алгоритъма, можете да се справите не само с обикновени софтуерни изчисления, но и със сложни олимпиадни задачи. В допълнение към изчисленията чрез масата на веществото е възможно също така, използвайки тази концепция, да се извършват изчисления чрез моларния обем. Това е от значение в случаите, когато във взаимодействието участват газообразни вещества.
Тест по темата „Основни химични понятия“
(Възможни са няколко верни отговора)
1. Обемни дробиазот и етилен (C 2 H 4) в сместа са еднакви. Масови фракции на газове в същата смес:
а) са еднакви; б) повече за азота;
в) повече за етилен; г) зависи от налягането.
2. Маса на 10 m3 въздух при бр. равен (в кг):
а) 20,15; б) 16,25; в) 14,50; г) 12,95.
3. 465 mg калциев фосфат съдържа съответно следния брой катиони и аниони:
а) 2,7 1021 и 1,8 1021; б) 4,5 1020 и 3,0 1020;
в) 2,7 1025 и 1,8 1025; г) 1,2 1025 и 1,1 1025.
4. Броят на моловете водни молекули, съдържащи се в 18.06 1022 водни молекули, е равен на:
а) 0,667; б) 0,5; в) 0,3; г) 12.
5. От следните вещества простите включват:
а) сярна киселина; б) сяра;
в) водород; г) бром.
6. Атом с маса 2,66 10–26 kg съответства на елемента:
а) сяра; б) магнезий;
в) кислород; г) цинк.
7. Частица, която е химически делима, е:
а) протон; б) молекула;
в) позитрон; г) атом.
8. За въглерода като за проста работав изявлението се казва:
а) въглеродът е разпространен в природата под формата на изотоп с масово число 12;
б) въглеродът по време на горене, в зависимост от условията, може да образува два оксида;
в) въглеродът е част от карбонатите;
г) въглеродът има няколко алотропни модификации.
9. Валентността на атома е:
номер химически връзки, образуван от даден атом в съединение;
б) степен на окисление на атома;
в) броя на отдадените или получените електрони;
г) броя на липсващите електрони за получаване на електронната конфигурация на най-близкия инертен газ.
10. Кое от следните е химично явление?
а) топене на лед; б) електролиза на вода;
в) сублимация на йод; г) фотосинтеза.
Ключ към теста
Задачи за определяне на количеството на веществото с помощта на основни формули
(Според известна маса, обем, брой структурни единици)
Ниво А
1. Колко хромни атома се съдържат в 2 g калиев дихромат?
Отговор. 8,19 1021.
2. Кои атоми - желязо или магнезий - са по-многобройни в земната кораи колко пъти? Масовата част на желязото в земната кора е 5,1%, магнезия – 2,1%.
Отговор. Има повече железни атоми от магнезиеви атоми с 1,04 пъти.
3. Какъв обем (в l) прави:
а) 1,5 1022 флуорни молекули;
б) 38 g флуор;
в) 1 1023 кислородни молекули?
Отговор. а) 0,558; б) 22,4; в) 3,72.
4. Намерете масата (в g) на една молекула: а) вода;
б) флуороводородна киселина; в) азотна киселина.
Отговор. а) 2,99 10–23; б) 3,32 10–23; в) 1,046 10–22.
5. Колко мола вещество се съдържа в:
а) 3 g борен трифлуорид;
б) 20 l хлороводород;
в) 47 mg фосфорен пентаоксид;
г) 5 ml вода?
Отговор. а) 0,044; б) 0,893; в) 0,33; г) 0,28.
6. Метал с тегло 0,4 g съдържа 6,02 1021 атома. Идентифицирайте метала.
дадени:
н= 6,02 1021 атома, м(М) = 0,4 g.
Намирам:
метал.
Решение


Желаният метал е Ca.
Отговор. калций.
7. В едната чаша на везната има известно количество медни стърготини, в другата част на везната има порция магнезий, съдържаща 75,25 1023 магнезиеви атоми, докато люспите са в състояние на равновесие. Каква е масата на порция медни стружки?
Отговор. 300 гр.
8. Изчислете количеството калций, съдържащо се в 62 kg калциев фосфат.
Отговор. 600 mol.
9. В проба от медно-сребърна сплав броят на медните атоми е равен на броя на сребърните атоми. Изчислете масовата част на среброто в сплавта.
Отговор. 62,8%.
10. Намерете масата на една структурна единица готварска сол NaCl.
Отговор. 9,72 10–23 Ж.
11. Намерете моларната маса на веществото, ако масата на една молекула е 5,31 10–23 Ж.
Отговор. 32 g/mol.
12. Намерете моларна маса газообразно вещество, ако 112 мл от него на бр. имат маса 0,14 g.
Отговор. 28 g/mol.
13. Намерете моларната маса на газообразното вещество, ако при не. 5 g от това вещество заемат обем от 56 литра.
Отговор. 2 g/mol.
14. Кое съдържа повече водородни атоми: 6 g вода или 6 g етилов алкохол?
Отговор. В 6 g етилов алкохол.
15. Колко грама калций се съдържат в 1 kg гипс?
Отговор. 232,5 g.
16. Изчислете в солта на Мор, която има формулата Fe(NH 4 ) 2 (ТАКА 4 ) 2 6H 2 O, масови фракции (%):
а) азот; б) вода; в) сулфатни йони.
Отговор. а) 7,14; б) 27,55; в) 48,98.
Ниво Б
1. Към 100 g 20% разтвор на солна киселинадобавени 100 g 20% разтвор на натриев хидроксид. Колко структурни единици от молекули NaCl сол и вода съдържа полученият разтвор?
Отговор. 5,65 1024 водни молекули и 3,01 1023 структурни единици на NaCl сол.
2. Определете масата на 8,2 литра газова смес от хелий, аргон и неон (н.у.), ако за един атом хелий в тази смес има два атома неон и три атома аргон.
Отговор. 10 гр.
3. В какво съотношение по маса трябва да се смесят 2% разтвори на калиев хлорид и натриев сулфат, така че крайният разтвор да съдържа четири пъти повече натриеви йони по маса от калиеви йони?
Отговор. 6,46:1.
4. Плътността на течния кислород при температура –183 °C е 1,14 g/cm3 . Колко пъти ще се увеличи обемът на кислорода, когато се движи от течно състояниекъм газообразен при N.S.?
Отговор. 798 пъти.
5. Каква е масовата част на сярната киселина в разтвор, в който броят на водородните и кислородните атоми е равен?
Решение
Разтвор H 2 ТАКА 4 се състои от Х 2 ТАКА 4 и Х 2 О. Нека (H 2 ТАКА 4 ) = x mol, тогава (H в H 2 ТАКА 4 ) = 2xmol;
(З 2 O) = y mol, тогава (H в H 2 O) = 2y mol.
Количество (H в разтвор) = (2x + 2y) mol.
Нека определим количеството атомно кислородно вещество:
(О до Н 2 ТАКА 4 ) = 4x mol, (О в Н 2 O) = y mol.
Количество (O в разтвор) = (4x + y) mol.
Тъй като броят на О и Н атомите е равен, тогава 2x + 2y = 4x + y.
Решавайки уравнението, получаваме: 2x = y. Ако
Определяне на еквивалентното количество материя от вторичен облак
Определяне на еквивалентното количество материя от първичния облак
Определяне на количествени характеристики на освобождаването
Прогнозиране на дълбочината на зоните на инфекция на SDYAV
Първоначални данни за прогнозиране на мащаба на инфекцията със СДЯВ
1. Общият брой на химически активните вещества в съоръжението и данни за разполагането на техните запаси в резервоари и технологични тръбопроводи.
2. Количеството експлозивни вещества, изпуснати в атмосферата, и естеството на тяхното разливане върху подлежащата повърхност („свободно“, „в тиган“ или „насип“).
3. Височината на палета или групата резервоари за съхранение.
4. Метеорологични условия: температура на въздуха, скорост на вятъра (на височината на ветропоказателя), степен на вертикална стабилност на въздуха.
При предварително прогнозиране на мащаба на замърсяване в случай на промишлени аварии се препоръчва да се вземат като първоначални данни: стойността на освобождаването на токсични вещества ( Q около ) – съдържанието му в максималния обемен капацитет (технологичен, складов, транспортен и др.), метеорологичните условия – степента на вертикална устойчивост на въздуха, скорост и температура на вятъра. За да се предвиди мащабът на замърсяване непосредствено след авария, трябва да се вземат конкретни данни за количеството изхвърлен (разлят) SDYAS, времето, изминало от аварията, и естеството на разлива върху подлежащата повърхност. Външните граници на зоната на инфекция на SDYV се изчисляват въз основа на праговата токсодоза по време на инхалационна експозиция на човешкото тяло.
Изчисляването на дълбочината на зоната на замърсяване на SDYAV се извършва с помощта на данните, дадени в таблици 11-13; стойността на дълбочината на зоната на замърсяване по време на аварийно изпускане (разлив) на SDYAV се определя съгласно таблица 8 в зависимост от количественото характеристики на изпускане и скорост на вятъра.
Количествените характеристики на освобождаването на SDYAV за изчисляване на мащаба на инфекцията се определят от техните еквивалентни стойности.
За сгъстените газове еквивалентното количество вещество се определя само от първичния облак.
За втечнен СДЯВ, чиято точка на кипене е по-висока от температурата заобикаляща среда, еквивалентното количество материя се определя само от вторичния облак. За SDYAS, чиято точка на кипене е по-ниска от температурата на околната среда, еквивалентното количество на веществото се определя от първичния и вторичния облак.
Еквивалентното количество вещество в първичния облак (в тонове) се определя по формулата
Където К 1 - коефициент в зависимост от условията на съхранение на СДЯВ, табл.12;
К 3- коефициент, равен на отношението на праговата токсодоза на хлор към праговата токсодоза на друг СДЯВ, таблица 12;
К 5- коефициент, отчитащ степента на вертикална устойчивост на въздуха (приема се равен за инверсия - 1; за изотерма - 0,23; за конвекция - 0,08), таблица 11;
К 7- коефициент, отчитащ влиянието на температурата на въздуха, таблица 12;
Q o- количеството вещество, изпуснато (разлято) по време на авария, т.е.
Еквивалентното количество материя във вторичния облак се изчислява по формулата
Където К 2 – коефициент в зависимост от физикохимичните свойства на СДЯВ, табл.12;
К 4– коефициент, отчитащ скоростта на вятъра, таблица 13;
К 6– коефициент в зависимост от времето, изминало от началото на аварията; н , К 6 определя се след изчисляване на продължителността TИ времето на изпаряване на веществото, при N = t I;
ч– дебелина на слоя СДЯВ, m;
д– Плътност на СДЯВ, t/m3, табл.12.
Височината на разлятата течност по време на свободно разливане се приема за 0,05 м. Ако има палет или контейнерът е задигнат, тогава
където H е височината на палета или насипа.
Времето за изпаряване на СДЯВ се изчислява по формулата

 , (h). (4)
, (h). (4)
Таблица 11
Определяне на степента на вертикална стабилност на въздуха въз основа на прогнозата за времето
ЗАБЕЛЕЖКА:
1. Обозначение: в –обръщане; от– изотермия; Да се– конвекция, букви в скоби - със снежна покривка.
2. Под термина "сутрин"се отнася за периода от време в рамките на два часа след изгрев слънце; под термина "вечер"- до два часа след залез слънце.
Периодът от изгрев до залез минус два сутрешни часа - ден,и периодът от залез до изгрев минус два вечерни часа – нощ.
3. Скоростта на вятъра и степента на вертикална устойчивост на въздуха се вземат предвид при изчисленията по време на аварии.
Таблица 9
Таблица 13
Стойността на коефициента K4 в зависимост от скоростта на вятъра
| Скорост на вятъра, m/s | |||||||||||
| К 4 | 1,0 | 1,33 | 1,67 | 2,0 | 2,34 | 2,67 | 3,0 | 3,34 | 3,67 | 4,0 | 5,68 |
Формула за намиране на количеството вещество?
Ирина Рудерфер
Количеството на веществото е физическо количество, което характеризира броя на подобни структурни единици, съдържащи се в веществото. Структурните единици се отнасят до всички частици, които изграждат дадено вещество (атоми, молекули, йони, електрони или всякакви други частици). Единицата SI за измерване на количеството вещество е молът.
[редактиране] Приложение
Това физическо количество се използва за измерване на макроскопични количества вещества в случаите, когато за цифрово описание на изследваните процеси е необходимо да се вземе предвид микроскопичната структура на веществото, например в химията, когато се изучават процеси на електролиза, или в термодинамиката, когато се описват уравненията на състоянието на идеален газ.
При описване химична реакция, количеството на веществото е по-удобно количество от масата, тъй като молекулите взаимодействат независимо от тяхната маса в количества, които са кратни на цели числа.
Например, реакцията на горене на водород (2H2 + O2 → 2H2O) изисква два пъти повече водород, отколкото кислород. В този случай масата на водорода, участващ в реакцията, е приблизително 8 пъти по-малка от масата на кислорода (тъй като атомната маса на водорода е приблизително 16 пъти по-малка атомна масакислород). По този начин използването на количеството вещество улеснява тълкуването на реакционните уравнения: връзката между количествата на реагиращите вещества се отразява директно от коефициентите в уравненията.
Тъй като е неудобно да се използва броят на молекулите директно в изчисленията, тъй като това число в реални експерименти е твърде голямо, вместо да се измерва броят на молекулите „на парчета“, те се измерват в молове. Действителният брой единици на вещество в 1 мол се нарича числото на Авогадро (NA = 6,022 141 79(30)×1023 mol-1 (по-правилно, константата на Авогадро, тъй като, за разлика от числото, това количество има мерни единици).
Количеството на дадено вещество се обозначава с гръцката буква ν (nu) или, опростено, с латинската буква n (en). За да се изчисли количеството на вещество въз основа на неговата маса, се използва понятието моларна маса: ν = m / M, където m е масата на веществото, M е моларната маса на веществото. Моларната маса е общата маса на един мол молекули от дадено вещество. Моларната маса на веществото може да се получи от продукта молекулно теглона това вещество по броя на молекулите в 1 мол - по числото на Авогадро.
Съгласно закона на Авогадро, количеството на газообразно вещество може да се определи и въз основа на неговия обем: ν = V / Vm - където V е обемът на газа (при нормални условия), Vm е моларният обем на газа при N.U., равен до 22,4 l/ mol.
По този начин една валидна формула комбинира основни изчисления с количеството вещество: ![]()
![]()
Диана Тангатова
обозначение: мол, международен: мол - единица за измерване на количеството на веществото. Съответства на количеството вещество, което съдържа NA частици (молекули, атоми, йони).Затова е въведена универсална стойност - броя на моловете. Често срещана фраза в задачите е „… беше получен мол вещество“
NA = 6,02 1023
NA е числото на Авогадро. Също така „номер по споразумение“. Колко атома има на върха на молив? Около хиляда. Не е удобно да се работи с такива количества. Затова химиците и физиците по света се съгласиха - нека обозначим 6,02 × 1023 частици (атоми, молекули, йони) като 1 мол вещество.
1 мол = 6,02 1023 частици
Това беше първата от основните формули за решаване на проблеми.
Моларна маса на веществото
Моларната маса на веществото е масата на един мол от веществото.
Означава се като Mr. Намира се според периодичната таблица - това е просто сумата от атомните маси на дадено вещество.
Например, дадена ни е сярна киселина - H2SO4. Нека изчислим моларната маса на веществото: атомна маса H = 1, S-32, O-16.
Mr(H2SO4)=1 2+32+16 4=98 g\mol.
Втората необходима формула за решаване на проблеми е
Формула за масата на веществото:
Тоест, за да намерите масата на дадено вещество, трябва да знаете броя молове (n), а моларната маса намираме от периодичната таблица.
Законът за запазване на масата - масата на веществата, които влизат в химична реакция, винаги е равна на масата на образуваните вещества.
Ако знаем масата(ите) на веществата, които са реагирали, можем да намерим масата(ите) на продуктите от тази реакция. И обратно.
Третата формула за решаване на задачи по химия е
Обем на веществото:
Основни формули за решаване на задачи по химия
Откъде идва числото 22,4? От закона на Авогадро:
IN равни обемиРазличните газове, взети при една и съща температура и налягане, съдържат еднакъв брой молекули.
Според закона на Авогадро 1 мол идеален газ при нормални условия (n.s.) има същия обем Vm = 22,413 996(39) l
Тоест, ако в проблема ни бъдат дадени нормални условия, тогава, знаейки броя на моловете (n), можем да намерим обема на веществото.
И така, основните формули за решаване на задачи по химия
Нотация Формула Числото на Авогадро NA
6.02 1023 частици
Количество вещество n (mol)
n=m\Mr
n=V\22,4 (l\mol)
Маса на веществото (g)
m=n Mr
Обем на веществото M (l)
V=n 22,4 (l\mol)
Или ето още един полезен знак:
Основни формули за решаване на задачи по химия
Това са формули. Често, за да решите задачи, първо трябва да напишете уравнението на реакцията и (задължително!) Подредете коефициентите - тяхното съотношение определя съотношението на моловете в процеса.
Формула за намиране на броя молове, използвайки маса и моларна маса. Моля, дайте ми формулата за изпита утре!!!
Екатерина от Курган
Мол, моларна маса
В химичните процеси участват най-малките частици – молекули, атоми, йони, електрони. Броят на такива частици дори в малка част от веществото е много голям. Следователно, за да се избегнат математически операции с големи числа, се използва специална единица, мол, за характеризиране на количеството вещество, участващо в химическа реакция.
Молът е количество от вещество, което съдържа определен брой частици (молекули, атоми, йони), равен на константата на Авогадро
Константата на Авогадро NA се определя като броя на атомите, съдържащи се в 12 g изотоп 12C:
Така 1 мол вещество съдържа 6,02 1023 частици от това вещество.
Въз основа на това всяко количество вещество може да бъде изразено чрез определен брой молове ν (nu). Например проба от вещество съдържа 12,04 1023 молекули. Следователно количеството вещество в тази проба е:
Общо взето:
Където N е броят на частиците от дадено вещество;
NA е броят на частиците, който съдържа 1 мол вещество (константа на Авогадро).
Моларна маса на вещество (M) е масата, която има 1 мол от дадено вещество.
Това количество, равно на съотношението на масата m на веществото към количеството вещество ν, има размерността kg/mol или g/mol. Моларната маса, изразена в g/mol, е числено равна на относителната относителна молекулна маса Mr (за вещества с атомна структура - относителната атомна маса Ar).
Например, моларната маса на метан CH4 се определя, както следва:
Мr(CH4) = Ar(C) + 4 Ar(H) = 12+4 =16
M(CH4) = 16 g/mol, т.е. 16 g CH4 съдържат 6,02 1023 молекули.
Моларната маса на дадено вещество може да се изчисли, ако са известни неговата маса m и количеството (брой молове) ν, като се използва формулата:
Съответно, знаейки масата и моларната маса на дадено вещество, можете да изчислите броя на неговите молове:
Или намерете масата на веществото по броя на моловете и моларната маса:
m = ν M
Трябва да се отбележи, че стойността на моларната маса на веществото се определя от неговия качествен и количествен състав, т.е. зависи от Mr и Ar. Следователно различните вещества с еднакъв брой молове имат различни маси m.
Пример
Изчислете масите на метан CH4 и етан C2H6, взети в количество ν = 2 mol всеки.
Решение
Моларната маса на метана M(CH4) е 16 g/mol;
моларна маса на етан M(C2H6) = 2 12 + 6 = 30 g/mol.
Оттук:
m(CH4) = 2 mol 16 g/mol = 32 g;
m(C2H6) = 2 mol 30 g/mol = 60 g.
По този начин молът е част от вещество, съдържаща същия брой частици, но с различни маси за различни вещества, тъй като частиците на веществото (атоми и молекули) не са еднакви по маса.
n(CH4) = n(C2H6), но m(CH4)< m(С2Н6)
Изчисляването на ν се използва в почти всеки изчислителен проблем.
Иван Князев
масата се измерва в грамове, количеството на веществото в молове, моларната маса в грамове, разделена на мол. Ясно е, че за да се получи моларната маса, масата трябва да се раздели на количеството, съответно количеството е масата, разделена на моларната маса
Най-типичните процеси, извършвани в химията, са химичните реакции, т.е. взаимодействия между някои изходни вещества, водещи до образуването на нови вещества. Веществата реагират в определени количествени отношения, които трябва да се вземат предвид, за да се получат желаните продукти. минимално количествоизходни материали и не създава безполезни производствени отпадъци. За да се изчислят масите на реагиращите вещества, се оказва, че е необходимо друго физическо количество, което характеризира част от веществото по отношение на броя на структурните единици, които съдържа. Самото това число е необичайно голямо. Това е очевидно по-специално от пример 2.2. Следователно при практически изчисления броят на структурните единици се заменя със специално количество, наречено количествовещества.
Количеството вещество е мярка за броя на структурните единици, определени от израза
Където N(X)- брой структурни единици на дадено вещество хв реална или умствено взета част от вещество, N A = 6.02 10 23 - Константа (число) на Авогадро, широко използвана в науката, една от основните физични константи. Ако е необходимо, можете да използвате по-точна стойност на константата на Авогадро 6.02214 10 23. Част от вещество, съдържаща N a структурни единици представлява единица количество вещество - 1 mol. По този начин количеството на веществото се измерва в молове, а константата на Авогадро има единица 1/mol или в друга нотация mol -1.
Във всички видове разсъждения и изчисления, свързани със свойствата на материята и химичните реакции, понятието количество веществонапълно замества концепцията брой структурни звена.Това елиминира необходимостта от използване на големи числа. Например, вместо да кажем „взети са 6,02 10 23 структурни единици (молекули) вода“, бихме казали: „взет е 1 мол вода“.
Всяка част от веществото се характеризира както с маса, така и с количество вещество.
Съотношение на масата на веществотохкъм количеството вещество се нарича моларна масаM(X):
Моларната маса е числено равна на масата на 1 мол вещество. Това е важна количествена характеристика на всяко вещество, зависи само от масата на структурните единици. Числото на Авогадро се установява така, че моларната маса на веществото, изразена в g/mol, числено съвпада с относителната молекулна маса M gЗа водна молекула M g = 18. Това означава, че моларната маса на водата M(H 2 0) = 18 g/mol. Използвайки данните от периодичната таблица, можете да изчислите по-точни стойности M gИ M(X),но в образователни задачив химията това обикновено не се изисква. От всичко казано е ясно колко лесно е да се изчисли моларната маса на дадено вещество - просто съберете атомните маси в съответствие с формулата на веществото и поставете мерната единица g/mol. Следователно формула (2.4) се използва практически за изчисляване на количеството вещество:

Пример 2.9.Изчислете моларната маса на сода за пиене NaHC0 3.
Решение.Според формулата на веществото M g = 23 + 1 + 12 + 3 16 = 84. Следователно, по дефиниция, M(NaIIC0 3) = 84 g/mol.
Пример 2.10.Какво количество вещество е 16,8 g сода за хляб? Решение. M(NaHC03) = 84 g/mol (виж по-горе). По формула (2.5)
Пример 2.11.Колко единици (структурни единици) сода за хляб има в 16,8 g от веществото?
Решение.Преобразувайки формула (2.3), намираме:
AT(NaHC03) = N a n(NaHC03);
tt(NaHC03) = 0,20 mol (вижте пример 2.10);
N(NaHC03) = 6,02 10 23 mol" 1 0,20 mol = 1,204 10 23.
Пример 2.12.Колко атома има в 16,8 g сода за хляб?
Решение.Содата за хляб, NaHC0 3, се състои от натриеви, водородни, въглеродни и кислородни атоми. Като цяло структурната единица на веществото съдържа 1 + 1 + 1 + 3 = 6 атома. Както беше установено в пример 2.11, тази маса сода за хляб се състои от 1,204 10 23 структурни единици. Следователно общият брой на атомите в едно вещество е
И така, количеството вещество в химията се обозначава с гръцката буква ну.
Спомням си как в 9 клас моят учител по физика Игор Юриевич ме научи как да пиша правилно буквата ну. Преди това ми се получи малко неумело.
Но тъй като гръцките букви не минават през BV, ще обознача количеството вещество с латинската буква v. Латинското v е много подобно на гръцкото голо.
Нека разгледаме следните случаи.
1) Ако знаем броя на частиците на дадено вещество, тогава количеството на веществото може да се намери по формулата:
v количество вещество;
n е броят на частиците на дадено вещество. Това е безразмерна величина, тоест е просто число. Вярно, това число може да бъде много голямо, например 5*(10^24).
NA е константата на Авогадро. Константата на Авогадро е универсална константа. NA = 6,022*(10^23) mol^(1).
2) Ако знаем масата на дадено вещество, тогава количеството на веществото се намира по следната формула:
v количество вещество;
m е масата на веществото;
M моларната маса на веществото се намира според химичната формула на веществото, като се използва периодичната таблицаД. И. Менделеев чрез сумиране на атомните маси на всички атоми, включени в молекулата, като се вземат предвид наличните индекси.
3) Ако знаем обема газообразенвещество, тогава можем да намерим количеството на газовото вещество, като използваме следната формула:
v количество вещество;
V обем газ;
Vm моларен обем на газовете. Моларният обем на газовете е универсална константа. Vm = 22,414 l/mol = 22414 m3/mol.
Повтарям това формулата v = V/Vm е валидна само за газове!
И накрая, нека да разгледаме вашия случай.
По условие ви е даден обем и обемна част.
Бих се осмелил да предположа, че вашата задача е нещо подобно:
Обемът на газовата смес е 240 l. Обемната част на кислорода в сместа е 45%. Изчислете количеството кислород в сместа.
Този проблем се решава на две стъпки.
1) Намерете обема на кислорода:
V (O2) = V0 * f / 100 = 240 l * 45 / 100 = 108 l.
(F е обемна фракция, обозначава се с гръцката буква фи. Вместо това не е необходимо да се пише руски f).
2) Намерете количеството кислородно вещество. Кислородът е газ, което означава, че имаме право да използваме формулата v = V/Vm.
v (O2) = V/Vm = 108 l: 22,414 l/mol = 4,818 mol. Закръгляването се извършва до хилядни.
По химия количеството вещество се измерва в молове. В един мол количеството вещество е числено = константата на Авогадро (NA = 6,022). Ако броят на молекулите N е равен на NA, тогава теглото им в единици за атомна маса (amu) е равно на теглото им в грамове. Следователно, за да преведем a.m.u. в грамове, просто ги умножете по NA (6,022*amu=1g).
Масата на 1 мол вещество обикновено се нарича моларна маса (означена с буквата М), която се определя чрез умножаване на молекулната маса по константата на Авогадро.
Молекулно теглонамира се чрез сумиране на атомната маса на атомите, които изграждат молекулата на определено вещество. Класически пример за молекулно тегло за водни молекули: 1*2+16=18 g/mol.
Количеството вещество се изчислява по формулата: n = mM, в което m е масата на веществото.
Брой молекули: N = NA*n
за газове се използва следната формула: V = Vm *n, в която Vm е моларният обем на газа, при нормални условия равен на 22,4 l/mol.
Общото съотношение е:
Количеството на веществото е химически термин, който се използва в някои случаи за преброяване на броя на структурните единици от същия тип.
Те преподават подобен материал в училище и беше интересно да запаметявам тази информация и формули.
Но ако някой е забравил, може би мога да опресня паметта си:
Решаваме задачи, като използваме формулата n = mM, където m се приема за масата на веществото.
Количеството на веществото е броят на молекулите и се означава с молове.
1 мол се равнява на 6.02.1023 структурни частици на дадено вещество.
Тук можете да видите как се решават подобни проблеми.
Намирането на количеството вещество обикновено се използва във физиката или химията. Има няколко формули, по които можете да намерите количеството на дадено вещество в зависимост от данните, дадени ни в задачата с данни. Това са формулите:

Количеството вещество може да се намери, като масата се раздели на моларната маса

Често можете да забележите как се използва такова понятие като моларен обем - V(m). Равен е на обема на един мол вещество - има следната формула:

Можете също така да използвате следствие от един от основните закони на химическата наука - закона на Авогардо.
Количеството вещество е физична величина, характеризираща се със сходни структурни единици, присъстващи в веществото. И така, тези структурни единици означават всички частици, които изграждат вещество (молекули, йони, атоми, електрони и т.н.). Количеството на веществото се измерва в единици SI в молове.
Ето как да намерите количеството вещество:



Най-широко използваната формула за намиране на количеството на дадено вещество е:
![]()
Както виждаме, изчисленията трябва да се основават на входните данни, след това или на масата, или на обема на веществото.

Мерната единица за количеството вещество е молът. Означава се с буква н. Общи формулида намеря:

Във формулата може да има непознати обозначения, трябва ясно да знаете, че:
N е броят на молекулите;
Vm моларен обем на газовете ( постояненравно на 22,414 l/mol).
Първо, нека да разберем какво е количеството на дадено вещество.
Това понятие се разбира като количество, което характеризира броя на структурните единици от същия вид вещество. Структурните единици могат да бъдат или атоми, молекули, или електрони и йони.
Количеството вещество се измерва в молове.
Един мол съдържа определено количество вещество, което се нарича константа на Авогадро или число на Авогадро.
Това число е равно на NA = 6,022 141 79(30)1023 mol1.
Така че количеството на дадено вещество може да се намери по следната формула:
n=m/M
където m е масата на веществото, а M е моларната маса на веществото.
Има и друга формула:
n = V / Vm
където V е обемът на газа при нормални условия, а Vm е моларният обем на газа при нормални условия (равно е на 22,4 l/mol).
Между веществата протичат химични реакции. Веществата се състоят от атоми, молекули или йони и именно тези елементарни частици на материята участват във взаимодействие помежду си.
химичните реакции са взаимодействие или пренареждане на отделни атоми, молекули или йони на реагиращи вещества
На практика (в индустрията или химическа лаборатория) реакциите се извършват с макроколичества вещества, които се състоят от огромен брой най-прости химически частици (атоми, йонни молекули).
Въз основа на атомната хипотеза на Далтон и хипотезата на Авогадро, австрийският физик Лошмид през 1865 г. установява количествена връзка между микро- и макрополетата на химията. Той установи, че 1 cm 3 газ при нормални физически условия съдържа приблизително 2,69·1019 частици от този газ (атоми - за атомни газове, например хелий (He), молекули - за молекулярни газове, например водород (H2)). Това число 2,69·10 19 във физиката се нарича числото на Лошмид.
За по-лесното разграничаване на микро- и макрообластите на химията е въведено понятието количество вещество (означението n - във физиката, или ν (nu) - в химията) - физико-химична величина, която характеризира макрочаст от това вещество по същия начин, както броят на частиците (или като цяло някои обекти, идентични обекти) характеризира микропорция от вещество (например 2 кислородни атома, 7 водородни молекули).
В химията мярката за химическите частици е тяхното цяло число (тъй като частиците - атоми, молекули, йони определят и характеризират свойствата на веществото, техният брой не може да бъде дробен, а само цяло число, например 2 атома хелий - но не и 2,3 (две точка три) от атом на хелий, тъй като три десети е част от атом, която не може да има нищо общо с атома и неговите характерни физикохимични свойства и химия), а мярката за частите на веществата е тяхното количество, чиято числена стойност вече може да бъде както цяло, така и дробно (например 1 mol хлор, 3,16 mol силиций).
Наред с това една и съща част от веществото може да се характеризира с неговата маса или обем (които са свързани помежду си чрез понятието плътност за твърди и течни вещества).
Точно както нашите предци са измислили имена, за да обозначат определен брой предмети, например 12 грахови зърна (или други предмети) са се наричали дузина; през 1971 г. химиците се споразумяха (официално на международно ниво и обозначението мол беше включено в Международната система SI) да наричат определен брой частици от вещество (материя) с думата - къртица(mol е международното обозначение).
Какъв брой частици се съдържа в 1 мол вещество (материя)?
Количеството вещество, съдържащо се в порция обикновен или сложно вещество, се определя чрез сравнение с някаква строго определена единица количество вещество. В този случай базата за сравнение е най-често срещаният изотоп на въглерода - 12 C
Един мол е количество от вещество, съдържащо същия брой формулни единици на това вещество, колкото има атоми в 12 грама (точно) от изотопа въглерод-12
Формула на вещество (или структурен елемент на вещество, негов елементарен обект) е химическа частица (атом, молекула, катион, анион), както и всяка комбинация от други елементарни частиципредадено от нея химична формула, или символ, например: Na, H 2 O, H 2 SO 4, NH +, e - (електрон), CuSO 4 5H 2 O. Следователно дадено количество вещество има смисъл, ако самото вещество е точно наименуван, т.е. е посочено от какви формулни единици се състои. По този начин записът „1 мол хлор“ е непълен (включването на подобни записи в условията на задачата се счита за грешка на условието), тъй като може да се отнася както за 1 мол молекулярен хлорен газ Cl 2, така и за 1 мол хлорни атоми Cl като елемент - и това са различни вещества, с различна маса на частиците и физикохимични свойства.
В наименованието на физическа величина - количеството вещество - думата "вещество" се използва в повече в широк смисъл, обозначавайки не само химическо вещество, но и самата материя. Следователно броят на формулните единици включва и електрони (а във физиката и други физически частици), които сами по себе си не образуват химическо вещество. Количеството електронен газ (или просто електрони) също може да бъде 1 мол, тъй като електроните (и други подобни частици) се броят наравно с атомите, молекулите и йоните.
Така, 1 mol = 6,02214082(11)×10 23части от формулни единици (атоми, молекули, йони и други частици). Физикохимичната константа, съответстваща на това число, се нарича константа на Авогадро (число на Авогадро) и се обозначава с N A:
N A = 6,02214082(11)×10 23 mol -1 ≈ 6,022×10 23 mol -1
Числото на Авогадро не трябва да се бърка с числото на Лошмид. Числото на Авогадро е универсално, то показва броя на формулните единици на веществото в неговото количество, равно на 1 мол, независимо от агрегатното състояние на веществото. Числото на Лошмид има ограничено значение; то се прилага само за газове при нормални физически условия, за които може да се използва константата на Лошмид:
N L = 2,686754 10 19 cm -3 ≈ 2,69 10 19 cm -3
Константите на Авогадро и Лошмид се определят с достатъчна точност с помощта на различни методи и обекти. Еднозначността на резултатите от техните определения е пряко доказателство за съществуването на атоми и молекули и потвърждава научната обоснованост на атомно-молекулярното учение.
Писането на формулни единици в уравненията на реакциите означава не само, че отделните частици на веществата реагират помежду си, но и техните макрочасти (всяка от които съдържа огромен брой химически частици).
Пример. От уравнението на химичната реакция
2Na + 2H 2 O = 2NaOH + H 2
следва, че два натриеви атома реагират с две водни молекули и в този случай се образуват две формулни единици на натриев хидроксид (веществото не се състои от молекули, а от Na + и OH - йони) и една водородна молекула. Но горното уравнение показва не само химическа реакция на микро ниво (между атоми), то показва и взаимодействието на веществата на макро ниво:
2 mol Na, или 2 * 6,022 × 10 23 части Na атоми реагират с 2 mol H 2 O, или 2 * 6,022 × 10 23 части H 2 O молекули, което води до образуването на 2 мола Na йони + 2 мола от OH - йони и 1 mol H2 молекули
Количеството материя може също да характеризира части от физически частици (например електрони) и следователно части електрически зарядикакто електрони, така и йони.
В старата химическа литература (преди 1970 г.), преди въвеждането на количеството на веществото като физична величина, молът беше заменен с понятието моларна маса, а именно една грам-молекула (съкратено мол) от веществото съответстваше на неговата маса (в грамове), числената стойност на която е равна на относителната молекулна маса на това вещество. Понятията „грам-йон“ и „грам-атом“ се използват по подобен начин.
Приложение
Това физическо количество се използва за измерване на макроскопични количества вещества в случаите, когато за цифрово описание на изследваните процеси е необходимо да се вземе предвид микроскопичната структура на веществото, например в химията, когато се изучават процеси на електролиза, или в термодинамиката, когато се описват уравненията на състоянието на идеален газ.
Когато се описват химични реакции, количеството на веществото е по-удобно количество от масата, тъй като молекулите взаимодействат независимо от тяхната маса в количества, кратни на цели числа.
Например, реакцията на горене на водород (2H 2 + O 2 → 2H 2 O) изисква два пъти повече водород от кислорода. В този случай масата на водорода, участващ в реакцията, е приблизително 8 пъти по-малка от масата на кислорода (тъй като атомната маса на водорода е приблизително 16 пъти по-малка от атомната маса на кислорода). По този начин използването на количеството вещество улеснява тълкуването на реакционните уравнения: връзката между количествата на реагиращите вещества се отразява директно от коефициентите в уравненията.
Тъй като е неудобно да се използва броят на молекулите директно в изчисленията, тъй като това число в реални експерименти е твърде голямо, вместо да се измерва броят на молекулите „на парчета“, те се измерват в молове. Действителният брой единици на вещество в 1 мол се нарича числото на Авогадро (N A = 6,022 141 79(30) 10 23 mol −1) (по-правилно - Константата на Авогадро, тъй като за разлика от числото това количество има мерни единици).
Количеството на веществото се обозначава с латинското n (en) и не се препоръчва да се обозначава с гръцката буква (nu), тъй като в химичната термодинамика тази буква означава стехиометричния коефициент на веществото в реакцията, а той, с определение, е положителен за реакционните продукти и отрицателен за реагентите. Въпреки това, в училищен курстой се използва широко гръцка буква(голо).
За да изчислите количеството на вещество въз основа на неговата маса, използвайте концепцията за моларна маса: където m е масата на веществото, M е моларната маса на веществото. Моларната маса е масата на мол от дадено вещество. Моларната маса на дадено вещество може да се получи чрез умножаване на молекулната маса на това вещество по броя на молекулите в 1 мол - по числото на Авогадро. Моларната маса (измерена в g/mol) е числено същата като относителната молекулна маса.
Съгласно закона на Авогадро, количеството на газообразно вещество може да се определи и въз основа на неговия обем: = V / V m, където V е обемът на газа (при нормални условия), V m е моларният обем на газа при N.U., равно на 22,4 l / mol.
По този начин една валидна формула комбинира основни изчисления с количеството вещество:
Фондация Уикимедия. 2010 г.
Вижте какво е „Количество вещество“ в други речници:
количество вещество- medžiagos kiekis statusas T sritis Standartizacija и метрология apibrėžtis Dydis, išreiškiamas medžiagos masės ir jos molio masės dalmeniu. атитикменис: англ. количество вещество вок. Molmenge, f; Щофменге, рус. количество вещество, n;… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
количество вещество- medžiagos kiekis statusas T sritis fizika atitikmenys: англ. количество вещество вок. Щофменге, рус. количество вещество, n пранц. quantité de matière, f … Fizikos terminų žodynas
Phys. количество, определено от броя на структурните елементи (атоми, молекули, йони и други частици или техните групи), съдържащи се в дадено вещество (виж Мол) ... Голям енциклопедичен политехнически речник
количество вещество, задържано в тялото- rus съдържание (c) на вредно вещество в тялото, количество (c) на вещество, задържано в тялото eng телесно натоварване fra такса (f) corporelle deu inkorporierte Noxe (f) spa carga (f) corporal ... Безопасност и здраве при работа. Превод на английски, френски, немски, испански
малко количество (вещество)- много малко количество вещество - Теми нефтена и газова промишленост Синоними много малко количество вещество EN следи ... Ръководство за технически преводач
Минималното количество вещество в производството наведнъж, което определя границата между технологичните процеси и технологичните процеси с повишена пожароопасност.