Над свободната повърхност на течност винаги има пари от тази течност. Ако съдът с течността не е затворен, тогава концентрацията на парни частици при постоянна температура може да варира в широк диапазон в посока на намаляване и увеличаване.
Процес на изпаряване в затворено пространство(затворен контейнер с течност) може да се случи при дадена температура само до определена граница. Това се дължи на факта, че кондензацията на парите настъпва едновременно с изпаряването на течността. Първо, броят на молекулите, напускащи течността за 1 s, е по-голям от броя на молекулите, които се връщат обратно, и плътността, а оттам и налягането на парите, се увеличава. Това води до увеличаване на скоростта на кондензация. След известно време се установява динамично равновесие, при което плътността на парите над течността става постоянна. Нарича се пара, която е в динамично равновесие с течността си наситена пара. Нарича се пара, която не е в динамично равновесие с течността си ненаситени.
Опитът показва, че ненаситените пари се подчиняват на всички газови закони и колкото по-точни са те, толкова по-далеч са от насищането. Наситените пари се характеризират със следните свойства:
литература
Аксенович Л. А. Физика в гимназия: Теория. Задачи. Тестове: Proc. надбавка за институции, предоставящи общ. среди, образование / Л. А. Аксенович, Н. Н. Ракина, К. С. Фарино; Изд. К. С. Фарино. - Мн.: Адукаци и възпитание, 2004. - C. 198-199.
Течностите са склонни да се изпаряват. Ако капнем капка вода, етер и живак на масата (само не го правете у дома!), можехме да наблюдаваме как капките постепенно изчезват – изпаряват се. Някои течности се изпаряват по-бързо, други по-бавно. Процесът на изпаряване на течност се нарича още изпаряване. Обратният процес на превръщане на парата в течност е кондензация.
Тези два процеса илюстрират фазов преход- процесът на преминаване на вещества от едно агрегатно състояние в друго:
- изпарение (преход от течно в газообразно състояние);
- кондензация (преход от газообразно състояние в течно състояние);
- десублимация (преход от газообразно състояние в твърдо състояние, заобикаляйки течната фаза);
- сублимация, тя също е сублимация (преход от твърдо в газообразно състояние, заобикаляйки течността).
Сега, между другото, е подходящият сезон да наблюдаваме процеса на десублимация в природата: измръзване и скреж по дърветата и предметите, мразовитите шарки по прозорците са неговият резултат.
Как се образува наситена и ненаситена пара?
Но обратно към изпаряването. Ще продължим да експериментираме и ще излеем течност - вода, например, в отворен съд, и ще свържем с него манометър. Невидимо за окото, изпарението се извършва в съда. Всички течни молекули са в постоянно движение. Някои се движат толкова бързо, че кинетичната им енергия е по-силна от тази, която свързва молекулите на течността заедно.
След като напуснат течността, тези молекули продължават да се движат произволно в пространството, по-голямата част от тях се разсейват в него - ето как ненаситена пара. Само малка част от тях се връща обратно в течността.
Ако затворим съда, молекулите на парите постепенно ще стават все повече и повече. И все повече и повече от тях ще се връщат в течността. Това ще увеличи налягането на парата. Това ще бъде записано от манометър, свързан към съда.
След известно време броят на молекулите, които излизат от течността и се връщат в нея, ще бъде равен. Налягането на парите ще спре да се променя. Като резултат насищане с парасе установява термодинамичното равновесие на системата течност-пара. Тоест, изпарението и кондензацията ще бъдат равни.
Свойства на наситена пара
За да ги илюстрираме ясно, използваме друг експеримент. Призовайте цялата сила на въображението си, за да си го представите. И така, нека вземем живачен манометър, състоящ се от две колена - комуникационни тръби. И в двете се излива живак, единият край е отворен, другият е запечатан, а над живака съдържа още малко етер и наситените му пари. Ако спуснете и повдигнете незапаеното коляно, нивото на живака в запоеното също ще се покачва и намалява.
В този случай количеството (обема) наситени етерни пари също ще се промени. Разликата между нивата на живачни колони в двете колена на манометъра показва налягането на наситените пари на етера. Тя ще остане непроменена през цялото време.
Това предполага свойството на наситената пара - налягането й не зависи от обема, който заема. Налягането на наситените пари на различни течности (вода и етер, например) е различно при една и съща температура.
Въпреки това, температурата на наситената пара има значение. Колкото по-висока е температурата, толкова по-високо е налягането. Налягането на наситената пара се повишава по-бързо с повишаване на температурата, отколкото при ненаситената пара. Температурата и налягането на ненаситените пари са свързани с линейна зависимост.
Може да се проведе още един интересен експеримент. Вземете празна колба без течни пари, затворете я и свържете манометър. Постепенно, капка по капка, подавайте течност в колбата. При навлизането и изпаряването на течността се установява налягането на наситените пари, което е най-високото за дадена течност при дадена температура.
Повече за температурата и наситената пара
Температурата на парата също влияе върху скоростта на кондензация. Точно както температурата на течността определя скоростта на изпаряване – с други думи броя на молекулите, които излизат от повърхността на течността за единица време.
Наситената пара има същата температура като течността. Колкото по-висока е температурата на наситената пара, толкова по-високо е нейното налягане и плътност, толкова по-ниска е плътността на течността. Когато се достигне критичната температура за веществото, плътността на течността и парата е еднаква. Ако температурата на парата е над критичната температура за веществото, физическите разлики между течна и наситена пара се изтриват.
Определяне на налягането на наситените пари в смеси с други газове
Говорихме за постоянното налягане на наситените пари при постоянна температура. Определихме налягането при "идеални" условия: когато съд или колба съдържа течност и пара само от едно вещество. Помислете също за експеримент, при който молекулите на дадено вещество се разпръскват в пространството в смес с други газове.
За целта вземаме два отворени стъклени цилиндъра и ги поставяме в двата затворени съда с етер. Както обикновено, свързваме манометър. Отваряме един съд с етер, след което манометърът отчита повишаването на налягането. Разликата между това налягане и налягането в цилиндъра със затворен съд с етер ви позволява да разберете налягането на наситените пари на етера.
Относно налягането и кипенето
Изпаряването е възможно не само от повърхността на течността, но и в нейния обем - тогава се нарича кипене. С повишаване на температурата на течността се образуват парни мехурчета. Когато налягането на наситените пари е по-голямо или равно на налягането на газа в мехурчетата, течността се изпарява в мехурчетата. И те се разширяват и се издигат на повърхността.
Течностите кипят при различни температури. При нормални условия водата кипи при 100 0 С. Но с промяна на атмосферното налягане се променя и точката на кипене. И така, в планините, където въздухът е много разреден и атмосферното налягане е по-ниско, докато се изкачвате в планините, температурата на кипене на водата също намалява.
Между другото, в херметически затворен съд кипенето изобщо е невъзможно.

Друг пример за връзката между налягането на парите и изпарението се демонстрира от такава характеристика на съдържанието на водни пари във въздуха като относителната влажност на въздуха. Представлява връзката парциално наляганеводна пара до налягане на наситена пара и се определя по формулата: φ \u003d p / p около * 100%.
При понижаване на температурата на въздуха концентрацията на водна пара в него се увеличава, т.е. те стават по-интензивни. Тази температура се нарича точка на оросяване.
Обобщаване
Използвайки прости примери, ние анализирахме същността на процеса на изпаряване и получената ненаситена и наситена пара. Можете да наблюдавате всички тези явления около себе си всеки ден: например можете да видите локви, които изсъхват след дъжд по улиците или огледало в банята, замъглено от пара. В банята можете дори да наблюдавате как първо настъпва изпаряване, а след това влагата, натрупана върху огледалото, кондензира обратно във вода.
Можете също да използвате това знание, за да направите живота си по-удобен. Например през зимата в много апартаменти въздухът е много сух и това се отразява зле на благосъстоянието. Можете да използвате модерен овлажнител, за да го направите по-влажен. Или, по старомоден начин, поставете съд с вода в стаята: постепенно изпарявайки се, водата ще насити въздуха със своите пари.
сайт, с пълно или частично копиране на материала е необходима връзка към източника.
Както знаете, течностите се изпаряват, тоест се превръщат в пара. Например локвите изсъхват след дъжд. Изпаряването на течност се дължи на факта, че някои от нейните молекули, поради тласъците на своите „съседи“, придобиват кинетична енергия, достатъчна, за да избягат от течността.
В резултат на изпарението над повърхността на течността винаги има пара.Това е газообразното състояние на материята. Водната пара е невидима, както и въздухът. Това, което често се нарича пара, е съвкупност от малки водни капчици, образувани от кондензацията на пара.
Кондензация- това е превръщането на парата в течност, тоест процесът, противоположен на изпарението. Поради кондензацията на водните пари, съдържащи се във въздуха, се образуват облаци (фиг. 44.1) и мъгла (фиг. 44.2). Студеното стъкло се замъглява, когато влезе в контакт с топъл въздух (фиг. 44.3). Това също е резултат от кондензация на водни пари.
динамичен баланс
Ако буркан с вода е плътно затворен, нивото на водата в него остава същото в продължение на много месеци.
Това означава ли, че течността не се изпарява в затворен съд?
Не, разбира се, че не: в него винаги има достатъчно бързи молекули, които постоянно излитат от течността. Въпреки това, едновременно с изпаряването настъпва кондензация: молекулите от парата летят обратно в течността.
Ако нивото на течността не се променя с времето, това означава, че процесите на изпарение и кондензация протичат със същата интензивност. В този случай се казва, че течността и парата са в динамично равновесие.
2. Наситена и ненаситена пара
Наситена пара
Фигура 44.4 схематично изобразява процесите на изпаряване и кондензация в плътно затворен съд, когато течността и парата са в динамично равновесие. 
Пара, която е в динамично равновесие с течността си, се нарича наситена.
ненаситена пара
Ако се отвори съд с течност, парата ще започне да излиза от съда навън. В резултат на това концентрацията на парите в съда ще намалее, а молекулите на парите по-рядко ще се сблъскват с повърхността на течността и ще летят в нея. Следователно интензивността на кондензацията ще намалее.
И интензивността на изпаряване остава същата. Следователно нивото на течността в съда ще започне да намалява. Ако процесът на изпаряване е по-бърз от процеса на кондензация, те казват, че над течността има ненаситена пара (фиг. 44.5). 
Във въздуха винаги има водна пара, но тя обикновено е ненаситена, така че изпарението преобладава над кондензацията. Затова локвите пресъхват.
Над повърхността на моретата и океаните парите също са ненаситени, така че те постепенно се изпаряват. Защо нивото на водата не пада?
Факт е, че издигащата се пара се охлажда и кондензира, образувайки облаци и облаци. Те се превръщат в дъждовни облаци и валят. И реките носят вода обратно към моретата и океаните.
3. Зависимост на налягането на наситените пари от температурата
Основното свойство на наситената пара е, че
Налягането на наситените пари не зависи от обема, а зависи само от температурата.
Това свойство на наситената пара не е толкова лесно за разбиране, защото изглежда противоречи на уравнението на състоянието за идеален газ
pV = (m/M)RT, (1)
от което следва, че за долната маса на газа при постоянна температура налягането е обратно пропорционално на обема. Може би за наситена пара това уравнение не е приложимо?
Отговорът е, че уравнението на състоянието на идеалния газ описва добре парата, както наситена, така и ненаситена. Но масата на наситената пара m, която е от дясната страна на уравнение (1), се променя по време на изотермично разширение или свиване - освен това по такъв начин, че налягането на наситените пари остава непроменено. Защо се случва това?
Факт е, че когато обемът на съда се промени, парата може да остане наситена само при условие, че „неговата“ течност е в същия съд. Чрез изотермично увеличаване на обема на съда ние сякаш „изваждаме” молекули от течността, които се превръщат в молекули на пара (фиг. 44.6, а). 
Ето защо това се случва. С увеличаване на обема на парата първоначално концентрацията му намалява - но за много кратък период от време. Веднага щом парата стане ненаситена, изпарението на течността в същия съд започва да „изпреварва“ кондензацията. В резултат на това масата на парата бързо нараства, докато отново се насити. След това налягането на парите ще се върне на същото ниво.
1. Като използвате фигура 44.6, б, обяснете защо когато обемът на наситената пара намалява, нейната маса намалява.
Така че, когато наситена пара се разширява или свива, нейната маса се променя поради промяна в масата на течността, съдържаща се в същия съд.
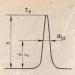
Температурната зависимост на налягането на наситените водни пари е измерена експериментално. Графиката на тази зависимост е показана на фигура 44.7. Виждаме, че налягането на наситените пари нараства много бързо с повишаване на температурата. 
Основната причина за увеличаването на налягането на наситените пари с повишаване на температурата е увеличаването на масата на парата. Както ще видите сами, изпълнявайки следната задача, с повишаване на температурата от 0 ºС до 100 ºС, масата на наситената пара в същия обем се увеличава с повече от 100 пъти!
Таблицата показва стойностите на налягането на наситените водни пари при някои температури.
Тази таблица ще ви помогне със следващата задача. Използвайте също формула (1).
2. В херметически затворен съд с обем 10 литра има вода и наситена пара. Температурата на съдържанието на съда се повишава от 0 ºС на 100 ºС. Имайте предвид, че обемът на водата в сравнение с обема на парата може да бъде пренебрегнат.
а) С колко се е увеличила абсолютната температура?
б) Колко пъти би се увеличило налягането на парите, ако остане наситено?
в) Колко пъти би се увеличила масата на парата, ако остане наситена?
г) Каква би била масата на парата в крайното състояние, ако тя остане наситена?
д) При каква минимална маса вода в първоначалното състояние парата ще остане наситена?
е) Какво ще бъде налягането на парите в крайното състояние, ако първоначалната маса на водата е 2 пъти по-малка от тази в предишния параграф?
3. Какво се увеличава по-бързо с повишаване на температурата – налягането на наситените пари или нейната плътност?
Улика. Формула (1) може да се запише като
4. Празен херметически затворен съд с обем 20 литра се напълва с наситена водна пара при температура 100 ºС.
а) Какво е налягането на парите?
б) Каква е масата на парата?
в) Каква е концентрацията на парите?
г) Какво ще бъде налягането на парата, когато се охлади до 20 ºС?
д) Какви са масите на парата и водата при 20 ºС?
Улика. Използвайте горната таблица и формула (1).
4. Сварете
От графиката по-горе (фиг. 44 7) и таблицата вероятно сте забелязали, че при точката на кипене на водата (100 ºС), налягането на наситената водна пара е точно равно на атмосферното налягане (пунктирана линия в графика 44.7). Това съвпадение ли е?
Не, не случайно. Помислете за процеса на кипене.
Нека сложим опит
Ще загреем вода в отворен прозрачен съд. Скоро по стените на съда ще се появят мехурчета. Това освобождава въздуха, разтворен във водата.
Водата започва да се изпарява вътре в тези мехурчета и мехурчетата се пълнят с наситена пара. Но тези мехурчета не могат да растат, докато налягането на наситените пари е по-малко от налягането в течността. В отворен плитък съд налягането в течността е почти равно на атмосферното налягане.
Нека продължим да нагряваме водата. Налягането на наситените пари в мехурчетата нараства бързо с повишаване на температурата. И веднага щом стане равно на атмосферното налягане, ще започне интензивно изпаряване на течността в мехурчетата.
Те ще растат бързо, ще се издигнат и ще се спукат на повърхността на течността (фиг. 44.8). Това кипи. 
В плитък съд налягането в течността е почти равно на външното налягане. Следователно можем да кажем това
кипенето на течността настъпва при температура, при която налягането p n на наситените пари е равно на външното налягане p ext:
p n = p вътр. (2)
От това следва, че точката на кипене зависи от налягането. Следователно може да се промени чрез промяна на налягането на течността. С увеличаване на налягането точката на кипене на течността се повишава. Това се използва например за стерилизиране на медицински инструменти: водата се вари в специални устройства - автоклави, където налягането е 1,5-2 пъти по-високо от нормалното атмосферно налягане.
Високо в планините, където атмосферното налягане е значително по-ниско от нормалното атмосферно налягане, не е лесно да се готви месо: например на височина от 5 км водата кипи вече при температура от 83 ºС.
5. Използвайки формула (2) и таблицата по-горе, определете точката на кипене на водата:
а) при налягане, равно на една пета от нормалното атмосферно налягане;
б) при налягане 2 пъти по-голямо от атмосферното налягане.
Вряща вода при понижено налягане може да се наблюдава в следващия експеримент.
Нека сложим опит
Доведете водата в колбата да заври и плътно затворете колбата. Когато водата се охлади малко, обърнете колбата и напоете дъното й. студена вода. Водата ще заври, въпреки че температурата й е много по-ниска от 100 ºС (фиг. 44.9). 
6. Обяснете това преживяване.
7. До каква височина би могла да се вдигне врящата вода с бутало, ако не изстине?
Допълнителни въпроси и задачи
8. В цилиндричен съд под буталото за дълго време има вода и водна пара. Масата на водата е два пъти по-голяма от масата на парата. При бавно движение на буталото обемът под буталото се увеличава от 1 литър на 6 литра. Температурата на съдържанието на съда остава 20°C през цялото време. Имайте предвид, че обемът на водата може да бъде пренебрегнат в сравнение с обема на парата.
а) Каква пара има под буталото в началото?
б) Обяснете защо налягането в съда няма да се промени, докато обемът под буталото стане равен на 3 l.
в) Какво е налягането в съда, когато обемът под буталото е 3 литра?
г) Каква е масата на парата в съда, когато обемът под буталото е 3 литра?
Улика. В този случай целият обем на съда е изпълнен с наситена пара.
д) Колко пъти се е увеличила масата на парата, когато обемът под буталото се е увеличил от 1 литър на 3 литра?
е) Каква е масата на водата в първоначалното състояние?
Улика. Възползвайте се от факта, че в първоначалното състояние масата на водата е 2 пъти по-голяма от масата на парата.
ж) Как ще се промени налягането в съда, когато обемът под буталото се промени от 3 литра на 6 литра?
Улика. За ненаситена пара е валидно уравнението на състоянието за идеален газ с постоянна маса.
з) Какво е налягането в съда, когато обемът под буталото е 6 литра?
i) Начертайте приблизителна графика на налягането на парите под буталото спрямо обема.
9. Двете запечатани U-образни тръби са наклонени, както е показано на фигура 44.10. В коя тръба над водата има само наситена пара и в коя въздух с пара? Обосновете отговора си. 
Процесите на изпарение и кондензация са непрекъснати и успоредни един на друг.
В отворен съд количеството течност намалява с времето, т.к. изпарението преобладава над кондензацията.
Пара, която е над повърхността на течност, когато изпарението преобладава над кондензацията, или пара в отсъствието на течност, се нарича ненаситени.
В херметически затворен съд нивото на течността не се променя с времето, т.к изпарението и кондензацията се компенсират взаимно: колко молекули излитат от течността, толкова много от тях се връщат към нея по едно и също време, настъпва динамично (подвижно) равновесие между парата и нейната течност.
Нарича се пара, която е в динамично равновесие с течността си наситен.
При дадена температура наситената пара на всяка течност има най-висока плътност ( ) и създава максимално налягане ( ), които парата на тази течност може да има при тази температура.
Налягането и плътността на наситените пари при същата температура зависят от вида на веществото: по-голямото налягане създава наситена пара на течността, която се изпарява по-бързо.Например и
Свойства на ненаситените пари:Ненаситените пари се подчиняват на газовите закони на Бойл – Мариот, Гей-Люсак, Чарлз и към тях може да се приложи идеалното газово уравнение на състоянието.
Свойства на наситени пари:1. При постоянен обем, с повишаване на температурата, налягането на наситената пара се увеличава, но не правопропорционално (законът на Чарлз не е изпълнен), налягането расте по-бързо от това на идеалния газ. , с повишаване на температурата ( ) , масата на парата се увеличава и следователно концентрацията на молекулите на парата се увеличава () и налягането на наситените пари ще се стопи по две причини (
3 1 – ненаситена пара (идеален газ);
2 2 - наситена пара; 3 - ненаситена пара,
1 получени от наситена пара в същата
обем при нагряване.
2. Налягането на наситените пари при постоянна температура не зависи от обема, който заема.
С увеличаване на обема масата на парата се увеличава и масата на течността намалява (част от течността преминава в пара), с намаляване на обема на парата тя става по-малка, а течността става по-голяма (част от парата преминава в течност), плътността и концентрацията на молекулите на наситените пари остават постоянни, следователно и налягането остава постоянно ().
течност
(седна пара + течност)
Ненаситен пара
Наситените пари не се подчиняват на газовите закони на Бойл - Мариот, Гей-Люсак, Шарл, т.к. масата на парата в процесите не остава постоянна, а всички газовите закониполучено за постоянна маса. Уравнението на състоянието за идеален газ може да се приложи към наситена пара.
Така, Наситената пара може да се превърне в ненаситена пара или чрез нагряване при постоянен обем или чрез увеличаване на обема при постоянна температура. Ненаситената пара може да се превърне в наситена пара или чрез охлаждане при постоянен обем или чрез компресиране при постоянна температура.
Критична ситуация
Наличието на свободна повърхност в течността дава възможност да се посочи къде се намира течната фаза на веществото и къде газообразната. Рязката разлика между течност и нейната пара се обяснява с факта, че плътността на течността е многократно по-голяма от тази на парата. Ако течността се нагрее в херметически затворен съд, тогава поради разширяване, нейната плътност ще намалее, а плътността на парата над нея ще се увеличи. Това означава, че разликата между течността и нейната наситена пара се изглажда и изчезва напълно при достатъчно висока температура. Температурата, при която се различават физични свойствамежду течност и нейната наситена пара и плътностите им стават еднакви, се наричакритична температура.
Критична точка
За образуването на течност от газ средната потенциална енергия на привличане на молекулите трябва да надвишава тяхната средна кинетична енергия.
Критична температура – Максималната температура, при която парата се превръща в течност.Критичната температура зависи от потенциалната енергия на взаимодействието на молекулите и следователно е различна за различните газове. Поради силното взаимодействие на водните молекули, водната пара може да се превърне във вода дори при температура от . В същото време втечняването на азот се случва само при температура по-ниска от = -147˚, т.к. азотните молекули слабо взаимодействат помежду си.
Друг макроскопичен параметър, който влияе на прехода пара-течност, е налягането. С увеличаване на външното налягане по време на компресия на газ средното разстояние между частиците намалява, силата на привличане между тях се увеличава и съответно средната потенциална енергия на тяхното взаимодействие.
наляганенаситена пара при критичната си температура се нарича критичен. Това е възможно най-високото налягане на парата на насищане на дадено вещество.
Състояние на материята с критични параметри се нарича критичен(критична точка) . Всяко вещество има своя собствена критична температура и налягане.
В критичното състояние, специфичната топлина на изпаряване и коефициентът повърхностно напрежениетечности. При температури над критичните, дори при много високи налягания, превръщането на газ в течност е невъзможно; над критичната температура течността не може да съществува. При свръхкритични температури е възможно само парното състояние на материята.
Втечняването на газове е възможно само при температури под критичната. За втечняване газовете се охлаждат до критична температура, например чрез адиабатно разширение, и след това се компресират изотермично.
Кипене
Външно явлението изглежда така:от целия обем на течността бързо нарастващите мехурчета се издигат на повърхността, те се спукват на повърхността и парата се отделя в околната среда.
MKT обяснява кипенето по следния начин:в течността винаги има въздушни мехурчета, в които се получава изпарение от течността. Затвореният обем на мехурчетата се оказва пълен не само с въздух, но и с наситена пара. Налягането на наситените пари в тях при нагряване на течността се увеличава по-бързо от налягането на въздуха. Когато налягането на наситените пари в мехурчетата в достатъчно загрята течност стане по-голямо от външното налягане, те се увеличават по обем и силата на плаваемост, която надвишава тяхната гравитация, повдига мехурчетата на повърхността. Плаващите мехурчета започват да се пукат, когато при определена температура налягането на наситените пари в тях надвиши налягането над течността. Температурата на течността, при която налягането на наситената й пара в мехурчетата е равно или по-голямо от външното налягане върху течността, се нарича точка на кипене.
Точката на кипене на различните течности е различна, защото налягането на наситените пари в техните мехурчета се сравнява със същото външно налягане при различни температури. Например налягането на наситените пари в мехурчетата е равно на нормалното атмосферно налягане за вода при 100°C, за живак при 357°C, за алкохол при 78°C, за етер при 35°C.
Точката на кипене остава постоянна по време на процеса на кипене,защото цялата топлина, която се подава към нагрятата течност, се изразходва за изпаряване.
Точката на кипене зависи от външното налягане върху течността: с увеличаване на налягането температурата се повишава; когато налягането намалява, температурата намалява.Например, на височина 5 км над морското равнище, където налягането е 2 пъти по-ниско от атмосферното налягане, точката на кипене на водата е 83 ° C, в котлите на парните машини, където налягането на парата е 15 атм. (), температурата на водата е около 200˚С.
Влажност на въздуха
Във въздуха винаги има водна пара, така че можем да говорим за влажност на въздуха, която се характеризира със следните стойности:
1.Абсолютна влажносте плътността на водната пара във въздуха (или налягането, което тази пара създава ( .
Абсолютната влажност не дава представа за степента на насищане на въздуха с водна пара. Едно и също количество водна пара при различни температури създава различно усещане за влажност.
2.Относителна влажносте съотношението на плътността (налягането) на водната пара, съдържаща се във въздуха при дадена температура, към плътността (налягането) на наситената пара при същата температура :
![]() или
или
е абсолютната влажност при дадена температура; - плътност, налягане на наситените пари при същата температура. Плътността и налягането на наситената водна пара при всяка температура могат да бъдат намерени в таблицата. Таблицата показва, че колкото по-висока е температурата на въздуха, толкова по-голяма трябва да бъде плътността и налягането на водната пара във въздуха, за да бъде наситен.
Познавайки относителната влажност, можете да разберете колко процента от водната пара във въздуха при дадена температура е далеч от насищането. Ако парата във въздуха е наситена, тогава . Ако , тогава във въздуха няма достатъчно пара до състояние на насищане.
Фактът, че парата във въздуха става наситена, се съди по появата на влага под формата на мъгла, роса. Температурата, при която водната пара във въздуха се насища се нарича Точка на оросяване.
Парата във въздуха може да се направи наситена чрез добавяне на пара поради допълнително изпаряване на течността без промяна на температурата на въздуха или чрез понижаване на температурата му с количеството пара във въздуха.
Нормалната относителна влажност, най-благоприятната за човека, е 40 - 60%. Голямо значениеима познания за влажността в метеорологията за прогнозиране на времето. При тъкане, сладкарско производство е необходима определена влажност за нормалното протичане на процеса. Съхраняването на произведения на изкуството и книги изисква поддържане на влажността на необходимото ниво.
Инструменти за влажност:
1. Кондензационен хигрометър (позволява да определите точката на оросяване).
2. Хигрометърът за коса (въз основа на дължината на обезмаслената коса спрямо влажността) измерва относителната влажност в проценти.
3. Психрометърът се състои от два сухи и мокри термометъра. Влажната крушка се увива в кърпа, потопена във вода. Поради изпаряване от тъканта, температурата на навлажнената е по-ниска от тази на сухата. Разликата в показанията на термометъра зависи от влажността на околния въздух: колкото по-сух е въздухът, толкова по-интензивно е изпарението от тъканта, толкова по-голяма е разликата в показанията на термометъра и обратно. Ако влажността на въздуха е 100%, то показанията на термометрите са еднакви, т.е. разликата в показанията е 0. За определяне на влажността с помощта на психрометър се използва психрометрична таблица.
Топене и кристализация
При топене твърдо тялоразстоянието между частиците, образуващи кристалната решетка, се увеличава и самата решетка се разрушава. Процесът на топене изисква енергия. При нагряване на твърдо тяло кинетичната енергия на вибриращите молекули се увеличава и съответно амплитудата на техните трептения. При определена температура, наречена точка на топене, редът в подреждането на частиците в кристалите се нарушава, кристалите губят формата си. Вещество се топи, преминавайки от твърдо в течно състояние.
По време на кристализацияима конвергенция на молекули, които образуват кристална решетка. Кристализация може да настъпи само когато течността освободи енергия. Когато разтопеното вещество се охлади, средната кинетична енергия и скоростта на молекулите намаляват. Привличащите сили могат да задържат частиците близо до положението на равновесие. При определена температура, наречена температура на втвърдяване (кристализация),всички молекули са в положение на стабилно равновесие, подреждането им става подредено - образува се кристал.
Топенето на твърдо вещество става при същата температура, при която веществото се втвърдява.
Всяко вещество има своя собствена точка на топене. Например точките на топене за хелия са -269,6˚С, за живака -38,9˚С, за медта 1083˚С.
По време на процеса на топене температурата остава постоянна. Количеството топлина, подадено отвън, отива за разрушаването на кристалната решетка.
По време на процеса на втвърдяване, въпреки че топлината се отстранява, температурата не се променя. Освободената по време на кристализация енергия се използва за поддържане на постоянна температура.
Докато цялото вещество се разтопи или цялото вещество се втвърди, т.е. докато твърдата и течната фаза на веществото съществуват заедно, температурата не се променя.
ТВ+течност течност + тв
,
къде е количеството топлина, ![]() - количеството топлина, необходимо за стопяване на вещество, отделено по време на кристализацията на вещество по маса по маса
- количеството топлина, необходимо за стопяване на вещество, отделено по време на кристализацията на вещество по маса по маса
- специфична топлина на топене– количеството топлина, необходимо за стопяване на 1 kg вещество при неговата точка на топене.
Какво количество топлина се изразходва при топенето на определена маса от вещество, същото количество топлина се отделя при кристализацията на тази маса.
Също наричан специфична топлина на кристализация.
При точката на топене вътрешната енергия на веществото в течно състояниеповече от вътрешната енергия на същата маса материя в твърдо състояние.
За голям брой вещества обемът се увеличава по време на топенето, а плътността намалява. При втвърдяване, напротив, обемът намалява, а плътността се увеличава. Например твърдите кристали нафталин потъват в течен нафталин.
Някои вещества, например бисмут, лед, галий, чугун и др., се свиват при разтопяване и се разширяват при втвърдяване. Тези отклонения от общото правило се обясняват с особеностите на структурата на кристалните решетки. Следователно водата е по-плътен от ледледът плува във вода. Разширяването на водата по време на замръзване води до разрушаване на скалите.
Промяната в обема на металите по време на топене и втвърдяване е от съществено значение в леярския бизнес.
Опитът показва това промяната във външното налягане върху твърдо вещество се отразява в точката на топене на това вещество. За тези вещества, които се разширяват по време на топене, увеличаването на външното налягане води до повишаване на точката на топене, т.к. затруднява процеса на топене. Ако веществата се компресират по време на топене, тогава за тях увеличаването на външното налягане води до намаляване на температурата на топене, т.к. подпомага процеса на топене. Само много голямо увеличение на налягането забележимо променя точката на топене. Например, за да намалите точката на топене на леда с 1˚C, налягането трябва да се увеличи със 130 атм. Точката на топене на вещество при нормално атмосферно налягане се нарича точката на топене на веществото.