У роботі підібрано завдання з хімічних зв'язків.
Пугачова Олена Володимирівна
Опис розробки
6. Ковалентний неполярний зв'язок характерний для
1) Сl 2 2) SO3 3) СО 4) SiO 2
1) NH 3 2) Зu 3) H 2 S 4) I 2
3) іонну 4) металеву
15. Трьма загальними електронними парами утворено ковалентний зв'язок у молекулі
16. Водневі зв'язки утворюються між молекулами
1) HI 2) НСl 3) HF 4) НВг
1) вода та алмаз 2) водень та хлор 3) мідь та азот 4) бром та метан
19. Водневий зв'язок не характернадля речовини
1) фтору 2) хлору 3) брому 4) йоду
1)СF 4 2)CCl 4 3)CBr 4 4)CI 4
1) 1 2) 2 3) 3 4) 4
1) 1 2) 2 3) 3 4) 4
32. Атоми хімічних елементів другого періоду періодичної системи Д.І. Менделєєва утворюють сполуки з іонним хімічним зв'язком складу 1) LiF 2) CO 2 3) Al 2 O 3 4) BaS
1) іонна 2) металева
43. Іонний зв'язок утворюють 1) Н і S 2) Р і С1 3) Сs і Вr 4) Si та F
при взаємодії
1) іонна 2) металічна
1) іонна 2) металічна
НАЗВА РЕЧОВИНИ ВИД ЗВ'ЯЗКУ
1) цинк А) іонна
2) азот Б) металева
62. Встановіть відповідність
ВИД ЗВ'ЯЗКУ З'ЄДНАННЯ
1) іонна А) Н 2
2) металева Б)
3) ковалентна полярна В) НF
66. Найбільш міцний хімічний зв'язок має місце в молекулі 1) F 2 2) Сl 2 3) O 2 4) N 2
67. Міцність зв'язку збільшується у ряді 1) Cl 2 -O 2 -N 2 2) Про 2 - N 2- Сl 2 3) Про 2 -Сl 2 -N 2 4) Сl 2 -N 2 -O 2
68. Вкажіть ряд, що характеризується збільшенням довжини хімічного зв'язку
1)O 2 , N 2 , F 2 , Cl 2 2)N 2 , O 2 , F 2 , Cl 2 3)F 2 , N 2 , O 2 , Cl 2 4)N 2 , O 2 , Cl 2 , F 2

Розберемо завдання №3 з варіантів ЄДІза 2016 рік.
Завдання із рішеннями.
Завдання №1.
З'єднання з ковалентним неполярним зв'язком розташовані в ряді:
1. O2, Cl2, H2
2. HCl, N2, F2
3. O3, P4, H2O
4. NH3, S8, NaF
Пояснення:нам потрібно знайти такий ряд, в якому будуть лише прості речовини, тому що ковалентний неполярний зв'язок утворюється тільки між атомами одного і того ж елемента. Правильна відповідь – 1.
Завдання №2.
Речовини з ковалентним полярним зв'язком вказані у рядку:
1. CaF2, Na2S, N2
2. P4, FeCl2, NH3
3. SiF4, HF, H2S
4. NaCl, Li2O, SO2
Пояснення:тут потрібно знайти ряд, у якому лише складні речовини і, до того ж, усі неметали. Правильна відповідь – 3.
Завдання №3.
Водневий зв'язок характерний для
1. Алканов 2. Аренів 3. Спиртів 4. Алкінов
Пояснення:водневий зв'язок утворюється між іоном водню та електронегативним іоном. Такий набір серед перерахованих є тільки у спиртів.
Правильна відповідь – 3.
Завдання №4.
Хімічний зв'язок між молекулами води
1. Воднева
2. Іонна
3. Ковалентна полярна
4. Ковалентна неполярна
Пояснення:між атомами Про і Н у воді утворюється ковалентний полярний зв'язок, тому що це два неметали, а ось між молекулами води водневий зв'язок. Правильна відповідь – 1.
Завдання №5.
Тільки ковалентні зв'язки має кожна з двох речовин:
1. CaO та C3H6
2. NaNO3 та CO
3. N2 та K2S
4. CH4 та SiO2
Пояснення:з'єднання повинні складатися тільки з неметалів, тобто правильна відповідь - 4.
Завдання №6.
Речовиною з ковалентним полярним зв'язком є
1. О3 2. NaBr 3. NH3 4. MgCl2
Пояснення:ковалентний полярний зв'язок утворюється між атомами різних неметалів. Правильна відповідь – 3.
Завдання №7.
Неполярний ковалентний зв'язок характерний для кожної з двох речовин:
1. Води та алмазу
2. Водню та хлору
3. Міді та азоту
4. Брома та метану
Пояснення:неполярний ковалентний зв'язок характерний для з'єднання атомів одного і того ж елемента-неметалу. Правильна відповідь – 2.
Завдання №8.
Який хімічний зв'язок утворюється між атомами елементів із порядковими номерами 9 та 19?
1. Іонна
2. Металева
3. Ковалентна полярна
4. Ковалентна неполярна
Пояснення:це елементи - фтор та калій, тобто неметал і метал відповідно, між такими елементами може утворитися лише іонний зв'язок. Правильна відповідь – 1.
Завдання №9.
Речовини з іонним типом зв'язку відповідає формула
1. NH3 2. HBr 3. CCl4 4. KCl
Пояснення:іонний зв'язок утворюється між атомом металу та атомом неметалу, тобто правильна відповідь - 4.
Завдання №10.
Одинаковий вид хімічного зв'язку мають хлороводень і
1. Аміак
2. Бром
3. Хлорид натрію
4. Оксид магнію
Пояснення:хлороводень має ковалентний полярний зв'язок, тобто нам потрібно знайти речовину, що складається з двох різних неметалів - це аміак.
Правильна відповідь – 1.
Завдання для самостійного вирішення.
1. Водневі зв'язки утворюються між молекулами
1. Фтороводородна кислота
2. Хлорметан
3. Диметиловий ефір
4. Етилену
2. З'єднанню з ковалентним зв'язком відповідає формула
1. Na2O 2. MgCl2 3. CaBr2 4. HF
3. Речовина з ковалентним неполярним зв'язком має формулу
1. H2O 2. Br2 3. CH4 4. N2O5
4. Речовиною з іонним зв'язком є
1. CaF2 2. Cl2 3. NH3 4. SO2
5. Водневі зв'язки утворюються між молекулами
1. Метанолу
3. Ацетилену
4. Метилформіату
6. Ковалентний неполярний зв'язок характерний для кожної з двох речовин:
1. Азоту та озону
2. Води та аміаку
3. Міді та азоту
4. Брома та метану
7. Ковалентний полярний зв'язок характерний для речовини
1. KI 2. CaO 3. Na2S 4. CH4
8. Ковалентний неполярний зв'язок характерний для
1. I2 2. NO 3. CO 4. SiO2
9. Речовиною з ковалентним полярним зв'язком є
1. Cl2 2. NaBr 3. H2S 4. MgCl2
10. Ковалентний неполярний зв'язок характерний для кожної з двох речовин:
1. Водню та хлору
2. Води та алмазу
3. Міді та азоту
4. Брома та метану
У цій замітці використовувалися завдання зі збірки ЄДІ 2016 року під редакцією О.О. Каверін.
А4 Хімічний зв'язок.
Хімічний зв'язок: ковалентний (полярний та неполярний), іонний, металевий, водневий. Способи утворення ковалентного зв'язку. Характеристики ковалентного зв'язку: довжина та енергія зв'язку. Утворення іонного зв'язку.
Варіант 1 - 1,5,9,13,17,21,25,29,33,37,41,45,49,53,57,61,65
Варіант 2 - 2,6,10,14,18,22,26,30,34,38,42,46,50,54,58,62,66
Варіант 3 – 3,7,11,15,19,23,27,31,35,39,43,47,51,55,59,63,67
Варіант 4 – 4,8,12,16,20,24,28,32,36,40,44,48,52,56,60,64,68
1. В аміаку та хлориді барію хімічний зв'язок відповідно
1) іонна та ковалентна полярна
2) ковалентна полярна та іонна
3) ковалентна неполярна та металева
4) ковалентна неполярна та іонна
2. Речовини лише з іонним зв'язком наведені у ряду:
1) F 2 , ССl 4 , КСl 2) NaBr,Na 2 O,KI 3) SO 2 .P 4 .CaF 2 4) H 2 S,Br 2 ,K 2 S
3. З'єднання з іонним зв'язком утворюється при взаємодії
1) СН 4 та О 2 2) SO 3 та Н 2 Про 3) С 2 Н 6 та HNO 3 4) NH 3 та HCI
4. У якому ряду всі речовини мають ковалентний полярний зв'язок?
1) HCl,NaCl,Cl 2 2) O 2 ,H 2 O,CO 2 3) H 2 O,NH 3 ,CH 4 4) NaBr,HBr,CO
5. У якому ряду записані формули речовин лише з ковалентним полярним зв'язком?
1) Сl 2 , NO 2 , НСl 2) HBr,NO,Br 2 3) H 2 S,H 2 O,Se 4) HI,H 2 O,PH 3
6. Ковалентний неполярний зв'язок характерний для
1) Сl 2 2) SO3 3) СО 4) SiO 2
7. Речовиною з ковалентним полярним зв'язком є
1) С1 2 2) NaBr 3) H 2 S 4) MgCl 2
8. Речовиною з ковалентним зв'язком є
1) СаСl 2 2) MgS 3) H 2 S 4) NaBr
9. Речовина з ковалентним неполярним зв'язком має формулу
1) NH 3 2) Зu 3) H 2 S 4) I 2
10. Речовинами з неполярним ковалентним зв'язком є
11. Між атомами з однаковою електронегативністю утворюється хімічний зв'язок
1) іонна 2) ковалентна полярна 3) ковалентна неполярна 4) воднева
12. Ковалентний полярний зв'язок характерний для
1) KCl 2) НВг 3) Р 4 4) СаСl 2
13. Хімічний елемент, в атомі якого електрони за шарами розподілено так: 2, 8, 8, 2 утворює з воднем хімічний зв'язок
1) ковалентна полярна 2) ковалентна неполярна
3) іонну 4) металеву
14. У молекулі якої речовини довжина зв'язку між атомами вуглецю є найбільшою?
1) ацетилену 2) етану 3) етену 4) бензолу
15. Трьма загальними електронними парами утворено ковалентний зв'язок у молекулі
1) азоту 2) сірководню 3) метану 4) хлору
16. Водневі зв'язки утворюються між молекулами
1) диметилового ефіру 2) метанолу 3) етилену 4) етилацетату
17. Полярність зв'язку найбільше виражена в молекулі
1) HI 2) НСl 3) HF 4) НВг
18. Речовинами з неполярним ковалентним зв'язком є
1) вода та алмаз 2) водень та хлор 3) мідь та азот 4) бром та метан
19. Водневий зв'язок не характернадля речовини
1) Н 2 Про 2) СН 4 3) NH 3 4) СНзОН
20. Ковалентний полярний зв'язок характерний для кожної з двох речовин, формули яких
1) KI та Н 2 Про 2) СО 2 та К 2 Про 3) H 2 S та Na 2 S 4) CS 2 та РС1 5
21. Найменш міцний хімічний зв'язок у молекулі
22. У молекулі якої речовини довжина хімічного зв'язку є найбільшою?
1) фтору 2) хлору 3) брому 4) йоду
23. Ковалентні зв'язки має кожна з речовин, зазначених у рядку:
1) C 4 H 10 , NO 2 , NaCl 2) СО, CuO, CH 3 Cl 3) BaS, C 6 H 6, H 2 4) C 6 H 5 NO 2 , F 2 , CCl 4
24. Ковалентний зв'язок має кожна з речовин, зазначених у рядку:
1) СаО,С 3 Н 6 , S 8 2) Fe,NaNO 3 , CO 3) N 2 , CuCO 3 , K 2 S 4) C 6 H 5 N0 2 , SО 2 , CHC1 3
25. Ковалентний зв'язок має кожна з речовин, зазначених у рядку:
1) З 3 Н 4 , NO, Na 2 O 2) СО, СН 3 С1, PBr 3 3) Р 2 Оз, NaHSO 4 , Сu 4) C 6 H 5 NO 2 , NaF, ССl 4
26. Ковалентні зв'язки має кожна з речовин, зазначених у рядку:
1) C 3 H a ,NO 2 , NaF 2) КСl , CH 3 Cl, C 6 H 12 0 6 3) P 2 O 5 , NaHSO 4 , Ba 4) C 2 H 5 NH 2 , P 4 , CH 3 OH
27. Полярність зв'язку найбільше виражена в молекулах
1) сірководню 2) хлору 3) фосфіну 4) хлороводню
28. У молекулі якої речовини хімічні зв'язки є найбільш міцними?
1)СF 4 2)CCl 4 3)CBr 4 4)CI 4
29. Серед речовин NH 4 Cl, CsCl, NaNO 3, PH 3 , HNO 3 - число сполук з іонним зв'язком дорівнює
1) 1 2) 2 3) 3 4) 4
30. Серед речовин (NH 4) 2 SO 4 , Na 2 SO 4 , CaI 2 , I 2 , CO 2 - число сполук з ковалентним зв'язком дорівнює
1) 1 2) 2 3) 3 4) 4
31. У речовинах, утворених шляхом з'єднання однакових атомів, хімічний зв'язок
1) іонна 2) ковалентна полярна 3) воднева 4) ковалентна неполярна
32. Атоми хімічних елементівдругого періоду періодичної системи Д.І. Менделєєва утворюють сполуки з іонним хімічним зв'язком складу 1) LiF 2) CO 2 3) Al 2 O 3 4) BaS
33. Сполуками з ковалентним полярним та ковалентним неполярним зв'язком є відповідно 1) вода та сірководень 2) бромід калію та азот 3) аміак та водень 4) кисень та метан
34. Ковалентний неполярний зв'язок характерний для 1) води 2) аміаку 3) азоту 4) метану
35. Хімічний зв'язок у молекулі фтороводню
1) ковалентна полярна 3) іонна
2) ковалентна неполярна 4) воднева
36.Виберіть пару речовин, всі зв'язки в яких - ковалентні:
1) NаСl, НСl 2) СО 2 , 3) СН 3 Сl, СН 3 Nа 4) SO 2 , NO 2
37. В іодиді калію хімічний зв'язок
1) ковалентна неполярна 3) металева
2) ковалентна полярна 4) іонна
38. У сірковуглецю СS 2 хімічний зв'язок
1) іонна 2) металева
3) ковалентна полярна 4) ковалентна неполярна
39. Ковалентний неполярний зв'язок реалізується у поєднанні
1) СrО 3 2) Р 2 Про 5 3) SO 2 4) F 2
40.Речовина з ковалентним полярним зв'язком має формулу 1)KCl 2)HBr 3)Р 4 4)CaCl 2
41. Поєднання з іонним характером хімічного зв'язку
1)хлорид фосфору 2)бромід калію 3)оксид азоту (II) 4)барій
42. В аміаку та хлориді барію хімічний зв'язок відповідно
1) іонна та ковалентна полярна 2) ковалентна полярна та іонна
3) ковалентна неполярна та металева 4) ковалентна неполярна та іонна
43. Іонний зв'язок утворюють 1) Н і S 2) Р і С1 3) Сs і Вr 4) Si та F
44. Який тип зв'язку в молекулі Н2?
1) Іонна 2) Воднева 3) Ковалентна неполярна 4) Донорно-акцепторна
45. Речовиною з ковалентним полярним зв'язком є
1)оксид сірки (IV) 2)кисень 3)гідрид кальцію 4)алмаз
46. У молекулі фтору хімічний зв'язок
1) ковалентна полярна 2) іонна 3) ковалентна неполярна 4) воднева
47. У якому ряду перераховані речовини лише з ковалентним полярним зв'язком:
1) СН 4 Н 2 Сl 2 2)NH 3 HBr CO 2 3) PCl 3 KCl CCl 4 4) H 2 S SO 2 LiF
48. У якому ряду всі речовини мають ковалентний полярний зв'язок?
1) НСl, NаСl, Сl 2 2) Про 2 Н 2 Про, 2 3) Н 2 O, NH 3 , СН 4 4) КВr, НВr, СО
49. У якому ряду перераховані речовини лише з іонним типом зв'язку:
1) F 2 O LiF SF 4 2) PCl 3 NaCl CO 2 3) KF Li 2 O BaCl 2 4) СаF 2 CH 4 CCl 4
50. З'єднання з іонним зв'язком утворюється при взаємодії
1) CH 4 та O 2 2)NH 3 та HCl 3) C 2 H 6 та HNO 3 4) SO 3 та H 2 O
51. Водневий зв'язок утворюється між молекулами 1) етану 2) бензолу 3) водню 4) етанолу
52. Яка речовина має водневі зв'язки? 1) Сірководень 2) Лід 3) Бромоводород 4) Бензол
53. Зв'язок, що утворюється між елементами з порядковими номерами 15 та 53
1) іонна 2) металічна
3) ковалентна неполярна 4) ковалентна полярна
54. Зв'язок, що утворюється між елементами з порядковими номерами 16 та 20
1) іонна 2) металічна
3) ковалентна полярна 4) воднева
55. Між атомами елементів із порядковими номерами 11 та 17 виникає зв'язок
1) металева 2) іонна 3) ковалентна 4) донорно-акцепторна
56. Водневі зв'язки утворюються між молекулами
1) водню 2) формальдегіду 3) оцтової кислоти 4) сірководню
57. У якому ряду записані формули речовин лише з ковалентним полярним зв'язком?
1) Сl 2 , NH 3 , НСl 2) НВr, NO, Вr 2 3) Н 2 S, Н 2 O, S 8 4) НI, Н 2 О, РН 3
58.У якій речовині є одночасно іонні та ковалентні хімічні зв'язки?
1) Хлорид натрію 2) Хлороводень 3) Сульфат натрію 4) Фосфорна кислота
59. Більш виражений іонний характер має хімічний зв'язок у молекулі
1)броміду літію 2)хлориду міді 3)карбіду кальцію 4)фториду калію
60. У якій речовині всі хімічні зв'язки – ковалентні неполярні?
1) Алмаз 2) Оксид вуглецю (IV) 3) Золото 4) Метан
61. Встановіть відповідність між речовиною та видом зв'язку атомів у цій речовині.
НАЗВА РЕЧОВИНИ ВИД ЗВ'ЯЗКУ
1) цинк А) іонна
2) азот Б) металева
3) аміак В) ковалентна полярна
4) хлорид кальцію; Г) ковалентна неполярна.
62. Встановіть відповідність
ВИД ЗВ'ЯЗКУ З'ЄДНАННЯ
1) іонна А) Н 2
2) металева Б)
3) ковалентна полярна В) НF
4) ковалентна неполярна Г) F 2
63. У якому поєднанні ковалентний зв'язок між атомами утворюється за донорно-акцепторним механізмом? 1) КСl 2) ССl 4 3) NН 4 Сl 4) СаСl 2
64. Вкажіть молекулу, в якій енергія зв'язку найбільша:1) N≡N 2) Н-Н 3) О=О 4) Н-F
65. Вкажіть молекулу, в якій хімічний зв'язок - найміцніший:1) НF 2) НСl 3) НВr 4) HI
Вільний фтор складається із двоатомних молекул. З хімічної сторони фтор може бути охарактеризований як одновалентний неметал, і найактивніший з усіх неметалів. Зумовлено це низкою причин, у тому числі легкістю розпаду молекули F 2 на окремі атоми - необхідна для цього енергія становить лише 159 кДж/моль (проти 493 кДж/моль для 2 і 242 кДж/моль для 12). Атоми фтору мають значну спорідненість до електрона і порівняно малими розмірами. Тому їх валентні зв'язки з атомами інших елементів виявляються міцнішими за аналогічні зв'язки інших металоїдів (наприклад, енергія зв'язку Н-Fстановить - 564 кДж/моль проти 460 кДж/моль для зв'язку Н-О та 431 кДж/моль для зв'язку Н-С1).
Зв'язок F-F характеризується ядерною відстанню 1,42 А. Для термічної дисоціації фтору розрахунковим шляхом було отримано такі дані:
Атом фтору має в основному стані структуру зовнішнього електронного шару 2s 2 2p 5 і одновалентний. Пов'язане з переведенням одного 2р-элсктрона на рівень 3s збудження тривалентного стану потребує витрати 1225 кДж/моль і практично не реалізується.
Спорідненість нейтрального атома фтору до електрона оцінюється в 339 кДж/моль. Іон F - характеризується ефективним радіусом 1,33 А та енергією гідратації 485 кДж/моль. Для ковалентного радіусу фтору зазвичай приймається значення 71 пм (тобто половина міжядерної відстані в молекулі F 2).
Хімічний зв'язок - електронний феномен, у тому, що, по крайнього заходу, один електрон, що у силовому полі свого ядра, перебувають у силовому полі іншого ядра чи кількох ядер одночасно.
Більшість простих речовині всі складні речовини (сполуки) складаються з атомів, які певним чином взаємодіють один з одним. Іншими словами, між атомами встановлюється хімічний зв'язок. При утворенні хімічного зв'язку енергія завжди виділяється, тобто енергія частки, що утворюється, повинна бути менше сумарної енергії вихідних частинок.
Перехід електрона від одного атома до іншого, внаслідок чого утворюються різноіменно заряджені іони зі стійкими електронними конфігураціями, між якими встановлюється електростатичне тяжіння, є найпростішою моделлю іонного зв'язку:
X → X + + e -; Y + e - → Y -; X + Y -
Гіпотеза утворення іонів та виникнення електростатичного тяжіння між ними була вперше висловлена німецьким ученим В. Косселем (1916).
Інший моделлю зв'язку є узагальнення електронів двома атомами, у результаті також утворюються стійкі електронні конфігурації. Такий зв'язок називається ковалентним її теорію в 1916 р. почав розробляти американський вчений Г. Льюїс.
Загальним моментом в обох теоріях було утворення частинок із сталою електронною конфігурацією, що збігається з електронною конфігурацією благородного газу.
Наприклад, при утворенні фториду літію реалізується іонний механізм утворення зв'язку. Атом літію (3 Li 1s 2 2s 1) втрачає електрон і перетворюється на катіон (3 Li + 1s 2) з електронною конфігурацією гелію. Фтор (9 F 1s 2 2s 2 2p 5) приймає електрон, утворюючи аніон (9 F - 1s 2 2s 2 2p 6) з електронною конфігурацією неону. Між іоном літію Li + та іоном фтору F - виникає електростатичне тяжіння, за рахунок чого утворюється нова сполука - фторид літію.
При утворенні фтороводню єдиний електрон атома водню (1s) і неспарений електрон атома фтору (2p) опиняються у полі обох ядер - атома водню та атома фтору. Таким чином виникає загальна електронна пара, що означає перерозподіл електронної густини та виникнення максимуму електронної густини. В результаті з ядром атома водню тепер пов'язані два електрони (електронна конфігурація атома гелію), а з ядром фтору - вісім електронів зовнішнього енергетичного рівня(електронна конфігурація атома неону):
Вона позначається однією рисою між символами елементів: H-F.Зв'язок, що здійснюється за допомогою однієї електронної пари, називається одинарним зв'язком.
Утворення двоелектронних оболонок у іона літію та атома водню є окремим випадком.Тенденція до утворення стійкої восьмиелектронної оболонки шляхом переходу електрона від одного атома до іншого (іонний зв'язок) або узагальнення електронів (ковалентний зв'язок) називається правилом октету.
Існують, однак, з'єднання, які не відповідають цьому правилу. Наприклад, атом берилію у фториді берилію BeF 2 має тільки чотириелектронну оболонку; шести електронні оболонки характерні для атома бору (точками позначені електрони зовнішнього енергетичного рівня):
У той же час у таких сполуках, як хлорид фосфору(V) та фторид сірки(VI), фторид йоду(VII), електронні оболонки центральних атомів містять більше восьми електронів (фосфор - 10; сірка - 12; йод - 14):

У більшості сполук d-елементів правило октету також не дотримується.
У всіх наведених вище прикладах хімічний зв'язок утворюється між атомами різних елементів; вона називається гетероатомною. Однак ковалентний зв'язок може утворитися між однаковими атомами. Наприклад, молекула водню утворюється за рахунок узагальнення 15 електронів кожного атома водню, внаслідок чого кожен атом набуває стійкої електронної конфігурації з двох електронів. Октет утворюється при утворенні молекул інших простих речовин, наприклад фтору:

Утворення хімічного зв'язку може здійснюватися шляхом узагальнення чотирьох або шести електронів. У першому випадку утворюється подвійний зв'язок, що є двома узагальненими парами електронів, у другому - потрійний зв'язок (три узагальнені електронні пари).
Наприклад, при утворенні молекули азоту N 2 хімічний зв'язок утворюється шляхом узагальнення шести електронів: по три неспарені p електрони від кожного атома. Для досягнення восьмиелектронної конфігурації утворюються три загальні електронні пари:
Подвійний зв'язок позначається двома рисками, потрійний - трьома. Молекулу азоту N 2 можна так: N≡N.
У двоатомних молекулах, утворених атомами одного елемента, максимум електронної густини знаходиться на середині міжядерної лінії. Оскільки поділу зарядів між атомами не відбувається, такий різновид ковалентного зв'язку отримав назву неполярної. Гетероатомний зв'язок завжди є тією чи іншою мірою полярним, тому що максимум електронної щільності зміщений у бік одного з атомів, за рахунок чого він набуває часткового негативного заряду (позначається σ-). Атом, від якого зміщений максимум електронної щільності, набуває часткового позитивного заряду (позначається σ+). Електронейтральні частинки, у яких центри часткового негативного та часткового позитивного зарядів не збігаються у просторі, називаються диполями. Полярність зв'язку вимірюється дипольним моментом (μ), який прямо пропорційний величині зарядів та відстані між ними.

Рис. Схематичне зображення диполя
Список використаної літератури
- Попков В. А., Пузаков С. А. Загальна хімія: підручник. – М.: ГЕОТАР-Медія, 2010. – 976 с.: ISBN 978-5-9704-1570-2. [с. 32-35]
У 1916 р. було запропоновано перші гранично спрощені теорії будови молекул, у яких використовувалися електронні уявлення: теорія американського фізикохіміка Г.Льюїса (1875-1946) та німецького вченого В.Косселя. За теорією Льюїса в утворенні хімічного зв'язку у двоатомної молекули беруть участь валентні електрони відразу двох атомів. Тому, наприклад, у молекулі водню замість валентного штриха стали малювати електронну пару, що утворює хімічний зв'язок:
Хімічний зв'язок, утворений електронною парою, називають ковалентним зв'язком. Молекулу фтористого водню зображають так:
Відмінність молекул простих речовин (H2, F2, N2, O2) від молекул складних речовин(HF, NO, H2O, NH3) у тому, що перші немає дипольного моменту, а другі - мають. Дипольний момент m визначається як твір абсолютної величинизаряду q на відстань між двома протилежними зарядами r:
Дипольний момент m двоатомної молекули можна визначити двома способами. По-перше, оскільки молекула електронейтральна, то відомий сумарний заряд позитивний молекули Z" (він дорівнює сумізарядів ядер атомів: Z" = ZA + ZB). Знаючи між'ядерну відстань re, можна визначити місце розташування центру тяжкості позитивного заряду молекули. Значення m молекули знаходять з експерименту.
По-друге, можна вважати, що при зміщенні електронної пари, що утворює хімічний зв'язок, до одного з атомів, на цьому атомі виникає деякий надлишковий негативний заряд -q" і заряд +q" виникає у другого атома. Відстань між атомами дорівнює re:
Дипольний момент молекули HF дорівнює 6.4Ч 10-30 КЛЧ м, міжядерне відстань H-Fі 0.917Ч 10-10 м. Розрахунок q" дає: q" = 0.4 елементарного заряду (тобто. заряду електрона). Раз на атомі фтору виник надлишковий негативний заряд, отже електронна пара, що утворює хімічний зв'язок у молекулі HF, зміщена до атома фтору. Такий хімічний зв'язок називається ковалентним полярним зв'язком. Молекули типу A2 дипольного моменту немає. Утворюють ці молекули хімічні зв'язки ковалентними неполярними зв'язками.
Теорія Косселябула запропонована для опису молекул, утворених активними металами (лужними та лужноземельними) та активними неметалами (галогенами, киснем, азотом). Зовнішні валентні електрони в атомів металів найвіддаленіші від ядра атома і тому порівняно слабо утримуються атомом металу. У атомів хімічних елементів, розташованих у тому самому ряду Періодичної системи, під час переходу зліва направо заряд ядра постійно зростає, а додаткові електрони розташовуються у тому самому електронному шарі. Це призводить до того, що зовнішня електронна оболонка стискається і електрони все міцніше утримуються в атомі. Тому в молекулі MeX з'являється можливість зовнішній валентний електрон металу, що слабо утримується, перемістити з витратою енергії, що дорівнює потенціалу іонізації, у валентну електронну оболонку атома неметалу з виділенням енергії, що дорівнює спорідненості до електрона. В результаті утворюються два іони: Me+ та X-. Електростатична взаємодія цих іонів і є хімічним зв'язком. Такий тип зв'язку назвали іонної.
Якщо визначити дипольні моменти молекул MeX в парах, то виявиться, що заряд з атома металу не переходить повністю до атома неметалу, і хімічний зв'язок у таких молекулах краще описується як ковалентний полярний зв'язок. Позитивні катіони металів Ме+ і негативні аніони атомів неметалів Х зазвичай існують у вузлах кристалічної решітки кристалів цих речовин. Але в цьому випадку кожен позитивний іон металу насамперед електростатично взаємодіє з найближчими до нього аніонами неметалів, потім із катіонами металів тощо. Тобто в іонних кристалах хімічні зв'язки справакалізовані і кожен іон зрештою взаємодіє з усіма іншими іонами, що входять до кристала, який і є гігантською молекулою.
Поряд із чітко визначеними характеристиками атомів, такими як заряди ядер атомів, потенціали іонізації, спорідненість до електрона, у хімії використовуються і менш певні характеристики. Однією є електронегативність. Вона була введена в науку американським хіміком Л.Полінгом. Спочатку розглянемо для елементів перших трьох періодів дані про перший потенціал іонізації та спорідненість до електрона.
Закономірності у потенціалах іонізації та спорідненість до електрона повністю пояснюються структурою валентних електронних оболонок атомів. Спорідненість до електрона у ізольованого атома азоту набагато менше, ніж у атомів лужних металів, хоча азот - це активний неметал. Саме молекулах при взаємодії з атомами інших хімічних елементів азот доводить, що він - активний неметал. Це і намагався зробити Л.Полінг, запроваджуючи "електронегативність" як здатність атомів хімічних елементів зміщувати до себе електронну пару при утворенні. ковалентних полярних зв'язків. Шкала електронегативності для хімічних елементів була запропонована Л.Полінгом. Найбільшу електронегативність в умовних безрозмірних одиницях він приписав фтору – 4,0 кисню – 3.5, хлору та азоту – 3.0, брому – 2.8. Характер зміни електронегативності в атомів повністю відповідають тим закономірностям, які виражені в Періодичною системою. Тому застосування поняття електронегативністьпросто перекладає іншою мовою ті закономірності у зміні властивостей металів і неметалів, які вже відображені в Періодичній системі.
Багато металів у твердому стані є майже ідеально освіченими кристалами.. У вузлах кристалічних ґрат у кристалі розташовані атоми або позитивні іони металів. Електрони тих атомів металів, у тому числі утворилися позитивні іони, як електронного газу перебувають у просторі між вузлами кристалічної решітки і належать всім атомам і іонам. Саме вони визначають характерний металевий блиск, високу електропровідність та теплопровідність металів. Тип хімічного зв'язку, який здійснюють узагальнені електрони в кристалі металу, називаєтьсяметалевим зв'язком.
У 1819 р. французькі вчені П.Дюлонг та А.Пті експериментально встановили, що мольна теплоємність майже всіх металів у кристалічному стані дорівнює 25 Дж/моль. Зараз ми можемо легко пояснити, чому це так. Атоми металів у вузлах кристалічної решітки постійно перебувають у русі - здійснюють коливальні рухи. Цей складний рух можна розкласти на три простих коливальні рухи в трьох взаємно перпендикулярних площинах. Кожному коливальному руху відповідає своя енергія та свій закон її зміни зі зростанням температури – своя теплоємність. Граничне значення теплоємності для будь-якого коливального руху атомів дорівнює R - універсальної газової постійної. Трьом незалежним коливальним рухам атомів у кристалі буде відповідати теплоємність, що дорівнює 3R. При нагріванні металів, починаючи з дуже низьких температур, їхня теплоємність зростає від нульового значення. При кімнатній та вищій температурі значення теплоємності більшості металів виходить на своє максимальне значення- 3R.
При нагріванні кристалічні грати металів руйнуються і вони переходять у розплавлений стан. При подальшому нагріванні метали випаровуються. У парах багато металів існують у вигляді молекул Me2. У цих молекулах атоми металу здатні утворювати ковалентні неполярні зв'язки.
Фтор - хімічний елемент (символ F, атомний номер 9), неметал, що відноситься до групи галогенів. Це найактивніша та електронегативна речовина. При нормальній температурі та тиску молекула фтору є блідо-жовтого кольору з формулою F 2 . Як і інші галоїди, молекулярний фтор дуже небезпечний і при контакті зі шкірою спричиняє важкі хімічні опіки.
Використання
Фтор та його сполуки широко застосовуються, у т. ч. і для отримання фармацевтичних препаратів, агрохімікатів, паливно-мастильних матеріалів та текстилю. використовується для травлення скла, а плазма з фтору - для напівпровідникових та інших матеріалів. Низькі концентрації іонів F у зубній пасті та питній воді можуть допомогти запобігти карієсу зубів, у той час як вищі концентрації входять до складу деяких інсектицидів. Багато загальні анестетики є похідними фторвуглеводнів. Ізотоп 18 F є джерелом позитронів для отримання медичних зображень методом позитронно-емісійної томографії, а гексафторид урану використовується для поділу ізотопів урану та отримання атомних електростанцій.
Історія відкриття
Мінерали, що містять сполуки фтору, були відомі багато років до виділення цього хімічного елемента. Наприклад, мінерал плавиковий шпат (або флюорит), що складається з фториду кальцію, був описаний в 1530 Георгієм Агриколою. Він помітив, що його можна використовувати як флюс - речовину, яка допомагає знизити температуру плавлення металу або руди та допомагає очистити потрібний метал. Тому фтор назвав свою латинську назву отримав від слова fluere («текти»).
У 1670 році склодув Генріх Шванхард виявив, що скло труїться під дією фтористого кальцію (плавикового шпату), обробленого кислотою. Карл Шееле та багато пізніших дослідників, у тому числі Гемфрі Деві, Жозеф-Луї Гей-Люссак, Антуан Лавуазьє, Луї Тенар, експериментували з плавиковою кислотою (HF), яку було нескладно отримати шляхом обробки CaF концентрованою сірчаною кислотою.
Зрештою, стало відомо, що HF містить раніше невідомий елемент. Цю речовину, однак, через його надмірну реактивність протягом багатьох років виділити не вдавалося. Його не тільки важко відокремити від з'єднань, але воно відразу вступає в реакцію з іншими їх компонентами. Виділення елементарного фтору з плавикової кислоти надзвичайно небезпечне, і ранні спроби засліпили та вбили кількох учених. Ці люди стали відомі як "мученики фтору".

Відкриття та виробництво
Нарешті, 1886 року французькому хіміку Анрі Муассану вдалося виділити фтор шляхом електролізу суміші розплавлених фторидів калію та плавикової кислоти. За це він був удостоєний Нобелівської премії 1906 року у галузі хімії. Його електролітичний підхід продовжує використовуватись сьогодні для промислового одержання даного хімічного елемента.
Перше масштабне виробництво фтору розпочалося під час Другої світової війни. Він був потрібен для одного з етапів створення атомної бомби в рамках Манхеттенського проекту. Фтор використовувався для отримання гексафториду урану (UF 6), який, у свою чергу, застосовувався для відокремлення один від одного двох ізотопів 235 U та 238 U. Сьогодні газоподібний UF 6 необхідний для отримання збагаченого урану для ядерної енергетики.

Найважливіші властивості фтору
У періодичній таблиці елемент знаходиться у верхній частині групи 17 (колишня група 7А), яку називають галогенною. До інших галогенів відносяться хлор, бром, йод та астат. Крім того, F знаходиться у другому періоді між киснем та неоном.
Чистий фтор – це корозійний газ ( хімічна формула F 2) з характерним різким запахом, який виявляється у концентрації 20 нл на літр об'єму. Як найбільш реактивний та електронегативний з усіх елементів, він легко утворює з'єднання з більшістю з них. Фтор дуже реактивний, щоб існувати в елементарній формі і має таку спорідненість з більшістю матеріалів, включаючи кремній, що його не можна готувати або зберігати у скляних ємностях. У вологому повітрі він реагує з водою, утворюючи не менш небезпечну плавикову кислоту.
Фтор, взаємодіючи з воднем, вибухає навіть за низької температури й у темряві. Він бурхливо реагує з водою, утворюючи плавикову кислоту та газоподібний кисень. Різні матеріали, у тому числі дрібнодисперсні метали та скло, у струмені газоподібного фтору горять яскравим полум'ям. Крім того, хімічний елемент утворює сполуки з благородними газами криптоном, ксеноном і радоном. Проте безпосередньо з азотом та киснем він не реагує.
Незважаючи на крайню активність фтору, сьогодні стали доступні методи його безпечної обробки та транспортування. Елемент може зберігатися в ємностях зі сталі або монелю (багатого на нікель сплаву), так як на поверхні цих матеріалів утворюються фториди, які перешкоджають подальшій реакції.
Фториди - це речовини, у яких фтор є у вигляді негативно зарядженого іона (F -) разом із деякими позитивно зарядженими елементами. З'єднання фтору з металами є одними з найстабільніших солей. При розчиненні у питній воді вони діляться на іони. Іншими формами фтору є комплекси, наприклад, - і H 2 F + .

Ізотопи
Існує безліч ізотопів даного галогену, починаючи від 14 F і закінчуючи 31 F. Але ізотопний склад фтору включає лише один з них, 19 F, який містить 10 нейтронів, так як він є стабільним. Радіоактивний ізотоп 18 F – цінне джерело позитронів.
Біологічний вплив
Фтор в організмі в основному міститься в кістках та зубах у вигляді іонів. Фторування питної води в концентрації менше однієї частини на мільйон значно знижує частоту карієсу – так вважають у Національній дослідницькій раді Національної академії наук США. З іншого боку, надмірне накопичення фтору може призвести до флюорозу, який проявляється у крапчастості зубів. Цей ефект зазвичай спостерігається в місцевостях, де вміст хімічного елемента в питній воді перевищує концентрацію 10 проміле.
Елементарний фтор та фтористі солі токсичні і з ними слід поводитися з великою обережністю. Контакту зі шкірою чи очима слід ретельно уникати. Реакція зі шкірним покривом виробляє яка швидко проникає через тканини та реагує з кальцієм у кістках, пошкоджуючи їх назавжди.

Фтор у навколишньому середовищі
Щорічний світовий видобуток мінералу флюориту становить близько 4 млн т, а загальна потужність розвіданих родовищ перебуває у межах 120 млн т. Основними районами видобутку цього мінералу є Мексика, Китай та Західна Європа.
У природі фтор зустрічається у земної кори, де його можна знайти в гірських породах, вугіллі та глині. Фториди потрапляють у повітря за вітрової ерозії грунтів. Фтор є 13-м за поширеністю хімічним елементом у земній корі - його вміст дорівнює 950 проміле. У ґрунтах його середня концентрація - приблизно 330 проміле. Фтороводород може виділятися повітря внаслідок процесів горіння у промисловості. Фториди, що знаходяться у повітрі, зрештою випадають на землю або у воду. Коли фтор утворює зв'язок з дуже дрібними частинками, може залишатися в повітрі протягом тривалого періоду часу.
В атмосфері 0,6 мільярдних часток даного хімічного елемента присутні у вигляді сольового туману та органічних сполук хлору. У міських умовах концентрація сягає 50 частин на мільярд.

З'єднання
Фтор - це хімічний елемент, який утворює широкий спектр органічних та неорганічних сполук. Хіміки можуть замінити їм атоми водню, цим створюючи безліч нових речовин. Високоактивний галоген утворює сполуки з благородними газами. У 1962 Ніл Бартлетт синтезував гексафторплатинат ксенону (XePtF6). Фториди криптону та радону також були отримані. Ще одним з'єднанням є фторгідрид аргону, стійкий лише за екстремально низьких температур.
Промислове застосування
В атомарному та молекулярному стані фтор використовується для плазмового травлення у виробництві напівпровідників, плоских дисплеїв та мікроелектромеханічних систем. Плавикова кислота застосовується для травлення скла у лампах та інших виробах.
Поряд з деякими з його сполук, фтор - це важлива складова виробництва фармацевтичних препаратів, агрохімікатів, паливно-мастильних матеріалів та текстилю. Хімічний елемент необхідний отримання галогенованих алканів (галони), які, своєю чергою, широко використовувалися у системах кондиціонування повітря та охолодження. Пізніше таке застосування хлорфторвуглеців було заборонено, оскільки вони сприяють руйнуванню озонового шару у верхніх шарах атмосфери.

Гексафторид сірки - надзвичайно інертний, нетоксичний газ, що відноситься до речовин, що спричиняють парниковий ефект. Без фтору неможливе виробництво пластмас з низьким коефіцієнтом тертя, таких як тефлон. Багато анестетики (наприклад, севофлуран, десфлуран та ізофлуран) є похідними фторвуглеводнів. Гексафторалюмінат натрію (кріоліт) застосовується у електролізі алюмінію.
З'єднання фтору, у тому числі NaF, використовуються в зубних пастах для запобігання карієсу. Ці речовини додаються до системи державного водопостачання для фторування води, проте через вплив на здоров'я людини ця практика вважається спірною. При більш високих концентраціях NaF використовуються як інсектицид, особливо для боротьби з тарганами.
У минулому фториди застосовувалися для зниження і руд та підвищення їхньої плинності. Фтор – це важливий компонент виробництва гексафториду урану, який застосовується для поділу його ізотопів. 18 F, радіоактивний ізотоп з 110 хвилин, випромінює позитрони і часто використовується в медичній позитронно-емісійній томографії.
Фізичні властивості фтору
Базові характеристики хімічного елемента такі:
- Атомна вага 18,9984032 г/моль.
- Електронна конфігурація 1s 2 2s 2 2p 5 .
- Ступінь окиснення -1.
- Щільність 1,7 г/л.
- Температура плавлення 53,53 К.
- Температура кипіння 85,03 К.
- Теплоємність 31,34 Дж/(Кмоль).
Хімічні частинки, утворені з двох або кількох атомів, називаються молекулами(реальними чи умовними формульними одиницямибагатоатомних речовин). Атоми у молекулах хімічно пов'язані.
Під хімічним зв'язком розуміють електричні сили тяжіння, що утримують частки одна біля одної. Кожен хімічний зв'язок у структурних формулахпредставляється валентною рисою,наприклад:
H – H (зв'язок між двома атомами водню);
H 3 N – Н + (зв'язок між атомом азоту молекули аміаку та катіоном водню);
(До +) – (I -) (зв'язок між катіоном калію та йодид-іоном).
Хімічний зв'язок утворюється парою електронів (), яка в електронних формулах складних частинок(Молекул, складних іонів) зазвичай замінюється валентною рисою, на відміну від власних, неподілених електронних пар атомів, наприклад:
Хімічний зв'язок називається ковалентний,якщо вона утворена шляхом узагальнення пари електронів обома атомами.
У молекулі F 2 обидва атоми фтору мають однакову електронегативність, отже, володіння електронною парою їм однаково. Такий хімічний зв'язок називають неполярним, тому що у кожного атома фтору електронна щільністьоднакова і в електронної формулимолекули може бути умовно розділена між ними порівну:
У молекулі хлороводню НСl хімічний зв'язок вже полярна,оскільки електронна щільність на атомі хлору (елемента з більшою електронегативністю) значно вища, ніж на атомі водню:
Ковалентний зв'язок, наприклад, Н – Н, може бути утворений шляхом узагальнення електронів двох нейтральних атомів:
H · + · H > H - H
Такий механізм утворення зв'язку називається обміннимабо рівноцінним.
За іншим механізмом той самий ковалентний зв'язок H – H виникає при узагальненні електронної пари гідрид-іону H катіоном водню Н + :
H + + (:H) - > H - H
Катіон Н+ у цьому випадку називають акцептором,а аніон Н - Доноромелектронної пари. Механізм утворення ковалентного зв'язку при цьому буде донорно-акцепторним,або координаційним.
Одинарні зв'язки (Н - Н, F - F, Н - CI, Н - N) а-зв'язками,вони визначають геометричну форму молекул.
Подвійні та потрійні зв'язки () містять одну?-складову та одну або дві?-складові; ?-складова, що є основною і умовно утворюється першою, завжди міцніше?-складових.
Фізичними (реально вимірюваними) характеристиками хімічного зв'язку є її енергія, довжина та полярність.
Енергія хімічного зв'язку (Есв) - це теплота, яка виділяється при утворенні даного зв'язку і витрачається на її розрив. Для тих самих атомів одинарний зв'язок завжди слабшеніж кратна (подвійна, потрійна).
Довжина хімічного зв'язку (lсв) - міжядерна відстань. Для тих самих атомів одинарний зв'язок завжди довшийніж кратна.
Полярністьзв'язку вимірюється електричним дипольним моментом р- Добутком реального електричного заряду (на атомах даного зв'язку) на довжину диполя (т. Е. Довжину зв'язку). Що дипольний момент, то вище полярність зв'язку. Реальні електричні зарядина атомах у ковалентному зв'язку завжди менше за значенням, ніж ступеня окиснення елементів, але збігаються за знаком; наприклад, зв'язку H +I -Cl -I реальні заряди рівні Н +0 " 17 -Сl -0 " 17 (двополюсна частка, чи диполь).
Полярність молекулвизначається їх складом та геометричною формою.
Неполярними (р = O) будуть:
а) молекули простихречовин, оскільки вони містять лише неполярні ковалентні зв'язки;
б) багатоатомнімолекули складнихречовин, якщо їх геометрична форма симетрична.
Наприклад, молекули 2 , BF 3 і СН 4 мають наступні напрямки рівних (за довжиною) векторів зв'язків:

При складанні векторів зв'язків їх сума завжди перетворюється на нуль, і молекули загалом неполярні, хоча містять полярні зв'язку.
Полярними (р> O) будуть:
а) двоатомнімолекули складнихречовин, оскільки вони містять лише полярні зв'язки;
б) багатоатомнімолекули складнихречовин, якщо їхня будова асиметрично,тобто їх геометрична форма або незавершена, або спотворена, що призводить до появи сумарного електричного диполя, наприклад, у молекул NH 3 , Н 2 О, HNО 3 і HCN.
Складні іони, наприклад NH 4 + , SO 4 2- і NO 3 - не можуть бути диполями в принципі, вони несуть тільки один (позитивний або негативний) заряд.
Іонний зв'язоквиникає при електростатичному тяжінні катіонів та аніонів майже без узагальнення пари електронів, наприклад між К+ та I-. У атома калію - нестача електронної щільності, у атома йоду - надлишок. Такий зв'язок вважають граничнимвипадком ковалентного зв'язку, оскільки пара електронів перебуває практично у володінні аніон. Такий зв'язок найбільш характерний для сполук типових металів і неметалів (CsF, NaBr, CaO, K 2 S, Li 3 N) і речовин класу солей (NaNО 3 , K 2 SО 4 СаСО 3). Всі ці сполуки за кімнатних умов є кристалічними речовинами, які об'єднують загальною назвою іонні кристали(кристали, побудовані з катіонів та аніонів).
Відомий ще один вид зв'язку, званого металевим зв'язком,в якій валентні електрони так неміцно утримуються атомами металів, що фактично не належать до конкретних атомів.
Атоми металів, що залишилися без зовнішніх електронів, що чітко належать їм, стають хіба що позитивними іонами. Вони утворюють металеві кристалічні грати.Сукупність узагальнених валентних електронів ( електронний газ)утримує позитивні іони металу разом та у певних вузлах решітки.
Крім іонних та металевих кристалів існують ще атомніі молекулярнікристалічні речовини, у вузлах ґрат яких знаходяться атоми або молекули відповідно. Приклади: алмаз і графіт – кристали з атомними ґратами, йод I 2 та діоксид вуглецю СО 2 (сухий лід) – кристали з молекулярними ґратами.
Хімічні зв'язки існують не тільки всередині молекул речовин, але можуть утворюватися і між молекулами, наприклад, для рідкого HF, води Н 2 O і суміші H 2 O + NH 3:

Водневий зв'язокутворюється за рахунок сил електростатичного тяжіння полярних молекул, що містять атоми самих електронегативних елементів - F, О, N. Наприклад, водневі зв'язки є в HF, Н 2 O і NH 3 але їх немає в HCl, H 2 S і РН 3 .
Водневі зв'язки малостійкі і розриваються досить легко, наприклад, при плавленні льоду та кипінні води. Однак на розрив цих зв'язків витрачається деяка додаткова енергія, і тому температури плавлення (табл. 5) та кипіння речовин із водневими зв'язками

(наприклад, HF і Н 2 O) виявляються значно вищими, ніж у подібних речовин, але без водневих зв'язків (наприклад, HCl і H 2 S відповідно).
Багато органічних сполук також утворюють водневі зв'язки; Важливу роль водневий зв'язок грає у біологічних процесах.
Приклади завдань частини А1. Речовини лише з ковалентними зв'язками – це
1) SiH 4 , Сl 2 O, СаВr 2
2) NF 3 , NH 4 Cl, P 2 O 5
3) CH 4 HNO 3 Na (CH 3 O)
4) CCl 2 O, I 2 , N 2 O
2–4. Ковалентний зв'язок
2. одинарна
3. подвійна
4. потрійна
присутній у речовині
5. Кратні зв'язки є в молекулах
6. Частинки, які називають радикалами, – це
7. Один із зв'язків утворений за донорно-акцепторним механізмом у наборі іонів.
1) SO 4 2-, NH 4 +
2) H 3 O + , NH 4 +
3) PO 4 3- , NO 3 -
4) PH 4 + , SO 3 2-
8. Найбільш міцнаі коротказв'язок – у молекулі
9. Речовини лише з іонними зв'язками – у наборі
2) NH 4 Cl, SiCl 4
10–13. Кристалічні грати речовини
13. (ВІН) 2
1) металева
Завдання №1
Із запропонованого списку виберіть дві сполуки, в яких є іонний хімічний зв'язок.
- 1. Ca(ClO 2) 2
- 2. HClO 3
- 3. NH 4 Cl
- 4. HClO 4
- 5. Cl 2 O 7
Відповідь: 13
Визначити наявність іонного типу зв'язку у поєднанні у переважній більшості випадків можна тому, що до складу його структурних одиниць одночасно входять атоми. типового металута атоми неметалу.
За цією ознакою ми встановлюємо, що іонний зв'язок є в поєднанні під номером 1 - Ca(ClO 2) 2 , т.к. у його формулі можна побачити атоми типового металу кальцію та атоми неметалів - кисню та хлору.
Однак, більше сполук, що містять одночасно атоми металу та неметалу, у зазначеному списку немає.
Серед зазначених у завданні сполук є хлорид амонію, у ньому іонний зв'язок реалізується між катіоном амонію NH 4 + та хлорид-іоном Cl − .
Завдання №2
З запропонованого переліку виберіть дві сполуки, у яких тип хімічного зв'язку такий самий, як у молекулі фтору.
1) кисень
2) оксид азоту (ІІ)
3) бромоводень
4) йодид натрію
Запишіть у полі відповіді номери вибраних з'єднань.
Відповідь: 15
Молекула фтору (F 2) складається з двох атомів одного хімічного елемента неметалу, тому хімічний зв'язок у цій молекулі ковалентний неполярний.
Ковалентний неполярний зв'язок може бути реалізований тільки між атомами одного і того ж хімічного елемента неметалу.
Із запропонованих варіантів ковалентний неполярний тип зв'язку мають лише кисень та алмаз. Молекула кисню є двоатомною, складається з атомів одного хімічного елемента неметалу. Алмаз має атомну будову і в його структурі кожен атом вуглецю, що є неметалом, пов'язаний з чотирма іншими атомами вуглецю.
Оксид азоту (II) - речовина, що складається з молекул, утворених атомами двох різних неметалів. Оскільки електронегативності різних атомів завжди різні, загальна електронна пара в молекулі зміщена до електронегативнішого елементу, в даному випадку до кисню. Таким чином, зв'язок у молекулі NO є ковалентною полярною.
Бромоводород також складається з двоатомних молекул, що складаються з атомів водню та брому. Загальна електронна пара, що утворює зв'язок H-Br, зміщена до більш негативного атома брому. Хімічний зв'язок у молекулі HBr також є ковалентним полярним.
Йодід натрію - речовина іонної будови, утворена катіоном металу та йодид-аніоном. Зв'язок у молекулі NaI утворений за рахунок переходу електрона з 3 s-орбіталі атома натрію (атом натрію перетворюється на катіон) на недозаповнену 5 p-орбіталь атома йоду (атом йоду перетворюється на аніон) Такий хімічний зв'язок називається іонним.
Завдання №3
Із запропонованого переліку оберіть дві речовини, між молекулами яких утворюються водневі зв'язки.
- 1. C 2 H 6
- 2. C 2 H 5 OH
- 3. H 2 O
- 4. CH 3 OCH 3
- 5. CH 3 COCH 3
Запишіть у полі відповіді номери вибраних з'єднань.
Відповідь: 23
Пояснення:
Водневі зв'язки мають місце у речовинах молекулярної будови, В яких присутні ковалетні зв'язки H-O, H-N, H-F. Тобто. ковалентні зв'язки атома водню з атомами трьох хімічних елементів із найвищою електронегативністю
Таким чином, очевидно, водневі зв'язки є між молекулами:
2) спиртів
3) фенолів
4) карбонових кислот
5) аміаку
6) первинних та вторинних амінів
7) плавикової кислоти
Завдання №4
Із запропонованого списку виберіть дві сполуки з іонним хімічним зв'язком.
- 1. PCl 3
- 2. CO 2
- 3. NaCl
- 4. H 2 S
- 5. MgO
Запишіть у полі відповіді номери вибраних з'єднань.
Відповідь: 35
Пояснення:
Зробити висновок про наявність іонного типу зв'язку в поєднанні в переважній більшості випадків можна тому, що до складу структурних одиниць речовини одночасно входять атоми типового металу та атоми неметалу.
За цією ознакою ми встановлюємо, що іонний зв'язок є у з'єднанні під номером 3 (NaCl) та 5 (MgO).
Примітка*
Крім зазначеної вище ознаки, про наявність іонного зв'язку в з'єднанні можна говорити, якщо у складі його структурної одиниці міститься катіон амонію (NH 4 +) або його органічні аналоги - катіони алкіламонію RNH 3 + , діалкиламонію R 2 NH 2 + , триалкіламонію R 3 N + або тетраалкіламонію R 4 N + де R - деякий вуглеводневий радикал. Наприклад, іонний тип зв'язку має місце у з'єднанні (CH 3) 4 NCl між катіоном (CH 3) 4 + і хлорид-іоном Cl − .
Завдання №5
Із запропонованого переліку оберіть дві речовини з однаковим типом будівлі.
4) кухонна сіль
Запишіть у полі відповіді номери вибраних з'єднань.
Відповідь: 23
Завдання №8
Із запропонованого переліку оберіть дві речовини немолекулярної будови.
2) кисень
3) білий фосфор
5) кремній
Запишіть у полі відповіді номери вибраних з'єднань.
Відповідь: 45
Завдання №11
Із запропонованого переліку виберіть дві речовини, у молекулах яких присутній подвійний зв'язок між атомами вуглецю та кисню.
3) формальдегід
4) оцтова кислота
5) гліцерин
Запишіть у полі відповіді номери вибраних з'єднань.
Відповідь: 34
Завдання №14
Із запропонованого переліку оберіть дві речовини з іонним зв'язком.
1) кисень
3) оксид вуглецю (IV)
4) хлорид натрію
5) оксид кальцію
Запишіть у полі відповіді номери вибраних з'єднань.
Відповідь: 45
Завдання №15
З запропонованого переліку виберіть дві речовини з таким же типом кристалічних ґрат, як у алмазу.
1) кремнезем SiO 2
2) оксид натрію Na 2 O
3) чадний газ CO
4) білий фосфор P 4
5) кремній Si
Запишіть у полі відповіді номери вибраних з'єднань.
Відповідь: 15
Завдання №20
Із запропонованого переліку оберіть дві речовини, в молекулах яких є один потрійний зв'язок.
- 1. HCOOH
- 2. HCOH
- 3. C 2 H 4
- 4. N 2
- 5. C 2 H 2
Запишіть у полі відповіді номери вибраних з'єднань.
Відповідь: 45
Пояснення:
Щоб знайти правильну відповідь, намалюємо структурні формули сполук з представленого списку:
Таким чином, бачимо, що потрійний зв'язок є в молекулах азоту та ацетилену. Тобто. правильні відповіді 45
Завдання №21
Із запропонованого переліку оберіть дві речовини, у молекулах яких є ковалентний неполярний зв'язок.
Хімія підготовка до ЗНО та ДПА
Комплексне видання
ЧАСТИНА І
ЗАГАЛЬНА ХІМІЯ
ХІМІЯ ЕЛЕМЕНТІВ
ГАЛОГЕНИ
Прості речовини
Хімічні властивості Фтору
Фтор - найсильніший окисник у природі. Безпосередньо не реагує лише з гелієм, неоном і аргоном.
Під час реакції з металами утворюються фториди, з'єднання іонного типу:
Фтор енергійно реагує з багатьма неметалами, навіть із деякими інертними газами:

Хімічні властивості Хлору. Взаємодія зі складними речовинами
Хлор є сильнішим окисником, ніж бром або йод, тому хлор витісняє важкі галогени з їх солей:
![]()
Розчиняючись у воді, хлор частково реагує з нею, внаслідок чого утворюються дві кислоти: хлоридна та гіпохлоритна. При цьому один атом хлору підвищує ступінь окислення, а інший атом - знижує. Такі реакції називають реакціями диспропорціонування. Реакції диспропорціонування – це реакції самовідновлення-самоокиснення, тобто. реакції, у яких один елемент виявляє властивості і окисника, і відновника. При диспропорціонуванні одночасно утворюються сполуки, в яких елемент знаходиться у більш окисленому та відновленому стані порівняно з первісним. Ступінь окиснення атома Хлору в молекулі гіпохлоритної кислоти дорівнює +1:
Аналогічно протікає взаємодія хлору із розчинами лугів. При цьому утворюються дві солі: хлорид та гіпохлорит.
Хлор вступає у взаємодію Космосу з різними оксидами:
![]()
Хлор окислює деякі солі, в яких метал знаходиться не максимально окислення:
Молекулярний хлор реагує з багатьма органічними сполуками. У присутності ферум(III) хлориду як каталізатора хлор реагує з бензолом з утворенням хлорбензолу, а при опроміненні світлом внаслідок цієї реакції утворюється гексахлорциклогексан:

Хімічні властивості брому та йоду
Обидві речовини реагують з воднем, фтором та лугами:

Йод окислюють різні сильні окисники:
Методи видобування простих речовин
Вилучення фтору
Оскільки фтор є найсильнішим хімічним окисником, то виділити його за допомогою хімічних реакцій із сполук у вільному вигляді неможливо, тому фтор видобувають фізико-хімічним методом - електролізом.
Для вилучення фтору використовують розплав калій фториду та нікелеві електроди. Нікель використовують завдяки тому, що поверхня металу пасивується фтором внаслідок утворення нерозчинного
NiF 2 , отже, самі електроди не руйнуються під дією речовини, що на них виділяється:Видобування хлору
Хлор у промислових масштабах видобувають електролізом розчину натрію хлориду. В результаті цього процесу видобувають також гідроксид натрій:
У невеликих кількостях хлор видобувають окисненням розчину хлороводню різними методами:

Хлор – дуже важливий продукт хімічної промисловості.
Його світове виробництво становить мільйони тонн.
Вилучення брому та йоду
Для промислового використання бром та йод видобувають при окисленні бромідів та йодидів, відповідно. Для окислення найчастіше використовують молекулярний хлор, концентровану сульфатну кислоту або манган діоксид:

Фтор та деякі його сполуки використовують як окислювач ракетного палива. Великі кількості фтору використовують для добування різних холодоагентів (фреонів) та деяких полімерів, яким властива хімічна та термічна стійкість (тефлон та деякі інші). Фтор застосовують у ядерної техніки для поділу ізотопів урану.
Більшість хлору використовують для отримання соляної кислоти, а також як окислювач для добування інших галогенів. У промисловості його використовують для відбілювання тканин та паперу. У більших кількостях, ніж фтор, його застосовують для виробництва полімерів (ПВХ та інших) та холодоагентів. За допомогою хлору дезінфікують питну воду. Він також потрібен для добування деяких розчинників, таких як хлороформ, метилен хлористий, тетрахлорметан. А ще його використовують для виробництва багатьох речовин, наприклад хлорату калію (бертолетової солі), хлорного вапна та багатьох інших сполук, що містять атоми Хлору.
Бром та йод застосовують у промисловості не в таких масштабах, як хлор або фтор, проте з кожним роком використання цих речовин збільшується. Бром використовують у виробництві різних медичних препаратів заспокійливої дії. Йод використовують під час виготовлення антисептичних препаратів. З'єднання Брому та Йоду широко застосовують при кількісному аналізі речовин. За допомогою йоду очищають деякі метали (цей процес називають йодним рафінуванням), наприклад титан, ванадій та інші.
Теми кодифікатора ЄДІ: Ковалентний хімічний зв'язок, його різновиди та механізми освіти. Характеристики ковалентного зв'язку (полярність та енергія зв'язку). Іонний зв'язок. Металевий зв'язок. Водневий зв'язок
Внутрішньомолекулярні хімічні зв'язки
Спочатку розглянемо зв'язки, що виникають між частинками всередині молекул. Такі зв'язки називають внутрішньомолекулярними.
Хімічний зв'язок між атомами хімічних елементів має електростатичну природу та утворюється за рахунок взаємодії зовнішніх (валентних) електронів, більшою чи меншою мірою утримуваних позитивно зарядженими ядрамизв'язуваних атомів.
Ключове поняття тут – ЕЛЕКТРОВІДІЙНІСТЬ. Саме вона визначає тип хімічного зв'язку між атомами та властивості цього зв'язку.
- Це здатність атома притягувати (утримувати) зовнішні(Валентні) електрони. Електронегативність визначається ступенем тяжіння зовнішніх електронів до ядра і залежить, переважно, від радіусу атома та заряду ядра.
Електронегативність складно визначити однозначно. Л.Полінг склав таблицю відносних електронегативностей (на основі енергій зв'язків двоатомних молекул). Найбільш електронегативний елемент - фторзі значенням 4 .
Важливо, що у різних джерелах можна зустріти різні шкали та таблиці значень електронегативності. Цього не варто лякатися, оскільки при утворенні хімічного зв'язку грає роль атомів, а вона приблизно однакова у будь-якій системі.
Якщо один із атомів у хімічному зв'язку А:В сильніше притягує електрони, то електронна пара зміщується до нього. Чим більше різницю електронегативностейатомів, тим більше зміщується електронна пара.
Якщо значення електронегативності взаємодіючих атомів рівні або приблизно рівні: ЕО(А)≈ЕО(В), то загальна електронна пара не зміщується до жодного з атомів: А: В. Такий зв'язок називається ковалентної неполярної.
Якщо електронегативності взаємодіючих атомів відрізняються, але не сильно (різниця електронегативностей приблизно від 0,4 до 2: 0,4<ΔЭО<2 ), то електронна пара зміщується до одного з атомів. Такий зв'язок називається ковалентна полярна .
Якщо електронегативності взаємодіючих атомів відрізняються суттєво (різниця електронегативностей більша за 2: ΔЕО>2), то один з електронів практично повністю переходить до іншого атома, з утворенням іонів. Такий зв'язок називається іонна.
Основні типи хімічних зв'язків ковалентна, іоннаі металевазв'язку. Розглянемо їх докладніше.
Ковалентний хімічний зв'язок
Ковалентний зв'язок – це хімічний зв'язок , утворена за рахунок утворення загальної електронної пари А: . При цьому у двох атомів перекриваютьсяатомні орбіталі. Ковалентний зв'язок утворюється при взаємодії атомів з невеликою різницею електронегативностей (як правило, між двома неметалами) або атомів одного елемента.
Основні властивості ковалентних зв'язків
- спрямованість,
- насичуваність,
- полярність,
- поляризованість.
Ці властивості зв'язку впливають на хімічні та фізичні властивості речовин.
Спрямованість зв'язку характеризує хімічну будову та форму речовин. Кути між двома зв'язками називаються валентними. Наприклад, у молекулі води валентний кут H-O-H дорівнює 104,45 о, тому молекула води — полярна, а молекулі метану валентний кут Н-С-Н 108 про 28′.
Насиченість - Це здатність атомів утворювати обмежену кількість ковалентних хімічних зв'язків. Кількість зв'язків, здатних утворювати атом, називається .
Полярністьзв'язку виникає через нерівномірний розподіл електронної щільності між двома атомами з різною електронегативністю. Ковалентні зв'язки поділяють на полярні та неполярні.
Поляризованість зв'язку - це здатність електронів зв'язку зміщуватися під дією зовнішнього електричного поля(зокрема, електричного поля іншої частки). Поляризуемість залежить від рухливості електронів. Чим далі електрон знаходиться від ядра, тим він більш рухливий, відповідно і молекула більш поляризується.
Ковалентний неполярний хімічний зв'язок
Існує 2 види ковалентного зв'язування – ПОЛЯРНИЙі НЕПОЛЯРНИЙ .
Приклад . Розглянемо будову молекули водню H2. Кожен атом водню на зовнішньому енергетичному рівні несе один неспарений електрон. Для відображення атома використовуємо структуру Льюїса – це схема будови зовнішнього рівня енергії атома, коли електрони позначаються точками. Моделі точкових структур Люїса непогано допомагають при роботі з елементами другого періоду.
H. +. H = H:H
Таким чином, у молекулі водню одна загальна електронна пара та один хімічний зв'язок H–H. Ця електронна пара не зміщується до жодного з атомів водню, т.к. електронегативність у атомів водню однакова. Такий зв'язок називається ковалентної неполярної .
Ковалентний неполярний (симетричний) зв'язок – це ковалентний зв'язок, утворений атомами з рівною елетронегативністю (як правило, однаковими неметалами) і, отже, з рівномірним розподілом електронної густини між ядрами атомів.
Дипольний момент неполярних зв'язків дорівнює 0.
Приклади: H 2 (H-H), O 2 (O = O), S 8 .
Ковалентний полярний хімічний зв'язок
Ковалентний полярний зв'язок – це ковалентний зв'язок, який виникає між атомами з різною електронегативністю (як правило, різними неметалами) і характеризується зміщеннямзагальної електронної пари до більш негативного атома (поляризацією).
Електронна щільність зміщена до більш електронегативного атома – отже, у ньому виникає частковий негативний заряд (δ-), але в менш електроотрицательном атомі виникає частковий позитивний заряд (δ+, дельта +).
Чим більша відмінність в електронегативності атомів, тим вище полярністьзв'язку і тим більше дипольний момент . Між сусідніми молекулами та протилежними за знаком зарядами діють додаткові сили тяжіння, що збільшує міцністьзв'язку.
Полярність зв'язку впливає фізичні та хімічні властивості сполук. Від полярності зв'язку залежить механізми реакцій і навіть реакційна здатність сусідніх зв'язків. Полярність зв'язку найчастіше визначає полярність молекулиі, таким чином, безпосередньо впливає такі фізичні властивості як температурі кипіння і температура плавлення, розчинність в полярних розчинниках.
Приклади: HCl, CO2, NH3.
Механізми утворення ковалентного зв'язку
Ковалентний хімічний зв'язок може виникати за двома механізмами:
1. Обмінний механізм утворення ковалентного хімічного зв'язку – це коли кожна частка надає для утворення загальної електронної пари один неспарений електрон:
А . + . В= А:В
2. утворення ковалентного зв'язку – це такий механізм, при якому одна з частинок надає неподілену електронну пару, а інша частка надає вакантну орбіталь для цієї електронної пари:
А: + B= А:В
При цьому один із атомів надає неподілену електронну пару ( донор), а інший атом надає вакантну орбіталь для цієї пари ( акцептор). Через війну освіти зв'язку обидва енергія електронів зменшується, тобто. це вигідно для атомів.
Ковалентний зв'язок, утворений за донорно-акцепторним механізмом, не відрізняєтьсяза властивостями від інших ковалентних зв'язків, утворених обмінним механізмом. Утворення ковалентного зв'язку по донорно-акцепторному механізму притаманно атомів або з великою кількістю електронів на зовнішньому енергетичному рівні (донори електронів), або навпаки, з дуже малою кількістю електронів (акцептори електронів). Докладніше валентні можливості атомів розглянуті у відповідній.
Ковалентний зв'язок за донорно-акцепторним механізмом утворюється:
– у молекулі чадного газу CO(зв'язок у молекулі – потрійний, 2 зв'язки утворені за обмінним механізмом, один – за донорно-акцепторним): C≡O;
– у іоні амонію NH 4 + , в іонах органічних амінів, Наприклад, в іоні метиламонію CH 3 -NH 2 + ;
– у комплексних з'єднаннях, хімічний зв'язок між центральним атомом і групами лігандів, наприклад, тетрагідроксоалюмінату натрію Na зв'язок між алюмінієм і гідроксид-іонами;
– у азотної кислоти та її солях- нітратах: HNO 3 , NaNO 3 в деяких інших сполуках азоту;
– у молекулі озону O 3 .
Основні характеристики ковалентного зв'язку
Ковалентний зв'язок, як правило, утворюється між атомами неметалів. Основними характеристиками ковалентного зв'язку є довжина, енергія, кратність та спрямованість.
Кратність хімічного зв'язку
Кратність хімічного зв'язку - це число спільних електронних пар між двома атомами у поєднанні. Кратність зв'язку досить легко можна визначити із значення атомів, що утворюють молекулу.
Наприклад , У молекулі водню H 2 кратність зв'язку дорівнює 1, т.к. у кожного водню лише один неспарений електрон на зовнішньому енергетичному рівні, отже, утворюється одна загальна електронна пара.
У молекулі кисню O 2 кратність зв'язку дорівнює 2 т.к. у кожного атома на зовнішньому енергетичному рівні є по 2 неспарені електрони: O=O.
У молекулі азоту N 2 кратність зв'язку дорівнює 3 т.к. між у кожного атома по 3 неспарених електрона на зовнішньому енергетичному рівні, і атоми утворюють 3 загальні електронні пари N≡N.
Довжина ковалентного зв'язку
Довжина хімічного зв'язку
- Це відстань між центрами ядер атомів, що утворюють зв'язок. Її визначають експериментальними фізичними методами. Оцінити величину довжини зв'язку можна приблизно, за правилом адитивності, згідно з яким довжина зв'язку в молекулі АВ приблизно дорівнює напівсумі довжин зв'язків у молекулах А 2 і 2: 
Довжину хімічного зв'язку можна оцінити приблизно за радіусами атомів, що утворюють зв'язок, або за кратністю зв'язкуякщо радіуси атомів не сильно відрізняються.
У разі збільшення радіусів атомів, що утворюють зв'язок, довжина зв'язку збільшиться.
Наприклад
При збільшенні кратності зв'язку між атомами (атомні радіуси яких не відрізняються, або незначно відрізняються) довжина зв'язку зменшиться.
Наприклад . У ряду: C–C, C=C, C≡C довжина зв'язку зменшується.
Енергія зв'язку
Мірою міцності хімічного зв'язку є енергія зв'язку. Енергія зв'язку визначається енергією, необхідної для розриву зв'язку та видалення атомів, що утворюють цей зв'язок, на нескінченно велику відстань один від одного.
Ковалентний зв'язок є дуже міцною.Її енергія становить від кількох десятків до кількох сотень кДж/моль. Чим більша енергія зв'язку, тим більша міцність зв'язку, і навпаки.
Міцність хімічного зв'язку залежить від довжини зв'язку, полярності зв'язку та кратності зв'язку. Чим довший хімічний зв'язок, тим легше його розірвати, і тим менша енергія зв'язку, тим нижча її міцність. Чим коротший хімічний зв'язок, тим він міцніший, і тим більша енергія зв'язку.
Наприклад, у ряді сполук HF, HCl, HBr зліва направо міцність хімічного зв'язку зменшується, т.к. збільшується довжина зв'язку.
Іонний хімічний зв'язок
Іонний зв'язок - це хімічний зв'язок, заснований на електростатичному тяжінні іонів.
Іониутворюються у процесі прийняття чи віддачі електронів атомами. Наприклад, атоми всіх металів слабо утримують електрони зовнішнього енергетичного рівня. Тому для атомів металів характерні відновлювальні властивості- Здатність віддавати електрони.
Приклад. Атом натрію містить на 3 енергетичному рівні 1 електрон. Легко віддаючи його, атом натрію утворює набагато стійкіший іон Na + з електронною конфігурацією благородного газу неону Ne. В іоні натрію міститься 11 протонів і лише 10 електронів, тому сумарний заряд іона -10+11 = +1:
+11Na) 2) 8) 1 - 1e = +11 Na +) 2 ) 8
Приклад. Атом хлору на зовнішньому енергетичному рівні містить 7 електронів. Щоб придбати конфігурацію стабільного інертного атома аргону Ar, хлору необхідно приєднати 1 електрон. Після приєднання електрона утворюється стабільний іон хлору, що складається з електронів. Сумарний заряд іона дорівнює -1:
+17Cl) 2 ) 8 ) 7 + 1e = +17 Cl — ) 2 ) 8 ) 8
Зверніть увагу:
- Властивості іонів відрізняються від властивостей атомів!
- Стійкі іони можуть утворювати не лише атоми, але і групи атомів. Наприклад: іон амонію NH 4 + , сульфат-іон SO 4 2- та ін. Хімічні зв'язки, утворені такими іонами, також вважаються іонними;
- Іонний зв'язок, як правило, утворюють між собою металиі неметали(групи неметалів);
Іони, що утворилися, притягуються за рахунок електричного тяжіння: Na + Cl - , Na 2 + SO 4 2- .
Наочно узагальним різницю між ковалентними та іонними типами зв'язку:
Металевий хімічний зв'язок
Металевий зв'язок - це зв'язок, який утворюють відносно вільні електрониміж іонами металів, що утворюють кристалічну решітку
У атомів металів на зовнішньому енергетичному рівні зазвичай розташовані від одного до трьох електронів. Радіуси в атомів металів, зазвичай, великі — отже, атоми металів, на відміну неметалів, досить легко віддають зовнішні електрони, тобто. є сильними відновниками
Міжмолекулярні взаємодії
Окремо варто розглянути взаємодії, що виникають між окремими молекулами в речовині. міжмолекулярні взаємодії . Міжмолекулярні взаємодії це такий вид взаємодії між нейтральними атомами, при якому не з'являються нові ковалентні зв'язки. Сили взаємодії між молекулами виявлені Ван-дер Ваальсом у 1869 році, і названі на честь нього Ван-дар-Ваальсовими силами. Сили Ван-дер-Ваальса поділяються на орієнтаційні, індукційні і дисперсійні . Енергія міжмолекулярних взаємодій набагато менша за енергію хімічного зв'язку.
Орієнтаційні сили тяжіння виникають між полярними молекулами (диполь-диполь взаємодія). Ці сили з'являються між полярними молекулами. Індукційні взаємодії — це взаємодія між полярною молекулою та неполярною. Неполярна молекула поляризується через полярну дію, що і породжує додаткове електростатичне тяжіння.
Особливий вид міжмолекулярної взаємодії – водневі зв'язки. - це міжмолекулярні (або внутрішньомолекулярні) хімічні зв'язки, що виникають між молекулами, в яких є сильно полярні ковалентні зв'язки. H-F, H-O або H-N. Якщо в молекулі є такі зв'язки, між молекулами виникатимуть додаткові сили тяжіння .
Механізм освіти водневого зв'язку частково електростатичний, а частково донорно-акцепторний. При цьому донором електронної пари виступають атом сильно-негативного елемента (F, O, N), а акцептором - атоми водню, з'єднані з цими атомами. Для водневого зв'язку характерні спрямованість у просторі та насичуваність.
Водневий зв'язок можна позначати точками: Н ··· O. Чим більша електронегативність атома, сполученого з воднем, і чим менші його розміри, тим міцніший водневий зв'язок. Вона характерна насамперед для з'єднань фтору з воднем , а також до олію з воднем , у меншій мірі азоту з воднем .
Водневі зв'язки виникають між такими речовинами:
— фтороводород HF(газ, розчин фтороводню у воді - плавикова кислота), вода H 2 O (пар, лід, рідка вода):
— розчин аміаку та органічних амінів- між молекулами аміаку та води;
— органічні сполуки, у яких зв'язку O-H або N-H: спирти, карбонові кислоти, аміни, амінокислоти, феноли, анілін та його похідні, білки, розчини вуглеводів - моносахаридів та дисахаридів.
Водневий зв'язок впливає на фізичні та хімічні властивості речовин. Так, додаткове тяжіння між молекулами ускладнює кипіння речовин. У речовин із водневими зв'язками спостерігається аномальне підвищення теператури кипіння.
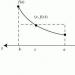
Наприклад Як правило, при підвищенні молекулярної маси спостерігається підвищення температури кипіння речовин. Однак у ряді речовин H 2 O-H 2 S-H 2 Se-H 2 Teми не спостерігаємо лінійної зміни температур кипіння.
А саме, у води температура кипіння аномально висока - не менше -61 про С, як показує нам пряма лінія, а набагато більше +100 про С. Ця аномалія пояснюється наявністю водневих зв'язків між молекулами води. Отже, за звичайних умов (0-20 о С) вода є рідиноюза фазовим станом.