Над вільною поверхнею рідини завжди є пари цієї рідини. Якщо посудина з рідиною не закрита, то концентрація частинок пари при постійній температурі може змінюватися в широких межах у бік зменшення та у бік збільшення.
Процес випаровування у замкнутий простір(закрита судина з рідиною) може при даній температурі відбуватися лише до певної межі. Це пояснюється тим, що одночасно з випаровуванням рідини відбувається конденсація пари. Спочатку число молекул, що вилітають з рідини за 1 с, більше за число молекул, що повертаються назад, і щільність, а значить, і тиск пари зростає. Це призводить до збільшення швидкості конденсації. Через деякий час настає динамічна рівновага, при якій щільність пари над рідиною стає постійною. Пара, що перебуває у стані динамічної рівноваги зі своєю рідиною, називається насиченою парою. Пара, яка не перебуває в стані динамічної рівноваги зі своєю рідиною, називається ненасиченим.
Досвід показує, що ненасичені пари підкоряються всім газовим законам, і тим точніше, чим далі вони від насичення. Для насичених пар характерні такі властивості:
Література
Аксенович Л. А. Фізика в середній школі: Теорія. Завдання. Тести: Навч. посібник для установ, які забезпечують отримання заг. середовищ, освіти/Л. А. Аксенович, Н.Н.Ракіна, К. С. Фаріно; За ред. К. С. Фаріно. – Мн.: Адукація i виховання, 2004. – C. 198-199.
Рідини мають властивість випаровуватися. Якби ми капнули на стіл по краплині води, ефіру та ртуті (тільки не робіть цього в домашніх умовах!), змогли б спостерігати, як поступово краплі зникають – випаровуються. Одні рідини випаровуються швидше, інші повільніше. Процес випаровування рідини ще називається пароутворенням. А зворотний процес перетворення пари на рідину – конденсацією.
Ці два процеси ілюструють фазовий перехід- Процес переходу речовин з одного агрегатного стану в інший:
- випаровування (перехід з рідкого в газоподібний стан);
- конденсація (перехід із газоподібного стану в рідкий);
- десублімація (перехід із газоподібного стану в твердий, минаючи рідку фазу);
- сублімація, вона ж сублімація (перехід з твердого в газоподібний стан, минаючи рідке).
Зараз, до речі, підходящий сезон, щоб спостерігати процес десублімації в природі: іній та паморозь на деревах та предметах, морозні візерунки на вікнах – її результат.
Як утворюється насичена та ненасичена пара
Але повернемося до пароутворення. Ми продовжимо експериментувати і наллємо рідину – воду, наприклад, у відкриту посудину, а до неї приєднаємо манометр. Невидиме оку, в посудині відбувається випаровування. Усі молекули рідини перебувають у безперервному русі. Деякі рухаються так швидко, що їх кінетична енергія виявляється сильнішою за ту, що пов'язує молекули рідини разом.
Залишивши рідину, ці молекули продовжують хаотично рухатися в просторі, переважна більшість їх розсіюється в ньому - так утворюється ненасичена пара. Лише невелика їх частина повертається у рідину.
Якщо закриємо посудину, молекул пара поступово ставатиме дедалі більше. І все більше їх повертатиметься в рідину. При цьому збільшуватиметься тиск пари. Це зафіксує приєднаний до судини манометр.
Через деякий час число молекул, що вилітають з рідини і повертаються до неї, зрівняється. Тиск пари перестане змінюватися. В результаті насичення паривстановиться термодинамічна рівновага системи рідина-пар. Тобто випаровування та конденсація будуть рівні.
Властивості насиченої пари
Щоб їх проілюструвати наочно, використовуємо ще один експеримент. Покличте всю силу своєї уяви, щоб уявити його. Отже, візьмемо ртутний манометр, що складається з двох колін – трубок, що сполучаються. В обидва налиті ртуть, один кінець відкритий, другий запаяний і над ртуттю в ньому знаходиться ще кілька ефірів та його насиченої пари. Якщо опускати і піднімати не запаяне коліно, рівень ртуті в запаяному також опускатиметься і підніматиметься.
При цьому змінюватиметься і кількість (обсяг) насиченої пари ефіру. Різниця рівнів ртутних стовпчиків в обох колінах манометра показує тиск насиченої пари ефіру. Воно зберігатиметься незмінним весь час.
Звідси витікає властивість насиченої пари – її тиск залежить від займаного ним обсягу. Тиск насичених пар різних рідин (води та ефіру, наприклад) різне при однаковій температурі.
Проте температура насиченої пари має значення. Чим вища температура, тим вищий і тиск. Тиск насиченої пари зі збільшенням температури зростає швидше, ніж це відбувається з ненасиченою парою. Температура та тиск ненасиченої пари пов'язані лінійною залежністю.
Можна провести ще один цікавий досвід. Взяти порожню колбу без пар рідини, закрити її і приєднати манометр. Поступово по краплі подавати всередину колби рідину. У міру надходження рідини та її випаровування встановлюється тиск насиченої пари, найбільший для цієї рідини при цій температурі.
Ще про температуру і насичену пару
Температура пари впливає і швидкість конденсації. Так само, як температура рідини визначає швидкість випаровування – число молекул, що вилітають із поверхні рідини в одиницю часу, тобто.
У насиченої пари його температура дорівнює температурі рідини. Чим вище температура насиченої пари, тим вище її тиск і щільність, нижче щільність рідини. При досягненні критичної для речовини температури щільність рідини та пари однакова. Якщо температура пари вище критичної для речовини температури, фізичні відмінності між рідиною та насиченою парою стираються.
Визначення тиску насиченої пари у суміші з іншими газами
Ми сказали про постійний при постійній температурі тиск насиченої пари. Ми визначали тиск в «ідеальних» умовах: коли в посудині чи колбі присутні рідина та пара лише однієї речовини. Розглянемо ще експеримент, у якому молекули речовини розсіяні у просторі суміші коїться з іншими газами.
Для цього візьмемо два відкриті скляні циліндри і помістимо в обидва закриті судини з ефіром. Як водиться, приєднаємо манометри. Одну судину з ефіром розкриваємо, після чого манометр фіксує підвищення тиску. Різниця між цим тиском і тиском в циліндрі із закритою судиною ефіру і дозволяє дізнатися тиск насиченої пари ефіру.
Про тиск і кипіння
Випаровування можливе не тільки з поверхні рідини, а й у її об'ємі – тоді його називають кипінням. У разі підвищення температури рідини утворюються бульбашки пари. Коли тиск насиченої пари більший або дорівнює тиску газу в бульбашках, рідина випаровується всередину бульбашок. А ті розширюються та піднімаються на поверхню.
Рідини киплять за різних температур. У звичайних умовах вода закипає при 100 0 С. Але зі зміною атмосферного тиску змінюється температура кипіння. Так, у горах, де повітря сильно розріджене і атмосферний тиск нижче, у міру підйому в гори знижується і температура кипіння води.
До речі, в герметично закритій посудині кипіння неможливе взагалі.

Ще один приклад взаємозв'язку тиску пари та випаровування демонструє така характеристика вмісту парів води у повітрі, як відносна вологість повітря. Вона є відношенням парціального тискупарів води до тиску насиченої пари та визначається за формулою: φ = р/р про * 100%.
При зниженні температури повітря концентрація водяної пари у ньому підвищується, тобто. вони стають більш насиченими. Ця температура називається точкою роси.
Підведемо підсумки
На нескладних прикладах ми розібрали суть процесу випаровування і ненасичену і насичену пару, що утворюються в його результаті. Всі ці явища ви щодня можете спостерігати навколо себе: наприклад, бачити калюжі, що висихають після дощу, на вулицях або запотіле від пари дзеркало у ванній кімнаті. У ванній ви навіть можете спостерігати, як спочатку відбувається пароутворення, а потім конденсація вологи, що накопичилася на дзеркалі, назад у воду.
Ви також можете використовувати ці знання, щоб зробити своє життя більш комфортним. Наприклад, взимку у багатьох квартирах повітря дуже сухе, і це погано позначається на самопочутті. Ви можете використовувати сучасний прилад-зволожувач, щоб зробити його більш вологим. Або по-старому поставити в кімнаті ємність з водою: поступово випаровуючись, вода наситить повітря своїми парами.
сайт, при повному або частковому копіюванні матеріалу посилання на першоджерело обов'язкове.
Як ви знаєте, рідини випаровуються, тобто перетворюються на пару. Наприклад, калюжі після дощу висихають. Випаровування рідини обумовлено тим, що деякі її молекули завдяки поштовхам своїх «сусідів» набувають кінетичної енергії, достатньої для того, щоб вирватися з рідини.
В результаті випаровування над поверхнею рідини завжди знаходиться пара, це газоподібний стан речовини. Водяна пара невидима, як і повітря. Те, що часто називають парою, є скупченням крихітних водяних крапельок, що утворилися внаслідок конденсації пари.
Конденсація– це перетворення пари на рідину, тобто процес, протилежний випаровування. Внаслідок конденсації водяної пари, що міститься в повітрі, утворюються хмари (рис. 44.1) і туман (рис. 44.2). Холодне скло запотіває, стикаючись з теплим повітрям (рис. 44.3). Це також результат конденсації водяної пари.
Динамічна рівновага
Якщо банку із водою щільно закрити, рівень води у ній залишається незмінним протягом багатьох місяців.
Чи означає це, що у закритій посудині рідина не випаровується?
Ні, звичайно: у ній завжди є досить швидкі молекули, які постійно вилітають з рідини. Однак одночасно з випаровуванням йде конденсація: молекули з пари влітають назад у рідину.
Якщо рівень рідини з часом не змінюється, це означає, що процеси випаровування та конденсації йдуть з однаковою інтенсивністю. У такому разі кажуть, що рідина та пара знаходяться в динамічній рівновазі.
2. Насичена та ненасичена пара
Насичиний пар
На малюнку 44.4 схематично зображені процеси випаровування та конденсації у щільно закритій посудині, коли рідина та пара знаходяться в динамічній рівновазі. 
Пара, що знаходиться в динамічній рівновазі зі своєю рідиною, називають насиченою.
Ненасичена пара
Якщо посудину з рідиною відкрити, пара почне виходити із посудини назовні. Внаслідок цього концентрація пари в посудині зменшиться, і молекули пари рідше стикатимуться з поверхнею рідини і влітатимуть у неї. Тому інтенсивність конденсації зменшиться.
А інтенсивність випаровування залишається незмінною. Тому рівень рідини у посудині почне знижуватися. Якщо процес випаровування йде швидше, ніж процес конденсації, кажуть, що над рідиною знаходиться ненасичена пара (рис. 44.5). 
У повітрі завжди є водяна пара, але зазвичай вона є ненасиченою, тому випаровування переважає над конденсацією. Тому калюжі і висихають.
Над поверхнею морів та океанів пара також ненасичена, тому вони поступово випаровуються. Чому рівень води при цьому не знижується?
Справа в тому, що пар, що піднімається вгору, охолоджується і конденсується, утворюючи хмари і хмари. Вони перетворюються на дощові хмари та проливаються дощами. А річки несуть воду назад у моря та океани.
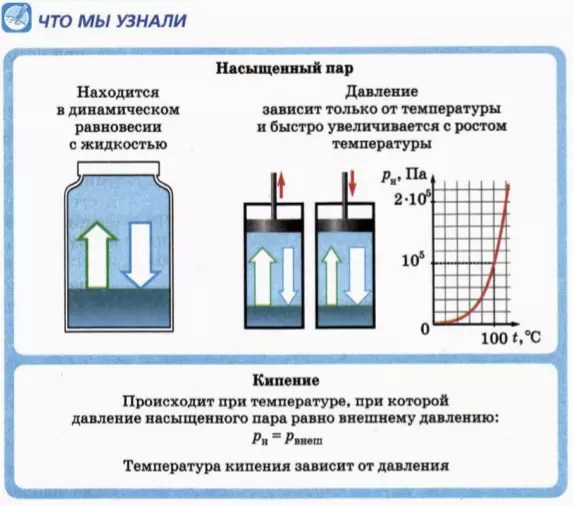
3. Залежність тиску насиченої пари від температури
Головна властивість насиченої пари полягає в тому, що
тиск насиченої пари не залежить від об'єму, а залежить лише від температури.
Ця властивість насиченої пари не так легко зрозуміти, тому що вона здається, що суперечить рівнянню стану ідеального газу
pV = (m/M)RT, (1)
з якого випливає, що для донної маси газу при постійній температурі тиск обернено пропорційно обсягу. Можливо, для насиченої пари це рівняння не застосовується?
Відповідь така: рівняння стану ідеального газу добре описує пару – як насичену, так і ненасичену. Але маса насиченої пари m, що стоїть у правій частині рівняння (1), при ізотермічному розширенні або стиску змінюється – причому так, що тиск насиченої пари залишається незмінним. Чому так відбувається?
Справа в тому, що при зміні обсягу судини пара може залишатися насиченою лише за умови, що в цій же посудині знаходиться «його» рідина. Збільшуючи ізотермічний об'єм судини, ми хіба що «витягуємо» з рідини молекули, що стають молекулами пари (рис. 44.6, а). 
Відбувається це чомусь. При збільшенні обсягу пари його концентрація спочатку зменшується - але дуже короткий проміжок часу. Як тільки пара стає ненасиченою, випаровування рідини, що знаходиться в цій же посудині, починає «випереджати» конденсацію. В результаті маса пари швидко зростає, поки вона знову не стане насиченою. Тиск пари при цьому знову стане незмінним.
1. Використовуючи малюнок 44.6, б поясніть, чому при зменшенні об'єму насиченої пари його маса зменшується.
Отже, при розширенні або стисканні насиченої пари його маса змінюється за рахунок зміни маси рідини, що міститься в цій же посудині.
Залежність тиску насиченої водяної пари від температури виміряна на досліді. Графік цієї залежності наведено малюнку 44.7. Ми бачимо, що тиск насиченої пари дуже швидко збільшується зі зростанням температури. 
Головна причина збільшення тиску насиченої пари зі зростанням температури – збільшення маси пари. Як ви самі переконаєтеся, виконуючи наступне завдання, при збільшенні температури від 0 ºС до 100 ºС маса насиченої пари в тому самому обсязі збільшується більш ніж у 100 разів!
У таблиці наведено значення тиску насиченої водяної пари при деяких значеннях температури.
Ця таблиця допоможе вам під час виконання наступного завдання. Скористайтеся формулою (1).
2. У герметично закритій посудині об'ємом 10 л знаходяться вода і насичена пара. Температуру вмісту судини підвищують від 0 ºС до 100 ºС. Вважайте, що об'єм води в порівнянні з об'ємом пари можна знехтувати.
а) У скільки разів збільшилась абсолютна температура?
б) У скільки разів збільшився б тиск пари, якби він залишився насиченим?
в) У скільки разів збільшилася б маса пари, якби вона залишилася насиченою?
г) Якою стала б маса пари в кінцевому стані, якби вона залишилася насиченою?
д) За якої мінімальної маси води в початковому стані пара залишиться насиченою?
е) Яким буде тиск пари в кінцевому стані, якщо початкова маса води буде в 2 рази меншою від знайденої в попередньому пункті?
3. Що збільшується зі зростанням температури швидше – тиск насиченої пари або її щільність?
Підказка. Формулу (1) можна записати у вигляді
4. Порожню герметично закриту посудину об'ємом 20 л заповнили насиченою водяною парою при температурі 100 ºС.
а) Чому дорівнює тиск пари?
б) Чому дорівнює маса пари?
в) Чому дорівнює концентрація пари?
г) Яким стане тиск пари, коли вона охолоне до 20 ºС?
д) Чому рівні маси пари та води при 20 ºС?
Підказка. Скористайтеся наведеною вище таблицею та формулою (1).
4. Кипіння
За наведеним вище графіком (рис. 44 7) та таблицею ви, напевно, помітили, що при температурі кипіння води (100 ºС) тиск насиченої водяної пари якраз дорівнює атмосферному (пунктир на графіку 44.7). Чи випадково цей збіг?
Ні, не випадково. Розглянемо процес кипіння.
Поставимо досвід
Нагріватимемо воду у відкритій прозорій посудині. Незабаром на стінках судини з'являться бульбашки. Це виділяється розчинене у воді повітря.
Всередину цих бульбашок починає випаровуватися вода, і бульбашки заповнюються насиченою парою. Але рости ці бульбашки не можуть, поки тиск насиченої пари менший за тиск у рідині. У відкритій неглибокій посудині тиск у рідині практично дорівнює атмосферному тиску.
Продовжимо нагрівати воду. Тиск насиченої пари у бульбашках із зростанням температури швидко збільшується. І як тільки воно стане рівним атмосферному тиску, почнеться інтенсивне випаровування рідини всередину бульбашок.
Вони швидко зростатимуть, підніматимуться вгору і лопатимуться на поверхні рідини (рис. 44.8). Це і є кипіння. 
У неглибокій судині тиск у рідині практично дорівнює зовнішньому тиску. Тому ми можемо сказати, що
кипіння рідини відбувається при температурі, при якій тиск p н насиченої пари дорівнює зовнішньому тиску p внеш:
p н = p зовніш. (2)
Звідси випливає, що температура кипіння залежить від тиску. Тому її можна змінювати, змінюючи тиск рідини. Зі збільшенням тиску температура кипіння рідини підвищується. Це використовують, наприклад, для стерилізації медичних інструментів: воду кип'ятять у спеціальних приладах – автоклавах, де тиск у 1,5–2 рази вищий за нормальний атмосферний.
Високо в горах, де атмосферний тиск істотно менший за нормальний атмосферний, зварити м'ясо непросто: наприклад, на висоті 5 км вода закипає вже при температурі 83 ºС.
5. Використовуючи формулу (2) та наведену вище таблицю, визначте температуру кипіння води:
а) при тиску, що дорівнює одній п'ятій нормального атмосферного тиску;
б) при тиску, в 2 рази більшому за атмосферний тиск.
кипіння води при зниженому тиску можна спостерігати в наступному досвіді.
Поставимо досвід
Доведемо воду в колбі до кипіння та щільно закриємо колбу. Коли вода трохи охолоне, перевернем колбу і поливатимемо її дно холодною водою. Вода закипить, хоча її температура істотно нижча за 100 ºС (рис. 44.9). 
6. Поясніть цей досвід.
7. На яку висоту можна було б підняти киплячу воду поршнем, якби вона при цьому не остигала?
Додаткові запитання та завдання
8. У циліндричній посудині під поршнем тривалий час знаходяться вода і водяна пара. Маса води в 2 рази більша за масу пари. Повільно переміщуючи поршень, об'єм під поршнем збільшують від 1 до 6 л. Температура вмісту посудини залишається рівною 20 ºС. Вважайте, що об'єм води можна знехтувати порівняно з об'ємом пари.
а) Яка пара знаходиться під поршнем спочатку?
б) Поясніть, чому тиск у посудині не змінюватиметься доти, доки обсяг під поршнем не стане рівним З л.
в) Чому дорівнює тиск у посудині, коли об'єм під поршнем дорівнює 3 л?
г) Чому дорівнює маса пари в посудині, коли об'єм під поршнем дорівнює 3 л?
Підказка. При цьому весь об'єм посудини заповнений насиченою парою.
д) У скільки разів збільшилася маса пари, коли об'єм під поршнем збільшився від 1 л до 3 л?
е) Чому дорівнює маса води у початковому стані?
Підказка. Скористайтеся тим, що в початковому стані маса води в 2 рази більша за масу пари.
ж) Як змінюватиметься тиск у посудині при зміні об'єму під поршнем від 3 л до 6 л?
Підказка. Для ненасиченої пари справедливе рівняння стану ідеального газу із постійною масою.
з) Чому дорівнює тиск у посудині, коли об'єм під поршнем дорівнює 6 л?
і) Накресліть зразковий графік залежності тиску пари під поршнем від об'єму.
9. Дві запаяні U-подібні трубки нахилили, як показано на малюнку 44.10. У якій трубці над водою знаходиться лише насичена пара, а в яке повітря з парою? Обґрунтуйте свою відповідь. 
Процеси випаровування та конденсації йдуть безперервно та паралельно один одному.
У відкритій посудині кількість рідини згодом зменшується, т.к. випаровування переважає над конденсацією.
Пар, який знаходиться над поверхнею рідини, коли випаровування переважає над конденсацією або пара за відсутності рідини, називається ненасиченим.
У герметично закритому посудині рівень рідини з часом не змінюється, т.к. випаровування і конденсація компенсують один одного: скільки молекул вилітає з рідини, стільки ж їх за теж час повертається в неї, настає динамічна (рухлива) рівновага між парою та її рідиною.
Пара, що знаходиться в динамічній рівновазі зі своєю рідиною, називається насиченим.
При цій температурі насичена пара будь-якої рідини має найбільшу щільність ( ) і створює максимальний тиск ( ), яке може мати пару цієї рідини за цієї температури.
Тиск і щільність насиченої пари за однієї і тієї ж температури залежить від роду речовини: більший тиск створює насичена пара тієї рідини, яка швидше випаровується.Наприклад, і
Властивості ненасиченої пари:Ненасичені пари підпорядковуються газовим законам Бойля – Маріотта, Гей-Люссака, Шарля, до яких можна застосовувати рівняння стану ідеального газу.
Властивості насиченої пари:1. При постійному обсязі зі зростанням температури тиск насиченої пари збільшується, але не прямо пропорційно (закон Шарля не виконується), тиск зростає швидше, ніж у ідеального газу. , при зростанні температури ( ) , збільшується маса пари, а тому зростає концентрація молекул пари () і тиск насиченої пари зростає з двох причин (
3 1 - Ненасичена пара (ідеальний газ);
2 2 - насичиний пар; 3 - Ненасичена пара,
1 отриманий з насиченої пари у тому ж
Об'єм при нагріванні.
2. Тиск насиченої пари при постійній температурі залежить від займаного ним обсягу.
Зі збільшенням об'єму маса пари збільшується, а маса рідини зменшується (частина рідини переходить у пару), при зменшенні обсягу пари стає менше, а рідини більше (частина пари переходить у рідину), щільність і концентрація молекул насиченої пари залишаються постійними, отже, і тиск залишається незмінним ().
рідина
(насич. пар + рідина)
Ненасич. пара
Насичені пари не підпорядковуються газовим законам Бойля – Маріотта, Гей-Люссака, Шарля, т.к. маса пари в процесах не залишається постійною, а все газові закониотримані для постійної маси. До насиченої пари можна застосовувати рівняння стану ідеального газу.
Отже, насичену пару можна перевести в ненасичену пару, або нагріваючи її при постійному обсязі, або збільшуючи її за постійної температури. Ненасичену пару можна перевести в насичену пару, або охолоджуючи її при постійному обсязі, або стискаючи її за постійної температури.
Критичний стан
Наявність вільної поверхні рідини дає можливість вказати, де знаходиться рідка фаза речовини, а де газоподібна. Різка різниця між рідиною та її парою пояснюється тим, що щільність рідини у багато разів більша, ніж у пари. Якщо нагрівати рідину в герметично закритому посудині, то внаслідок розширення її щільність зменшуватиметься, а щільність пари над нею збільшуватиметься. Це означає, що різниця між рідиною та її насиченою парою згладжується і за досить високої температури зникає зовсім. Температура, при якій зникають відмінності в фізичні властивостіміж рідиною та її насиченою парою, та їх щільності стають однаковими, називаєтьсякритичною температурою.
Критична точка
Для утворення рідини з газу середня потенційна енергія тяжіння молекул має перевищувати їхню середню кінетичну енергію.
Критична температура – максимальна температура, при якій пара перетворюється на рідину.Критична температура залежить від потенційної енергії взаємодії молекул і тому є різною для різних газів. Через сильну взаємодію молекул води водяну пару можна перетворити на воду навіть при температурі . У той самий час зрідження азоту відбувається при температурі, меншої =-147˚ , т.к. молекули азоту слабко взаємодіють між собою.
Іншим макроскопічним параметром, що впливає перехід пар - рідина, є тиск. Зі зростанням зовнішнього тиску при стисканні газу зменшується середня відстань між частинками, зростає сила тяжіння між ними і, відповідно, середня потенційна енергія їхньої взаємодії.
Тискнасиченої пари при її критичній температурі називається критичним. Це найбільший можливий тиск насиченої пари даної речовини.
Стан речовини з критичними параметрами називається критичним(Критична точка) . У кожної речовини свої критичні температура та тиск.
У критичному стані звертаються в нуль питома теплота пароутворення та коефіцієнт поверхневого натягурідини. При температурах вище критичної, навіть за дуже великих тисках неможливе перетворення газу рідина, тобто. вище за критичну температуру рідина не може існувати. При надкритичних температурах можливий лише пароподібний стан речовини.
Зрідження газів можливе лише за температури нижче критичної температури. Для зрідження гази охолоджують до критичної температури, наприклад, при адіабатному розширенні, а потім стискають ізотермічно.
Кипіння
Зовнішнє явище виглядає так:з усього обсягу рідини до поверхні піднімаються бульбашки, що швидко ростуть, на поверхні вони лопаються, і пара викидається в навколишнє середовище.
МКТ пояснює кипіння так:у рідині завжди є бульбашки повітря, у них із рідини відбувається випаровування. Замкнений обсяг бульбашок виявляється заповненим не тільки повітрям, а й насиченою парою. Тиск насиченої пари в них при нагріванні рідини зростає швидше, ніж тиск повітря. Коли в досить нагрітій рідині тиск насиченої пари в бульбашках стає більше зовнішнього тиску, вони збільшуються в обсязі, і сила, що виштовхує, перевершує їх силу тяжкості, піднімає бульбашки до поверхні. Спливлі бульбашки починають лопатися, коли при певній температурі тиск насиченої пари в них перевершує тиск над рідиною. Температура рідини, при якій тиск її насиченої пари в бульбашках дорівнює або перевищує зовнішній тиск на рідину, називається температурою кипіння.
Температура кипіння різних рідин різна, т.к. тиск насиченої пари в їх пухирцях порівнюється з тим самим зовнішнім тиском при різних температурах. Наприклад, тиск насиченої пари в бульбашках дорівнює нормальному атмосферному тиску у води при 100С, у ртуті при 357С, у спирту при 78С, в ефіру при 35С.
Температура кипіння в процесі кипіння залишається постійною,т.к. все тепло, яке підводиться до рідини, що нагрівається, витрачається на пароутворення.
Температура кипіння залежить від зовнішнього тиску рідина: зі збільшенням тиску температура підвищується; із зменшенням тиску температура знижується.Наприклад, на висоті 5км над рівнем моря, де тиск у 2 рази нижчий за атмосферний, температура кипіння води 83˚С, у котлах парових машин, де тиск пари 15 атм. (), температура води близько 200˚С.
Вологість повітря
У повітрі завжди є водяна пара, тому можна говорити про вологість повітря, яка характеризується такими величинами:
1.Абсолютна вологість- Це щільність водяної пари, що знаходиться в повітрі (або тиск, який ця пара створює ( ).
Абсолютна вологість не дає уявлення про рівень насичення повітря водяними парами. Одна й та сама кількість водяної пари при різній температурі створює різне відчуття вологості.
2.Відносна вологість- це відношення щільності (тиску) водяної пари, що міститься в повітрі при даній температурі, до щільності (тиску) насиченої пари при тій же температурі :
![]() або
або
– абсолютна вологість за даної температури; - щільність, тиск насиченої пари за тієї ж температури. Щільність і тиск насиченої водяної пари за будь-якої температури можна знайти в таблиці. З таблиці видно, що стоїть температура повітря, тим більше має бути щільність і тиск водяної пари у повітрі, щоб він був насиченим.
Знаючи відносну вологість, можна зрозуміти, на скільки відсотків водяна пара в повітрі при даній температурі далека від насичення. Якщо пара в повітрі насичена, то . Якщо , то до стану насичення повітря не вистачає пари.
Про те, що пара в повітрі стає насиченою, судять за появою вологи у вигляді туману, роси. Температура, при якій водяна пара в повітрі стає насиченою, називається точкою роси.
Пара в повітрі можна зробити насиченою, якщо додати пари за рахунок додаткового випаровування рідини, не змінюючи температури повітря, або при кількості пари в повітрі знизити її температуру.
Нормальна відносна вологість, найбільш сприятлива для людини 40 – 60%. Велике значеннямає знання вологості у метеорології для передбачення погоди. У ткацькому кондитерському виробництві для нормального перебігу процесу необхідна певна вологість. Зберігання творів мистецтва та книг потребує підтримання вологості повітря на необхідному рівні.
Прилади для визначення вологості:
1. Конденсаційний гігрометр (дозволяє визначити точку роси).
2. Волосний гігрометр (принцип дії заснований на залежності довжини знежиреного волосся від вологості) вимірює відносну вологість у відсотках.
3. Психрометр складається з двох термометрів сухого та зволоженого. Резервуар зволоженого термометра обмотаний тканиною, опущеною у воду. За рахунок випаровування тканини температура зволоженого нижче, ніж сухого. Різниця показань термометрів залежить від вологості навколишнього повітря: чим сухіше повітря, тим інтенсивніше випаровування з тканини, тим більша різниця показань термометрів і навпаки. Якщо вологість повітря 100%, показання термометрів однакові, тобто. різниця показань 0. Для визначення вологості з допомогою психрометра використовують психрометричну таблицю.
Плавлення та кристалізація
При плавленні твердого тілазбільшується відстань між частинками, що утворюють кристалічну решітку, і відбувається руйнування самої ґрат. На процес плавлення потрібно витрачати енергію. При нагріванні твердого тіла зростає кінетична енергія молекул, що коливаються, і відповідно амплітуда їх коливань. При певній температурі, яка називається температурою плавлення, порушується порядок розташування частинок в кристалах, кристали втрачають свою форму. Речовина плавиться, переходячи з твердого стану рідкий стан.
При кристалізаціївідбувається зближення молекул, що утворюють кристалічну решітку. Кристалізація може відбуватися лише тоді, коли рідина віддає енергію. При охолодженні розплавленої речовини середня кінетична енергія та швидкість молекул зменшуються. Сили тяжіння можуть утримувати частки близько положення рівноваги. При певній температурі, яка називається температурою затвердіння (кристалізації),всі молекули опиняються в положенні стійкої рівноваги, їхнє розташування стає впорядкованим - утворюється кристал.
Плавлення твердого тіла відбувається за тієї ж температури, при якій ця речовина твердне
Кожна речовина має температуру плавлення. Наприклад, температури плавлення у гелію -269,6С, у ртуті -38,9С, у міді 1083С.
Під час плавлення температура залишається постійною. Кількість теплоти, що підводиться ззовні, йде на руйнування кристалічної решітки.
Під час процесу затвердіння, незважаючи на те, що тепло відводиться, температура не змінюється. Енергія, що виділяється при кристалізації, витрачається на підтримку постійної температури.
Поки що вся речовина не розплавиться чи вся речовина не затвердіє, тобто. Поки існують разом тверда і рідка фази речовини, температура не змінюється.
Тв.+жид. жид.+тв.
,
де – кількість теплоти, ![]() - кількість теплоти, необхідне для розплавлення речовини, що виділяється при кристалізації речовини масою масою
- кількість теплоти, необхідне для розплавлення речовини, що виділяється при кристалізації речовини масою масою
- питома теплота плавлення– кількість теплоти, необхідне плавлення речовини масою 1кг за нормальної температури плавлення.
Яка кількість теплоти витрачається при плавленні певної маси речовини, така кількість теплоти виділяється при кристалізації цієї маси.
Називається також питомою теплотою кристалізації.
При температурі плавлення внутрішня енергія речовини рідкому станібільше внутрішньої енергії такої ж маси речовини у твердому стані.
У багатьох речовин обсяг при плавленні збільшується, а щільність зменшується. При затвердінні навпаки обсяг зменшується, а щільність збільшується. Наприклад, кристалики твердого нафталіну тонуть у рідкому нафталіні.
Деякі речовини, наприклад, вісмут, лід, галій, чавун та ін. При плавленні стискуються, а при затвердінні розширюються. Ці відхилення від загального правила пояснюються особливостями будови кристалічних ґрат. Тому вода виявляється щільніше льоду, лід плаває у воді. Розширення води під час замерзання веде до руйнації гірських порід.
Зміна обсягу металів при плавленні та затвердінні має важливе значення у ливарній справі.
Досвід показує, що зміна зовнішнього тиску на тверду речовину відбивається на температурі плавлення цієї речовини. Для тих речовин, які під час плавлення розширюються, збільшення зовнішнього тиску призводить до підвищення температури плавлення, т.к. ускладнює процес плавлення. Якщо ж речовини при плавленні стискуються, то їм збільшення зовнішнього тиску веде до зниження температури плавлення, т.к. допомагає процесу плавлення. Тільки дуже велике збільшення тиску помітно змінює температуру плавлення. Наприклад, щоб знизити температуру плавлення льоду на 1С, тиск потрібно підвищити на 130 атм. Температуру плавлення речовини за нормального атмосферного тиску називають точкою плавлення речовини.