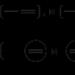Комплексні з'єднання. Їхня будова на основі координаційної теорії А. Вернера. Комплексний іон, його заряд. Катіонні, аніонні, нейтральні комплекси. Номенклатура, приклади.



Реакція заміщення лігандів. Константа нестійкості комплексного іона, константа стійкості.

 До нестійкості-це відношення творів концентрації іонів, що розпалися, на нерозпалу кількість.
До нестійкості-це відношення творів концентрації іонів, що розпалися, на нерозпалу кількість.
До уст = 1/ До нест (зворотна величина)
 Вторинна дисоціація -розпад внутрішньої сфери комплексу на складові її компоненти.
Вторинна дисоціація -розпад внутрішньої сфери комплексу на складові її компоненти.
43. Конкуренція за ліганд або за комплексоутворювач: ізольоване та поєднане рівноваги заміщення лігандів. Загальна константа суміщеної рівноваги заміщення лігандів.
В результаті конкуренції протон руйнує досить міцний комплекс, утворюючи слабко дисоціюючу речовину - воду.
Cl + NiS0 4 +4NH 3 ^ S0 4 +AgCl I
Це вже приклад конкуренції ліганду за комплексоутворювач, з утворенням більш міцного комплексу (K H + =9,3-1(Г 8 ; К Н [М(Ш 3) 6 ] 2+ = 1,9-Ю -9) та важкорозчинної сполуки AgCl - K s = 1,8 10" 10
Уявлення про будову металоферментів та інших біокомплексних сполук (гемоглобін, цитохроми, кобаламіни). Фізико-хімічні принципи транспортування кисню гемоглобіном



Кобаламіни. Вітаміни B 12називають групу кобальтовмісних біологічно активних речовин, званих кобаламінами. До них відносять власне ціанокобаламін, гідроксикобаламін та дві коферментні форми вітаміну B 12: метилкобаламін та 5-дезоксиаденозилкобаламін
Іноді у вужчому сенсі вітаміном B 12 називають ціанокобаламін, так як саме в цій формі в організм людини надходить основна кількість вітаміну B 12 , не зважаючи на те, що він не синонім з B 12 , і кілька інших сполук також мають B 12 - вітамінної активністю. Вітамін B12 також називається зовнішнім фактором Касла.
B 12 має найскладнішу порівняно з іншими вітамінами хімічну структуру, основою якої є корінове кільце. Коррін багато в чому схожий на порфірин (складна хімічна структура, що входить до складу гему, хлорофілу і цитохромів), але відрізняється від порфірину тим, що два піррольні цикли у складі корину з'єднані між собою безпосередньо, а не метиленовим містком. У центрі корінової структури розташований іон кобальту. Чотири координаційні зв'язки кобальт утворює з атомами азоту. Ще один координаційний зв'язок з'єднує кобальт з диметилбензімідазольним нуклеотидом. Останній, шостий координаційний зв'язок кобальту залишається вільним: саме з цього зв'язку і приєднується ціаногрупа, гідроксильна група, метильний або 5"-дезоксиаденозильний залишок з утворенням чотирьох варіантів вітаміну B 12 , відповідно. Ковалентний зв'язок Приклад приклад ковалентного зв'язку перехідний метал-вуглець.
Ліганди – іони або молекули, які безпосередньо пов'язані з комплексоутворювачем та є донорами електронних пар. Ці електронадлишкові системи, що мають вільні та рухливі електронні пари, можуть бути донорами електронів, наприклад: Сполуки р-елементів виявляють комплексоутворюючі властивості та виступають у комплексному поєднанні як ліганди. Лігандами можуть бути атоми та молекули
(білка, амінокислот, нуклеїнових кислот, вуглеводів). Ефективність і міцність донорно-акцкпторної взаємодії ліганду та комплексоутворювача визначається їх поляризованістю-здатністю частки трансформувати свої електронні оболонки під зовнішнім впливом.
Константа нестійкості:
Кнест = 2 /
До уст=1/Кнест
Реакції заміщення лігандів
Одна з найважливіших стадій у металокомплексному каталізі – взаємодія субстрату Y з комплексом – відбувається за трьома механізмами:
а) Заміщення ліганду розчинником. Зазвичай таку стадію зображають як дисоціацію комплексу
Суть процесу в більшості випадків - заміщення ліганду L розчинником S, який далі легко замінюється молекулою субстрату
б) Приєднання нового ліганду за вільною координатою з утворенням асоціату з подальшою дисоціацією заміщуваного ліганду
в) Синхронне заміщення (типу S N 2) без утворення інтермедіату
Уявлення про будову металоферментів та інших біокомплексних сполук (гемоглобін, цитохроми, кобаламіни). Фізико-хімічні принципи транспортування кисню гемоглобіном.
Особливості будови металоферментів.
Біокомплексні сполуки значно різняться за стійкістю. Роль металу в таких комплексах є високоспецифічною: заміна його навіть на близький за властивостями елемент призводить до значної або повної втрати фізіологічної активності.
1. В12: містить 4 піррольні кільця, іон кобальту та групи CN-. Сприяє перенесення атома H на атом С в обмін на якусь групу, бере участь у процесі утворення дезоксирибози з рибози.
2. гемоглобін: має четвертинну структуру. Чотири поліпептидні ланцюги, з'єднані разом, утворюють майже правильну формукулі, де кожен ланцюг контактує з двома ланцюгами.
Гемоглобін- дихальний пігмент, що надає крові червоного кольору. Гемоглобін складається з білка та залізопорфірину і переносить кисень від органів дихання до тканин тіла та вуглекислий газ від них до дихальним органам.
Цитохроми- складні білки (гемопротеїди), що здійснюють у живих клітинах ступінчасте перенесення електронів та/або водню від окислюваних органічних речовин до молекулярного кисню. При цьому утворюється багате на енергію з'єднання АТФ.
Кобаламіни- природні біологічно активні кобальторганічні сполуки. Структурною основою К. є коринове кільце, що складається з 4 піррольних ядер, у яких атоми азоту пов'язані з центральним атомом кобальту.
Фізико-хімічні принципи транспортування кисню гемоглобіном- Атом (Fe(II)) (один із компонентів гемоглобіну) здатний утворювати 6 координаційних зв'язків. З них чотири використовуються для закріплення самого атома Fe(II) у гемі, п'ятий зв'язок - для зв'язування гему з білковою субодиницею, а за допомогою шостого зв'язку відбувається зв'язування молекули 2 або 2.
Метало-лігандний гомеостаз та причини його порушення. Механізм токсичної дії важких металів та миш'яку на основі теорії жорстких та м'яких кислот та основ (ЖМКО). Термодинамічні засади хелатотерапії. Механізм цитотоксичної дії сполук платини.
В організмі безперервно відбувається утворення та руйнування біокомплексів з катіонів металів та біолігандів (порфінів, амінокислот, білків, полінуклеотидів), до складу яких входять донорні атоми кисню, азоту, сірки. Обмін з довкіллямпідтримує концентрації цих речовин на постійному рівні, забезпечуючи метало- лігандний гомеостаз. Порушення рівноваги, що склалася, веде до ряду патологічних явищ – металлоизбыточным і металлодефицитным станам. Як приклад можна навести неповний перелік захворювань, пов'язаних із зміною метало-лігандного балансу лише одного іона – катіону міді. Дефіцит цього елемента в організмі викликає синдром Менкеса, синдром Морфана, хвороба Вільсона-Коновалова, цироз печінки, емфізему легень, аорто- та артеріопатії, анемії. Надмірне надходження катіону може вести до серії захворювань різних органів: ревматизму, бронхіальної астми, запалення нирок і печінки, інфаркту міокарда і т.д., званих гіперкупреміями. Відомий і професійний гіперкупреоз – мідна гарячка.
Циркуляція важких металів відбувається частково як іонів чи комплексів з амінокислотами, жирними кислотами. Проте провідна роль транспорті важких металів належить білкам, які утворюють із нею міцний зв'язок.
Вони фіксуються на клітинних оболонках, блокують тіолові групи мембранних протеїнів.- 50% з них білки-ферменти, порушують стабільність білково-ліпідних комплексів клітинної оболонки та її проникність, викликаючи вихід із клітини калію та проникнення в неї натрію та води.
Подібна дія цих отрут, що активно фіксуються на червоних кров'яних клітинах, призводить до порушення цілісності мембран еритроцитів, гальмування в них процесів аеробного гліколізу та метаболізму взагалі та накопичення гемолітично активного перекису водню внаслідок гальмування пероксидази зокрема, що призводить до розвитку одного з характерів. цієї групи – до гемолізу.
Розподіл та депонування важких металів та миш'яку відбуваються практично у всіх органах. Особливий інтерес представляє здатність цих речовин накопичуватися у нирках, що пояснюється багатим вмістом у нирковій тканині тіолових груп, наявністю в ній білка – металобіоніну, що містить велика кількістьтіолових груп, що сприяє тривалому депонуванню отрут. Високим ступенем накопичення токсичних сполук цієї групи відрізняється і тканина печінки, також багата на тіолові групи і містить металобіонін. Термін депонування, наприклад, ртуті може досягати 2 місяців і більше.
Виділення важких металів і миш'яку відбувається в різних пропорціях через нирки, печінку (з жовчю), слизову оболонку шлунка і кишечника (з калом), потові та слинні залози, легені, що супроводжується, як правило, ураженням апаратів виділення цих органів і проявляється відповідною клінічною. симптоматикою.
Смертельна доза розчинних сполук ртуті 0,5 г, для каломелі 1-2 г, для мідного купоросу 10 г, для ацетату свинцю 50 г, для свинцевих білил 20 г, для миш'яку 0,1-0,2 г.
Токсичною вважається концентрація ртуті у крові понад 10 мкг/л (1γ%), у сечі понад 100 мкг/л (10γ%), концентрація міді у крові понад 1600 мкг/л (160γ%), миш'яку понад 250 мкг/л (25γ %) у сечі.
Хелатотерапія – це виведення токсичних частинок
з організму, заснований на хелатуванні їх
комплексонатами s-елементів.
Препарати, що застосовуються для виведення
інкорпорованих в організмі токсичних
частинок називають детоксикантами.
Реакції координаційних з'єднань завжди відбуваються у координаційній сфері металу із пов'язаними у ній лігандами. Тому очевидно, що для того, щоби взагалі щось відбувалося, ліганди повинні вміти в цю сферу потрапляти. Це може відбуватися двома способами:
- координаційно-ненасичений комплекс пов'язує новий ліганд
- у вже укомплектованій координаційній сфері один ліганд змінюється іншим.
З першим способом ми вже ознайомилися, коли обговорювали координаційну ненасиченість та 18-електронне правило. Другим займемося тут.
Заміщатися можуть у будь-яких комбінаціях ліганди будь-яких типів
Але зазвичай діє негласне правило – кількість зайнятих координаційних місць не змінюється. Іншими словами, під час заміщення не змінюється рахунок електронів. Заміщення ліганду одного типу на інший цілком можливе і часто відбувається насправді. Звернемо лише увагу на коректне поводження із зарядами, коли змінюється L-ліганд на X-ліганд і навпаки. Якщо ми про це забудемо, то зміниться ступінь окислення металу, а заміщення лігандів не є окисно-відновним процесом (якщо знайдете або придумаєте неприємний приклад, дайте знати – залік автоматично відразу, якщо я не зможу довести, що ви помилилися, навіщо навіть і в цьому випадку гарантую позитивний внесок у карму).
Заміщення за участю гапто-лігандів
З більш складними лігандами складнощів не більше – потрібно просто пам'ятати досить очевидне правило: кількість лігандних місць (тобто загальна кількість лігандів чи лігандних центрів X- або L-типів) зберігається. Це безпосередньо випливає із збереження рахунку електронів. Ось очевидні приклади.
Звернімо увагу на останній приклад. Вихідний реагент цієї реакції дихлорид заліза FeCl 2 . Ще недавно ми сказали б: “Це просто сіль, причому тут координаційна хімія?”. Але ми не будемо собі дозволяти таке невігластво. У хімії перехідних металів не буває "просто солей", будь-які похідні суть координаційні з'єднання, до яких застосовні всі міркування щодо електронів, d-конфігурацію, координаційну насиченість і т.п. Дихлорид заліза, тому що ми його звикли писати, виявився б комплексом Fe(2+) типу MX 2 зі зміною d 6 і числом електронів 10. Замало щось! Нормально? Ми вже розібралися, що ліганди бувають неявні. Щоб зробити реакцію, нам потрібен розчинник, і для таких реакцій це швидше за все ТГФ. Розчинення кристалічної солі заліза в ТГФ відбувається саме тому, що донорний розчинник займає вільні місця, і енергія цього процесу компенсує руйнування кристалічної решітки. Ми не змогли б розчинити цю "сіль" у розчиннику, який не надає послуг сольватації металу за рахунок основності Льюїса. В даному випадку, і в мільйоні подібних, сольватація – це просто координаційна взаємодія. Напишемо, просто для визначеності результат сольватації у вигляді комплексу FeX 2 L 4 , у якого два іони хлору залишаються в координаційній сфері у вигляді двох X-лігандів, хоча швидше за все вони теж витіснені молекулами донорного розчинника утворенням зарядженого комплексу FeL 6 2+. У цьому випадку це не так важливо. І так, і так ми можемо спокійно вважати, що у нас 18-електронний комплекс і ліворуч, і праворуч.
Заміщення, приєднання та дисоціація лігандів тісно та нерозривно пов'язані
Якщо ми пам'ятаємо органічну хімію, там було два механізми заміщення при насиченому атомі вуглецю – SN1 і SN2. У першому заміщення відбувалося двостадійно: старий заступник спочатку йшов, залишаючи вакантну орбіталь на атомі вуглецю, яку слідом заходив новий заступник із парою електронів. Другий механізм припускав, що догляд та прихід здійснюються одночасно, узгоджено, а процес був одностадійним.
У хімії координаційних з'єднань можна уявити щось схоже. Але з'являється і третя можливість, якої не було насиченого атома вуглецю – спочатку приєднуємо новий ліганд, потім відчіплюємо старий. Відразу стає зрозуміло, що цей третій варіант навряд чи можливий, якщо комплекс має 18 електронів і є координаційно насиченим. Але цілком можливий, якщо число елетронів 16 чи менше, тобто комплекс ненасичений. Тут же згадаємо і очевидну аналогію з органічної хімії- нуклеофільне заміщення у ненасиченого атома вуглецю (в ароматичному кільці або у карбонільного вуглецю) теж йдуть спочатку як приєднання нового нуклеофіла, а потім відщеплення старого.
Отже, якщо у нас 18 електронів, то заміщення йде як відщеплення-приєднання (любителі "розумних" слів використовують термін дисоціативно-асоціативний або просто дисоціативний механізм). Інший шлях зажадав би розширення координаційної сфери до рахунку 20 електронів. Це не є абсолютно неможливим, і такі варіанти іноді навіть розглядаються, але це точно дуже невигідно і щоразу у разі підозри на такий шлях потрібні дуже вагомі докази. У більшості таких історій дослідники зрештою приходили до висновку, що вони щось переглянули чи не врахували, і асоціативний механізм відкидався. Отже, якщо вихідний комплекс з 18 електронами, спочатку один ліганд повинен піти, потім на його місце прийти новий, наприклад:

Якщо ми хочемо ввести в координаційну сферу гапто-ліганд, який займає кілька місць, то спочатку ми маємо їх все звільнити. Як правило, це відбувається тільки в досить жорстких умовах, наприклад, щоб в карбонілі хрому замінити три карбонілу на 6 -бензол, суміш багато годин нагрівають під тиском, час від часу стравлюючи оксид вуглецю, що вивільнився. Хоча у схемі намальована дисоціація трьох лігандів з утворенням дуже ненасиченого комплексу з 12 електронами, насправді реакція, швидше за все, відбувається стадійно, йде по одному карбонілу, а бензол заходить у сферу, поступово збільшуючи гаптність, через стадії мінус CO – дигапто – мінус ще одна CO – тетрагапто – мінус ще одна CO – гексагапто, щоб менше 16 електронів не виходило.

Отже, якщо у нас комплекс із 16 електронами або менше, то заміщення ліганду, швидше за все, йде як приєднання-відщеплення (для любителів глибокодумних слів: асоціативно-дисоціативний чи просто асоціативний): новий ліганд спочатку приходить, потім старий іде. Напрошуються два очевидні питання: чому йде старий ліганд, адже 18 електронів це дуже добре, і чому б і в цьому випадку не зробити навпаки, як у 18-електронних комплексах. На перше запитання відповісти легко: у кожного металу свої звички, і деякі метали, особливо з пізніх, з майже повністю заповненими d-оболонками, віддають перевагу 16-електронному рахунку та відповідним структурним типам, тому й викидають зайвий ліганд, повертаючись до улюбленої конфігурації. Іноді в справу ще втручається просторовий фактор, вже наявні ліганди великі і додатковий почувається, як пасажир автобуса в годину пік. Простіше зійти і прогулятися пішки, ніж так мучитися. Втім, можна випхати іншого пасажира, хай погуляє, а ми поїдемо. Друге питання теж просте – у цьому випадку дисоціативний механізм мав би спочатку дати 14-електронний комплекс, а це рідко буває вигідно.
Ось приклад. Для різноманітності замінимо X-ліганд на L-ліганд, і не заплутаємось у ступенях окиснення та зарядах. Ще раз: при заміщенні рівень окислення не змінюється, і якщо пішов X-ліганд, то втрату потрібно компенсувати зарядом на металі. Якщо про це забути, то рівень окислення зменшилася б на 1, а це не так.

І ще одна дивина. Утворився зв'язок метал-піридин за рахунок неподіленої пари на азоті. В органічній хімії в цьому випадку ми обов'язково показали б плюс на азоті піридину (наприклад, при протонуванні або утворенні четвертинної солі), але ми ніколи не робимо це в координаційній хімії ні з піридином, ні з будь-якими іншими L-лігандами. Це страшно дратує всіх, хто звик до суворої та недвозначної системи малювання структур в органічній хімії, але доведеться звикати, це не так складно.
А точного аналога SN2 у хімії координаційних з'єднань немає, є далекий, але він рідкісний і нам не дуже потрібен.
Стабільні та лабільні ліганди
Про механізми заміщення лігандів можна було б взагалі не говорити, якби не одна надзвичайно важлива обставина, якою ми дуже користуватимемося: заміщення лігандів, хоч асоціативне, хоч дисоціативне обов'язково передбачає дисоціацію старого ліганду. І нам дуже важливо знати, які ліганди легко йдуть, а які йдуть погано, воліючи залишатися в координаційній сфері металу.
Як скоро побачимо, у будь-якій реакції частина лігандів залишається у координаційної сфері і змінюється. Такі ліганди прийнято називати лігандами-глядачами (якщо не хочете таких простих, ненаукових слів, використовуйте англійське слово spectator у місцевій транскрипції спектатор, ліганд-спектатор, тільки, благаю, не спектейтор – це нестерпно!). А частина безпосередньо бере участь у реакції, перетворюючись на продукти реакції. Такі ліганди називають акторами (не акторами!), тобто діючими. Цілком зрозуміло, що ліганди-актори потрібно в координаційну сферу металу легко вводити та виводити, інакше реакція просто застрягне. А ось ліганди-спектатори краще в координаційній сфері залишати з багатьох причин, але хоча б і за такою банальною, як необхідність уникнути зайвої метушні навколо металу. Краще, щоб лише ліганди актори та у необхідних кількостях могли брати участь у потрібному процесі. Якщо доступних координаційних місць буде більше, ніж необхідно, на них можуть сісти зайві ліганди-актори, і навіть такі, які братимуть участь у побічних реакціях, знижуючи вихід цільового продукту та селективність. Ліганди-спектатори також майже завжди здійснюють безліч важливих функцій, наприклад, забезпечують розчинність комплексів, стабілізують правильний валентний стан металу, особливо якщо воно не зовсім звичайне, допомагають окремим стадіям, забезпечують стереоселективність, і т.п. Поки що не розшифровуємо, тому що все це ми обговорюватимемо докладно, коли доберемося до конкретних реакцій.
Виходить, що частина лігандів у координаційній сфері має бути міцно пов'язаною та не схильною до дисоціації та заміщення іншими лігандами. Такі ліганди прийнято називати координаційно стабільними . Або просто стабільними, якщо з контексту ясно, що йдеться про міцність зв'язку лігандів, а не про їхню власну термодинамічну стабільність, яка якраз нас абсолютно не хвилює.
А ліганди, які легко і охоче входять і виходять, і завжди готові поступитися місцем іншим, називають координаційно лабільними , або просто лабільними, і тут, на щастя, жодних двозначностей немає.
Циклобутадієн як ліганд
Ось, напевно, найяскравіший приклад того, що в координаційній сфері дуже нестабільна молекула може стати відмінним лігандом, причому за визначенням координаційно стабільним, хоча б тому, що якщо вона ризикне вийти з теплої та затишної сфери назовні, нічого хорошого на неї не чекає (ціною виходу буде якраз енергія антиароматичної дестабілізації).
Циклобутадієн та його похідні – найвідоміші приклади антиароматичності. Ці молекули існують тільки при низьких температурах, і в сильно спотвореному вигляді, - щоб піти якнайдалі від антиароматичності, цикл спотворюється у витягнутий прямокутник, знімаючи ділокалізацію і максимально послаблюючи пару подвійних зв'язків (інакше це називається ефектом Яна-Теллера 2 роду: вироджена система, а циклобутадієн-квадрат є виродженим бірадикалом, згадайте коло Фроста, – спотворюється і знижує симетрію, щоб зняти виродження).
Але в комплексах циклобутадієн та заміщені циклобутадієни – відмінні тетрагапто-ліганди, та геометрія таких лігандів – саме квадрат, з однаковими довжинами зв'язків. Як і чому це відбувається – окрема історія, і далеко не така очевидна, якою її часто подають.
Координаційно-лабільні ліганди
Потрібно розуміти, що залізобетонного паркану з колючим дротом та вежами охорони між областями лабільних та стабільних лігандів немає. По-перше, це залежить від металу, і в цьому контексті непогано працює ЖМКО. Наприклад, пізні перехідні метали віддають перевагу м'яким лігандам, а ранні - жорсткі. Скажімо, іодид дуже міцно тримається за d 8 атоми паладію або платини, але рідко взагалі входять до координаційної сфери титану або цирконію в конфігурації d 0 . Але в багатьох комплексах металів з не настільки яскраво вираженими ознаками, іодид виявляє себе як цілком лабільний ліганд, який легко поступається місцем іншим.
За інших рівних умов:
- L-ліганди зазвичай лабільніше X-лігандів;
- лабільність X-лігандів визначається жорсткістю/м'якістю та природою металу;
- дуже лабільні “неявні” ліганди: розчинники та містки у димерах та кластерах, настільки, що їх присутністю у координаційній сфері часто взагалі нехтують та малюють структури без них з формально ненасиченою координаційною сферою;
- дигапто-ліганди, наприклад, алкени та алкіни, поводяться як типові L-ліганди: вони зазвичай цілком лабільні;
- ліганди з більшою гаптністю рідко бувають лабільні, але якщо полігапто-ліганд може змінювати спосіб зв'язку на моно-гапто, він стає лабільнішим, так поводяться, наприклад, η 3 -аліли;
- хелатні ліганди, що утворюють 5 і 6-членні хелатні цикли стабільні, а хелати з меншим або більшим числом атомів циклу лабільні, принаймні по одному центру (хелатний цикл розкривається і ліганд залишається висіти як простий). Так поводиться, наприклад, ацетат;
Координаційно стабільні ліганди
Повторимо все ще раз, тільки з іншого боку
У координаційній сфері металів зберігаються (є координаційно стабільними) як правило:
- 5-ти та 6-члені хелатори;
- полігапто-ліганди: щоб вибити з координаційної сфери циклопентадіеніли або бензол (арени) доводиться застосовувати будь-які спеціальні прийоми - просто так вони не виходять, часто витримуючи навіть тривале нагрівання;
- ліганди, пов'язані з металом з високою часткою π-донорного ефекту (back-donation);
- м'які ліганди у пізніх перехідних металах;
- "Останній" ліганд у координаційній сфері.
Остання умова виглядає дивно, але уявіть собі комплекс, який має багато різних лігандів, серед яких немає безумовно стабільних (немає хелаторів та полігапто-лігандів). Тоді у реакціях ліганди змінюватимуться, умовно кажучи, у порядку відносної лабільності. Найменш лабільний і залишиться останнім. Такий фокус має місце, наприклад, коли ми використовуємо фосфінові комплекси паладію. Фосфіни – відносно стабільні ліганди, але коли їх багато, а метал багатий електронами (d 8 , d 10), вони поступаються, один за одним, місцем лігандам-акторам. Але останній фосфіновий ліганд зазвичай залишається у координаційній сфері, і це дуже добре з погляду тих реакцій, у яких ці комплекси беруть участь. Ми ще повернемося до цієї важливої проблеми. Ось типовий приклад, коли від вихідної координаційної сфери фосфінового комплексу паладію в реакції Хека залишається лише один, “останній” фосфін. Цей приклад дуже близько підводить нас до найважливішої концепції реакціях комплексів перехідних металів – концепції контролюючого ліганду (ligand control). Обговоримо пізніше.

Переметування
При заміщенні одних лігандів на інші важливо не переборщити з реакційною здатністю ліганду, що входить. Коли ми маємо справу з реакціями органічних молекул, нам важливо доставити в координаційну сферу по одній молекулі кожного з реагентів. Якщо замість однієї увійде дві молекули, то висока ймовірність побічних реакцій за участю двох однакових лігандів. Можлива також і втрата реакційної здатності через насичення координаційної сфери та неможливості введення в неї інших необхідних для очікуваного процесу лігандів. особливо часто ця проблема виникає при введенні до координаційної сфери сильних аніонних нуклеофілів, наприклад, карбаніонів. Щоб уникнути цього, використовують менш реакційні похідні, в яких, замість катіону лужного металу, що обумовлює високу іонність зв'язку, використовують менш електропозитивні метали та металоїди (цинк, олово, бор, кремній, тощо), що утворюють ковалентні зв'язкиз нуклеофільною частиною. Реакції таких похідних з похідними перехідних металів дають продукти заміщення лігандів, в принципі, так само як би нуклеофіл був в аніонній формі, але через знижену нуклеофільність з меншими ускладненнями і без побічних реакцій.
Такі реакції заміщення лігандів прийнято називати переметалювання (transmetallation), щоб підкреслити те очевидне обсоятельство, що нуклеофіл нібито змінює метали - більш електропозитивний на менш електропозитивний. У цій назві, таким чином, закладено елемент малоприємної шизофренії – ми начебто вже домовилися, що на всі реакції дивитися з погляду перехідного металу, але раптом знову зірвалися і дивимося на цю реакцію і тільки на цю реакцію з точки зору нуклеофіла. Доведеться потерпіти, так склалася термінологія і так заведено. Насправді це слово походить від ранньої хімії металоорганічних сполук і до того, що дія літій або магнійорганічних сполук на галогеніди різних металів і металоїдів – один з основних методів синтезу будь-якої металоорганіки, насамперед неперехідної, і реакція, яку ми зараз розглядаємо в хімії координаційних з'єднань перехідних металів – просто узагальнення старовинного методу металоорганічної хімії, з якого вона вся виросла.

Як відбувається переметалювання?
Переметалювання і схоже на звичайне заміщення, і не схоже. Схоже – якщо ми вважаємо неперехідний металоорганічний реагент просто карбаніоном з протиіоном, тобто зв'язок вуглець-неперехідний метал іонний. Але це уявлення схоже на правду тільки для електропозитивних металів – для магнію. Але вже для цинку та олова це уявлення дуже далеке від істини.
Тому в реакцію вступають два σ-зв'язку та чотири атоми на їх кінцях. В результаті утворюються два нових σ-зв'язку і чотири атоми зв'язуються один з одним в іншому порядку. Швидше за все, все це відбувається одночасно в чотиричленному перехідному стані, і сама реакція має узгоджений характер, як і багато інших реакцій перехідних металів. Велика кількість електронів і орбіталей буквально на всі смаки і всі види симетрій робить перехідні метали здатними одночасно підтримувати зв'язки в перехідних станах з кількома атомами.
У разі переметалірванія отримуємо окремий випадок дуже загального процесу, який називається просто метатезою σ-зв'язків (σ-bond metathesis). Не плутайте тільки зі справжніми метатезами олефінів та ацетиленів, які є повноцінними каталітичними реакціями зі своїми механізмами. У разі йдеться про механізм переметалирования чи іншого процесу, у якому відбувається щось подібне.

Введення в роботу
Актуальність роботи. Комплекси порфіринів з металами високих ступеняхокислення можуть координувати основи набагато ефективніше, ніж комплекси М 2+ і утворювати змішані координаційні сполуки, які у першій координаційної сфері центрального атома металу поруч із макроциклическим лігандом перебувають нециклічні ацидоліганди, котрий іноді координовані молекули. Питання сумісності лігандів у таких комплексах надзвичайно важливі, оскільки у вигляді змішаних комплексів порфірини здійснюють свої біологічні функції. Крім того, реакції оборотного приєднання (перенесення) молекул основ, що характеризуються помірно високими константами рівноваги, можуть успішно застосовуватися для поділу сумішей органічних ізомерів, для кількісного аналізу, для цілей екології та медицини. Тому дослідження кількісних характеристик та стехіометрії рівноваг додаткової координації на металопорфіринах (МР) та заміщення простих лігандів у них корисно не лише з погляду теоретичних знань властивостей металопорфіринів як з'єднань комплексних, але й для вирішення практичного завдання пошуку рецепторів та переносників малих молекул або іонів. До цього часу систематичних досліджень для комплексів високозарядних іонів металів практично відсутні.
Мета роботи. Дана робота присвячена вивченню реакцій змішаних порфірин-містять комплексів високозарядних катіонів металів Zr IV, Hf IV, Mo V і W V з біоактивними N-підставами: імідазолом (Im), піридином (Py), піразином (Pyz), бензімідазолом (Bz стійкості та оптичних властивостей молекулярних комплексів, обґрунтування ступінчастих механізмів реакцій.
Наукова новизна. Методами модифікованого спектрофотометричного титрування, хімічної кінетики, електронної та коливальної абсорбційної та 1 Н ЯМР спектроскопіївперше отримано термодинамічні характеристики та обґрунтовано стехіометричні механізми реакцій N-підстав з металопорфіринами зі змішаною координаційною сферою (Х) n-2 МТРР (Х – ацидоліганд Cl-, OH-, O2-, ТРР-діаніон тетрафенілпорфірину). Встановлено, що у переважній більшості випадків процеси утворення супрамолекул металопорфірин – основа протікають східчасто та включає кілька оборотних та повільних необоротних елементарних реакцій координації молекул основ та заміщення ацидолігандів. Для кожної зі стадій ступінчастих реакцій визначені стехіометрія, константи рівноваг або швидкості, порядки повільних реакцій на основі, спектрально охарактеризовані продукти (УФ, видимі спектри для проміжних продуктів та УФ, видимих та ІЧ – для кінцевих). Вперше отримано кореляційні рівняння, що дозволяють прогнозувати стійкість супрамолекулярних комплексів з іншими основами. Рівняння використані у роботі для обговорення детального механізму заміщення ВІН - у комплексах Mo та W на молекулу основи. Описано властивості МР, що зумовлюють перспективу використання для детектування, поділу та кількісного аналізу біологічно активних основ, такі як помірно висока стійкість супрамолекулярних комплексів, чіткий та швидкий оптичний відгук, низький поріг чутливості, секундний час обігу.
Практична значущість роботи. Кількісні результати та обґрунтування стехіометричних механізмів реакцій молекулярного комплексоутворення мають важливе значення для координаційної хімії макрогетероциклічних лігандів. У дисертаційній роботі показано, що змішані порфірин-місткі комплекси виявляють високу чутливість і селективність щодо біоактивних органічних основ, протягом декількох секунд або хвилин дають оптичний відгук, придатний для практичного детектування реакцій з основами - VOCs, компонентами ліків та харчових продуктів, завдяки чому рекомендовані для використання як компоненти сенсорів основ в екології, харчовій промисловості, медицині та сільському господарстві.
Апробація роботи. Результати роботи доповідалися та обговорювалися на:
IX Міжнародній конференції з проблем сольватації та комплексоутворення у розчинах, Плес, 2004; XII Симпозіумі з міжмолекулярної взаємодії та конформацій молекул, Пущино, 2004; XXV, XXVI та XXIX наукових сесіях Російського семінару з хімії порфіринів та їх аналогів, Іваново, 2004 та 2006; VI Школі-конференції молодих вчених країн СНД з хімії порфіринів та споріднених сполук, Санкт-Петербург, 2005; VIII науковій школі- конференції з органічної хімії, Казань, 2005; Всеросійської наукової конференції «Природні макроциклічні сполуки та їх синтетичні аналоги», Сиктивкар, 2007; XVI Міжнародної конференції з хімічної термодинаміки у Росії, Суздаль, 2007; XXIII Міжнародній Чугаївській конференції з координаційної хімії, Одеса, 2007; International Conference on Porphyrins and Phtalocyanines ISPP-5, 2008; 38th International Conference on Coordination Chemistry, Israel, 2008.
Глава 17. Комплексні з'єднання
17.1. Основні визначення
У цьому розділі ви познайомитеся з особливою групою складних речовин, які називаються комплексними(або координаційними) з'єднаннями.
В даний час строгого визначення поняття комплексна часткані. Зазвичай використовується таке визначення.
Наприклад, гідратований іон міді 2 - комплексна частка, так як вона реально існує в розчинах і деяких кристалогідратах, утворена з іонів Cu 2 і молекул H 2 O, молекули води - реально існуючі молекули, а іони Cu 2 існують в кристалах багатьох сполук міді. Навпаки, іон SO 4 2 не є комплексною частинкою, так як хоч іони O 2 в кристалах зустрічаються, іон S 6 в хімічних системахне існує.
Приклади інших комплексних частинок: 2, 3, 2, 2 .
Разом з тим до комплексних частинок відносять іони NH 4 і H 3 O хоча іони H в хімічних системах не існують.
Іноді комплексними частинками називають складні хімічні частинки, усі або частина зв'язків у яких утворені за донорно-акцепторним механізмом. У більшості комплексних частинок так і є, але, наприклад, в алюмокалієвих галун SO 4 в комплексній частинці 3 зв'язок між атомами Al і O дійсно утворена по донорно-акцепторного механізму, а в комплексній частинці є лише електростатична (іон-дипольна) взаємодія. Підтвердженням цього є існування в залізоамонійних галунах аналогічної за будовою комплексної частинки , в якій між молекулами води та іоном NH 4 можлива тільки іон-дипольна взаємодія.
По заряду комплексні частинки може бути катіонами, аніонами, і навіть нейтральними молекулами. Комплексні сполуки, що включають такі частинки, можуть належати до різних класів хімічних речовин (кислот, основ, солей). Приклади: (H 3 O) – кислота, OH – основа, NH 4 Cl та K 3 – солі.
Зазвичай комплексоутворювач – атом елемента, що утворює метал, але може бути і атом кисню, азоту, сірки, йоду та інших елементів, які утворюють неметали. Ступінь окислення комплексоутворювача може бути позитивним, негативним або рівною нулю; при утворенні комплексного з'єднання з найпростіших речовин вона змінюється.
Лігандами можуть бути частинки, до утворення комплексного з'єднання молекули (H 2 O, CO, NH 3 та ін), аніони (OH , Cl , PO 4 3 та ін), а також катіон водню. Розрізняють унідентатніабо монодентатні ліганди (пов'язані з центральним атомом через один зі своїх атомів, тобто одним -зв'язком), бідентатні(пов'язані з центральним атомом через два своїх атоми, тобто двома зв'язками), трідентатніі т.д.
Якщо ліганди унідентатні, то координаційне число дорівнює кількості таких лігандів.
КЧ залежить від електронної будови центрального атома, від його ступеня окиснення, розмірів центрального атома та лігандів, умов утворення комплексної сполуки, температури та інших факторів. КЧ може приймати значення від 2 до 12. Найчастіше воно дорівнює шести, дещо рідше – чотирьом.
Існують комплексні частинки та з декількома центральними атомами.
Використовуються два види структурних формул комплексних частинок: із зазначенням формального заряду центрального атома та лігандів, або із зазначенням формального заряду всієї комплексної частинки. Приклади:

Для характеристики форми комплексної частки використовується уявлення про координаційний поліедр (багатогранник).

До координаційних поліедр відносять також квадрат (КЧ = 4), трикутник (КЧ = 3) і гантель (КЧ = 2), хоча ці фігури і не є багатогранниками. Приклади координаційних поліедрів і відповідних форм комплексних частинок для найбільш поширених значень КЧ наведено на рис. 1.
17.2. Класифікація комплексних з'єднань
Як хімічні речовиникомплексні сполуки поділяються на іонні (їх іноді називають іоногенними) та молекулярні ( неіоногенні) з'єднання. Іонні комплексні сполуки містять заряджені комплексні частинки – іони – є кислотами, основами чи солями (див. § 1). Молекулярні комплексні сполуки складаються з незаряджених комплексних частинок (молекул), наприклад: або віднесення їх до якого-небудь основного класу хімічних речовин важко.
Комплексні частинки, що входять до складу комплексних сполук, досить різноманітні. Тому для їхньої класифікації використовується кілька класифікаційних ознак: число центральних атомів, тип ліганду, координаційне число та інші.
За кількістю центральних атомівкомплексні частинки поділяються на одноядерніі багатоядерні. Центральні атоми багатоядерних комплексних частинок можуть бути пов'язані між собою або безпосередньо або через ліганди. І в тому, і в іншому випадку центральні атоми з лігандами утворюють єдину внутрішню сферу комплексної сполуки:


За типом лігандів комплексні частки поділяються на
1) Аквакомплекси, тобто комплексні частинки, в яких як ліганди присутні молекули води. Більш менш стійкі катіонні аквакомплекси m, аніонні аквакомплекси нестійкі. Всі кристалогідрати відносяться до сполук, що містять аквакомплекси, наприклад:
Mg(ClO 4) 2 . 6H 2 O насправді (ClO 4) 2;
BeSO 4 . 4H 2 O насправді SO 4;
Zn(BrO 3) 2 . 6H 2 O насправді (BrO 3) 2;
CuSO 4 . 5H 2 O насправді SO 4 . H2O.
2) Гідроксокомплекси, тобто комплексні частинки, в яких як ліганди присутні гідроксильні групи, які до входження до складу комплексної частинки були гідроксид-іонами, наприклад: 2 , 3 , .
Гідроксокомплекси утворюються з аквакомплексів, що виявляють властивості катіонних кислот:
2 + 4OH = 2 + 4H 2 O
3) Аміакати, тобто комплексні частинки, в яких як ліганди присутні групи NH 3 (до утворення комплексної частинки - молекули аміаку), наприклад: 2 , 3 .
Аміакати також можуть бути одержані з аквакомплексів, наприклад:
2 + 4NH 3 = 2 + 4 H 2 O
Забарвлення розчину в цьому випадку змінюється з блакитного до ультрамаринового.
4) Ацидокомплекси, тобто комплексні частинки, в яких як ліганди присутні кислотні залишки як безкисневих, так і кисневмісних кислот (до утворення комплексної частки - аніони, наприклад: Cl , Br , I , CN , S 2 , NO 2 , S 2 O 3 2 , CO 3 2 , C 2 O 4 2 тощо).
Приклади утворення ацидокомплексів:
Hg 2 + 4I = 2
AgBr + 2S 2 O 3 2 = 3 + Br
Остання реакція використовується у фотографії для видалення з фотоматеріалів срібла, що не прореагував броміду.
(При прояві фотоплівки та фотопаперу незасвітлена частина броміду срібла, що міститься у фотографічній емульсії, не відновлюється проявником. Для її видалення і використовують цю реакцію (процес носить назву "фіксування", тому що невіддалений бромід срібла надалі на світлі поступово розкладається, руйнуючи зображення)
5) Комплекси, в яких лігандами є атоми водню, поділяються на дві різні групи: гідриднікомплекси та комплекси, що входять до складу онієвихз'єднань.
При утворенні гідридних комплексів – , , – центральний атом є акцептором електронів, а донором – гідридний іон. Ступінь окиснення атомів водню у цих комплексах дорівнює –1.
У онієвих комплексах центральний атом є донором електронів, а акцептором – атом водню у ступеня окиснення +1. Приклади: H 3 O або – іон оксонію, NH 4 або – іон амонію. Крім того, існують і заміщені похідні таких іонів: – іон тетраметиламонію, – іон тетрафеніларсонію, – іон діетілоксонію тощо.
6) Карбонільнікомплекси – комплекси, у яких як лігандів присутні групи CO (до утворення комплексу – молекули монооксиду вуглецю), наприклад: , , та інших.
7) Аніонгалогенатнікомплекси - комплекси типу.
За типом лігандів виділяють інші класи комплексних частинок. Крім того, існують комплексні частинки з різними за типом лігандами; Найпростіший приклад - аква-гідроксокомплекс.
17.3. Основи номенклатури комплексних сполук
Формула комплексної сполуки складається так само, як і формула будь-якої іонної речовини: на першому місці записується формула катіону, на другому – аніону.
Формула комплексної частки записується в квадратних дужках у наступній послідовності: на першому місці ставиться символ елемента-комплексоутворювача, далі – формули лігандів, що були до утворення комплексу катіонами, потім – формули лігандів, що були до утворення комплексу нейтральними молекулами, і після них – формули лігандів, що були до утворення комплексу аніонами.
Назва комплексної сполуки будується так само, як і назва будь-якої солі або основи (комплексні кислоти називаються солями водню або оксонію). У назву з'єднання входить назва катіону та назва аніону.
У назву комплексної частки входить назва комплексоутворювача та назви лігандів (назва записується відповідно до формули, але справа наліво. Для комплексоутворювачів у катіонах використовуються російські назви елементів, а в аніонах – латинські.
Назви найпоширеніших лігандів:
| H 2 O - водний | Cl – хлоро | SO 4 2 – сульфато | OH – гідроксо |
| CO – карбоніл | Br – бромо | CO 3 2 – карбонато | H – гідридо |
| NH 3 – аммін | NO 2 – нітро | CN – ціано | NO - нітрозо |
| NO – нітрозил | O 2 – оксо | NCS – тіоціанато | H+I – гідро |
Приклади назв комплексних катіонів:
Приклади назв комплексних аніонів:
2 – тетрагідроксоцінкат-іон
3 – ді(тіосульфато)аргентат(I)-іон
3 – гексаціанохромат(III)-іон
– тетрагідроксодіакваалюмінат-іон
– тетранітродіаммінкобальтат(III)-іон
3 – пентаціаноакваферрат(II)-іон
Приклади назв нейтральних комплексних частинок:
Більш докладні номенклатурні правила наводяться у довідниках та спеціальних посібниках.
17.4. Хімічний зв'язок у комплексних з'єднаннях та їх будова
У кристалічних комплексних з'єднаннях із зарядженими комплексами зв'язок між комплексом та зовнішньосферними іонами іонний, зв'язки між іншими частинками зовнішньої сфери – міжмолекулярні (у тому числі й водневі). У молекулярних комплексних сполуках зв'язок між комплексами міжмолекулярний.
У більшості комплексних частинок між центральним атомом та лігандами зв'язки ковалентні. Усі вони або їх частина утворені за донорно-акцепторним механізмом (як наслідок – зі зміною формальних зарядів). У найменш міцних комплексах (наприклад, в аквакомплексах лужних та лужноземельних елементів, а також амонію) ліганди утримуються електростатичним тяжінням. Зв'язок у комплексних частках часто називають донорно-акцепторним або координаційним зв'язком.
Розглянемо її утворення з прикладу аквакатиона заліза(II). Цей іон утворюється за реакцією:
FeCl 2кр + 6H 2 O = 2 + 2Cl
Електронна формула атома заліза. s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6 . Складемо схему валентних підрівнів цього атома:
При утворенні двозарядного іона атом заліза втрачає два 4 s-електрона:
Іон заліза акцептує шість електронних пар атомів кисню шести молекул води на вільні валентні орбіталі:

Утворюється комплексний катіон, хімічну будову якого можна виразити однією з таких формул:

Просторова будова цієї частки виражається однією з просторових формул:

Форма координаційного поліедра – октаедр. Усі зв'язки Fe-O однакові. Передбачається sp 3 d 2-гібридизація АТ атома заліза. Магнітні властивостікомплексу свідчить про наявність неспарених електронів.
Якщо FeCl 2 розчиняти в розчині, що містить ціанід-іони, протікає реакція
FeCl 2кр + 6CN = 4 + 2Cl.
Той самий комплекс виходить і при додаванні до розчину FeCl 2 розчину ціаніду калію KCN:
2 + 6CN = 4 + 6H 2 O.
Це говорить про те, що ціанідний комплекс міцніший за аквакомплекс. Крім того, магнітні властивості ціанідного комплексу вказують на відсутність неспарених електронів у атома заліза. Все це пов'язано з дещо іншою електронною будовою цього комплексу:

Більш "сильні" ліганди CN утворюють міцніші зв'язки з атомом заліза, виграшу в енергії вистачає на те, щоб "порушити" правило Хунда і звільнити. d-орбіталі для неподілених пар лігандів Просторова будова ціанідного комплексу така сама, як і аквакомплексу, але тип гібридизації інший – d 2 sp 3 .
"Сила" ліганда залежить насамперед від електронної щільності хмари неподіленої пари електронів, тобто вона збільшується зі зменшенням розміру атома, зі зменшенням головного квантового числазалежить від типу гібридизації ЕО і від деяких інших факторів. Найважливіші ліганди можна побудувати до ряду за зростанням їх " сили " (своєрідний " ряд активності " лігандів), цей ряд називається спектрохімічним рядом лігандів:
| I; Br; : SCN, Cl, F, OH, H 2 O; : NCS, NH 3; SO 3 S : 2 ; : CN, CO |
Для комплексів 3 та 3 схеми освіти виглядають наступним чином:
|
|
Для комплексів з КЧ = 4 можливі дві структури: тетраедр (у разі sp 3-гібридизації), наприклад, 2 і плоский квадрат (у випадку dsp 2 -гібридизації), наприклад, 2 .
17.5. Хімічні властивості комплексних сполук
Для комплексних сполук насамперед характерні самі властивості, як і звичайних сполук тих самих класів (солі, кислоти, основи).
Якщо комплексне з'єднання кислота, це сильна кислота, якщо основа, те й основа сильне. Ці властивості комплексних сполук визначаються лише наявністю іонів H 3 O чи OH . Крім цього комплексні кислоти, основи та солі вступають у звичайні реакції обміну, наприклад:
SO 4 + BaCl 2 = BaSO 4 + Cl 2
FeCl 3 + K 4 = Fe 4 3 + 3KCl
Остання з цих реакцій використовується як якісна реакція на іони Fe 3 . Нерозчинну речовину ультрамаринового кольору, що утворюється, називають "берлінською блакиттю" [систематична назва – гексаціаноферрат(II) заліза(III)-калію].
Крім цього реакцію може вступати і сама комплексна частка, причому, тим активніше, що вона менш стійка. Зазвичай це реакції заміщення лігандів, що протікають у розчині, наприклад:
2 + 4NH 3 = 2 + 4H 2 O,
а також кислотно-основні реакції типу
2 + 2H 3 O = + 2H 2 O
2 + 2OH = + 2H 2 O
Утворюється в цих реакціях після виділення та висушування перетворюється на гідроксид цинку:
Zn(OH) 2 + 2H 2 O
Остання реакція – найпростіший приклад розкладання комплексної сполуки. У цьому випадку вона протікає за кімнатної температури. Інші комплексні з'єднання розкладаються при нагріванні, наприклад:
SO 4 . H 2 O = CuSO 4 + 4NH 3 + H 2 O (вище 300 o С)
4K 3 = 12KNO 2 + 4CoO + 4NO + 8NO 2 (понад 200 o С)
K 2 = K 2 ZnO 2 + 2H 2 O (вище 100 o С)
Для оцінки можливості протікання реакції заміщення лігандів можна використовувати спектрохімічний ряд, керуючись тим, що сильніші ліганди витісняють із внутрішньої сфери менш сильні.
17.6. Ізомерія комплексних сполук
Ізомерія комплексних сполук пов'язана
1) з можливим різним розташуванням лігандів та зовнішньосферних частинок,
2) з різною будовою найкомплекснішої частки.
До першої групи належить гідратна(у загальному випадку сольватна) та іонізаційнаізомерія, до другої – простороваі оптична.
Гідратна ізомерія пов'язана з можливістю різного розподілу молекул води у зовнішній та внутрішній сферах комплексної сполуки, наприклад: (колір червоно-коричневий) та Br2 (колір блакитний).
Іонізаційна ізомерія пов'язана з можливістю різного розподілу іонів у зовнішній та внутрішній сфері, наприклад: SO 4 (пурпурного кольору) та Br (червоного кольору). Перше з цих сполук утворює осад, реагуючи з розчином хлориду барію, а друге – з розчином нітрату срібла.
Просторова (геометрична) ізомерія, інакше звана цис-транс ізомерією, характерна для квадратних та октаедричних комплексів (для тетраедричних неможлива). Приклад: цис-транс ізомерія квадратного комплексу

Оптична (дзеркальна) ізомерія за своєю суттю не відрізняється від оптичної ізомерії в органічній хімії та характерна для тетраедричних та октаедричних комплексів (для квадратних неможлива).