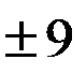Концепцията за киселинно-алкалната хомеостаза, нейните основни параметри. Ролята на стабилизирането на pH на вътрешната среда за тялото. Функционална система за поддържане на постоянството на параметрите на киселинно-алкалната хомеостаза. Значението на поддържането на постоянно pH в живота. Ролята на външното дишане, бъбреците и кръвните буферни системи за стабилизиране на pH.
Концепцията за pH, ролята на постоянството на pH на вътрешната среда за осъществяването на вътреклетъчния метаболизъм.
Киселинно-алкалният баланс е един от най-важните физични и химични параметри на вътрешната среда на тялото. Съотношението на водородните и хидроксилните йони във вътрешната среда на тялото до голяма степен определя активността на ензимите, посоката и интензивността на окислително-възстановителните реакции, процесите на разграждане и синтез на протеини, гликолиза и окисление на въглехидрати и мазнини, функциите на брой органи, чувствителността на рецепторите към медиаторите, пропускливостта на мембраните и др. Активността на реакцията на околната среда определя способността на хемоглобина да свързва кислорода и да го освобождава в тъканите. При промяна на реакцията на околната среда се променят физикохимичните характеристики на клетъчните колоиди и междуклетъчните структури - степента на тяхната дисперсност, хидрофилност, адсорбционна способност и други важни свойства.
Съотношението на активните маси на водородните и хидроксилните йони в биологичните среди зависи от съдържанието на киселини (донори на протони) и буферни основи (акцептори на протони) в телесните течности. Обичайно е да се оценява активната реакция на околната среда чрез един от йоните (Н +) или (ОН -), по-често чрез йона Н +. Съдържанието на H+ в организма се определя, от една страна, от прякото или индиректното им образуване чрез въглероден диоксид по време на метаболизма на протеини, мазнини и въглехидрати, а от друга страна, от тяхното навлизане в тялото или извеждане от него през под формата на нелетливи киселини или въглероден диоксид. Дори сравнително малки промени в CH + неизбежно водят до нарушаване на физиологичните процеси и с изместване извън определени граници до смърт на организма. В тази връзка стойността на pH, която характеризира състоянието на киселинно-алкалния баланс, е един от най-„твърдите“ кръвни параметри и варира в тесен диапазон при хората - от 7,32 до 7,45. Изместване на рН с 0,1 над посочените граници предизвиква изразени смущения в дихателната, сърдечно-съдовата система и др.; намаляването на рН с 0,3 причинява ацидотична кома, а промяната на рН с 0,4 често е несъвместима с живота.
Обмяната на киселини и основи в организма е тясно свързана с обмяната на вода и електролити. Всички тези видове обмен са обединени от законите на електронеутралността, изомоларността и хоместатичните физиологични механизми. За плазмата законът за електрическата неутралност може да се илюстрира с данните в табл. 20.
Общото количество на плазмените катиони е 155 mmol/l, от които 142 mmol/l е натрий. Общото количество на аниони също е 155 mmol/l, от които 103 mmol/l е слабата основа C1 - и 27 mmol/l е делът на HCO - 3 (силна основа). G. Ruth (1978) смята, че HCO-3 и протеиновите аниони (приблизително 42 mmol/l) представляват основните буферни основи на плазмата. Поради факта, че концентрацията на водородни йони в плазмата е само 40·10 -6 mmol/l, кръвта е добре буфериран разтвор и има леко алкална реакция. Протеиновите аниони, особено HCO-3 йонът, са тясно свързани, от една страна, с обмена на електролити, а от друга, с киселинно-алкалния баланс, поради което правилното тълкуване на промените в тяхната концентрация е важно за разбирането процесите, протичащи при обмяната на електролити, вода и Н + .
Киселинно-основно състояние (ABS)- относително постоянство на реакцията на вътрешната среда на тялото, количествено характеризирана с концентрацията на Н +.
Концентрацията на Н+ се изразява чрез стойността на рН. Концентрацията на H + и съответно стойността на рН зависят от съотношението на киселини и основи в тялото.
Киселини на Бронстед -молекули или йони, способни да даряват Н+.
Фондации Брьонстед -съединения, способни да приемат Н +.
Най-често срещаната киселина в тялото е въглеродната киселина, около 20 мола се образуват на ден. Тялото произвежда и други неорганични (солна, сярна, фосфорна) и органични (амино-, кето-, хидрокси-, нуклеинова, мастна) киселини в количество от 80 mmol/ден.
най-силният от тях е амонякът. Основни свойства имат и аминокиселините аргинин и лизин, биогенните амини, например катехоламини, хистамин, серотонин и др.
Биологично значениеРегулиране на pH, последствия от нарушения
H + са положително заредени частици, те се присъединяват към отрицателно заредени групи от молекули и аниони, в резултат на което променят своя състав и свойства. По този начин количеството Н + в течността определя структурата и свойствата на всички основни групи органични съединения– протеини, нуклеинова киселина, въглехидрати и липиди (амфифилни). Най-важният ефект от концентрацията на Н+ е върху ензимната активност. Всеки ензим има свой собствен оптимален рН, при който ензимът има максимална активност. Например ензимите на гликолизата, TCA цикъла, PFS са активни в неутрална среда, а лизозомните ензими и стомашните ензими са активни в кисела среда (pH = 2). В резултат на това промените в pH предизвикват промени в активността на отделните ензими и водят до метаболитни нарушения като цяло.
Основни принципи на регулиране на ПСОВ
Регулирането на CBS се основава на 3 основни принципа:
1. постоянство на pH . Регулаторните механизми на CBS поддържат постоянно pH.
2. изомоларност . При регулиране на CBS концентрацията на частици в междуклетъчната и извънклетъчната течност не се променя.
3. електрическа неутралност . При регулиране на CBS броят на положителните и отрицателни частицине се променя в междуклетъчната и извънклетъчната течност.
МЕХАНИЗМИ ЗА РЕГУЛИРАНЕ НА СПАТ
- Физико-химичен механизъм , Това буферни системикръв и тъкани;
- Физиологичен механизъм , това са органи: бели дробове, бъбреци, костна тъкан, черен дроб, кожа, стомашно-чревен тракт.
- Метаболитен (на клетъчно ниво).
Нарушения на ПСОВ - класификация по механизми? Биохимични пътища на компенсация.
НАРУШЕНИЯ НА ДИШАНЕТО
Компенсация за CBS- адаптивна реакция от страна на тялото, която не е виновна за нарушаване на CBS.
Корекция на CBS– адаптивна реакция от страна на органа, който е причинил нарушение на CBS.
Има два основни типа нарушения на CBS - ацидоза и алкалоза.
ацидоза– абсолютен или относителен излишък на киселини или дефицит на основи.
Алкалоза– абсолютен или относителен излишък на основи или дефицит на киселини.
Ацидозата или алкалозата не винаги е придружена от забележима промяна в концентрацията на Н +, тъй като буферните системи поддържат постоянно рН. Такива ацидози и алкалози се наричат компенсиран (PH им е нормално). AN ↔ A - + N + , N + + B - ↔ BH
Ако по време на ацидоза или алкалоза буферният капацитет се изразходва, стойността на pH се променя и се наблюдава следното: ацидемия – намаляване на стойността на рН под нормалното, или алкалиемия - повишаване на стойността на pH над нормалното. Такива ацидози и алкалози се наричат декомпенсиран .
Хомеостазата е едно от основните свойства на живите същества да поддържат относителна динамика
постоянство на вътрешната среда, т.е. химичен състав, осмотичен
налягане, стабилност на основните физиологични функции.
Това е способността на тялото да поддържа относително постоянство на вътрешната среда (кръв, лимфа, междуклетъчна течност).
Човешкото тяло се адаптира към постоянно променящите се условия на околната среда, но вътрешната среда остава постоянна и нейните показатели се колебаят в много тесни граници. Следователно човек може да живее в различни условия на околната среда. Някои физиологични параметри се регулират особено внимателно и фино, например телесна температура, кръвно налягане, глюкоза, газове, соли, калциеви йони в кръвта, киселинно-алкален баланс, обем на кръвта, нейното осмотично налягане, апетит и много други. Регулирането се извършва на принципа на отрицателната обратна връзка между рецепторите, които откриват промени в тези индикатори и контролните системи. По този начин намаляването на един от параметрите се улавя от съответния рецептор, от който се изпращат импулси към една или друга структура на мозъка, по команда на която автономната нервна система включва сложни механизми за изравняване на настъпилите промени . Мозъкът използва две основни системи за поддържане на хомеостазата: вегетативна и ендокринна.
Един от най-важните физикохимични параметри на вътрешната среда е киселинно-алкален баланс .
Количествена характеристика на кръвната реакция pH стойност(pH) – отрицателен десетичен логаритъм от концентрацията на водород и йони.
Повечето разтвори в тялото са буферни разтвори,при които pH не се променя, когато към тях се добавят малки количества силна киселина или основа.
Тъканната течност, кръвта, урината и други течности са буферни разтвори.
Индикаторът pH на телесните течности ясно демонстрира колко са усвоени Na, Mg, Ca, K. Тези 4 компонента регулират киселинността на тялото. Ако киселинността е висока, веществата започват да се заемат от други органи и кухини. За осъществяване на всички функции на живите структури на всички нива от молекулярни системи до органи е необходима леко алкална среда (рН 7,4).
Дори и най-малкото отклонение от нормалната стойност може да причини патология.
Промени в pH: до киселинно - ацидоза
към алкална – алкалоза
Изместване от 0,1 може да доведе до нарушаване на околната среда, а отместване от 0,3 може да бъде животозастрашаващо.
нивата на pH на кръвта и други вътрешни течности. Метаболизъм и метаболити.
Стандарти за вътрешни течности:
Артериална кръв 7,35 – 7,45
Венозна кръв 7,26 – 7,36
Лимфа 7.35 – 7.40
Междуклетъчна течност 7.26 – 7.38
pH на урината 5-7 (киселинността се променя в зависимост от приема на храна и физическата активност. Алкалност на урината - растителни храни; киселинност на урината - месо, физическа активност).
Отклонения и норми:
- Киселинна течна реакция
Гладуване, повишена телесна температура, диабет, нарушена бъбречна функция, тежка физическа работа.
- Алкална реакция
Възпаление на пикочния мехур, бедна на месни продукти диета, прекаляване минерална вода, попадане на кръв в урината.
Всеки организъм се характеризира с набор от показатели, чрез които се оценяват физикохимичните свойства на вътрешната среда, с изключение на pH, което се оценява чрез обратен десетичен логаритъм p и p, както и ударен обем на сърцето, сърдечна честота, кръв налягане, скорост на кръвния поток, периферно съдово съпротивление, минутен обем на дишането и др. Съвкупността от тези показатели характеризира функционалното ниво на тялото.
Метаболизъм – съвкупност химична реакцияСрещащи се в живите клетки и
осигуряване на организма с вещества и енергия за основния метаболизъм.
Метаболитите са продукти на вътреклетъчния метаболизъм, които подлежат на окончателно елиминиране от тялото.
2. Кръвни буферни системи. Ролята на буферните системи за поддържане на pH хомеостазата. Киселинно-основно състояние. Концепцията за ацидоза и алкалоза.
В организма киселинното образуване преобладава над образуването на основни съединения.
Източници на Н+ в организма:
1. летлива киселина H2CO3, 10-20 хиляди mmol CO2 на ден по време на окисляването на протеини, F, U.
2.нелетливи киселини на ден. 70 mmol:
Фосфорен при разграждане на органични фосфати (нуклеотиди, PL, фосфопротеини)
Сярна, солна по време на окисление Б
3.org.k-you: мляко, кетонови тела, PVC и др.
pH се поддържа на леко алкално ниво благодарение на участието на буферни клетки и физиологичен контрол (отделителна функция на бъбреците и дихателна функция на белите дробове)
Уравнение на Хендерсън-Хеселбах: pH = pKa + log [протонен акумулатор]/[протонен донор].
(сол) (киселина)
Всеки буфер се състои от конюгирана киселинно-базова двойка: протонен донор + акцептор.
Буферен капацитет: зависи от абсолютните концентрации на буферните компоненти.
Бикарбонат.
10% буферен кръвен капацитет.
При нормално рН на кръвта (7,4) концентрацията на бикарбонатни йони HCO 3 в кръвната плазма надвишава концентрацията на CO 2 приблизително 20 пъти. Бикарбонатната буферна система функционира като ефективен регулатор в pH диапазон от 7,4.
Механизмът на действие на тази система е, че когато относително големи количества киселинни продукти се отделят в кръвта, водородните йони H + взаимодействат с бикарбонатните йони HCO 3 –, което води до образуването на слабо дисоциирана въглена киселина H 2 CO 3. Последващо намаляване на концентрацията на H 2 CO 3 се постига в резултат на ускореното освобождаване на CO 2 през белите дробове в резултат на тяхната хипервентилация (припомнете си, че концентрацията на H 2 CO 3 в кръвната плазма се определя от налягане на CO 2 в алвеоларната газова смес).
Ако количеството на основите в кръвта се увеличи, тогава те взаимодействат със слаба въглена киселина, за да образуват бикарбонатни йони и вода. В този случай не се наблюдават забележими промени в стойността на pH. Освен това, за да се поддържа нормално съотношение между компонентите на буферната система, в този случай се активират физиологични механизми за регулиране на киселинно-алкалния баланс: определено количество CO 2 се задържа в кръвната плазма в резултат на хиповентилация на бели дробове.
NaHCO3 + H+ → Na+ + H2CO3
Реактиви в бъбреците ↓карбоанхидраза
↓повишена вентилация на белите дробове
Фосфатът е спрегната киселинно-основна двойка, състояща се от H 2 PO 4 – йон (протонен донор) и HPO 4 2 – йон (протонен акцептор):
 Фосфатната буферна система представлява само 1% от буферния капацитет на кръвта. В извънклетъчната течност, включително кръвта, съотношението [HPO 4 2– ]: [H 2 PO 4 – ] е 4:1. Буферният ефект на фосфатната система се основава на възможността за свързване на водородни йони с HPO 4 2– йони за образуване на H 2 PO 4 – (H + + + HPO 4 2– -> H 2 PO 4 –), както и OH – йони с H 2 PO йони 4 – (OH – + + H 2 R O 4 – -> HPO 4 2– + H 2 O). Буферната двойка (H 2 PO 4 – –HPO 4 2–) е в състояние да повлияе на промените в pH в диапазона от 6,1 до 7,7 и може да осигури определен буферен капацитет на вътреклетъчната течност, чиято стойност на pH е в диапазона от 6.9–7, 4. В кръвта максималният капацитет на фосфатния буфер се появява около рН стойност 7,2.
Фосфатната буферна система представлява само 1% от буферния капацитет на кръвта. В извънклетъчната течност, включително кръвта, съотношението [HPO 4 2– ]: [H 2 PO 4 – ] е 4:1. Буферният ефект на фосфатната система се основава на възможността за свързване на водородни йони с HPO 4 2– йони за образуване на H 2 PO 4 – (H + + + HPO 4 2– -> H 2 PO 4 –), както и OH – йони с H 2 PO йони 4 – (OH – + + H 2 R O 4 – -> HPO 4 2– + H 2 O). Буферната двойка (H 2 PO 4 – –HPO 4 2–) е в състояние да повлияе на промените в pH в диапазона от 6,1 до 7,7 и може да осигури определен буферен капацитет на вътреклетъчната течност, чиято стойност на pH е в диапазона от 6.9–7, 4. В кръвта максималният капацитет на фосфатния буфер се появява около рН стойност 7,2.
1 и 2 – изход.
Протеинът е по-малко важен за поддържането на COR в кръвната плазма, отколкото другите буферни системи. Протеините образуват буферна система поради наличието на киселинно-базови групи в протеиновата молекула: протеин-H + (киселина, протонен донор) и протеин (конюгирана база, протонен акцептор). Протеиновата буферна система на кръвната плазма е ефективна в диапазона на рН 7,2–7,4.
Буферната система на хемоглобина е най-мощната буферна система в кръвта. Той е 9 пъти по-мощен от бикарбонатен буфер; той представлява 75% от общия буферен капацитет на кръвта. се състои от нейонизиран хемоглобин HHb (слаба органична киселина, донор на протони) и калиева сол на хемоглобин KHb (конюгирана основа, акцептор на протони). Оксихемоглобиновата буферна система може да се разглежда по същия начин. Хемоглобиновата система и оксихемоглобиновата система са взаимно конвертируеми системи и съществуват като едно цяло.
Механизъм на действие:
В тъканите: H2O + CO2 (карбоанхидраза) -> H2CO3 -> H + + HCO3 - (дифундира в кръвната плазма)
KNvO2 ->KNv + 4O2
KHb + 2H+ -> HHb + 2K+ (К-хемоглобин неутрализира Н+ йони)
В белите дробове: HHb + 4O2 -> 2H+ + HbO2
2H+ + HBO2 + 2K+ + 2HCO3- ->KHBO2 + 2H2CO3 (карбоанхидраза) ->H2O + 2CO2
pH и концентрацията на CO2 влияят на освобождаването и свързването на O2 от немоглобина - ефект на бор.
Увеличаването на концентрацията на протони, CO2, насърчава освобождаването на O2, а увеличаването на концентрацията на O2 стимулира освобождаването на CO2 и протони.
| IN в широк смисълпонятието "физико-химични свойства" на организма включва целия набор компонентивътрешна среда, връзките им помежду си, с клетъчното съдържание и с външната среда. Във връзка с целите на тази монография изглежда целесъобразно да се изберат физикохимични параметри на вътрешната среда, които са от жизненоважно значение, добре „хомеостазирани“ и в същото време относително напълно проучени от гледна точка на специфични физиологични механизми, които осигуряват запазване на техните хомеостатични граници. Като такива параметри са избрани газовият състав, киселинно-алкалното състояние и осмотичните свойства на кръвта. По същество тялото няма отделни изолирани системи за хомеостаза на тези параметри на вътрешната среда. |
Киселинно-алкална хомеостаза
Киселинно-алкалният баланс е един от най-важните физични и химични параметри на вътрешната среда на тялото. Съотношението на водородните и хидроксилните йони във вътрешната среда на тялото до голяма степен определя активността на ензимите, посоката и интензивността на окислително-възстановителните реакции, процесите на разграждане и синтез на протеини, гликолиза и окисление на въглехидрати и мазнини, функциите на брой органи, чувствителността на рецепторите към медиаторите, пропускливостта на мембраните и др. Активността на реакцията на околната среда определя способността на хемоглобина да свързва кислорода и да го освобождава в тъканите. При промяна на реакцията на околната среда се променят физикохимичните характеристики на клетъчните колоиди и междуклетъчните структури - степента на тяхната дисперсност, хидрофилност, адсорбционна способност и други важни свойства.
Съотношението на активните маси на водородните и хидроксилните йони в биологичните среди зависи от съдържанието на киселини (донори на протони) и буферни основи (акцептори на протони) в телесните течности. Обичайно е да се оценява активната реакция на околната среда чрез един от йоните (Н +) или (ОН -), по-често чрез йона Н +. Съдържанието на H+ в организма се определя, от една страна, от прякото или индиректното им образуване чрез въглероден диоксид по време на метаболизма на протеини, мазнини и въглехидрати, а от друга страна, от тяхното навлизане в тялото или извеждане от него през под формата на нелетливи киселини или въглероден диоксид. Дори относително малки промени в cH + неизбежно водят до нарушаване на физиологичните процеси, а когато промените над определени граници водят до смърт на организма. В тази връзка стойността на pH, която характеризира състоянието на киселинно-алкалния баланс, е един от най-„твърдите“ кръвни параметри и варира в тесен диапазон при хората - от 7,32 до 7,45. Изместване на рН с 0,1 над посочените граници предизвиква изразени смущения в дихателната, сърдечно-съдовата система и др.; намаляването на pH с 0,3 причинява ацидотична кома, а промяната на pH с 0,4 често е несъвместима с живота.
Обмяната на киселини и основи в организма е тясно свързана с обмяната на вода и електролити. Всички тези видове обмен са обединени от законите на електронеутралността, изомоларността и хоместатичните физиологични механизми. За плазмата законът за електрическата неутралност може да се илюстрира с данните в табл. 20.
| Таблица 20. Концентрация на йони в плазмата (Hermann N., Cier J., 1969) | |||||
| Катиони | Концентрация | Аниони | Концентрация | ||
| mg/l | mmol/l | mg/l | mmol/l | ||
| Na+ | 3 300 | 142 | C1 - | 3650 | 103 |
| К+ | 180-190 | 5 | НСО - 3 | 1650 | 27 |
| Ca 2+ | 100 | 2,5 | катерици | 70000 | 7,5-9 |
| Mg 2+ | 18-20 | 0,5 | PO 2- 4 | 95-106 | 1,5 |
| SO 2-4 | 45 | 0,5 | |||
| Други предмети | Приблизително 1,5 | Органични киселини | Приблизително 5 | ||
| Обща сума. . . | 155 mmol/l | Обща сума. . . | 155 mmol/l | ||
Общото количество на плазмените катиони е 155 mmol/l, от които 142 mmol/l е натрий. Общото количество на аниони също е 155 mmol/l, от които 103 mmol/l е слабата основа C1 - и 27 mmol/l е делът на HCO - 3 (силна основа). G. Ruth (1978) смята, че HCO-3 и протеиновите аниони (приблизително 42 mmol/l) представляват основните буферни основи на плазмата. Поради факта, че концентрацията на водородни йони в плазмата е само 40·10 -6 mmol/l, кръвта е добре буфериран разтвор и има леко алкална реакция. Протеиновите аниони, особено HCO-3 йонът, са тясно свързани, от една страна, с обмена на електролити, а от друга, с киселинно-алкалния баланс, поради което правилното тълкуване на промените в тяхната концентрация е важно за разбирането процесите, протичащи при обмяната на електролити, вода и Н + .
Киселинно-алкалният баланс се поддържа от мощни хомеостатични механизми. Тези механизми се основават на особеностите на физико-химичните свойства на кръвта и физиологичните процеси, в които участват системите за външно дишане, бъбреците, черния дроб, стомашно-чревния тракт и др.
Физикохимични хомеостатични механизми
Буферни системи на кръвта и тъканите. Както в условията на нормален живот, така и когато тялото е изложено на екстремни фактори, поддържането на киселинно-алкалната хомеостаза се осигурява предимно от физикохимични регулаторни механизми.
- Особено място сред тези механизми заема карбонатната буферна система [покажи]
Според закона електролитна дисоциация, съотношението на произведението на концентрацията на йони към концентрацията на недисоциирани молекули е постоянна стойност:
(H+) (HCO - 3) (H2CO3) (Na+) (HCO - 3) (NaHCO3) Йонът HCO - 3 е общ за всеки компонент на системата и следователно този йон, образуван от силно дисоцииращата сол NaHCO 3, ще потисне образуването на подобен йон от слабия H 2 CO 3, т.е. почти всички от HCO-3 в бикарбонатния буфер възниква от дисоциацията на NaHCO3. Следователно уравнение (1) може да бъде представено по следния начин:
(H+) (NaHCO3) (H2CO3) и според предложението на Sörensen pH = -log (H +) се приема като символ за обозначаване на активна реакция. В крайната си форма уравнението на Хендерсън-Хаселбалх за карбонатен буфер обикновено се представя по следния начин:
H2CO3 NaHC03 където pK = -logK. Следователно карбонатният буфер се състои от слаб H 2 CO 3 и натриева сол на неговия анион (силна основа HCO - 3 -NaHCO 3. При нормални условия в плазмата има 20 пъти повече бикарбонат, отколкото въглена киселина. Когато този буфер дойде в контакт с киселини, последните се неутрализират от алкален компонент на буфера с образуването на слаб H 2 CO 3. След това образуваният въглероден диоксид възбужда дихателния център и целият излишък на въглероден диоксид се отстранява от кръвта с издишания въздух. карбонатният буфер също е в състояние да неутрализира излишните основи, които ще бъдат свързани с въглероден диоксид с образуването на NaHCO 3 и последващото му освобождаване чрез бъбреците.
Буферният капацитет на карбонатната система е 7-9% от общия буферен капацитет на кръвта, но нейното значение е много голямо поради факта, че тя е тясно свързана с другите буферни системи и нейното състояние зависи и от функциите, участващи в поддържане на киселинно-алкалната хомеостаза на отделителните органи. По този начин той е чувствителен индикатор за киселинно-алкалния баланс и определянето на неговите компоненти се използва широко за диагностициране на неговите нарушения.
- Друга плазмена буферна система е фосфатният буфер, образуван от моно- и двуосновни фосфатни соли [покажи]
:
Фосфатен буфер, образуван от едно- и двуосновни фосфатни соли:
NaH2PO4 1 Na2PO4 4 Едноосновните фосфорни соли са слаби киселини, докато двуосновните соли имат ясно изразена алкална реакция. Принципът на действие на фосфатния буфер е подобен на този на карбонатния буфер. Пряката роля на фосфатния буфер в кръвта е незначителна; този буфер е от много по-голямо значение за бъбречната регулация на киселинно-алкалната хомеостаза. Освен това играе важна роля в регулирането на активната реакция на определени тъкани. В кръвта действието му се свежда главно до поддържане на постоянството и възпроизводството на бикарбонатния буфер. Всъщност "агресията" на киселините причинява увеличаване на съдържанието на H 2 CO 3 и намаляване на съдържанието на NaHCO 3 в система, съдържаща карбонатни и фосфатни буфери. Поради едновременното присъствие на фосфатен буфер в разтвора възниква реакция на обмен:
т.е. излишъкът от H 2 CO 3 се елиминира и концентрацията на NaHCO 3 се увеличава, поддържайки постоянен израз:
H2CO3 1 NaHC03 20 - Третата буферна система на кръвта са протеините [покажи]

Буферните свойства на протеините се определят от тяхната амфотерност. Протеините могат да се дисоциират, за да образуват както Н +, така и ОН - йони. Характерът на дисоциацията зависи от химическа природапротеин и реакцията на околната среда. Буферният капацитет на плазмените протеини е малък в сравнение с бикарбонатите. Най-големият буферен капацитет на кръвта (до 75%) е хемоглобинът. Човешкият хемоглобин съдържа 8,1% хистидин, аминокиселина, която включва както киселинни (COOH), така и основни (NH2) групи. Буферните свойства на хемоглобина се дължат на възможността за взаимодействие на киселини с калиевата сол на хемоглобина за образуване на еквивалентно количество от съответната калиева сол и свободен хемоглобин, който има свойствата на много слаба органична киселина. По този начин могат да се свържат много значителни количества H + йони. Способността за свързване на H + йони е по-изразена в хемоглобиновите соли, отколкото в оксихемоглобиновите соли (HbO 2), т.е. Hb е по-слаба органична киселина от HbO 2. Следователно, когато HbO 2 се дисоциира в тъканните капиляри на O 2 и Hb, се появява допълнително количество основи (алкално-реактивни хемоглобинови соли), които могат да свържат въглеродния диоксид, противодействайки на намаляването на pH. Напротив, оксигенирането на хемоглобина води до изместване на H 2 CO 2 от бикарбонат (фиг. 38).
Тези механизми, очевидно, могат да влязат в действие не само по време на превръщането на артериалната кръв във венозна кръв и обратно, но и във всички случаи, когато Pco 2 се променя. Хемоглобинът също е способен да свързва въглеродния диоксид, използвайки свободни аминогрупи, образувайки карбхемоглобин:
По този начин консумацията на NaHCO 3 бикарбонат в карбонатната буферна система по време на киселинна "агресия" се компенсира от алкални протеинати, фосфати и хемоглобинови соли.
Обменът на Cl - и HCO - 3 йони между червените кръвни клетки и плазмата също е изключително важен. Когато концентрацията на въглероден диоксид в плазмата се увеличи, концентрацията на Cl - в нея намалява, тъй като Cl - преминава в червените кръвни клетки. Основният източник на Cl - в плазмата е натриевият хлорид; следователно повишаването на концентрацията на въглеродна киселина причинява прекъсване на връзката между Na + и Cl - и тяхното разделяне, като Cl - навлиза в еритроцитите, а Na + остава в плазмата, тъй като мембраната на еритроцитите е практически непроницаема за тях . Полученият излишък от Na+ се комбинира с излишъка от HCO-3, образувайки натриев бикарбонат, попълвайки загубата му в резултат на подкиселяване на кръвта и по този начин поддържайки постоянно рН на кръвта.
Намаляването на Pco 2 причинява обратния процес: Cl - напуска червените кръвни клетки, комбинирайки се с излишния Na +, освободен от бикарбонат, и по този начин предотвратява алкализацията на кръвта. Тези движения на йони през полупропускливата мембрана на еритроцитите се обясняват с едно от правилата на Донан, което гласи, че съотношенията на концентрациите на йони, способни да преминат през мембраната, трябва да бъдат еднакви от двете страни на мембраната. Този процес е от изключително значение за поддържане на pH на кръвта, Cl - er / Cl - pl = 0,48-0,52 може да служи като един от индикаторите за състоянието на киселинно-алкалната хомеостаза.
Основна роля в поддържането на киселинно-алкалната хомеостаза принадлежи на тъканните буферни системи, които поддържат постоянството на интерстициалното рН и участват в регулирането на рН на кръвта. Тъканите съдържат карбонатни и фосфатни буферни системи. Въпреки това, специална роля играят тъканните протеини, които са способни да свързват много големи количества киселини и основи. Най-силно изразен буферен капацитет има колагеновото вещество на съединителната тъкан, което също е способно да свързва киселините чрез тяхната адсорбция.
Хомеостатични метаболитни процеси. Много важна роля в регулирането на киселинно-алкалния баланс играят метаболитните процеси, протичащи в тъканите, особено в черния дроб, бъбреците и мускулите. Органичните киселини могат да претърпят окисление с образуването или на летливи киселини, които лесно се отделят от тялото (главно въглероден диоксид), или да се превърнат в некиселинни вещества. Те могат да се комбинират с продуктите на протеиновия метаболизъм, напълно или частично да ги загубят кисели свойства(например, съединение на бензоена киселина с глицин); млечната киселина, образувана в големи количества по време на интензивна мускулна работа, се ресинтезира в гликоген, кетонни тела - във висши мастни киселини и след това в мазнини и др. Неорганичните киселини могат да бъдат неутрализирани от калиеви и натриеви соли, освободени при дезаминиране на аминокиселините с амоняк за образуване на амониеви киселини, соли и др. Алкалите се неутрализират главно от млечна киселина, която, когато активната реакция на тъканите се измести към алкалната страна, се образува интензивно от гликоген. Киселинно-алкалната хомеостаза се поддържа и от редица физикохимични процеси: разтваряне на силни киселини и алкали в среда с ниска диелектрична константа (например в липиди), свързване на киселини и алкали от различни органични вещества в недисоциирани и неразтворими соли, обмен на йони между клетките на различни тъкани и кръв и др.
Отбелязвайки важността на дискутираните по-горе механизми за поддържане на киселинно-алкалната хомеостаза, трябва да се признае, че в крайна сметка ключовата връзка в разглежданата хомеостатична система е клетъчният метаболизъм, тъй като движението на аниони и катиони между екстра- и вътреклетъчните сектори и тяхното разпределение в тези сектори са предимно резултат от клетъчната дейност и са подчинени на нуждите на тази дейност.
Механизмите, които осигуряват този обмен, са много разнообразни. Движението на йони зависи от градиента на осмотичното налягане, пропускливостта на мембраната и се определя от динамиката електрически потенциалмембрани и др.
Физиологични хомеостатични механизми
Вторият ешелон на поддържане на киселинно-алкалната хомеостаза е представен от физиологични регулаторни механизми, сред които основната роля принадлежи на белите дробове и бъбреците.
Благодарение на кръвните буфери, органичните киселини, образувани по време на метаболитния процес, или киселините, въведени в тялото отвън, не променят реакцията на кръвта, а само изместват въглеродния диоксид от връзката му с основите; Излишният въглероден диоксид се елиминира от белите дробове. Високата дифузионна способност на въглеродния диоксид осигурява бързото преминаване на газа през мембраните и отстраняването му от тялото. Скоростта на дифузия на всеки газ е обратно пропорционална на корен квадратен от него молекулно тегло, а количеството на дифузиращия газ е пропорционално на неговата разтворимост в течността.
Комбинирането на тези два закона на дифузия ни позволява да заключим, че въглеродният диоксид дифундира приблизително 20 пъти по-интензивно от кислорода:
където 0,545 и 0,023 са коефициентите на разтворимост съответно на CO 2 и O 2 във вода при t=38°C. Преходът на въглероден диоксид от кръвта към алвеоларния въздух се обяснява с наличния тук градиент Pco 2 . Този процес се улеснява от два механизма: прехода на Hb към HbO 2, който измества въглеродния диоксид като по-силна киселина от кръвта, и действието на карбоанхидразата, която играе голяма роля в освобождаването на свободен въглероден диоксид в белите дробове. . Количеството въглероден диоксид, отстранен от белите дробове, зависи основно от амплитудата и честотата дихателни движения. Параметрите на дишането се регулират в зависимост от съдържанието на въглероден диоксид в тялото. Като цяло връзката между Pco 2 в кръвта и белодробната вентилация се изразява по следния начин (Ruth G., 1978):
където Pco 2 и P (барометрично налягане) са изразени в милиметри живачен стълб, производството на CO 2 е в молове, а алвеоларната вентилация е в литри.
Ролята на бъбреците за поддържане на киселинно-алкалната хомеостаза се определя главно от тяхната киселинно-отделяща функция. При физиологични условия бъбреците произвеждат кисела урина, чието рН варира от 5,0 до 7,0. Стойността на pH на урината може да достигне 4,5 и следователно концентрацията на свободни H + йони може да бъде 800 пъти по-висока от съдържанието им в кръвната плазма. Подкисляването на урината в проксималните и дисталните тубули е резултат от секрецията на Н + йони, в чието образуване и секреция (ацидогенеза) ензимът карбоанхидраза (СА), съдържащ се в клетките на тубулите, играе важна роля . Ензимът ускорява постигането на равновесие между бавната реакция на хидратация и дехидратация на въглеродна киселина (H 2 CO 3):
![]()
Скоростта на тази некатализирана реакция се увеличава с намаляването на pH. Ацидогенезата осигурява отстраняването на киселинните компоненти на фосфатния буфер (по време на образуването на кисела урина се извършва следната трансформация: HPO 2- 4 + H + ---> H 2 PO 4), както и слаби органични киселини: млечна, лимонена, β-хидроксимаслена и др. Процесът Освобождаването на H + от епитела на бъбречните тубули протича срещу електрохимичния градиент с цената голямо количествоенергия и изисква едновременна реабсорбция на еквивалентно количество Na + йони. Намаляването на натриевата реабсорбция обикновено е придружено от намаляване на ацидогенезата. Реабсорбиран в резултат на ацидогенеза, Na + образува в кръвта, заедно с HCO-3, секретиран от епитела на бъбречните тубули, натриев бикарбонат. Н + йони, секретирани от клетките на бъбречните тубули, взаимодействат с анионите на буферните съединения. Ацидогенезата осигурява освобождаването предимно на аниони на карбонатни и фосфатни буфери, както и аниони на слаби органични киселини.

При филтриране на съединения, съдържащи аниони на силни органични и неорганични киселини (Cl -, SO 2- 4), в бъбреците се активира друг механизъм - амониогенеза, която осигурява отделянето на киселини и предпазва от намаляване на pH на урината под критично ниво ( Фиг. 39). Амониогенезата протича на нивото на дисталните тубули и събирателните канали. NH3, образуван в епитела на бъбречните тубули, навлиза в лумена на тубулите, където взаимодейства с Н + в резултат на ацидогенезата. По този начин NH3 осигурява, от една страна, свързването на Н +, а от друга, отстраняването на силни киселинни аниони под формата на амониеви соли, в които Н + йони нямат увреждащ ефект върху тубуларния епител. Източникът на амоний е главно кръвният глутамин. Около 60% от NH3 се образува от глутамин чрез неговото дезаминиране с йод под действието на ензима глутаминаза I. Останалите 40% от амоняка се образуват от други аминокиселини (Pitts R. F., 1964)
Тъй като амониогенезата е тясно свързана с ацидогенезата, очевидно е, че концентрацията на амоний в урината е пряко зависима от концентрацията на Н + в нея. Подкисляването на кръвта, което води до намаляване на рН на тубулната течност, насърчава дифузията на амоняк от клетките. Интензивността на отделянето на амоний също се определя от скоростта на неговото производство и скоростта на потока на урината, което определя времето на контакт между тубулната течност и епитела на бъбречните тубули и, следователно, навременното отстраняване на получения йон от клетката.
Хлоридите играят важна роля в регулирането на отделянето на киселина от бъбреците. По-специално, увеличаването на реабсорбцията на HCO-3 обикновено е придружено от увеличаване на реабсорбцията на хлорид. С1- йонът обикновено пасивно следва Na+ катиона. Увеличаването на концентрацията на HCO-3 бикарбонати в урината обикновено се придружава от намаляване на съдържанието на хлориди по такъв начин, че сумата от тези аниони е еквивалентна на количеството Na + (Matthews D.L., O'Connor W.J. , 1968). Промяната в транспорта на хлорид е следствие от първична промяна в секрецията на H + йони и бикарбонатна реабсорбция и се дължи на необходимостта да се поддържа електрическа неутралност на тубулната урина. Според друга гледна точка транспортът на хлоридите се променя предимно.
В допълнение към механизмите на ацидо- и амониогенезата, при запазването на Na + йон по време на подкисляването на кръвта значителна роляпринадлежи към секрецията на K + йони. Калият, освободен от клетките при понижаване на pH на кръвта, се екскретира от бъбречните тубули в увеличени количества; в същото време се наблюдава повишена реабсорбция на Na +. Този метаболизъм се регулира от минералкортикоиди (алдостерон, дезоксикортикостерон). При нормални условия бъбреците секретират предимно киселинни метаболитни продукти. С увеличаване на приема на основи в тялото, реакцията на урината става по-алкална поради повишената екскреция на бикарбонат и основен фосфат.
Стомашно-чревният тракт заема определено място в екскреторната регулация на киселинно-алкалната хомеостаза. Клетките на стомашната лигавица отделят HCl, който се образува от Cl - йони, идващи от кръвта, и H + йони, произхождащи от стомашния епител. В замяна на хлориди бикарбонатът навлиза в кръвта чрез стомашната секреция. Алкализиране на кръвта обаче не настъпва, тъй като Cl йоните на стомашния сок се реабсорбират в кръвта в червата. Епителът на чревната лигавица отделя алкален сок, богат на бикарбонати. В този случай Н + йони преминават в кръвта под формата на НС1. Краткосрочната промяна в реакцията незабавно се балансира от реабсорбцията на бикарбонат в червата. Докато бъбреците концентрират и екскретират предимно Н+ и едновалентни катиони от тялото, чревният тракт концентрира и екскретира двувалентни алкални йони. При кисела диета се увеличава освобождаването главно на двувалентен Са 2+ и Mg 2+, при алкална диета - освобождаването на всички катиони.
Нарушения на киселинно-алкалния баланс
Системата за хомеостатичен киселинно-алкален баланс по своята същност не е в състояние да бъде непрекъснато в състояние на напрежение за дълго време при наличие на смущаващи влияния. Нарушенията на киселинно-алкалната хомеостаза могат да възникнат в резултат на продължително продължително действие дори на умерено интензивни смущаващи фактори или ако влиянието на смущаващите фактори е краткосрочно, но тяхната интензивност надхвърля възможностите на спешно мобилизираните хомеостатични механизми. Абсолютната или относителна недостатъчност на хомеостатичните механизми (или техните резервни възможности) може да стане основа за нарушения на киселинно-алкалния баланс на вътрешната среда на тялото и да доведе до ацидоза или алкалоза.Понастоящем ацидозата е нарушение на киселинно-алкалния баланс, при което в кръвта се появява относителен или абсолютен излишък на киселини. Алкалозата се характеризира с абсолютно или относително повишаване на количеството на основите в кръвта. Според степента на компенсация всички ацидози и алкалози се делят на компенсирани и некомпенсирани. Компенсираната ацидоза и алкалоза също са състояния, при които абсолютните количества на H 2 CO 3 и NaHCO 3 се променят, но съотношението NaHCO 3 /H 2 CO 3 остава в нормални граници (около 20:1). Ако определеното съотношение се поддържа, pH на кръвта не се променя значително. Съответно, некомпенсираната ацидоза и алкалоза са състояния, при които се променя не само общото количество H 2 CO 3 и NaHCO 3, но и тяхното съотношение, което води до промяна на рН на кръвта в една или друга посока (Weisberg N. F., 1977).
Понятията „негазова ацидоза“ и „метаболитна ацидоза“ (или алкалоза) се използват като синоними. Подобно идентифициране на термини обаче не може да се счита за оправдано. Негазовата ацидоза (алкалоза) е сборно понятие, което включва всички възможни форми на нарушения на киселинно-алкалната хомеостаза, водещи до първична промяна в съдържанието на бикарбонат в кръвта, т.е. знаменателя на фракцията в уравнението:
| H2CO3 | |||
| NaHC03 |
Развитието на негазова ацидоза може да се дължи на:
- увеличаване на доставките на киселини отвън;
- метаболитни нарушения, придружени от натрупване на органични киселини, неспособност на бъбреците да отстраняват киселини или, обратно, прекомерна екскреция на буферни основи през бъбреците и стомашно-чревния тракт.
Следователно само тези ацидози, които се развиват в резултат на метаболитни нарушения, водещи до прекомерно натрупване на киселини, могат да бъдат наречени метаболитни ацидози в тесния смисъл на думата. Ацидозите, причинени от затруднено отстраняване на киселини от тялото или прекомерна загуба на буферни аниони, трябва да се класифицират като екскреторни ацидози.
Въз основа на горните съображения класификацията на нарушенията на киселинно-алкалния баланс може да бъде представена под формата на следната диаграма.
- Газо-респираторен (натрупване на въглероден диоксид):
- затруднено отстраняване на въглероден диоксид поради проблеми с дишането;
- висока концентрация на въглероден диоксид в заобикаляща среда(затворени пространства, мини, подводници и др.);
- неизправности на анестезиологично-дихателно оборудване (рядко!).
- Негаз (натрупване на нелетливи киселини):
- Метаболитен:
- кетоацидоза, дължаща се на повишено производство или нарушено окисление и ресинтез на кетонни тела (захарен диабет, гладуване, чернодробна дисфункция, треска, хипоксия и др.)
- лактатна ацидоза поради повишено производство, намалено окисление и ресинтез на млечна киселина (хипоксия, нарушена чернодробна функция, инфекции и др.);
- ацидоза поради натрупване на други органични и неорганични киселини (обширни възпалителни процеси, изгаряния, наранявания и др.).
- Отделителна:
- задържане на киселина при бъбречна недостатъчност (дифузен нефрит, уремия);
- загуба на алкали, бъбречна (бъбречна тубулна ацидоза, обезсоляващ нефрит, хипоксия, сулфонамидна интоксикация); загуба на алкали, стомашно-чревни (диария, хиперсаливация)
- Екзогенни:
- продължителна консумация на кисели храни;
- прием на лекарства (NH 4 Cl);
- приемане на киселини през устата (рядко!)
- Комбинирани форми:
- кетоацидоза + лактатна ацидоза;
- метаболитен + отделителен;
- различни други комбинации.
- Метаболитен:
- Смесен (газ + негаз) при асфиксия, сърдечно-съдова недостатъчност, тежки състояния с нарушения на сърдечно-съдовата и дихателната система и др.).
- Дишане на газове:
- повишено отделяне на въглероден диоксид по време на нарушения на външното дишане с хипервентилационен характер;
- контролирано от хипервентилация дишане
- Без газ:
- Отделителна:
- алкална задръжка (повишена реабсорбция на алкални аниони (бази) от бъбреците);
- загуба на киселини (повръщане поради стеноза на пилора, чревна обструкция, токсикоза на бременността; хиперсекреция на стомашен сок);
- хипохлоремия-"метаболитен"
- Екзогенни:
- продължителен прием на алкални храни;
- прилагане на лекарства (бикарбонат и други алкални вещества)
- Отделителна:
СМЕСЕНИ ФОРМИ НА АЦИДОЗИ И АЛКАЛОЗИ (ПРИМЕРИ)
- Газова алкалоза + метаболитна ацидоза (височинна болест, загуба на кръв);
- Газова алкалоза + бъбречна тубулна ацидоза (сърдечна недостатъчност и лечение с инхибитори на въглероден анхидрид);
- Артериална газова алкалоза + венозна газова ацидоза (дишане на чист кислород под високо налягане) и др.
Хомеостатични процеси при ацидоза и алкалоза и техните нарушения.С развитието на ацидоза настъпват следните промени в буферните системи и регулаторните механизми. Ако ацидозата е причинена от излишък на силна киселина, например НС1, тогава ще настъпят следните реакции:
- НС1 + NaHCO 3 H 2 CO 3 + NaCl.
следователно
т.е. възниква известен излишък на H2CO3 и известен дефицит на NaHCO3.
- Излишъкът на H 2 CO 3 (H + и CO 2) предизвиква повишена активност на дихателния център, което води до хипервентилация и измиване на CO 2 от кръвта.
- Излишък от H 2 CO 3 NaHCO 3 + NaH 2 PO 4. Тази реакция осигурява до известна степен елиминиране на дефицита на NaHCO3.
- NaHCO 3 се попълва до голяма степен поради обмена на йони между еритроцитите и плазмата съгласно правилото на Donnan, т.е. C1 - йони навлизат в еритроцитите, създавайки излишък от Na + йони в плазмата, който, комбинирайки се с излишъка на HCO - 3, образуват бикарбонат.
- HCl + Na 2 HPO 4 = NaH 2 PO 4 + NaCl, т.е. киселината е частично неутрализирана с основни фосфати.
- Киселината се екскретира чрез бъбреците под формата на Na + и K + соли или под формата на амониеви соли. Включването на тези механизми осигурява компенсация на получената ацидоза, която може да премине в некомпенсирана форма, ако буферните системи са изчерпани или има недостатъчност на отделителните процеси.
Най-честите форми на ацидоза са:
Метаболитна ацидоза, в резултат на натрупването на междинни киселинни метаболитни продукти, като кетонови тела (ацетооцетна, β-хидроксимаслена киселина), млечна киселина и други органични киселини. Хиперкетонемията може да се развие в резултат на повишено производство на кетонови тела, например с намаляване на съдържанието на гликоген в черния дроб, както и с интензивно разграждане на мазнините; за нарушения на цикъла трикарбоксилни киселиниводещ до инхибиране на окислението на кетонните тела; с кислородно гладуване, намалено производство на NADP и инхибиране на техния ресинтез. Често има комбиниран ефект от няколко фактора, причиняващи хиперкетонемия (например при диабет на панкреаса). Концентрацията на кетонни тела при патологични състояния може да се увеличи десетки и стотици пъти. Значителни количества кетонни тела се екскретират от бъбреците под формата на натриеви и калиеви соли, което може да доведе до големи загуби на алкални йони и развитие на некомпенсирана ацидоза. Това състояние възниква при захарен диабет, гладуване (особено въглехидратно гладуване), висока температура, тежка инсулинова хипогликемия и при някои видове анестезия.
Ацидозата, дължаща се на натрупване на млечна киселина, е доста често срещана дори при здрави хора. Краткосрочната ацидоза възниква при интензивна мускулна работа, особено при нетренирани хора, когато концентрацията на млечна киселина се повишава поради относителна липса на кислород. Дългосрочна ацидоза от този вид възниква при тежко чернодробно увреждане (цироза, токсични дистрофии), при декомпенсация на сърдечната дейност, както и при намаляване на доставката на кислород към тялото, свързано с недостатъчно външно дишане и други форми на кислородно гладуване.
Негазова екскреторна ацидоза, дължаща се на намаляване на освобождаването на нелетливи киселини, се наблюдава при бъбречни заболявания, когато освобождаването на кисели фосфати, сулфати и органични киселини е затруднено, амоняогенезата се инхибира, докато буферните основи се освобождават повече или по-малко нормално. В резултат на това може да възникне ацидоза поради относителен или абсолютен излишък на H +. Такава ацидоза възниква при хроничен дифузен гломерулонефрит, нефросклероза и някои други тежки бъбречни увреждания. Декомпенсираната форма обикновено се наблюдава при уремия. Повишената екскреция на бикарбонат в урината възниква при някои интоксикации, например при продължителна употреба на сулфонамиди, които инхибират активността на карбоанхидразата и водят до отслабване на ацидогенезата. Ацидозата при нефрит се развива в резултат на първична недостатъчност на екскрецията на органични киселини в урината в свободна форма и под формата на амониеви соли. В същото време е доказано, че реабсорбцията на бикарбонат в бъбреците, когато са увредени, е намалена. Реакцията на урината при бъбречна ацидоза обикновено е неутрална или алкална. Компенсацията на ацидозата на фона на увреждане на бъбреците може да се постигне само чрез мобилизирането на голям брой катиони и преди всичко натрий от всички негови съединения. Значителен натриев резерв в този случай е скелетната система. Негазовата ацидоза може да се развие и при повишена секреция на алкали през стомашно-чревния тракт, например при диария при деца или при повръщане на алкален чревен сок.
Газовата ацидоза се характеризира с натрупване на въглена киселина в кръвта в резултат на недостатъчна функция на външното дишане или поради наличието на повече или по-малко значителни количества въглероден диоксид във вдишания въздух.
Възможността за развитие на смесени форми на ацидоза се основава по-специално на факта, че обменът на въглероден диоксид в белите дробове е приблизително 25 пъти по-интензивен от обмена на кислород. Следователно, когато отделянето на въглероден диоксид е затруднено поради увреждане на белите дробове или сърцето, се развива кислороден глад с последващо натрупване на недостатъчно окислени продукти на интерстициалния метаболизъм. Умерената компенсирана ацидоза протича без изразени клинични симптоми и се разпознава чрез изследване на буферните системи на кръвта, както и състава на урината. При задълбочаване на ацидозата един от първите клинични симптоми е учестеното дишане, което при некомпенсирана ацидоза се превръща в тежък задух. Некомпенсираната ацидоза също се характеризира с нарушения на сърдечно-съдовата система и стомашно-чревния тракт, до голяма степен поради факта, че ацидозата едновременно намалява активността на α- и β-адренергичните рецептори на сърцето, кръвоносните съдове и червата, намалявайки функционалния и метаболитен ефект на катехоламини.
Ацидозата води до повишаване на съдържанието на катехоламини в кръвта, следователно в процеса на нейното развитие се наблюдава повишаване на сърдечната дейност, увеличаване на сърдечната честота, увеличаване на минутния обем на кръвта и повишаване на кръвното налягане. първо отбелязано. Но когато ацидозата се задълбочи, активността на адренергичните рецептори намалява и въпреки повишеното съдържание на катехоламини в кръвта, сърдечната дейност се потиска и кръвното налягане пада. В този случай се появяват екстрасистоли и други ритъмни нарушения, включително камерно мъждене. Установено е също, че ацидозата рязко засилва парасимпатиковите ефекти, предизвиквайки бронхоспазъм и повишена секреция на бронхиалните жлези. От стомашно-чревния тракт се наблюдават повръщане и диария.
Когато има излишък на H + в плазмата, част от него се движи вътре в клетките в замяна на K +, който се отделя от протеините в кисела среда. От гледна точка на диагностиката плазмената концентрация на K + може да служи като признак за тежестта на "биохимичната травма" на телесните тъкани. Освен това част от йоните на HCO3 навлизат в клетките и неутрализират H + йони. Вместо HCO3, C1 - напуска клетките, осмотичното налягане на извънклетъчната течност се повишава и се развива извънклетъчна хиперхидрия. При некомпенсирана ацидоза настъпват тежки нарушения във функцията на централната нервна система. нервна система, първо се появяват замайване и сънливост, а след това, с развитието на ацидотична кома, настъпва пълна загуба на съзнание. Естествено, ацидотичните симптоми се комбинират със симптоми на основното заболяване, което е причинило ацидозата.
Алкалоза. С натрупването на алкални съединения в организма настъпват следните фундаментални промени в системата на хомеостатичното киселинно-алкално равновесие (в дадения пример NaOH условно се приема като алкално съединение).
- NaOH + H 2 CO 3 NaHCO 3 + H 2 0
следователно
H 2 CO 3 - изразходван H 2 CO 3 Образува се NaHCO3 + NaHCO3 създава се известен излишък на NaHCO 3 и дефицит на H 2 CO 3 .
- Дефицитът на H 2 CO 3 се компенсира, първо, чрез освобождаването на Cl - йони от еритроцитите и освобождаването на HCO - 3 йони от натриев бикарбонат: Cl - + NaHCO 3 NaCl + HCO 3. (HCO-3 йонът, заедно с H +, напускайки клетките в обмен на K + йони, образува H 2 CO 3; второ, при липса на H 2 CO 3, активността на дихателния център намалява, което води до намаляване на вентилацията и забавяне на освобождаването на въглероден диоксид от тялото.
- NaOH + NaH 2 PO 4 Na 2 HPO 4 + H 2 O, т.е. част от алкалите се свързват с киселинни фосфати.
- Излишъкът от NaHCO 3 и Na 2 HPO 4 се екскретира в урината, което спомага за поддържане на pH в нормални граници.
Докато буферните системи се изчерпят и бъбреците функционират нормално, алкалозата остава компенсирана и след това, ако механизмите за поддържане на рН не успеят, тя може да премине в некомпенсирана форма.
Най-голямо клинично значение има негазовата алкалоза, по-специално нейната гастроентерална форма, която се проявява при повръщане на кисело стомашно съдържимо (пилорна стеноза, чревна непроходимост). При бъбречни заболявания, придружени от загуба на способността за отделяне на Na +, K + катиони и др., Развива се бъбречната форма на негазовата алкалоза.
Газовата алкалоза е следствие от хипервентилация, която възниква по време на височинна болест, истерия, епилепсия и други състояния, когато повишената активност на дихателния център не е свързана с излагане на въглероден диоксид, както и при прекомерно изкуствено дишане. Симптомите на алкалозата се проявяват в отслабена дихателна функция и повишена нервно-мускулна възбудимост, което може да доведе до тетания. Това се дължи на намаляване на плазмените нива на Ca 2+. В същото време съдържанието на Cl - в плазмата се увеличава, количеството на амоняка в урината намалява (инхибиране на амониогенезата) и се отбелязва промяна в неговата реакция към алкалната страна (резултат от повишена екскреция на бикарбонати). Алкалозата повишава възбудимостта на β-адренергичните рецептори в сърцето, кръвоносните съдове, червата и бронхите, като същевременно намалява парасимпатиковите ефекти. Това се изразява в повишен сърдечен ритъм, придружен от спадане на системното кръвно налягане. От стомашно-чревния тракт се наблюдава запек поради забавена перисталтика. Не е открит ефект на алкалозата върху α-адренергичните рецептори.
Смесени форми на алкалоза могат да се наблюдават например при мозъчни наранявания, придружени от задух (газова алкалоза) и повръщане на кисел стомашен сок (безгазова алкалоза).
По време на изкуствена хипервентилация могат да възникнат комбинирани форми на нарушения на киселинно-алкалния баланс, водещи, от една страна, до газова алкалоза (повишено извличане на въглероден диоксид), а от друга - до метаболитна ацидоза (нарушена дисоциация на оксихемоглобина в тъканите по време на алкалоза) . Подобни нарушения възникват при височинна болест. Нарушенията на киселинно-алкалния баланс не винаги са придружени от изразени клинични симптоми, но постепенно подкопават защитните способности на организма, което впоследствие води до необратими нарушения.