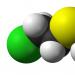
Видове изомерия в органични съединения
Изомерията е феномен на съществуването на изомери.Изомерът е нещо, което има същия състав на атоми, но различна по структура.
НО)Структурен изомер 1) Изомерия на въглеродния скелет.
Разграничаване в относителна позицияатоми C.
2) Изомерия според позицията на кратната връзка
(двойно).
3) От позицията на функционалната група Разлики в позицията на функционалната група спрямо въглеродния скелет.
AT)Пространствен изомер-I
Свързани с различното положение на атоми или групи от атоми спрямо двойната връзка (цис-(вана) и транс-изомери (фотьойл), огледална изоерия)
Ограничете въглеводородите, техните химични свойства.
Алканите (парафините) са наситени (ограничаващи) въглеводороди с отворена верига. Те имат обща формулаСnН2n+2, В алканите въглеродните атоми са свързани един с друг само чрез прости (единични) връзки, а останалите въглеродни валентности са наситени с водородни атоми. Характерният суфикс за наситените въглеводороди е an.,
CH4 - метан; C2H6 - етан; С3Н8 - пропан
С4Н10 - бутан (2 изомера)
С5Н12 - пентан (3 изомера)
С6Н14 - хексан, С7Н16 - хептан
Химични свойства:
1) Заместване: CH4+Cl2→CH3Cl+HCl (метил хлорид)
CH3Cl+HCl→CH2Cl2+HCl (метиленхлорид) CH2Cl2+Cl2→CHCl3+HCl (хлороформ)
3) Нитриране: характеристика на наличието на вторичен или третичен въглероден атом.

Област КОНОВАЛОВ
4) При температура 100-500ºС и достъп на кислород се образуват мастни киселини, а при температура 500-600ºС се наблюдава процес на крекинг
R-I горя CH4+2O2 →CO2+H20 (пълен), 2CH4+O2à2CO+4H2 (незавършен)
Каталитично окисление на 2CH3-CH2-CH2-CH3 + 5O2 → 4CH3COOH (оцетна киселина),
Реакция на отщипване: (пукане)
![]()
Изомеризация ![]()
![]()
Получаване на алкани.
Получаване на метан
в индустрията:
1. Фракциониране на природен газ и дестилация на нефт.
2. Синтез на елементи при висока температура (волтаична дъга),
C + 2H2 →CH4
Химични методи за получаване: 1) От соли на органични киселини. Сливане на натриев ацетат с алкали: CH3COONa + NaOH →CH4 + Na2CO3
2) Wurtz синтез: CH3Cl+2Na+ClCH2-CH3→2NaCl+C3H8
3) От магнезиеви органични съединения: CH3Br+Mg→CH3MgBr
CH3MgBr+H2O→CH4+Mg(OH)Br
4) Синтез на Бертло: C2H5I+HI→C2H6+I2
5) От алкени
6) Възстановяване на халогенирани алкани. CH3Cl+H2→(p,pt)→CH4+HCl
Правила за ориентация
1. Заместителите, присъстващи в бензеновото ядро, насочват нововлизащата група към определени позиции, т.е. имат ориентиращ ефект.
2. Според насочващото си действие всички заместители са разделени на две групи: ориентатори от първи види ориентатори от втори вид.
Ориенти от 1-ви вид (орто двойка-ориенти) насочват последващото заместване главно в орто- и двойка-провизии.
Те включват донор на електронигрупи (електронните ефекти на групите са посочени в скоби):
R( +аз); -ох (+M,-I); -ИЛИ (+M,-I); -NH2 (+M,-I); -NR 2 (+M,-I)
+M-ефектът в тези групи е по-силен от -I-ефекта.
Ориенти от 1-ви вид увеличават електронната плътност в бензоловия пръстен, особено върху въглеродните атоми в орто- и двойка-позиции, което благоприятства взаимодействието на тези атоми с електрофилни реагенти.  пример:
пример:

Ориенти от 1-ви вид, като увеличават електронната плътност в бензеновия пръстен, повишават неговата активност в реакциите на електрофилно заместване в сравнение с незаместения бензен.
Специално място сред ориентантите от 1-ви вид заемат халогените, които проявяват изтегляне на електрониИмоти:- Ф (+М<–I
), -кл (+М<–I
), -Бр (+М<–I
).
Битие орто двойка-ориенти, те забавят електрофилното заместване. Причината е силна –Аз-ефектът на електроотрицателните халогенни атоми, който понижава електронната плътност в пръстена.
Ориентатори от 2-ри вид ( мета-ориенти)директно последващо заместване предимно на мета- позиция.
Те включват изтегляне на електронигрупи:
-НЕ 2 (-М, -Аз); -COOH (-М, -Аз); -СН=О (-М, -Аз); -SO3H (–Аз); -NH3+ (–Аз); -CCl 3 (–Аз).
Ориенти от 2-ри вид намаляват електронната плътност в бензоловия пръстен, особено в орто- и двойка-провизии. Следователно електрофилът атакува въглеродните атоми не в тези позиции, а в мета-позиция, където електронната плътност е малко по-висока.
пример:
Всички ориентанти от 2-ри вид, намалявайки общата електронна плътност в бензоловия пръстен, намаляват неговата активност в реакциите на електрофилно заместване.
По този начин, лекотата на електрофилното заместване на съединенията (посочени като примери) намалява в серия:
толуен C 6 H 5 CH 3 > бензен C 6 H 6 > нитробензен C 6 H 5 NO 2.
Chem. свят.
РЕАКЦИИ НА ДОБИВАНЕ
1. Хидрогенирането на карбонилни съединения, като алкени, протича в присъствието на ката-
лизери (Ni, Pt, Pd). От алдехидите при редукция се образуват първични алкохоли.
вие, H-COH + H2 → CH3OH;
2. Добавяне на H2O
R-COH+H2O=R-CH(OH)2 (дихидролен алкохол) 3. Взаимодействие със сенилна киселина R-COH+H-CN=R-CH(OH)(CN) (оксинитрил)
4. Взаимодействие с алкохоли R-COH+R1-OH=R-CH(OR1)(OH)(хемацетал) R-COH+R1-OH=(t* HCl)=R-CH(OR1)(OR1) (ацетал )
РЕАКЦИИ НА ЗАМЕСТВАНЕ НА КАРБОНИЛНАТА ГРУПА
CH3-COH+PCl5→CH3-CHCl2+POCl3
РЕАКЦИИ ПОРАДИ ЗАМЕСТВАНЕ В РАДИКАЛ
CH3-COH+Br2=Br-CH2-COH+HBr (бромоацеталдехид)
R.ОКИСЛЕНИЕ
CH3-COH+Ag2O→CH3COOH+2Ag
Р.АЛДОЛ КОНЦЕНТРАЦИЯ
CH3COH+ CH3COH→CH3-CH(CH3)-CH2-COH→CH3-CH=CH-COH+H2O
Получаване на алдехиди.
Алдехидите включват органични съединения, които имат в състава си карбонилна група C=O, комбинирана в алдехиди с един въглеводороден радикал
1 окисление на метанол върху меден катализатор при 300O
CH3OH + O2 → 2H-COH(формалдехид, мравчен алдехид) + 2H2O;
2. Дехидрогениране на метанол в газова фаза на катализатор (Cu, Ni).CH3OH→H-COH + H2
С2H2 + H2O CH2=CH-OH CH3-COH(оцетен анедр
3 АЛКАЛНА ХИДРОЛИЗА НА ДИХАЛОГЕНЕРИВАТИ
CH3-CHCl2+2NaOH→CH3-C(OH)3+2NaCl→CH3COH+H2O+2NaCl
4. R.KUCHEROVA CH≡CH+H2O→CH3COH
дикарбоксилни киселини.
Карбоксилните киселини са производни на въглеводороди, съдържащи
една или повече карбоксилни групи. Общата формула за карбоксилни киселини е R-COOH. Карбоксилната група от своя страна се състои от
карбонилни (> C \u003d O) и хидроксилни (-OH) групи В зависимост от броя на карбоксилните групи, карбоксилните киселини се разделят на
едноосновни (монокарбоксилни), двуосновни (дикарбоксилни) и многоосновни киселини. Това са органични съединения, съдържащи две карбоксилни групи. Двуосновни киселини
HOOS-COOH оксалова киселина (етандий)
HOOS-CH2-COOH малонов пропан
HOOS-CH2-CH2-COOH кехлибар (бутан)
HOOC-CH2-CH2-CH2-COOH пентандиова, глутарова
HOOC-CH2-CH2-COOH янтарна \u003d (-H2O) \u003d янтарна анхидрид
ПОЛУЧАВАНЕ:
1) окисление на 2 атомни алкохола CH2(OH)-CH2(OH)→[O],-H2O→COH-COH→[O]→COOH-COOH
2) от дихалогенни производни Cl-CH2-CH2-Cl→(2KCl)→N≡C-CH2-CH2-C≡N→(+6H2O,-2NH3)→HOOC-CH2-CH2-COOH+2H2O
ХИМИЧЕСКИ ST-VA
1) реакции на заместване
COOH-COOH→(+NaOH,-H2O)→COONa-COOH→(+NaOH,-H2O)→COONa-COONa
2) отделяне на CO2 при нагряване
COOH-COOH→CO2+HCOOH
COOH-CH2-COOH→CO2+CH3COOH
3) отделяне на H2O при нагряване
COOH-CH2-CH2-COOH→(t,-H2O)→ (-CH2-COOOC-CH2-)ЦИКЪЛ
4) COOH-COOH→[O]→CO2+CO+H2O
5) COOH-CH2-COOH+2C2H5O→CO(O-C2H5)-CH2-CO(O-C2H5)+H2O
6) COOH-CH2-CH2-COOH+2NH4OH→COOHNH4-CH2-CH2-COONH4→(-H2O)→CONH2-CH2-CH2-CONH2→(-NH3)→(-CH2-C(O)-NH-C (O)-CH2-)→(-CH=CH-NH-CH=CH-)
Него св-ва
1) Хар-ни всички реакции към окисляването на карбоксилната група
Образуване на етер
Образуване на два вида естери
Разлагане при нагряване
Отделяне на вода при нагряване (алфа киселини)
Бета киселини
Гама киселина
Оптична изомерия.
Коламин
Спокоен
Лецитин

![]()
Ди- и трипептиди.
– Това са органични вещества, чиито молекули са изградени от аминокиселини, свързани с пептидна връзка. В зависимост от броя на аминокиселините, включени в молекулата, се разграничават дипептиди, трипептиди и др., както и полипептиди. По правило пептидните молекули са линейни, като единият край на веригата завършва с карбоксилна група ( -COOH), а другият с аминогрупа ( -NH2). Но веригата може да бъде затворена и в циклична структура. Добавянето става поради освобождаването на вода от карбонилната група на единия a/c и аминогрупата на другия. Тъй като протеините се синтезират под формата на полипептидни вериги, границата между полипептид и прост протеин е произволна. Пептидите са много важни вещества за организмите – някои хормони, антибиотици, токсини.
Нуклеозиди и нукпеотиди.
Нуклеинова киселинаса изградени от мононуклеотиди. Нуклеотидсе състои от три компонента: 1 азотна основа (пурин или перимедин), 2 .захар: рибоза (C 5 H 10 O 5) или дезоксирибоза C 5 H 10 O 4 ., фосфорна киселина. Пуринови основи.Предшественикът е PUREEN:
пиримидинови основи.ПИРИМИДИН:
Азотни основи:АМФаденозин монофосфат (аденилова киселина):
АТФ аденозин трифосфат:
Нуклеозидиса нуклеотиди без фосфорна киселина. аденозин:
Присъединяването на фосфор към вас е възможно в три позиции на рибозните хидроксогрупи: 2, 3, 5. Аденин, гуанин и цитозин са включени както в ДНК, така и в РНК. Тимин - само в ДНК, урацил - само в РНК.
Схема на структурата на РНК и ДНК.
структура на ДНК:ДНК веригата е въглехидратно-фосфатна последователност, към която са прикрепени азотни бази. Молекулите на фосфорната киселина комбинират молекули оксирибоза, OH 3 и 5 въглеродни групи. Молекулата на ДНК има 2 вериги от нуклеотиди, успоредни една на друга. Тези две вериги се държат заедно чрез водородни връзки. Допълняемостта осигурява еднакво разстояние между азотните основи. Последователността на азотните бази от едната верига стриктно съответства на последователността на основите на другата верига.
структура на РНК. верига от РНКтова е последователност от рибонуклеотиди, свързани в една верига. (линейна структура) . Свързването на рибонуклеотидите един с друг се осъществява чрез етерна връзка между 3-та -ТОЙрибози на един нуклеотид и 5-ти -ТОЙрибоза на следващия нуклеотид. Азотните бази на РНК са A и G (пурин) и C и U (пиримидин). A и G са прикрепени към пентозата чрез н 9-та позиция. C и U - през N атома в 1-ва позиция. Отличителна черта на ДНК от РНК е, че тя няма стабилна спирална структура. Тя е линейна. РНК)
Диализа. Електрофореза.
Диализата е метод за пречистване на протеинови разтвори от нискомолекулни примеси. За диализа е необходим цилиндър, в който вместо ден PPM, чиито пори позволяват на малки молекули да преминават, но не пропускат протеинови молекули. Цилиндър с протеинов разтвор с примеси се потапя в съд с дестилирана вода. Малките примесни молекули свободно преминават през порите на мембраната, като са равномерно разпределени между регионите вътре и извън цилиндъра. За пълно почистване цилиндърът трябва да бъде потопен в течаща вода. Диализата се използва за пречистване на протеиновите разтвори на фармацевтичната индустрия. Този метод е в основата на "изкуствен бъбрек".
Електрофорезата е метод за разделяне на протеини на отделни фракции. Работата на апарата eff се основава на способността на заредените протеинови молекули да се движат в електрическо поле към противоположно зареден електрод. Различни молекули - различна скорост, в зависимост от молекулното тегло, общия заряд, формата. Устройството за ef се състои от хоризонтален носител (хелий) и електроди, които създават електрическо поле. Върху носителя се нанася разтвор с електролити. Тестовият разтвор се прилага към началната зона и се прилага напрежение. След определен период от време протеините с различни молекулно теглоразпределени в зони. От всяка зона могат да бъдат извлечени и количествено определени протеини.
Катализа. Видове катализа.
Катализата е химично явление, чиято същност е да се промени скоростта химична реакцияпод действието на определени вещества (те се наричат катализатори).
Хомогенна катализа - катализаторът и реагентите са в една и съща фаза.
Хетерогенна катализа - катализаторът обикновено е твърд и реакцията протича на повърхността му.
Адсорбция, същност, значение.
Адсорбцията е утаяване на частици върху повърхността на адсорбента. Активният въглен в противогазите предпазва от въздействието на отровните газове.
67) Хроматография:
Хроматографията е метод за разделяне и анализиране на смеси от вещества и изследване на физиката. химични свойствавещества, се основава на разпределението на компонентите между две фази: подвижна и неподвижна. Неподвижният служи твърдо(сорбент) или филм от течност, отложен върху твърдо вещество. Подвижната фаза е течност или газ, протичащи през неподвижна фаза. Възможно е да се пречисти веществото от примеси.
Феноменът на дифузията.
Дифузията е едностранно преминаване на разтворено вещество от по-висока концентрация към по-ниска.
Видове химически връзкив органични съединения
Ковалентната връзка е вътрешномолекулна химична връзка, осъществявана от една или повече електронни двойки, силно взаимодействащи с ядрата на двата свързани атома.
Сигма връзка - връзка, образувана в резултат на припокриване на електронни облаци и разположена на права линия, свързваща центровете на ядрата на атомите.
Pi - връзка - връзка, образувана в резултат на припокриване на електронни облаци и разположена извън правата линия, свързваща центровете на ядрата на атомите.
1. Електронна структура на въглеродния атом;
2. Хибридизация на атомни орбитали;
3. Естеството на химическата връзка;
4. Видове химична връзка.
Когато се образува химична връзка, енергията се освобождава, така че появата на две нови валентни възможности води до освобождаване на допълнителна енергия (1053,4 kJ/mol), което надвишава енергията, изразходвана за разпадане на 2s електрони (401 kJ/mol).
Орбитали с различни форми (s, p) се смесват по време на образуването на връзка, давайки нови еквивалентни хибридизирани орбитали (хибридизационна теория, L. Pauling, D. Slater, 1928-1931). Концепцията за хибридизация се прилага само за молекули, а не за атоми и само орбиталите влизат в хибридизация, а не електроните върху тях.
За разлика от нехибридизираните s- и p-орбитали, хибридната орбитала е полярна (електронната плътност е изместена) и е в състояние да образува по-силни връзки.

Валентни състояния на въглеродния атом
|
вал. комп. |
взаимодействащи орбитали |
Космос страница |
Тип комуникация |
вал. ъгъл |
|
|
тетраедрични | |||
|
| ||||
|
|
линеен |
С промяна на вида на хибридизация на въглероден атом, неговите свойства също се променят. При прехода от sp 3 към sp-, фракцията на s-орбитала в състава на хибридизирания облак се увеличава, което води до промяна в неговата форма. Границите на електронния облак са по-близо до ядрото в случай на sp 2 и sp-орбитали, в сравнение с sp 3 облака. Това се отразява в увеличаване на електроотрицателността на въглеродния атом в серията: sp 3< sp 2 < sp. В связи с этим, уменьшается ковалентный радиус, увеличивается полярность связи.
Видове химична връзка
Йонна връзка
Възниква в случай на пълно освобождаване на електрони от едни атоми и тяхното придобиване от други. В този случай атомите се превръщат в йони.
ковалентна връзка
Образува се от споделянето на електрони. Свързването на атомите в една молекула се осъществява от електронна двойка, принадлежаща едновременно на два атома. Социализацията на електроните е възможна по два начина:
1) колигиране (обменен механизъм);
2) координация (донорно-акцепторен механизъм).
Има два вида ковалентни връзки: σ (сигма)- и π (pi)-връзки.

σ-връзката е единична ковалентна връзка, образувана, когато атомните орбитали се припокриват по права линия (ос), свързваща ядрата на два свързани атома с максимално припокриване на тази права линия.
π-връзката е връзка, образувана от страничното припокриване на нехибридизирани стр z-атомни орбитали с максимално припокриване от двете страни на правата линия, свързваща ядрата на атомите.
Количествени характеристики на ковалентната връзка
1. Енергията на връзката е енергията, освободена по време на образуването на връзка или необходима за нейното прекъсване.
2. Дължината на връзката е разстоянието между центровете на свързаните атоми.
3. Полярност на връзката – неравномерно разпределение на електронната плътност.
4. Поляризация на връзката - изместване на електроните на връзката под въздействието на външно електрическо поле, включително друга реагираща частица.
Междумолекулни взаимодействия

| Име на параметъра | смисъл |
| Тема на статията: | Химични връзки в органични съединения |
| Рубрика (тематична категория) | Образование |
Повечето органични съединения съдържат само няколко основни елемента: въглерод, водород, азот, кислород, сяра и много по-рядко други елементи. Τᴀᴋᴎᴍ ᴏϬᴩᴀᴈᴏᴍ, цялото разнообразие от органични съединения се определя, от една страна, от техния качествен и количествен състав, а от друга страна, от реда и естеството на връзките между атомите.
1.1 Електроотрицателност на елементите
Електроотрицателност на атома - ϶ᴛᴏ способността му да привлича елементи. Стойностите на електроотрицателността нямат значението на константи, а показват само относителната способност на атомите да привличат електрони по-силни или по-слаби, когато се образуват с други атоми.
Атомите, разположени в серията на електроотрицателността преди въглерода и имащи стойност на електроотрицателност по-малка от 2,5 увеличават електронната плътност на въглеродния атом, когато образуват връзка с него. Обратно, атоми, чиято стойност на електроотрицателност надвишава 2,5, понижават електронната плътност на въглеродния атом, когато се образува връзка.
1.2 Йонна връзка
Електронната конфигурация за всеки атом може да бъде формирана по два различни начина. Един от тях е електронен трансфер: атомите на един елемент даряват електрони, които се прехвърлят към атомите на друг елемент. В случая се получава т.нар йонна (електровалентна, хетерополярна) връзка:
Атом, който дарява електрони, става положителен йон катион); атом, който е приел електрон в отрицателен йон ( анион).
Отличителни черти на йонните съединения са мигновени реакции, дисоциация и разтваряне на йони във водни разтвори, високи точки на топене и кипене, разтворимост в полярни разтворители, електропроводимостразтвори и стопилки.
Хетерополярна връзка възниква между атоми, които са много различни по електроотрицателност.
1.3 Ковалентна връзка
При взаимодействието на атоми, които са равни или близки по електроотрицателност, не се осъществява електронен трансфер. Образуването на електронна конфигурация за такива атоми става в резултат на обобщаването на два, четири или шест електрона от взаимодействащи атоми. Всяка от обобщените двойки електрони образува един ковалентна (хомеополярна) връзка:
Най-важните физически параметриКовалентните връзки са тези, които характеризират тяхната симетрия, размер, електрически и термохимични свойства.
Дължина на връзката- ϶ᴛᴏ е равновесното разстояние между центровете на ядрата и зависи от това с какви други атоми са свързани. Да, дължината C-C връзкивъз основа на околната среда варира в рамките на 0,154 - 0,14 nm.
Валентни ъглиса ъглите между линиите, свързващи свързаните атоми. Познаването на дължините на връзките и ъглите на връзката е изключително важно за изграждането на правилен пространствен модел, разбирането на разпределението на електронната плътност и се използва в квантово-химичните изчисления.
Енергия на разрушаване на химическа връзка- ϶ᴛᴏ енергията, изразходвана за разрушаване на тази връзка или освободена по време на нейното образуване на мол частици. В случай на молекули, съдържащи две или повече еднакви връзки, се прави разлика между енергията на скъсване на една от тези връзки или средната енергия на скъсване на тези връзки. Колкото по-висока е енергията на химическата връзка, толкова по-силна връзка. Една връзка се счита за силна или силна, ако нейната енергия надвишава 500 kJ/mol, слаба, ако нейната енергия е по-малка от 100 kJ/mol. Ако при взаимодействието на атомите се отдели енергия под 15 kJ/mol, тогава се счита, че не се образува химическа връзка, а се наблюдава междумолекулно взаимодействие. Силата на връзката обикновено намалява с увеличаване на дължината на връзката.
Полярност на химичните връзки- характеристика на химическа връзка, показваща промяна в разпределението на електронната плътност в пространството около ядрата в сравнение с разпределението на електронната плътност в неутралните атоми, образуващи тази връзка. Познаването на полярността на връзката е изключително важно за преценката на разпределението на електронната плътност в молекулата и следователно естеството на нейната реактивност.
Комуникационна поляризуемостизразяващо се в изместване на електроните на връзката под въздействието на външно електрическо поле, вкл. и друга реагираща частица. Поляризацията се определя от подвижността на електроните. Електроните са по-подвижни, колкото по-далеч са от ядрата.
1.4 Прекъсване на връзките
Разрушаването на ковалентна връзка между два атома може да се случи по различни начини:
Кога авсеки атом е разделен с един електрон, което води до образуването на частици, наречени радикали, и са силно реактивни поради наличието на несдвоен електрон; тази празнина се нарича хомолитично разцепваневръзки. В случаите би ведин атом може да задържи и двата електрона, оставяйки другия атом без електрони, което води до отрицателен и положителен йон, съответно. Ако атомите R и X не са идентични, разделянето може да продължи по един от тези пътища, в зависимост от това кой атом - R или X - държи двойка електрони. Такива прекъсвания се наричат хетеролитично разцепванеи водят до образуването на йонна двойка.
Химични връзки в органичните съединения - понятие и видове. Класификация и характеристики на категорията "Химически връзки в органични съединения" 2017, 2018.
Задача номер 1
Обяснение:
1) Дехидрохалогениране на хлорбутан под действието на алкохолен разтвор на алкали:
2) Окисление на двойната връзка на бутен-1 с подкиселен разтвор на калиев перманганат (разкъсване на двойната връзка):
3) Реакция на естерификация - образуването на естер от алкохол и карбоксилна киселина:
4) Алкална хидролиза на изопропил пропионат с образуване на натриев пропионат и изопропилов алкохол:
5) Сливане на сол на пропионова киселина с алкали за образуване на етан и натриев карбонат:
Задача номер 2
Напишете уравненията на реакцията, които могат да се използват за извършване на следните трансформации:
Обяснение:
1) От натриев ацетат метанът се получава чрез реакция на декарбоксилиране, която се случва, когато се слее с алкали, например, натриев хидроксид:
2) Когато метанът взаимодейства с хлора в моларно съотношение едно към едно, се образуват предимно монохлорометан (X 1) и хлороводород:
3) Когато монохлорометанът се третира с воден разтвор на алкали, нуклеофилното заместване на хлорния атом с хидроксилната група настъпва с образуването на метилов алкохол (X 2):
4) Метанал (формалдехид) може да се получи от метилов алкохол, като действа като слаб окислител - меден (II) оксид при нагряване:
5) Калиев перманганат, подкиселен със сярна киселина, окислява метанала до въглероден диоксид и вода. В същото време, тъй като средата на разтвора е кисела, перманганатният йон се редуцира до двувалентен манган:
Задача номер 3
Напишете уравненията на реакцията, които могат да се използват за извършване на следните трансформации:
Когато пишете уравнения на реакциите, използвайте структурни формули органична материя.
Обяснение:
1) Когато бромоводородът действа върху пропанол-1, протича реакцията на заместване на хидроксилната група в алкохола с бромен атом с образуването на 1-бромпропан (X 1)
2) Можете да получите пропен от 1-бромпропан чрез реакцията на дехидробромиране с алкохолен разтвор на алкали, например натриев хидроксид:
3) В кисела среда пропенът може да реагира с вода в съответствие с правилото на Марковников - водородът отива към най-хидрогенирания атом, а хидроксилната група към най-малко хидрогенирания. Това произвежда изопропилов алкохол:
4) Изопропилов алкохол (X 2), когато се окислява с калиев перманганат във воден разтвор, се превръща в ацетон, докато тъй като средата на разтвора е неутрална, перманганатният йон се редуцира от +7 степен на окисление до +4 степен на окисление - се образува манганов диоксид:
5) Ацетонът може да се превърне в изопропанол (X 2) чрез реакция на хидрогениране при нагряване, като се използва катализатор за хидрогениране като никел:
Задача номер 4
Напишете уравненията на реакцията, които могат да се използват за извършване на следните трансформации:
Когато пишете уравнения на реакциите, използвайте структурните формули на органичните вещества.
1) Когато сол на карбоксилна киселина се калцинира с излишък от алкали, се образува въглеводород, в този конкретен случай бензен (X 1):
2) Бензенът влиза в реакция на алкилиране с пропен в присъствието на киселинни катализатори и се образува кумол (X 2):
3) Кумолът реагира с хлор на светлина чрез верижен радикален механизъм. При липса на хлор водородният атом при третичния въглероден атом се замества главно:
4) Когато хлорното производно е изложено на алкохолен разтвор на алкали, хлороводородът се отделя:
5) В последната реакция на пръв поглед може да се помисли, че се осъществява превръщането на въглеводород с двойна връзка в съответния диол, но за да се образува гликол, е необходимо охлаждане (0-10 ° C) и не отопление. При нагряване ще настъпи дълбоко окисление до калиев бензоат и калиев карбонат.
Проблемът е, че очевидно в тази задача на банката FIPI, която между другото попадна на някои на ранния изпит USE през април 2016 г., има печатна грешка и това означаваше 0 o C, а не отопление.
Задача номер 5
Напишете уравненията на реакцията, които могат да се използват за извършване на следните трансформации:
Когато пишете уравнения на реакциите, използвайте структурните формули на органичните вещества.
1) При действие върху бромоетан воден разтворалкали, протича нуклеофилното заместване на бромния атом за хидроксидния йон с образуването на етилов алкохол (X 1):
2) Етиловият алкохол (X 1) може да се превърне в оцетна киселина чрез окисляването му с воден разтвор на калиев перманганат в кисела среда при нагряване:
3) Оцетната киселина влиза в реакция на неутрализация с алкали, например с натриев хидроксид, и се образува натриев ацетат (X 2):
4) След изпаряване на воден разтвор на натриев ацетат (X 2) и сливане на получения твърд натриев ацетат с твърд натриев хидроксид, настъпва реакция на декарбоксилиране с образуването на метан (X 3) и натриев карбонат:
5) Пиролизата на метан при 1500 o C води до образуването на ацетилен (X 4) и водород:
Задача номер 6
Напишете уравненията на реакцията, които могат да се използват за извършване на следните трансформации:
Когато пишете уравнения на реакциите, използвайте структурните формули на органичните вещества.
1) Пропилацетатът, като естер, претърпява алкална хидролиза за образуване на калиев ацетат (X 1) и пропанол:
2) От калиев ацетат, чрез реакцията на декарбоксилиране, която се получава, когато се кондензира с алкали, се получава метан:
3) При температура 1200 o C и бързо охлаждане (за да се предотврати разлагането на ацетилена до прости вещества) метанът се разлага на ацетилен (X 2) и водород:
4) Димеризацията на ацетилена протича в присъствието на катализатори - разтвор на солна киселина на медни (I) и амониев хлориди - с образуването на винилацетилен:
5) Когато винилацетиленът премине през бромна вода, бромната вода се обезцветява поради добавянето на бром към множество връзки с образуването на наситено бромо производно на бутан - 1,1,2,2,3,4-хексабромобутан (X 3 ):
Задача номер 7
Напишете уравненията на реакцията, които могат да се използват за извършване на следните трансформации:
Когато пишете уравнения на реакциите, използвайте структурните формули на органичните вещества.
1) В промишлеността формалдехидът се получава чрез окисляване на метан върху алуминиев фосфатен катализатор при температура 450 o C и налягане 1-2 MPa:
2) По време на хидрогениране върху катализатори (Pt, Pd, Ni) карбонилната група на формалдехида се редуцира до хидроксил, т.е. алдехидът се превръща в алкохол - метанол (X 1):
3) Металният натрий реагира с метанол, за да образува натриев метоксид (X 2) и освобождава водород:
4) При реакция със солна киселина, натриевият метоксид се превръща обратно в метанол (X 1):
5) Калиев перманганат в кисела среда, когато се нагрява, окислява метиловия алкохол до въглероден диоксид (X 3) (Mn +7 → Mn +2; C -2 → C +4):
Задача номер 8
Напишете уравненията на реакцията, които могат да се използват за извършване на следните трансформации:
1) В присъствието на алуминиев оксид при температура 400 o C, алкохолът се дехидратира с образуването на етилен (X 1) и вода:
2) Калиевият перманганат в неутрална среда окислява етилена до етиленгликол (X 2) (Mn +7 → Mn +4; 2C -2 → 2C -1):
3) Под действието на излишък от бромоводород върху етиленгликол, хидроксилните групи се заменят с бромни аниони, което води до образуването на 1,2-дибромоетан (X 3):
4) Етин (или ацетилен) може да се получи чрез действието на алкохолен разтвор на алкали върху 1,2-дибромоетан:
5) Според реакцията на М.Г. Кучеров, в присъствието на живачни соли в кисела среда (във воден или алкохолен разтвор), ацетиленът се превръща в етанал:
Задача номер 9
Напишете уравненията на реакцията, които могат да се използват за извършване на следните трансформации:
1) Можете да получите ацетон (пропанон) чрез реакцията на M.G. Кучеров, действащ върху пропин (X 1) с вода в присъствието на живачни соли в кисела среда (във воден или алкохолен разтвор):
2) По време на хидрогениране върху катализатори (Pt, Pd, Ni) карбонилната група на кетона се редуцира до хидроксилна група, т.е. кетонът се превръща във вторичен алкохол - изопропанол (X 2):
3) Под действието на бромоводород върху изопропанол настъпва нуклеофилното заместване на хидроксилната група за бромния анион, което води до образуването на 2-бромпропан:
4) Под действието на алкохолен разтвор на алкали, 2-бромпропанът се превръща в ненаситен въглеводород - пропилен (X 3):
5) Чрез дехидрогениране на пропилен върху катализатор (Pt, Pd, Ni) може да се получи пропин (X 1):
Задача номер 10
Напишете уравненията на реакцията, които могат да се използват за извършване на следните трансформации:
1) Бромметанът може да се получи чрез действието на брома върху метана (X 1) на светлина. Реакцията на заместване протича по механизма на свободните радикали:
2) Когато бромометанът реагира с амоняк, първо се образува аминна сол, която при излишък от амоняк се превръща в свободен амин. В случай на метиламин се образуват метиламин (X 2) и амониев бромид:
3) Азотна киселинанестабилен, така че се получава по време на реакцията, действайки върху подкиселен аминен разтвор с натриев нитрит. При първичния амин се отделя метиламин, азот и в разтвора се образува метанол (X 3):
4) Действайки върху метилов алкохол с меден (II) оксид, при нагряване получаваме формалдехид, докато Cu + 2 ще се редуцира до Cu 0:
5) Когато формалдехидът се окисли с калиев перманганат в кисела среда, се отделя въглероден диоксид (X 4) (Mn +7 → Mn +2; C 0 → C +4):
Задача номер 11
Напишете уравненията на реакцията, които могат да се използват за извършване на следните трансформации:
1) Алканите с основна верига от 6 или повече въглеродни атома могат да влязат в реакция на дехидроциклизация, докато полученият шестчленен пръстен допълнително се дехидрогенира и се превръща в енергийно по-стабилен бензенов пръстен на ароматен въглеводород. В този случай полученият циклохексан се дехидрогенира до бензен (X 1):
2) Алкилирането на ароматни въглеводороди до алкилхалогениди и в присъствието на безводен AlCl 3 е класически пример за реакцията на Фридел-Крафтс. Реакцията е електрофилно заместване на бензоловия пръстен. Алкилирането на бензол с метилхлорид води до образуването на толуен (X 2):
3) Когато толуенът е изложен на излишък от хлор в светлината, всички водородни атоми в метиловия радикал на толуена се заменят с хлор. Реакцията на заместване протича по механизма на свободните радикали:
4) При алкална хидролиза на трихалогениди с хлорни атоми при един въглероден атом се образуват соли на карбоксилни киселини с високи добиви (в този случай калиев бензоат (X 3)):
5) От калиев бензоат, чрез реакцията на декарбоксилиране, която се получава, когато се кондензира с алкали, се получава бензол (X 1):
Задача номер 12
Напишете уравненията на реакцията, които могат да се използват за извършване на следните трансформации:
1) 1,2-дихлороетанът е геминално дихлоро производно на етан. При условията на воден разтвор на алкали, 1,2-дихлороетанът се превръща в карбонилно съединение - ацеталдехид:
2) Когато карбонилните съединения се редуцират с водород, се образуват алкохоли. Така че, преминавайки смес от ацеталдехид и водородни пари върху никелов катализатор, можете да получите етанол (X 1):
3) Заместването на хидроксилната група на алкохола с аминогрупата става при тежки условия. Чрез преминаване на етанол и амоняк върху нагрят алуминиев триоксид се получава етиламин:
4) Когато въглеродният диоксид се пропусне през воден разтвор на етиламин, се образува етиламониев бикарбонат (X 2):
5) При нагряване етиламониевият бикарбонат се разлага на въглероден диоксид, етиламин (X 3) и вода:
Задача номер 13
Напишете уравненията на реакцията, които могат да се използват за извършване на следните трансформации:
1) Ацетилен (етин) влиза в реакция на хидратация в присъствието на живачни соли във воден разтвор с образуването на ацеталдехид (реакция на Кучеров) (X 1):
2) Ацеталдехидът, когато е изложен на подкиселен воден разтвор на калиев перманганат, се превръща в оцетна киселина:
3) Оцетната киселина влиза в реакция на неутрализация с натриев хидроксид и се образуват натриев ацетат (X 2) и вода:
4) Натриевият ацетат реагира с халоалкани за образуване на естери, в този случай се образува метилов естер на оцетната киселина (метил ацетат) (X 3):
5) Естерив присъствието на киселини те могат да влязат в реакция на хидролиза. Хидролизата на метилацетат в кисела среда произвежда оцетна киселина и метанол:
Задача номер 14
Напишете уравненията на реакцията, които могат да се използват за извършване на следните трансформации:
1) Под действието на алкохолен разтвор на алкали върху някой от изомерите на диброметан се образува ацетилен (X 1):
2) Действайки върху ацетилен (X 1) с вода в присъствието на живачни соли в кисела среда (във воден или алкохолен разтвор), се получава ацеталдехид (X 2) (реакция на М. Г. Кучеров):
3) Когато ацеталдехидът се окисли с калиев перманганат в кисела среда, се образува оцетна киселина (Mn +7 → Mn +2; C +1 → C +3):
4) Хлорооцетната киселина може да се получи чрез действието на хлор върху оцетна киселина на светлина. Реакцията на заместване протича по механизма на свободните радикали, в резултат на което водородният атом при алкиловия радикал се заменя с хлор (X 3):
5) Когато хлороцетната киселина се третира с амоняк, се образува аминокиселина - глицин:
Задача номер 15
Напишете уравненията на реакцията, които могат да се използват за извършване на следните трансформации:
1) При температури над 140 0 С в присъствието на концентрирана сярна киселина алкохолите се подлагат на вътремолекулна дехидратация с образуване на алкен и вода. В този случай при 180 0 С и действието на конц. H 2 SO 4 пропанол-1 се превръща в пропилен (X 1):
2) Когато пропиленът премине през бромна вода, се наблюдава обезцветяване на бромната вода поради добавянето на бром към двойната връзка с образуването на 1,2-дибромпропан (X 2):
3) Под действието на алкохолен разтвор на алкали върху 1,2-дибромпропан се образува пропин:
4) Действайки върху пропин с вода в присъствието на живачни соли в кисела среда (във воден или алкохолен разтвор), се получава ацетон (X 3) (реакция на M.G. Kucherov):
5) Чрез преминаване на смес от ацетон и водородни пари върху паладиев катализатор се получава пропанол-2 (или изопропанол) (X 4):
Задача номер 16
Напишете уравненията на реакцията, които могат да се използват за извършване на следните трансформации:
1) Циклопропанът добавя бромоводород с отваряне на пръстена, което води до образуването на 1-бромпропан:
2) При лабораторни условия алканите се получават чрез реакцията на Wurtz от халоалкани. Частичният положителен заряд на въглеродния атом при халогена в халогенните производни прави възможно тези съединения да реагират с активни метали. Монохалоалканите вече при стайна температура взаимодействат с натрия, превръщайки се в алкани с удвоен въглероден скелет. Така от две молекули 1-бромпропан се получава n-хексан (X 1):
3) Алканите с шест или повече въглеродни атома в молекулата могат да влязат в по-сложни реакции на дехидрогениране, по време на които елиминирането на водорода е придружено от затваряне на веригата в цикъл: реакции на дехидрогениране - циклизация. В този случай хексанът се превръща в бензол (X 2):
4) Толуенът се получава чрез алкилиране на бензен с метилхалид в присъствието на AlCl3 катализатор (електрофилно заместване, S E механизъм):
5) Метиловата група на толуена се окислява от калиев перманганат в кисела среда до карбоксилна група, следователно толуенът се превръща в бензоена киселина (X 3) (Mn + 7 → Mn + 2; C -3 → C + 3) :
Задача номер 17
Напишете уравненията на реакцията, които могат да се използват за извършване на следните трансформации:
1) При лабораторни условия пропанът може да се получи чрез реакцията на Wurtz от халоалкани - хлороетан и хлорометан, но тази реакция е свързана с образуването на два странични продукта - бутан и етан. Монохалоалканите при стайна температура са в състояние да взаимодействат с натрий:
2) Дехидрогенирането на пропан върху катализатор (Pt, Pd, Ni) може да произведе пропилен (X 1):
3) Когато алкенът се окисли с перманганат в неутрална среда на студено, се образуват двувалентен алкохол, алкален и манганов (IV) оксид. В този случай пропандиол-1,2 (X 2) се образува от пропилен (Mn +7 → Mn +4; C -2 → C -1, C -1 → C 0):
4) Многовалентните алкохоли са способни да влизат в реакции на нуклеофилно заместване с халогеноводороди. Действайки с излишък от бромоводород върху пропандиол-1,2, 1,2-дибромпропан (X 3) се получава:
5) Под действието на алкохолен разтвор на алкали върху дихалоалкан - 1,2-дибромпропан - се образува пропин (X 4).