двойки други. Тези промени съпътстват всеки цикъл на репликация на ДНК, но честотата им е много по-малка, отколкото би трябвало да бъде. Това се обяснява с факта, че повечето промени от този вид се елиминират поради действието на механизма за възстановяване (молекулно възстановяване) на оригиналната ДНК нуклеотидна последователност.
Механизмът за възстановяване се основава на наличието на две комплементарни вериги в молекулата на ДНК. Изкривяването на нуклеотидната последователност в един от тях се открива от специфични ензими. След това съответното място се отстранява и се заменя с ново, синтезирано върху втората комплементарна ДНК верига. Такъв ремонт се нарича ексцизионен, т.е. с "изрязване" (фиг. 3.15). Извършва се преди следващия цикъл на репликация, така че се нарича още
предрепликативни.
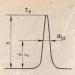
Ориз. 3.14. Схема на процеса на корекция по време на синтеза на ДНК: I - включване във веригата на ДНК на нуклеотид с модифицирана (тавтомерна) форма на цитоеин, който „незаконно“ се сдвоява с аденин; II - бърз преход
цитозинът в обичайната си форма нарушава сдвояването му с аденина; несдвоеният 3"-OH-край на синтезираната верига предотвратява по-нататъшното й удължаване под действието на ДНК-полимераза; III - ДНК-полимеразата премахва нелегалния нуклеотид, в резултат на което 3"-OH-края, сдвоен с матрицата, се появява отново; IV - ДНК полимеразата продължава да изгражда веригата в 3 "-OH-края
Възстановяването на оригиналната структура на ДНК изисква участието на редица ензими. Важен момент при стартирането на механизма за възстановяване е откриването на грешка в структурата на ДНК. Често такива грешки възникват в новосинтезираната верига по време на репликация. Ремонтните ензими трябва да открият точно тази верига. При много видове живи организми новосинтезираната ДНК верига се различава от майчината степен на метилиране на азотните й бази, което изостава от синтеза. В този случай неметилираната верига претърпява възстановяване. Обект на разпознаване от възстановителните ензими също могат да бъдат прекъсвания във веригата на ДНК. При висшите организми, където синтезът на ДНК не протича непрекъснато, а чрез отделни репликони, новосинтезираната ДНК верига има прекъсвания, което прави възможно разпознаването й.
Възстановяването на структурата на ДНК в случай на загуба на пуриновите бази на една от нейните вериги включва откриване на дефект с помощта на ензима ендонуклеаза, който разрушава фосфоестерната връзка на мястото на увреждане на веригата. След това измененото място с няколко съседни на него нуклеотида се отстранява от ензима екзонуклеаза и на негово място, в съответствие с реда на базите на комплементарната верига, се образува правилната нуклеотидна последователност (фиг. 3.15).

Ориз. 3.15. Схема за ексцизионно, предрепликативно възстановяване на ДНК Когато една от базите в ДНК веригата се промени при възстановяването на оригинала
В структурите участват около 20 ензима ДНК гликозилаза, които разпознават специфично увреждане, причинено от дезаминиране, алкилиране и други структурни трансформации на основите. Такива модифицирани бази се отстраняват. Има зони лишени от основи, които се ремонтират, както при загубата на пурини. Ако възстановяването на нормалната структура не се извърши, например в случай на дезаминиране на азотни основи, някои двойки допълващи се основи се заменят с други - двойката C-G може да бъде заменена с двойка T-A и т.н. (Вижте раздел 3.4.2.3).
Образуването на тиминови димери (T-T) в полинуклеотидни вериги под действието на UV лъчи изисква участието на ензими, които разпознават не отделни променени бази, а по-обширно увреждане на структурата на ДНК. Репаративният процес в този случай също е свързан с отстраняването на мястото, носещо димера, и възстановяването на нормалната нуклеотидна последователност чрез синтез върху комплементарната ДНК верига.
В случай, че системата за възстановяване на ексцизия не коригира промяна, която е настъпила в една ДНК верига, фиксирането настъпва по време на репликацията.
тази промяна и тя става собственост и на двете вериги на ДНК. Това води до замяна на една двойка комплементарни нуклеотиди с друга или до поява на прекъсвания (пропуски) в новосинтезираната верига срещу променените участъци. Възстановяването на нормалната структура на ДНК може да се случи и след репликация.
Пострепликативен ремонтсе осъществява чрез рекомбинация (обмяна на фрагменти) между две новообразувани двойни спирали на ДНК. Пример за такова пострепликативно възстановяване е възстановяването на нормалната структура на ДНК, когато се появят тиминови димери (T-T), когато те не се елиминират спонтанно под действието на видима светлина ( лек ремонт) или по време на предрепликативен ексцизионен ремонт.
Ковалентните връзки, които възникват между съседни тиминови остатъци, ги правят неспособни да се свързват с комплементарни нуклеотиди. В резултат на това в новосинтезираната ДНК верига се появяват прекъсвания (пропуски), които се разпознават от възстановителните ензими. Възстановяването на целостта на новата полинуклеотидна верига на една от дъщерните ДНК се извършва поради рекомбинация със съответната нормална майчина верига на другата дъщерна ДНК. След това празнината, образувана в родителската верига, се запълва чрез синтез върху комплементарната полинуклеотидна верига (фиг. 3.16). Проява на такова възстановяване след репликация, извършено чрез рекомбинация между веригите на две дъщерни ДНК молекули, може да се счита за често наблюдавания обмен на материал между сестринските хроматиди (фиг. 3.17).

Ориз. 3.16. Схема на пострепликативна репарация на ДНК: I - поява на тиминов димер в една от нишките на ДНК;
II - образуването на "празнина" в новосинтезираната верига срещу промененото място на родителската молекула след репликация (стрелката показва последващото запълване на "празнината" с място от съответната верига на втората дъщерна ДНК молекула) ;
III - възстановяване на целостта на дъщерната верига на горната молекула поради рекомбинация и в долната молекула поради синтез върху комплементарната верига

Ориз. 3.17. Междухроматидни обмени (обозначени със стрелки)
В хода на предрепликативния и пострепликативния ремонт, по-голямата част от увреждането на ДНК структурата се възстановява. Ако обаче в наследствения материал на клетката възникнат твърде големи увреждания и някои от тях не бъдат елиминирани, се включва системата от индуцируеми (възбудени) възстановителни ензими (SOS-система). Тези ензими запълват празнините, като възстановяват целостта на синтезираните полинуклеотидни вериги без стриктно спазване на принципа на комплементарност. Ето защо понякога самите възстановителни процеси могат да служат като източник на устойчиви промени в структурата на ДНК (мутации). Посочената реакция важи и за системата SOS.
Ако в клетката, въпреки продължаващото възстановяване, количеството на увреждането на ДНК структурата остане високо, процесите на репликация на ДНК в нея се блокират. Такава клетка не се дели, което означава, че не предава възникналите промени на потомството.
Спирането на клетъчния цикъл, причинено от увреждане на ДНК, съчетано с невъзможността за молекулярно възстановяване на изменения наследствен материал, може с участието на протеин, чийто синтез се контролира от гена p53, да доведе до активиране на процеса на самоусъвършенстване. -разрушаване (апоптоза) на дефектна клетка с цел отстраняването й от тялото.
По този начин обширен набор от различни възстановителни ензими извършва непрекъснато „изследване” на ДНК, премахвайки увредените участъци от нея и спомагайки за поддържането на стабилността на наследствения материал. Комбинираното действие на ензими за репликация (ДНК полимераза и редактираща ендонуклеаза) и ензими за възстановяване осигурява доста нисък процент на грешки в ДНК молекулите, който се поддържа на ниво 1 × 10–9 двойки променени нуклеотиди на геном. С размер на човешкия геном от 3 × 109 базови двойки, това означава появата на около 3 грешки на репликиращ геном. В същото време дори това ниво е достатъчно за формиране на значително генетично разнообразие под формата на генни мутации по време на съществуването на живот на Земята.

3.4.2.3. Промени в ДНК нуклеотидните последователности. Генни мутации
Некоригирани промени химическа структурагени, които се възпроизвеждат в последователни цикли на репликация и се появяват в потомството под формата на нови варианти на черти, се наричат генни мутации.
Промените в структурата на ДНК, която изгражда ген, могат да бъдат разделени на три групи. Мутациите от първата група се състоят в замяната на едни бази с други. Те съставляват около 20% от спонтанно настъпилите генни промени. Втората група мутации се причинява от изместване на рамката, което се случва, когато броят на нуклеотидните двойки в гена се промени. И накрая, третата група е представена от мутации, свързани с промяна в реда на нуклеотидните последователности в гена (инверсия).
Мутации според вида на заместване на азотните основи. Тези мутации възникват по редица специфични причини. Едно от тях може да е промяна в структурата на база, която вече е включена в ДНК спиралата, която настъпва случайно или под въздействието на специфични химични агенти. Ако такава променена форма на основата остане незабелязана от възстановителните ензими, тогава по време на следващия цикъл на репликация тя може да прикрепи друг нуклеотид към себе си. Пример за това е дезаминирането на цитозин, който се превръща в урацил спонтанно или под въздействието на азотна киселина(фиг. 3.18). Полученият урацил, не се забелязва от ензимаДНК гликозилаза,по време на репликация, той се свързва с аденин, който впоследствие свързва тимидилов нуклеотид. В резултат на това двойка C-G се заменя в ДНК с двойка T-A (фиг. 3.19, I ). Деаминирането на метилирания цитозин го превръща в тимин (виж Фигура 3.18). Тимидиловият нуклеотид, който е естествен компонент на ДНК, не се открива като промяна от ензими за възстановяване и добавя аденилов нуклеотид по време на следващата репликация. В резултат на това вместо чифт C-G двойка се появява и в молекулата на ДНК T-A (фиг. 3.19, II).
Ориз. 3.18. Спонтанно дезаминиране на цитозин
Друга причина за заместването на базите може да бъде погрешното включване в синтезираната ДНК верига на нуклеотид, носещ химически модифицирана форма на базата или нейния аналог. Ако тази грешка остане незабелязана от ензимите за репликация и възстановяване, променената база се включва в процеса на репликация, което често води до замяна на една двойка с друга. Пример за това е добавянето на нуклеотид с 5-бромурацил (5-BU), подобен на тимидиловия нуклеотид, към аденина на майчината верига по време на репликация. По време на последваща репликация, 5-BU по-лесно се прикрепя към себе си не аденин, а гуанин. Гуанинът в хода на по-нататъшно удвояване образува комплементарна двойка с цитозин. В крайна сметка двойка A-Tзаместени в молекулата на ДНК чифт H-C(фиг. 3.20).

Ориз. 3. 19. Мутации по вид на заместване на базата (дезаминиране на азотни бази в ДНК веригата):
I - превръщане на цитозин в урацил, замяна на C-G-двойка с T-A-двойка;
II - превръщане на метилцитозин в тимин, замяна на C-G двойка с T-A двойка
От горните примери може да се види, че промените в структурата на ДНК молекулата според вида на заместването на базата се случват преди или по време на репликация, първоначално в една полинуклеотидна верига. Ако такива промени не бъдат коригирани по време на ремонт, тогава по време на последваща репликация те стават собственост и на двете ДНК вериги.
Ориз. 3.20. Базови заместващи мутации
(Включване на аналог на азотна основа в репликацията на ДНК)
Последица от замяната на една двойка комплементарни нуклеотиди с друга е образуването на нов триплет в ДНК нуклеотидната последователност, кодираща аминокиселинната последователност в пептидната верига. Това може да не повлияе на структурата на пептида, ако новият триплет е "синоним" на предишния, т.е. ще кодира същата аминокиселина. Например, аминокиселината валин е криптирана от четири триплета: CAA, CAG, CAT, CAC. Замяната на третата основа в която и да е от тези триплети няма да промени нейното значение (израждането на генетичния код).
AT в случай, когато нововъзникналият триплет кодира друга аминокиселина, структурата на пептидната верига и свойствата на съответния протеин се променят. В зависимост от естеството и мястото на заместването специфичните свойства на протеина се променят в различна степен. Известни са случаи, когато замяната само на една аминокиселина в пептида влияе значително върху свойствата на протеина, което се проявява в промяна на по-сложни характеристики. Пример е промяната в свойствата на човешкия хемоглобин, когатосърповидно-клетъчна анемия (фиг. 3.21). При такъв хемоглобин-(HbS) (за разлика от нормалния HbA) - в р-глобиновите вериги на шеста позиция, глутаминовата киселина се заменя с валин. Това е следствие от заместването на една от основите в триплета, кодиращ глутаминова киселина (СТТ или СТК). В резултат на това се появява триплетен криптиращ валин (CAT или CAC). В този случай замяната на една аминокиселина в пептида значително променя свойствата на глобина, който е част от хемоглобина (способността му да се свързва с 02 намалява), човек развива признаци на сърповидноклетъчна анемия.
AT в някои случаи замяната на една основа с друга може да доведе до появата на една отбезсмислени триплети (ATT, ATC, ACT), които не кодират нито една аминокиселина. Последствието от такава замяна ще бъде прекъсването на синтеза на пептидната верига. Смята се, че нуклеотидните замествания в един триплет водят в 25% от случаите до образуването на синонимни триплети; при 2-3 безсмислени тризнаци, при 70-75% - до появата на истински генни мутации.
По този начин мутациите на заместване на базата могат да възникнат както в резултат на спонтанни промени в основната структура в една от веригите на вече съществуваща двойна спирала на ДНК, така и по време на репликация в новосинтезирана верига. Ако тези промени не бъдат коригирани по време на репарацията (или, обратно, възникнат по време на репарацията), те се фиксират и в двете вериги и след това ще бъдат възпроизведени в следващите цикли на репликация. Следователно, важен източник на такива мутации са нарушенията на процесите на репликация и възстановяване.
Мутации с изместване в рамката на четене. Този тип мутации съставляват значителна част от спонтанните мутации. Те възникват поради загуба или вмъкване на една или повече двойки комплементарни нуклеотиди в ДНК нуклеотидната последователност. Повечето от изследваните мутации, причиняващи
РЕПАРАЦИЯ НА ДНК
Репарационни системи
2 Ексцизионен ремонт. Примери и видове
3 Поправяне на грешки в репликацията на ДНК
4 Рекомбинантно (пост-репликативно) възстановяване в бактерии
5 SOS репарация
Системите за възстановяване на ДНК са доста консервативни в еволюцията от бактерии към хора и са най-добре проучени при E. coli.
Има два вида репарация:права и ексцизионна
Директна репарация
Директното възстановяване е най-простият начин за елиминиране на увреждане в ДНК, което обикновено включва специфични ензими, които могат бързо (обикновено на един етап) да елиминират съответното увреждане, възстановявайки оригиналната структура на нуклеотидите.
1. Това работи, напр.О6-метилгуанин-ДНК-метилтрансфераза
(самоубийствен ензим), който премахва метилова група от азотна основа до един от собствените си цистеинови остатъци
В E. coli за 1 минута могат да се синтезират до 100 молекули от този протеин. Протеинът на висшите еукариоти, сходен по функция, очевидно играе важна роля в защитата срещу рак, причинен от вътрешни и външни алкилиращи фактори.
ДНК инсертаза
2. ДНК инсертази
фотолиаза
3. Димерите на тимина са "бродирани" от директна репарацияВ ролитефотолиаза, които извършват съответната фотохимична трансформация. ДНК фотолиазите са група светлинно-активирани ензими с дължина на вълната 300 - 600 nm (видима област), за които имат специален светлочувствителен център в структурата си.
Те са широко разпространени в природата и се срещат в бактерии, дрожди, насекоми, влечуги, земноводни и хора. Тези ензими изискват различни кофактори (FADH, тетрахидрофолиева киселина и др.), участващи във фотохимичното активиране на ензима. Е. coli фотолиазата е 35 kDa протеин, плътно свързан с олигорибонуклеотид с дължина 10-15 нуклеотиданеобходими за ензимната активност.
Примери за директна репарация
1. Метилирана основа O 6-mG диметилиран от ензима метилтрансферазаО6-метилгуанин-ДНК-метилтрансфераза (суициден ензим), който прехвърля метилова група към един от нейните остатъци
цистеин
2. AP местата могат да бъдат възстановени чрез директно вмъкване на пурини с помощта на ензими, наречениДНК инсертази(от англ. insert- insert).
СХЕМА ЗА ПРИМЕР ЗА ДИРЕКТНО ВЪЗСТАНОВЯВАНЕ НА ПОВРЕДИ В ДНК - Метилирана база О6- mgдеметилиран от ензима метилтрансфераза, който прехвърля метилова група към един от неговите цистеинови аминокиселинни остатъци.
3. Фотолиазата се прикрепя към димера на тимина и след облъчване на този комплекс с видима светлина (300-600 nm), димерът се разширява
ПРИМЕРНА СХЕМА ЗА ДИРЕКТНО РЕПАРАТИРАНЕ НА УВРЕЖДАНЕ В ДНК – Фотолиаза
се прикрепя към димера на тимина и след облъчване с видима светлина този димер се разширява

Ремонт на ексцизия
(от английски excision - рязане).
ОПРЕДЕЛЕНИЕ
Ексцизионният ремонт включва отстраняванеувредени азотни бази от ДНК и последващо възстановяваненормална молекулярна структура.
МЕХАНИЗЪМ
Няколко ензима обикновено участват в възстановяването на ексцизия и самият процес засяга
не само повредени ,
но и съседни нуклеотиди .
УСЛОВИЯ
За възстановяване на ексцизия е необходима втора (комплементарна) верига от ДНК. Общата опростена схема на ексцизионния ремонт е показана на фиг. 171.
ЕТАПИ
Първата стъпка в ремонта на ексцизия е изрязване на анормалните азотни бази. Това е катализирано от групаДНК-н-гликозилаза- ензими, които разцепват гликозидната връзка между дезоксирибоза и азотна основа.
ВАЖНА ЗАБЕЛЕЖКА:
ВчовекДНК-н-гликозилазаимат висока субстратна специфичност: различни ензими от това семейство разпознават и изрязват различни аномални бази(8-оксогуанин, урацил, метилпурини и др.).
ВбактерииДНК-н-гликозилазаняма такава субстратна специфичност.
ЕНЗИМИ ЗА ОБЩО ИЗКРИВАНЕ
| ЗАГЛАВИЕ | ФУНКЦИЯ | МЕХАНИЗЪМ |
| ДНК-н-гликозилаза | ексцизия на анормални азотни бази | разцепва гликозидната връзка между дезоксирибоза и азотна основа |
| AP ендонуклеаза | създава условия за работата на следващия ензим - екзонуклеази | разрушава захарно-фосфатния гръбнак на ДНК молекулата в АР мястото |
| екзонуклеаза | разцепва няколко нуклеотида | последователно разцепва няколко нуклеотида от увредената част на една ДНК верига |
СПЕЦИФИЧНИ ПОСЛЕДОВАТЕЛНИ СТЪПКИ НА ТОЗИ МЕХАНИЗМ:
В резултат на действие ДНК- н-гликозилазаобразува се АР място, което се атакува от ензима AR-ендонуклеаза. Той разрушава захарно-фосфатния гръбнак на ДНК молекулата в AP мястото и по този начин създава условия за работата на следващия ензим - екзонуклеази, който последователно отцепва няколко нуклеотида от увредената част на една ДНК верига.
В бактериални клетки освободеното място се запълва със съответните нуклеотиди с участието ДНК полимераза Iориентирани към втората (комплементарна) верига на ДНК.
Тъй като ДНК полимераза I е в състояние да удължи 3' края на една от веригите при прекъсване на двуверижната ДНК и да премахне нуклеотидите от 5' края на същото прекъсване,
тези. осъзнай „излъчване на ник“ , този ензим играе ключова роля в възстановяването на ДНК. Извършва се окончателното зашиване на ремонтираните зони ДНК лигаза.
В еукариотни (бозайници) клетки
Възстановяването на ДНК ексцизия в клетките на бозайници е придружено от рязък скок в активността на друг ензим,поли АдР-рибозна полимераза . В същото време се случва ADP-рибозилиране на хроматинови протеини(хистони и нехистонови протеини), което води до отслабване на връзката им с ДНК и отваря достъп до ензими за възстановяване.
Донор ADP-рибозав тези реакцииNAD+, чиито резерви са силно изчерпани по време на ексцизионно възстановяване на щети, причинени от рентгеново облъчване:

Отрицателно заредени остатъци ADP-рибозаот вътрешния състав на молекулата NAD+присъединете се чрез радикалглутаминкиселини или фосфосериндо хроматиновите протеини, което води до неутрализиране на положителните заряди на тези протеини и отслабване на контакта им с ДНК.
КАКВО Е ГРУПА ЕНЗИМИ
ДНК - гликозилази
разцепва гликозидната връзка между дезоксирибозата и азотната основа
което води до ексцизия на анормални азотни бази
ДНК - гликозилази , участващи в елиминирането на окислителното увреждане на ДНК в клетките прокариоти и еукариоти, са много разнообразни и се различават по субстратна специфичност, пространствена структура и начини на взаимодействие с ДНК.
Най-изучаваните ДНК гликозилази включват:
ендонуклеаза III(EndoIII),
образува амидопиримидин-ДНК-гликозилаза (fpg)
Мут Ти
Мут Йcoli.
Ендонуклеаза IIIE. coli разпознава и специфично се отцепва от ДНК окислени пиримидинови основи.
Този ензим е мономерен глобуларен протеин, състоящ се от 211 аминокиселиниостатъци (мол. тегло 23,4 kDa). Генът, кодиращ Endo III, е секвениран и неговата нуклеотидна последователност е установена. Ендо III е желязо-сярен протеин [(4 Fe-4S )2+-протеин], който има елемента по-горе вторична структура тип "гръцки ключ" (спирала - фиби - спирала), служещи за свързване с ДНК. От тях също са изолирани ензими с подобна субстратна специфичност и подобни аминокиселинни последователности говежди и човешки клетки.
Образува амидопиридин-ДНК-гликозилаза E. coli "разпознава" и разцепва окислен хетероцикличен основи от пуриновата серия .
СХЕМА ЗА ЕКЦИЗИОНЕН РЕМОНТ ЕТАП 1
ДНКн

ЕКЦИЗИОННА РЕМОНТНА СХЕМА
1 ДНКнгликозидаза премахва увредената основа
AR ендонуклеазата разрушава ДНК
2 Екзонуклеазата премахва редица нуклеотиди
3 ДНК полимераза запълва свободното място с комплементарни
Мононуклеотиди
ДНК лигазата омрежва възстановената ДНК верига

Мут Т- малък протеин с молекулно тегло 15 kDa, който има нуклеозидна трифосфатазна активност, която е предимно хидролизира dGTP до dGMP и пирофосфат.
Биологична роляМут Т е да се предотврати образуването на неканонични двойки по време на репликацияA: Gи A: 8-оксо-G.
Такива двойки могат да се появят, когато окислена форма
dGTP (8-оксо-dGTP)става субстратДНК полимераза.
Мут Тхидролизира 8-оксо-dGTP10 пъти по-бързо от dGTP.
Това е така 8-оксо-dGTPнай-предпочитан субстратMutTи обяснява функционалната му роля.
Мут Йе специфична аденин-ДНК гликозилаза, която разцепва N-гликозидната връзка между аденин и дезоксирибоза аденозин,образуване на неканонична двойка с гуанин.
Функционалната роля на този ензим е да предотвратява мутация
T:A - G:A от разцепване на непокътнат остатък аденинот основна двойка А: 8-оксо-G.
Ремонт с ексцизия на нуклеотиди
(ATP-зависим механизъм за отстраняване на увреждане на ДНК)
Напоследък при възстановяването на ексцизия се отделя специално внимание на АТФ-зависимия механизъм за отстраняване на увреждане от ДНК. Този тип ексцизионно възстановяване се нарича нуклеотидна ексцизионна репарация (NER).
Включва ДВА ЕТАПА :
1. отстраняване от ДНКолигонуклеотидни фрагменти съдържащи щети и
Ексинуклеаза
2. последваща реконструкция на ДНК веригата с участието на комплекс от ензими (нуклеази, ДНК полимерази, ДНК лигази и др.).
Настъпва отстраняването на ДНК фрагмент от двете страни на повредениянуклеотид. Дължината на отстранените олигонуклеотидни фрагменти се различава между прокариотите и еукариотите.
Отстраняване на ДНК фрагмент от прокариоти
И така, в E. coli, B. subtilus, Micrococcus luteus, фрагмент с дължина 12-13 нуклеотиди
Отстраняване на ДНК фрагмент от еукариоти
и при дрожди, земноводни и хора, фрагмент, състоящ се от 24-32 нуклеотиди.
Ексинуклеаза- ензим, който премахва ДНК фрагменти
ДНК фрагмент се разцепва от ензимексцинуклеаза(ексинуклеаза). В E. coli този ензим се състои от 3 различни протомера -
uvra
uvr B
uvr C
всеки от които изпълнява специфична функция по време на ексцизионно разцепване на ДНК фрагмент. Името на тези протеини се дава от първите букви на думите"ултравиолетов ремонт".
Протомер uvr Aима АТФазна активност, свързва се с ДНК под формата на димер, осъществявайки
първично разпознаване на щетите и
обвързванеuvr B
Протомер uvr Bима:
един . Латентен АТФазна и латентна хеликазна активност, необходима за промяна на конформациите и развиване на двойната спирала на ДНК;
2. Ендонуклеаза активност, разцепване на интернуклеотидната (фосфодиестерна) връзка отстраниZ"-крайотцепен фрагмент.
Protomer uvr Cдейства като ендонуклеаза, въвеждайки прекъсване на възстановената ДНК верига с5"-крайизрязан фрагмент.
Така че протомеритеuvr A, uvr B, uvr Cвзаимодействат с ДНК в определена последователност, осъществявайки АТФ-зависима реакцияразцепване на олигонуклеотидния фрагмент от ДНК веригата, която се ремонтира.
Получената празнина в ДНК молекулата се възстановява с участието на ДНК полимераза I и ДНК лигаза. Моделът на ексцизионно възстановяване с участието на горните ензими е показан на фиг. 172.
Ексцизионни ремонти при хора
Ексцизионните ремонти при хора също са АТФ-зависими и включваттри основни етапа :
разпознаване на щети,
двойно разрязване на ДНК веригата,
редукционен синтез и
лигиране на ремонтираната нишка.
Въпреки това, възстановяването на човешка ДНК ексцизия включва
25 различни полипептида ,
16 от които участват в разцепването на олигонуклеотидния фрагмент, като са протомериексцинуклеази,
и останалото 9 извършват синтеза на ремонтираната част от молекулата.
В системата за възстановяване на ДНК при хората е много съществена роляизвършват транскрипционни протеини
РНК полимераза II и
TF Понедин от шестте основни транскрипционни фактора еукариот.
Трябва да се отбележи, че възстановяването на ексцизия при прокариотите, както и при еукариотите, зависи от функционалното състояние на ДНК:
транскрибираната ДНК се възстановява по-бързо
отколкото транскрипционно неактивен.
Това явление се обяснява със следните фактори:
структура на хроматина,
хомология на вериги от транскрибирани ДНК региони,
ефект на увреждане на веригата и неговия ефект върху РНК полимеразата.
ВАЖНА ЗАБЕЛЕЖКА:
КОДИРАЩА ВЕРИГА ДНК (верига за съхранение на информация)
МАТРИЦА ВЕРИГА от ДНК (информацията се отписва от нея)
Известно е, че такива големи щети като образуване на тимин димер, блокират транскрипцията както при бактерии, така и при хора, ако се появят на матрична веригаДНК (увреждане на кодираневериги не влияяткъм транскрипционния комплекс). РНК полимеразата спира на мястото на увреждане на ДНК и блокира работата на транскрипционния комплекс.
Фактор на свързване на транскрипция-поправка (TRCF) .
При E. coli засилването на репарацията на транскрипцията се медиира от един специален протеин -транскрипционно-поправящ фактор на връзката (TRCF) .
Този протеин допринася :
1. отделяне на РНК полимераза от ДНК
2. едновременно стимулира образуването на протеинов комплекс,
Извършване на ремонт на повредената зона.
В края на поправката РНК полимеразата си идва на мястото и транскрипцията продължава (виж Фиг.).
Така обща схемаексцизионен ремонт
1. ДНК-N -гликозилазата премахва увредената основа
2. AR-ендонуклеазата въвежда прекъсване във веригата на ДНК
3. Екзонуклеазата премахва редица нуклеотиди
4. ДНК полимераза запълва освободената площ
Комплементарни нуклеотиди
5. ДНК лигазата кръстосано свързва възстановената ДНК верига
Поправяне на грешки при репликация на ДНК
чрез метилиране
Грешки в сдвояването на азотни бази по време на репликация на ДНК възникват доста често (при бактериите веднъж на 10 хиляди нуклеотида), в резултат на коетов дъщерната верига на ДНК са включени нуклеотиди, които не са комплементарни на нуклеотидите на майчината верига -несъответствия(Несъответствие на английски език n e мач).
Макар чеДНК полимераза Iпрокариотът има способността да се самокоригира, усилията му да елиминира погрешно свързани нуклеотиди понякога не е достатъчно, а след това някои грешни (некомплементарни) двойки остават в ДНК.
В този случай възстановяването се извършва с помощта на специфична система, свързана сДНК метилиране . Действието на тази система за възстановяване се основава на факта, че след репликация, след определено време (няколко минути), ДНК претърпява метилиране.
Е. coli метилираннай-вече аденин с образование
N6-метил-аденин (N6-mA).
До този момент новосинтезираните(дъщерно дружество)веригата остава неметилирана.
Ако в такава верига има несдвоени нуклеотиди, тогава тя претърпява възстановяване: Такаметилиране марки ДНК и
включва система за корекция на грешки репликация.
В тази репарационна система се разпознават специални структури:
подпоследователностG-N6-mA-T-Cи следващиязад него деформация
в двойната спирала на мястото на липса на комплементарност (Фигура по-долу).
при елиминирането на несдвоени нуклеотиди в полуметилиранв молекулата на ДНК участва доста сложен комплекс от възстановителни ензими, който сканира повърхността на ДНК молекулата,изрязва част от дъщерната верига прибягвайки до несъответствие, а след това създава условия за надграждане
неговите желани (комплементарни) нуклеотиди.
Различните компоненти на този комплекс имат различни дейности.нуклеаза,
хеликаза,
ATPaznoy,
необходими за въвеждане на прекъсвания в ДНК и разцепване на нуклеотиди, развиване на двойната спирала на ДНК и осигуряване на енергия за движението на комплекса по протежение на ремонтираната част на молекулата.
Комплекс от възстановителни ензими, сходни по структура и функции, е открит и при хората.
Рекомбинантно (пострепликативно) възстановяване
В случаите, когато по една или друга причина горепосочените системи за възстановяване са нарушени, могат да се образуват празнини (недоремонтирани зони) в ДНК вериги, които имат понякога доста значими, което е изпълнено с нарушаване на системата за репликация и може да доведе до клетъчна смърт.
В този случай клетката е в състояние да използва за възстановяване на една ДНК молекула друга ДНК молекула, получена след репликация, т.е. да включи за тази цел механизмарекомбинация.
В бактерии
При бактериите участва рекомбинантно възстановяванеRec A протеин. Той се свързва с едноверижна ДНК област и я включва в рекомбинация схомоложни области на непокътнати вериги на друга ДНК молекула .
В резултат на това както счупените (съдържащи пропуски), така и непокътнатите вериги на възстановяваната ДНК молекула се оказват сдвоенис непокътнати комплементарни ДНК региони, което отваря възможността за възстановяване от гореописаните системи.
В същото време може да има изрязванеспецифичен фрагмент и
пълненес негова помощ пролуки в дефектната верига.
Получените пропуски и прекъсвания във веригите на ДНК се запълват с участието наДНК полимераза I и ДНК лигаза .
SOS репарация
Съществуването на тази система за първи път е постулирано от М. Радман през 1974 г. Той също така дава името на този механизъм, като включва в него международния сигнал за бедствие "SOS" (спаси нашите души).
Всъщност тази система се включва, когато увреждането на ДНК става толкова голямо, че заплашва живота на клетката. В този случай се индуцира активността на разнообразна група гени, участващи в различни клетъчни процеси, свързани с възстановяването на ДНК.
Включването на определени гени, определени от размера на увреждането в ДНК, води до клетъчни отговори с различно значение (започвайки от стандартните репарация на повреденитенуклеотиди и край потисканеклетъчно делене).
Най-изучаванSOS репарацияв E. coli, чиито основни участници са кодирани протеини гени Рек АиЛекс А.
Първият е многофункционаленRec A протеинучастващи
в ДНК рекомбинация, както и
в регулиране на генната транскрипция фаг ламбдакойто инфектира E. coli,
и второ (протеин Lex A)е репресортранскрипция на голяма група гени, предназначени за възстановяване на ДНКбактерии. Когато е инхибиран или разрешен ремонтът е активиран.
Обвързване Rec A с Lex Aводи до разцепването на последнотои съответно на активиране на ремонтни гени.
От своя страна индукцията на бактериалната SOS система служи зафаг ламбда сигнал за опасности кара профага да се превключи от пасивен към активен (литичен) пътсъществуване, като по този начин причинява смърт на клетката гостоприемник.
Системата за възстановяване на SOS е открита не само при бактерии, но и при животни и хора.
Гени, участващи в възстановяването на SOS ДНК щети
| гени | Последици от активиране на ген |
| uvr A, B, C, D | Възстановяване на увреждане на вторичната структура на ДНК |
| Рек А | Пострепликативен ремонт, индукции на SOS система |
| лекс А | Изключване на SOS системата |
| rec N, ruv | Ремонт на двойни счупвания |
| Осигуряване на рекомбинационен ремонт |
|
| ум C, D | Мутагенеза, причинена от промени в свойствата на ДНК полимеразата |
| сул А | Потискане на клетъчното делене |
Заключение
Възстановяването на увреждане на ДНК е тясно свързано с други фундаментални молекулярно-генетични процеси: репликация, транскрипция и рекомбинация.Всички тези процеси са преплетенив обща системавзаимодействия, обслужвани от голям брой различни протеини, много от които са полифункционални молекули, участващи в контрол на изпълнението генетична информация в про- и еукариотни клетки. В същото време е ясно, че природата "не пести"върху контролните елементи, създавайки най-сложните системи за коригиране на тези повреди в ДНК, които са опасниза организма и особено за неговото потомство. От друга страна, в случаите, когато репаративният капацитет не е достатъчен за поддържане на генетичния статус на организма, има нужда от програмирана клетъчна смърт -апоптоза..
СХЕМА НА НУКЛЕОТИДНА ЕКЦИЗИОННА РЕМОНТ В Е. КОЛИС УЧАСТИЕТО НА EXINUCLEASE
1. ТРАНСКРИПЦИОННО НЕЗАВИСИМ МЕХАНИЗЪМ

2. ЗАВИСИМ ОТ ТРАНСКРИПЦИЯ МЕХАНИЗЪМ

3. ОБЩ ЕТАП НА РЕМОНТ

СИМВОЛИ
А - протеинувр НО
B - протеинувр AT
C - протеинувр ОТ
малък черен триъгълник - знакът показва местоположението на повредата
СХЕМА ЗА РЕМОНТ, СВЪРЗАНА С МЕТИЛИРАНЕ НА ДНК

репарации
наречена способността на молекулата на ДНК да "коригира" промените, които настъпват в нейните вериги. Най-малко 20 протеина участват във възстановяването на оригиналната структура: те разпознават променените участъци от ДНК и ги отстраняват от веригата, възстановяват правилната последователност от нуклеотиди и омрежват възстановения фрагмент с останалата част от ДНК молекулата.
Изброените особености на химичната структура и свойства на ДНК определят функциите, които тя изпълнява. ДНК записва, съхранява, възпроизвежда генетична информация, участва в процесите на нейното внедряване между новите поколения клетки и организми.
рибонуклеинови киселини - РНК -
са представени от молекули с различни размери, структура и изпълнявани функции. Всички молекули на РНК са копия на определени участъци от ДНК молекулата и в допълнение към вече посочените разлики са по-къси от нея и се състоят от една верига. Между отделни участъци от една РНК верига, комплементарни една на друга, е възможно сдвояване на бази (A с U, G с C) и образуване на спираловидни участъци. В резултат на това молекулите придобиват специфична конформация.
Матрична или информационна РНК (иРНК, иРНК) се синтезира в ядрото под контрола на ензима РНК полимераза, комплементарна на информационните ДНК последователности, прехвърля тази информация към рибозомите, където се превръща в матрица за синтеза на протеинова молекула. В зависимост от количеството копирана информация, молекулата на иРНК може да има различна дължина и да съставлява около 5% от цялата клетъчна РНК.
Рибоспецифичната РНК (рРНК) се синтезира главно в ядрото, в областта на рРНК гените и е представена от молекули с различно молекулно тегло, които са част от големите и малките субчастици на рибозомите. рРНК представлява 85% от цялата клетъчна РНК.
Трансферната РНК (тРНК) съставлява около 10% от клетъчната РНК. Има над 40 вида tRNA. Когато се реализира генетична информация, всяка tRNA прикрепя специфична аминокиселина и я транспортира до мястото на сглобяване на полипентида. При еукариотите тРНК са дълги 70-90 нуклеотида.
Клетъчна структура
Видове клетъчна организация.
Сред разнообразието от организми, съществуващи в момента на Земята, се разграничават две групи: вируси и фаги, които нямат клетъчна структура; всички останали организми са представени от различни клетъчни форми на живот. Има два вида клетъчна организация: прокариотни
и еукариотен (
виж фиг.1 ).
Клетките от прокариотния тип са сравнително прости. Те нямат морфологично изолирано ядро, единствената хромозома е образувана от кръгова ДНК и се намира в цитоплазмата; липсват мембранни органели (функцията им се изпълнява от различни инвагинации на плазмената мембрана); в цитоплазмата има множество малки рибозоми; микротубули липсват, така че цитоплазмата е неподвижна, а ресничките и флагелата имат специална структура. Бактериите се класифицират като прокариоти.
Повечето съвременни живи организми принадлежат към едно от трите царства – растения, гъби или животни, обединени в надцарството на еукариотите.
В зависимост от броя на организмите, които са съставени, последните се делят на едноклетъчни и многоклетъчни. Едноклетъчните организми се състоят от една клетка, която изпълнява всички функции. Много от тези клетки са много по-сложни от клетките на многоклетъчен организъм. Всички прокариоти са едноклетъчни, както и протозоите, някои зелени водорасли и гъбички.
Съдържание на темата "Генетични елементи на бактериите. Мутации в бактерии. Трансдукция.":1. Мигриращи генетични елементи на бактерии. Транспозони. Бактериофагите като мигриращи генетични елементи.
2. Мутация. мутации в бактерии. Мутагени. спонтанни мутации. Обратни мутации (реверсии).
3. Индуцирани мутации на бактерии. химична мутагенеза. радиационна мутагенеза. Видове мутации.
4. ДНК възстановяване на бактерии. Системи за възстановяване на ДНК. Компенсация на функциите, нарушени в резултат на мутации. Вътрешно потискане. Екстрагенно потискане.
5. Трансфер на бактериална ДНК. бактериална конюгация. F-фактор на бактериите.
6. Трансформация на бактерии. Етапи на бактериална трансформация. Картиране на бактериални хромозоми.
7. Трансдукция. Неспецифична трансдукция. специфична трансдукция. Абортивна трансдукция. Феноменът лизогения.
8. Свойства на бактериите. Ненаследствени промени в свойствата на бактериите. S - колонии. R - колонии. М - колонии. D - бактериални колонии.
Ремонт на бактериална ДНК. Системи за възстановяване на ДНК. Компенсация на функциите, нарушени в резултат на мутации. Вътрешно потискане. Екстрагенно потискане.
В клетката има механизми, които могат напълно или частично да възстановят първоначалната структура на променената ДНК. Мутации, причинени от радиация химикалии други фактори, теоретично биха могли да доведат до изчезване на бактериалната популация, ако последната бъде лишена от способността да възстановяване на ДНК. Наборът от ензими, които катализират корекцията на увреждането на ДНК, се комбинира в така наречените възстановителни системи, които се различават фундаментално по биохимичните механизми на „изцеление“ на увреждането. Има три основни направления за коригиране на ДНК дефекти.
1. Директно връщане от увредена ДНКкъм оригиналната структура, когато промени в ДНКкоригирано чрез една ензимна реакция. Например отстраняване на неправилно прикрепена метилова група при шести кислороден атом на гуанин с помощта на метилтрансфераза; или разцепване на облъчения тиминов димер чрез фотолиаза ( рекомбинационен ремонт).
2. "Режещи" щетипоследвано от възстановяване на оригиналната структура (ексцизионен ремонт).
3. Активиране на специални механизмикоито гарантират оцеляване в случай на повреда ДНК(възстановяване на оригиналната структура ДНКв резултат на рекомбинация; корекция на базовото несъответствие; транслационен синтез върху увредена матрица ДНК). Тези механизми не винаги водят до пълно възстановяване на оригиналната структура на ДНК.
Компенсация на функциите, нарушени в резултат на мутации
първична мутацияможе да бъде компенсирана от вторична мутация, възникнала в мутиралия ген (интрагенно) или в друг ген (екстрагенно). Промени, които премахват проявите на мутация, без да коригират първоначалното нарушение в ДНК, Наречен потискане.
вътрешногенно потисканепричинено от вторична мутация, която коригира ефектите на първичната мутация. Например, точкова мутация, водеща до синтеза на дефектен протеин със загубена биологична активност, може да бъде коригирана, ако вторична точкова мутация води до кодиране на аминокиселина, която запазва конфигурацията и активността на протеина. Точното възстановяване на оригиналната структура на гена се нарича истинска обратна мутация ( истинска реверсия). Ако ефектът от първата мутация се компенсира от мутация в друга част на гена, такива мутации се наричат вторични реверсии.
Екстрагенно потискане- потискане на проявата на мутация, възникнала в един ген, поради мутация във втория ген.