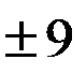Tema 5. ORGANSKI SPOJEVI KOJI SADRŽE DUŠIK
Lekcija 51
Tema lekcije. Anilin, njegov sastav, molekularna struktura, fizička svojstva. Kemijska svojstva anilina: interakcija s anorganskim kiselinama, bromna voda.
Međusobni utjecaj atoma u molekuli anilina. Dobivanje anilina
Ciljevi lekcije: upoznati studente s anilinom kao predstavnikom nitro spojeva, njegovim fizikalnim svojstvima; dati ideju o strukturi molekule anilina; smatrati Kemijska svojstva anilin, metode njegove pripreme i upotrebe.
Vrsta sata: kombinirani sat ovladavanja znanjima, vještinama i sposobnostima te njihove kreativne primjene u praksi.
Oblici rada: priča nastavnika, heuristički razgovor, laboratorijski rad.
Demonstracija 1. Reakcija anilina s kloridnom kiselinom.
Demonstracija 2. Reakcija anilina s bromnom vodom.
Oprema: dijagram strukture molekule anilina.
1. Zašto se amini nazivaju organskim bazama?
Tri učenika su za pločom, ostali rade zadatak u bilježnicama.
2. Sastavite jednadžbe za interakcijske reakcije:
a) metilamin sa sumpornom kiselinom;
b) dimetilamin s nitratnom kiselinom;
c) metiletilamin s kloridnom kiselinom.
3. Uzmite etilamin:
a) iz odgovarajućeg nitro spoja;
b) iz odgovarajućeg alkohola;
c) s etilamin kloridom.
4. Kako se klasificiraju amini prema vrsti ugljikovodičnih radikala?
III. Učenje novog gradiva
1. Povijest otkrića anilina
Anilin (fenilamin) - organski spoj s formulom C 6 H 5 NH 2, najjednostavniji aromatski amin. je bezbojna uljasta tekućina karakterističnog mirisa, malo teža od vode i slabo topljiva u njoj, topiva u organskim otapalima. Na zraku anilin brzo oksidira i dobiva crveno-smeđu boju. Otrovno.
Anilin je prvi dobio 1826. godine njemački kemičar u procesu destilacije indiga s vapnom, koji mu je dao naziv "kristalini". 1834. F. Runge otkrio je anilin u katranu ugljena i nazvao ga "kyanol". 1841. Yu F. Frishtse dobio je anilin zagrijavanjem indiga s otopinom KOH i nazvao ga "anilin". Godine 1842. anilin je dobio M. M. Zinin redukcijom s nitrobenzenom (NH 4) 2SO 3 i nazvao ga "benzidam". 1843. A. V. Hoffman utvrdio je identitet svih navedenih spojeva. Riječ "anilin" dolazi od naziva jedne od biljaka koje sadrže indigo - Indigofera anil (suvremeni međunarodni naziv biljke je Indigofera suffruticosa).
Anilin je najjednostavniji aromatski amin. Amini su slabije baze od amonijaka jer je nepodijeljeni elektronski par atoma dušika pomaknut prema benzenskom prstenu, spajajući se s p-elektronima benzenskog prstena.
Smanjenje gustoće elektrona na atomu dušika dovodi do smanjenja sposobnosti uklanjanja protona iz slabih kiselina. Stoga je anilin slabija baza od alifatskih amina i amonijaka, u interakciji je samo s jakim kiselinama (HCl, H2SO4), a njegov vodena otopina ne postaje lakmus plava.
2. Dobivanje anilina
♦ Predloži načine dobivanja anilina.
Redukcija nitro spojeva obično se koristi za dobivanje primarnih amina aromatske serije (Zininova reakcija).
Atomski vodik nastaje u trenutku oslobađanja kao rezultat reakcije cinka (ili aluminija) s kiselinom ili lužinom.
U početku se anilin dobivao redukcijom nitrobenzena s molekulskim vodikom; praktični prinos anilina nije prelazio 15%. Godine 1842. profesor Sveučilišta u Kazanu N.M. Zinin razvio je racionalniju metodu za proizvodnju anilina redukcijom nitrobenzena (Zininova reakcija):
Tijekom interakcije koncentrirane klorovodične kiseline sa željezom oslobađa se atomski vodik, koji je kemijski aktivniji od molekularnog vodika.
3. Kemijska svojstva anilina
Anilin je slaba baza. Anilin može tvoriti soli s jakim kiselinama.
Demonstracija 1. Reakcija anilina s kloridnom kiselinom
Pripremimo smjesu anilina i vode. Dodajte kloridnu kiselinu u smjesu. Anilin se otapa. U otopini nastaje fenilamonijev klorid ili anilin hidroklorid.
Zadatak 1. Napišite jednadžbe interakcije anilina i sumporne kiseline.
Amino skupina utječe na benzenski prsten, uzrokujući povećanje pokretljivosti vodikovih atoma u usporedbi s benzenom, a zbog konjugacije slobodnog elektronskog para s p-elektronskim aromatskim sustavom, povećava se gustoća elektrona u orto i para položajima. .
Tijekom procesa nitriranja i bromiranja, anilin lako stvara 2,4,6-trisupstituirane produkte reakcije. Na primjer, anilin snažno reagira s bromnom vodom stvarajući bijeli talog 2,4,6-tribromoanilina. Ova reakcija se koristi za kvalitativno i kvantitativno određivanje anilina:

Demonstracija 2. Međudjelovanje anilina s bromnom vodom Anilin se lako oksidira. Na zraku anilin postaje smeđi i djelovanjem drugih oksidansa stvara tvari raznih boja. S izbjeljivačem CaOCl 2 daje karakterističnu ljubičastu boju. Ovo je jedna od najosjetljivijih kvalitativnih reakcija na anilin.
*Reakcija anilina s nitritnom kiselinom pri niskoj temperaturi (oko 0 °C) od praktične je važnosti. Kao rezultat te reakcije (reakcija diazotubinacije) nastaju diazonijeve soli koje se koriste u sintezi nitrobarija i niza drugih spojeva.
Na višim temperaturama dolazi do reakcije uz oslobađanje dušika, a anilin se pretvara u fenol:
4. Primjena anilina. Štetno djelovanje na ljude
1) Glavno područje primjene anilina je sinteza boja i lijekovi.
Industrijska proizvodnja ljubičaste boje mauvein na bazi anilina započela je 1856. Oksidacijom anilina sa smjesom kroma (K 2Cr 2O 7 + H 2SO 4), "anilin crna je boja za tkanine."
Sada se velika većina (85%) anilina proizvedenog u svijetu koristi za proizvodnju metil diizocijanata, koji se kasnije koriste za proizvodnju poliuretana. Anilin se također koristi u proizvodnji umjetne gume (9%), herbicida (2%) i bojila (2%).
Dakle, anilin se primarno koristi kao intermedijer u proizvodnji boja, eksploziva i lijekova (sulfonamidi), no s obzirom na očekivani rast proizvodnje poliuretana, u srednjem roku moguća je značajna promjena u potrošačkoj slici.
2) Anilin utječe na središnji živčani sustav, uzrokuje gladovanje organizma kisikom zbog stvaranja methemoglobina u krvi, hemolize i degenerativnih promjena crvenih krvnih zrnaca. Anilin u organizam ulazi disanjem, u obliku pare, kao i kroz kožu i sluznicu. Apsorpciju kroz kožu pojačava zagrijavanje zraka ili pijenje alkohola.
U slučaju blagog trovanja anilinom, opaža se slabost, vrtoglavica, glavobolja, cijanoza usana, ušiju i noktiju. U slučajevima umjerenog trovanja uočava se i mučnina, povraćanje, ponekad i teturanje u hodu te ubrzan rad srca. Teži slučajevi trovanja izuzetno su rijetki.
Kod kroničnog trovanja anilinom (aniliza) dolazi do toksičnog hepatitisa, neuropsihičkih poremećaja, poremećaja spavanja i poremećaja pamćenja.
U slučaju trovanja anilinom, potrebno je prije svega ukloniti žrtvu od izvora trovanja i oprati toplom (ali ne vrućom!) Vodom. Također je potrebno udisanje kisika s karbogenom. Osim toga, koriste se puštanje krvi, uvođenje protuotrova (metilensko plavo) i lijekovi za kardiovaskularni sustav. Žrtvu treba držati u miru.
IV. Sažimanje lekcije
Sažimamo sat i ocjenjujemo rad učenika na satu.
V. Domaća zadaća
Proradite gradivo u odlomku, odgovorite na pitanja o njemu i dovršite vježbe.
Kreativni zadatak: pronađite informacije o temi “Utjecaj anilina na okoliš.”
Ciljevi lekcije: na primjeru anilize učvrstiti znanje učenika o kemijskim svojstvima amina; dati ideju o aromatskim aminima; pokazati praktično značenje anilina kao najvažnijeg proizvoda kemijske industrije.
Oprema: na demonstracijskom stolu - anilin, voda, fenolftalein, klorovodična kiselina, otopina lužine, epruvete.
Anilin se proučava kako bi se odredio opći koncept o aminima i kao najvažnijem predstavniku ove klase spojeva.
U tom smislu, nastava se može provesti u obliku priče uz maksimalno uključivanje učenika u raspravu o zadacima i pitanjima:
Navedite homologne nizove ugljikovodika i navedite značajke njihove strukture.
Koje tvari su amini?
Koja je formula aromatskog amina?
Kako dokazati da anilin pokazuje osnovna svojstva? Napiši jednadžbu kemijske reakcije.
Zatim se učenicima skreće pozornost na reakciju između anilina i broma, ne zadržavajući se na utjecaju amino skupine na benzenski prsten, već samo ističući da strukturne značajke molekule anilina omogućuju izvođenje ove reakcije.
O proizvodnji i uporabi anilina za proizvodnju boja, raznih lijekova, fotoreagensa, eksploziva, plastike itd. kaže učiteljica.
U ovoj lekciji, po našem mišljenju, preporučljivo je u priči o proizvodnji i uporabi anilina primijetiti toksične učinke emisija iz proizvodnje i nusproizvoda pri korištenju amino spojeva.
Detaljan plan lekcije
Prilikom proučavanja ove teme potrebno je konsolidirati osnovnu ideju o razvoju organska tvar i razlozi koji dovode do njihove raznolikosti; produbiti pojam kovalentne veze na primjerima amina; proširiti znanja o vodikovim vezama i amfoternim spojevima.
Pri početku razmatranja teme od učenika se traži da se prisjete koje spojeve koji sadrže dušik poznaju. Učenici imenuju nitrobenzen, nitroglicerin, trinitrocelulozu. Ukratko ponoviti podatke o svojstvima nitrobenzena i njegovoj proizvodnji u laboratoriju. Pritom na ploči sastavljaju jednadžbu reakcije, bilježe njezinu vrstu (supstitucija) i daju joj naziv (reakcija nitracije). Na pitanje mogu li se provoditi reakcije nitracije zasićenih ugljikovodika učenici daju potvrdan odgovor. Nakon toga napišite jednadžbe za reakcije nitracije do petog homologa. Učitelj napominje da je ove reakcije prvi izveo ruski znanstvenik M.I. Konovalov 1886. Po analogiji s nitrobenzenom, on daje imena novodobivenim tvarima koje sadrže dušik - nitrometan, nitroetan itd. Zatim nastavnik ukratko upoznaje učenike s fizikalnim svojstvima dobivenih homologa. Među kemijskim svojstvima nitro spojeva valja istaknuti njihovu sposobnost redukcije vodikom. Kako bi se učenici uvjerili u nastanak homolognog niza novih tvari koje sadrže dušik i samostalno ih imenovali, izrađuju jednadžbe reakcije:
CH3NO2 + 3H22H20 + CH3NH2
C 2 H 5 NO 2 + 3 H 2 2 H 2 O + C 2 H 5 NH 2
C 3 H 7 NO 2 + 3 H 2 2 H 2 O + C 3 H 7 NH 2, itd.
Obratite pozornost na nastanak nove funkcionalne skupine atoma – NH 2 – amino skupine. Ovdje treba napomenuti da se aminima nazivaju oni radikali koji su dio molekule, uz dodatak riječi "amin". Nakon toga učenici mogu lako imenovati nastale tvari: metilamin, etilamin itd. Uspoređujući prethodno napisane jednadžbe reakcija nitracije s reakcijama redukcije, zaključuju da genetska povezanost između homolognih nizova organskih tvari: ugljikovodici se mogu pretvoriti u nitro spojeve, a nitro spojevi u amine:
CH4 + HNO3H20 + CH3NO2;
CH3NO2 + 3H22H20 + CH3NH2.
Ovi spojevi su masni amini, budući da se dobivaju iz zasićenih ugljikovodika. Zatim su opisana fizikalna svojstva prvih članova niza amina. Prije nego što prijeđete na proučavanje njihovih kemijskih svojstava, obratite pozornost na sastav funkcionalne skupine. Amino skupina je ostatak iz amonijaka u kojem je jedan atom vodika zamijenjen radikalom ugljikovodika. Zatim predlažu da se amini smatraju derivatima amonijaka. Učenici primjećuju da se druga dva atoma vodika mogu zamijeniti radikalima ugljikovodika u amonijaku. Zatim, ovisno o broju ugljikovodičnih ostataka uključenih u molekulu, amini mogu biti
CH3NH2, C2H5NH2
primarni
sekundarni
tercijarni
U prirodi amini se nalaze tijekom razgradnje proteinskih spojeva; na primjer, salamura od haringe sadrži metilamin, dimetilamin, tri-metilamin. Svi amini su derivati amonijaka, pa mu moraju biti i slični. Ovo pitanje učenici mogu riješiti sami (za ovaj sat trebaju ponoviti svojstva amonijaka). Na primjer, jedan od učenika na lijevoj strani ploče zapisuje jednadžbe reakcija koje karakteriziraju kemijska svojstva amonijaka (reakcija s vodom, s kiselinama, izgaranje u struji kisika). Ovi pokusi su ovdje prikazani, posebno naglašavajući sposobnost amonijaka gori samo u protoku kisika.
Zatim se slični pokusi izvode s aminima (vidi stavak 1.1.3.1.). Na temelju pokusa izvode se zaključci o svojstvima amina.
Za razliku od amonijaka, amini izgaraju na zraku. Zaključuju: amini su po kemijskim svojstvima slični amonijaku, ali za razliku od njega gore na zraku. Ovo svojstvo dovelo je znanstvenika Wurtza do otkrića amina 1848. godine. Tijekom objašnjenja jednadžbe za reakcije s aminima ispisuju se na desnoj strani ploče paralelno sa svojstvima amonijaka. Kao rezultat usporedbe svojstava amonijaka i amina, učenici su uvjereni da među organskim tvarima postoje tvari sa svojstvima baza - organske baze. Ovo je objašnjeno na temelju elektronička struktura, razmatrajući primjer nastanka amonijevog iona. Podsjećamo, od pet valentnih elektrona atoma dušika, tri nesparena elektrona odlaze na stvaranje kovalentnih veza s atomima vodika, tvoreći molekulu amonijaka, a dva uparena elektrona ostaju nepodijeljena i slobodna. Zbog njih se uspostavlja kovalentna veza na atomu dušika s vodikovim ionom (protonom) vode ili kiseline. U ovom slučaju, u prvom slučaju, oslobađaju se hidroksilni ioni, koji određuju svojstva baza, u drugom - ioni kiselog ostatka. Razmotrimo elektronsku strukturu amina:
Posebna se pažnja posvećuje slobodnom elektronskom paru dušika, koji, kao u amonijaku, stvara kovalentnu vezu s protonom vodika. U ovom slučaju nastaje organski spoj sa svojstvima baze (1) ili soli (2), ako je vodikov proton (ion) iz kiseline:


Formula soli može se napisati drugačije:
CH 3. NH 2. HC1
Metilamin hidroklorid
Učenici znaju da su svojstva tvari određena njihovom građom. Usporedba elektronske strukture amonijevog hidroksida i metilamonija. znaju odrediti koje su tvari – amini ili amonijak – jače baze.
Preporučljivo je podsjetiti da je metilni radikal sposoban istisnuti elektronsku gustoću. Tada se na dušiku pojavljuje povećana gustoća elektrona i on će čvršće držati proton vodika u molekuli. Hidroksilni ion se oslobađa, njegova koncentracija u otopini raste, zbog čega su masni amini jače baze od amonijaka. Za učvršćivanje gradiva nastavnik postavlja pitanje: očekuje li se da će dimetilamin i trimetilamin pojačati ili oslabiti osnovna svojstva? Učenici znaju da je radikal sposoban istisnuti elektronsku gustoću pa samostalno zaključuju da bi di- i trisupstituirani amini trebali biti jače baze u odnosu na monosupstituirane. Dva radikala će u većoj mjeri povećati gustoću elektrona na dušiku, pa će stoga dušik jače zadržati vodikov ion, a hidroksilni ioni će početi ulaziti u otopinu, tj. snaga osnovnih svojstava amina ovisi o veličini negativnog naboja na atomu dušika: što je on veći, to je veća snaga baza. Čini se da bi tercijarni amin trebao biti najjača baza, ali eksperiment pokazuje suprotno. Očigledno tri metilna radikala štite slobodni par dušikovih elektrona, ometaju slobodnu adiciju vodikovih iona, pa prema tome malo hidroksilnih iona ulazi u otopinu, pa je medij slabo bazičan.
Kako bi učenici bolje razumjeli genetski odnos između klasa organskih tvari, analiziraju nastanak aromatskih amina od „pretka“ svih aromatskih ugljikovodika - benzena preko nitro spojeva. Najprije se ukratko podsjećaju na metode dobivanja masnih amina iz zasićenih ugljikovodika, zatim predlažu prisjećanje ranije proučavanih svojstava benzena i njihovo objašnjenje na temelju elektronske strukture benzena. Da biste to učinili, preporučljivo je postaviti tablicu elektroničke strukture benzena i pripremiti model njegove molekule. Tako će učenici sami “provući nit” od benzena do fenilamina kroz nitrobenzen i lako napisati odgovarajuće jednadžbe reakcije.
Ovdje pokazuju iskustvo dobivanja nitrobenzena u tikvici s povratnim kondenzatorom. Zapišite jednadžbu odgovarajuće reakcije na ploču. Zatim se provodi pokus redukcije dobivenog nitrobenzena u anilin. Tijekom ovog eksperimenta učenici su obaviješteni o reakciji N.N. Zinin i njegov značaj za narodnu ekonomiju.
Zatim demonstriraju čisti anilin (ako je dostupan u školi), govoreći o njegovoj toksičnosti i kako njime pažljivo rukovati. Pokazuju neka fizikalna svojstva: agregatno stanje, boju, miris, topljivost u vodi.
Zatim prelaze na proučavanje kemijskih svojstava anilina. Po analogiji s masnim aminima, pretpostavlja se da anilin ima bazična svojstva. U tu svrhu dodajte nekoliko kapi fenolftaleina u čašu u kojoj je ispitivana topljivost anilina u vodi. Boja otopine se ne mijenja. Provjeriti međudjelovanje anilina s koncentriranom klorovodičnom i sumpornom kiselinom. Nakon hlađenja smjese učenici promatraju kristalizaciju soli, dakle, anilin pokazuje svojstva baza, ne slabija od masnih amina. Tijekom rasprave o tim pokusima sastavljaju se jednadžbe reakcija i daju se imena dobivenim tvarima.
Zatim pokazuju interakciju anilinskih soli s alkalijama (povlačimo analogiju s amonijevim solima). Ovdje se, uzgred, postavlja pitanje: u kojem obliku se masni amini nalaze u salamuri od haringe ako ona reagira s alkalijama i stvara amine? (Učenici u pravilu odgovaraju: u obliku soli). Provjerava se njihova topljivost u vodi i međudjelovanje anilinskih soli s oksidansima, na primjer s kalijevim dikromatom. Ova reakcija detektira tvari različitih boja. Studenti su obaviješteni da se proizvodnja brojnih anilinskih boja (uključujući one vrijedne kao što je sintetski indigo) temelji na svojstvima anilina. ljekovite tvari, plastika. Zaključno, demonstriraju iskustvo interakcije anilina s izbjeljivačem. Primijećeno je da je ova reakcija karakteristična za anilin. Za testiranje se predlaže otkrivanje anilina u smjesi tvari dobivenih tijekom pokusa redukcije nitrobenzena s metalima. Učenici su se još jednom uvjerili u postojanje genetske povezanosti razreda. Kako bi se konsolidiralo naučeno, predlaže se sastavljanje jednadžbi reakcija koje potvrđuju mogućnost provođenja sljedećih transformacija:
Učenici će iskustvom uvidjeti da osnovna svojstva anilina su oslabljena u usporedbi s aminima limitirajućeg niza. To se objašnjava utjecajem aromatskog fenilnog radikala C 6 H 5 . Radi pojašnjenja, ponovno razmotrimo elektronsku strukturu benzena. Učenici se prisjećaju da pokretni elektronski oblak benzenove jezgre tvori šest elektrona (dobro je imati model molekule ili dobar crtež molekule benzena). Potrebno je naglasiti da se u benzenskom prstenu nalazi amino skupina umjesto jednog atoma vodika, nacrtati elektronsku strukturu molekule amina i još jednom obratiti pozornost na slobodni usamljeni par elektrona atoma dušika u amino skupini, koji stupa u interakciju s -elektronima benzenskog prstena. Kao rezultat toga, gustoća elektrona na dušiku se smanjuje, slobodni par elektrona drži proton vodika s manjom silom, a malo hidroksilnih iona ulazi u otopinu. Sve to uvjetuje slabija bazična svojstva anilina, što je uočeno kada je reagirao s indikatorima.
Usamljeni par dušikovih elektrona amino skupine, u interakciji s -elektronima benzenskog prstena, pomiče elektronsku gustoću u orto i para položaj, čineći benzenski prsten kemijski aktivnijim na tim mjestima. To se lako potvrđuje iskustvom interakcije anilina s bromnom vodom, što se odmah pokazuje:


Zaključno, učenici trebaju obratiti pozornost na povezanost tvari koja postoji u prirodi, na njihov razvoj od jednostavnog prema složenom.
Vrsta lekcije: lekcija učenja novog materijala na temelju postojećeg znanja
Svrha lekcije: Generalizirati, proširiti i sistematizirati znanja i pojmove učenika u proučavanom odjeljku "Amins". Usredotočite se na ključne koncepte teme "Anilin".
Predviđeni rezultat: Znanje će se generalizirati i sistematizirati sa svrhom.
Ciljevi lekcije:
Obrazovni:
Provjerite svoje znanje o dijelu koji ste učili i učvrstite ga novi materijal, produbiti znanje o temi; sažeti proučeno gradivo; provjera usvojenosti gradiva na temelju kreativnih zadataka; razvijati sposobnost primjene stečenog znanja u praksi pri izvođenju vježbi i rješavanju zadataka;
Obrazovni:
Poticati razvoj sposobnosti procjenjivanja prijatelja i sebe; razvijati sposobnost izražavanja vlastitog stajališta, vođenja argumentiranog razgovora i donošenja zaključaka na temelju analize; pomoći učenicima da vide rezultate svoga rada; razvijati kod učenika sposobnost isticanja glavnoga; razviti kognitivnu aktivnost I Kreativne vještine.
Obrazovni:
Njegovati aktivnu životnu poziciju, poštenje i ljudsku pristojnost; kroz nastavu ulijevati samopouzdanje učenicima; dovesti učenike do zaključka o intrinzičnoj vrijednosti ljudskih kvaliteta.
Tijekom nastave
I Organizacijska i motivacijska faza (1 min)
Cilj etape (očekivani rezultat): motivirati učenike za aktivan rad
Ciljevi faze: Postavite učenike za visok tempo lekcije
Pozdrav učenicima s razredom. Danas će naša lekcija biti vrlo intenzivna i suočit ćemo se s nizom zadataka.
Ali prvo zapišite domaću zadaću D-Z slajda 2
(dnevnički zapis)
1. § 52, § 51 ponoviti.
2. § 52, br. 4-6 pismeno, 1-3 usmeno
I I Postavljanje ciljeva (1,5 min)
Cilj: Sažeti znanje o završenom odjeljku "Amini", steći znanje o temi lekcije, moći usporediti anilin s drugim predstavnicima aromatskih i alifatskih amina
Ciljevi: Slajd 3 Ciljevi lekcije
Prisjetiti se fizikalnih i kemijskih svojstava amina; nastaviti razvijati sposobnost sastavljanja reakcijskih jednadžbi koje karakteriziraju svojstva amina; upoznati se sa značajkama kemijskih procesa u odjeljku "Anilin"; nastaviti učiti vidjeti razlog protoka kemikalija. reakcije ovisno o strukturi molekule; ocijenite svoj rad u razredu.
III Glavni dio. Učenje novih stvari na temelju poznatih činjenica
Struktura amina i anilina
Učenje novog gradiva na temelju postojećeg znanja
Amini su organski derivati u kojima su jedan, dva ili sva tri atoma zamijenjeni ugljikovodičnim ostatkom.
Prema tome, obično se razlikuju tri vrste amina:
primarni amin metilamin
CH3CH2—NH—CH2CH3
sekundarni amin dietilamin
H3CH2—N—CH2CH3
tercijarni amin trietilamin
Amine karakterizira strukturna izomerija:
Izomerija ugljikovog skeleta
Izomerija položaja funkcionalne skupine
Primarni, sekundarni i tercijarni amini su međusobno izomerni (interklasna izomerija).
Obuka o izomeriji i nomenklaturi amina
Učenje novog gradiva
Elektronska struktura anilina
Amini u kojima je amino skupina vezana izravno na aromatski prsten nazivaju se aromatski amini.
Najjednostavniji predstavnik ovih spojeva je aminobenzen, odnosno anilin.
Glavna značajka razlikovanja elektronske strukture amina je prisutnost slobodnog elektronskog para na atomu uključenom u funkcionalnu skupinu. To uzrokuje da amini pokazuju svojstva baza.
Postoje ioni koji su proizvod formalne zamjene svih vodikovih atoma u amonijevom ionu radikalom ugljikovodika.
Ti se ioni nalaze u solima sličnim amonijevim solima. Zovu se kvaterne soli.
Obuka o izomeriji i nomenklaturi aromatskih amina
Proučavanje fizikalnih svojstava anilina u usporedbi s fizikalnim svojstvima amina
Fizikalna svojstva amina i anilina
Najjednostavniji amini (metilamin, dimetilamin, trimetilamin) - plinovite tvari. Preostali niži amini su tekućine koje se dobro otapaju u vodi. Imaju karakterističan miris koji podsjeća na amonijak.
Primarni i sekundarni amini mogu stvarati vodikove veze. To dovodi do primjetnog povećanja njihovih vrelišta u usporedbi sa spojevima koji imaju isto Molekularna težina, ali ne mogu tvoriti vodikove veze.
Anilin je uljasta tekućina, teško topiva u vodi, vrela je na temperaturi od 184 °C.
Ruski organski kemičar, akademik.
otkrio (1842) reakciju redukcije aromatskih nitro spojeva i dobio anilin. Dokazano da su amini baze koje mogu tvoriti soli s različitim kiselinama. Anilin ima toliku industrijsku važnost da samo jednom reakcijom ime ovog znanstvenika može biti zapisano “zlatnim slovima” u povijesti kemije.
Kemijska svojstva amina i anilina
Kemijska svojstva amina uglavnom su određena prisutnošću slobodnog elektronskog para na atomu dušika.
1. Amini kao baze. Atom dušika amino skupine, poput atoma dušika u molekuli amonijaka, zbog usamljenog para elektrona može formirati kovalentna veza prema donor-akceptorskom mehanizmu, djelujući kao donor. U tom smislu, amini, poput amonijaka, mogu vezati kation vodika, tj. djelovati kao baza.
Kao što već znate iz tečaja, reakcija amonijaka s vodom dovodi do stvaranja hidroksidnih iona. Otopina amonijaka u vodi ima alkalnu reakciju. Otopine amina u vodi također daju alkalnu reakciju. Ali anilin je slabija baza i nerado reagira.
Amonijak reagira s kiselinama stvarajući amonijeve soli. Amini također mogu reagirati s kiselinama.
Osnovna svojstva alifatskih amina su izraženija nego kod amonijaka. To je zbog prisutnosti jednog ili više donorskih alkilnih supstituenata, čiji pozitivni induktivni učinak povećava gustoću elektrona na atomu dušika. Povećanje gustoće elektrona pretvara dušik u snažnijeg donora elektronskog para, što poboljšava njegova osnovna svojstva.
Anilin također ima bazična svojstva u reakcijama s kiselinama, ali su ona manje izražena nego kod alifatskih amina.
U slučaju aromatskih amina, amino skupina i benzenski prsten imaju značajan utjecaj jedni na druge.
Amino skupina je orijentacijsko sredstvo prve vrste. Amino skupina ima negativan induktivni učinak i izraženi pozitivni mezomerni učinak. Stoga će reakcije elektrofilne supstitucije (bromiranje, nitriranje) dovesti do orto- i para-supstituiranih proizvoda.
Imajte na umu da, za razliku od benzena, koji se bromira samo u prisutnosti katalizatora - željezovog (III) klorida, anilin može reagirati s bromnom vodom. To se objašnjava činjenicom da amino skupina, povećavajući gustoću elektrona u benzenskom prstenu (sjetite se sličnog učinka supstituenata u molekulama toluena i fenola), aktivira aromatski sustav u reakcijama elektrofilne supstitucije. Osim toga, anilin je, za razliku od benzena, slabo topljiv u vodi.
Konjugacija p-sustava benzenskog prstena s slobodnim elektronskim parom amino skupine dovodi do činjenice da je anilin znatno slabija baza od alifatskih amina.
Prikazane su značajke reakcija potpune i nepotpune oksidacije amina i anilina, međusobni prijelaz reakcija oksidacije i redukcije.
SVI PRIMJERI HRM-a SU BILJEŽENI, PROIZVODI IMENOVANI (objašnjenje se daje u obliku heurističkog razgovora)
Dobivanje amina i anilina
1. Dobivanje amina iz halogenih derivata
CH3CH2Br + NH3 -> CH3CH2NH2 C6H5Br + NH3 -> C6H5NH2
2. Dobivanje primarnih amina redukcijom nitro spojeva - alifatskih i aromatskih. Reducirajuće sredstvo je vodik "u trenutku oslobađanja", koji nastaje interakcijom, na primjer, cinka s alkalijom ili željeza s klorovodičnom kiselinom.
Primjena amina i anilina
Amini se široko koriste za proizvodnju lijekova i polimernih materijala. anilin - kritična veza ove klase (dijagram), koji se koristi za proizvodnju anilinskih boja, lijekova (sulfonamidni lijekovi), polimernih materijala (anilin formaldehidne smole), eksploziva, raketnog goriva i pesticida.
"Reaktivne" ili "reaktivne" boje najbolji su izbor anilinskih boja na današnjem tržištu. Ova skupina boja pokazala se izvrsnom za tkanine od biljnih vlakana (pamuk, lan, viskoza, konoplja, bambus, papir, juta itd.).
IV Učvršćivanje proučenog gradiva
1. Označite broj y-veza u molekuli metil-fenilamina:
a) 6; b) 5; na 7; d) 4.
2. Koja se svojstva anilina objašnjavaju utjecajem fenilnog radikala na amino skupinu:
a) anilin lakše prolazi reakcije supstitucije od benzena;
b) gustoća elektrona u aromatskom prstenu je neravnomjerno raspoređena;
c) za razliku od amonijaka, vodena otopina anilina ne mijenja boju lakmusa;
d) kako je anilin slabija baza od amonijaka?
3. Pišite grafičke formule izomerni amini opće molekulske formule C4H11N. Imenuj te tvari.
4. a) Dobiti amonijev fenil klorid iz anorganskih sirovina.
HC1 + KOH alkohol +HI +NH3 +HC1
b) Propanol-2 → ? → ? → ? → ? → ?
5. Odredite masu 19,6% otopine sumporne kiseline koja može reagirati s 11,2 litre metilamina (n.s.) da bi nastala prosječna sol.
6. Smjesa fenola i anilina potpuno je reagirala s 480 g bromne vode s w (Br2) = 3%. Za neutralizaciju produkata reakcije utrošeno je 36,4 cm3 otopine NaOH (w = 10%, p = 1,2 g/cm3). Odredite masene udjele tvari u izvornoj smjesi.
7. Za neutralizaciju 30 g smjese benzena, fenola i anilina potrebno je 49,7 ml 17%-tne HC1 (p = 1,0 g/ml). U reakciji iste količine smjese s bromnom vodom nastaje 99,05 g taloga. Odredite masene udjele komponenata u izvornoj smjesi.
V Ocjenjivanje aktivnosti na satu. Odraz.
Struktura anilina
Najjednostavniji predstavnik klase aromatskih amina je anilin. To je uljasta tekućina, slabo topljiva u vodi (slika 1).
Riža. 1. Anilin

Neki drugi aromatski amini (slika 2):

orto-toluidin 2-naftilamin 4-aminobifenil
Riža. 2. Aromatski amini
Kako kombinacija benzenskog prstena i supstituenta koji ima slobodni elektronski par utječe na svojstva tvari? Elektronski par dušika uvučen je u aromatski sustav (slika 3):

Riža. 3. Sustav aroma
Čemu to vodi?
Osnovna svojstva anilina
Elektronski par anilina se "povlači" u opći aromatski sustav, a gustoća elektrona na anilinskom dušiku se smanjuje. To znači da će anilin biti slabija baza od amina i amonijaka. Anilin ne mijenja boju lakmusa i fenolftaleina.

Elektrofilna supstitucija u anilinu
Povećana gustoća elektrona u benzenskom prstenu (zbog apsorpcije dušikovog elektronskog para) dovodi do lakše elektrofilne supstitucije, osobito na orto i para položajima.
Anilin reagira s bromnom vodom, u ovom slučaju, odmah se formira
2,4,6-tribromoanilin - bijeli talog (kvalitativna reakcija na anilin i druge aminbenzene).
Podsjetimo: benzen reagira s bromom samo u prisutnosti katalizatora (slika 4).

Riža. 4. Interakcija anilina s bromom
Oksidacija anilina
Visoka gustoća elektrona u benzenskom prstenu olakšava oksidaciju anilina. Anilin je obično obojen smeđe zbog činjenice da dio njega oksidira atmosferski kisik čak i pod normalnim uvjetima.
Primjena anilina i amina
Anilinske boje, koje se odlikuju postojanošću i svjetlinom, dobivaju se iz produkata oksidacije anilina.
Anestezin i novokain, koji se koriste za lokalnu anesteziju, dobivaju se iz anilina i amina; antibakterijsko sredstvo streptocid; popularni lijek protiv bolova i antipiretik paracetamol (slika 5):


Anestezin novokain
![]()

streptocid paracetamol
(para-aminobenzensulfamid (para-acetoaminofenol)
Riža. 5. Derivati anilina
Anilin i amini su sirovine za proizvodnju plastike, fotoreagensa i eksploziva. Eksplozivni heksil (heksanitrodifenilamin) (slika 6):

Riža. 6. Heksil
Dobivanje anilina i amina
1. Zagrijavanje haloalkana s amonijakom ili manje supstituiranim aminima (Hoffmannova reakcija).
CH3Br + NH3 = CH3NH2 + HBr (točnije CH3NH3Br);
SH3NH2 + CH3Br = (CH3)2NH + HBr (točnije (CH3)2NH2Br);
(CH3)2NH + CH3Br = (CH3)3N + HBr (točnije (CH3)3NHBr).
2. Istiskivanje amina iz njihovih soli zagrijavanjem s alkalijama:
CH3NH3Cl + KOH = CH3NH2- + KCl + H2O.
3. Redukcija nitro spojeva (Zininova reakcija):
S6N5NO2 + 3Fe + 6HCl = C6H5NH2 + 3FeCl2 + 2H2O;
S6N5NO2 + 3H2 S6N5NH2 + 2H2O.
Sažimanje lekcije
Ova lekcija pokrivala je temu „Značajke svojstava anilina. Dobivanje i uporaba amina." U ovoj ste lekciji proučavali svojstva anilina koja su određena međusobnim utjecajem aromatske strukture i atoma vezanog na aromatski prsten. Također smo pogledali metode za proizvodnju amina i njihova područja primjene.
Bibliografija
Rudzitis G. E., Feldman F. G. Kemija: Organska kemija. 10. razred: udžbenik za općeobrazovne ustanove: osnovna razina / G. E. Rudzitis, F. G. Feldman. - 14. izdanje. - M.: Obrazovanje, 2012. Kemija. 10. razred. Razina profila: udžbenik za opće obrazovanje institucije/ V.V. Eremin, N.E. Kuzmenko, V.V. Lunin, A.A. Drozdov, V.I. Terenin. - M.: Bustard, 2008. - 463 str. Kemija. 11. razred. Razina profila: akademski. za opće obrazovanje institucije/ V.V. Eremin, N.E. Kuzmenko, V.V. Lunin, A.A. Drozdov, V.I. Terenin. - M.: Bustard, 2010. - 462 str. Khomchenko G. P., Khomchenko I. G. Zbirka problema iz kemije za kandidate na sveučilištima. - 4. izd. - M.: RIA "Novi val": Izdavač Umerenkov, 2012. - 278 str.
Domaća zadaća
Broj 5, 8 (str. 14) Rudzitis G. E., Feldman F. G. Kemija: Organska kemija. 10. razred: udžbenik za općeobrazovne ustanove: osnovna razina / G. E. Rudzitis, F. G. Feldman. - 14. izdanje. - M.: Obrazovanje, 2012. Usporedite svojstva graničnih serija amina i anilina. Na primjeru anilina objasnite bit utjecaja atoma u molekuli.
Organska kemija. Web stranica o kemiji. Internet portal promobud.
U odjeljku na pitanje Anilin je predstavnik amina, struktura, funkcionalna skupina!? dao autor Dlaka najbolji odgovor je Anilin (fenilamin) je organski spoj formule C6H5NH2, najjednostavniji aromatski amin. Sadrži amino skupinu -NH2. To je bezbojna uljasta tekućina karakterističnog mirisa, malo teža od vode i slabo topljiva u njoj, topiva u organskim otapalima. Na zraku brzo oksidira i dobiva crveno-smeđu boju. Otrovno.
Anilin karakteriziraju reakcije i na amino skupini i na aromatskom prstenu. Značajke ovih reakcija posljedica su međusobnog utjecaja atoma. S jedne strane, benzenski prsten slabi osnovna svojstva amino skupine u usporedbi s alifatskim aminima, pa čak i amonijakom. S druge strane, pod utjecajem amino skupine, benzenski prsten postaje aktivniji u reakcijama supstitucije od benzena. Na primjer, anilin snažno reagira s bromnom vodom stvarajući 2,4,6-tribromoanilin (bijeli talog).
Osnovni, temeljni način dobivanja anilina-katalitički. redukcija nitrobenzena vodikom u plinovitoj ili tekućoj fazi. Proces plinske faze provodi se u cjevastom kontaktnom aparatu na 250-350°C na kotaču koji sadrži nikal ili bakar.
S6N5NO2 + 3H2 = C6H5NH2 + 2H2O + 443,8 kJ/mol
Anilin se odvaja od vode separacijom i pročišćava destilacijom; reakcija voda se biokemijski neutralizira. Za dobivanje 1 tone anilina utroši se 1,35 tona nitrobenzena, 800 m3 H2 i 1 kg katalizatora.
U tekućoj fazi anilin se dobiva na povišenim temperaturama. tlak H2 (do 1,1 MPa) i 160-170°C na niklu ili paladiju kat. s istodobnim destilacija vode i anilina uslijed topline otopine.