разпръснатонаречени хетерогенни системи, при които едно вещество под формата на много малки частици е равномерно разпределено в обема на друго.
Веществото, което присъства в по-малко количество и е разпределено в обема на друго, се нарича дисперсна фаза. Може да се състои от няколко вещества.
Вещество, което присъства в по-голямо количество, в чийто обем е разпределена дисперсната фаза, се нарича дисперсионна среда. Между него и частиците на дисперсната фаза има интерфейс, поради което дисперсните системи се наричат хетерогенни (неравномерни).
Както дисперсионната среда, така и дисперсната фаза могат да бъдат представени от вещества в различни агрегатни състояния – твърдо, течно и газообразно.
В зависимост от комбинацията от агрегатното състояние на дисперсионната среда и дисперсната фаза могат да се разграничат 8 вида такива системи.
Според размера на частиците на веществата, които съставляват дисперсната фаза, дисперсните системи се разделят на груба(спиране) с размери на частиците над 100 nm и фино диспергирани(колоидни разтвори или колоидни системи) с размери на частиците от 100 до 1 nm. Ако веществото е фрагментирано до молекули или йони с размер по-малък от 1 nm, се образува хомогенна система – решение. Той е хомогенен (хомогенен), няма интерфейс между частиците на дисперсната фаза и средата.
Дори едно бегло запознаване с дисперсните системи и решения показва колко важни са те в ежедневието и в природата (виж таблицата).
Таблица. Примери за дисперсни системи
| Дисперсионна среда | Дисперсна фаза | Примери за някои естествени и домашни дисперсни системи |
| Газ | Течност | Мъгла, свързан газ с маслени капчици, карбураторна смес в автомобилните двигатели (бензинови капчици във въздуха), аерозоли |
| Солиден | Прах във въздуха, дим, смог, симуми (прашни и пясъчни бури), аерозоли | |
| Течност | Газ | Ефервесцентни напитки, пяна |
| Течност | емулсии. Телесни течности (кръвна плазма, лимфа, храносмилателни сокове), течно съдържание на клетките (цитоплазма, кариоплазма) | |
| Солиден | Соли, гелове, пасти (желета, желета, лепила). Речна и морска тиня, суспендирана във вода; минохвъргачки | |
| Солиден | Газ | Снежна кора с въздушни мехурчета в нея, почва, текстилни тъкани, тухли и керамика, гума от пяна, газиран шоколад, прахове |
| Течност | Влажна почва, медицински и козметични продукти (мехлеми, спирала, червило и др.) | |
| Солиден | Скали, цветни стъкла, някои сплави |
Преценете сами: без тиня на Нил нямаше да има голяма цивилизация древен Египет; без вода, въздух, скали и минерали, жива планета изобщо не би съществувала – нашата общ дом− Земята; без клетки не би имало живи организми и т.н.
Ако всички частици от дисперсната фаза имат еднакъв размер, тогава такива системи се наричат монодисперсни (фиг. 1, а и б). Частици от дисперсната фаза с нееднакъв размер образуват полидисперсни системи (фиг. 1, в).
Ориз. 1. Свободно диспергирани системи: корпускулярни - (a-c), фиброзни - (d) и филм-дисперсни - (e); a, b - монодисперсна; в - полидисперсна система.
Дисперсните системи могат да бъдат свободно разпръснати(фиг. 1) и кохерентно разпръснати(фиг. 2, а - в) в зависимост от отсъствието или наличието на взаимодействие между частиците на дисперсната фаза. Свободно диспергираните системи включват аерозоли, разредени суспензии и емулсии. Те са течни, в тези системи частиците на дисперсната фаза нямат контакти, участват в произволно топлинно движение, движат се свободно под действието на гравитацията. Кохезионно-дисперсните системи са твърди; те възникват, когато частиците от дисперсната фаза влязат в контакт, което води до образуването на структура под формата на рамка или мрежа. Такава структура ограничава течливостта на дисперсната система и й дава способността да запази формата си. Прахове, концентрирани емулсии и суспензии (пасти), пяни, гелове са примери за кохезионно диспергирани системи. Твърда маса от вещество може да бъде проникната от пори и капиляри, които образуват капилярно-дисперсни системи (кожа, картон, тъкани, дърво).

Ориз. 3. Кохезионно-дисперсна (а-в) и капилярно-дисперсна (г, д) системи: гел (а), коагулант с плътна (б) и рехаво - дъговидна (в) структура.
Дисперсните системи, в съответствие с тяхното междинно положение между света на молекулите и големите тела, могат да бъдат получени по два начина: чрез дисперсионни методи, т.е. смилане на големи тела, и чрез методи за кондензация на молекулни или йонни вещества.
Под взаимодействието на фазите на дисперсните системи имаме предвид процесите на солватация (хидратация при водните системи), т.е. образуване на солватни (хидратни) обвивки от молекулите на дисперсионната среда около частиците на дисперсната фаза . Съответно, според интензивността на взаимодействие между веществата на дисперсната фаза и дисперсионната среда (само за системи с течна дисперсионна среда), по предложение на G. Freindlich се разграничават следните дисперсни системи:
− Лиофилна (хидрофилен, ако DS е вода): мицеларни разтвори на повърхностноактивни вещества, критични емулсии, водни разтвори на някои естествени HMS, например протеини (желатин, яйчен белтък), полизахариди (нишесте). Те се характеризират със силно взаимодействие на DF частици с DS молекули. В граничния случай се наблюдава пълно разтваряне. Лиофилните дисперсни системи се образуват спонтанно поради процеса на солватация. Термодинамично агрегатно стабилен.
− Лиофобни (хидрофобни, ако DS е вода): емулсии, суспензии, золи. Те се характеризират със слабо взаимодействие на DF частици с DS молекули. Те не се образуват спонтанно, за тяхното формиране е необходимо да се изразходва работа. Термодинамично агрегативно нестабилни (т.е. склонни към спонтанно агрегиране на частици от дисперсната фаза), относителната им стабилност (т.нар. метастабилност) се дължи на кинетични фактори (т.е. ниска скорост на агрегиране).
3. Претеглете.
окачване са дисперсни системи, в които размерът на частиците на фазата е повече от 100 nm. Това са непрозрачни системи, отделни частици от които могат да се видят с просто око. Дисперсната фаза и дисперсната среда се разделят лесно чрез утаяване, филтриране. Такива системи се делят на:
1. емулсии (както средата, така и фазата са течности, неразтворими една в друга). От вода и масло можете да приготвите емулсия, като разклащате сместа дълго време. Това са добре познати млечни, лимфни, водни бои и др.
2. Суспензии (средата е течност, фазата е твърдо вещество, неразтворимо в нея) За да се приготви суспензия, веществото трябва да се смила на фин прах, да се излее в течност и да се разклати добре. С течение на времето частицата ще падне на дъното на съда. Очевидно, колкото по-малки са частиците, толкова по-дълго ще издържи суспензията. Това са строителни разтвори, речна и морска тиня, суспендирана във вода, жива суспензия на микроскопични живи организми в морска вода – планктон, които се хранят с гиганти – китове и др.
3. аерозоли суспензии в газ (например във въздух) на малки частици течности или твърди вещества. Прах, дим, мъгла се различават. Първите два вида аерозоли са суспензии на твърди частици в газ (по-големи частици в прахове), последният е суспензия на течни капчици в газ. Например: мъгла, гръмотевични облаци - суспензия от водни капчици във въздуха, дим - малки твърди частици. И смогът надвисна главни градовесвета, също аерозол с твърда и течна дисперсна фаза. Обитатели селищаблизо до циментовите заводи страдат от най-финия циментов прах, който винаги виси във въздуха, който се образува при смилането на циментовите суровини и продукта от неговото изпичане - клинкер. Димът от фабричните тръби, смогът, най-малките капчици слюнка, излитащи от устата на болен от грип, също са вредни аерозоли. Аерозолите играят важна роля в природата, ежедневието и човешките производствени дейности. Натрупване на облаци, третиране на полето с химикали, пръскане на боя, респираторно лечение (вдишване) са примери за явления и процеси, при които аерозолите са полезни. Аерозолите - мъгли над морския сърф, близо до водопади и фонтани, дъгата, която възниква в тях, доставя на човек радост, естетическо удоволствие.
За химията най-висока стойностимат диспергирани системи, в които среда е вода и течни разтвори.
Естествената вода винаги съдържа разтворени вещества. Естествените водни разтвори участват в процесите на образуване на почвата и доставят на растенията хранителни вещества. Сложните жизнени процеси, които протичат в човешките и животинските организми, също се срещат в разтвори. Много технологични процеси в химическата и други индустрии, като производството на киселини, метали, хартия, сода, торове, протичат в разтвори.
4. Колоидни системи.
колоидни системи (в превод от гръцки "кола" - лепило, "ейдос" вид на лепило) – това са дисперсни системи, при които размерът на частиците на фазата е от 100 до 1 nm. Тези частици не се виждат с невъоръжено око и дисперсната фаза и дисперсната среда в такива системи се разделят трудно.
Знаете от вашия общ курс по биология, че частици с такъв размер могат да бъдат открити с помощта на ултрамикроскоп, който използва принципа на разсейване на светлината. Поради това колоидната частица в него изглежда като ярка точка на тъмен фон.
Те се разделят на золи (колоидни разтвори) и гелове (желе).
1. Колоидни разтвори, или сол. Това е по-голямата част от течностите на жива клетка (цитоплазма, ядрен сок - кариоплазма, съдържанието на органели и вакуоли). И живият организъм като цяло (кръв, лимфа, тъканна течност, храносмилателни сокове и др.) Такива системи образуват лепила, нишесте, протеини и някои полимери.
В резултат на това могат да се получат колоидни разтвори химична реакция; например, когато разтвори на калиеви или натриеви силикати („разтворимо стъкло“) взаимодействат с киселинни разтвори, се образува колоиден разтвор на силициева киселина. Золът се образува и по време на хидролизата на железен (III) хлорид в гореща вода.
Характерно свойство на колоидни разтвори е тяхната прозрачност. Колоидните разтвори са външно подобни на истинските разтвори. Те се отличават от последните с получения „светещ път“ - конус, когато лъч светлина преминава през тях. Това явление се нарича ефект на Тиндал. По-големи, отколкото в истински разтвор, частиците на дисперсната фаза на зола отразяват светлината от повърхността си и наблюдателят вижда светещ конус в съд с колоиден разтвор. Не се образува в истинско решение. Подобен ефект, но само за аерозол, а не за течен колоид, може да се наблюдава в гората и в кината, когато лъч светлина от филмова камера преминава през въздуха на кинозалата.

Пропускане на лъч светлина през разтвори:
а - истински разтвор на натриев хлорид;
б – колоиден разтвор на железен (III) хидроксид.
Частиците от дисперсната фаза на колоидни разтвори често не се утаяват дори при продължително съхранение поради непрекъснати сблъсъци с молекули на разтворителя поради термично движение. Те не се слепват, дори когато се приближават един към друг поради наличието на едно и също име на повърхността им. електрически заряди. Това се обяснява с факта, че веществата в колоидно, т.е. във фино разделено състояние, имат голяма повърхност. На тази повърхност се адсорбират положително или отрицателно заредени йони. Например, силициева киселина адсорбира отрицателни SiO 3 2- йони, които са в изобилие в разтвор поради дисоциацията на натриевия силикат:

Частиците с подобни заряди се отблъскват и следователно не се слепват.
Но при определени условия може да възникне процесът на коагулация. При кипене на някои колоидни разтвори настъпва десорбция на заредени йони, т.е. колоидните частици губят заряда си. Започват да се сгъстяват и утаяват. Същото се наблюдава и при добавяне на какъвто и да е електролит. В този случай колоидна частица привлича противоположно зареден йон и зарядът му се неутрализира.
Коагулация - феноменът на сцепление на колоидни частици и тяхното утаяване - се наблюдава при неутрализиране на зарядите на тези частици, при добавяне на електролит към колоиден разтвор. В този случай разтворът се превръща в суспензия или гел. Някои органични колоиди се коагулират при нагряване (лепило, яйчен белтък) или при смяна киселинно-алкална средарешение.
2. гелове или желета са желатинови преципитати, образувани по време на коагулацията на золите. Те включват голям брой полимерни гелове, сладкарски изделия, козметични и медицински гелове, така добре познати на вас (желатин, желе, мармалад, хляб, месо, конфитюр, желе, мармалад, желе, сирене, извара, подсирено мляко, торта от птиче мляко ) и разбира се, безкраен брой естествени гелове: минерали (опал), тела на медузи, хрущяли, сухожилия, коса, мускулна и нервна тъкан и т.н. Историята на развитието на Земята може едновременно да се счита за история на еволюцията на колоидно състояние на материята. С течение на времето структурата на геловете се нарушава (отлепва) – от тях се отделя вода. Това явление се нарича синерезис .
желе са структурирани системи със свойства на еластични твърди тела. Желатиновото състояние на материята може да се разглежда като междинно между течно и твърдо състояние.
Желетата от макромолекулни вещества могат да се получат главно по два начина: по метода на образуване на желета от полимерни разтвори и по метода на набъбване на сухи макромолекулни вещества в съответните течности.
Процесът на преход на полимерен разтвор или зол в желе се нарича образуване на желе . Образуването на гел е свързано с увеличаване на вискозитета и забавяне на Брауновото движение и се състои в комбиниране на частици от диспергираната фаза под формата на решетка или клетки и свързване на целия разтворител.
Процесът на желиране се влияе значително от естеството на разтворените вещества, формата на техните частици, концентрацията, температурата, времето на процеса и примесите на други вещества, особено електролити. .
Въз основа на техните свойства желета се разделят на две големи групи:
а) еластични или обратими, получени от макромолекулни вещества;
б) крехки или необратими, получени от неорганични хидрофобни золи.
Както вече споменахме, желета от макромолекулни вещества могат да бъдат получени не само чрез метода на желиране на разтвори, но и чрез метода на набъбване на сухи вещества. Ограниченото подуване завършва с образуването на желе и не преминава в разтваряне, а при неограничено подуване желето е междинен етап по пътя към разтварянето.
Желето се характеризира с редица свойства на твърдите вещества: те запазват формата си, имат еластични свойства и еластичност. Техните механични свойства обаче се определят от концентрацията и температурата.
При нагряване желетата преминават във вискозно състояние. Този процес се нарича топене. Той е обратим, тъй като при охлаждане разтворът отново образува желе.
Много желета могат да се втечнят и да преминат в разтвори при механично действие (разбъркване, разклащане). Този процес е обратим, тъй като в покой след известно време разтворът образува желе. Свойството на желето да се втечнява многократно изотермично при механични въздействия и да образува желе в покой се нарича тиксотропия . Например, шоколадовата маса, маргаринът, тестото са способни на тиксотропни промени.
Имайки в състава си огромно количество вода, желета, освен свойствата на твърди тела, имат и свойствата на течно тяло. В тях могат да протичат различни физични и химични процеси: дифузия, химични реакции между веществата.
Прясно приготвеното желе подлежи на промяна с течение на времето, тъй като процесът на структуриране в желето продължава. В същото време на повърхността на желето започват да се появяват капчици течност, които, сливайки се, образуват течна среда. Получената дисперсионна среда е разреден полимерен разтвор, а дисперсната фаза е желатинова фракция. Такъв спонтанен процес на разделяне на желето на фази, придружен от промяна в обема, се нарича от студиото. синерезис (накисване).
Синерезисът се разглежда като продължение на процесите, които предизвикват образуването на желе. Скоростта на синерезис на различните желета е различна и зависи главно от температурата и концентрацията.
Синерезисът в желета, образувани от полимери, е частично обратим. Понякога нагряването е достатъчно, за да се върне желето, което е претърпяло синерезис, в първоначалното му състояние.В кулинарната практика този метод се използва например за освежаване на зърнени храни, картофено пюре и остарял хляб. Ако по време на съхранението на желето възникнат химични процеси, тогава синерезисата става по-сложна и нейната обратимост се губи, настъпва стареене на желето. В този случай желето губи способността си да задържа свързана вода (застояване на хляба). Практическото значение на синерезиса е доста голямо. Най-често синезисът в ежедневието и индустрията е нежелан. Това е застояването на хляба, накисването на мармалад, желе, карамел, плодови конфитюри.
5. Разтвори на високомолекулни вещества.
Полимерите, като вещества с ниско молекулно тегло, в зависимост от условията за получаване на разтвор (естеството на полимера и разтворителя, температурата и т.н.), могат да образуват както колоидни, така и истински разтвори. В тази връзка е обичайно да се говори за колоидно или истинско състояние на вещество в разтвор. Няма да засягаме системи от колоиден тип "полимер-разтворител". Нека разгледаме само разтвори на полимери от молекулен тип. Трябва да се отбележи, че поради големия размер на молекулите и особеностите на тяхната структура, HMS разтворите имат редица специфични свойства:
1. Равновесните процеси в HMS разтворите се установяват бавно.
2. Процесът на разтваряне на IUD, като правило, се предшества от процеса на подуване.
3. Полимерните разтвори не се подчиняват на законите на идеалните разтвори, т.е. законите на Раул и Вант Хоф.
4. При протичане на полимерни разтвори възниква анизотропия на свойствата (неравномерна физични свойстваразтвор в различни посоки) поради ориентацията на молекулите в посоката на потока.
5. Висок вискозитет на IUD разтвори.
6. Поради големия си размер, полимерните молекули са склонни да се свързват в разтвори. Животът на полимерните асоциати е по-дълъг от този на асоциираните вещества с ниско молекулно тегло.
Процесът на разтваряне на НМС протича спонтанно, но за дълго време и често се предшества от набъбване на полимера в разтворителя. Полимери, чиито макромолекули имат симетрична форма, могат да преминат в разтвор без предварително набъбване. Например, хемоглобинът, чернодробното нишесте - гликогенът почти не набъбват при разтваряне, а разтворите на тези вещества нямат висок вискозитет дори при относително високи концентрации. Докато веществата със силно асиметрични удължени молекули набъбват много силно при разтваряне (желатин, целулоза, естествен и синтетичен каучук).
Подуването е увеличаване на масата и обема на полимера поради проникването на молекули на разтворителя в пространствената структура на IUD.
Има два вида подуване: неограничен,завършва с пълно разтваряне на IUD (например набъбване на желатин във вода, каучук в бензол, нитроцелулоза в ацетон) и ограничен, което води до образуването на набъбнал полимер - желе (например набъбване на целулоза във вода, желатин в студена вода, вулканизиран каучук в бензол).
Класификацията на дисперсните системи може да се извърши въз основа на различни свойства: чрез дисперсия, по състояние на агрегация на фазите, чрез взаимодействие на дисперсна фаза и дисперсна среда, чрез взаимодействие между частици.
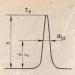
Класификация по дисперсия
Зависимостта на специфичната повърхност от дисперсията Ssp = f(d) е графично изразена с равностранна хипербола (фиг.).От графиката се вижда, че с намаляване на напречните размери на частиците специфичната повърхност нараства значително. Ако куб с размер на ръба 1 cm се смачка до кубични частици с размери d = 10 -6 cm, стойността на общата повърхност на повърхността ще се увеличи от 6 cm 2 на 600 m 2.
При d ≤ 10 -7 cm хиперболата се разпада, тъй като частиците се намаляват до размера на отделните молекули и хетерогенната система става хомогенна, в която няма повърхностна повърхност. Според степента на дисперсия дисперсните системи се делят на:
- груби системи, d ≥ 10 -3 cm;
- микрохетерогенни системи, 10 -5 ≤ d ≤ 10 -3 cm;
- колоидно-дисперсни системи или колоидни разтвори, 10 -7 ≤ d ≤ 10 -5 cm;
- истински разтвори, d ≤ 10 -7 cm.
Класификация според състоянието на агрегиране на фазите
Класификацията според състоянието на агрегиране на фазите е предложена от Волфганг Оствалд. По принцип са възможни 9 комбинации. Нека ги поставим под формата на таблица.| Агрегатно състояние на дисперсната фаза | Агрегатно състояние на дисперсна среда | Легенда | Име на системата | Примери |
| г | г | г/г | аерозоли | Земната атмосфера |
| и | г | w/g | мъгла, пластови облаци | |
| тв | г | тв/г | дим, прах, перисти облаци | |
| г | и | g/f | газови емулсии, пени | газирана вода, сапунена пяна, лечебен кислороден коктейл, бирена пяна |
| и | и | w/w | емулсии | мляко, масло, маргарин, кремове и др. |
| тв | и | телевизор/б | лиозоли, суспензии | лиофобни колоидни разтвори, суспензии, пасти, бои и др. д. |
| г | тв | g/tv | твърда пяна | пемза, твърди пени, полистирол, пенобетон, хляб, порести тела в газ и др. д. |
| и | тв | g телевизор | твърди емулсии | вода в парафин, естествени минерали с течни включвания, порести тела в течност |
| тв | тв | телевизия/телевизор | твърди золи | стомана, чугун, цветни стъкла, скъпоценни камъни: Au зол в стъкло - рубинено стъкло (0,0001%) (1 т стъкло - 1 g Au) |
Класификация според взаимодействието на дисперсната фаза и дисперсната среда (според междинното взаимодействие).
Тази класификация е подходяща само за системи с течна дисперсионна среда. G. Freindlich предложи дисперсните системи да бъдат разделени на два типа:- лиофобни, при които дисперсната фаза не е в състояние да взаимодейства с дисперсионната среда и следователно да се разтваря в нея; те включват колоидни разтвори, микрохетерогенни системи;
- лиофилни, при които дисперсната фаза взаимодейства с дисперсионната среда и при определени условия може да се разтвори в нея, те включват разтвори на колоидни повърхностно активни вещества и разтвори на IUD.
Класификация по взаимодействие между частици
Според тази класификация дисперсните системи се разделят на:- свободно разпръснати (безструктурни);
- свързани разпръснати (структурирани).
В кохерентно диспергирани системи частиците на дисперсната фаза са свързани помежду си поради междумолекулни сили, образувайки своеобразни пространствени мрежи или рамки (структури) в дисперсионната среда. Частиците, които образуват структурата, не са способни на взаимно изместване и могат да извършват само осцилаторни движения.
Списък на използваната литература
- Гелфман М.И., Ковалевич О.В., Юстратов В.П.колоидна химия. 2-ро изд., стер. – СПб.: Издателство „Лан”, 2004. – 336 с.: ил. ISBN 5-8114-0478-6 [стр. 8-10]
Дисперсионните системи могат да бъдат разделени според размера на частиците на дисперсионната фаза. Ако размерът на частиците е по-малък от един nm, това са молекулярно-йонни системи, от един до сто nm - колоидни и повече от сто nm - грубо диспергирани. Групата молекулярно диспергирани системи е представена от разтвори. Това са хомогенни системи, които се състоят от две или повече вещества и са еднофазни. Те включват газ, твърдо вещество или разтвори. От своя страна тези системи могат да бъдат разделени на подгрупи:
- Молекулярна. Кога органична материя, като глюкоза, се комбинират с неелектролити. Такива разтвори бяха наречени истински, за да могат да бъдат разграничени от колоидни. Те включват разтвори на глюкоза, захароза, алкохол и др.
- Молекулярно-йонен. В случай на взаимодействие между слаби електролити. Тази група включва киселинни разтвори, азотни, сероводородни и други.
- йонен. Свързване на силни електролити. Ярки представители са разтвори на алкали, соли и някои киселини.
колоидни системи
Колоидните системи са микрохетерогенни системи, в които размерите на колоидни частици варират от 100 до 1 nm. Те може да не се утаяват за дълго време поради солватната йонна обвивка и електрическия заряд. Когато се разпределят в среда, колоидни разтвори запълват равномерно целия обем и се разделят на золи и гелове, които от своя страна са утайки под формата на желе. Те включват разтвор на албумин, желатин, колоидни разтвори на сребро. Заливка, суфле, пудинги са ярки колоидни системи, които се срещат в ежедневието.
Груби системи
Непрозрачни системи или суспензии, в които фините съставки и частици са видими с просто око. По време на утаяване дисперсната фаза лесно се отделя от дисперсната среда. Те са разделени на суспензии, емулсии, аерозоли. Системи, при които твърдо вещество с по-големи частици се поставя в течна дисперсионна среда, се наричат суспензии. Те включват водни разтвори на нишесте и глина. За разлика от суспензиите, емулсиите се получават чрез смесване на две течности, в които едната се разпределя на капчици в другата. Пример за емулсия е смес от масло и вода, капчици мазнини в млякото. Ако малки твърди или течни частици са разпределени в газ, те са аерозоли. Аерозолът по същество е суспензия в газ. Един от представителите на аерозол на течна основа е мъглата - това е голям брой малки водни капчици, суспендирани във въздуха. Аерозол в твърдо състояние - дим или прах - многократно натрупване на малки твърди частици, също суспендирани във въздуха.
Колоидната химия е наука, която изучава методи за получаване, състав, вътрешна структура, химични и физични свойства на дисперсните системи. Дисперсните системи са системи, които се състоят от фрагментирани частици (дисперсна фаза), разпределени в заобикалящата (дисперсна) среда: газове, течности или твърди вещества. Размерите на частиците на дисперсната фаза (кристали, капчици, мехурчета) се различават по степента на дисперсност, чиято стойност е право пропорционална на размера на частиците. В допълнение, дисперсните частици се отличават и с други характеристики, като правило, от дисперсната фаза и среда.
Дисперсни системи и тяхната класификация
Всички дисперсионни системи според размера на частиците на дисперсионната фаза могат да бъдат класифицирани на молекулярно-йонни (по-малко от един nm), колоидни (от един до сто nm), груби (повече от сто nm).
Молекулно диспергирани системи.Тези системи съдържат частици, чийто размер не надвишава един nm. Тази група включва различни истински разтвори на неелектролити: глюкоза, урея, алкохол, захароза.
Груби системихарактеризиращ се с най-големите частици. Те включват емулсии и суспензии. Дисперсните системи, в които твърдо вещество е локализирано в течна дисперсионна среда (разтвор на нишесте, глина), се наричат суспензии. Емулсиите са системи, които се получават чрез смесване на две течности, при които едната се диспергира под формата на капчици в друга (масло, толуен, бензол във вода или капчици триацилглицероли (мазнини) в мляко).
Колоидни дисперсни системи. Размерите им достигат до 100 nm. Такива частици лесно проникват през порите на хартиените филтри, но не проникват през порите на биологичните мембрани на растенията и животните. Тъй като колоидните частици (мицели) имат електрически заряд и солватни йонни обвивки, поради което остават в суспендирано състояние, те може да не се утаят за достатъчно дълго време. Ярък пример са разтвори на желатин, албумин, гума арабика, злато и сребро.
Позволява да се прави разлика между хомогенни и хетерогенни дисперсни системи. В хомогенни диспергирани системи фазовите частици се смилат до молекули, атоми и йони. Пример за такива дисперсионни системи може да бъде разтвор на глюкоза във вода (система за молекулярна дисперсия) и кухненска сол във вода (йонна дисперсионна система). Те са Размерът на молекулите на дисперсната фаза не надвишава един нанометър.
Дисперсни системи и решения
От всички представени системи и решения в живота на живите организми, колоидно дисперсните системи са от най-голямо значение. Както знаете, химическата основа за съществуването на жив организъм е обменът на протеини в него. Средно концентрацията на протеини в организма е от 18 до 21%. Повечето протеини се разтварят във вода (чиято концентрация при хора и животни е приблизително 65%) и образуват колоидни разтвори.
Има две групи колоидни разтвори: течни (золи) и гелообразни (гелове). Всички жизненоважни процеси, протичащи в живите организми, са свързани с колоидно състояние на материята. Във всяка жива клетка има биополимери ( нуклеинова киселина, протеини, глюкозаминогликани, гликоген) са под формата на диспергирани системи.
Колоидните разтвори са широко разпространени и в такива разтвори се включват масло, тъкани, пластмаси.Много хранителни продукти могат да бъдат приписани на колоидни разтвори: кефир, мляко и др. Повечето лекарства (серуми, антигени, ваксини) са колоидни разтвори. Колоидните разтвори включват и бои.
Чистите вещества са много редки в природата. Смеси от различни вещества в различни агрегатни състояния могат да образуват хетерогенни и хомогенни системи – дисперсни системи и разтвори.
Веществото, което присъства в по-малко количество и е разпределено в обема на друго, се нарича дисперсна фаза. Може да се състои от няколко вещества.
Вещество, което присъства в по-голямо количество, в чийто обем е разпределена дисперсната фаза, се нарича дисперсионна среда. Между него и частиците на дисперсната фаза има интерфейс, поради което дисперсните системи се наричат хетерогенни (неравномерни).
Както дисперсионната среда, така и дисперсната фаза могат да бъдат представени от вещества в различни агрегатни състояния – твърдо, течно и газообразно.
В зависимост от комбинацията на агрегатното състояние на дисперсионната среда и дисперсната фаза могат да се разграничат 8 вида такива системи (Таблица 11).
Таблица 11
Примери за дисперсни системи

Според размера на частиците на веществата, които съставляват дисперсната фаза, дисперсните системи се разделят на груби (суспензии) с размер на частиците над 100 nm и фино диспергирани (колоидни разтвори или колоидни системи) с размери на частиците от 100 до 1 nm . Ако веществото се фрагментира на молекули или йони с размер по-малък от 1 nm, се образува хомогенна система - разтвор. Той е хомогенен (хомогенен), няма интерфейс между частиците на дисперсната фаза и средата.
Дори едно бегло запознаване с дисперсните системи и решения показва колко важни са те в ежедневието и в природата (виж Таблица 11).
Преценете сами: без тиня на Нил не би се състояла великата цивилизация на Древен Египет; без вода, въздух, скали и минерали изобщо нямаше да има жива планета – нашия общ дом – Земята; без клетки не би имало живи организми и т.н.
Класификацията на дисперсните системи и разтвори е показана на схема 2.
Схема 2
Класификация на дисперсните системи и разтвори

окачване
Суспензиите са дисперсни системи, в които размерът на частиците на фазата е повече от 100 nm. Това са непрозрачни системи, отделни частици от които могат да се видят с просто око. Дисперсната фаза и дисперсионната среда се разделят лесно чрез утаяване. Такива системи са разделени на три групи:
- емулсии (и средата и фазата са течности, неразтворими една в друга). Това са добре познати млечни, лимфни, водни бои и др.;
- суспензии (средата е течност, а фазата е твърдо вещество, неразтворимо в нея). Това са строителни разтвори (например „варно мляко“ за избелване), речна и морска тиня, суспендирана във вода, жива суспензия от микроскопични живи организми в морска вода - планктон, с който се хранят гигантските китове и др .;
- аерозоли - суспензии в газ (например във въздух) на малки частици от течности или твърди вещества. Правете разлика между прах, дим, мъгла. Първите два вида аерозоли са суспензии на твърди частици в газ (по-големи частици в прах), последният е суспензия на малки течни капчици в газ. Например, естествени аерозоли: мъгла, гръмотевични облаци - суспензия от водни капчици във въздуха, дим - малки твърди частици. А смогът, надвиснал над най-големите градове в света, също е аерозол с твърда и течна дисперсна фаза. Жителите на населени места в близост до циментови заводи страдат от най-финия циментов прах, винаги висящ във въздуха, който се образува при смилането на циментовите суровини и продукта от изпичането му - клинкер. Подобни вредни аерозоли - прах - се срещат и в градове с металургична промишленост. Димът от фабричните тръби, смогът, най-малките капчици слюнка, излитащи от устата на болен от грип, също са вредни аерозоли.
Аерозолите играят важна роля в природата, ежедневието и човешките производствени дейности. Натрупване на облаци, химическа обработка на полета, пръскане с боя, пръскане на гориво, сухи млечни продукти, респираторно лечение (вдишване) са примери за явления и процеси, при които аерозолите са полезни.
Аерозолите - мъгли над морския сърф, близо до водопади и фонтани, дъгата, която възниква в тях, доставя на човек радост, естетическо удоволствие.
За химията от най-голямо значение са дисперсните системи, в които водата е среда.
колоидни системи
Колоидните системи са такива дисперсни системи, в които размерът на частиците на фазата е от 100 до 1 nm. Тези частици не се виждат с невъоръжено око, а дисперсната фаза и дисперсионната среда в такива системи се разделят трудно.
Те се разделят на золи (колоидни разтвори) и гелове (желе).
1. Колоидни разтвори, или сол. Това е по-голямата част от течностите на жива клетка (цитоплазма, ядрен сок - кариоплазма, съдържанието на органели и вакуоли) и жив организъм като цяло (кръв, лимфа, тъканна течност, храносмилателни сокове, хуморални течности и др.). Такива системи образуват лепила, нишесте, протеини и някои полимери.
В резултат на химични реакции могат да се получат колоидни разтвори; например, когато разтвори на калиеви или натриеви силикати („разтворимо стъкло“) взаимодействат с киселинни разтвори, се образува колоиден разтвор на силициева киселина. Золът се образува и по време на хидролизата на железен (III) хлорид в гореща вода. Колоидните разтвори са външно подобни на истинските разтвори. Те се отличават от последните по получения "светещ път" - конус, когато през тях преминава лъч светлина. Това явление се нарича ефект на Тиндал. По-големи, отколкото в истински разтвор, частиците на дисперсната фаза на зола отразяват светлината от повърхността си и наблюдателят вижда светещ конус в съд с колоиден разтвор. Не се образува в истинско решение. Подобен ефект, но само за аерозол, а не за течен колоид, може да се наблюдава в кината, когато лъч светлина от филмова камера преминава през въздуха на кинозалата.
Частиците от дисперсната фаза на колоидни разтвори често не се утаяват дори при продължително съхранение поради непрекъснати сблъсъци с молекули на разтворителя поради термично движение. Те не се слепват, когато се приближават един към друг поради наличието на подобни електрически заряди на повърхността им. Но при определени условия може да възникне процесът на коагулация.
Коагулация- феноменът на сцепление на колоидни частици и тяхното утаяване - се наблюдава при неутрализиране на зарядите на тези частици, при добавяне на електролит към колоиден разтвор. В този случай разтворът се превръща в суспензия или гел. Някои органични колоиди се коагулират при нагряване (лепило, яйчен белтък) или при промяна на киселинно-алкалната среда на разтвора.
2. Втората подгрупа колоидни системи е гелове, или желета y представлява желатинови седименти, образувани по време на коагулацията на золите. Те включват голям брой полимерни гелове, сладкарски изделия, козметични и медицински гелове, така добре познати на вас (желатин, желе, желе, мармалад, торта за суфле от птиче мляко) и, разбира се, безкраен брой естествени гелове: минерали (опал) , тела на медузи, хрущяли, сухожилия, коса, мускулна и нервна тъкан и др. Историята на развитието на живота на Земята може да се счита едновременно за история на еволюцията на колоидно състояние на материята. С течение на времето структурата на геловете се нарушава – от тях се отделя вода. Това явление се нарича синерезис.