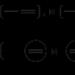У періодичній системі має своє певне місце положення, яке відображає властивості, які він проявляється, і говорить про його електронній будові. Однак є серед усіх один особливий атом, який займає одразу два осередки. Він розташовується у двох абсолютно протилежних за властивостями групах елементів. Це водень. Такі особливості роблять його унікальним.
Водень - це не просто елемент, а й проста речовина, а також складова частина багатьох складних з'єднань, біогенний та органогенний елемент. Тому розглянемо його характеристики та властивості докладніше.
Водень як хімічний елемент
Водень - це елемент першої групи головної підгрупи, а також сьомої групи головної підгрупи у першому малому періоді. Цей період складається з двох атомів: гелію і аналізованого нами елемента. Опишемо основні особливості становища водню у періодичній системі.
- Порядковий номер водню - 1, кількість електронів така ж, відповідно, протонів стільки ж. Атомна маса – 1,00795. Існує три ізотопи даного елемента з масовими числами 1, 2, 3. Однак властивості кожного з них дуже відрізняються, так як збільшення маси навіть на одиницю саме для водню є відразу подвійним.
- Те, що на зовнішньому він містить лише один електрон, дозволяє успішно виявляти йому як окисні, так і відновлювальні властивості. Крім того, після віддачі електрона у нього залишається вільна орбіталь, яка бере участь в освіті хімічних зв'язківза донорно-акцепторним механізмом.
- Водень – це сильний відновник. Тому основним місцем його вважається перша група головної підгрупи, де він очолює найактивніші метали – лужні.
- Однак при взаємодії з сильними відновниками, такими як, наприклад, метали, він може бути окислювачем, приймаючи електрон. Ці сполуки отримали назву гідридів. За цією ознакою він очолює підгрупу галогенів, з якими схожим.
- Завдяки зовсім невеликій атомній масі, водень вважається найлегшим елементом. Крім того, його щільність також мала, тому він також є еталоном легкості.
Отже, очевидно, що атом водню - це унікальний, несхожий на всі інші елемент. Отже, властивості його теж особливі, а утворювані прості та складні речовинидуже важливі. Розглянемо їх надалі.

Проста речовина
Якщо говорити про цей елемент як про молекулу, то слід сказати, що вона двоатомна. Тобто водень (проста речовина) – це газ. Формула його емпірична буде записуватися як Н 2 , а графічна через одинарну сигма-зв'язок Н-Н. Механізм утворення зв'язку між атомами – ковалентний неполярний.
- Парова конверсія метану.
- Газифікація вугілля - процес передбачає нагрівання вугілля до 1000 0 З, у результаті утворюється водень і високовуглецеве вугілля.
- Електроліз. Даний метод може використовуватися тільки для водних розчинів різних солей, оскільки розплави не призводять до розряджання води на катоді.
Лабораторні способи одержання водню:
- Гідроліз гідридів металів.
- Дія розведених кислот на активні метали та середню активність.
- Взаємодія лужних та лужноземельних металів з водою.
Щоб зібрати водень, що утворюється, необхідно тримати пробірку перевернутої вгору дном. Адже цей газ не можна зібрати так, як, наприклад, вуглекислий газ. Це водень, він набагато легший за повітря. Швидко випаровується, а у великих кількостях при змішуванні з повітрям вибухає. Тому слід перевертати пробірку. Після заповнення її потрібно закрити гумовою пробкою.
Щоб перевірити чистоту зібраного водню, слід піднести до шийки запалений сірник. Якщо бавовна глуха і тиха - значить газ чистий, з мінімальними домішками повітря. Якщо ж гучний і свистячий – брудний, з великою часткою сторонніх компонентів.

Області використання
При згорянні водню виділяється настільки велика кількість енергії (теплоти), що цей газ вважається найвигіднішим паливом. До того ж, екологічно чистим. Однак на сьогоднішній день його застосування в цій галузі обмежене. Це пов'язано з непродуманими до кінця та не вирішеними проблемами синтезу чистого водню, який був би придатний для використання як паливо в реакторах, двигунах та портативних пристроях, а також опалювальних котлах житлових будинків.
Адже способи отримання даного газу є досить дорогими, тому насамперед необхідно розробити особливий метод синтезу. Такий, який дозволить отримувати продукт у великому обсязі та з мінімальними витратами.
Можна виділити кілька основних областей, у яких знаходить застосування аналізований нами газ.
- хімічні синтези. З гідрування отримують мила, маргарини, пластмаси. За участю водню синтезується метанол та аміак, а також інші сполуки.
- У харчовій промисловості – як добавка Е949.
- Авіаційна промисловість (ракетобудування, літакобудування).
- Електроенергетика.
- Метеорологія.
- Паливо екологічно чистий.
Очевидно, що водень так само важливий, як і поширений у природі. Ще більшу роль грають різні сполуки, що утворюються ним.

З'єднання водню
Це складні речовини, що містять атоми водню. Можна виділити кілька основних типів подібних речовин.
- Галогеноводні. Загальна формула- HHal. Особливого значення у тому числі має хлорид водню. Це газ, що розчиняється у воді з утворенням розчину соляної кислоти. Ця кислота знаходить широке застосування практично у всіх хімічних синтезах. Причому як органічних, і неорганічних. Хлорид водню - це з'єднання, що має емпіричну формулу HCL і є одним із найбільших за обсягами виробництва в нашій країні щорічно. Також до галогеноводів відносяться йодоводород, фтороводород і бромоводень. Усі вони утворюють відповідні кислоти.
- Практично всі вони досить отруйні гази. Наприклад, сірководень, метан, силан, фосфін та інші. При цьому дуже горючі.
- Гідриди – з'єднання з металами. Належать до класу солей.
- Гідроксиди: основи, кислоти та амфотерні сполуки. До їхнього складу обов'язково входять атоми водню, один або кілька. Приклад: NaOH, K 2 , H 2 SO 4 та інші.
- Гідроксид водню. Це з'єднання більше відоме як вода. Інша назва оксид водню. Емпірична формула виглядає так - Н2О.
- Перекис водню. Це найсильніший окисник, формула якого має вигляд Н2О2.
- Численні органічні сполуки: вуглеводні, білки, жири, ліпіди, вітаміни, гормони, ефірні олії та інші.
Вочевидь, що розмаїтість сполук аналізованого нами елемента дуже велика. Це ще раз підтверджує його високе значення для природи та людини, а також для всіх живих істот.
- це найкращий розчинник
Як згадувалося вище, простонародна назва даної речовини - вода. Складається із двох атомів водню та одного кисню, з'єднаних між собою ковалентними полярними зв'язками. Молекула води є диполем, це пояснює багато властивостей. Зокрема, що вона є універсальним розчинником.
Саме у водному середовищі відбуваються практично всі хімічні процеси. Внутрішні реакції пластичного та енергетичного обміну у живих організмах також здійснюються за допомогою оксиду водню.
Вода по праву вважається найважливішою речовиною на планеті. Відомо, що без неї не зможе жити жоден живий організм. На Землі вона здатна існувати у трьох агрегатних станах:
- рідина;
- газ (пар);
- тверде (лід).
Залежно від ізотопу водню, що входить до складу молекули, розрізняють три види води.
- Легка чи протиєва. Ізотоп з масовим числом 1. Формула – Н 2 О. Це звична форма, яку використовують усі організми.
- Дейтерієва або важка, її формула – D 2 O. Містить ізотоп 2 Н.
- Надважка чи тритієва. Формула виглядає як Т3О, ізотоп - 3Н.
Дуже важливими є запаси прісної протиєвої води на планеті. Вже зараз у багатьох країнах відчувається її нестача. Розробляються способи обробки солоної води з одержання питної.

Пероксид водню – це універсальний засіб
Дане з'єднання, як згадувалося вище, прекрасний окислювач. Однак із сильними представниками може поводитися і як відновник теж. Крім того, має виражений бактерицидний ефект.
Інша назва цієї сполуки - перекис. Саме у такому вигляді його використовують у медицині. 3% розчин кристалогідрату розглянутої сполуки - це медичні ліки, які застосовують для обробки невеликих ран з метою їх знезараження. Однак доведено, що при цьому загоєння поранення за часом збільшується.
Також пероксид водню використовується в ракетному паливі, в промисловості для дезінфекції та відбілювання, як піноутворювач для отримання відповідних матеріалів (пінопласту, наприклад). Крім того, перекис допомагає очищати акваріуми, знебарвлювати волосся та відбілювати зуби. Однак при цьому завдає шкоди тканинам, тому фахівцями з цією метою не рекомендується.
Рідкий
Водень(Лат. Hydrogenium; позначається символом H) - Перший елемент періодичної системи елементів. Широко поширений у природі. Катіон (і ядро) найпоширенішого ізотопу водню 1H - протон. Властивості ядра H дозволяють широко використовувати ЯМР-спектроскопію в аналізі органічних речовин.
Три ізотопи водню мають власні назви: 1 H – протий (Н), 2 H – дейтерій (D) та 3 H – тритій (радіоактивний) (T).
Проста речовина водень – H 2 – легкий безбарвний газ. У суміші з повітрям або киснем горюча і вибухонебезпечна. Нетоксичний. Розчинний в етанолі та ряді металів: залозі, нікелі, паладії, платині.
Історія
Виділення пального газу при взаємодії кислот та металів спостерігали у XVI та XVII століттяхна зорі становлення хімії як науки. Прямо вказував на виділення його та Михайло Васильович Ломоносов, але вже безперечно усвідомлюючи, що це не флогістон. Англійський фізик і хімік Генрі Кавендіш в 1766 досліджував цей газ і назвав його «горючим повітрям». При спалюванні «горюче повітря» давало воду, але відданість Кавендіша теорії флогістона завадила йому зробити правильні висновки. Французький хімік Антуан Лавуазьє разом з інженером Ж. Менье, використовуючи спеціальні газометри, в 1783 здійснив синтез води, а потім і її аналіз, розклавши водяну пару розжареним залізом. Таким чином він встановив, що «горюче повітря» входить до складу води і може бути отримано.
походження назви
Лавуазьє дав водню назву hydrogène - "що народжує воду". Російське найменування «водень» запропонував хімік М. Ф. Соловйов в 1824 - за аналогією сломоносівським «киснем».
Поширеність
Водень - найпоширеніший елемент у Всесвіті. На його частку припадає близько 92% всіх атомів (8% складають атоми гелію, частка решти разом узятих елементів — менше 0,1%). Таким чином, водень - основна складова частина зірок та міжзоряного газу. В умовах зоряних температур (наприклад, температура поверхні Сонця ~ 6000 °C) водень існує у вигляді плазми, у міжзоряному просторі цей елемент існує у вигляді окремих молекул, атомів та іонів і може утворювати молекулярні хмари, що значно відрізняються за розмірами, щільністю та температурою.
Земна кора та живі організми
Масова частка водню в земної користановить 1 % - це десятий за поширеністю елемент. Однак його роль у природі визначається не масою, а числом атомів, частка яких серед інших елементів становить 17% (друге місце після кисню, частка атомів якого дорівнює ~52%). Тому значення водню в хімічних процесах, що відбуваються на Землі, майже так само велике, як і кисню. На відміну від кисню, що існує на Землі та у зв'язаному, та у вільному станах, практично весь водень на Землі знаходиться у вигляді сполук; Тільки дуже незначному кількості водень як простої речовини міститься у атмосфері (0,00005 % за обсягом).
Водень входить до складу практично всіх органічних речовин і присутній у всіх живих клітинах. У живих клітинах за кількістю атомів водень припадає майже 50 %.
Отримання
Промислові способи одержання простих речовинзалежать від того, в якому вигляді відповідний елемент знаходиться в природі, тобто може бути сировиною для його отримання. Так, кисень, що у вільному стані, отримують фізичним способом - виділенням з рідкого повітря. Водень же майже весь знаходиться у вигляді сполук, тому для його отримання застосовують хімічні методи. Зокрема, можуть бути використані реакції розкладання. Одним із способів отримання водню є реакція розкладання води електричним струмом.
Основний промисловий спосіб отримання водню - реакція з водою метану, що входить до складу газу. Вона проводиться при високій температурі (легко переконатися, що при пропущенні метану навіть через киплячу воду жодної реакції не відбувається):
СН 4 + 2Н 2 O = CO 2 + 4Н 2 −165 кДж
У лабораторії для отримання простих речовин використовують не обов'язково природну сировину, а вибирають ті вихідні речовини, з яких легко виділити необхідну речовину. Наприклад, у лабораторії кисень не отримують із повітря. Це саме стосується і отримання водню. Один з лабораторних способів одержання водню, який іноді застосовується і в промисловості, - розкладання води електрострумом.
Зазвичай у лабораторії водень отримують взаємодією цинку із соляною кислотою.
У промисловості
1.Електроліз водних розчинів солей:
2NaCl + 2H 2 O → H 2 + 2NaOH + Cl 2
2.Пропускання пар води над розпеченим коксом при температурі близько 1000 °C:
H 2 O + C? H 2 + CO
3.З природного газу.
Конверсія з водяною парою:
CH 4 + H 2 O? CO + 3H 2 (1000 °C)
Каталітичне окиснення киснем:
2CH 4 + O 2? 2CO + 4H 2
4. Крекінг та риформінг вуглеводнів у процесі переробки нафти.
В лабораторії
1.Дія розведених кислот на метали.Для проведення такої реакції найчастіше використовують цинк та розведену соляну кислоту:
Zn + 2HCl → ZnCl 2 + H 2
2.Взаємодія кальцію з водою:
Ca + 2H 2 O → Ca(OH) 2 + H 2
3.Гідроліз гідридів:
NaH + H 2 O → NaOH + H 2
4.Дія лугів на цинк або алюміній:
2Al + 2NaOH + 6H 2 O → 2Na + 3H 2
Zn + 2KOH + 2H 2 O → K 2 + H 2
5.За допомогою електролізу.При електролізі водних розчинів лугів або кислот на катоді відбувається виділення водню, наприклад:
2H 3 O + + 2e − → H 2 + 2H 2 O
Фізичні властивості
Водень може існувати у двох формах (модифікаціях) — у вигляді орто- та пароводню. У молекулі ортоводороду o-H 2 (т. пл. −259,10 °C, т. кіп. −252,56 °C) ядерні спини спрямовані однаково (паралельні), а у параводню p-H 2 (т. пл. -259,32 ° C, т. Кіп. -252,89 ° C) - протилежно один одному (антипаралельні). Рівноважна суміш o-H 2 та p-H 2 при заданій температурі називається рівноважний водень e-H 2 .
Розділити модифікації водню можна адсорбцією на активному вугіллі за нормальної температури рідкого азоту. При дуже низьких температурах рівновага між ортоводородом і параводнем майже націло зрушена в бік останнього. При 80 К співвідношення форм приблизно 1:1. Десорбований параводень при нагріванні перетворюється на ортоводород до утворення рівноважної при кімнатній температурі суміші (орто-пара: 75:25). Без каталізатора перетворення відбувається повільно (в умовах міжзоряного середовища - з характерними часамиаж до космологічних), що дозволяє вивчити властивості окремих модифікацій.
Водень - найлегший газ, він легший за повітря в 14,5 разів. Очевидно, що чим менша маса молекул, тим вища їхня швидкість при одній і тій же температурі. Як найлегші, молекули водню рухаються швидше за молекули будь-якого іншого газу і тим швидше можуть передавати теплоту від одного тіла до іншого. Звідси випливає, що водень має найвищу теплопровідність серед газоподібних речовин. Його теплопровідність приблизно в сім разів вища за теплопровідність повітря.
Молекула водню двоатомна - Н2. За нормальних умов - це газ без кольору, запаху та смаку. Щільність 0,08987 г/л (н.у.), температура кипіння –252,76 °C, питома теплота згоряння 120.9×10 6 Дж/кг, малорозчинний у воді – 18,8 мл/л. Водень добре розчинний у багатьох металах (Ni, Pt, Pd та ін), особливо в паладії (850 об'ємів на 1 об'єм Pd). З розчинністю водню в металах пов'язана його здатність дифундувати через них; дифузія через вуглецевий сплав (наприклад сталь) іноді супроводжується руйнуванням сплаву внаслідок взаємодії водню з вуглецем (так звана декарбонізація). Практично не розчинний у срібло.
Рідкий воденьіснує у дуже вузькому інтервалі температур від -252,76 до -259,2 °C. Це безбарвна рідина, дуже легка (щільність при -253 °C 0,0708 г/см 3) і текуча (в'язкість при -253 °C 13,8 спуаз). Критичні параметри водню дуже низькі: температура -240,2 ° C і тиск 12,8 атм. Цим пояснюються проблеми при зрідженні водню. У рідкому стані рівноважний водень складається з 99,79% пара-Н2, 0,21% орто-Н2.
Твердий водень, температура плавлення −259,2 °C, щільність 0,0807 г/см 3 (при −262 °C) — снігоподібна маса, кристали гексогональної сингонії, просторова група P6/mmc, параметри комірки a=3,75 c=6,12. При високому тиску водень перетворюється на металевий стан.
Ізотопи
Водень зустрічається у вигляді трьох ізотопів, які мають індивідуальні назви: 1 H – протий (Н), 2 Н – дейтерій (D), 3 Н – тритій (радіоактивний) (T).
Проти і дейтерій є стабільними ізотопами з масовими числами 1 і 2. Зміст їх у природі відповідно становить 99,9885±0,0070% та 0,0115±0,0070%. Це співвідношення може змінюватись в залежності від джерела і способу отримання водню.
Ізотоп водню 3 Н (тритій) нестабільний. Його період напіврозпаду становить 12,32 років. Тритій міститься у природі у дуже малих кількостях.
У літературі також наводяться дані про ізотопи водню з масовими числами 4 - 7 та періодами піврозпаду 10 -22 - 10 -23 с.
Природний водень складається з молекул H 2 і HD (Дейтероводород) у співвідношенні 3200:1. Зміст чистого дейтерійного водню D2 ще менше. Відношення концентрацій HD і D 2 приблизно 6400:1.
З усіх ізотопів хімічних елементівфізичні та Хімічні властивостіІзотопи водню відрізняються один від одного найбільш сильно. Це з найбільшим відносним зміною мас атомів.
|
Температура |
Температура |
Потрійна |
Критична |
густина |
|
Дейтерій та тритій також мають орто- та пара-модифікації: p-D 2 o-D 2 p-T 2 o-T2. Гетероізотопний водень (HD, HT, DT) не мають орто-і пара-модифікацій.
Хімічні властивості
Частка дисоціюючих молекул водню
Молекули водню Н 2 досить міцні, і для того, щоб водень міг вступити в реакцію, має бути витрачена велика енергія:
Н 2 = 2Н − 432 кДж
Тому при звичайних температурах водень реагує тільки з дуже активними металами, наприклад, з кальцієм, утворюючи гідрид кальцію:
Ca + Н 2 = СаН 2
і з єдиним неметалом - фтором, утворюючи фтороводород:
З більшістю металів і неметалів водень реагує при підвищеній температурі або при іншій дії, наприклад при освітленні:
О 2 + 2Н2 = 2Н2О
Він може «віднімати» кисень від деяких оксидів, наприклад:
CuO + Н 2 = Cu + Н 2 O
Записане рівняння відбиває відновлювальні властивості водню.
N 2 + 3H 2 → 2NH 3
З галогенами утворює галогеноводороди:
F 2 + H 2 → 2HF, реакція протікає з вибухом у темряві та за будь-якої температури,
Cl 2 + H 2 → 2HCl, реакція протікає з вибухом, тільки світла.
З сажею взаємодіє при сильному нагріванні:
C + 2H 2 → CH 4
Взаємодія з лужними та лужноземельними металами
При взаємодії з активними металами водень утворює гідриди:
2Na + H 2 → 2NaH
Ca + H 2 → CaH 2
Mg + H 2 → MgH 2
Гідриди- солеподібні, тверді речовини, легко гідролізуються:
CaH 2 + 2H 2 O → Ca(OH) 2 + 2H 2
Взаємодія з оксидами металів (як правило, d-елементів)
Оксиди відновлюються до металів:
CuO+H2 → Cu+H2O
Fe 2 O 3 + 3H 2 → 2Fe + 3H 2 O
WO 3 + 3H 2 → W + 3H 2 O
Гідрування органічних сполук
Молекулярний водень широко застосовується в органічному синтезі для відновлення органічних сполук. Ці процеси називають реакціями гідрування. Ці реакції проводять у присутності каталізатора при підвищених тиску та температурі. Каталізатор може бути як гомогенним (напр.Каталізатор Уїлкінсона), так і гетерогенним (напр. нікель Ренея, паладій на вугіллі).
Так, зокрема, при каталітичному гідруванні ненасичених сполук, таких як алкени та алкіни, утворюються насичені сполуки – алкани.
Геохімія водню
Вільний водень H 2 відносно рідко зустрічається у земних газах, але у вигляді води він бере виключно важливу участь у геохімічних процесах.
До складу мінералів водень може входити у вигляді іону амонію, гідроксил-іона та кристалічної води.
У атмосфері водень безупинно утворюється внаслідок розкладання води сонячним випромінюванням. Маючи малу масу, молекули водню мають високу швидкість дифузійного руху (вона близька до другої космічної швидкості) і, потрапляючи у верхні шари атмосфери, можуть полетіти в космічний простір.
Особливості звернення
Водень при суміші з повітрям утворює вибухонебезпечну суміш - так званий гримучий газ. Найбільшу вибухонебезпечність цей газ має при об'ємному відношенні водню та кисню 2:1, або водню та повітря приблизно 2:5, оскільки у повітрі кисню міститься приблизно 21 %. Також водень пожежонебезпечний. Рідкий водень при попаданні на шкіру може спричинити сильне обмороження.
Вибухонебезпечні концентрації водню з киснем виникають від 4% до 96% об'ємних. При суміші з повітрям від 4% до 75(74)% об'ємних.
Економіка
Вартість водню при великооптових поставках коливається в діапазоні 2-5 $ за кг.
Застосування
Атомарний водень використовується для атомно-водневого зварювання.
Хімічна промисловість
- При виробництві аміаку, метанолу, мила та пластмас
- При виробництві маргарину з рідких рослинних олій
- Зареєстрований як харчова добавка E949(Пакувальний газ)
Харчова промисловість
Авіаційна промисловість
Водень дуже легкий і у повітрі завжди піднімається нагору. Колись дирижаблі та повітряні кулінаповнювали воднем. Але в 30-х роках. ХХ ст. сталося кількакатастроф, під час яких дирижаблі вибухали та згоряли. У наш час дирижаблі наповнюють гелієм, незважаючи на його значно високу вартість.
Паливо
Водень використовують як ракетне паливо.
Ведуться дослідження щодо застосування водню як палива для легкових та вантажних автомобілів. Водневі двигуни не забруднюють довкілляі виділяють лише водяну пару.
У воднево-кисневих паливних елементах використовується водень для безпосереднього перетворення енергії хімічної реакції на електричну.
«Рідкий водень»(«ЖВ») — рідкий агрегатний стан водню, з низькою питомою щільністю 0.07 г/см³ та кріогенними властивостями з точкою замерзання 14.01 K (−259.14 °C) та точкою кипіння 20.28 K (−252.87 °C). Є безбарвною рідиною без запаху, яка при змішуванні з повітрям відноситься до вибухонебезпечних речовин з діапазоном коефіцієнта займання 4-75%. Спинове співвідношення ізомерів у рідкому водні становить: 99,79% - паводок; 0,21% - ортоводород. Коефіцієнт розширення водню при зміні агрегатного стану газоподібне становить 848:1 при 20°C.
Як і будь-якого іншого газу, зрідження водню призводить до зменшення його обсягу. Після зрідження "ЖВ" зберігається в термічно ізольованих контейнерах під тиском. Рідкий водень (англ. Liquid hydrogen, LH2, LH 2) активно використовується в промисловості, як форма зберігання газу, і в космічній галузі, як ракетне паливо.
Історія
Перше документоване використання штучного охолодження в 1756 році було здійснено англійським ученим Вільямом Калленом, Гаспар Монж першим отримав рідкий стан оксиду сірки в 1784 році, Майкл Фарадей першим отримав скраплений аміак, американський винахідник Олівер Еванс охолодну машину в 1834 році і Джон Горі першим у США запатентував кондиціонер у 1851 році. Вернер Сіменс запропонував концепцію регенеративного охолодження у 1857 році, Карл Лінде запатентував обладнання для отримання рідкого повітря з використанням каскадного «ефекту розширення Джоуля - Томсона» та регенеративного охолодження у 1876 році. У 1885 році польський фізик та хімік Зигмунд Вро?блевський опублікував критичну температуру водню 33 K, критичний тиск 13.3 атм. і точку кипіння при 23 K. Вперше водень був зріджений Джеймсом Дьюаром в 1898 з використанням регенеративного охолодження і свого винаходу, суду Дьюара. Перший синтез стабільного ізомеру рідкого водню – параводню – був здійснений Полом Хартеком та Карлом Бонхеффером у 1929 році.
Спінові ізомери водню
Водень при кімнатній температурі складається здебільшого зі спинового ізомеру, ортоводороду. Після виробництва рідкий водень знаходиться в метастабільному стані і повинен бути перетворений на параводневу форму, для того щоб уникнути вибухонебезпечної екзотермічної реакції, яка має місце при його зміні при низьких температурах. Перетворення на пароводневу фазу зазвичай проводиться з використанням таких каталізаторів, як оксид заліза, оксид хрому, активоване вугілля, покритих платиною азбестів, рідкісноземельних металів або шляхом використання уранових або нікелевих добавок.
Використання
Рідкий водень може бути використаний як форма зберігання палива для двигунів. внутрішнього згоряннята паливних елементів. Різні підводні човни (проекти «212А» та «214», Німеччина) та концепти водневого транспорту були створені з використанням цієї агрегатної форми водню (див. наприклад «DeepC» або «BMW H2R»). Завдяки близькості конструкцій, творці техніки на «ЖВ» можуть використовувати або модифікувати системи, що використовують скраплений природний газ («СПГ»). Однак через нижчу об'ємну щільність енергії для горіння потрібен більший обсяг водню, ніж природного газу. Якщо рідкий водень використовується замість «СПГ» у поршневих двигунах, зазвичай потрібна громіздка паливна система. При прямому впорскуванні втрати у впускному тракті збільшують наповнення циліндрів.
Рідкий водень використовується для охолодження нейтронів в експериментах з нейтронного розсіювання. Маси нейтрону та ядра водню практично рівні, тому обмін енергією при пружному зіткненні найефективніший.
Переваги
Перевагою використання водню є "нульова емісія" його застосування. Продуктом взаємодії з повітрям є вода.
Перешкоди
Один літр «ЖВ» важить лише 0.07 кг. Тобто його питома густина становить 70.99 г/л при 20 K. Рідкий водень вимагає кріогенної технології зберігання, такої як спеціальні термічно ізольовані контейнери і вимагає особливого обігу, що властиво всім кріогенних матеріалів. Він близький у цьому відношенні до рідкого кисню, але потребує більшої обережності через пожежну небезпеку. Навіть у випадку з контейнерами з тепловою ізоляцією його важко утримувати при тій низькій температурі, яка потрібна для його збереження в рідкому стані (зазвичай він випаровується зі швидкістю 1% на день). При поводженні з ним також слід дотримуватися звичайних заходів безпеки під час роботи з воднем — він досить холодний для зрідження повітря, що є вибухонебезпечним.
Ракетне паливо
Рідкий водень є поширеним компонентом ракетного палива, що використовується для реактивного прискорення ракет-носіїв та космічних апаратів. У більшості рідинних ракетних двигунахна водні він спочатку застосовується для регенеративного охолодження сопла та інших частин двигуна, перед його змішуванням з окислювачем і спалюванням для отримання тяги. Використовувані сучасні двигуни на компонентах H 2 /O 2 споживають перебагачену воднем паливну суміш, що призводить до деякої кількості водню, що не згорів, у вихлопі. Крім збільшення питомого імпульсу двигуна за рахунок зменшення молекулярної ваги, це ще скорочує ерозію сопла та камери згоряння.
Такі перешкоди використання «ЖВ» в інших областях, як кріогенна природа та мала щільність, є також стримуючим фактором для використання у цьому випадку. На 2009 рік існує лише одна ракета-носій (РН «Дельта-4»), яка є водневою ракетою. В основному «ЖВ» використовується або на верхніх щаблях ракет, або на блоках, які значну частину роботи з виведення корисного навантаження в космос виконують у вакуумі. Як один із заходів щодо збільшення щільності цього виду палива існують пропозиції використання шугоподібного водню, тобто напівзамерзлої форми «ЖВ».
Водень H — найпоширеніший елемент у Всесвіті (близько 75 % за масою), Землі — дев'ятий за поширеністю. Найбільш важливою природною сполукою водню є вода.
Водень займає перше місце у періодичній системі (Z = 1). Він має найпростішу будову атома: ядро атома – 1 протон, оточене електронною хмарою, що складається з 1 електрона.
В одних умовах водень виявляє металеві властивості (віддає електрон), в інших – неметалічні (приймає електрон).
У природі зустрічаються ізотопи водню: 1Н – протий (ядро складається з одного протону), 2Н – дейтерій (D – ядро складається з одного протону та одного нейтрону), 3Н – тритій (Т – ядро складається з одного протону та двох нейтронів).
Проста речовина водень
Молекула водню складається з двох атомів, пов'язаних між собою ковалентним неполярним зв'язком.
Фізичні властивості.Водень - безбарвний нетоксичний газ без запаху та смаку. Молекула водню не є полярною. Тому сили міжмолекулярної взаємодії в газоподібному водні малі. Це проявляється у низьких температурах кипіння (-252,6 0С) та плавлення (-259,2 0С).
Водень легший за повітря, D (по повітрю) = 0,069; незначно розчиняється у воді (у 100 об'ємах H2O розчиняється 2 об'єми H2). Тому водень при його одержанні у лабораторії можна збирати методами витіснення повітря чи води.

Одержання водню
В лабораторії:
1.Дія розведених кислот на метали:
Zn +2HCl → ZnCl 2 +H 2
2.Взаємодія лужних та щ-з металівз водою:
Ca +2H 2 O → Ca(OH) 2 +H 2
3.Гідроліз гідридів: гідриди металів легко розкладаються водою з утворенням відповідного лугу та водню:
NaH+H2O → NaOH+H2
СаH 2 + 2Н 2 О = Са(ОН) 2 + 2Н 2
4.Дія лугів на цинк чи алюміній чи кремній:
2Al +2NaOH +6H 2 O → 2Na +3H 2
Zn +2KOH +2H 2 O → K 2 +H 2
Si + 2NaOH + H 2 O → Na 2 SiO 3 + 2H 2
5. Електроліз води. Для збільшення електричної провідностіводи до неї додають електроліт, наприклад NаОН, Н 2 SO 4 або Na 2 SO 4 . На катоді утворюється 2 обсяги водню, аноді - 1 обсяг кисню.
2H 2 O → 2H 2 +О 2
Промислове одержання водню
1. Конверсія метану з водяною парою, Ni 800 °С (найдешевший):
CH 4 + H 2 O → CO + 3 H 2
CO + H 2 O → CO 2 + H 2
У сумі:
CH 4 + 2 H 2 O → 4 H 2 + CO 2
2. Пари води через розпечений кокс при 1000 про:
З + H 2 O → CO + H 2
CO + H 2 O → CO 2 + H 2
Оксид вуглецю (IV), що утворюється, поглинається водою, цим способом отримують 50 % промислового водню.
3. Нагріванням метану до 350°С у присутності залізного або нікелевого каталізатора:
СH 4 → С + 2Н 2
4. Електроліз водних розчинів KCl або NaCl як побічний продукт:
2Н 2 Про + 2NaCl→ Cl 2 + H 2 + 2NaOH
Хімічні властивості водню
- У сполуках водень завжди одновалентний. Він характерна ступінь окислення +1, але у гідридах металів вона дорівнює -1.
- Молекула водню і двох атомів. Виникнення зв'язку з-поміж них пояснюється утворенням узагальненої пари електронів Н:Н чи Н 2
- Завдяки цьому узагальнення електронів молекула Н 2 більш енергетично стійка, ніж окремі атоми. Щоб розірвати в 1 моль водню молекули на атоми, необхідно витратити енергію 436 кДж: Н 2 = 2Н, ∆H° = 436 кДж/моль
- Цим пояснюється порівняно невелика активність молекулярного водню за нормальної температури.
- З багатьма неметалами водень утворює газоподібні сполуки типу RН 4 , RН 3 , RН 2 , RН.
1) З галогенами утворює галогеноводороди:
Н 2 + Cl 2 → 2НСl.
При цьому з фтором вибухає, з хлором і бромом реагує лише при освітленні або нагріванні, а з йодом тільки при нагріванні.
2) З киснем:
2Н 2 + О 2 → 2Н 2 О
із виділенням тепла. При нормальних температурах реакція протікає повільно, вище 550 ° С - з вибухом. Суміш 2 обсягів Н 2 і 1 обсягу 2 називається гримучим газом.
3) При нагріванні енергійно реагує із сіркою (значно важче з селеном та телуром):
Н 2 + S → H 2 S (сірководень),
4) З азотом з утворенням аміаку лише на каталізаторі та при підвищених температурах та тисках:
ДТ 2 + N 2 → 2NН 3
5) З вуглецем при високих температурах:
2Н 2 + С → СН 4 (метан)
6) З лужними та лужноземельними металами утворює гідриди (водень – окисник):
Н 2 + 2Li → 2LiH
у гідридах металів іон водню заряджений негативно (ступінь окислення -1), тобто гідрид Na + H - побудований подібно до хлориду Na + Cl -
Зі складними речовинами:
7) З оксидами металів (використовується для відновлення металів):
CuO+H2 → Cu+H2O
Fe 3 O 4 + 4H 2 → 3Fe + 4Н 2 О
8) з оксидом вуглецю (II):
CO + 2H 2 → CH 3 OH
Синтез - газ (суміш водню і чадного газу) має важливе практичне значення, т.к. залежно від температури, тиску і каталізатора утворюються різні органічні сполуки, наприклад НСНО, СН 3 ВІН та інші.
9) Ненасичені вуглеводні реагують з воднем, переходячи в насичені:
З n Н 2n + Н 2 → З n Н 2n+2.

Найпоширеніший елемент у всесвіті – це водень. У речовині зірок він має вигляд ядер – протонів – і є матеріалом для термоядерних процесів. Майже половина маси Сонця також складається з молекул H2. Зміст їх у земної корі сягає 0,15 % , а атоми є у складі нафти, газу, води. Разом з киснем, азотом та вуглецем він є органогенним елементом, що входить до складу всіх живих організмів на Землі. У нашій статті ми вивчимо фізичні та хімічні властивості водню, визначимо основні галузі його застосування у промисловості та значення у природі.
Положення в періодичній системі хімічних елементів Менделєєва
Перший елемент, що відкриває періодичну систему – це водень. Його атомна масаскладає 1,0079. Має два стабільні (проти і дейтерій) і один радіоактивний ізотоп (тритій). Фізичні властивості визначаються місцем неметалу в таблиці хімічних елементів. У звичайних умовах водень (формула його - H 2) є газом, який майже в 15 разів легший за повітря. Будова атома елемента унікальна: він складається лише з ядра та одного електрона. Молекула речовини двоатомна, частинки у ній з'єднуються за допомогою ковалентного неполярного зв'язку. Її енергоємність досить велика – 431 кДж. Це пояснює невисоку хімічну активність сполуки у звичайних умовах. Електронна формула водню є такою: H:H.
Речовина має ще цілу низку властивостей, аналогів яким немає серед інших неметалів. Розглянемо деякі з них.
Розчинність та теплопровідність
Найкраще проводять тепло метали, але водень теплопровідністю наближається до них. Пояснення феномену полягає у дуже великій швидкості теплового руху легких молекул речовини, тому у водневій атмосфері нагрітий предмет остигає у 6 разів швидше, ніж на повітрі. З'єднання може добре розчинятися у металах, наприклад, майже 900 об'ємів водню можуть бути поглинені одним об'ємом паладію. Метали можуть вступати з H 2 у хімічні реакції, у яких виявляються окисні властивості водню. В цьому випадку утворюються гідриди:
2Na + H2 = 2NaH.
У цій реакції атоми елемента приймають електрони від частинок металу, перетворюючись на аніони з поодиноким негативним зарядом. Просте речовина H 2 у разі є окислювачем, що з нього зазвичай не характерно.
Водень як відновник
Об'єднує метали і водень як висока теплопровідність, а й здатність їх атомів у хімічних процесах віддавати власні електрони, тобто окисляться. Наприклад, основні оксиди вступають у реакції з воднем. Окисно-відновна реакція закінчується виділенням чистого металу та утворенням молекул води:
CuO+H2=Cu+H2O.
Взаємодія речовини з киснем при нагріванні також призводить до отримання молекул води. Процес є екзотермічним та супроводжується виділенням великої кількостітеплової енергії. Якщо газова суміш H 2 і O 2 реагує у співвідношенні 2:1, її називають так як при підпалюванні вона вибухає:
2H 2 + O 2 = 2H 2 O.
Вода є і грає найважливішу роль формуванні гідросфери Землі, клімату, погоди. Вона забезпечує кругообіг елементів у природі, підтримує всі життєві процеси організмів – мешканців нашої планети.

Взаємодія з неметалами
Найбільш важливі хімічні властивості водню – це його реакції з неметалевими елементами. За нормальних умов досить хімічно інертні, тому речовина може реагувати тільки з галогенами, наприклад, з фтором або хлором, що є найбільш активними серед усіх неметалів. Так, суміш фтору і водню вибухає у темряві чи холоді, і з хлором - при нагріванні чи світла. Продуктами реакції будуть галогеноводи, водні розчинияких відомі як фторидна та хлоридна кислоти. З взаємодіє при температурі 450-500 градусів, тиску 30-100 мПа та у присутності каталізатора:
N₂ + 3H₂ ⇔ p, t, kat ⇔ 2NH₃.
Розглянуті хімічні властивості водню мають велике значеннядля промисловості. Наприклад, можна отримати цінний хімічний продукт – аміак. Він є основною сировиною для отримання нітратної кислоти та азотних добрив: карбаміду, нітрату амонію.

Органічні речовини
Між вуглецем і воднем призводить до отримання найпростішого вуглеводню - метану:
C + 2H2 = CH4.
Речовина є найважливішою складовоюприродного і вони застосовуються як цінний вид палива та сировини для промисловості органічного синтезу.
У хімії сполук вуглецю елемент входить до складу величезної кількості речовин: алканів, алкенів, вуглеводів, спиртів і т. д. Відомо багато реакцій органічних сполук з молекулами H 2 . Вони мають загальну назву - гідрування чи гідрогенізація. Так, альдегіди можна відновити воднем до спиртів, ненасичені вуглеводні - до алканів. Наприклад, етилен перетворюється на етан:
C 2 H 4 + H 2 = C 2 H 6 .

Важливе практичне значення мають такі хімічні властивості водню, як, наприклад, гідрогенізація рідких олій: соняшникової, кукурудзяної, рапсової. Вона призводить до отримання твердого жиру – саломасу, який використовують у виробництві гліцерину, мила, стеарину, твердих сортів маргарину. Для поліпшення зовнішнього виглядута смакових якостей харчового продукту до нього додають молоко, тваринні жири, цукор, вітаміни.
У нашій статті ми вивчили властивості водню та з'ясували його роль у природі та житті людини.
- Позначення – H (Hydrogen);
- Латинська назва – Hydrogenium;
- Період – I;
- Група – 1 (Ia);
- Атомна маса – 1,00794;
- Атомний номер – 1;
- Радіус атома = 53 пм;
- Ковалентний радіус = 32 пм;
- Розподіл електронів - 1s 1;
- t плавлення = -259,14 ° C;
- t кипіння = -252,87 ° C;
- Електронегативність (по Полінгу/по Алпреду та Рохову) = 2,02/-;
- Ступінь окиснення: +1; 0; -1;
- Щільність (н. у.) = 0,0000899 г/см3;
- Молярний об'єм = 14,1 см3/моль.
Бінарні сполуки водню з киснем:
Водень ("що народжує воду") було відкрито англійським ученим Г. Кавендішем у 1766 році. Це найпростіший елемент у природі - атом водню має ядро і один електрон, мабуть, тому водень є найпоширенішим елементом у Всесвіті (становить більше половини маси більшості зірок).
Про водень можна сказати, що "малий золотник, та дорогий". Незважаючи на свою "простоту", водень дає енергію всім живим істотам на Землі - на Сонці йде безперервна термоядерна реакція в ході якої з чотирьох атомів водню утворюється один атом гелію, цей процес супроводжується виділенням колосальної кількості енергії (детальніше див. ядерний синтез).
У земній корі масова частка водню становить лише 0,15%. Тим часом, переважна кількість (95%) всіх відомих на Землі хімічних речовинмістять один або кілька атомів водню.

У з'єднаннях з неметалами (HCl, H 2 O, CH 4 ...) водень віддає свій єдиний електрон більш електронегативним елементам, виявляючи ступінь окислення +1 (частіше), утворюючи тільки ковалентні зв'язки(Див. Ковалентний зв'язок).
У з'єднаннях з металами (NaH, CaH 2 ...) водень, навпаки, приймає на свою єдину s-орбіталь ще один електрон, намагаючись таким чином завершити свій електронний шар, виявляючи ступінь окислення -1 (рідше), утворюючи частіше іонну. зв'язок (див. Іонний зв'язок), т. до., різниця в електронегативності атома водню та атома металу може бути досить великою.
H 2
У газоподібному стані водень перебуває у вигляді двоатомних молекул, утворюючи неполярний ковалентний зв'язок.

Молекули водню мають:
- великою рухливістю;
- великою міцністю;
- малою поляризованістю;
- малими розмірами та масою.
Властивості газу водню:
- найлегший у природі газ, без кольору та запаху;
- погано розчиняється у воді та органічних розчинниках;
- в незначних кіл-вах розчиняється в рідких і твердих металах (особливо в платині та паладії);
- важко піддається зрідженню (через свою малу поляризуемість);
- має найвищу теплопровідність з усіх відомих газів;
- при нагріванні реагує з багатьма неметалами, виявляючи властивості відновника;
- при кімнатній температурі реагує зі фтором (відбувається вибух): H2 + F2 = 2HF;
- з металами реагує з утворенням гідридів, виявляючи окисні властивості: H 2 + Ca = CaH 2;
У сполуках водень набагато сильніше виявляє свої відновлювальні властивості, ніж окисні. Водень є найсильнішим відновником після вугілля, алюмінію та кальцію. Відновлювальні властивості водню широко використовуються в промисловості для одержання металів та неметалів (простих речовин) з оксидів та галідів.
Fe 2 O 3 + 3H 2 = 2Fe + 3H 2 O
Реакції водню із простими речовинами
Водень приймає електрон, граючи роль відновлювача, у реакціях:
- з киснем(при підпалюванні або у присутності каталізатора), у співвідношенні 2:1 (водень: кисень) утворюється вибухонебезпечний гримучий газ: 2H 2 0 +O 2 = 2H 2 +1 O+572 кДж
- з сірий(при нагріванні до 150°C-300°C): H 2 0 +S ↔ H 2 +1 S
- з хлором(при підпалюванні або опроміненні УФ-променями): H 2 0 +Cl 2 = 2H +1 Cl
- з фтором: H 2 0 +F 2 = 2H +1 F
- з азотом(при нагріванні в присутності каталізаторів або при високому тиску): 3H 2 0 +N 2 ↔ 2NH 3 +1
Водень віддає електрон, граючи роль окислювача, у реакціях з лужнимиі лужноземельнимиметалами з утворенням гідридів металів - солеподібні іонні сполуки, що містять гідрид-іони H - це нестійкі кристалічні в-ва білого кольору.
Ca+H 2 = CaH 2 -1 2Na+H 2 0 = 2NaH -1
Для водню нехарактерно виявляти рівень окислення -1. Реагуючи з водою, гідриди розкладаються, відновлюючи воду до водню. Реакція гідриду кальцію з водою має такий вигляд:
CaH 2 -1 +2H 2 +1 0 = 2H 2 0 +Ca(OH) 2
Реакції водню зі складними речовинами
- за високої температури водень відновлює багато оксидів металів: ZnO+H 2 = Zn+H 2 O
- метиловий спирт отримують внаслідок реакції водню з оксидом вуглецю (II): 2H 2 +CO → CH 3 OH
- у реакціях гідрогенізації водень реагує з багатьма органічними речовинами.
Докладніше рівняння хімічних реакцій водню та його сполук розглянуто сторінку " Водень і його сполуки - рівняння хімічних реакцій з участю водню " .
Застосування водню
- в атомної енергетикивикористовуються ізотопи водню - дейтерій та тритій;
- у хімічній промисловості водень використовують для синтезу багатьох органічних речовин, аміаку, хлороводню;
- у харчовій промисловості водень застосовують у виробництві твердих жирів за допомогою гідрогенізації рослинних олій;
- для зварювання та різання металів використовують високу температуру горіння водню в кисні (2600 ° C);
- при отриманні деяких металів водень використовують як відновник (див. вище);
- оскільки водень є легким газом, його використовують у повітроплаванні як наповнювач повітряних куль, аеростатів, дирижаблів;
- як паливо водень використовують у суміші з СО.
Останнім часом вчені приділяють чимало уваги пошуку альтернативних джерелвідновлюваної енергії. Одним із перспективних напрямів є "воднева" енергетика, в якій як паливо використовується водень, продуктом згоряння якого є звичайна вода.
Способи одержання водню
Промислові способи одержання водню:
- конверсією метану (каталітичним відновленням водяної пари) парами води за високої температури (800°C) на нікелевому каталізаторі: CH 4 + 2H 2 O = 4H 2 + CO 2 ;
- конверсією оксиду вуглецю з водяною парою (t=500°C) на каталізаторі Fe 2 O 3: CO + H 2 O = CO 2 + H 2;
- термічним розкладанням метану: CH 4 = C + 2H 2;
- газифікацією твердих палив (t=1000°C): C + H 2 O = CO + H 2;
- електролізом води (дуже дорогий спосіб, у якому виходить дуже чистий водень): 2H 2 O → 2H 2 + O 2 .
Лабораторні способи одержання водню:
- дією на метали (частіше цинк) соляною або розведеною сірчаною кислотою: Zn + 2HCl = ZCl 2 + H 2; Zn + H 2 SO 4 = ZnSO 4 + H 2;
- взаємодією пар води з розпеченими залізними стружками: 4H 2 O + 3Fe = Fe 3 O 4 + 4H 2 .