Є.Н.ФРЕНКЕЛЬ
Самовчитель з хімії
Посібник для тих, хто не знає, але хоче дізнатися та зрозуміти хімію
Частина I. Елементи загальної хімії
(Перший рівень складності)
Продовження. Див. у № 13, 18, 23/2007;
6/2008
Глава 4. Поняття про хімічного зв'язку
У попередніх розділах цього посібника були обговорення те, що речовина складається з молекул, а молекули – з атомів. А чи не виникало у вас питання: чому атоми, що становлять молекулу, не розлітаються в різні боки? Що утримує атоми у молекулі?
Їх утримує хімічний зв'язок .
Щоб зрозуміти природу хімічного зв'язку, досить згадати простий фізичний досвід. Дві кульки, що висять поруч на ниточках, ніяк не реагують один на одного. Але якщо надати одній кульці позитивний заряд, а іншій – негативний, вони притягнуться одна до одної. Чи не ця сила притягує атоми один до одного? Справді, дослідження показали, що хімічний зв'язок має електричну природу.
Звідки виникають заряди в нейтральних атомах?
Стаття опублікована за підтримки онлайн курсу підготовки до ЄДІ "Екзамір". На сайті Ви знайдете всі необхідні матеріали для самостійної підготовки до ЄДІ – складання унікального плану підготовки для кожного користувача, відстеження прогресу з кожної теми предмета, теорія та завдання. Усі завдання відповідають останнім змінам та доповненням. Є також можливість надсилати завдання з письмової частини ЄДІ на перевірку експертам для отримання балів та розбору роботи за критеріями оцінювання. Завдання у вигляді квестів із накопиченням досвіду, проходженням рівнів, отриманням бонусів та нагород, змагання з друзями на ЄДІ Арені. Щоб почати підготовку, перейдіть за посиланням: https://examer.ru.
При описі будови атомів було показано, що це атоми, крім атомів благородних газів, прагнуть приєднати чи віддати електрони. Причина – утворення стійкого восьмиелектронного зовнішнього рівня (як шляхетних газів). При прийомі чи віддачі електронів виникають електричні зарядиі, як наслідок, електростатична взаємодія частинок. Так виникає іонний зв'язок , тобто. зв'язок між іонами
Іони – це стійкі заряджені частинки, які утворюються внаслідок прийому чи віддачі електронів.
Наприклад, у реакції бере участь атом активного металу та активного неметалу:
У цьому процесі атом металу (натрію) віддає електрони:
![]()
а) Чи стійка така частка?
б) Скільки електронів залишилося в атомі натрію?
в) Чи матиме ця частка заряд?
Отже, у процесі утворилася стійка частка (8 електронів зовнішньому рівні), що має заряд, т.к. у ядра атома натрію заряд, як і раніше, +11, а електрони, що залишилися, мають сумарний заряд –10. Тому заряд іона натрію +1. Коротко запис цього процесу виглядає так:
![]()
Що відбувається з атомом сірки? Цей атом приймає електрони до завершення зовнішнього рівня:
![]()
Простий підрахунок показує, що ця частка має заряд:
![]()
Різноіменно заряджені іони притягуються, внаслідок чого виникає іонний зв'язок та «іонна молекула»:
Існують інші способи утворення іонів, про які буде сказано в розділі 6.
Формально сульфіду натрію приписують саме такий склад молекули, хоча речовина, що складається з іонів, має приблизно таку будову (рис. 1):
Таким чином, речовини, що складаються з іонів, не містять окремих молекул!У цьому випадку можна говорити лише про умовну «іонну молекулу».
Завдання 4.1.Покажіть, як відбувається перехід електронів у разі виникнення іонного зв'язку між атомами:
а) кальцію та хлору;
б) алюмінію та кисню.
П о м н і т е! Атом металу віддає зовнішні електрони; атом неметалу приймає електрони, що відсутні.
Висновок.Іонний зв'язок за описаним вище механізмом утворюється між атомами активних металів та активних неметалів.
Дослідження, однак, показують, що повний перехід електронів від одного атома до іншого відбувається далеко не завжди. Дуже часто хімічний зв'язок утворюється не при віддачі-прийомі електронів, а внаслідок утворення загальних електронних пар*. Такий зв'язок називається ковалентної .
Ковалентний зв'язок виникає за рахунок утворення спільних електронних пар. Цей вид зв'язку утворюється, наприклад, між атомами неметалів. Так, відомо, що молекула азоту і двох атомів – N 2 . Як виникає ковалентний зв'язокміж цими атомами? Щоб відповісти на це питання, необхідно розглянути будову атома азоту:
П о про с. Скільки електронів не вистачає до завершення зовнішнього рівня?
Відповідь. Бракує трьох електронів. Тому, позначивши кожен електрон зовнішнього рівня крапкою, отримаємо:
П о про с. Чому три електрони позначені одиночними точками?
Відповідь. Справа в тому, що ми хочемо показати утворення загальних пар електронів. А пара – це два електрони. Така пара виникає, зокрема, якщо кожен атом надасть по одному електрону для утворення пари. Тому азоту не вистачає трьох електронів до завершення зовнішнього рівня. Отже, він повинен «приготувати» три одиночні електрони для утворення майбутніх пар (рис. 2).
Отримано електронна формула молекулиазоту, що показує, що з кожного атома азоту є тепер вісім електронів (шість їх обведені в овал плюс по 2 електрона своїх); між атомами виникли три загальні пари електронів (місце перетину гуртків).
Кожна пара електронів відповідає одному ковалентному зв'язку.Скільки ковалентних зв'язків з'явилося? Три. Кожен зв'язок (кожну загальну пару електронів) покажемо за допомогою рисочки (валентний штрих):
![]()
Всі ці формули не дають, однак, відповіді на запитання: що пов'язує атоми при утворенні ковалентного зв'язку? Електронна формула показує, що загальна пара електронів розташована між атомами. У цій галузі простору виникає надлишковий негативний заряд. А ядра атомів, як відомо, мають позитивний заряд. Таким чином, ядра обох атомів притягуються до загального негативного заряду, який виник завдяки загальним електронним парам (точніше, перетину електронних хмар) (рис. 3).
Чи може виникнути такий зв'язок між різними атомами? Може. Нехай атом азоту взаємодіє з атомами водню:
Будова атома водню показує, що атом має електрон. Скільки таких атомів потрібно взяти, щоб атом азоту «отримав бажане» – три електрони? Очевидно, три атоми водню
(Рис. 4):
Хрестиком на мал. 4 позначені електрони атома водню. Електронна формула молекули аміаку показує, що атом атома стало вісім електронів, а кожен атом водню вийшло по два електрони (а більше на першому енергетичному рівні і бути не може).
Графічна формула показує, що атом азоту має валентність три (три рисочки, або три валентні штрихи), а кожен атом водню – валентність один (по одній рисці).
Хоча до складу обох молекул N 2 і NН 3 входить той самий атом азоту, хімічні зв'язки між атомами відрізняються один від одного. У молекулі азоту N 2 хімічні зв'язки утворюють однакові атомитому загальні пари електронів знаходяться посередині між атомами. Атоми зберігають нейтральний характер. Такий хімічний зв'язок називається неполярний .
У молекулі аміаку NH 3 утворюють хімічний зв'язок різні атоми. Тому один із атомів (в даному випадку – атом азоту) сильніше притягує загальну пару електронів. Загальні пари електронів зміщуються у бік атома азоту, і у ньому виникає невеликий негативний заряд, але в атомі водню – позитивний, виникли полюси електрики – зв'язок полярна (Рис. 5).
Більшість речовин, збудованих за допомогою ковалентного зв'язку, складаються з окремих молекул (рис. 6).
З рис. 6 видно, що між атомами хімічні зв'язки є, між молекулами вони відсутні або незначні.
Тип хімічного зв'язку впливає властивості речовини, з його поведінка у розчинах. Так, чим більше, значніше тяжіння між частинками, тим важче їх відірвати один від одного і складніше перевести тверду речовину в газоподібну або рідкий стан. Спробуйте визначити на схемі, наведеній нижче, між якими частинками сили взаємодії більше і який хімічний зв'язок утворюється при цьому (рис. 7).
Якщо ви уважно прочитали розділ, відповідь у вас буде такою: максимальна взаємодія між частинками здійснюється у разі I (іонний зв'язок). Тому всі такі речовини – тверді. Найменша взаємодія між незарядженими частинками (випадок III – неполярний ковалентний зв'язок). Такі речовини найчастіше гази.
Завдання 4.2.Визначте, який хімічний зв'язок здійснюється між атомами в речовинах: NаСl, НСl, Сl2, АlСl3, Н2О. Дайте пояснення.
Завдання 4.3.Складіть електронні та графічні формулидля тих речовин із завдання 4.2, у яких ви визначили наявність ковалентного зв'язку. Для іонного зв'язку складіть схеми переходу електронів.
Розділ 5. Розчини
Немає на Землі людини, яка не бачила б розчинів. А що це таке?
Розчин – це однорідна суміш із двох або більше компонентів ( складових частинчи речовин).
Що таке однорідна суміш? Однорідність суміші передбачає, що між складовими її речовинами відсутня поверхня розділу. У цьому випадку неможливо принаймні візуально визначити, скільки речовин утворило цю суміш. Наприклад, дивлячись на водопровідну воду в склянці, важко припустити, що в ній, крім молекул води, міститься ще добрий десяток іонів і молекул (Про 2, СО2, Са2+ та ін). І ніякий мікроскоп не допоможе бачити ці частинки.
Але відсутність поверхні розділу – не єдина ознака однорідності. В однорідній суміші склад суміші в будь-якій точці однаковий. Тому для отримання розчину потрібно ретельно перемішати компоненти (речовини), що утворюють його.
Розчини можуть мати різний агрегатний стан:
Газоподібні розчини (наприклад, повітря - суміш газів О 2, N 2, СО 2, Аr);
Рідкі розчини (наприклад, одеколон, сироп, розсіл);
Тверді розчини (наприклад, метали).
Одна з речовин, що утворюють розчин, називається розчинником. Розчинник має такий же агрегатний стан, що і розчин. Так, для рідких розчинів – це рідина: вода, олія, бензин тощо. Найчастіше практично застосовуються водні розчини. Про них і йтиметься далі (якщо не буде зроблено відповідне застереження).
Що відбувається при розчиненні різних речовин у воді? Чому одні речовини добре розчиняються у воді, інші – погано? Від чого залежить розчинність – здатність речовини розчинятися у воді?
Уявімо, що у склянку з теплою водою поклали шматочок цукру. Полежав він, зменшився у розмірах і... зник. Куди? Невже порушується закон збереження речовини (її маси, енергії)? Ні. Зробіть ковток отриманого розчину, і ви переконаєтесь, що вода солодка, цукор не зник. Але чому його не видно?
Справа в тому, що в ході розчинення відбувається дроблення (подрібнення) речовини. У разі шматочок цукру розпався на молекули, які ми бачити не можемо. Так, але чому цукор, що лежить на столі, не розпадається на молекули? Чому шматочок маргарину, опущений у воду, також нікуди не зникає? А тому, що дроблення розчиняється речовини відбувається під дією розчинника, наприклад води. Але розчинник може «розтягти» кристал, тверда речовина на молекули, якщо зможе «учепитися» за ці частинки. Іншими словами, при розчиненні речовини має бути взаємодія між речовиною та розчинником.
Коли можлива така взаємодія? Тільки в тому випадку, коли будова речовин (і розчинника, і розчинника) схожа, подібна. Здавна відомо правило алхіміків: "подібне розчиняється в подібному". У прикладах молекули цукру полярні і з-поміж них і полярними молекулами води існують певні сили взаємодії. Такі сили відсутні між неполярними молекулами жиру та полярними молекулами води. Тому жири у воді не розчиняються. Таким чином, розчинність залежить від природи розчиняється речовини та розчинника.
В результаті взаємодії між речовиною, що розчиняється, і водою утворюються сполуки – гідрати. Це можуть бути дуже міцні сполуки:

Такі сполуки існують як індивідуальні речовини: основи, кислоти, що містять кисень. Звичайно, при утворенні цих сполук виникають міцні хімічні зв'язки, виділяється теплота. Так при розчиненні СаО (негашене вапно) у воді виділяється так багато теплоти, що суміш закипає.
Але чому при розчиненні цукру чи солі у воді отриманий розчин не нагрівається? По-перше, далеко не всі гідрати такі міцні, як сірчана кислота або гідроксид кальцію. Існують гідрати солей (кристаллогідрати), які легко розкладаються при нагріванні:

По-друге, при розчиненні, як згадувалося, йде процес дроблення. На це витрачається енергія, поглинається теплота.
Оскільки обидва процеси відбуваються одночасно, розчин може нагріватися або охолоджуватися, залежно від того, який процес переважає.
Завдання 5.1.Визначте, який процес – дроблення чи гідратація – переважає у кожному разі:
а) при розчиненні сірчаної кислоти у воді, якщо нагрівся розчин;
б) при розчиненні нітрату амонію у воді, якщо розчин охолоне;
в) при розчиненні кухонної солі у воді, якщо температура розчину мало змінилася.
Оскільки при розчиненні змінюється температура розчину, природно припустити, що розчинність залежить від температури. Справді, розчинність більшості твердих речовин збільшується під час нагрівання. Розчинність газів при нагріванні зменшується. Тому тверді речовини зазвичай розчиняють у теплій або гарячій водіа газовані напої зберігають на холоді.
Розчинність(Здатність розчинятися) речовин не залежить від подрібнення речовини або інтенсивності перемішування. Але, підвищуючи температуру, подрібнюючи речовину, перемішуючи готовий розчин, можна прискорити процес розчинення. Змінюючи умови одержання розчину, можна отримувати розчини різних складів. Природно, існує межа, досягнувши яку, легко виявити, що речовина більше не розчиняється у воді. Такий розчин називається насиченим. Для добре розчинних речовин насичений розчин міститиме багато розчиненої речовини. Так, насичений розчин KNO 3 при 100 °С містить 245 г солі на 100 г води (345 г розчину), це концентрованийрозчин. Насичені розчини погано розчинних речовин містять нікчемні маси розчинених сполук. Так, насичений розчин срібла хлориду містить 0,15 мг AgCl в 100 г води. Це дуже розведенийрозчин.
Таким чином, якщо розчин містить багато розчиненої речовини стосовно розчинника, він називається концентрованим, якщо речовини мало - розведеним. Найчастіше від складу розчину залежать його властивості, отже, і застосування.
Так, розведений розчин оцтової кислоти (столовий оцет) використовують як смакову приправу, а концентрований розчин цієї кислоти (оцтова есенція прийому внутрішньо) може викликати смертельний опік.
Для того щоб відобразити кількісний склад розчинів, використовують величину, яка називається масовою часткою розчиненої речовини :
де m(В-ва) - маса розчиненої речовини в розчині; m(р-ра) – загальна маса розчину, що містить розчинену речовину та розчинник.
Так, якщо 100 г оцту містять 6 г оцтової кислоти, то йдеться про 6% розчин оцтової кислоти (це столовий оцет). Способи розв'язання задач з використанням поняття масової частки розчиненої речовини будуть розглянуті у розділі 8.
Висновки за розділом 5.Розчини – це однорідні суміші, що складаються не менше ніж із двох речовин, одна з яких називається розчинник, інша – розчинена речовина. При розчиненні відбувається взаємодія цієї речовини з розчинником, завдяки чому розчиняється речовина подрібнюється. Склад розчину виражають за допомогою масової частки розчиненої речовини у розчині.
* Ці електронні пари виникають у місці перетину електронних хмар.
Далі буде
ВИЗНАЧЕННЯ
Аміак- Нітрид водню.
Формула - NH3. Молярна маса- 17 г/моль.
Фізичні властивості аміаку
Аміак (NH 3) – безбарвний газ із різким запахом (запах «нашатирного спирту»), легший за повітря, добре розчинний у воді (один обсяг води розчинять до 700 обсягів аміаку). Концентрований розчин аміаку містить 25% (масових) аміаку та має щільність 0,91 г/см 3 .
Зв'язки між атомами у молекулі аміаку – ковалентні. Загальний виглядмолекули AB 3 . У гібридизацію вступають усі валентні орбіталі атома азоту, отже, тип гібридизації молекули аміаку – sp 3 . Аміак має геометричну структуру типу AB 3 E – тригональну піраміду (рис. 1).
Рис. 1. Будова молекули аміаку.
Хімічні властивості аміаку
У хімічному відношенні аміак досить активний: він вступає у реакції взаємодії з багатьма речовинами. Ступінь окислення азоту в аміаку «-3» - мінімальний, тому аміак виявляє лише відновлювальні властивості.
При нагріванні аміаку з галогенами, оксидами важких металів та киснем утворюється азот:
2NH 3 + 3Br 2 = N 2 + 6HBr
2NH 3 + 3CuO = 3Cu + N 2 + 3H 2 O
4NH 3 +3O 2 = 2N 2 + 6H 2 O
У присутності каталізатора аміак здатний окислюватися до оксиду азоту (II):
4NH 3 + 5O 2 = 4NO + 6H 2 O (каталізатор – платина)
На відміну від водневих сполукнеметалів VI та VII груп, аміак не виявляє кислотних властивостей. Однак, атоми водню в його молекулі все ж таки здатні заміщатися на атоми металів. При повному заміщенні водню металом відбувається утворення сполук, званих нітридами, які також можна отримати і за безпосередньої взаємодії азоту з металом при високій температурі.
Основні властивості аміаку обумовлені наявністю неподіленої пари електронів у атома азоту. Розчин аміаку у воді має лужне середовище:
NH 3 + H 2 O ↔ NH 4 OH ↔ NH 4 + + OH
При взаємодії аміаку з кислотами утворюються солі амонію, які при нагріванні розкладаються:
NH 3 + HCl = NH 4 Cl
NH 4 Cl = NH 3 + HCl (при нагріванні)
Отримання аміаку
Виділяють промислові та лабораторні способи одержання аміаку. У лабораторії аміак одержують дією лугів на розчини солей амонію при нагріванні:
NH 4 Cl + KOH = NH 3 + KCl + H 2 O
NH 4 + + OH - = NH 3 + H 2 O
Ця реакція є якісною на іони амонію.
Застосування аміаку
Виробництво аміаку – один із найважливіших технологічних процесів у всьому світі. Щорічно у світі виробляють близько 100 млн. т. Аміаку. Випуск аміаку здійснюють у рідкому вигляді або у вигляді 25% водного розчину – аміачної води. Основні напрями використання аміаку – виробництво азотної кислоти (виробництво азотсодержащих мінеральних добрив згодом), солей амонію, сечовини, уротропіну, синтетичних волокон (нейлону і капрону). Аміак застосовують як холодоагент у промислових холодильних установках, як відбілювач при очищенні та фарбуванні бавовни, вовни та шовку.
Приклади розв'язання задач
ПРИКЛАД 1
| Завдання | Які маса та обсяг аміаку, які потрібні для отримання 5т нітрату амонію? |
| Рішення | Запишемо рівняння реакції отримання нітрату амонію з аміаку та азотної кислоти: NH 3 + HNO 3 = NH 4 NO 3 За рівнянням реакції кількість речовини нітрату амонію дорівнює 1 моль - v(NH 4 NO 3) = 1моль. Тоді, маса нітрату амонію, розрахована за рівнянням реакції: m(NH 4 NO 3) = v(NH 4 NO 3)×M(NH 4 NO 3); m(NH 4 NO 3) = 1×80 = 80 т Відповідно до рівняння реакції, кількість речовини аміаку також дорівнює 1 моль - v (NH 3) = 1 моль. Тоді, маса аміаку, розрахована за рівнянням: m(NH 3) = v(NH 3)×M(NH 3); m(NH 3) = 1×17 = 17 т Складемо пропорцію і знайдемо масу аміаку (практичну): х г NH 3 – 5 т NH 4 NO 3 17 т NH 3 - 80 т NH 4 NO 3 х = 17×5/80 = 1,06 m(NH 3) = 1,06 т Аналогічну пропорцію складемо для знаходження обсягу аміаку: 1,06 г NH 3 - х л NH 3 17 т NH 3 – 22,4×10 3 м 3 NH 3 х = 22,4×10 3 ×1,06/17 = 1,4×10 3 V(NH 3) = 1,4×10 3 м 3 |
| Відповідь | Маса аміаку – 1,06 т, об'єм аміаку – 1,4×10 м |
3.3.1 Ковалентний зв'язок - Це двоцентровий двоелектронний зв'язок, що утворюється за рахунок перекриття електронних хмар, що несуть неспарені електрони з антипаралельними спинами. Як правило, утворюється між атомами одного хімічного елемента.
Кількісно вона характеризується валентністю. Валентність елемента – це його здатність утворювати певну кількість хімічних зв'язків рахунок вільних електронів, що є атомної валентної зоні.
Ковалентний зв'язок утворює лише пара електронів, що перебуває між атомами. Вона називається поділеною парою. Інші пари електронів називають неподіленими парами. Вони заповнюють оболонки та не беруть участь у зв'язуванні.Зв'язок між атомами може здійснюватися як однієї, а й двома і навіть трьома поділеними парами. Такі зв'язки називаються подвійними і т рійними – кратними зв'язками.
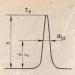
3.3.1.1 Ковалентний неполярний зв'язок. Зв'язок, що здійснюється за рахунок утворення електронних пар, що однаково належать обом атомам, називається ковалентної неполярної. Вона виникає між атомами з практично рівною електронегативністю (0,4 > ΔЕО > 0) і, отже, рівномірним розподілом електронної густини між ядрами атомів у гомоядерних молекул. Наприклад, Н 2, О 2, N 2, Cl 2 і т. д. Дипольний момент таких зв'язків дорівнює нулю. Зв'язок СН в граничних вуглеводнях (наприклад, СН 4) вважається практично неполярною, т.к. Δ ЕО = 2,5(С) – 2,1(Н) = 0,4.
3.3.1.2 Ковалентний полярний зв'язок.Якщо молекула утворена двома різними атомами, то зона перекриття електронних хмар (орбіталей) зміщується у бік одного з атомів, і такий зв'язок називається полярний . При такому зв'язку ймовірність знаходження електронів біля ядра одного з атомів вища. Наприклад, НCl, H 2 S, PH 3 .
Полярний (несиметричний) ковалентний зв'язок - зв'язок між атомами з різною електронегативністю (2 > ΔЕО > 0.4) та несиметричним розподілом загальної електронної пари. Як правило, вона утворюється між двома неметалами.
Електронна щільність такого зв'язку зміщена у бік більш електронегативного атома, що призводить до появи на ньому часткового негативного заряду (дельта мінус), а на менш електронегативному атомі - часткового позитивного заряду (дельта плюс)
C Cl C O C N O H C Mg
Напрямок зміщення електронів позначається також стрілкою:
CCl, CО, CN, ОН, CMg.
Чим більша різниця в електронегативності зв'язуваних атомів, тим вище полярність зв'язку і більший її дипольний момент. Між протилежними за знаком частковими зарядами діють додаткові сили тяжіння. Тому, чим полярніший зв'язок, тим він міцніший.
Крім поляризованості ковалентний зв'язок має властивість насичуваності - Здатністю атома утворювати стільки ковалентних зв'язків, скільки в нього є енергетично доступних атомних орбіталей. Третьою властивістю ковалентного зв'язку є її спрямованість.
3.3.2 Іонний зв'язок. Рушійною силою її утворення є те саме прагнення атомів до октетної оболонки. Але в ряді випадків така "октетна" оболонка може виникнути лише при передачі електронів від одного атома до іншого. Тому, як правило, іонний зв'язок утворюється між металом та неметалом.
Розглянемо як приклад реакцію між атомами натрію (3s 1) і фтору (2s 2 3s 5). Різниця електронегативності у поєднанні NaF
ЕО = 4,0 - 0,93 = 3,07
Натрій, віддавши фтору свій 3s 1 -електрон, стає іоном Na + і залишається із заповненою 2s 2 2p 6 оболонкою, що відповідає електронній конфігурації атома неону. Таку саму електронну конфігурацію набуває фтор, прийнявши один електрон, відданий натрієм. Внаслідок цього виникають сили електростатичного тяжіння між протилежно зарядженими іонами.
Іонний зв'язок - крайній випадок полярного ковалентного зв'язку, заснований на електростатичному тяжінні іонів. Такий зв'язок виникає при великій різниці в електронегативності зв'язуваних атомів (ЕО > 2), коли менш електронегативний атом майже повністю віддає свої валентні електрони і перетворюється на катіон, а інший, більш електронегативний атом, ці електрони приєднує і стає аніоном. Взаємодія іонів протилежного знака не залежить від напрямку, а кулонівські сили не мають властивість насиченості. В силу цього іонний зв'язок не має просторової спрямованості і насичуваності , Оскільки кожен іон пов'язаний з певною кількістю протиіонів (координаційне число іона). Тому іонно-пов'язані з'єднання не мають молекулярної будови і є твердими речовинами, що утворюють іонні кристалічні грати, з високими температурами плавлення і кипіння, вони високополярні, часто солеподібні, у водних розчинах електропровідні. Наприклад, MgS, NaCl, А 2 O 3 . З'єднань із чисто іонними зв'язками практично не існує, оскільки завжди залишається деяка частка ковалентності через те, що повного переходу одного електрона до іншого атома не спостерігається; у «іонних» речовин частка іонності зв'язку не перевищує 90 %. Наприклад, NaF поляризація зв'язку становить близько 80%.
У органічних сполуках іонні зв'язки трапляються досить рідко, т.к. атом вуглецю не схильний ні втрачати, ні купувати електрони із заснуванням іонів.
Валентність елементів у з'єднаннях з іонними зв'язками дуже часто характеризують ступенем окиснення , Яка, у свою чергу, відповідає величині заряду іона елемента в даному з'єднанні.
Ступінь окислення - це умовний заряд, який набуває атома в результаті перерозподілу електронної щільності. Кількісно вона характеризується числом зміщених електронів від менш електронегативного елемента до більш електронегативного. Позитивно заряджений іон утворюється з елемента, який віддав свої електрони, а негативний іон - з елемента, який ці електрони прийняв.
Елемент, що знаходиться в вищого ступеня окиснення (максимально позитивною), вже віддав усі свої валентні електрони, що перебувають у АВЗ. А оскільки їхня кількість визначається номером групи, в якій стоїть елемент, то вищий ступінь окиснення для більшості елементів і дорівнюватиме номеру групи . Що стосується нижчого ступеня окиснення (максимально негативною), вона з'являється для формування восьмиелектронної оболонки, тобто у разі, коли АВЗ заповнюється повністю. Для неметалів вона розраховується за формулою № групи – 8 . Для металів дорівнює нулю оскільки вони електрони приймати не можуть.
Наприклад, АВЗ сірки має вигляд: 3s 2 3р 4 . Якщо атом віддасть усі електрони (шість), то придбає вищий ступіньокиснення +6 , рівну номеру групи VI якщо прийме два, необхідні для завершення стійкої оболонки, то придбає нижчий ступінь окислення –2 , рівну № групи - 8 = 6 - 8 = -2.
3.3.3 Металевий зв'язок.Більшість металів має ряд властивостей, що мають загальний характері від властивостей інших речовин. Такими властивостями є порівняно високі температури плавлення, здатність до відображення світла, висока тепло- та електропровідність. Ці особливості пояснюються існуванням у металах особливого виду взаємодії – металевий зв'язок.
Відповідно до положення в періодичній системі атоми металів мають невелику кількість валентних електронів, які досить слабо пов'язані зі своїми ядрами і можуть легко відриватися від них. В результаті цього в кристалічній решітці металу з'являються позитивно заряджені іони, локалізовані в певних положеннях кристалічної решітки, і велика кількість ділокалізованих (вільних) електронів, що вільно переміщуються в полі позитивних центрів і здійснюють зв'язок між усіма атомами металу за рахунок електростатичного тяжіння.
У цьому полягає важлива відмінність металевих зв'язків від ковалентних, які мають сувору спрямованість у просторі. Сили зв'язку в металах не локалізовані і не спрямовані, а вільні електрони, що утворюють «електронний газ», зумовлюють високу тепло- та електропровідність. Тому в цьому випадку неможливо говорити про спрямованість зв'язків, тому що валентні електрони розподілені по кристалу майже рівномірно. Саме цим і пояснюється, наприклад, пластичність металів, тобто можливість усунення іонів та атомів у будь-якому напрямку
3.3.4 Донорно-акцепторний зв'язок. Крім механізму утворення ковалентного зв'язку, згідно з яким загальна електронна пара виникає при взаємодії двох електронів, існує також особливий донорно-акцепторний механізм . Він полягає в тому, що ковалентний зв'язок утворюється в результаті переходу вже існуючої (неподіленої) електронної пари донора (постачальника електронів) у спільне користування донора та акцептора (Постачальника вільної атомної орбіталі).
Після утворення вона нічим не відрізняється від ковалентної. Донорно-акцепторний механізм добре ілюструється схемою утворення іону амонію (рисунок 9) (зірочками позначені електрони зовнішнього рівня атома азоту):

Рисунок 9- Схема утворення іона амонію
Електронна формула АВЗ атома азоту 2s 2 2р 3 тобто він має три неспарених електрони, які вступають у ковалентний зв'язок з трьома атомами водню (1s 1), кожен з яких має один валентний електрон. У цьому утворюється молекула аміаку NH 3, у якій зберігається неподілена електронна пара азоту. Якщо до цієї молекули підійде протон водню (1s 0), який не має електронів, то азот передасть свою пару електронів (донор) на цю атомну орбіталь водню (акцептор), внаслідок чого утворюється іон амонію. У ньому кожен атом водню пов'язані з атомом азоту загальної електронної парою, одне з яких реалізована по донорно-акцепторному механізму. Важливо, що зв'язку Н-N, Утворені за різними механізмами, жодних відмінностей у властивостях не мають. Зазначене явище обумовлено тим, що в момент утворення зв'язку орбіталі 2s-і 2р-електронів атома азоту змінюють свою форму. У результаті з'являються чотири абсолютно однакові формою орбіталі.
Як донори зазвичай виступають атоми з великою кількістю електронів, але мають невелику кількість неспарених електронів. Для елементів II періоду така можливість крім атома азоту є у кисню (дві неподілені пари) та у фтору (три неподілені пари). Наприклад, іон водню Н + у водних розчинах ніколи не буває у вільному стані, так як з молекул води Н 2 Про та іона Н + завжди утворюється іон гідроксонію Н 3 О + Іон гідроксонію присутній у всіх водних розчинах, хоча для простоти в написанні зберігається символ H+.
3.3.5 Водневий зв'язок. Атом водню, пов'язаний із сильно електронегативним елементом (азотом, киснем, фтором та ін.), який «стягує» на себе загальну електронну пару, відчуває нестачу електронів і набуває ефективного позитивного заряду. Тому він здатний взаємодіяти з неподіленою парою електронів іншого електронегативного атома (який набуває ефективний негативний заряд) цієї ж (внутрішньомолекулярний зв'язок) або іншої молекули (міжмолекулярний зв'язок). В результаті виникає водневий зв'язок , яка графічно позначається точками:

Цей зв'язок значно слабший за інші хімічні зв'язки (енергія її утворення 10 – 40 кДж/моль) і переважно має частково електростатичний, частково донорно-акцепторний характер.
Винятково важливу роль водневий зв'язок грає в біологічних макромолекулах, таких неорганічних сполуках як H2O, H2F2, NH3. Наприклад, зв'язки О-Н у Н2О мають помітний полярний характер із надлишком негативного заряду – на атомі кисню. Атом водню, навпаки, набуває невеликого позитивного заряду + і може взаємодіяти з неподіленими парами електронів атома кисню сусідньої молекули води.
Взаємодія між молекулами води виявляється досить сильною, такою, що навіть у парах води присутні димери і тримери складу (H 2 O) 2 , (Н 2 O) 3 і т. д. У розчинах можуть виникати довгі ланцюги асоціатів такого виду:
оскільки атом кисню має дві неподілені пари електронів.
Наявність водневих зв'язків пояснює високі температури кипіння води, спиртів, карбонових кислот. За рахунок водневих зв'язків вода характеризується такими високими в порівнянні з H 2 Е (Е = S, Se, Te) температурами плавлення та кипіння. Якби водневі зв'язки були відсутні, то вода плавилася при -100 °С, а кипіла при -80 °С. Типові випадки асоціації спостерігаються для спиртів та органічних кислот.
Водневі зв'язки можуть виникати між різними молекулами, так і всередині молекули, якщо в цій молекулі є групи з донорною і акцепторною здібностями. Наприклад, саме внутрішньомолекулярні водневі зв'язки відіграють основну роль в утворенні пептидних ланцюгів, що визначають будову білків. Н-зв'язки впливають на фізичні та Хімічні властивостіречовини.
Зв'язки типу водневих не утворюють атоми інших елементів , Оскільки сили електростатичного тяжіння різноїменних кінців диполів полярних зв'язків (О-Н, N-H і т.п.) досить слабкі та діють лише на малих відстанях. Водень, маючи найменший атомний радіус, дозволяє зблизитися таким диполям настільки, що сили тяжіння стають помітними. Жоден інший елемент з великим атомним радіусом не здатний до утворення подібних зв'язків.
3.3.6 Сили міжмолекулярної взаємодії (сили Ван-дер-Ваальса). У 1873 р. голландський вчений І. Ван-дер-Ваальс припустив, що існують сили, що зумовлюють тяжіння між молекулами. Ці сили пізніше отримали назву ван-дер-ваальсових сил – найуніверсальніший вид міжмолекулярного зв'язку. Енергія ван-дер-ваальсового зв'язку менша від водневої і становить 2–20 кДж/∙моль.
Залежно від способу виникнення сили поділяються на:
1) орієнтаційні (диполь-диполь або іон-диполь) – виникають між полярними молекулами або між іонами та полярними молекулами. При зближенні полярних молекул вони орієнтуються таким чином, щоб позитивна сторона одного диполя була орієнтована на негативну сторону іншого диполя (рисунок 10).
|
Рисунок 10 - Орієнтаційна взаємодія |
||||
2) індукційні (диполь - індукований диполь або іон - індукований диполь) - виникають між полярними молекулами або іонами та неполярними молекулами, але здатними до поляризації. Диполі можуть впливати на неполярні молекули, перетворюючи їх на індиковані (наведені) диполі. (Малюнок 11).
|
Рисунок 11 - Індукційна взаємодія |
||||
3) дисперсійні (індукований диполь – індукований диполь) – виникають між неполярними молекулами, здатними до поляризації. У будь-якій молекулі або атомі благородного газу виникають флуктуації електричної щільності, внаслідок чого з'являються миттєві диполі, які індукують миттєві диполі в сусідніх молекул. Рух миттєвих диполів стає узгодженим, їхня поява та розпад відбувається синхронно. Через війну взаємодії миттєвих диполів енергія системи знижується (рисунок 12).
|
Рисунок 12 - Дисперсійна взаємодія |
|||||||
.
Вам відомо, що атоми можуть з'єднуватись один з одним з утворенням як простих, так і складних речовин. При цьому утворюються різного типухімічні зв'язки: іонна, ковалентна (неполярна та полярна), металева та воднева.Одна з найбільш істотних властивостей атомів елементів, що визначають, який зв'язок утворюється між ними - іонна або ковалентна, - це електронегативність, тобто. здатність атомів у поєднанні притягувати себе електрони.
Умовну кількісну оцінку електронегативності дає шкала відносних електронегативностей.
У періодах спостерігається загальна тенденція зростання електронегативності елементів, а в групах - їх падіння. Елементи по електронегативностям розташовують у ряд, на підставі якого можна порівняти електронегативності елементів, що знаходяться в різних періодах.
Тип хімічного зв'язку залежить від того, наскільки велика різниця значень електронегативності атомів елементів, що з'єднуються. Чим більше відрізняються за електронегативністю атоми елементів, що утворюють зв'язок, тим хімічніший зв'язок полярніший. Провести різку межу між типами хімічних зв'язків не можна. У більшості сполук тип хімічного зв'язку виявляється проміжним; наприклад, сильнополярний ковалентний хімічний зв'язок близький до іонного зв'язку. Залежно від того, до якого з граничних випадків ближчий за своїм характером хімічний зв'язок, його відносять або до іонного, або до ковалентного полярного зв'язку.
Іонний зв'язок.Іонний зв'язок утворюється при взаємодії атомів, які різко відрізняються один від одного за електронегативністю.Наприклад, типові металилітій(Li), натрій(Na), калій(K), кальцій (Ca), стронцій(Sr), барій(Ba) утворюють іонний зв'язок із типовими неметалами, в основному з галогенами.
Крім галогенідів лужних металів, іонний зв'язок також утворюється в таких сполуках, як луги та солі. Наприклад, у гідроксиді натрію (NaOH) та сульфаті натрію (Na 2 SO 4) іонні зв'язки існують тільки між атомами натрію та кисню (інші зв'язки – ковалентні полярні).
Ковалентний неполярний зв'язок.При взаємодії атомів з однаковою електронегативністю утворюються молекули з ковалентним неполярним зв'язком.Такий зв'язок існує в молекулах наступних простих речовин: H 2 , F 2 , Cl 2 , O 2 , N 2 Хімічні зв'язку у цих газах утворені у вигляді загальних електронних пар, тобто. при перекриванні відповідних електронних хмар, обумовленому електронно-ядерним взаємодією, які здійснює при зближенні атомів.
Складаючи електронні формулиречовин, слід пам'ятати, що кожна загальна електронна пара – це умовне зображення підвищеної електронної густини, що виникає внаслідок перекривання відповідних електронних хмар.
Ковалентний полярний зв'язок.При взаємодії атомів, значення електронегативностей яких відрізняються, але не різко, відбувається зсув загальної електронної пари до більш негативного атома.Це найбільш поширений тип хімічного зв'язку, який зустрічається як у неорганічних, так і органічних сполуках.
До ковалентних зв'язків повною мірою відносяться ті зв'язки, які утворені за донорно-акцепторним механізмом, наприклад в іонах гідроксонію і аммонію.
Металевий зв'язок.
Зв'язок, який утворюється в результаті взаємодії відносно вільних електронів з іонами металів, називаються металевим зв'язком.Цей тип зв'язку уражає простих речовин- металів.
Сутність процесу утворення металевого зв'язку полягає в наступному: атоми металів легко віддають валентні електрони та перетворюються на позитивні заряджені іони. Щодо вільні електрони, що відірвалися від атома, переміщуються між позитивними іонами металів. Між ними виникає металевий зв'язок, Т. е. Електрони хіба що цементують позитивні іони кристалічної решітки металів.
Водневий зв'язок.
Зв'язок, що утворюється між атомами водню однієї молекули та атомом сильно електронегативного елемента(O, N, F) іншої молекули називається водневим зв'язком.
Може виникнути питання: чому саме водень утворює такий специфічний хімічний зв'язок?
Це пояснюється тим, що атомний радіусводню дуже малий. Крім того, при зміщенні або повній віддачі свого єдиного електрона водень набуває порівняно високого позитивного заряду, за рахунок якого водень однієї молекули взаємодіє з атомами електронегативних елементів, що мають частковий негативний заряд, що виходить до складу інших молекул (HF, H 2 O, NH 3) .
Розглянемо деякі приклади. Зазвичай ми зображаємо склад води хімічною формулою H 2 O. Однак це не зовсім точно. Правильніше було б склад води позначати формулою (H 2 O)n, де n = 2,3,4 тощо. буд. Це пояснюється лише тим, що окремі молекули води пов'язані між собою у вигляді водневих зв'язків.
Водневий зв'язок прийнято позначати крапками. Вона набагато слабша, ніж іонна або ковалентна зв'язок, але сильніша, ніж звичайна міжмолекулярна взаємодія.
Наявність водневих зв'язків пояснює збільшення обсягу води при зниженні температури. Це з тим, що з зниження температури відбувається зміцнення молекул і тому зменшується щільність їх «упаковки».
При вивченні органічної хіміївиникало і таке питання: чому температури кипіння спиртів набагато вищі, ніж відповідних вуглеводнів? Пояснюється це тим, що між молекулами спиртів також утворюються водневі зв'язки.
Підвищення температури кипіння спиртів відбувається також внаслідок укрупнення їх молекул.
Водневий зв'язок характерний і для багатьох інших. органічних сполук(фенолів, карбонових кислот та ін.). З курсів органічної хімії та загальної біології вам відомо, що наявністю водневого зв'язку пояснюється вторинна структурабілків, будова подвійної спіралі ДНК, т. е. явище компліментарності.
NH3 - одне з найвідоміших та найкорисніших хімічних речовин. Воно набуло широкого застосування в аграрній промисловості і не тільки. Відрізняється унікальними хімічними властивостями, завдяки яким використовується у різних галузях.
Що таке NH3
NH 3 відомо навіть найдальшій від хімії людині. Це аміак. Аміак (NH 3) інакше називається нітридом водню і є за нормальних умов безбарвним газом, що має яскраво виражений, характерний для даної речовини запах. Також варто зазначити, що газ NH 3 (під назвою аміак) майже вдвічі легший за повітря!
Крім газу, може бути рідина при температурі близько 70 ° С або ж існувати у вигляді розчину (розчин аміаку). Відмінною особливістю рідкого NH 3 виступає можливість розчиняти в собі метали головних підгруп I та II групи таблиці елементів Д. І. Менделєєва (тобто лужні та лужноземельні метали), а також магній, алюміній, європій та ітербій. На відміну від води рідкий аміак не взаємодіє з вищезгаданими елементами, а виступає саме в ролі розчинника. Ця властивість дозволяє виділяти метали у вихідному вигляді за допомогою випаровування розчинника (NH 3). На малюнку нижче можна побачити, як виглядає розчинений у рідкому аміаку натрій.
Як виглядає аміак із погляду хімічних зв'язків?
Схему аміаку (NH 3) та її просторової будови найбільш наочно демонструє трикутна піраміда. Вершиною "піраміди" аміаку є атом азоту (виділений синім кольором), що видно на зображенні нижче.

Атоми речовини під назвою аміак (NH 3) пов'язані водневими зв'язками, як й у молекулі води. Але дуже важливо пам'ятати, що зв'язки у молекулі аміаку слабші, ніж у молекулі води. Це пояснює те, що температури плавлення та кипіння NH 3 нижче, якщо порівнювати з H 2 O.
Хімічні властивості
Найбільш поширені 2 способи одержання речовини NH 3 під назвою аміак. У промисловості застосовується так званий процес Габер, суть якого полягає у зв'язуванні азоту повітря та водню (отриманого з метану) за допомогою пропускання суміші даних газів при високому тиску над нагрітим каталізатором.
У лабораторіях синтез аміаку найчастіше ґрунтується на взаємодії концентрованого хлориду амонію з твердим гідроксидом натрію.
Приступимо до безпосереднього розгляду хімічних властивостей NH3.
1) NH 3 виступає як слабка основа. Саме тому має місце наступне рівняння, що описує взаємодію з водою:
NH 3 + H 2 O = NH4 + + OH -
2) Також на основних властивостях NH 3 ґрунтується його здатність реагувати з кислотами та утворювати відповідні солі амонію:
NH3 + HNO 3 = NH 4 NO 3 (нітрат амонію)
3) Раніше йшлося про те, що певна група металів розчиняється у рідкому аміаку. Однак деякі метали також здатні не просто розчинятися, а утворювати сполуки NH 3 під назвою аміди:
Na (тв) + NH3 (г) = NaNH 2 + H 2
Na (тв) + NH3 (ж) = NaNH 2 + H 2 (реакція здійснюється в присутності заліза як каталізатор)
4) При взаємодії NH 3 з металами Fe 3+ , Cr 3+ , Al 3+ , Sn 4+ , Sn 2+ відбувається утворення відповідних гідроксидів металів та катіону аміонію:
Fe 3+ + NH 3 + H 2 O = Fe(OH) 3 + NH 4 +
5) Результатом взаємодії NH 3 c металами Cu 2+ , Ni 2+ , Co 2+ , Pd 2+ , Pt 2+ , Pt 4+ найчастіше є відповідні комплекси металів:
Cu 2+ + NH 3 + H 2 O = Cu(OH) 2 + NH 4 +
Cu(OH) 2 + NH 3 = 2 + + OH -
Утворення та подальший шлях NH3 в організмі людини
Відомо, що невід'ємною частиною біохімічних процесів у людини є амінокислоти. Саме вони є основним джерелом NH 3, речовини під назвою аміак, - результату їхнього окисного дезамінування (найчастіше). На жаль, для організму людини аміак токсичний, з нього легко утворюється згаданий вище катіон амонію (NH 4 +), що накопичується в клітинах. Згодом відбувається уповільнення найважливіших біохімічних циклів, а результаті - падіння рівня виробленого АТФ.
Неважко здогадатися, що організму необхідні механізми зв'язування і знешкодження NH 3 , що виділяється. На схемі нижче представлені джерела та деякі продукти зв'язування аміаку в організмі людини.

Отже, коротко кажучи, знешкодження аміаку відбувається через утворення його транспортних форм у тканинах (наприклад, глутамін і аланін), шляхом екскреції з сечею, за допомогою біосинтезу сечовини, що є основним природним способом знешкодження NH 3 в організмі людини.
NH3 - речовини з назвою аміак
В сучасності рідкий аміак є найбільш концентрованим та дешевим азотним добривом, що використовується в сільському господарстві для аммонізації грубих ґрунтів та торфу. При внесенні рідкого аміаку в ґрунті відбувається зростання кількості мікроорганізмів, але не спостерігається негативних наслідків, як, наприклад, від твердих добрив. Нижче на малюнку представлено одну з можливих установок для зрідження газоподібного аміаку за допомогою рідкого азоту.

Випаровуючись, рідкий аміак поглинає з довкіллябагато теплоти, що викликає охолодження. Ця властивість використовується в холодильних установках для отримання штучного льодупри зберіганні швидкопсувних харчових продуктів. Крім того, з його допомогою заморожують ґрунт при будівництві підземних споруд. Водні розчиниаміаку знаходять застосування в хімічній промисловості (є промисловим неводним розчинником), лабораторній практиці (наприклад, у ролі розчинника при електрохімічному одержанні хімічних продуктів), медицині та домашньому побуті.