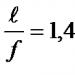ОПРЕДЕЛЕНИЕ
Бензол(циклохексатриен - 1,3,5) - органично вещество, най-простият представител на редица ароматни въглеводороди.
Формула - C 6 H 6 (структурна формула - фиг. 1). Молекулна маса – 78, 11.
Ориз. 1. Структурни и пространствени формули на бензола.
Всичките шест въглеродни атома в молекулата на бензола са в sp 2 хибридно състояние. Всеки въглероден атом образува 3σ връзки с два други въглеродни атома и един водороден атом, лежащи в същата равнина. Шест въглеродни атома образуват правилен шестоъгълник (σ-скелет на бензоловата молекула). Всеки въглероден атом има една нехибридизирана р-орбитала, която съдържа един електрон. Шест p-електрона образуват един π-електронен облак (ароматна система), който е изобразен като кръг в шестчленен цикъл. Въглеводородният радикал, получен от бензол, се нарича C 6 H 5 - - фенил (Ph-).
Химични свойства на бензола
Бензенът се характеризира с реакции на заместване, протичащи по електрофилния механизъм:
- халогениране (бензенът взаимодейства с хлор и бром в присъствието на катализатори - безводен AlCl 3, FeCl 3, AlBr 3)
C 6 H 6 + Cl 2 = C 6H 5 -Cl + HCl;
- нитриране (бензолът лесно реагира с нитрираща смес - смес от концентрирана азотна и сярна киселини)

- алкилиране с алкени
C 6 H 6 + CH 2 \u003d CH-CH 3 → C 6 H 5 -CH (CH 3) 2;
Реакциите на присъединяване към бензол водят до разрушаване ароматна системаи продължете само при тежки условия:
- хидрогениране (реакцията протича при нагряване, катализаторът е Pt)

- добавяне на хлор (възниква под действието на UV лъчение с образуване на твърд продукт - хексахлорциклохексан (хексахлоран) - C 6 H 6 Cl 6)

Като всеки органично съединениебензолът влиза в реакция на горене с образуване на въглероден диоксид и вода като реакционни продукти (гори с сажди пламък):
2C 6 H 6 + 15O 2 → 12CO 2 + 6H 2 O.
Физични свойства на бензола
Бензолът е безцветна течност, но има специфична остра миризма. Образува азеотропна смес с вода, смесва се добре с етери, бензин и различни органични разтворители. Точка на кипене - 80.1C, точка на топене - 5.5C. Токсичен, канцерогенен (т.е. допринася за развитието на рак).
Получаване и използване на бензол
Основните методи за получаване на бензол:
— дехидроциклизация на хексан (катализатори - Pt, Cr 3 O 2)
CH3-(CH2)4-CH3 → C6H6 + 4H2;
- дехидрогениране на циклохексан (реакцията протича при нагряване, катализаторът е Pt)
C6H12 → C6H6 + 4H2;
– тримеризация на ацетилен (реакцията протича при нагряване до 600С, катализаторът е активен въглен)
3HC≡CH → C6H6.
Бензенът служи като суровина за производството на хомолози (етилбензол, кумол), циклохексан, нитробензен, хлорбензол и други вещества. Преди това бензолът се използваше като добавка към бензина за увеличаване на октановото му число, но сега, поради високата му токсичност, съдържанието на бензол в горивото е строго регулирано. Понякога бензолът се използва като разтворител.
Примери за решаване на проблеми
ПРИМЕР 1
| Упражнение | Запишете уравненията, с които можете да извършите следните трансформации: CH 4 → C 2 H 2 → C 6 H 6 → C 6 H 5 Cl. |
| Решение | За получаване на ацетилен от метан се използва следната реакция: 2CH4 → C2H2 + 3H2 (t = 1400°С). Получаването на бензол от ацетилен е възможно чрез реакцията на тримеризация на ацетилена, която се случва при нагряване (t = 600C) и в присъствието на активен въглен: 3C 2 H 2 → C 6 H 6 . Реакцията на хлориране на бензол за получаване на хлоробензен като продукт се извършва в присъствието на железен (III) хлорид: C 6 H 6 + Cl 2 → C 6 H 5 Cl + HCl. |
ПРИМЕР 2
| Упражнение | Към 39 g бензен в присъствието на железен (III) хлорид се прибавя 1 mol бромна вода. Какво количество от веществото и колко грама от какви продукти е довело това? |
| Решение | Нека напишем уравнението за реакцията на бромиране на бензол в присъствието на железен (III) хлорид: C 6 H 6 + Br 2 → C 6 H 5 Br + HBr. Продуктите на реакцията са бромобензен и бромоводород. Моларна масабензол, изчислен с помощта на таблицата химични елементи DI. Менделеев - 78 g/mol. Намерете количеството бензолово вещество: n(C6H6) = m(C6H6) / M(C6H6); n(C6H6) = 39/78 = 0,5 mol. Според условието на задачата бензенът реагира с 1 mol бром. Следователно бензолът е в недостиг и ще бъдат направени допълнителни изчисления за бензола. Според уравнението на реакцията n (C 6 H 6): n (C 6 H 5 Br) : n (HBr) \u003d 1: 1: 1, следователно n (C 6 H 6) = n (C 6 H 5 Br) \u003d: n(HBr) = 0,5 mol. Тогава масите на бромобензол и бромоводород ще бъдат равни: m(C6H5Br) = n(C6H5Br)×M(C6H5Br); m(HBr) = n(HBr)×M(HBr). Моларни маси на бромобензен и бромоводород, изчислени с помощта на таблицата на химичните елементи на D.I. Менделеев - съответно 157 и 81 g/mol. m(C6H5Br) = 0,5 × 157 = 78,5 g; m(HBr) = 0,5 х 81 = 40,5 g. |
| Отговор | Продуктите на реакцията са бромобензен и бромоводород. Масите на бромобензола и бромоводорода са съответно 78,5 и 40,5 g. |
Арени (ароматни въглеводороди) – това са ненаситени (ненаситени) циклични въглеводороди, чиито молекули съдържат стабилни циклични групиатоми (бензолни ядра) със затворена система от спрегнати връзки.
Обща формула: C n H 2n–6за n ≥ 6.
Химични свойстваарени
Арени- ненаситени въглеводороди, чиито молекули съдържат три двойни връзки и цикъл. Но поради ефекта на конюгиране, свойствата на арените се различават от тези на другите ненаситени въглеводороди.
Ароматните въглеводороди се характеризират с реакции:
- присъединяване,
- заместване,
- окисление (за хомолози на бензол).
Ароматната система на бензола е устойчива на окислители. Въпреки това, хомолозите на бензола се окисляват от действието на калиев перманганат и други окислители.
1. Реакции на добавяне
Бензенът добавя хлор в светлината и водород, когато се нагрява в присъствието на катализатор.
1.1. хидрогениране
Бензенът добавя водород при нагряване и под налягане в присъствието на метални катализатори (Ni, Pt и др.).
При хидрогениране на бензол се получава циклохексан:
Хидрогенирането на хомолози дава циклоалканови производни. Когато толуенът се нагрява с водород под налягане и в присъствието на катализатор, се образува метилциклохексан:
1.2. Хлориране на арени
Продължава добавянето на хлор към бензол по радикален механизъм при висока температура, под въздействието на ултравиолетова радиация.
Хлорирането на бензола в присъствието на светлина произвежда 1,2,3,4,5,6-хексахлорциклохексан (хексахлоран).
Хексахлоран е пестицид, използван за борба с вредни насекоми. Понастоящем употребата на хексахлоран е забранена.
Хомолозите на бензола не добавят хлор. Ако хомологът на бензола реагира с хлор или бром изложени на светлина или висока температура (300°C), тогава има заместване на водородни атоми на страничния алкилов заместител, а не на ароматния пръстен.
2. Реакции на заместване
2.1. Халогениране
Бензолът и неговите хомолози влизат в реакции на заместване с халогени (хлор, бром) в присъствието на катализатори (AlCl 3 , FeBr 3) .
При взаимодействие с хлор върху катализатора AlCl 3 се образува хлоробензен:
Ароматните въглеводороди взаимодействат с брома при нагряване и в присъствието на катализатор - FeBr 3 . Металното желязо може да се използва и като катализатор.
Бромът реагира с желязо, за да образува железен (III) бромид, който катализира бромирането на бензол:
Мета-хлоротолуен се образува в малки количества.
При взаимодействието на хомолозите на бензола с халогени на светлина или при висока температура(300 o C), водородът се замества не в бензоловия пръстен, а в страничния въглеводороден радикал.
Например, при хлориране на етилбензен:
2.2. Нитриране
Бензолът реагира с концентриран азотна киселинао в присъствието на концентрирана сярна киселина (нитрираща смес).
В този случай се образува нитробензол:
Толуенът реагира с концентрирана азотна киселина в присъствието на концентрирана сярна киселина.
В продуктите на реакцията ние посочваме едно от двете относно-нитротолуен:
или П-нитротолуен:
Нитрирането на толуен може да продължи и със заместването на три водородни атома. В този случай се образува 2,4,6-тринитротолуен (тротил, тол):
2.3. Алкилиране на ароматни въглеводороди
- Арените взаимодействат с халоалкани в присъствието на катализатори (AlCl 3, FeBr 3 и др.), за да образуват бензенови хомолози.
- Ароматните въглеводороди взаимодействат с алкени в присъствието на алуминиев хлорид, железен (III) бромид, фосфорна киселинаи т.н.
- Алкилирането с алкохоли протича в присъствието на концентрирана сярна киселина.
2.4. Сулфониране на ароматни въглеводороди
Бензенът реагира при нагряване с концентрирана сярна киселина или разтвор на SO 3 в сярна киселина (олеум), за да образува бензенсулфонова киселина:
3. Окисление на арени
Бензенът е устойчив дори на силни окислители. Но хомолозите на бензола се окисляват под действието на силни окислители. Бензолът и неговите хомолози изгарят.
3.1. Пълно окисление - изгаряне
Изгарянето на бензола и неговите хомолози произвежда въглероден диоксид и вода. Реакцията на горене на арените е придружена от освобождаване Голям бройтоплина.
2C 6 H 6 + 15O 2 → 12CO 2 + 6H 2 O + Q
Уравнение за изгаряне на арен в общ изглед:
C n H 2n–6 + (3n – 3)/2 O 2 → nCO 2 + (n – 3)H 2 O + В
Когато ароматните въглеводороди изгарят при липса на кислород, може да се образува въглероден окис CO или сажди C.
Бензолът и неговите хомолози горят във въздуха с димящ пламък. Бензолът и неговите хомолози образуват експлозивни смеси с въздух и кислород.
3.2. Оокисляване на хомолози на бензол
Хомолозите на бензола се окисляват лесно от перманганат и калиев бихромат в кисела или неутрална среда при нагряване.
В същото време се случва окисляване на всички връзки при въглеродния атомв съседство с бензоловия пръстен, с изключение на връзката на този въглероден атом към бензоловия пръстен.
Толуенът се окислява калиев перманганат в сярна киселинас образование бензоена киселина:
Ако толуенът е окислен в неутрален разтвор при нагряване, тогава се образува сол на бензоена киселина - калиев бензоат:
Значи толуен обезцветява подкиселен разтвор на калиев перманганатпри нагряване.
По-дългите радикали се окисляват до бензоена киселина и карбоксилна киселина:
Когато пропилбензолът се окисли, се образуват бензоена и оцетна киселини:
Изопропилбензенът се окислява от калиев перманганат в кисела среда до бензоена киселина и въглероден диоксид:
4. Ориентиращо действие на заместители в бензоловия пръстен
Ако в бензеновия пръстен има заместители, не само алкилови, но и съдържащи други атоми (хидроксил, аминогрупа, нитро група и т.н.), тогава реакциите на заместване на водородните атоми в ароматната система протичат по строго определен начин, в в съответствие с природата влияние на заместителя върху ароматната π-система.
Видове заместители на бензоловия пръстен
| Заместители от първи вид | Заместители от втори вид |
| орто- и двойка- позиция | По-нататъшното заместване се извършва главно в мета- позиция |
| Донор на електрони, увеличете електронната плътност в бензоловия пръстен | Извличането на електрони намалява електронната плътност в конюгираната система. |
|
|
Физически свойства
Бензолът и неговите най-близки хомолози са безцветни течности със специфична миризма. Ароматните въглеводороди са по-леки от водата и не се разтварят в нея, но лесно се разтварят в органични разтворители - алкохол, етер, ацетон.
Бензолът и неговите хомолози сами по себе си са добри разтворители за мнозина органична материя. Всички арени горят с опушен пламък поради високото съдържание на въглерод в техните молекули.
Физичните свойства на някои арени са представени в таблицата.
Таблица. Физически свойства на някои арени
|
име |
Формула |
t°.pl., |
t°.bp., |
|
Бензол |
C6H6 |
5,5 |
80,1 |
|
Толуен (метилбензен) |
C 6 H 5 CH 3 |
95,0 |
110,6 |
|
Етилбензол |
C 6 H 5 C 2 H 5 |
95,0 |
136,2 |
|
Ксилол (диметилбензен) |
C6H4 (CH3)2 |
||
|
орто- |
25,18 |
144,41 |
|
|
мета- |
47,87 |
139,10 |
|
|
двойка- |
13,26 |
138,35 |
|
|
Пропилбензол |
C 6 H 5 (CH 2) 2 CH 3 |
99,0 |
159,20 |
|
Кумол (изопропилбензен) |
C6H5CH(CH3)2 |
96,0 |
152,39 |
|
стирол (винилбензен) |
C 6 H 5 CH = CH 2 |
30,6 |
145,2 |
Бензол - ниско кипящ ( Tкип= 80,1°C), безцветна течност, неразтворима във вода
Внимание! Бензол - отрова, действа върху бъбреците, променя формулата на кръвта (при продължителна експозиция), може да наруши структурата на хромозомите.
Повечето ароматни въглеводороди са животозастрашаващи и токсични.
Получаване на арени (бензол и неговите хомолози)
В лабораторията
1. Сливане на соли на бензоена киселина с твърди основи
C6H5-COONa + NaOH t → C6H6 + Na2CO3
натриев бензоат
2. Реакция на Wurtz-Fitting: (тук G е халоген)
От 6Х 5 -G+2на + Р-G →° С 6 Х 5 - Р + 2 наг
ОТ 6 H 5 -Cl + 2Na + CH 3 -Cl → C 6 H 5 -CH 3 + 2NaCl
В индустрията
- изолиран от нефт и въглища чрез фракционна дестилация, реформинг;
- от каменовъглен катран и коксов газ
1. Дехидроциклизация на алканис повече от 6 въглеродни атома:
C6H14 T , кат→C6H6 + 4H2
2. Тримеризация на ацетилен(само за бензол) – Р. Зелински:
3С 2 H2 600°° С, Закон. въглища→C6H6
3. Дехидрогениранециклохексан и неговите хомолози:
Съветският академик Николай Дмитриевич Зелински установи, че бензолът се образува от циклохексан (дехидрогениране на циклоалкани
C6H12 т, кат→C6H6 + 3H2

C6H11-CH3 T , кат→C6H5-CH3 + 3H2
метилциклохексанетолуен
4. Алкилиране на бензол(получаване на хомолози на бензола) – r Friedel-Crafts.
C6H6 + C2H5-Cl t, AlCl3→C6H5-C2H5 + HCl
хлороетан етилбензол

Химични свойства на арените
аз. РЕАКЦИИ НА ОКИСЛЕНИЕ
1. Изгаряне (опушен пламък):
2C6H6 + 15O2 T→12CO2 + 6H2O + Q
2. Бензенът при нормални условия не обезцветява бромната вода и воден разтворкалиев перманганат
3. Хомолозите на бензола се окисляват от калиев перманганат (обезцветяване на калиев перманганат):
А) в кисела среда до бензоена киселина
Под действието на калиев перманганат и други силни окислители върху хомолозите на бензола, страничните вериги се окисляват. Колкото и сложна да е веригата на заместителя, тя се разрушава, с изключение на а-въглеродния атом, който се окислява до карбоксилна група.
Хомолозите на бензола с една странична верига дават бензоена киселина:
Хомолозите, съдържащи две странични вериги, дават двуосновни киселини:
5C 6 H 5 -C 2 H 5 + 12KMnO 4 + 18H 2 SO 4 → 5C 6 H 5 COOH + 5CO 2 + 6K 2 SO 4 + 12MnSO 4 + 28H 2 O
5C 6 H 5 -CH 3 + 6KMnO 4 + 9H 2 SO 4 → 5C 6 H 5 COOH + 3K 2 SO 4 + 6MnSO 4 + 14H 2 O
Опростено :
C6H5-CH3 + 3O KMnO4→C6H5COOH + H2O
Б) в неутрални и слабо алкални до соли на бензоена киселина
C 6 H 5 -CH 3 + 2KMnO 4 → C 6 H 5 COO K + K OH + 2MnO 2 + H 2 O
II. РЕАКЦИИ НА ДОБИВАНЕ (по-твърд от алкените)
1. Халогениране
C6H6 + 3Cl2 з ν → C 6 H 6 Cl 6 (хексахлорциклохексан - хексахлоран)
2. Хидрогениране
C6H6 + 3H2 T , тилиNi→C6H12 (циклохексан)
3. Полимеризация
III. РЕАКЦИИ НА ЗАМЕСТВАНЕ – йонен механизъм (по-лек от алканите)
1. Халогениране -
а ) бензол
C6H6 + Cl2 AlCl 3 → C6H5-Cl + HCl (хлоробензен)
C6H6 + 6Cl2 t,AlCl3→C6Cl6 + 6HCl( хексахлорбензол)
C6H6 + Br2 t,FeCl3→ C6H5-Br + HBr( бромбензен)
б) хомолози на бензол при облъчване или нагряване
По химични свойства алкиловите радикали са подобни на алканите. Водородните атоми в тях се заменят с халогени чрез свободен радикален механизъм. Следователно, в отсъствието на катализатор, нагряването или UV облъчването води до реакция на радикално заместване в страничната верига. Влиянието на бензоловия пръстен върху алкиловите заместители води до факта, че водородният атом винаги се замества при въглеродния атом, директно свързан с бензоловия пръстен (а-въглероден атом).
1) C6H5-CH3 + Cl2 з ν → C6H5-CH2-Cl + HCl
в) хомолози на бензол в присъствието на катализатор
C6H5-CH3 + Cl2 AlCl 3 → (смес от орта, двойка производни) +HCl
2. Нитриране (с азотна киселина)
C 6 H 6 + HO-NO 2 t, H2SO4→C6H5-NO2 + H2O
нитробензол - миризма бадем!
C6H5-CH3 + 3HO-NO2 t, H2SO4→ ОТ H3-C6H2 (NO2)3 + 3H2O2,4,6-тринитротолуен (тол, тротил)
Използването на бензол и неговите хомолози
Бензол C6H6 е добър разтворител. Бензолът като добавка подобрява качеството на моторното гориво. Той служи като суровина за производството на много ароматни органични съединения - нитробензен C 6 H 5 NO 2 (разтворител, от него се получава анилин), хлоробензен C 6 H 5 Cl, фенол C 6 H 5 OH, стирен и др.
толуен C 6 H 5 -CH 3 - разтворител, използван при производството на багрила, лекарства и експлозиви (тротил (тол) или 2,4,6-тринитротолуен TNT).
ксилен C6H4 (CH3)2. Техническият ксилен е смес от три изомера ( орто-, мета- и двойка-ксилони) - се използва като разтворител и изходен продукт за синтеза на много органични съединения.
Изопропилбензол C 6 H 5 -CH (CH 3) 2 служи за получаване на фенол и ацетон.
Хлорни производни на бензолизползвани за растителна защита. По този начин продуктът от заместване на Н атоми в бензол с хлорни атоми е хексахлоробензен C 6 Cl 6 - фунгицид; използва се за суха семена на пшеница и ръж срещу твърда смута. Продуктът от добавянето на хлор към бензол е хексахлорциклохексан (хексахлоран) C 6 H 6 Cl 6 - инсектицид; използва се за борба с вредни насекоми. Тези вещества се отнасят до пестициди - химически средства за борба с микроорганизми, растения и животни.
стирол C 6 H 5 - CH \u003d CH 2 полимеризира много лесно, образувайки полистирол и кополимеризирайки с бутадиен - стирол-бутадиенови каучуци.
ВИДЕО ИЗПИТВАНЕ
Представяме на вашето внимание видео урок на тема "Химични свойства на бензола". Използвайки това видео, можете да получите представа за химичните свойства на бензола, както и за тежките условия, които са необходими за реакцията на бензола с други вещества.
тема:ароматни въглеводороди
Урок:Химични свойства на бензола
Ориз. 1. Молекула на бензол
Разбиването на р-електронния облак в молекулата на бензола е трудно. Следователно бензолът влиза в химична реакциямного по-малко активни от ненаситените съединения.


За да може бензолът да влезе в химични реакции, са необходими доста тежки условия: повишена температура и в много случаи катализатор. При повечето реакции стабилният бензенов пръстен се запазва.
1. Бромиране.

Необходим е катализатор (желязо(III) или алуминиев бромид) и дори малки количества вода не трябва да влизат. Ролята на катализатора е, че бромната молекула се привлича от един от бромните атоми към атома на желязото. В резултат на това се поляризира - двойка електрони на връзката преминават към бромния атом, свързан с желязо:
Br+…. Br-FeBr 3 .
Br+ е силен електрофил. Той се привлича от шестелектронния облак на бензоловия пръстен и го разбива, образувайки ковалентна връзкас въглероден атом:
Бромният анион може да се присъедини към получения катион. Но намаляването на ароматната система на бензоловия пръстен е енергийно по-благоприятно от добавянето на бромен анион. Следователно, молекулата преминава в стабилно състояние чрез изхвърляне на водороден йон:
Всички реакции на електрофилно заместване в бензоловия пръстен протичат по подобен механизъм.
2. Нитриране

Бензолът и неговите хомолози реагират със смес от концентрирана сярна и азотна киселини (нитрираща смес). В нитриращата смес, в равновесие, има нитрониев йон NO 2 +, който е електрофил:

3. Сулфониране.
Бензен и други арени, когато се нагряват, реагират с концентрирана сярна киселина или олеум - разтвор на SO 3 в сярна киселина:

4 . Алкилиране на Фридел-Крафтс
5. Алкилиране с алкени

Тези реакции са енергийно неблагоприятни, следователно те протичат само при нагряване или облъчване.
1. Хидрогениране.
При нагряване, при повишено налягане и в присъствието на Ni, Pt или Pd катализатор, бензолът и други арени добавят водород, за да образуват циклохексан:

2. Хлориране на бензол.
Под действието на ултравиолетовото лъчение бензенът добавя хлор. Ако колба от кварцово стъкло с разтвор на хлор в бензол бъде изложена на слънчева светлина, разтворът бързо ще се обезцвети, хлорът ще се комбинира с бензол, за да образува 1,2,3,4,5,6-хексахлорциклохексан, който е известен като хексахлоран(използван преди като инсектицид):

3. изгаряне на бензол.
За разлика от алканите, пламъкът на бензол и други ароматни въглеводороди е ярък и опушен.
Обобщаване на урока
В този урок изучавахте темата "Химически свойства на бензола". Използвайки този материал, вие успяхте да получите представа за химичните свойства на бензола, както и за тежките условия, които са необходими за реакцията на бензола с други вещества.
Библиография
1. Рудзитис Г.Е. Химия. Основи обща химия. 10 клас: учебник за образователни институции: основно ниво / G. E. Rudzitis, F.G. Фелдман. - 14-то издание. - М.: Образование, 2012.
2. Химия. 10 клас. Ниво на профил: проучвания. за общо образование институции / В.В. Еремин, Н.Е. Кузменко, В.В. Лунин и др. - М.: Дрофа, 2008. - 463 с.
3. Химия. 11 клас. Профилно ниво: учебник. за общо образование институции / В.В. Еремин, Н.Е. Кузменко, В.В. Лунин и др. - М.: Дрофа, 2010. - 462 с.
4. Хомченко Г.П., Хомченко И.Г. Сборник със задачи по химия за постъпващи в университети. - 4-то изд. - М.: РИА "Нова вълна": Издател Умеренков, 2012. - 278 с.
Домашна работа
1. No 13, 14 (стр. 62) Рудзитис Г.Е., Фелдман Ф.Г. Химия: Органична химия. 10 клас: учебник за образователни институции: основно ниво / G. E. Rudzitis, F.G. Фелдман. - 14-то издание. - М.: Образование, 2012.
2. Защо ароматните съединения се различават по химични свойства както от наситените, така и от ненаситените въглеводороди?
3. Напишете уравненията за реакциите на горене на етилбензол и ксилен.
Ароматни HC (арени)са въглеводороди, чиито молекули съдържат един или повече бензолови пръстени.
Примери за ароматни въглеводороди:

Бензолови арени (моноциклични арени)
Обща формула:C n H 2n-6 , n≥6
Най-простият представител на ароматните въглеводороди е бензолът, неговата емпирична формула е C 6 H 6 .
Електронната структура на молекулата на бензола
Общата формула на C n H 2 n -6 моноциклични арени показва, че те са ненаситени съединения.
През 1856 г. немският химик A.F. Кекуле предложи циклична формула за бензен с конюгирани връзки (редуващи се единични и двойни връзки) - циклохексатриен-1,3,5: 
Тази структура на молекулата на бензола не обяснява много от свойствата на бензола:
- за бензола са характерни реакции на заместване, а не реакции на присъединяване, характерни за ненаситени съединения. Възможни са реакции на добавяне, но те са по-трудни, отколкото за;
- бензенът не влиза в реакции, които са качествени реакции към ненаситени въглеводороди (с бромна вода и разтвор на KMnO 4).
По-късни изследвания с електронна дифракция показаха, че всички връзки между въглеродните атоми в бензоловата молекула имат еднаква дължина от 0,140 nm (средната стойност между дължината на обикновена C-C връзки 0,154 nm и C=C двойна връзка 0,134 nm). Ъгълът между връзките при всеки въглероден атом е 120°. Молекулата е правилен плосък шестоъгълник.
Съвременната теория за обяснение на структурата на C 6 H 6 молекулата използва концепцията за хибридизация на атомни орбитали.
Въглеродните атоми в бензола са в състояние на sp 2 хибридизация. Всеки "С" атом образува три σ-връзки (две с въглеродни атоми и една с водороден атом). Всички σ-връзки са в една и съща равнина:
Всеки въглероден атом има един р-електрон, който не участва в хибридизацията. Нехибридизираните p-орбитали на въглеродните атоми са в равнина, перпендикулярна на равнината на σ-връзките. Всеки p-облак се припокрива с два съседни p-облака и в резултат се образува единична конюгирана π-система (припомнете си ефекта от конюгирането на p-електроните в молекулата 1,3-бутадиен, разгледан в темата „Диен въглеводороди“):
Комбинацията от шест σ-връзки с една π-система се нарича ароматна връзка.
Нарича се пръстен от шест въглеродни атома, свързани с ароматна връзка бензолов пръстен,или бензолово ядро.
В съответствие със съвременни идеиотносно електронна структурабензен, молекулата C 6 H 6 е изобразена, както следва:

Физични свойства на бензола
Бензолът при нормални условия е безцветна течност; t o pl = 5,5 o С; t o kip. = 80 около С; има характерна миризма; не се смесва с вода, добър разтворител, силно токсичен.
Химични свойства на бензола
Ароматната връзка определя химичните свойства на бензола и други ароматни въглеводороди.
6π-електронната система е по-стабилна от конвенционалните двуелектронни π-връзки. Следователно реакциите на присъединяване са по-малко типични за ароматните въглеводороди, отколкото за ненаситените въглеводороди. Най-характерните за арените са реакциите на заместване.
аз. Реакции на заместване
1. Халогениране

2. Нитриране
Реакцията се провежда със смес от и киселини (нитрираща смес): 
3. Сулфониране

4. Алкилиране (замяна на "Н" атома с алкилова група) - Реакции на Фридел-Крафтссе образуват хомолози на бензола:

Вместо халоалкани могат да се използват алкени (в присъствието на катализатор - AlCl 3 или неорганична киселина):

II. Реакции на добавяне
1. Хидрогениране

2. Добавяне на хлор

III.Реакции на окисление
1. Изгаряне
2C 6 H 6 + 15O 2 → 12CO 2 + 6H 2 O
2. Непълно окисление (KMnO 4 или K 2 Cr 2 O 7 в кисела среда). Бензоловият пръстен е устойчив на окислители. Реакцията не настъпва.
Получаване на бензол
В индустрията:
1) преработка на нефт и въглища;
2) дехидрогениране на циклохексан:

3) дехидроциклизация (ароматизация) на хексан:

В лабораторията:
Сливане на соли на бензоената киселина с:

Изомерия и номенклатура на хомолозите на бензола
Всеки хомолог на бензол има странична верига, т.е. алкилови радикали, прикрепени към бензеновия пръстен. Първият хомолог на бензола е бензолово ядро, свързано с метилов радикал: 
Толуенът няма изомери, тъй като всички позиции в бензоловия пръстен са еквивалентни.
За последващи хомолози на бензола е възможен един вид изомерия - изомерия на страничната верига, която може да бъде от два вида:
1) изомерия на броя и структурата на заместителите;
2) изомерия на позицията на заместителите.



Физични свойства на толуена
толуен- безцветна течност с характерна миризма, неразтворима във вода, разтворима в органични разтворители. Толуенът е по-малко токсичен от бензола.
Химични свойства на толуена
аз. Реакции на заместване
1. Реакции, включващи бензоловия пръстен
Метилбензенът влиза във всички реакции на заместване, в които участва бензолът, и в същото време проявява по-висока реактивност, реакциите протичат с по-бърза скорост.
Метиловият радикал, съдържащ се в молекулата на толуена, е заместител на рода, следователно в резултат на реакции на заместване в бензеновото ядро се получават орто- и пара-производни на толуен или, с излишък от реагента, три производни от общата формула:

а) халогениране


При по-нататъшно хлориране могат да се получат дихлорометилбензен и трихлорометилбензол:

II. Реакции на добавяне
хидрогениране

III.Реакции на окисление
1. Изгаряне
C 6 H 5 CH 3 + 9O 2 → 7CO 2 + 4H 2 O
2. Непълно окисление
За разлика от бензола, неговите хомолози се окисляват от някои окислители; в този случай страничната верига претърпява окисление, в случай на толуен - метиловата група. Меките окислители като MnO 2 го окисляват до алдехидна група, по-силните окислители (KMnO 4) причиняват по-нататъшно окисление до киселина: 
Всеки хомолог на бензол с една странична верига се окислява от силен окислител като KMnO4 до бензоена киселина, т.е. има прекъсване на страничната верига с окисляване на нейната отцепена част до CO 2; например: 
В присъствието на няколко странични вериги, всяка от тях се окислява до карбоксилна група и в резултат се образуват многоосновни киселини, например:

Получаване на толуен:
В индустрията:
1) преработка на нефт и въглища;
2) дехидрогениране на метилциклохексан:

3) дехидроциклизация на хептан:
В лабораторията:
1) алкилиране на Фридел-Крафтс;
2) Реакция на Wurtz-Fittig(реакция на натрий със смес от халобензен и халоалкан).