Под вторична структура протеин означава конфигурацията на полипептидната верига, т.е. метод за сгъване, усукване (сгъване, опаковане) на полипептидна верига в спирална или някаква друга конформация. Този процес не протича на случаен принцип, а в съответствие с програма, вградена в първичната структура на протеина. Подробно са проучени две основни конфигурации на полипептидни вериги, които отговарят на структурните изисквания и експерименталните данни:
- а-спирали,
- β структури.
Най-вероятният тип структура на глобуларните протеини се счита а-спирала.Усукването на полипептидната верига става по посока на часовниковата стрелка (правилният ход на спиралата), което се дължи на L-аминокиселинния състав на естествените протеини.
движеща силапри появата на a-спирали (както и β-структури) е способността на аминокиселините да образуват водородни връзки.
В структурата на a-спирали, редица модели:
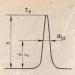
- За всеки завой (стъпка) на спиралата има 3,6 аминокиселинни остатъка.
- Стъпката на спиралата (разстоянието по оста) е 0,54 nm на завой и 0,15 nm на аминокиселинен остатък.
- Ъгълът на спиралата е 26°, след 5 завъртания на спиралата (18 аминокиселинни остатъка) структурната конфигурация на полипептидната верига се повтаря. Това означава, че периодът на повторение (или идентичността) на a-спиралната структура е 2,7 nm.
Друг тип конфигурация на полипептидна верига, открита в косата, коприната, мускулите и други фибриларни протеини, се нарича β структури.В този случай две или повече линейни полипептидни вериги, подредени успоредно или по-често антипаралелно, са тясно свързани чрез междуверижни водородни връзки между -NH- и -CO групите на съседни вериги, образувайки структура от типа на сгънат слой.

Схематично представяне на β-структурата на полипептидните вериги.
В природата съществуват протеини, чиято структура обаче не съответства нито на β-, нито на a-структура. Типичен пример за такива протеини е колаген- фибриларен протеин, който съставлява основната част от съединителната тъкан при хора и животни.
Методите за рентгенов дифракционен анализ вече доказаха съществуването на още две нива на структурна организация на протеиновата молекула, които се оказаха междинни между вторични и третични структури. Това са т.нар надвторични структури и структурни домейни.
над-вторични структуриса агрегати от полипептидни вериги, които имат собствена вторична структура и се образуват в някои протеини в резултат на тяхната термодинамична или кинетична стабилност. И така, в глобуларните протеини, (βхβ)-елементи (представени от две успоредни β-вериги, свързани с x сегмента), βaβaβ-елементи (представени от два сегмента на α-спирала, вмъкнати между три успоредни β-вериги) и т.н.

Доменна структура на глобуларен протеин (флаводоксин) (според A. A. Boldyrev)
домейне компактна глобуларна структурна единица в полипептидната верига. Домените могат да изпълняват различни функции и да се подлагат на сгъване (сгъване) в независими компактни глобуларни структурни единици, свързани помежду си чрез гъвкави региони в рамките на протеиновата молекула.
водородни връзки
Разграничаване a-спирала, b-структура (чип).
структура α-спирали беше предложено Полинги Кори

колаген
b-структура
Ориз. 2.3. b-структура
Структурата има плоска форма паралелна b-структура; ако в обратното антипаралелна b-структура
супернамотка. протофибрили микрофибрили 10 nm в диаметър.
bombyx mori фиброин
нарушена конформация.
Свръхвторична структура.
ВИЖ ПОВЕЧЕ:
СТРУКТУРНА ОРГАНИЗАЦИЯ НА БЕЛТЪЦИ
Доказано е съществуването на 4 нива на структурна организация на протеиновата молекула.
Първична структура на протеин- последователността на аминокиселинните остатъци в полипептидната верига. В протеините отделните аминокиселини са свързани една с друга. пептидни връзкипроизтичащи от взаимодействието на а-карбоксилни и а-амино групи на аминокиселини.

Към днешна дата е дешифрирана първичната структура на десетки хиляди различни протеини. За да се определи първичната структура на протеин, методите на хидролиза определят аминокиселинния състав. След това определете химическа природатерминални аминокиселини. Следващата стъпка е да се определи последователността на аминокиселините в полипептидната верига. За това се използва селективна частична (химична и ензимна) хидролиза. Възможно е да се използва рентгенов дифракционен анализ, както и данни за комплементарни нуклеотидна последователностДНК.
Вторична структура на протеин– конфигурация на полипептидната верига, т.е. метод за пакетиране на полипептидна верига в специфична конформация. Този процес не протича хаотично, а в съответствие с програмата, заложена в първичната структура.
стабилност вторична структураОсигурява се главно от водородни връзки, но известен принос имат ковалентните връзки, пептидните и дисулфидните връзки.
Разглежда се най-вероятният тип структура на глобуларните протеини а-спирала. Усукването на полипептидната верига става по посока на часовниковата стрелка. Всеки протеин се характеризира с определена степен на спирализация. Ако хемоглобиновите вериги са 75% спираловидни, тогава пепсинът е само 30%.
Типът конфигурация на полипептидните вериги, намиращи се в протеините на косата, коприната и мускулите, се нарича b-структури.
Сегментите на пептидната верига са подредени в един слой, образувайки фигура, подобна на лист, сгънат в акордеон. Слоят може да бъде образуван от две или повече пептидни вериги.
В природата има протеини, чиято структура не съответства нито на β-, нито на а-структура, например, колагенът е фибриларен протеин, който съставлява по-голямата част от съединителната тъкан при хора и животни.
Третична структура на протеина- пространствена ориентация на полипептидната спирала или метода за полагане на полипептидната верига в определен обем. Първият протеин, чиято третична структура беше изяснена чрез рентгенов дифракционен анализ, беше миоглобинът на кашалота (фиг. 2).
При стабилизирането на пространствената структура на протеините, освен ковалентните връзки, основна роля играят нековалентните връзки (водород, електростатични взаимодействия на заредени групи, междумолекулни сили на Ван дер Ваалс, хидрофобни взаимодействия и др.).
от съвременни идеи, третичната структура на протеина след завършване на неговия синтез се формира спонтанно. Основен движеща силае взаимодействието на аминокиселинните радикали с водните молекули. В този случай неполярните хидрофобни радикали на аминокиселините са потопени вътре в протеиновата молекула, а полярните радикали са ориентирани към водата. Процесът на образуване на нативната пространствена структура на полипептидната верига се нарича сгъване. Клетките имат изолирани протеини, наречени придружители.Те участват в сгъването. Описани са редица човешки наследствени заболявания, чието развитие е свързано с нарушение поради мутации в процеса на сгъване (пигментоза, фиброза и др.).
Наличието на нива на структурна организация на белтъчната молекула, междинни между вторични и третични структури, е доказано с методите на рентгеновия дифракционен анализ. домейне компактна глобуларна структурна единица в полипептидната верига (фиг. 3). Открити са много протеини (например имуноглобулини), които се състоят от домейни, които са различни по структура и функция и са кодирани от различни гени.
Всички биологични свойства на протеините са свързани със запазването на тяхната третична структура, която се нарича местен. Белтъчната глобула не е абсолютно твърда структура: възможни са обратими движения на части от пептидната верига. Тези промени не нарушават цялостната конформация на молекулата. Конформацията на протеиновата молекула се влияе от рН на средата, йонната сила на разтвора и взаимодействието с други вещества. Всяко въздействие, което води до нарушаване на естествената конформация на молекулата, е придружено от частична или пълна загуба на протеина на неговите биологични свойства.
Кватернерна протеинова структура- начин за полагане в пространството на отделни полипептидни вериги с еднаква или различна първична, вторична или третична структура и образуване на единна макромолекулна формация в структурно и функционално отношение.
Нарича се протеинова молекула, състояща се от няколко полипептидни вериги олигомер, и всяка верига, включена в него - протомер. Олигомерните протеини по-често се изграждат от четен брой протомери, например молекула на хемоглобина се състои от две a- и две b-полипептидни вериги (фиг. 4).
Кватернерната структура има около 5% протеини, включително хемоглобин, имуноглобулини. Структурата на субединицата е характерна за много ензими.
Протеиновите молекули, които изграждат протеин с кватернерна структура, се образуват отделно върху рибозомите и едва след края на синтеза образуват обща супрамолекулна структура. Протеинът придобива биологична активност само когато съставните му протомери се комбинират. В стабилизирането на кватернерната структура участват същите видове взаимодействия, както и при стабилизирането на третичната.
Някои изследователи признават съществуването на пето ниво на структурна организация на протеините. то метаболони -полифункционални макромолекулни комплекси от различни ензими, които катализират целия път на трансформации на субстрата (синтетази на висши мастни киселини, пируватдехидрогеназен комплекс, дихателна верига).
Вторична структура на протеин
Вторична структура - начин за полагане на полипептидна верига в подредена структура. Вторичната структура се определя от първичната структура. Тъй като първичната структура е генетично детерминирана, образуването на вторична структура може да се случи, когато полипептидната верига напусне рибозомата. Вторичната структура се стабилизира водородни връзки, които се образуват между NH- и CO-групите на пептидната връзка.
Разграничаване a-спирала, b-структураи нарушена конформация (чип).
структура α-спирали беше предложено Полинги Кори(1951). Това е вид протеинова вторична структура, която изглежда като правилна спирала (фиг. 2.2). α-спирала е пръчковидна структура, в която пептидните връзки са разположени вътре в спиралата, а страничните вериги на аминокиселини са отвън. А-спирала се стабилизира от водородни връзки, които са успоредни на оста на спиралата и се появяват между първия и петия аминокиселинни остатъци. По този начин, в разширени спирални области, всеки аминокиселинен остатък участва в образуването на две водородни връзки.

Ориз. 2.2. Структурата на α-спирала.
Има 3,6 аминокиселинни остатъка на завъртане на спиралата, стъпката на спиралата е 0,54 nm и 0,15 nm на аминокиселинен остатък. Ъгъл на спиралата 26°. Периодът на редовност на a-спирала е 5 завъртания или 18 аминокиселинни остатъка. Най-често срещаните са десните a-спирали, т.е. усукването на спиралата върви по посока на часовниковата стрелка. Образуването на а-спирала се предотвратява от пролин, аминокиселини със заредени и обемисти радикали (електростатични и механични препятствия).
Друга форма на спирала присъства в колаген . При бозайниците колагенът е преобладаващият протеин в количествено отношение: съставлява 25% общ протеин. Колагенът присъства в различни форми, главно в съединителната тъкан. Това е лява спирала със стъпка от 0,96 nm и 3,3 остатъка във всеки завой, по-нежна от α-спирала. За разлика от α-спирала, образуването на водородни мостове тук е невъзможно. Колагенът има необичаен аминокиселинен състав: 1/3 е глицин, приблизително 10% пролин, както и хидроксипролин и хидроксилизин. Последните две аминокиселини се образуват след биосинтеза на колаген чрез пост-транслационна модификация. В структурата на колагена триплетът gly-X-Y непрекъснато се повтаря и X позицията често се заема от пролин, а Y от хидроксилизин. Има убедителни доказателства, че колагенът е повсеместен под формата на дясна тройна спирала, усукана от три основни лява спирала. В тройната спирала всеки трети остатък се озовава в центъра, където по стерични причини е поставен само глицин. Цялата колагенова молекула е дълга около 300 nm.
b-структура(b-сгънат слой). Среща се в глобуларни протеини, както и в някои фибриларни протеини, например копринен фиброин (фиг. 2.3).
Ориз. 2.3. b-структура
Структурата има плоска форма. Полипептидните вериги са почти напълно удължени, а не плътно усукани, както в a-спирала. Равнините на пептидните връзки са разположени в пространството като еднородни гънки на лист хартия.
Вторична структура на полипептиди и протеини
Стабилизира се чрез водородни връзки между CO и NH групи на пептидни връзки на съседни полипептидни вериги. Ако полипептидните вериги, които образуват b-структурата, вървят в една и съща посока (т.е. C- и N-терминалите съвпадат) - паралелна b-структура; ако в обратното антипаралелна b-структура. Страничните радикали на един слой се поставят между страничните радикали на друг слой. Ако една полипептидна верига се огъва и върви успоредно на себе си, тогава това антипаралелна b-кръстосана структура. Водородните връзки в b-кръстосаната структура се образуват между пептидните групи на бримките на полипептидната верига.
Съдържанието на a-спирали в протеините, изследвани до момента, е силно променливо. В някои протеини, например миоглобин и хемоглобин, а-спирала е в основата на структурата и съставлява 75%, в лизозима - 42%, в пепсина само 30%. Други протеини, като храносмилателния ензим химотрипсин, са практически лишени от а-спирална структура и значителна част от полипептидната верига се вписва в слоести b-структури. Поддържащи тъканни протеини колаген (протеин на сухожилията, кожа), фиброин (естествен копринен протеин) имат b-конфигурация на полипептидни вериги.
Доказано е, че образуването на α-спирала се насърчава от glu, ala, leu и β-структури от met, val, ile; в местата на огъване на полипептидната верига - gly, pro, asn. Смята се, че шест групирани остатъка, четири от които допринасят за образуването на спирала, могат да се разглеждат като център на спирала. От този център спиралите растат в двете посоки към място - тетрапептид, състоящ се от остатъци, които предотвратяват образуването на тези спирали. При образуването на β-структурата ролята на семената играят три аминокиселинни остатъка от пет, които допринасят за образуването на β-структурата.
Повечето структурни протеинипреобладава една от вторичните структури, което е предопределено от аминокиселинния им състав. Структурният протеин, изграден главно под формата на α-спирала, е α-кератин. Косата (вълна), перата, иглите, ноктите и копита на животните са съставени главно от кератин. Като компонент на междинните филаменти, кератинът (цитокератин) е най-важният интегрална частцитоскелет. При кератините по-голямата част от пептидната верига е нагъната в дясна α-спирала. Две пептидни вериги образуват една лява супернамотка.Свръхнавитите кератинови димери се комбинират, за да образуват тетрамери, които се агрегират, за да се образуват протофибрили 3 nm в диаметър. Накрая се образуват осем протофибрила микрофибрили 10 nm в диаметър.
Косата е изградена от същите фибрили. И така, в едно вълнено влакно с диаметър 20 микрона, милиони фибрили са преплетени. Отделните кератинови вериги са омрежени чрез множество дисулфидни връзки, което им придава допълнителна здравина. По време на къдрене се случват следните процеси: първо, дисулфидните мостове се разрушават чрез редукция с тиоли, а след това, за да се даде на косата желаната форма, те се изсушават чрез нагряване. В същото време поради окисляване с атмосферен кислород се образуват нови дисулфидни мостове, които запазват формата на прическата.
Коприната се получава от пашкулите на гъсениците на копринените буби ( bombyx mori) и сродни видове. Основен копринен протеин фиброин, има структурата на антипаралелен нагънат слой, а самите слоеве са успоредни един на друг, образувайки множество слоеве. Тъй като в сгънатите структури страничните вериги от аминокиселинни остатъци са ориентирани вертикално нагоре и надолу, само компактни групи могат да се поберат в пространствата между отделните слоеве. Всъщност фиброинът се състои от 80% глицин, аланин и серин, т.е. три характеризирани аминокиселини минимални размеристранични вериги. Молекулата на фиброина съдържа типичен повтарящ се фрагмент (gli-ala-gli-ala-gli-ser)n.
нарушена конформация.Секции от протеинова молекула, които не принадлежат към спираловидни или нагънати структури, се наричат неуредени.
Свръхвторична структура.Алфа-спиралните и бета структурните области в протеините могат да взаимодействат помежду си и помежду си, образувайки ансамбли. Супрасекондарните структури, открити в естествените протеини, са енергийно най-предпочитани. Те включват супернавита α-спирала, в която две α-спирали са усукани една спрямо друга, образувайки лява супернамотка (бактериородопсин, хемеритрин); редуващи се α-спирални и β-структурни фрагменти на полипептидната верига (например, βαβαβ-връзка според Rossman, открита в NAD+-свързващия регион на ензимните молекули на дехидрогеназа); антипаралелната триверижна β-структура (βββ) се нарича β-зигзаг и се намира в редица микробни, протозойни и гръбначни ензими.
Предишна234567891011121314151617Следваща
ВИЖ ПОВЕЧЕ:
Вторична структура на протеините
Пептидните вериги на протеините са организирани във вторична структура, стабилизирана от водородни връзки. Кислородният атом на всяка пептидна група образува водородна връзка с NH групата, съответстваща на пептидната връзка. В този случай се образуват следните структури: a-спирала, b-структура и b-извиване. а-спирала.Една от най-термодинамично благоприятните структури е дясната a-спирала. a-спирала, представляваща стабилна структура, в която всяка карбонилна група образува водородна връзка с четвъртата NH група по веригата.
Протеини: Вторичната структура на протеините
В a-спирала има 3,6 аминокиселинни остатъка на един завой, стъпката на спиралата е приблизително 0,54 nm, а разстоянието между остатъците е 0,15 nm. L-аминокиселините могат да образуват само десни a-спирали, със странични радикали, разположени от двете страни на оста и обърнати навън. В a-спирала възможността за образуване на водородни връзки се използва напълно, следователно, за разлика от b-структурата, тя не е в състояние да образува водородни връзки с други елементи от вторичната структура. По време на образуването на α-спирала, страничните вериги на аминокиселините могат да се доближат една до друга, образувайки хидрофобни или хидрофилни компактни места. Тези сайтове играят съществена роляпри образуването на триизмерна конформация на протеиновата макромолекула, тъй като те се използват за опаковане на a-спирали в пространствената структура на протеина. Спирална топка.Съдържанието на a-спирали в протеините варира и е индивидуална особеност на всяка белтъчна макромолекула. За някои протеини, като миоглобин, а-спирала е в основата на структурата, други, като химотрипсин, нямат области на а-спирала. Средно глобуларните протеини имат степен на спиралност от порядъка на 60-70%. Спирализираните участъци се редуват с хаотични намотки и в резултат на денатурацията преходите спирала-намотка се увеличават. Спирализацията на полипептидната верига зависи от аминокиселинните остатъци, които я образуват. Така отрицателно заредените групи глутаминова киселина, разположени в непосредствена близост една до друга, изпитват силно взаимно отблъскване, което предотвратява образуването на съответните водородни връзки в a-спирала. По същата причина навиването на веригата е трудно в резултат на отблъскването на близко разположени положително заредени химически групи от лизин или аргинин. Големият размер на аминокиселинните радикали също е причината спирализацията на полипептидната верига да е трудна (серин, треонин, левцин). Най-често срещаният интерфериращ фактор при образуването на а-спирала е аминокиселината пролин. В допълнение, пролинът не образува вътреверижна водородна връзка поради отсъствието на водороден атом при азотния атом. По този начин, във всички случаи, когато пролинът се среща в полипептидната верига, а-спиралната структура се разрушава и се образува намотка или (b-bend). b-структура.За разлика от a-спирала, b-структурата се формира от взаимна веригаводородни връзки между съседни участъци от полипептидната верига, тъй като няма вътрешноверижни контакти. Ако тези секции са насочени в една посока, тогава такава структура се нарича паралелна, ако в обратна посока, тогава антипаралелна. Полипептидната верига в b-структурата е силно удължена и няма спираловидна, а по-скоро зигзагообразна форма. Разстоянието между съседни аминокиселинни остатъци по оста е 0,35 nm, т.е. три пъти по-голямо, отколкото в a-спирала, броят на остатъците на завой е 2. В случай на паралелно подреждане на b-структурата, водородните връзки са по-малко силни в сравнение с тези в антипаралелното подреждане на аминокиселинните остатъци. За разлика от а-спирала, която е наситена с водородни връзки, всеки участък от полипептидната верига в b-структурата е отворен за образуването на допълнителни водородни връзки. Горното се отнася както за успоредните, така и за антипаралелните b-структури, но в антипаралелната структура връзките са по-стабилни. В сегмента на полипептидната верига, който образува b-структурата, има от три до седем аминокиселинни остатъка, а самата b-структура се състои от 2-6 вериги, въпреки че броят им може да е по-голям. b-структурата има сгъната форма, в зависимост от съответните a-въглеродни атоми. Повърхността му може да бъде плоска и лява, така че ъгълът между отделните сегменти на веригата да е 20-25°. b-огъване.Глобуларните протеини имат сферична форма до голяма степен поради факта, че полипептидната верига се характеризира с наличието на бримки, зигзаги, фиби и посоката на веригата може да се промени дори със 180 °. В последния случай има b-завой. Този завой е оформен като фиби и е стабилизиран от единична водородна връзка. Големите странични радикали могат да бъдат фактор, възпрепятстващ образуването му и затова доста често в него се наблюдава включването на най-малкия аминокиселинен остатък, глицин. Тази конфигурация винаги е на повърхността на протеиновата глобула и следователно B-сгъвката участва във взаимодействието с други полипептидни вериги. супервторични структури.За първи път бяха постулирани и след това открити супервторични структури на протеини от Л. Полинг и Р. Кори. Пример е супернавита а-спирала, при която две a-спирали са усукани в лява суперспирала. По-често обаче свръхнавитите структури включват както a-спирали, така и b-листове. Техният състав може да бъде представен по следния начин: (aa), (ab), (ba) и (bXb). Последният вариант е два успоредно сгънати листа, между които има статистическа намотка (bСb).Съотношението между вторичните и супервторичните структури има висока степен на променливост и зависи от индивидуални характеристикиедна или друга белтъчна макромолекула. Домейните са по-сложни нива на организация на вторичната структура. Те са изолирани глобуларни области, свързани помежду си чрез къси, така наречени шарнирни области на полипептидната верига. D. Birktoft е един от първите, които описват доменната организация на химотрипсина, отбелязвайки наличието на два домена в този протеин.
Вторична структура на протеин
Вторична структура - начин за полагане на полипептидна верига в подредена структура. Вторичната структура се определя от първичната структура. Тъй като първичната структура е генетично детерминирана, образуването на вторична структура може да се случи, когато полипептидната верига напусне рибозомата. Вторичната структура се стабилизира водородни връзки, които се образуват между NH- и CO-групите на пептидната връзка.
Разграничаване a-спирала, b-структураи нарушена конформация (чип).
структура α-спирали беше предложено Полинги Кори(1951). Това е вид протеинова вторична структура, която изглежда като правилна спирала (фиг.
Конформацията на полипептидната верига. Вторична структура на полипептидната верига
2.2). α-спирала е пръчковидна структура, в която пептидните връзки са разположени вътре в спиралата, а страничните вериги на аминокиселини са отвън. А-спирала се стабилизира от водородни връзки, които са успоредни на оста на спиралата и се появяват между първия и петия аминокиселинни остатъци. По този начин, в разширени спирални области, всеки аминокиселинен остатък участва в образуването на две водородни връзки.

Ориз. 2.2. Структурата на α-спирала.
Има 3,6 аминокиселинни остатъка на завъртане на спиралата, стъпката на спиралата е 0,54 nm и 0,15 nm на аминокиселинен остатък. Ъгъл на спиралата 26°. Периодът на редовност на a-спирала е 5 завъртания или 18 аминокиселинни остатъка. Най-често срещаните са десните a-спирали, т.е. усукването на спиралата върви по посока на часовниковата стрелка. Образуването на а-спирала се предотвратява от пролин, аминокиселини със заредени и обемисти радикали (електростатични и механични препятствия).
Друга форма на спирала присъства в колаген . В тялото на бозайниците колагенът е преобладаващият протеин в количествено отношение: той съставлява 25% от общия протеин. Колагенът присъства в различни форми, главно в съединителната тъкан. Това е лява спирала със стъпка от 0,96 nm и 3,3 остатъка във всеки завой, по-нежна от α-спирала. За разлика от α-спирала, образуването на водородни мостове тук е невъзможно. Колагенът има необичаен аминокиселинен състав: 1/3 е глицин, приблизително 10% пролин, както и хидроксипролин и хидроксилизин. Последните две аминокиселини се образуват след биосинтеза на колаген чрез пост-транслационна модификация. В структурата на колагена триплетът gly-X-Y непрекъснато се повтаря и X позицията често се заема от пролин, а Y от хидроксилизин. Има убедителни доказателства, че колагенът е повсеместен под формата на дясна тройна спирала, усукана от три основни лява спирала. В тройната спирала всеки трети остатък се озовава в центъра, където по стерични причини е поставен само глицин. Цялата колагенова молекула е дълга около 300 nm.
b-структура(b-сгънат слой). Среща се в глобуларни протеини, както и в някои фибриларни протеини, например копринен фиброин (фиг. 2.3).
Ориз. 2.3. b-структура
Структурата има плоска форма. Полипептидните вериги са почти напълно удължени, а не плътно усукани, както в a-спирала. Равнините на пептидните връзки са разположени в пространството като еднородни гънки на лист хартия. Стабилизира се чрез водородни връзки между CO и NH групи на пептидни връзки на съседни полипептидни вериги. Ако полипептидните вериги, които образуват b-структурата, вървят в една и съща посока (т.е. C- и N-терминалите съвпадат) - паралелна b-структура; ако в обратното антипаралелна b-структура. Страничните радикали на един слой се поставят между страничните радикали на друг слой. Ако една полипептидна верига се огъва и върви успоредно на себе си, тогава това антипаралелна b-кръстосана структура. Водородните връзки в b-кръстосаната структура се образуват между пептидните групи на бримките на полипептидната верига.
Съдържанието на a-спирали в протеините, изследвани до момента, е силно променливо. В някои протеини, например миоглобин и хемоглобин, а-спирала е в основата на структурата и съставлява 75%, в лизозима - 42%, в пепсина само 30%. Други протеини, като храносмилателния ензим химотрипсин, са практически лишени от а-спирална структура и значителна част от полипептидната верига се вписва в слоести b-структури. Поддържащи тъканни протеини колаген (протеин на сухожилията, кожа), фиброин (естествен копринен протеин) имат b-конфигурация на полипептидни вериги.
Доказано е, че образуването на α-спирала се насърчава от glu, ala, leu и β-структури от met, val, ile; в местата на огъване на полипептидната верига - gly, pro, asn. Смята се, че шест групирани остатъка, четири от които допринасят за образуването на спирала, могат да се разглеждат като център на спирала. От този център спиралите растат в двете посоки към място - тетрапептид, състоящ се от остатъци, които предотвратяват образуването на тези спирали. При образуването на β-структурата ролята на семената играят три аминокиселинни остатъка от пет, които допринасят за образуването на β-структурата.
В повечето структурни протеини преобладава една от вторичните структури, което се предопределя от техния аминокиселинен състав. Структурният протеин, изграден главно под формата на α-спирала, е α-кератин. Косата (вълна), перата, иглите, ноктите и копита на животните са съставени главно от кератин. Като компонент на междинните филаменти, кератинът (цитокератин) е основен компонент на цитоскелета. При кератините по-голямата част от пептидната верига е нагъната в дясна α-спирала. Две пептидни вериги образуват една лява супернамотка.Свръхнавитите кератинови димери се комбинират, за да образуват тетрамери, които се агрегират, за да се образуват протофибрили 3 nm в диаметър. Накрая се образуват осем протофибрила микрофибрили 10 nm в диаметър.
Косата е изградена от същите фибрили. И така, в едно вълнено влакно с диаметър 20 микрона, милиони фибрили са преплетени. Отделните кератинови вериги са омрежени чрез множество дисулфидни връзки, което им придава допълнителна здравина. По време на къдрене се случват следните процеси: първо, дисулфидните мостове се разрушават чрез редукция с тиоли, а след това, за да се даде на косата желаната форма, те се изсушават чрез нагряване. В същото време поради окисляване с атмосферен кислород се образуват нови дисулфидни мостове, които запазват формата на прическата.
Коприната се получава от пашкулите на гъсениците на копринените буби ( bombyx mori) и сродни видове. Основен копринен протеин фиброин, има структурата на антипаралелен нагънат слой, а самите слоеве са успоредни един на друг, образувайки множество слоеве. Тъй като в сгънатите структури страничните вериги от аминокиселинни остатъци са ориентирани вертикално нагоре и надолу, само компактни групи могат да се поберат в пространствата между отделните слоеве. Всъщност фиброинът се състои от 80% глицин, аланин и серин, т.е. три аминокиселини с най-малки странични вериги. Молекулата на фиброина съдържа типичен повтарящ се фрагмент (gli-ala-gli-ala-gli-ser)n.
нарушена конформация.Секции от протеинова молекула, които не принадлежат към спираловидни или нагънати структури, се наричат неуредени.
Свръхвторична структура.Алфа-спиралните и бета структурните области в протеините могат да взаимодействат помежду си и помежду си, образувайки ансамбли. Супрасекондарните структури, открити в естествените протеини, са енергийно най-предпочитани. Те включват супернавита α-спирала, в която две α-спирали са усукани една спрямо друга, образувайки лява супернамотка (бактериородопсин, хемеритрин); редуващи се α-спирални и β-структурни фрагменти на полипептидната верига (например, βαβαβ-връзка според Rossman, открита в NAD+-свързващия регион на ензимните молекули на дехидрогеназа); антипаралелната триверижна β-структура (βββ) се нарича β-зигзаг и се намира в редица микробни, протозойни и гръбначни ензими.
Предишна234567891011121314151617Следваща
ВИЖ ПОВЕЧЕ:
ПРОТЕИНИ Вариант 1 A1. Структурната връзка на протеините са: ...
5 - 9 клас
ПРОТЕИНИ
Опция 1
A1. Структурната връзка на протеините са:
НО)
амини
AT)
Аминокиселини
Б)
глюкоза
ж)
Нуклеотиди
A2. Образуването на спирала характеризира:
НО)
Първичната структура на протеина
AT)
Третична структура на протеина
Б)
Вторична структура на протеин
ж)
Кватернерна протеинова структура
A3. Какви фактори причиняват необратима денатурация на протеина?
НО)
Взаимодействие с разтвори на соли на олово, желязо, живак
Б)
Въздействие върху протеина с концентриран разтвор азотна киселина
AT)
Силно нагряване
ж)
Всички горепосочени фактори са правилни.
A4. Посочете какво се наблюдава, когато концентрирана азотна киселина действа върху протеинови разтвори:
НО)
Утаяване на бяла утайка
AT)
Червено-виолетово оцветяване
Б)
черна утайка
ж)
Жълто оцветяване
A5. Протеините, които изпълняват каталитична функция, се наричат:
НО)
Хормони
AT)
Ензими
Б)
витамини
ж)
протеини
A6. Протеинът хемоглобин изпълнява следната функция:
НО)
каталитичен
AT)
Строителство
Б)
Защитен
ж)
транспорт
част Б
B1. корелира:
Тип протеинова молекула
Имот
1)
Глобуларни протеини
НО)
Молекула се навива
2)
фибриларни протеини
Б)
Не е разтворим във вода
AT)
разтварят се във вода или образуват колоидни разтвори
ж)
нишковидна структура
вторична структура
протеини:
НО)
Изграден от аминокиселинни остатъци
Б)
Съдържа само въглерод, водород и кислород
AT)
Хидролизиран в киселина и алкална среда
ж)
способни на денатурация
Д)
Полизахариди са
д)
Те са естествени полимери
Част В
C1. Напишете реакционните уравнения, по които от етанол и неорганични веществаможете да получите глицин.
Протеините са един от важните органични елементи на всяка жива клетка на тялото. Те изпълняват много функции: поддържащи, сигнални, ензимни, транспортни, структурни, рецепторни и т.н. Първичните, вторични, третични и четвъртични структури на протеините са се превърнали във важни еволюционни адаптации. От какво са направени тези молекули? Защо правилната конформация на протеините в клетките на тялото е толкова важна?
Структурни компоненти на протеините
Мономерите на всяка полипептидна верига са аминокиселини (AA). Тези с ниско молекулно тегло органични съединенияса доста често срещани в природата и могат да съществуват като независими молекули, които изпълняват свои собствени функции. Сред тях са транспортиране на вещества, приемане, инхибиране или активиране на ензими.
Общо биогенните аминокиселини са около 200, но могат да бъдат само 20. Те са лесно разтворими във вода, имат кристална структура и много от тях са сладки на вкус.
От химическа гледна точка, AA са молекули, които задължително съдържат две функционални групи: -COOH и -NH2. С помощта на тези групи аминокиселините образуват вериги, свързващи се помежду си чрез пептидна връзка.
Всяка от 20-те протеиногенни аминокиселини има свой собствен радикал, в зависимост от това кой Химични свойства. Според състава на такива радикали всички АА се класифицират в няколко групи.
- Неполярни: изолевцин, глицин, левцин, валин, пролин, аланин.
- Полярни и незаредени: треонин, метионин, цистеин, серин, глутамин, аспарагин.
- Ароматни: тирозин, фенилаланин, триптофан.
- Полярен и отрицателно зареден: глутамат, аспартат.
- Полярен и положително зареден: аргинин, хистидин, лизин.
Всяко ниво на организация на протеиновата структура (първична, вторична, третична, кватернерна) се основава на полипептидна верига, състояща се от АА. Единствената разлика е как се формира тази последователност в пространството и с помощта на какви химични връзки се поддържа такава конформация.

Първична структура на протеин
Всеки протеин се образува върху рибозоми - немембранни клетъчни органели, които участват в синтеза на полипептидната верига. Тук аминокиселините са свързани помежду си с помощта на силен пептидна връзка, образувайки първичната структура. Такава първична структура на протеина обаче е изключително различна от кватернерната, така че е необходимо по-нататъшно узряване на молекулата.
Протеини като еластин, хистони, глутатион, вече с толкова проста структура, са в състояние да изпълняват функциите си в тялото. За по-голямата част от протеините следващата стъпка е образуването на по-сложна вторична конформация.

Вторична структура на протеин
Образуването на пептидни връзки е първата стъпка в узряването на повечето протеини. За да изпълняват функциите си, тяхната локална конформация трябва да претърпи някои промени. Това се постига с помощта на водородни връзки – крехки, но в същото време многобройни връзки между основните и киселинните центрове на аминокиселинните молекули.
Така се формира вторичната структура на протеина, която се различава от кватернерната по простота на конфигурация и локална конформация. Последното означава, че не цялата верига е подложена на трансформация. Водородните връзки могат да се образуват на няколко места на различни разстояния една от друга, като формата им също зависи от вида на аминокиселините и начина на сглобяване.
Лизозимът и пепсинът са представители на протеини, които имат вторична структура. Пепсинът участва в процесите на храносмилане, а лизозимът изпълнява защитна функцияв тялото, унищожавайки клетъчните стени на бактериите.

Характеристики на вторичната структура
Локалните конформации на пептидната верига могат да се различават една от друга. Вече са проучени няколко десетки, като три от тях са най-често срещаните. Сред тях са алфа спирала, бета слоеве и бета завой.
- Алфа спиралата е една от най-често срещаните вторични структурни конформации на повечето протеини. Това е рамка от твърд прът с ход от 0,54 nm. Аминокиселинните радикали са насочени навън.
Най-често срещаните са десните спирали, а понякога могат да се намерят и ляво-ръкообразни. Оформящата функция се изпълнява от водородни връзки, които стабилизират къдриците. Веригата, която образува алфа спиралата, съдържа много малко пролин и полярно заредени аминокиселини.
- Бета завъртането е изолирано в отделна конформация, въпреки че това може да се нарече част от бета листа. Изводът е огъването на пептидната верига, която се поддържа от водородни връзки. Обикновено самото място на завоя се състои от 4-5 аминокиселини, сред които е задължително наличието на пролин. Този AK е единственият, който има твърд и къс скелет, който ви позволява да оформите самия завой.
- Бета слоят е верига от аминокиселини, която образува няколко гънки и ги стабилизира с водородни връзки. Тази форма е много подобна на лист хартия, сгънат в акордеон. Най-често агресивните протеини имат тази форма, но има много изключения.
Има паралелни и антипаралелни бета слоеве. В първия случай C- и N- краищата в завоите и в краищата на веригата съвпадат, но във втория случай не.
Третична структура
По-нататъшното опаковане на протеина води до образуването на третична структура. Тази конформация се стабилизира с помощта на водородни, дисулфидни, хидрофобни и йонни връзки. Големият им брой позволява вторичната структура да бъде усукана в по-сложна форма и стабилизирана.
Те са разделени от глобуларни и глобуларни пептиди.Молекулата на глобуларните пептиди е сферична структура. Примери: албумин, глобулин, хистони в третична структура.
Образуват се силни нишки, чиято дължина надвишава ширината им. Такива протеини най-често изпълняват структурни и оформящи функции. Примери са фиброин, кератин, колаген, еластин.

Структурата на протеините в кватернерната структура на молекулата
Ако няколко глобули се обединят в един комплекс, се образува така наречената кватернерна структура. Тази конформация не е характерна за всички пептиди и се образува, когато е необходимо да се изпълняват важни и специфични функции.
Всяка глобула в състава е отделен домен или протомер. Взети заедно, молекулите се наричат олигомер.
Обикновено такъв протеин има няколко стабилни конформации, които постоянно се заменят взаимно, или в зависимост от въздействието на някои външни фактори, или когато е необходимо да се изпълняват различни функции.
Важна разлика между третичната и кватернерната структура на протеина са междумолекулните връзки, които са отговорни за свързването на няколко глобули. В центъра на цялата молекула често има метален йон, който пряко влияе върху образуването на междумолекулни връзки.
Допълнителни протеинови структури
Не винаги веригата от аминокиселини е достатъчна, за да изпълнява функциите на протеин. В повечето случаи към такива молекули са прикрепени други вещества от органична и неорганична природа. Тъй като тази характеристика е характерна за по-голямата част от ензимите, съставът на сложните протеини обикновено се разделя на три части:
- Апоензимът е протеинова част от молекула, която е аминокиселинна последователност.
- Коензимът не е протеин, а органична част. Може да включва различни видовелипиди, въглехидрати или дори нуклеинова киселина. Това включва представители на биологично активни съединения, сред които има витамини.
- Кофактор - неорганична част, представена в по-голямата част от случаите от метални йони.
Структурата на протеините в кватернерната структура на една молекула изисква участието на няколко молекули с различен произход, така че много ензими имат три компонента наведнъж. Пример е фосфокиназа, ензим, който осигурява прехвърлянето на фосфатна група от молекула на АТФ.
Къде се образува четвъртичната структура на протеинова молекула?
Полипептидната верига започва да се синтезира върху рибозомите на клетката, но по-нататъшното съзряване на протеина настъпва в други органели. Новообразуваната молекула трябва да влезе в транспортната система, която се състои от ядрената мембрана, ER, апарата на Голджи и лизозомите.
Усложнението на пространствената структура на протеина възниква в ендоплазмения ретикулум, където се образуват не само различни видове връзки (водородни, дисулфидни, хидрофобни, междумолекулни, йонни), но се добавят и коензим и кофактор. Така се образува кватернерната структура на протеина.
Когато молекулата е напълно готова за работа, тя влиза или в цитоплазмата на клетката, или в апарата на Голджи. В последния случай тези пептиди се пакетират в лизозоми и се транспортират до други отделения на клетката.
Примери за олигомерни протеини
Четвъртичната структура е структурата на протеините, която е предназначена да допринесе за изпълнението на жизнените функции в живия организъм. Сложната конформация на органичните молекули дава възможност преди всичко да се повлияе върху работата на много метаболитни процеси (ензими).
Биологично важни протеини са хемоглобин, хлорофил и хемоцианин. В основата на тези молекули е порфириновият пръстен, в центъра на който е метален йон.
хемоглобин
Четвъртичната структура на протеиновата молекула на хемоглобина се състои от 4 глобули, свързани с междумолекулни връзки. В центъра е порфин с железен йон. Протеинът се транспортира в цитоплазмата на еритроцитите, където те заемат около 80% от общия обем на цитоплазмата.
Основата на молекулата е хемът, който има по-неорганична природа и е оцветен в червено. Това е и разграждането на хемоглобина в черния дроб.
Всички знаем, че хемоглобинът изпълнява важна транспортна функция – пренасянето на кислород и въглероден диоксид в човешкото тяло. Сложната конформация на белтъчната молекула образува специални активни центрове, които са способни да свързват съответните газове с хемоглобина.
Когато се образува протеин-газов комплекс, се образуват така наречените оксихемоглобин и карбохемоглобин. Има обаче друг вид такива асоциации, които са доста стабилни: карбоксихемоглобин. Това е комплекс от протеин и въглероден оксид, чиято стабилност обяснява пристъпите на задушаване с прекомерна токсичност.

хлорофил
Друг представител на протеини с кватернерна структура, чиито доменни връзки вече се поддържат от магнезиев йон. Основната функция на цялата молекула е участието в процесите на фотосинтеза в растенията.
Има различни видове хлорофили, които се различават един от друг по радикалите на порфириновия пръстен. Всяка от тези разновидности е маркирана с отделна буква от латинската азбука. Например, сухоземните растения се характеризират с наличието на хлорофил а или хлорофил b, докато водораслите имат и други видове от този протеин.

хемоцианин
Тази молекула е аналог на хемоглобина при много по-нисши животни (членестоноги, мекотели и др.). Основната разлика в структурата на протеин с кватернерна молекулярна структура е наличието на цинков йон вместо железен. Хемоцианинът има синкав цвят.
Понякога хората се чудят какво би станало, ако заменим човешкия хемоглобин с хемоцианин. В този случай се нарушава обичайното съдържание на вещества в кръвта, и по-специално аминокиселини. Също така, хемоцианинът е нестабилен да образува комплекс с въглероден диоксид, така че "синята кръв" би имала тенденция да образува кръвни съсиреци.
Ролята на протеините в организма е изключително голяма. В същото време едно вещество може да носи такова име само след като придобие предварително определена структура. До този момент това е полипептид, просто верига от аминокиселина, която не може да изпълнява предназначените си функции. AT общ изгледпространствената структура на протеините (първична, вторична, третична и домейна) е тяхната обемна структура. Освен това вторичните, третичните и доменните структури са най-важни за организма.
Предпоставки за изследване на белтъчната структура
Сред методите за изследване на структурата химични веществаСпециална роля играе рентгеновата дифракционна кристалография. Чрез него може да се получи информация за последователността на атомите в молекулярните съединения и за тяхната пространствена организация. Просто казано, рентгеново изображение може да се направи и за една молекула, което стана възможно през 30-те години на 20-ти век.
Тогава изследователите откриха, че много протеини не само имат линейна структура, но могат да бъдат разположени и в спирали, намотки и домейни. И в резултат на маса научни експерименти се оказа, че вторичната структура на протеина е крайната форма за структурните протеини и междинна форма за ензими и имуноглобулини. Това означава, че веществата, които в крайна сметка имат третична или кватернерна структура, на етапа на своето „съзряване“ също трябва да преминат през етапа на образуване на спирала, което е характерно за вторичната структура.

Образуване на вторична протеинова структура
Веднага след като завърши синтеза на полипептида върху рибозомите в грубата мрежа на клетъчната ендоплазма, започва да се формира вторичната структура на протеина. Самият полипептид е дълга молекула, която заема много място и е неудобна за транспортиране и изпълнение на функциите си. Следователно, за да се намали размерът му и да му се придадат специални свойства, се развива вторична структура. Това се случва чрез образуването на алфа спирали и бета слоеве. Така се получава протеин с вторична структура, който в бъдеще или ще се превърне в третичен и четвъртичен, или ще се използва в тази форма.

Организация на вторичната структура
Многобройни проучвания показват, че вторичната структура на протеина е или алфа спирала, или бета слой, или редуване на участъци с тези елементи. Нещо повече, вторичната структура е начин за усукване и спираловидно навиване на протеинова молекула. Това е хаотичен процес, който възниква поради водородни връзки, които възникват между полярните области на аминокиселинните остатъци в полипептида.
Вторична структура на алфа спиралата
Тъй като в биосинтезата на полипептидите участват само L-аминокиселини, образуването на вторичната протеинова структура започва с усукване на спиралата по посока на часовниковата стрелка (дясно). Има строго 3,6 аминокиселинни остатъка за всеки спираловиден завой, а разстоянието по оста на спирала е 0,54 nm. то общи свойстваза вторичната структура на протеина, които не зависят от вида на аминокиселините, участващи в синтеза.

Установено е, че не цялата полипептидна верига е напълно спираловидна. Неговата структура съдържа линейни секции. По-специално, протеиновата молекула на пепсина е само 30% спираловидна, лизозимът - 42%, а хемоглобинът - 75%. Това означава, че вторичната структура на протеина не е строго спирала, а комбинация от неговите участъци с линейни или слоести.
Вторична структура на бета слой
Вторият тип структурна организация на веществото е бета слоят, който представлява две или повече полипептидни вериги, свързани с водородна връзка. Последното се случва между свободни CO NH2 групи. По този начин се свързват основно структурни (мускулни) протеини.
Структурата на протеините от този тип е следната: едната верига на полипептида с обозначението на крайните участъци A-B е успоредна на другата. Единственото предупреждение е, че втората молекула е разположена антипаралелно и е обозначена като B-A. Така се образува бета-слоят, който може да се състои от произволно голям брой полипептидни вериги, свързани с множество водородни връзки.
водородна връзка
Вторичната структура на протеина е връзка, базирана на множество полярни взаимодействия на атоми с различни показателиелектроотрицателност. Четири елемента имат най-голяма способност да образуват такава връзка: флуор, кислород, азот и водород. Протеините съдържат всичко освен флуор. Следователно, водородна връзка може и се образува, което прави възможно свързването на полипептидни вериги в бета слоеве и в алфа спирали.

Образуването на водородна връзка най-лесно се обяснява с примера на водата, която е дипол. Кислородът носи силен отрицателен заряд и поради високия поляризация O-Hводородните връзки се считат за положителни. В това състояние молекулите присъстват в определена среда. И много от тях се докосват и се сблъскват. Тогава кислородът от първата водна молекула привлича водород от другата. И така по веригата.
Подобни процеси протичат и в протеините: електроотрицателният кислород на пептидната връзка привлича водород от всяка част на друг аминокиселинен остатък, образувайки водородна връзка. Това е слаба полярна конюгация, която изисква около 6,3 kJ енергия за прекъсване.
За сравнение, най-слабата ковалентна връзка в протеините изисква 84 kJ енергия, за да я разруши. Най-силният ковалентна връзкаще изисква 8400 kJ. Въпреки това, броят на водородните връзки в протеиновата молекула е толкова огромен, че тяхната обща енергия позволява на молекулата да съществува в агресивни условия и да запази пространствената си структура. Поради това има протеини. Структурата на този вид протеин осигурява сила, която е необходима за функционирането на мускулите, костите и връзките. Толкова голямо е значението на вторичната структура на протеините за тялото.
В по-компактна в сравнение с първичната структура, в която се осъществява взаимодействието на пептидните групи с образуването на водородни връзки между тях.
Полагане на протеин под формата на въже и акордеон
Има два вида такива структури - въже като катерицаи под формата на акордеон.
Образуването на вторичната структура се причинява от желанието на пептида да приеме конформация с най-голямото числовръзки между пептидни групи. Видът на вторичната структура зависи от стабилността на пептидната връзка, подвижността на връзката между централния въглероден атом и въглерода на пептидната група и размера на аминокиселинния радикал.
Всичко по-горе, заедно с аминокиселинната последователност, впоследствие ще доведе до строго определена протеинова конфигурация.
Могат да се разграничат два възможни варианта на вторичната структура: α-спирала (α-структура) и β-нагънат слой (β-структура). В един протеин, като правило, присъстват и двете структури, но в различни пропорции. При глобуларните протеини преобладава α-спирала, при фибриларните протеини β-структурата.
Участие на водородните връзки в образуването на вторичната структура.
Вторичната структура се образува само с участието на водородни връзки между пептидните групи: кислородният атом на едната група реагира с водородния атом на втората, докато кислородът на втората пептидна група се свързва с водорода на третата и т.н.
α-спирала

Сгъване на протеина под формата на α-спирала.
Тази структура е дясна спирала, образувана от водородни връзки между пептидните групи от 1-ва и 4-та, 4-та и 7-ма, 7-ма и 10-та и така нататък аминокиселинни остатъци.
Образуването на спирала се предотвратява от пролин и хидроксипролин, които поради своята структура причиняват "счупване" на веригата, нейния рязък огъване.
Височината на завоя на спиралата е 0,54 nm и съответства на 3,6 аминокиселинни остатъка, 5 пълни завъртания отговарят на 18 аминокиселини и заемат 2,7 nm.
β-нагънат слой

Сгъване на протеина под формата на β-нагънат слой.
При този начин на полагане протеиновата молекула лежи в "змия", отдалечените сегменти на веригата са близо един до друг. В резултат на това пептидните групи на предварително отстранени аминокиселини от протеиновата верига са в състояние да взаимодействат с помощта на водородни връзки.