Klasifikacija organskih tvari.
Kemija se može podijeliti u 3 glavna dijela: opću, anorgansku i organsku.
opća kemija razmatra zakonitosti vezane uz sve kemijske transformacije.
Anorganska kemija proučava svojstva i pretvorbe anorganskih tvari.
Organska kemija – Ovo je velika i samostalna grana kemije čiji su predmet organske tvari:
- njihova struktura;
- Svojstva;
- metode stjecanja;
- mogućnosti praktične upotrebe.
Ime organska kemija ponudio švedski znanstvenik Berzelius.
Prije početkom 19. stoljeća Sve poznate tvari podijeljene su prema podrijetlu u 2 skupine:
1) mineralne (anorganske) tvari i
2) organske tvari .
Berzelius i mnogi znanstvenici tog vremena vjerovali su da organske tvari mogu nastati samo u živim organizmima uz pomoć neke vrste "životne sile". Takvi idealistički pogledi zvali su se vitalistički (od latinskog "vita" - život). Oni su odgodili razvoj organske kemije kao znanosti.
Velik udarac gledištima vitalista zadao je njemački kemičar V. Wehler . Prvi je dobio organske tvari iz anorganskih:
U 1824 g. - oksalna kiselina, i
U 1828 g. - urea.
U prirodi se oksalna kiselina nalazi u biljkama, a urea se stvara u ljudima i životinjama.
Takvih je činjenica bilo sve više.
U 1845 njemački znanstvenik Kolbe sintetizirao octenu kiselinu iz drvenog ugljena.
U 1854 gospodine francuski znanstvenik M. Berthelot sintetizirao tvar sličnu masti.
Postalo je jasno da nikakva "životna sila" ne postoji, da se tvari izolirane iz organizama životinja i biljaka mogu umjetno sintetizirati, da su iste prirode kao i sve druge tvari.
Ovih dana organska tvar smatrati karbonatan tvari koje nastaju u prirodi (živi organizmi) i mogu se dobiti sintetski. Zato se organska kemija zove kemija ugljikovih spojeva.
Značajke organskih tvari .
Za razliku od anorganskih tvari, organske tvari imaju niz svojstava koja su posljedica strukturnih značajki atoma ugljika.
Značajke strukture ugljikovog atoma.
1) U molekulama organskih tvari atom ugljika je u pobuđenom stanju i pokazuje valenciju jednaku IV.
2) Kada se formiraju molekule organskih tvari, elektronske orbitale ugljikovog atoma mogu biti podvrgnute hibridizaciji ( hibridizacija – to je poravnanje elektronskih oblaka u obliku i energiji).
3) Atomi ugljika u molekulama organskih tvari mogu djelovati jedni s drugima, tvoreći lance i prstenove.
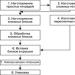
Klasifikacija organski spojevi.
Postoje različite klasifikacije organskih tvari:
1) prema porijeklu,
2) po elementarnom sastavu,
3) prema vrsti ugljičnog skeleta,
4) prema vrsti kemijske veze,
5) prema kvalitativnom sastavu funkcionalnih skupina.
Podjela organskih tvari prema podrijetlu.
Podjela organskih tvari prema elementarnom sastavu.
organska tvar |
||
ugljikovodici | koji sadrže kisik | Uz ugljik, vodik i kisik sadrže dušikove i druge atome. |
Sastoji se od ugljik i vodik | Sastoji se od ugljik, vodik i kisik | |
Ograničenje HC | ||
Neograničen HC | Aminokiseline |
|
Aromatični HC | Aldehidi | |
karboksilne kiseline | Nitro spojevi |
|
Esteri (jednostavni i složeni) | ||
Ugljikohidrati |
Podjela organskih tvari prema vrsti ugljikovog skeleta.
Karbonski kostur -to je niz kemijski povezanih atoma ugljika.
Podjela organskih tvari prema vrsti kemijske veze.
Klasifikacija organskih tvari prema kvalitativnom sastavu funkcionalnih skupina.
Funkcionalna grupa – stalna skupina atoma koja određuje karakteristična svojstva tvari.
Funkcionalna grupa | Ime | Klasa organski | Sufiksi i prefiksi |
-F, -Cl, -Br, -J | Fluor, klor, brom, jod (halogen) | derivati halogena | fluorometan klorometan bromometan jodometan |
hidroksil | Alkoholi, fenoli | ||
- C \u003d O | karbonil | Aldehidi, ketoni | - al metanal |
- COOH | karboksil | karboksilne kiseline |
metanska kiselina |
- NO2 | nitro skupina | Nitro spojevi | Nitro nitrometan |
- NH2 | amino skupina | - amin metilamin |
Lekcija 3-4
Tema: Osnovne odredbe teorije strukture organskih spojeva
.
Razlozi raznolikosti organskih tvari (homologija, izomerija ).
Do početka drugog poluvremena 19. stoljeća bilo je poznato dosta organskih spojeva, ali nije postojala jedinstvena teorija koja bi objašnjavala njihova svojstva. Pokušaji stvaranja takve teorije učinjeni su više puta. Nijedan nije bio uspješan.
Dugujemo stvaranje teorije o strukturi organskih tvari .
Godine 1861., na 36. kongresu njemačkih prirodoslovaca i liječnika u Speyeru, Butlerov je napravio izvješće u kojem je iznio glavne odredbe nove teorije - teorije kemijske strukture organskih tvari.
Teorija kemijske strukture organskih tvari nije nastala od nule.
Objektivni preduvjeti za njegovu pojavu bili su :
1) socio-ekonomska pozadina .
Nagli razvoj industrije i trgovine od početka 19. stoljeća postavio je visoke zahtjeve pred mnoge grane znanosti, uključujući i organsku kemiju.
Stavljaju ispred ove nauke nove zadatke:
- sintetsko dobivanje boja,
- poboljšanje metoda prerade poljoprivrednih proizvoda i tako dalje.
2) Znanstvena pozadina .
Bilo je mnogo činjenica koje su zahtijevale objašnjenje:
- Znanstvenici nisu mogli objasniti valenciju ugljika u spojevima kao što su etan, propan itd.
- Znanstvenici kemičari nisu mogli objasniti zašto dva elementa: ugljik i vodik mogu tvoriti takve veliki broj razni spojevi i zašto org. toliko je tvari.
- Nije bilo jasno zašto mogu postojati organske tvari s istom molekulskom formulom (C6H12O6 - glukoza i fruktoza).
Znanstveno potkrijepljen odgovor na ova pitanja dala je teorija kemijske strukture organskih tvari.
U vrijeme kada se teorija pojavila, mnogo se već znalo :
- A. Kekule ponudio četverovalentni atom ugljika za organske spojeve.
- A. Cooper i A. Kekule predložio o ugljik-ugljik veze i mogućnost povezivanja ugljikovih atoma u lanac.
U 1860 . na Međunarodnom kongresu kemičara jasno definirane pojmove atoma, molekule, atomske težine, molekularne težine .
Bit teorije kemijske strukture organskih tvari može se izraziti na sljedeći način :
1. Svi atomi u molekulama organskih tvari međusobno su povezani određenim redom kemijskim vezama prema svojoj valenciji.
2. Svojstva tvari ovise ne samo o tome koji atomi i koliko ih je dio molekule, već i o redoslijedu veza atoma u molekuli .
Redoslijed povezivanja atoma u molekuli i prirodu njihovih veza Butlerov je nazvao kemijska struktura .
Iskazuje se kemijska struktura molekule strukturna formula , u kojem su simboli elemenata odgovarajućih atoma povezani crticama ( valence strokes) koji označavaju kovalentne veze.
Strukturna formula prenosi :
Redoslijed povezivanja atoma;
Mnoštvo veza između njih (jednostavne, dvostruke, trostruke).
izomerija - to je postojanje tvari koje imaju istu molekulsku formulu, ali različita svojstva.
Izomeri - To su tvari koje imaju isti sastav molekula (istu molekulsku formulu), ali različite kemijska struktura te stoga imaju različita svojstva.
3. Po svojstvima određene tvari može se odrediti struktura njezine molekule, a po strukturi molekule mogu se predvidjeti svojstva.
Svojstva tvari ovise o vrsti kristalne rešetke.
4. Atomi i skupine atoma u molekulama tvari međusobno utječu jedni na druge.
Vrijednost teorije.
Teorija koju je stvorio Butlerov najprije je negativno dočekana od strane znanstvenog svijeta, jer su njene ideje bile u suprotnosti s idealističkim svjetonazorom koji je prevladavao u to vrijeme, ali nakon nekoliko godina teorija je postala općepriznata, a tome su pridonijele sljedeće okolnosti:
1. Teorija je posložila stvari nezamislivi kaos u kojem je bila organska kemija prije nje. Teorija je omogućila objašnjenje novih činjenica, dokazala je to uz pomoć kemijske metode(sinteza, razgradnja i druge reakcije), možete uspostaviti redoslijed povezivanja atoma u molekulama.
2. Teorija je unijela nešto novo u atomsku i molekularnu teoriju
Raspored atoma u molekulama,
Međusobni utjecaj atoma
Ovisnost svojstava o molekuli tvari.
3. Teorija je bila u stanju ne samo objasniti već poznate činjenice, već je također omogućila predvidjeti svojstva organskih tvari na temelju strukture za sintetiziranje novih tvari.
4. Teorija je omogućila objašnjenje razdjelnik kemijske tvari.
5. Dala je snažan poticaj sintezi organskih tvari.
Razvoj teorije tekao je, kako je Butlerov predvidio, uglavnom u dva smjera. :
1. Proučavanje prostorne strukture molekula (stvarni raspored atoma u trodimenzionalnom prostoru)
2. Razvoj elektroničkih prikaza (otkrivanje suštine kemijske veze).
Postoji mnogo organskih spojeva, ali među njima ima spojeva zajedničkih i sličnih svojstava. Stoga su svi zajedničke značajke klasificirani, spojeni u zasebne razrede i skupine. Klasifikacija se temelji na ugljikovodicima – spojevi koji se sastoje samo od atoma ugljika i vodika. Ostatak organske tvari je "Druge klase organskih spojeva".
Ugljikovodici se dijele u dvije široke klase: aciklički i ciklički spojevi.
Aciklički spojevi (masni ili alifatski) – spojevi čije molekule sadrže otvoreni (ne prstenasto zatvoreni) nerazgranati ili razgranati ugljikov lanac s jednostrukim ili višestrukim vezama. Aciklički spojevi se dijele u dvije glavne skupine:
zasićeni (granični) ugljikovodici (alkani), u kojoj su svi atomi ugljika međusobno povezani samo jednostavnim vezama;
nezasićeni (nezasićeni) ugljikovodici, u kojoj između atoma ugljika osim jednostrukih jednostavnih veza postoje i dvostruke i trostruke veze.
Nezasićeni (nezasićeni) ugljikovodici dijele se u tri skupine: alkeni, alkini i alkadieni.
Alkeni(olefini, etilen ugljikovodici) – aciklički nezasićeni ugljikovodici koji sadrže jednu dvostruku vezu između ugljikovih atoma tvore homologni niz s općom formulom C n H 2n . Imena alkena tvore se od imena odgovarajućih alkana s sufiksom "-an" zamijenjenim sufiksom "-en". Na primjer, propen, buten, izobutilen ili metilpropen.
alkini(acetilen ugljikovodici) – ugljikovodici koji sadrže trostruku vezu između ugljikovih atoma tvore homologni niz s općom formulom C n H 2n-2 . Imena alkena tvore se od naziva odgovarajućih alkana s sufiksom "-an" zamijenjenim sufiksom "-in". Na primjer, etin (acilen), butin, peptin.
Alkadijeni – organski spojevi koji sadrže dvije dvostruke veze ugljik-ugljik. Ovisno o tome kako su dvostruke veze međusobno raspoređene, dieni se dijele u tri skupine: konjugirani dieni, aleni i dieni s izoliranim dvostrukim vezama. Tipično, dieni uključuju acikličke i cikličke 1,3-diene, koji tvore s općim formulama CnH2n-2 i CnH2n-4. Aciklički dieni su strukturni izomeri alkina.
Ciklički spojevi se pak dijele u dvije velike skupine:
- karbociklički spojevi – spojevi čiji se prstenovi sastoje samo od ugljikovih atoma; Karbociklički spojevi se dalje dijele na alicikličke – zasićeni (cikloparafini) i aromatski;
- heterociklički spojevi – spojevi čiji se ciklusi ne sastoje samo od atoma ugljika, već i od atoma drugih elemenata: dušika, kisika, sumpora itd.
U molekulama i acikličkih i cikličkih spojeva atomi vodika mogu se zamijeniti drugim atomima ili skupinama atoma, pa se uvođenjem funkcionalnih skupina mogu dobiti derivati ugljikovodika. Ovo svojstvo dodatno proširuje mogućnosti dobivanja različitih organskih spojeva i objašnjava njihovu raznolikost.
Prisutnost određenih skupina u molekulama organskih spojeva određuje općenitost njihovih svojstava. Ovo je osnova za klasifikaciju derivata ugljikovodika.
 "Druge klase organskih spojeva" uključuju sljedeće:
"Druge klase organskih spojeva" uključuju sljedeće:
Alkoholi dobivaju se zamjenom jednog ili više atoma vodika hidroksilnim skupinama – Oh. To je spoj opće formule R – (OH) x, gdje je x – broj hidroksilnih skupina.
Aldehidi sadrže aldehidnu skupinu (C = O), koja je uvijek na kraju lanca ugljikovodika.
karboksilne kiseline sadrže jednu ili više karboksilnih skupina – COOH.
Esteri – derivati kiselina koje sadržavaju kisik, a koji su formalno produkti supstitucije vodikovih atoma hidroksida – OH kiselinska funkcija po ugljikovodikovom ostatku; također se smatraju acilnim derivatima alkohola.
Masti (trigliceridi) – prirodni organski spojevi, potpuni esteri glicerol i monokomponentne masne kiseline; pripadaju klasi lipida. Prirodne masti u svom sastavu sadrže tri kiselinska radikala s nerazgranatom strukturom i obično Parni broj atomi ugljika.
Ugljikohidrati – organske tvari koje sadrže ravni lanac od nekoliko ugljikovih atoma, karboksilnu skupinu i nekoliko hidroksilnih skupina.
amini sadrže amino skupinu – NH2
Aminokiseline– organski spojevi, čija molekula istodobno sadrži karboksilne i aminske skupine.
Vjeverice – visokomolekularne organske tvari, koje se sastoje od alfa-aminokiselina lančano povezanih peptidnom vezom.
Nukleinske kiseline – visokomolekularni organski spojevi, biopolimeri nastali od nukleotidnih ostataka.
Imate li kakvih pitanja? Želite li znati više o klasifikaciji organskih spojeva?
Za pomoć mentora - prijavite se.
Prvi sat je besplatan!
stranica, uz potpuno ili djelomično kopiranje materijala, potrebna je veza na izvor.
U prošlosti su znanstvenici sve tvari u prirodi dijelili na uvjetno nežive i žive, uključujući životinjsko i biljno carstvo među potonjima. Tvari prve skupine nazivaju se mineralima. A oni koji su ušli u drugu, počeli su se nazivati organske tvari.
Što se ovime misli? Klasa organskih tvari najopsežnija je od svih kemijski spojevi poznat modernim znanstvenicima. Na pitanje koje su tvari organske može se odgovoriti na sljedeći način - to su kemijski spojevi koji uključuju ugljik.
Imajte na umu da nisu svi spojevi koji sadrže ugljik organski. Na primjer, korbidi i karbonati, ugljična kiselina i cijanidi, ugljikovi oksidi nisu među njima.
Zašto postoji toliko mnogo organskih tvari?
Odgovor na ovo pitanje leži u svojstvima ugljika. Ovaj element je zanimljiv po tome što može formirati lance od svojih atoma. A u isto vrijeme, ugljikova veza je vrlo stabilna.
Osim toga, u organskim spojevima pokazuje visoku valenciju (IV), tj. sposobnost formiranja kemijske veze s drugim tvarima. I ne samo jednostruki, već i dvostruki, pa čak i trostruki (inače - višestruki). Kako se višestrukost veze povećava, lanac atoma postaje kraći, a stabilnost veze raste.
A ugljik je obdaren sposobnošću formiranja linearnih, ravnih i trodimenzionalnih struktura.
Zato su organske tvari u prirodi tako raznolike. To možete lako provjeriti sami: stanite ispred ogledala i pažljivo pogledajte svoj odraz. Svatko od nas je hodajući udžbenik organske kemije. Razmislite o tome: najmanje 30% mase svake vaše stanice čine organski spojevi. Proteini koji su izgradili vaše tijelo. Ugljikohidrati, koji služe kao "gorivo" i izvor energije. Masti koje čuvaju rezerve energije. Hormoni koji kontroliraju rad organa, pa čak i vaše ponašanje. Enzimi koji pokreću kemijske reakcije unutar tebe. Pa čak i "izvorni kod", niti DNK, svi su organski spojevi na bazi ugljika.
Sastav organskih tvari
Kao što smo rekli na samom početku, glavni građevinski materijal za organsku tvar je ugljik. I praktički svi elementi, kombinirajući se s ugljikom, mogu tvoriti organske spojeve.
U prirodi se najčešće u sastavu organskih tvari nalaze vodik, kisik, dušik, sumpor i fosfor.
Struktura organskih tvari
Raznolikost organskih tvari na planetu i raznolikost njihove strukture mogu se objasniti karakterističnim značajkama ugljikovih atoma.
Sjećate se da atomi ugljika mogu stvoriti vrlo jake međusobne veze, povezujući se u lance. Rezultat su stabilne molekule. Način na koji se atomi ugljika spajaju u lance (poređani u cik-cak uzorak) jedan je od glavne značajke njene zgrade. Ugljik se može spajati i u otvorene i u zatvorene (cikličke) lance.
Također je važno da struktura kemikalija izravno utječe na njihovu Kemijska svojstva. Značajnu ulogu ima i način na koji atomi i skupine atoma u molekuli utječu jedni na druge.
Zbog osobitosti strukture, broj ugljikovih spojeva iste vrste ide do desetaka i stotina. Za primjer, razmotrite vodikovi spojevi ugljik: metan, etan, propan, butan itd.
Na primjer, metan - CH 4. Takva kombinacija vodika s ugljikom u normalnim je uvjetima u plinovitom agregatnom stanju. Kada se u sastavu pojavi kisik, nastaje tekućina - metilni alkohol CH 3 OH.
Ne samo da tvari različitog kvalitativnog sastava (kao u gornjem primjeru) pokazuju različita svojstva, već su to sposobne i tvari istog kvalitativnog sastava. Primjer je različita sposobnost metana CH 4 i etilena C 2 H 4 da reagiraju s bromom i klorom. Metan je sposoban za takve reakcije samo kada se zagrije ili pod ultraljubičastim svjetlom. A etilen reagira i bez osvjetljenja i grijanja.
Razmotrite ovu opciju: kvalitativni sastav kemijskih spojeva je isti, kvantitativni je drugačiji. Tada su kemijska svojstva spojeva različita. Kao u slučaju acetilena C 2 H 2 i benzena C 6 H 6.
Ne posljednju ulogu u ovoj raznolikosti igraju takva svojstva organskih tvari, "vezana" za njihovu strukturu, kao što su izomerija i homologija.
Zamislite da imate dvije naizgled identične tvari - isti sastav i istu molekularnu formulu koja ih opisuje. Ali struktura ovih tvari je bitno različita, iz čega slijedi razlika u kemijskim i fizička svojstva. Na primjer, molekulska formula C 4 H 10 može se napisati kao dva razne tvari: butan i izobutan.

Govorimo o izomeri spojevi koji imaju isti sastav i Molekularna težina. Ali atomi u njihovim molekulama smješteni su različitim redoslijedom (razgranata i nerazgranata struktura).
O homologija- to je karakteristika takvog ugljikovog lanca u kojem se svaki sljedeći član može dobiti dodavanjem jedne CH 2 skupine na prethodni. Svaki homologni niz može se izraziti jednom općom formulom. A znajući formulu, lako je odrediti sastav bilo kojeg člana serije. Na primjer, homolozi metana opisani su formulom C n H 2n+2.
Kako se dodaje "homologna razlika" CH 2, jača veza između atoma tvari. Uzmimo homologni niz metana: njegova prva četiri člana su plinovi (metan, etan, propan, butan), sljedećih šest su tekućine (pentan, heksan, heptan, oktan, nonan, dekan), a zatim tvari u krutom stanju. agregacije slijede (pentadekan, eikozan, itd.). I tada jača veza između ugljikovih atoma, veća je molekularna težina, vrelište i talište tvari.
Koje klase organskih tvari postoje?
Organske tvari biološkog podrijetla uključuju:
- bjelančevine;
- ugljikohidrati;
- nukleinske kiseline;
- lipidi.
Prve tri točke također se mogu nazvati biološkim polimerima.
Detaljnija klasifikacija organskih kemikalija obuhvaća tvari ne samo biološkog podrijetla.
Ugljikovodici su:
- aciklički spojevi:
- zasićeni ugljikovodici (alkani);
- nezasićeni ugljikovodici:
- alkeni;
- alkini;
- alkadijeni.
- ciklički spojevi:
- karbociklički spojevi:
- aliciklički;
- aromatičan.
- heterociklički spojevi.
- karbociklički spojevi:
Postoje i druge klase organskih spojeva u kojima se ugljik spaja s drugim tvarima osim vodika:
- alkoholi i fenoli;
- aldehidi i ketoni;
- karboksilne kiseline;
- esteri;
- lipidi;
- ugljikohidrati:
- monosaharidi;
- oligosaharidi;
- polisaharidi.
- mukopolisaharidi.
- amini;
- aminokiseline;
- bjelančevine;
- nukleinske kiseline.
Formule organskih tvari po klasama

Primjeri organskih tvari
Kao što se sjećate, u ljudskom tijelu različite vrste organskih tvari temelj su temelja. To su naša tkiva i tekućine, hormoni i pigmenti, enzimi i ATP i još mnogo toga.
U tijelima ljudi i životinja prioritet su bjelančevine i masti (polovica suhe težine životinjske stanice su bjelančevine). U biljkama (oko 80% suhe mase stanice) - za ugljikohidrate, prvenstveno složene - polisaharide. Uključujući celulozu (bez koje ne bi bilo papira), škrob.
Razgovarajmo o nekima od njih detaljnije.
Na primjer, oko ugljikohidrata. Kada bi bilo moguće uzeti i izmjeriti mase svih organskih tvari na planetu, ugljikohidrati bi bili ti koji bi pobijedili u ovom natjecanju.
Oni služe kao izvor energije u tijelu, građevni su materijali za stanice, a također vrše opskrbu tvarima. Biljke u tu svrhu koriste škrob, a životinje glikogen.
Osim toga, ugljikohidrati su vrlo raznoliki. Na primjer, jednostavni ugljikohidrati. Najčešći monosaharidi u prirodi su pentoze (uključujući deoksiribozu, koja je dio DNK) i heksoze (glukoza, koja vam je dobro poznata).
Kao cigle, na velikom gradilištu prirode, polisaharidi se grade od tisuća i tisuća monosaharida. Bez njih, točnije bez celuloze, škroba, ne bi bilo ni biljaka. Da, i životinjama bez glikogena, laktoze i hitina bilo bi teško.
Pogledajmo pažljivo vjeverice. Priroda je najveći majstor mozaika i slagalica: od samo 20 aminokiselina u ljudskom tijelu nastaje 5 milijuna vrsta proteina. Proteini također imaju mnoge vitalne funkcije. Na primjer, izgradnja, regulacija procesa u tijelu, zgrušavanje krvi (za to postoje posebni proteini), kretanje, transport određenih tvari u tijelu, također su izvor energije, u obliku enzima djeluju kao katalizator za reakcije, pruža zaštitu. Protutijela imaju važnu ulogu u zaštiti organizma od negativnih vanjskih utjecaja. A ako dođe do nesklada u finom ugađanju tijela, antitijela, umjesto da uništavaju vanjske neprijatelje, mogu djelovati kao agresori na vlastite organe i tkiva u tijelu.

Bjelančevine se također dijele na jednostavne (proteini) i složene (proteini). I imaju svojstva svojstvena samo njima: denaturacija (uništavanje, koje ste više puta primijetili kada ste kuhali tvrdo kuhano jaje) i renaturacija (ovo se svojstvo naširoko koristi u proizvodnji antibiotika, prehrambenih koncentrata itd.).
Nemojmo zanemariti i lipidi(masti). U našem tijelu služe kao rezervni izvor energije. Kao otapala pomažu tijek biokemijskih reakcija. Sudjeluju u izgradnji tijela – primjerice, u stvaranju staničnih membrana.
I još nekoliko riječi o takvim neobičnim organskim spojevima kao što su hormoni. Uključeni su u biokemijske reakcije i metabolizam. Ovi mali hormoni čine muškarce muškarcima (testosteron), a žene ženama (estrogen). Čine nas sretnima ili tužnima (hormoni štitnjače igraju važnu ulogu u promjenama raspoloženja, a endorfini daju osjećaj sreće). Čak određuju jesmo li „sove“ ili „ševe“. Jeste li spremni učiti do kasno ili radije rano ustajete i radite domaća zadaća prije škole, ne odlučuje samo o vašoj dnevnoj rutini, već io nekim hormonima nadbubrežne žlijezde.
Zaključak
Svijet organske tvari doista je nevjerojatan. Dovoljno je samo malo zadubiti u njegovo proučavanje da vam zastane dah od osjećaja srodstva sa svim životom na Zemlji. Dvije noge, četiri ili korijenje umjesto nogu - sve nas spaja čarolija kemijskog laboratorija majke prirode. Uzrokuje spajanje ugljikovih atoma u lance, reakciju i stvaranje tisuća takvih različitih kemijskih spojeva.
Sada imate kratki vodič kroz organsku kemiju. Naravno, ovdje nisu prikazane sve moguće informacije. Neke ćete točke možda morati sami razjasniti. Ali uvijek možete koristiti rutu koju smo planirali za vaše samostalno istraživanje.
Također možete koristiti definiciju organske tvari danu u članku, klasifikaciju i opće formule organski spojevi i opće informacije o njima za pripremu za sate kemije u školi.
Recite nam u komentarima koji vam se dio kemije (organske ili anorganske) najviše sviđa i zašto. Ne zaboravite "podijeliti" članak na društvenim mrežama kako bi ga mogli koristiti i vaši kolege iz razreda.
Molimo prijavite ako pronađete bilo kakvu netočnost ili pogrešku u članku. Svi smo mi ljudi i svi ponekad griješimo.
stranica, uz potpuno ili djelomično kopiranje materijala, potrebna je veza na izvor.
Počinjete učiti organsku kemiju s kojom ste se malo upoznali tek u 9. razredu. Zašto "organski"? Okrenimo se povijesti.
Čak i na prijelazu iz IX-X stoljeća. Arapski alkemičar Abu Bakr ar-Razi (865-925) prvi je sve podijelio kemijske tvari prema podrijetlu u tri kraljevstva: mineralne, biljne i životinjske tvari. Ova jedinstvena klasifikacija trajala je gotovo tisuću godina.
Međutim, u početkom XIX V. pojavila se potreba da se kemija tvari biljnog i životinjskog podrijetla spoji u jedinstvenu znanost. Ovaj pristup će vam se činiti logičnim ako imate barem elementarne ideje o sastavu živih organizama.
Iz kolegija prirodnih znanosti i osnovnih tečajeva biologije znate da sastav svake žive stanice, bilo biljne ili životinjske, nužno uključuje proteine, masti, ugljikohidrate i druge tvari koje se obično nazivaju organskim. Na prijedlog švedskog kemičara J. Ya.Berzeliusa, 1808. godine znanost koja proučava organske tvari počela se nazivati organska kemija.
Ideja o kemijskom jedinstvu živih organizama na Zemlji toliko je oduševila znanstvenike da su čak stvorili lijepu, ali lažnu doktrinu - vitalizam, prema kojoj se vjerovalo da je za dobivanje potrebna posebna "životna sila" (vis vitalis). (sinteza) organskih spojeva iz anorganskih. Znanstvenici su vjerovali da je vitalna sila obavezna osobina samo živih organizama. Iz toga je slijedio pogrešan zaključak da je sinteza organskih spojeva iz anorganskih vanjskih živih organizama – u epruvetama ili industrijskim postrojenjima – nemoguća.
Vitalisti su razumno tvrdili da je najvažnija temeljna sinteza na našem planetu - fotosinteza (slika 1) nemoguća izvan zelenih biljaka.
Riža. 1.
Fotosinteza
Pojednostavljeno, proces fotosinteze opisuje se jednadžbom
Prema vitalistima, svaka druga sinteza organskih spojeva izvan živih organizama također je nemoguća. Međutim, daljnji razvoj kemije i gomilanje novih znanstvenih činjenica dokazali su da su vitalisti bili duboko u zabludi.
Godine 1828. njemački kemičar F. Wöhler sintetizirao je organski spoj ureu iz anorganske tvari amonijevog cijanata. Francuski znanstvenik M. Bert-lo 1854. godine dobio je mast u epruveti. Godine 1861. ruski kemičar A. M. Butlerov sintetizirao je šećernu tvar. Vitalizam je zakazao.
Danas je organska kemija grana kemijske znanosti i proizvodnje koja se brzo razvija. Trenutno postoji više od 25 milijuna organskih spojeva, među kojima ima tvari koje do danas nisu pronađene u divljini. Priprava ovih tvari postala je moguća zahvaljujući rezultatima znanstvena djelatnost organski kemičari.
Svi organski spojevi prema podrijetlu mogu se podijeliti u tri vrste: prirodni, umjetni i sintetski.
Prirodni organski spojevi su otpadni proizvodi živih organizama (bakterija, gljiva, biljaka, životinja). To su vama dobro poznati proteini, masti, ugljikohidrati, vitamini, hormoni, enzimi, prirodna guma itd. (slika 2).

Riža. 2.
Prirodni organski spojevi:
1-4 - u vlaknima i tkaninama (vuna 1, svila 2, lan 3, pamuk 4); 5-10 - u prehrambenim proizvodima (mlijeko 5, meso 6, riba 7, povrće i maslac 8, povrće i voće 9, žitarice i kruh 10); 11, 12 - u gorivu i sirovinama za kemijsku industriju (zemni plin 11, nafta 12); 13 - u drvu
umjetni organski spojevi- to su proizvodi kemijski pretvorenih prirodnih tvari u spojeve koji se ne nalaze u divljini. Tako se na temelju prirodnog organskog spoja celuloze dobivaju umjetna vlakna (acetatna, viskozna, bakreno-amonijačna), negorivi filmski i fotografski filmovi, plastične mase (celuloid), bezdimni barut itd. (slika 3).

Riža. 3. Proizvodi i materijali izrađeni na bazi umjetnih organskih spojeva: 1.2 - umjetna vlakna i tkanine; 3 - plastika (celuloid); 4 - film; 5 - bezdimni prah
Sintetski organski spojevi dobiva se sintetski, tj. spajanjem jednostavnijih molekula u složenije. Tu spadaju npr. sintetička guma, plastika, lijekovi, sintetski vitamini, stimulansi rasta, sredstva za zaštitu bilja itd. (slika 4).

Riža. 4.
Proizvodi i materijali na bazi sintetskih organskih spojeva:
1 - plastika; 2- lijekovi; 3 - deterdženti; 4 - sintetička vlakna i tkanine; 5 - boje, emajli i ljepila; 6 - sredstva za borbu protiv insekata; 7 - gnojiva; 8 - sintetičke gume
Unatoč velikoj raznolikosti, svi organski spojevi imaju atome ugljika u svom sastavu. Stoga se organska kemija može nazvati kemijom ugljikovih spojeva.
Uz ugljik, većina organskih spojeva sadrži atome vodika. Ova dva elementa tvore niz klasa organskih spojeva, koji se nazivaju ugljikovodici. Sve druge klase organskih spojeva mogu se smatrati derivatima ugljikovodika. To je omogućilo njemačkom kemičaru K. Schorlemmeru da da klasičnu definiciju organske kemije, koja ni više od 120 godina kasnije nije izgubila na značaju.
Na primjer, pri zamjeni jednog atoma vodika u molekuli C 2 H 6 etana s hidroksilnom skupinom -OH nastaje dobro poznati etilni alkohol C 2 H 5 OH, a pri zamjeni atoma vodika u molekuli metana CH 4 s karboksilnom skupinom -COOH nastaje octena kiselina CH 3 COOH.
Zašto, od više od stotinu elemenata Periodni sustav D. I. Mendeljejeva, upravo je ugljik postao osnova svega života? Puno toga će vam biti jasno ako pročitate slijedeće riječi D. I. Mendeleev, koju je napisao u udžbeniku „Osnove kemije”: „Ugljik se u prirodi nalazi iu slobodnom iu vezivnom stanju, u vrlo različitim oblicima i tipovima ... Sposobnost ugljikovih atoma da se međusobno spajaju i dati složene čestice očituje se u svim spojevima ugljika ... Ni u jednom elementu ... sposobnost kompliciranja nije razvijena do te mjere kao u ugljika ... Nijedan par elemenata ne daje toliko spojeva kao ugljik s vodikom.
Kemijske veze atoma ugljika međusobno i s atomima drugih elemenata (vodik, kisik, dušik, sumpor, fosfor), koji su dio organskih spojeva, mogu se uništiti pod utjecajem prirodnih čimbenika. Dakle, ugljik čini kontinuirani ciklus u prirodi: od atmosfere (ugljični dioksid) do biljaka (fotosinteza), od biljaka do životinjskih organizama, od živog do neživog, od neživog do živog (slika 5).

Riža. 5.
Kruženje ugljika u prirodi
Zaključno, bilježimo niz značajki koje karakteriziraju organske spojeve.
Budući da molekule svih organskih spojeva sadrže atome ugljika, a gotovo sve sadrže atome vodika, većina njih je zapaljiva i kao rezultat izgaranja stvaraju ugljikov monoksid (IV) (ugljični dioksid) i vodu.
Za razliku od anorganskih tvari, kojih ima oko 500 tisuća, organski spojevi su raznolikiji, pa njihov broj danas iznosi više od 25 milijuna.
Mnogi organski spojevi su složeniji od anorganske tvari, a mnogi od njih imaju ogromnu molekularnu težinu, poput proteina, ugljikohidrata, nukleinskih kiselina, odnosno tvari zahvaljujući kojima se odvijaju životni procesi.
Organski spojevi nastaju, u pravilu, zbog kovalentnih veza i stoga imaju molekularna struktura i, prema tome, imaju niska tališta i vrelišta, te su toplinski nestabilni.
Nove riječi i pojmovi
- Vitalizam.
- Fotosinteza.
- Organski spojevi: prirodni, umjetni i sintetski.
- Organska kemija.
- Značajke koje karakteriziraju organske spojeve.
Pitanja i zadaci
- Koristeći se znanjem iz kolegija biologije, usporedite kemijski sastav biljne i životinjske stanice. Koji organski spojevi ulaze u njihov sastav? Koja je razlika između organskih spojeva biljnih i životinjskih stanica?
- Opišite kruženje ugljika u prirodi.
- Objasnite zašto je vitalizam nastao i kako je propao.
- Koje vrste organskih spojeva (po podrijetlu) poznajete? Navedite primjere i naznačite područja njihove primjene.
- Izračunajte volumen kisika (n.a.) i masu glukoze nastale fotosintezom iz 880 tona ugljičnog dioksida.
- Izračunajte volumen zraka (n.p.) potreban za spaljivanje 480 kg CH4 metana ako volumni udio kisika u zraku je 21%.
Ovisno o strukturi ugljikovih lanaca, među organskim spojevima razlikuju se sljedeća tri reda:
1) veze s otvorenim lancem ugljikovih atoma, koji se također nazivaju aciklički, ili spojevi masne serije (ovo je ime nastalo povijesno: kiseline su pripadale prvim spojevima s dugim otvorenim ugljikovim lancima).
Ovisno o prirodi veza između ugljikovih atoma, ovi se spojevi dijele na: a) granične (ili zasićene), koji sadrže samo jednostavne (obične) veze u molekulama; b) nezasićene (ili nezasićene), u čijim molekulama postoje višestruke (dvostruke ili trostruke) veze između atoma ugljika;
2) veze sa zatvorenim lancem ugljikovih atoma, ili karbociklički. Ovi se spojevi, pak, dijele na:
a) aromatski spojevi.
Karakterizira ih prisutnost u molekulama posebne cikličke skupine od šest atoma ugljika - aromatske serije benzena.
Ovo grupiranje razlikuje se u prirodi veza između ugljikovih atoma i daje spojevima koji ga sadrže posebna kemijska svojstva, koja se nazivaju aromatskim svojstvima;
b) aliciklički spojevi su svi ostali karbociklički spojevi.
Razlikuju se po broju ugljikovih atoma u ciklusu i, ovisno o prirodi veza između tih atoma, mogu biti ograničavajuće i neograničene;
3) heterociklički spojevi.
U molekulama ovih spojeva postoje ciklusi koji uključuju, osim ugljikovih atoma, također heteroatomi.
U nizu acikličkih (masnih) i karbocikličkih spojeva ugljikovodici su najjednostavniji. Svi ostali spojevi iz ovih nizova smatraju se derivatima ugljikovodika, koji nastaju zamjenom jednog, dva ili više vodikovih atoma u molekuli ugljikovodika s drugim atomima ili skupinama atoma.
Ostaci ugljikovodika, koji nastaju kada se njihovim molekulama oduzmu jedan, dva ili više atoma vodika, nazivaju se ugljikovodični radikali.
Atomi ili skupine atoma koji zamjenjuju vodik u obliku baze ugljikovodika funkcionalni ili karakteristika(ovaj izraz razvila je Međunarodna unija za čistu i primijenjenu kemiju) skupine koje određuju opća kemijska svojstva tvari koje pripadaju istoj klasi derivata ugljikovodika.
Vrste organskih spojeva:
1) halogenirani ugljikovodici: a) derivati fluora; b) derivati klora; c) derivati broma, d) derivati joda;
2) spojevi koji sadrže kisik: a) alkoholi i fenoli; b) eteri; c) aldehidi; d) ketoni.
8. Vrste organskih spojeva
Organske reakcije, poput anorganskih reakcija, dijele se u 3 glavne vrste:
1) reakcija supstitucije: CH 4 + CI 2 → CH 3 CI + HCI;
2) reakcija cijepanja: CH 3 CH 2 Br → CH 2 = CH 2 + HBr;
3) reakcija adicije: CH 2 \u003d CH 2 + HBr → CH 3 CH 2 Br.
Reakcije dodavanja uključuju reakcije polimerizacije. Posebna vrsta organskih reakcija su reakcije polikondenzacije. Organske reakcije mogu se klasificirati i o mehanizmu kidanja kovalentnih veza u reagirajućim molekulama.
Ovisno o dva načina kidanja kovalentnih veza, ova se klasifikacija gradi.
1. Ako se zajednički elektronski par podijeli između atoma, tada nastaju radikali. Radikali su čestice koje imaju nesparene elektrone. Ovaj prekid veze se zove radikal (homolitički).Posebnost Ova veza leži u činjenici da radikali koji se formiraju djeluju u interakciji s molekulama prisutnim u reakcijskom sustavu ili međusobno.
Nastali radikali međusobno djeluju s molekulama prisutnim u reakcijskom sustavu ili međusobno: CH 3 + CI 2 → CH 3 CI + CI.
Prema radikalskom mehanizmu nastaju reakcije u kojima se veze niske polarnosti (C-C, C-H, N-N) prekidaju na visokoj temperaturi, pod djelovanjem svjetlosti ili radioaktivnog zračenja.
2. Ako pri prekidu veze s jednim atomom ostane zajednički elektronski par, tada ioni su kation i anion. Takav mehanizam se zove ionski ili heterolitički. Dovodi do stvaranja organskih kationi ili anioni: 1) metil klorid tvori metil kation i klorid anion; 2) metil litij tvori litijev kation i metil anion.
Organski ioni ulaze u daljnje transformacije. U ovom slučaju kationi stupaju u interakciju s nukleofilni("ljubavne jezgre") čestice, i organski anioni - sa elektrofilni("ljubeći elektrone") čestice (metalni kationi, halogeni itd.).
Ionski mehanizam se opaža kada polarni kovalentna veza(ugljik - halogen, ugljik - kisik itd.).
Organske ionske čestice su poput iona u anorganskoj kemiji - imaju odgovarajuće naboje. Međutim, oni se oštro razlikuju: ioni anorganskih spojeva stalno su prisutni u vodenim otopinama, dok se organske ionske čestice pojavljuju samo u trenutku reakcije.
Stoga je u mnogim slučajevima potrebno govoriti ne o slobodnim organskim ionima, već o jako polariziranim molekulama.
Radikalni mehanizam opaža se kada se prekine nepolarna ili niskopolarna kovalentna veza (ugljik - ugljik, ugljik - vodik itd.).
Organske ionske čestice su poput iona u anorganskoj kemiji - imaju odgovarajuće naboje.